海藻糖是2个吡喃葡萄糖分子以α,α-1,1-糖苷键连接而成的非还原性双糖,甜度约为蔗糖的45%。海藻糖可以调节植物响应各类非生物胁迫[1],在高温、极寒、高渗透压和干燥失水等恶劣条件下能有效保护细胞。如:在干燥状态下可以起到生物体膜水代替物的作用[2];在冷冻状态下可以抑制胞外冰晶对细胞的抑制作用[3],提高冷冻水产品的保水效果和稳定的疏水性,有助于提高益生菌类饮料的贮存稳定性[4]。海藻糖能够保持食品在冻融期间的稳定性[5],可以增加非均质化作用下益生菌的疏水性,从而作为安全的冷冻食品的保水剂使用[6]。由于这些特殊的生物保护功能,海藻糖被作为稳定剂、保护剂和甜味剂等广泛应用于食品、农业、医药及化妆品等行业中。
目前,海藻糖的生产方法主要有酵母提取法[7-10]、发酵法[11-12]、基因重组法[13-14]和生物酶转化法[14-15];其中生物酶转化法由于具有相对收率高、成本低和专一性强等特点,愈发受到青睐。酶法制备海藻糖的方法研究依据于生物体内的海藻糖合成途径,目前已经发现的海藻糖合成途径主要包括OtsAB途径、TreYZ两步催化途径、海藻糖合酶(trehalose synthase,TreS)途径、海藻糖糖基转移酶(trehalose glycosyltransferase,TreT)途径和海藻糖磷酸化酶(trehalose phosphorylase,TreP)途径等[16]。其中TreYZ途径和TreS途径所分别对应的双酶法和单酶法是目前认为最具工业化价值的2种方法。双酶法指在2种酶的协同作用下将一定链长的直链淀粉转化为海藻糖的方法;单酶法一般指以麦芽糖为底物,利用一种海藻糖合酶转化生成海藻糖的方法;这2种方法在工业制备中各具优势,受到广泛关注。
1 双酶法
1.1 双酶法原理
日本林原生物化学研究所于20世纪90年代发现2种酶:低聚麦芽糖基海藻糖合成酶(maltooligosyl trahalose synthase, MTSase)和低聚麦芽糖基海藻糖水解酶(maltooligosyl trahalose trahalohydrolase, MTHase)。其中,MTSase可以作用于一定长度的直链淀粉,在其末端生成具有海藻糖结构的α,α-1,1-葡萄糖苷键;MTHase能将α,α-1,1-葡萄糖苷键特异性的从直链末端切掉,生成海藻糖(图1)[1]。这种制备海藻糖的方法也被简称为双酶法。
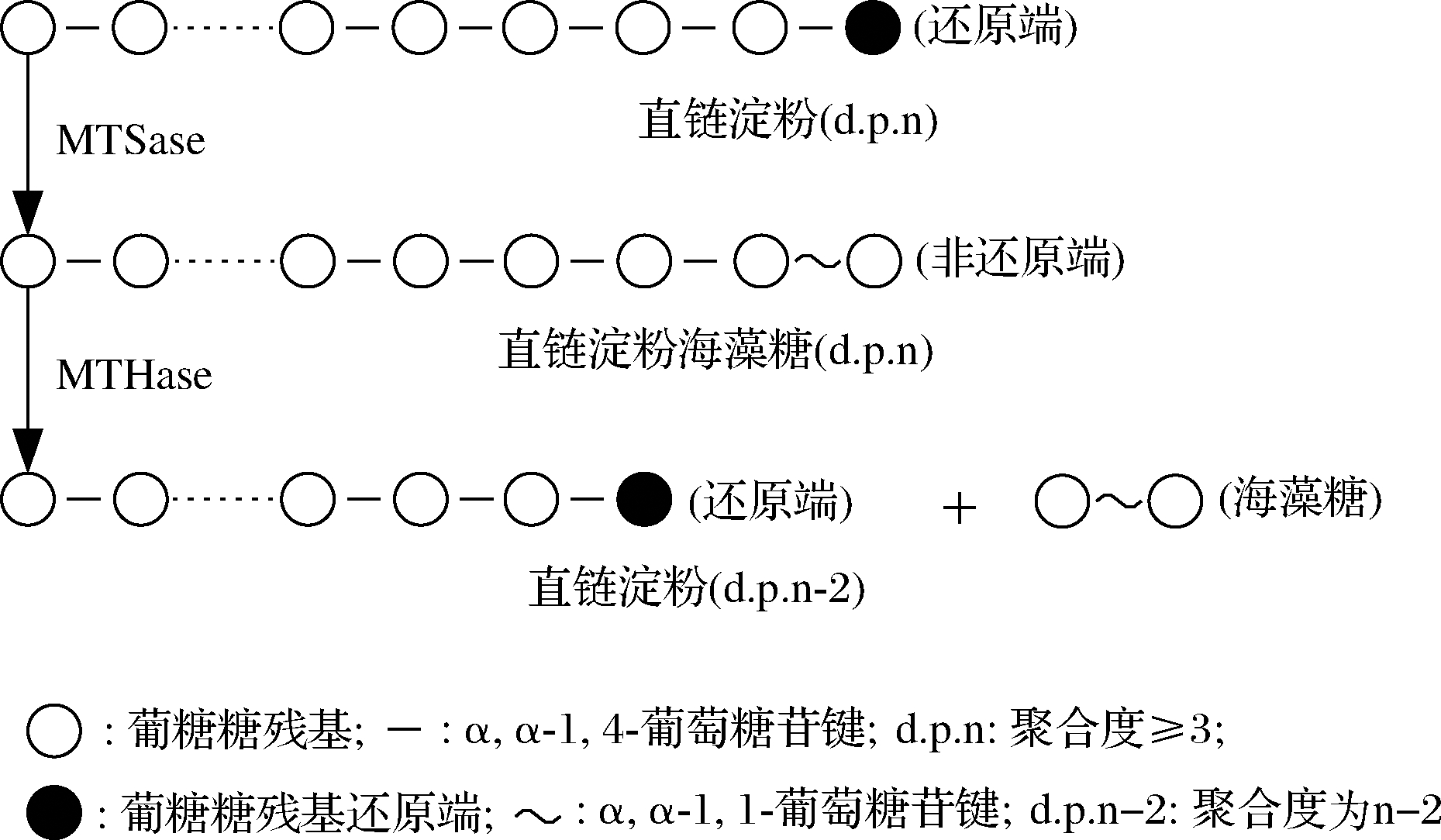
图1 淀粉双酶法生产海藻糖反应过程
Fig.1 Reaction principle of trehalose preparation by double-enzyme method with starch as raw material
1.2 双酶法工艺
双酶法可以使用多种淀粉作为底物,淀粉经酶反应后得到海藻糖和副产物葡萄糖、麦芽糖、麦芽寡糖、а-葡萄糖基海藻糖和а-麦芽糖基海藻糖等,一般再采用葡萄糖淀粉酶将副产物进一步转化为葡萄糖和海藻糖后再分离,其MTSase和MTHase的作用温度为35~40 ℃,pH 5.6~6.4,最终转化率可达80%以上,专利JP3559585 (B2)或EP0628630(B1)等对该工艺进行了实例介绍。比起早期的微生物提取法,双酶法的生产成本大幅降低,海藻糖价格由每千克2万多日元下降到350日元,产品纯度98%;由此日本成为最先实现以淀粉为原料工业化生产海藻糖的国家,林原生化研究所也成为当时最大的海藻糖生产商。
以林原公司为代表的众多研究者不断对淀粉生产海藻糖的工艺进行优化,积极探寻有关海藻糖制备的新酶,并发现制备了工作温度为75 ℃(pH 7.0)、60 ℃(pH 5.5)下的重组型耐热海藻糖水解酶和耐热非还原性糖质生成酶(JP3557289B或EP0697461B1)。林原公司在原有双酶法基础上,配合使用α-淀粉酶、β-淀粉酶、淀粉脱支酶(异淀粉酶或直链淀粉酶)、葡萄糖淀粉酶、一种天然型或重组型环状糊精葡萄糖苷基转移酶(cyclomaltodextrin glucanotransferase,CGTase)或其突变体和α-葡糖苷酶和β-呋喃果糖苷酶(专利EP0990704B1、EP0691407B1),显著提高海藻糖产率,经过液化、糖化、灭酶过滤、脱色、脱盐及浓缩等过程得到高海藻糖浆;并在专利EP2759600A1中,进一步采用控制冷却法得到二水合海藻糖结晶粉末,制备工艺过程如图2所示。
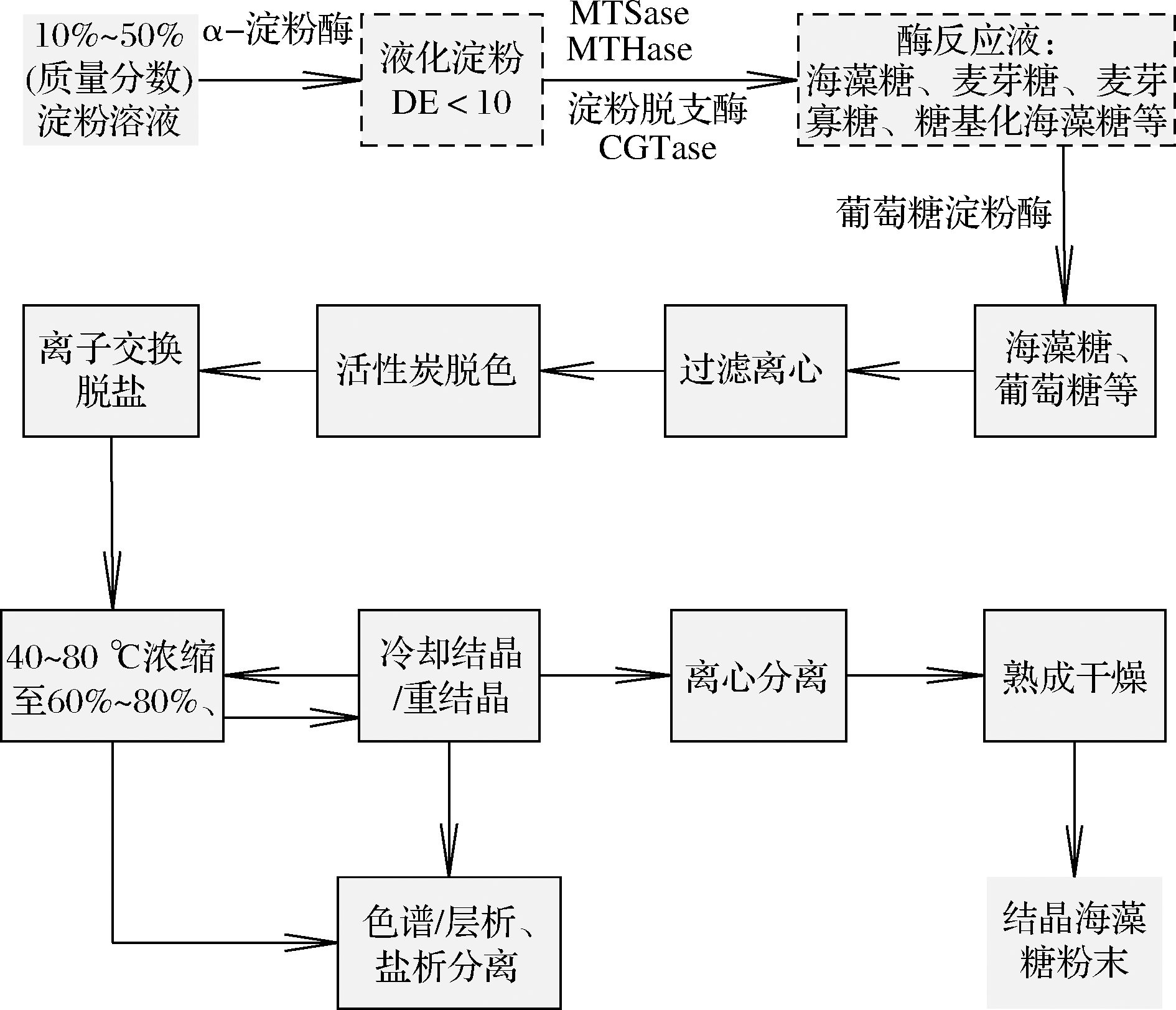
图2 CGTase参与下的双酶法制造海藻糖基本工艺
Fig.2 Technological process of trehalose production by double-enzyme with the participation of CGTase
注:DE值是以葡萄糖计的还原糖占淀粉水解液中干物质的百分比,也称葡萄糖值,表示的是淀粉的水解程度或糖化程度
1.3 双酶法在国内的应用与研究进展
1999年,黄日波从硫矿硫化叶菌 (Sulfolobus sotfataricus GX×05T)中克隆到MTSase和MTHase基因并表达成功[17]。2000年,南宁中诺生物工程有限责任公司在此基础上成功开发出酶法转化木薯淀粉制备海藻糖的工艺,精制后得到纯度为98%的食品级结晶海藻糖和99%高纯度的结晶海藻糖;我国成为世界上第2个酶法工业化生产海藻糖的国家。2002年,我国结晶海藻糖价格为79元/kg[17-18],至2010年底,海藻糖价格降低至25 000元/t。2014年,山东天力药业有限公司完成了以淀粉为原料双酶法生产海藻糖项目的中试,并在专利CN103205475A中介绍了公开了以淀粉为原料利用新型MTHase和MTSase、高温淀粉酶及普鲁兰酶生产海藻糖的工艺条件,至2020年天力药业的海藻糖产量达3 000 t。
MTSase和MTHase 2种酶的制备技术难度较大,前期报道的适用温度多在50 ℃以内,最高不超过60 ℃[19-21]。随后日本进一步优化并完成了耐高温双酶法工艺应用,但国内的反应温度普遍较低;这导致在实际生产中容易发生杂菌污染现象、增加生产控制成本。为了提高酶活及其耐高温性能,江南大学、齐鲁工业大学等研究者采用基因工程手段改造或重建MTSase和MTHase[22-24]。如:江南大学的吴世雄等将来源于嗜酸热硫化叶菌ATCC 33909的 MTSase和MTHase在短芽孢杆菌中重组表达,并进行了酶转化实验,发现在60 ℃,pH 5.5的条件下转化率达到80.2%[25], 酶的耐温性和活性都得到了显著提高。此外,有研究采用复合酶技术[26]以及酶固定化技术或细胞固定化技术来提高酶的稳定性。上述研究成果多在实验室阶段,但对双酶法的工业化完善有重要意义。
2 单酶法
2.1 单酶法原理
双酶法采用直链淀粉为底物,还可以采用麦芽糖作为底物制备海藻糖。以麦芽糖为底物的制备途径主要有2种:
(1)在磷酸的作用下,先利用麦芽糖磷酸化酶生成葡萄糖和β-1-磷酸-葡萄糖,再利用海藻糖磷酸化酶将二者合成海藻糖,该方法反应复杂,收率低,不适宜于工业制备。
(2)利用TreS的分子内转糖基作用,将麦芽糖分子中的α,α-1,4-糖苷键断裂形成葡萄糖和葡萄糖基,随后直接形成α, α-1,1-糖苷键从而将麦芽糖异构为海藻糖,如图3所示,该方法只需用一种酶作用于底物,常被称作为单酶法(也被称为TreS法),利用TreS合成海藻糖的单酶法的转化率要明显大于上述磷酸作用下的方法,反应过程更简单,更适用于工业生产。
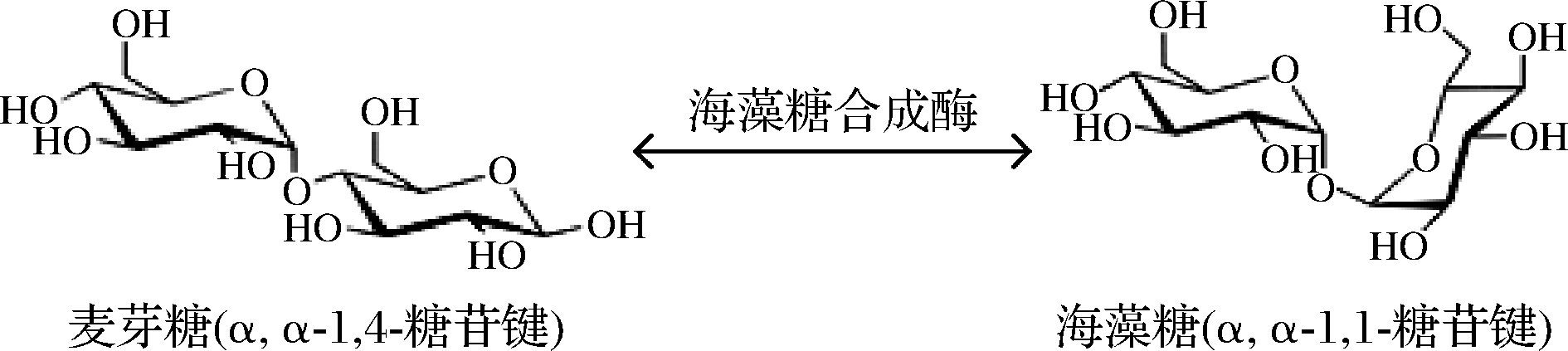
图3 TreS作用于麦芽糖合成海藻糖
Fig.3 The conversion reaction from maltose to trehalose by TreS
2.2 单酶法工艺
以麦芽糖为原料单酶法制备海藻糖的工艺相对简单,酶反应后经过脱色、脱盐、分离提纯、浓缩、结晶后即可得到海藻糖产品。一般而言,原料麦芽糖可以直接采用市售麦芽糖浆或市售结晶麦芽糖,也可以利用淀粉转化制备得到麦芽糖。麦芽糖底物的纯度越高,海藻糖产物纯度越高,副产物越少,专利EP0636693认为麦芽糖底物纯度优选为70%及以上(以干燥固体计),从这个角度看后2种方式应该更为可靠有效。
底物麦芽糖可由淀粉水解制备,且水解工艺已经成熟,所以也可以直接以淀粉为原料水解成麦芽糖,然后经过酶反应得到海藻糖。日本林原生化所在专利JP1994014402、EP0636693和CN1281744C中介绍了来自3种不同微生物的TreS(原文称为麦芽糖-海藻糖转化酶),该工艺采用先以淀粉为原料制备麦芽糖后再合成海藻糖的方法,利用α-淀粉酶、β-淀粉酶和异淀粉酶等分别对淀粉进行液化、糖化得到90%及以上的麦芽糖浆;随后在海藻糖合酶TreS的作用下发酵转化,对反应混合物(组成为约73%海藻糖、22%麦芽糖和5%葡萄糖,质量分数)脱色、脱盐和浓缩,得到富含海藻糖的糖浆,也可以一步分离纯化后结晶干燥得到有水或无水结晶海藻糖(图4)。

图4 单酶法制备海藻糖的工艺流程
Fig.4 Technological process of trehalose preparation by single-enzyme method
TreS对底物麦芽糖的浓度不敏感,在2.5%~40%的底物质量分数下反应都能得到70%~80%的转化率。海藻糖合酶的耐温性普遍不高,目前国内报道的酶活性温度范围大多不超过45 ℃,温度较低时反而有较好的海藻糖产率,当温度升高时,酶活力下降,同时又会把部分麦芽糖底物水解为葡萄糖,降低海藻糖产率。目前采用TreS法制备海藻糖的转化率基本不超过80%或在70%以下,意味着至少有20%的原料(麦芽糖)未被利用,或需要分离后再次利用,这在无形中增加了成本,需进一步提高TreS的海藻糖转化效率。
2.3 单酶法在国内的应用与研究
我国对海藻糖的工业化生产起步晚于日本与欧美,相较于日本的双酶法、欧美的转基因植物法,国内更倾向于工艺相对简单的海藻糖合酶法的研究,相关报道也更多。2004年开始,南宁中诺生物工程有限公司、中国农业科学院、长沙理工大学等在专利CN1563371A、CN1570098A、CN103215300、CN103421761B、CN102533822A、CN101100658B、CN101519652B中公布了不同TreS的制备方法或TreS转化麦芽糖制备海藻糖的工艺。广西大学、南京工业大学和中科院微生物研究所等也对海藻糖合酶筛选制备和应用做了大量研究。
海藻糖合酶存在热稳定性差、转化效率低于双酶法等问题,限制了应用范围,探索酶的热稳定性机制、提高TreS的热稳定性和转化效率是当前国内的研究热点。赵晓艳等[27]和张悦[28]对60 ℃保温3 h就会丧失酶活性TreS I进行分子改造,通过 PCR介导的方法对TreS II可能影响到热稳定性的氨基酸进行定点突变,改造TreS II在60 ℃保温3 h条件下酶活力最多可保留68%。张悦等[28]和宿玲恰等[29]利用定点突变技术,将海藻糖合酶第251位Pro突变为Leu,突变酶转化麦芽糖制备海藻糖的转化率比天然酶高出13.0%。 任绪东[30]和WANG等[31]通过半理性设计结合定点饱和突变的方法,建立了针对非保守氨基酸的饱和突变,4种突变体的转化率相比原始酶分别提高了4.38%、3.47%、2.74%和3.6%。吕鑫[32]通过预测Pseudomonas putidaP06的TreS的空间结构,并结合分子对接和保守性分析,选择第490位的Lys进行饱和突变,筛选突变体K490L 和K490的转化率比原始酶分别提高了18%和15%。
除了对TreS酶活性和热稳定性的优化,也有研究者通过优化产酶培养条件来提高酶活[33];或者通过构建胞外产酶微生物来提高产酶效率和酶活性。如刘洪玲等[34]成功构建了芽胞表面展示TreS的重组枯草芽胞杆菌,实现了TreS在胞外的应用及避免胞内表达的不便利。上述研究成果还处于实验室阶段,但对于TreS单酶法的工业应用极具参考意义。
3 单酶法与双酶法生产海藻糖的比较
3.1 原料
双酶法以淀粉为原料,单酶法多采用麦芽糖为原料。淀粉原料生产技术成熟、来源广、价格也低于麦芽糖,以木薯淀粉为例,售价约为2 500~4 000元/t,麦芽糖浆的售价在4 000~5 000元/t,高纯麦芽糖或结晶麦芽糖的价格更高。
鉴于麦芽糖可由淀粉转化生成,且技术成熟,也有些研究者以淀粉为原料,先将淀粉水解成麦芽糖后,再采用单酶法生产海藻糖。虽然原料价格下降,但增加了麦芽糖的生产工段的投资,且影响后续分离精制及海藻糖的纯度,该方式更适用于现有的麦芽糖生产厂家拓展下游生产线。但随着融合酶技术的提高,以淀粉为原料的单酶法工艺可行性也越来越高。谌芳[35]通过替换海藻糖合酶生产菌以及T4 连接酶插入连接肽的方式,构建了β-淀粉酶-海藻糖合酶融合酶,该融合酶在温度 45 ℃、pH 6.5条件下催化6%直链淀粉12 h的转化率可高达86%,该研究对于单酶法工艺具有突破性的应用价值。
3.2 产物组分
从产物组成上来看,淀粉双酶法产物中的糖类组合物非常复杂,副产物有麦芽糖、葡萄糖、麦芽寡糖甚至糖基海藻糖(如α-葡萄糖基海藻糖、α-麦芽糖基海藻糖、α-麦芽三糖基海藻糖、α-麦芽四糖基海藻糖等),使得生产分离成本较高;采用麦芽糖合成海藻糖时,反应产物较为简单:海藻糖和副产物葡萄糖以及剩余麦芽糖,理论上而言这一方法的后续分离工艺也会更为简单;但实际生产中使用的商品麦芽糖(浆)含有很多杂糖,对反应和后续分离会有一定程度的影响,所以更宜采用价格高的结晶麦芽糖;若采用以淀粉为原料自行制备麦芽糖使用,会相应增加制备麦芽糖的工艺和设备成本,但同时原料成本降低,副产物麦芽糖等可作为第2经济产物或再次利用。
3.3 制备工艺
淀粉双酶法制备海藻糖虽然具有原料便宜来源广等优点,但制备过程要用到2种酶,这2种酶的制备技术难度较大,反应时间长、易染菌;尽管国内有报道一些耐热耐酸性酶,但在确保酶活性或实现大规模生产上仍有技术难度。同时该工艺淀粉酶用量较大,对副产品的控制以及副产品中麦芽糖和海藻糖的分离难度相对较大,工艺过程较为复杂,存在技术壁垒,世界上只有少数公司企业机构拥有该生产工艺。
双酶法反应前需要将淀粉转化为葡萄糖聚合度为3或以上的、相对高黏度高分子量的淀粉糖,需要淀粉酶、MTHase和MTSase等多种酶的参与,造成工艺冗长。而单酶法只需要一种海藻糖合酶,所以制酶工艺更简单;同时该酶专一性很强,只作用于麦芽糖和海藻糖,反应过程简单,工艺流程也更简短,设备占用率更低;又因为无需考虑2种酶的协同作用,在工业生产上更容易控制调节。
无论是双酶法还是单酶法都必然需要面对去除以葡萄糖为主的副产物的问题。现有方法主要包括结晶分离、色谱提纯(如模拟移动色谱分离技术)和微生物发酵法。对于双酶法,控制好淀粉的糊化反应和双酶促反应也是降低副产物的关键。对于单酶法,除了酶促反应过程,麦芽糖原料的纯度也直接影响副产物水平;张晓元等[36]利用酵母发酵法预处理去除原料麦芽糖浆中的葡萄糖,以消除底物抑制提高酶法生产海藻糖产率,降低副产物葡萄糖水平,具备一定的工业参考意义。
3.4 转化效率
从转化效率上而言,研究和工业化应用更早的双酶法转化率最高可达85%,而单酶法的转化率略低一些,已报道的数据多为60%~70%,甚至更低,在工业上,不足60%的转化率难以满足生产需求,不具备竞争优势。少数转化率大于80%的数据还停留在实验室研究阶段,距离工业化还有很大差距。
无论是淀粉双酶法还是麦芽糖转化法,其转化效率都有进一步提升的余地,在工业化生产时二者都普遍存在酶反应时间长、耐热耐酸性较差的特点,如海藻糖合酶法的反应时间多在48~72 h,所采用的温度普遍较低(<50 ℃),如若解决这一难题,将更加有利于海藻糖的大规模生产与推广应用。为了提高其转化效率和热稳定性、缩短反应时间,采用定点突破技术、易错PCR技术等蛋白质工程和基因工程技术手段来改造TreS是一种有效且热门的方法,并且取得了众多有意义的研究成果,如何将这些研究成果应用于工业化是后续的主要研究方向。
一些研究者尝试筛选天然微生物制备耐酸耐热性能更好的酶,如中国科学院微生物研究所在专利CN100393873C发现一种淀粉海藻糖基合成酶,其可用的反应pH为4.5~8.0,优选7.0~6.0,优选温度55~70 ℃,最高达约75 ℃。专利CN1177043C中介绍了利用耐热嗜酸型海藻糖基合成酶和海藻糖基水解酶作用于还原性淀粉水解产物制备海藻糖的过程。也有的研究者考虑通过固定化酶的方式来实现。如专利CN103981233A引入二氧化硅纳米材料作为酶的固定相,专利CN104328107A通过透性化处理、并利用壳聚糖和海藻酸钠共固定化制备形成合成海藻糖的双酶微球。这些方法为工业生产提供了一种可能的方向。
4 小结与展望
目前日本主要利用淀粉双酶法生产海藻糖,单酶法在国内更受关注。2种生物酶转化技术各有优势,双酶法的原料便宜易得、工艺较成熟、转化率较高,而单酶法具有反应过程易控、工艺流程简单、副产物少等优点。单酶法因为其只需一步酶促反应的简单工艺而被国内外众多研究者视为未来海藻糖酶法生产的方向。目前2种方法在反应机制探索、酶的耐高温性能优化和酶转化率上都有需要进一步完善的地方。尽管无论是淀粉双酶法还是单酶法都存在着一定的缺陷,但随着基因工程和蛋白工程技术领域的发展、对海藻糖合成相关酶的构建优化以及色谱提纯等配套分离技术的日益成熟与应用,这2种海藻糖生产技术尤其是TreS法仍具实现更大规模的工业化生产的潜力。
[1] 王文静, 张悦, 余明芳, 等.海藻糖调节植物响应非生物胁迫的研究进展[J].分子植物育种, 2020, 18(10):3 433-3 440.
WANG W J, ZHANG Y, YU M F, et al.Research progress of trehalose in regulating plant response to abiotic stress[J].Molecular Plant Breeding, 2020, 18(10):3 433-3 440.
[2] 尤新. 淀粉糖品生产与应用手册[M].北京:中国轻工业出版社, 2010.
YOU X.Production and Application of Starch Sugar Products[M].Beijing:China Light Industry Press, 2010.
[3] SHIREAASHI R, MÜLLER K J, SUKHORUKOV V L, et al.Effects of physiological isotonic cryoprotectants on living cells during the freezing-thawing process and effects of their uptake by electroporation (alginate-trehalose solutions to Sp2 cells)[J].Heat Transfer-Asian Research,2003,32(6):511-523.
[4] BETORET E, CALABUIG-JIMÉNEZ L, PATRIGNANI F, et al.Effect of high pressure processing and trehalose addition on functional properties of mandarin juice enriched with probiotic microorganisms[J].LWT-Food Science and Technology, 2017, 85:418-422.
[5] 尚珊, 祁立波, 姜鹏飞, 等.海藻糖和复合磷酸盐对鲟鱼肉冻融稳定性的影响[J].食品工业科技, 2020, 41(9):205-209;326.
SHANG S, QI L B, JIANG P F,et al.Effect of trehalose and composite phosphate on the freezing-thawing stability of sturgeon[J].Science and Technology of Food Industry, 2020, 41(9):205-209;326.
[6] 张小利, 祈雪儿, 姚慧, 等.磷酸化海藻糖制备工艺优化及其活性评价[J].食品安全质量检测学报, 2020, 11(5):1 446-1 451.
ZHANG X L, QI X E, YAO H, et al.Optimization of the preparation of phosphorylated trahalose and its activity evaluation[J].Journal of Food Safety and Quality, 2020, 11(5):1 446-1 451.
[7] PASTINEN O, NYYSSÖL A, PIHLAJANIEMI V, et al.Fractionation process for the protective isolation of ergosterol and trehalose from microbial biomass[J].Process Biochemistry, 2017, 58:217-223.
A, PIHLAJANIEMI V, et al.Fractionation process for the protective isolation of ergosterol and trehalose from microbial biomass[J].Process Biochemistry, 2017, 58:217-223.
[8] 刘功良, 杨松光, 张敏倩, 等.一种海藻糖的制备方法:中国, CN2019112219807[P].2020-01-21.
LIU G L, YANG S G, ZHANG M Q, et al.A preparation method of trehalose:China, CN2019112219807[P].2020-01-21.
[9] 宋建民, 王德海, 宛荣生, 等.一种酵母提取海藻糖的生产方法:中国, CN2018107742570[P].2018-10-23.
SONG J M, WANG H D, WAN R S, et al.A production method of trehalose extraction by yeast:China, CN2018107742570[P].2018-10-23.
[10] 洪厚胜, 窦冰然, 郭会明.基于面包酵母中海藻糖提取工艺优化及菌株筛选的高密度培养工艺[J].食品科学, 2018, 39(6):122-129.
HONG H S, DOU B R, GUO H M.Optimization of extraction process for trehalose from baker′s yeast for strain screening and high density culture[J].Food Science, 2018, 39(6):122-129.
[11] 吴亦菲. 碳源协同利用平台的构建及其在海藻糖生产中的应用[D].北京:北京化工大学, 2017.
WU Y F.Construction of carbon sources synergetic utilization mechanism and its application in trehalose biosynthesis[D].Beijing:Beijing University of Chemical Technology, 2017.
[12] 齐鲁工业大学. 一种利用高效分泌表达的双酶融合酶耦合发酵生产海藻糖的方法:中国, CN2018114901961[P].2019-04-26.
Qilu University of Technology.A method for trehalose production by coupled fermentation of two enzyme fusion enzymes:China, CN2018114901961[P].2019-04-26.
[13] GONG T, LI L L, ZHAO Z Z,et al.Advances in trehalose biosynthesis pathways and application of molecular biology technique[J].Agricultural Science & Technology, 2016, 17(8):1 790-1 795.
[14] 邓丹丹, 李美, 凌婉阳.海藻糖的生产及分析方法的国内研究进展[J].甘蔗糖业, 2020(1):57-66.
DENG D D, LI M, LING W Y.Research progress in production and analysis of trehalose in China[J].Sugarcane and Canesugar, 2020(1):57-66.
[15] 龙学铖. 海藻糖合成酶生产工艺研究[D].北京:北京化工大学, 2016.
LONG X C.Progress research of trehalose production[D].Beijing:Beijing University of Chemical Technology, 2016.
[16] 曲茂华, 张凤英, 何名芳, 等.海藻糖生物合成及应用研究进展[J].食品工业科技, 2014, 35(16):358-362.
QU M H, ZHANG F Y, HE M F, et al.Research progress in trehalose biosynthesis and applications[J].Science and Technology of Food Industry, 2014, 35(16):358-362.
[17] 黄日波. 海藻糖:21世纪的新型糖类[M].北京:化学工业出版社, 2010.
HUANG R B.Trehalose:A New Tpe of Sugar in the 21st Century[M].Beijing:Chemical Industry Press, 2010.
[18] 韦航, 马少敏, 张云光, 等.海藻糖的酶转化法生产技术[J].安徽农业科学, 2010, 38(22):12 016-12 018.
WEI H, MA S M, ZHANG Y G, et al.Production technology of trehalose by enzymatic transformation[J].Journal of Anhui Agricultural Sciences, 2010, 38(22):12 016-12 018.
[19] YAMAMOTO T, MARUTA K, KUBOTA M, et al.Non-reducing saccharide-forming enzyme, trehalose-releasing enzyme, and process for producing saccharides using the enzymes:US, US7582463[P].2009-09-01.
[20] TAKASHI S, SEISUKE I.Process for producing a powder containing crystalline α, α-trehalose dihydrate:Spain, EP2759600[P].2018-06-13.
[21] MARUTA K, KUBOTA M, SUGIMOTO T, et al.Trehalose-releasing enzyme, and its preparation and uses:US, US5591612[P].1997-01-07.
[22] 薛乐平. 产MTSase、MTHase融合酶菌株的构建及其表达[D].济南:齐鲁工业大学, 2017.
XUE L P.Construction and expression of MTSase and MTHase fusion strain [D].Jinan:Qilu University of Technology, 2017.
[23] 王魁. 来源于Athrobacter ramosus S34的MTSase和MTHase的重组表达、发酵优化及制备海藻糖的研究[D].无锡:江南大学, 2017.
WANG K.Recombinant expression, fermentation optimization and trehalose production of MTSase and MTase from Athrobacter ramosus S34[D].Wuxi:Jiangnan University, 2017.
[24] 王魁, 宿玲恰, 吴敬, 等.重组Athrobacter ramosus S34 MTSase和MTHase的酶学性质及其制备海藻糖的应用条件优化[J].食品与发酵工业, 2017, 43(7):1-6.
WANG K, SU L Q, WU J, et al.Enzymatic properties of recombinant Athrobacter ramosus S34 MTSase and MTase and optimization of application conditions for production of trehalose[J].Food and Fermentation Industries, 2017, 43(7):1-6.
[25] 吴世雄, 宿玲恰, 姚锴琳, 等.MTSase和MTHase在Brevibacillus brevis中的克隆表达及应用研究[J].食品与生物技术学报, 2018, 37(8):838-844.
WU S X, SU L Q, YAO K L, et al.Heterologous expression of MTSase and MTHase in Brevibacillus Brevis and its application[J].Journal of Food Science and Biotechnology, 2018, 37(8):838-844.
[26] 吴敬, 宿玲恰, 封金云.一种多酶复配生产海藻糖的方法及其应用:中国, CN108707633A[P].2018-06-05.
WU J, SU L Q, FENG J Y.A Method of trehalose production with multiple enzymes and its application:China, CN108707633A[P].2018-06-05.
[27] 赵晓艳, 陈允妲, 章雅倩, 等.Myxococcus sp. V11海藻糖合酶TreS II分子改造[J].中国生物工程杂志, 2020, 40(3):79-87.
ZHAO X Y, CHEN Y D, ZHANG Y Q, et al.Site-directed mutagenesis improves the thermostability of trehalose synthase TreS II from Myxococcus sp. V11[J].China Biotechnology, 2020, 40(3):79-87.
[28] 张悦. 嗜热栖热菌海藻糖合酶的表达、分子改造及其应用研究[D].无锡:江南大学, 2015.
ZHANG Y.The study of expression, molecular modification and application of trehalose synthase from Thermus thermophilus[D].Wuxi:JiangNan University, 2015.
[29] 宿玲恰, 张悦, 吴敬.嗜热栖热菌海藻糖合酶的分子改造及其应用[J].食品与发酵工业, 2015, 41 (12):1-5.
SU L Q, ZHANG Y, WU J.Molecular modification and application of trehalose synthase from Thermus thermophilus[J].Food and Fermentation Industries, 2015, 41 (12):1-5.
[30] 任绪东. Thermobaculum terrenum海藻糖合酶的耐热和催化机制分析及其催化活性定点改造的研究[D].济南:齐鲁工业大学, 2019.
REN X D.Heat-resistant and catalytic mechanism and catalytic activity modification of a new kind of thermostable trehalose synthase from Thermobaculum terrenum[D].Jinan:Qilu University of Technology, 2019.
[31] WANG J Q, REN X D, WANG R M, et al.Structural characteristics and function of a new kind of thermostable trehalose synthase from Thermobaculum terrenum[J].Journal of Agricultural and Food Chemistry, 2017, 65(35):7 726-7 735.
[32] 吕鑫. 海藻糖合酶分子改造及在毕赤酵母中的分泌表达研究[D].济南:齐鲁工业大学, 2018.
LYU X.Molecular modification of trehalose synthase and secretory expression in Pichia pastoris[D].Jinan:Qilu University of Technology, 2018.
[33] 刘红娟, 王腾飞, 汤丹丹, 等.响应面法优化大肠杆菌产海藻糖合酶发酵培养基[J].食品工业科技, 2015, 36(11):181-187.
LIU H J, WANG T F, TANG D D, et al.Optimization of fermentation conditions for trehalose synthase production by Escherichia coli using response surface method[J].Science and Technology of Food Industry, 2015, 36(11):181-187.
[34] 刘洪玲, 刘浩, 王腾飞.枯草芽胞表面 CotC 和 CotG 共展示海藻糖合酶研究[J].天津科技大学学报, 2020, 35(1):18-25.
LIU H L, LIU H, WANG T F.Surface display trehalose synthase on Bacillus subtilis spore by CotC and CotG[J].Journal of Tianjin University of Science & Technology, 2020, 35(1):18-25.
[35] 谌芳. 分子改造提高融合酶特性的研究[D].济南:齐鲁工业大学, 2020.
CHEN F.The study on improving the characteristics of fusion enzyme by molecular modification[D].Jinan:Qilu University of Technology, 2020.
[36] 张晓元, 郝荣华, 刘飞, 等.麦芽糖浆预处理对酶法生产海藻糖的影响研究[J].食品工业科技, 2016, 37(11):161-164.
ZHANG X Y, HAO R H, LIU F.et al.Effect of malt syrup pretreatments on the trehalose production by enzymatic method[J].Science and Technology of Food Industry, 2016, 37(11):161-164.