酱香型大曲是以小麦为原料制成的一种用于酱香型白酒酿造的糖化剂和发酵剂,可为白酒酿造提供微生物、风味物质以及营养底物[1-2]。因此大曲的质量直接关系到酒的风格与品质。在制曲的过程中,小麦被来自于原材料和环境的微生物降解,然后在高温条件下通过生化过程形成并积累了酱香的风味[3-4]。由于发酵仓内温度、水分的差异,使得大曲在不同部位的外观有很大差异。因此,3种类型的大曲一般通过感官评估来区分(例如水分,气味和颜色),分别命名为白曲、黄曲、黑曲[5]。在实际的白酒生产中所使用的成熟大曲是3种类型的大曲经过贮存后混合磨碎制成。因此,保证不同曲种产量的连续性并研究它们之间的差异具有重要意义。
近年来,通过不依赖培养的方法探索了大曲发酵过程中微生物群落的组成和动态演替[6-8]。但是,很少有人关心发酵过程中同时形成的3种类型的大曲。因此,我们使用顶空固相微萃取气质联用技术[9]比较了不同曲种的挥发性物质,并找到相对的主要风味。通过高通量测序研究不同曲种生物标记的同时借助实时定量PCR分析微生物的绝对定量,并基于绝对定量进行生物标志物和主要风味的相关分析。研究为区分不同曲种提供了代谢标记,并探讨了引起代谢物组成差异的生物学因素。
1 材料与方法
1.1 材料与试剂
酱香型高温大曲来自贵州茅台酒股份有限公司,在大曲拆仓时从曲仓不同部位随机取9个样,经液氮处理后放于无菌自封袋中,保存于-40 ℃备用。其中BQ1、BQ2、BQ3为黑曲的3个平行样,YQ1、YQ2、YQ3为黄曲的3个平行样,WQ1、WQ2、WQ3为白曲的3个平行样。
乙酸铵、氨水、福林酚、甲醇、乙腈、2-辛醇,上海国药集团;土壤DNA试剂盒、Quant-iT PicoGreen dsDNA分析试剂盒,赛默飞;Vazyme VAHTSTM DNA Clean Beads试剂盒,南京诺唯赞。
1.2 仪器与设备
7890B气相色谱仪,安捷伦;Q-Exactive HF X质谱仪,Thermo Fisher Scientific。
1.3 实验方法
1.3.1 酱香大曲酶活性测定
将大曲和缓冲液按照料液比1∶10(g∶mL)浸提,得到大曲粗酶溶液,用于下一步的酶活性测定。根据CUPP-ENYARD[10]描述的方法,以酪蛋白作为测定蛋白酶的底物。一个单位蛋白酶活性(U)定义为1 min释放1 μg酪氨酸的酶量。如ZHANG等[11]所述测定糖化酶和淀粉酶活性。一个单位淀粉酶活性(U)定义为在5 min内释放1 mg葡萄糖的酶量。一个单位的糖化酶活性(U)定义为在30 min内释放1 mg葡萄糖的酶量。使用羧甲基纤维素作为底物,根据DASHTBAN等[12]的方法测量纤维素酶活性。一个单位纤维素酶(U)被定义为在合适的条件下在5 min内水解底物以产生1 mg葡萄糖所需的酶量。
1.3.2 顶空固相微萃取气质联用技术分析代谢物
5 g大曲样品与20 μL 2-辛醇(10 mg/L)混合作为内标,用SPME纤维(50∶30 mm二乙烯基苯-羧基-聚二甲基硅氧烷)在60 ℃下萃取30 min。在DB-Wax色谱柱(60.0 m×0.25 mm, 0.25 μm)上进行化合物的分离。氦气以1 mL/min的恒定流速用作载气。在50 ℃下保持2 min,以5 ℃/min到145 ℃,然后以15 ℃/min到230 ℃,并保持5 min。质谱仪以电子碰撞模式操作,电子能量设置为70 eV,扫描范围为33~400 m/z。MS源和四极杆的温度分别设置为200、230 ℃。使用美国国家标准与技术研究所和Wiley数据库鉴定每种化合物。选择正负匹配度>800的化合物。根据内标峰面积与风味物质峰面积的比值,计算出大曲挥发风味的相对浓度。
1.3.3 高通量测序
按照制造商的说明,利用土壤DNA试剂盒提取总基因组DNA样品,样品在-20 ℃下保存。使用正向引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和反向引物907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌16S rRNA基因V4~V5区进行PCR扩增。使用正向引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和反向引物ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS1区域扩增。将样品特异的7-bp条形码掺入引物中,以进行多重测序。PCR扩增子利用试剂盒进行纯化以及定量。定量后,将等量的扩增子合并,并使用位于上海个人生物技术有限公司的带有Illlumina MiSeq平台和MiSeq试剂盒v3的双末端2×250 bp测序。序列数据分析主要使用QIIME和R软件包(v3.2.0)进行。
1.3.4 细菌和真菌总数的定量分析
分别为插入200 bp长读段的16S rDNA引物Eub338(5′-ACTCCTACGGGAGGCAGCAG-3′)和Eub518 (5′-ATTACCGCGGCTGCTGG-3′)构建标准曲线。对于ITS rDNA引物,插入了300 bp长的ITS1f(5′-TCCGTAGGTGAACCTGCGG-3′)和5.8 s(5′-CGCTGCG-TTCTTCATCG-3′)。在实时荧光定量PCR系统(Roche)上确定样品中16S rDNA和ITS rDNA的绝对拷贝数。实时荧光定量PCR程序包括在95 ℃进行30 s的初始变性步骤,然后在95 ℃进行5 s变性的40个循环,在60 ℃进行30 s的退火。所有样品(包括标准品和无模板对照品)均一式三份进行测试。使用Origin 2018可视化量化结果,并通过R测试组之间的显着差异。
2 结果与分析
2.1 酱香大曲中主要酶的活性
小麦中富含淀粉和纤维素,可用作生产大曲的原料。大曲中可将淀粉和纤维素分解为葡萄糖的主要酶类有淀粉酶,糖化酶和纤维素酶[13-15]。葡萄糖作为微生物最常用的能量物质,为微生物的生长和繁殖提供了能量。它通过糖酵解途径参与了微生物的中央碳代谢,并且与各种代谢物如丙酮酸的合成密切相关。从酶活性水平来看(表1),白曲、黄曲中酶活性较高,可以实现原料的综合利用。白曲中的糖化酶活性明显高于其他大曲(P<0.001),具有很强的糖化能力,可以有效地实现淀粉和葡萄糖的转化。黑曲中的纤维素酶活性明显高于其他大曲(P<0.001)。一方面,黑曲中的纤维素酶可以分解小麦纤维素,使淀粉暴露出来。另一方面,黑曲中的纤维素酶可以将纤维素分解为葡萄糖,以满足微生物的生长。此外,白曲中的蛋白酶活性远高于其他酶(P<0.001),这对蛋白质的利用具有积极作用,并为进一步形成氨提供了氨基酸。
表1 不同曲种中酶活性 单位:U/g
Table 1 Enzyme activity of different kinds of Daqu
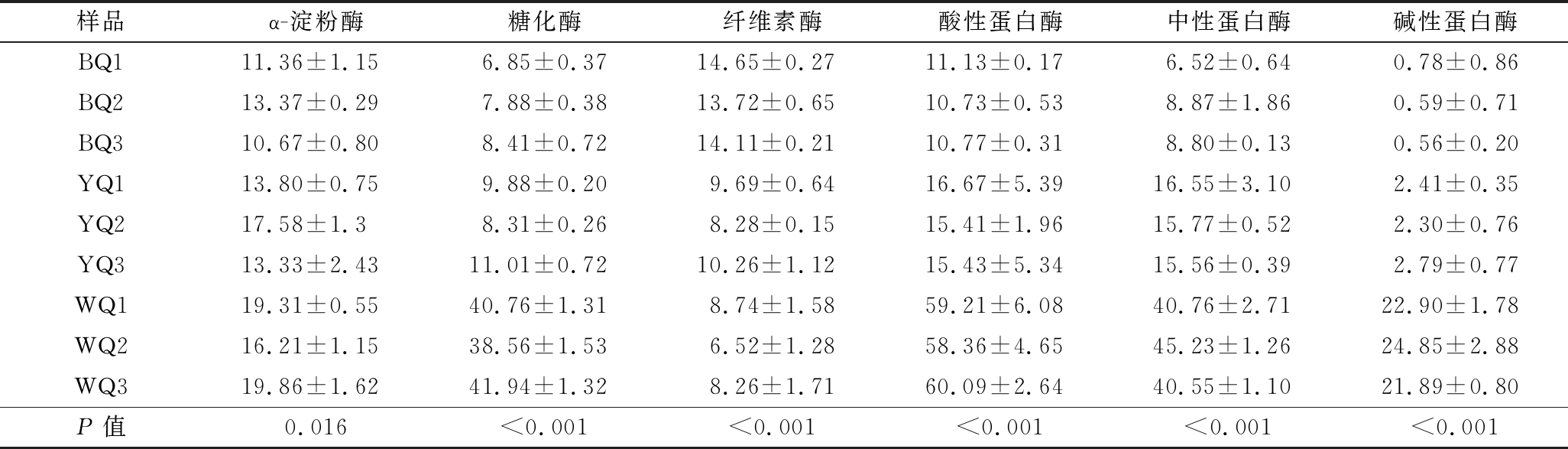
样品α-淀粉酶糖化酶纤维素酶酸性蛋白酶中性蛋白酶碱性蛋白酶BQ111.36±1.156.85±0.3714.65±0.2711.13±0.176.52±0.640.78±0.86BQ213.37±0.297.88±0.3813.72±0.6510.73±0.538.87±1.860.59±0.71BQ310.67±0.808.41±0.7214.11±0.2110.77±0.318.80±0.130.56±0.20YQ113.80±0.759.88±0.209.69±0.6416.67±5.3916.55±3.102.41±0.35YQ217.58±1.38.31±0.268.28±0.1515.41±1.9615.77±0.522.30±0.76YQ313.33±2.4311.01±0.7210.26±1.1215.43±5.3415.56±0.392.79±0.77WQ119.31±0.5540.76±1.318.74±1.5859.21±6.0840.76±2.7122.90±1.78WQ216.21±1.1538.56±1.536.52±1.2858.36±4.6545.23±1.2624.85±2.88WQ319.86±1.6241.94±1.328.26±1.7160.09±2.6440.55±1.1021.89±0.80P值0.016<0.001<0.001<0.001<0.001<0.001
2.2 酱香大曲中不同代谢物的分析
2.2.1 不同曲种代谢物组成
9个样品中总共鉴定出66种挥发性化合物。黑曲、黄曲和白曲中分别有43、47和43种物质,其中3种大曲共有的物质有23种(图1-a)。根据化合物的浓度绘制热图(图1-b),所有化合物主要分为7组,包括12种醇,10种酸,5种酯,9种醛,11种酮,15种吡嗪和4种酚。吡嗪,醇和酸在所有组中均占主导地位,其中白曲中的吡嗪浓度显着高于黑曲和黄曲,而黄曲中的醇和酸含量高于其余曲种(图2-a)。醇类物质中含量较高的是异戊醇和苯乙醇,酸中含量高的有乙酸,二甲基丙二酸和戊酸,吡嗪类物质中高含量的有2,5-二甲基吡嗪,三甲基吡嗪和四甲基吡嗪。
2.2.2 不同曲种特征风味物质解析
利用偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)分析3种类型大曲的代谢组成的相似性。PLS-DA得分图(图2-b,Q2> 0.9)显示,9种样品根据大曲类型分为3类,表明不同曲种之间代谢物具有显著差异。同时,通过计算可变重要性的投影(variable importance for the projection,VIP)表示变量对组间差异的贡献值,VIP值> 1表示“重要”变量。由图2可知共有16种代谢物对代谢差异有重要影响(图2-c,VIP值>1),其中乙酸,3-辛醇和戊酸是黄曲的特征物质(P<0.05)。 乙酸可通过酯化反应与醇进一步合成为酯如乙酸乙酯等,对白酒的特殊风味做出了巨大贡献[16-18]。2,5-二甲基吡嗪,三甲基吡嗪和四甲基吡嗪对白曲的代谢组成有巨大贡献,且这几种物质在白曲中含量丰富。其中四甲基吡嗪具有令人愉悦的坚果味、烘烤味和烘烤味,常见于酱香型白酒中,因此可被定义为白曲的特征风味物质[19]。尽管黑曲中没有显著的代谢物,但在黑曲中检测到了7种特定物质(图1),包括1种醇,2种酯,2种醛和2种酮,其中2,3-丁二醇含量最高,可视为黑曲的特征风味物质。

a-大曲代谢物韦恩图; b-大曲代谢物组成热图
图1 不同曲种中代谢物组成
Fig.1 Composition of metabolites in different kinds of Daqu

a-大曲中主要物质的质量分数; b-代谢物的PLS-DA评分图; c-重要代谢物的VIP图
图2 不同曲种的PLS-DA评分图以及重要代谢物
Fig.2 PLS-DA score plot and important volatiles of different Daqu
2.3 不同曲种的微生物解析
2.3.1 不同曲种菌群结构
所有样品中共检测到150个细菌属和44个真菌属。不同曲种中检测到的大多数属于厚壁菌门、变形菌门、放线菌门和子囊菌门,平均相对丰度分别为89.47%、5.58%、4.91%和97.26%。选择前20个优势细菌属和前10个优势真菌属进行分析。结果表明,不同曲种的细菌群落主要由4个优势细菌属(图3-a)组成:Kroppenstedtia、Bacillus、Thermoactinomyces 和Saccharopolyspora,其中所有样品的总相对丰度平均为85.65%。利用线性判别分析效应值(linear discriminant analysis effect size,LEfSe)以鉴定3种类型大曲的潜在生物标志物(图3-b、图3-d),Bacillus为白曲生物标志物(LDA> 4),Saccharopolyspora是黄曲的生物标志物(LDA> 4)。黑曲中相对丰度最高的是Lactobacillus(1.35%)以及Escherichia_Shigella(6.67%),其中Escherichia_Shigella是黑曲的生物标志物(LDA> 4)。
对于真菌属(图3-c),Paecilomyces、Thermoascus 和 Thermomyces平均总相对丰度为96.88%,在黑曲和黄曲中占主导地位。其中Paecilomyces的相对丰度在不同曲种间存在显著差异,在黑曲中相对丰度可达67.94%,但在白曲中相对丰度仅0.24%。Thermomyces在黄曲中相对丰度最高(37.04%),可视为黄曲的真菌生物标记。白曲的真菌群落组成主要由Thermoascus、Aspergillus和hypophoichia(88.33%)组成,这3种微生物在白曲中丰度比在其他两种类型的大曲中丰度高得多,可确定为白曲的生物标记。

a-细菌群落组成; b-细菌LEfSe分析; c-真菌群落组成; d-真菌LEfSe分析
图3 三种大曲中微生物组成及生物标志物
Fig.3 Microbial composition and biomarkers of three kinds of Daqu
2.3.2 大曲中细菌和真菌的绝对定量
基于实时荧光定量PCR的定量比较3种类型的大曲之间的细菌(图4-a)和真菌(图4-b)微生物的生物量。总细菌生物量和真菌生物量具有相同的趋势,其中白曲细菌和真菌数量最多,而黑曲最少。此外,各组大曲之间的定量差异显著(P <0.05)。同时,还值得注意的是,细菌生物量显著高于真菌生物量,并且其倍数变化为4~14。通过将相应的相对丰度和总生物量相乘,获得了每个微生物属的绝对定量。

a-细菌; b-真菌
图4 三种大曲中微生物数量
Fig.4 The number of microorganisms in three kinds of Daqu
2.4 微生物群落与风味物质和酶活力的关联分析
利用冗余分析[20](redundancy analysis,RDA)根据上面计算的绝对定量分析3种不同类型的大曲中特征性风味物质,酶活性和微生物群落之间的关系(图5-a)。冗余度分析中的蒙特卡罗置换检验表明,微生物与选定的影响因素之间存在显着的相关性(Pseudo-F=28.2,P=0.004),并且不同类型的大曲之间存在很大差异。
根据前向选择和长期效应的结果,结果保留了4种代谢物和3种酶(图5-a)。保留的影响因素解释了大曲微生物群落组成总变化的90.14%(RDA1和RDA2)。根据简单效果的结果比较了影响因素的解释率。糖化酶(解释率=71.3%,P=0.002)、酸性蛋白酶(解释率=71.3%,P=0.002)、碱性蛋白酶(解释率=70.9%,P=0.01)和四甲基吡嗪(解释率=65.8%,P=0.006)对大曲的微生物群落组成的总体变化有很高的单独解释率。从RDA分析图可以看出,Paecilomyces与Thermomyces两种微生物之间为正相关,两微生物在3-辛醇以及乙酸上的投影点位于其正方向,表明物种与环境因子间为正相关。因此,可得出结论Paecilomyces、Thermomyces与3-辛醇和乙酸呈正相关。同上分析可得Escherichia_Shigella与2,3-丁二醇呈正相关;四甲基吡嗪与Bacillus、Staphylococcus呈正相关;糖化酶和蛋白酶与多种优势微生物呈正相关,包括Bacillus、Exiguobacterium、Scopulibacillus、 Aspergillus等;糖化酶、蛋白酶与四甲基吡嗪呈正相关。以上分析结果表明,芽孢杆菌与糖化酶、蛋白酶和四甲基吡嗪具有强的相关性。
芽孢杆菌是大曲中四甲基吡嗪微生物合成的主要来源[21-23],并具有高产糖化酶的功能[24]。功能菌株如芽孢杆菌中的四甲基吡嗪的合成过程可分为三个部分(图5-b)[19]。首先,丙酮酸通过糖酵解途径产生,两个丙酮酸分子通过缩合形成α-乙酰乳酸。其次,将α-乙酰乳酸脱羧以产生乙酰丁酸酯。最后,乙酰丙酮和氨进行非酶反应生成四甲基吡嗪[25]。分析可得,白曲中糖化酶和蛋白酶与芽孢杆菌以及四甲基吡嗪密切相关,在这几种酶的作用下可以有效地分解原料,并为微生物的生长提供碳源,氮源和氨基酸等营养。此外,糖化酶可以通过分解淀粉产生葡萄糖的方式促进丙酮酸的产生,并为形成乙酰丙酮(四甲基吡嗪的前体)提供物质基础。蛋白酶可以将蛋白质分解为氨基酸,这为氨的形成提供了物质基础[26]。因此,这3种酶可用作代谢途径的一部分,为微生物合成四甲基吡嗪提供了驱动力。总之,糖化酶和蛋白酶可用作微生物合成四甲基吡嗪的驱动因子。
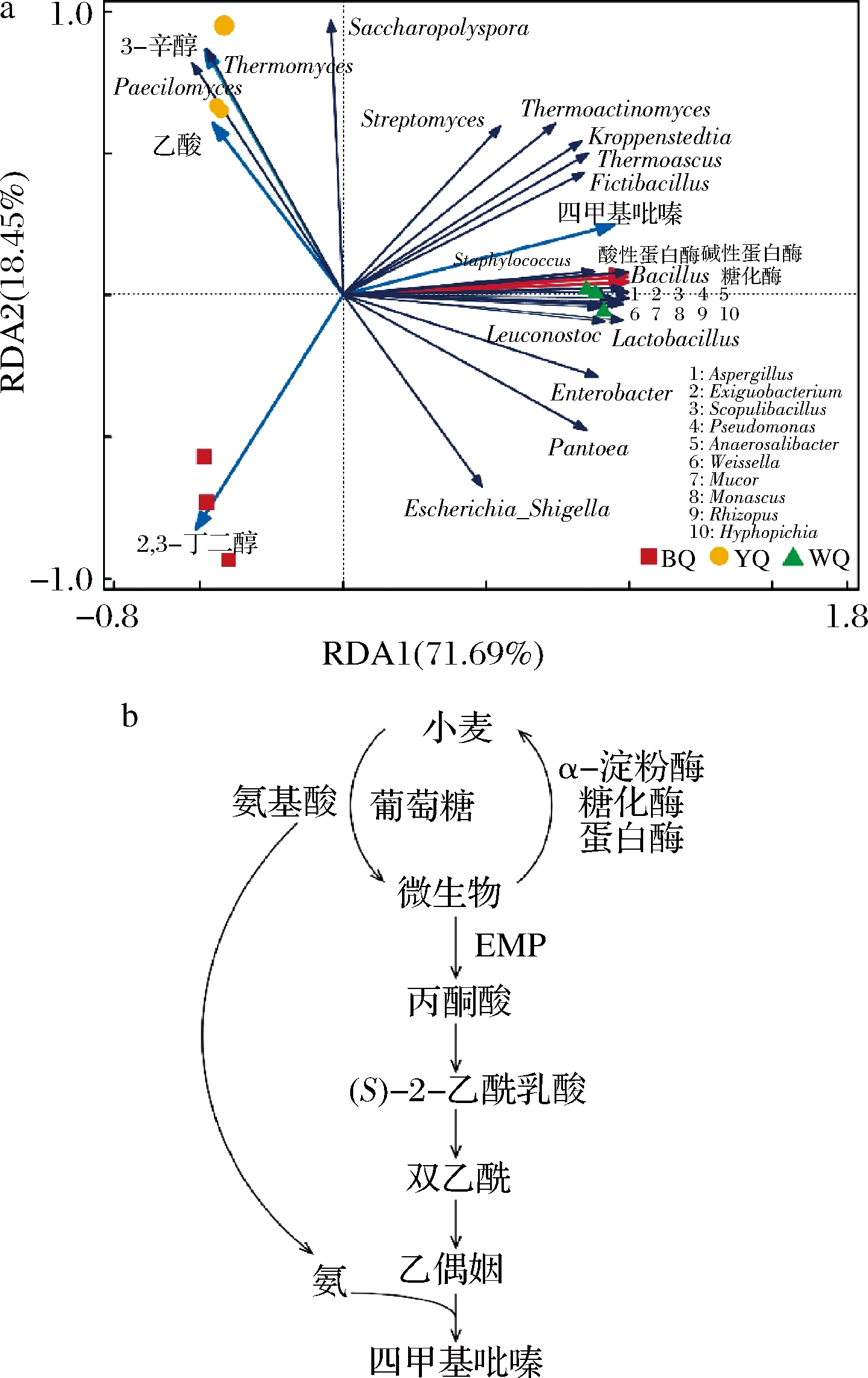
a-大曲微生物与代谢物冗余分析; b-大曲中四甲基吡嗪代谢通路
图5 大曲微生物及代谢物的冗余分析
Fig.5 Redundant analysis of Daqu microorganisms and metabolites
注:物种与环境因子的相关性可根据物种箭头在环境变量箭头上的垂直投影判断;投影点沿箭头指示的方向为正相关,且落得越远相关性越高,反之相关性为负
3 结论与讨论
利用多组学技术对不同曲种进行解析,明确了不同曲种中微生物、代谢物的组成及差异,揭示了微生物以及代谢物之间的关联性,为大曲生产工艺的优化奠定科学基础从而达到优化白酒品质的目的。研究表明黄曲的特征风味物质为乙酸、3-辛醇以及戊酸,白曲的特征风味物质为四甲基吡嗪,黑曲的特征风味物质为2,3-丁二醇;糖多孢菌和嗜热真菌是黄曲的标记微生物,芽孢杆菌、热子囊菌和曲霉是白曲的标记微生物,黑曲的标记微生物为拟青霉菌。白曲中高含量的芽孢杆菌对酱香白酒中四甲基吡嗪的提供具有重要贡献。同时,糖化酶和蛋白酶是芽孢杆菌生物合成四甲基吡嗪的重要作用因素。上述研究对于优化大曲风味以及为后续的白酒酿造提供高质量大曲提供了理论基础。后期工作可以利用定量蛋白质组学解析大曲中影响风味物质形成的酶类,实现大曲功能以及大曲中各物质之间关系的全面解析。
[1] ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu-A traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2011, 117(1):82-90.
[2] ZHENG X W, HAN B Z.Baijiu, Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[3] LUND M N, RAY C A.Control of Maillard reactions in foods:Strategies and chemical mechanisms[J].Journal of Agricultural and Food Chemistry, 2017, 65(23):4 537-4 552.
[4] 陈萍,连宾,尹祚莹,等.茅型酒酱香物质的本质和影响因素分析研究进展[J].食品科学,2013,34(15):403-408.
CHEN P, LIAN B, YIN Z Y, et al.Volatile flavor substances in Maotai-flavor liquor and their formation mechanisms[J].Food Science, 2013, 34(15):403-408.
[5] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology, 2019,10:1 540.
[6] LI H, LIAN B, DING Y H, et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Annals of Microbiology, 2014, 64(4):1 659-1 669.
[7] WANG X D, BAN S D, QIU S Y.Analysis of the mould microbiome and exogenous enzyme production in Moutai-flavor Daqu[J].Journal of the Institute of Brewing, 2018, 124(1):91-99.
[8] WANG X D, BAN S D, HU B D, et al.Bacterial diversity of Moutai-flavour Daqu based on high-throughput sequencing method[J].Journal of the Institute of Brewing, 2017, 123(1):138-143.
[9] DING X F, WU C D, HUANG J, et al.Characterization of interphase volatile compounds in Chinese Luzhou-flavor liquor fermentation cellar analyzed by head space-solid phase micro extraction coupled with gas chromatography mass spectrometry (HS-SPME-GC/MS)[J].LWT-Food Science and Technology, 2016, 66:124-133.
[10] CUPP-ENYARD C. Sigma′s non-specific protease activity assay-casein as a substrate[J].Journal of Visualized Experiments, 2008(19).DOI:10.3791/899.
[11] ZHANG B, HE P J, LYU F, et al.Extracellular enzyme activities during regulated hydrolysis of high-solid organic wastes[J].Water Research, 2007, 41(19):4 468-4 478.
[12] DASHTBAN M, MAKI M, LEUNG K T, et al.Cellulase activities in biomass conversion:Measurement methods and comparison[J].Critical Reviews in Biotechnology, 2010, 30(4):302-309.
[13] LIU J J, CHEN J Y, FAN Y, et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Journal of the Science of Food and Agriculture, 2018, 98(1):113-121.
[14] 刘延波,王肖行,赵志军,等.大曲中高产糖化酶菌株的筛选及产酶条件优化[J].中国农学通报,2020,36(33):108-113.
LIU Y B, WANG X H, ZHAO Z J, et al.The high-yield glucoamylase strains in Daqu:Screening and optimization of enzyme production[J].Chinese Agricultural Science Bulletin, 2020, 36(33):108-113.
[15] 胡宝东,邱树毅,周鸿翔,等.酱香型大曲的理化指标、水解酶系、微生物产酶的关系研究[J].现代食品科技,2017,33(2):99-106.
HU B D, QIU S Y, ZHOU H X, et al.Relationships among physiochemical indices and hydrolyzing enzyme systems and enzymes-produced-ability in Jiangxiang Daqu[J].Modern Food Science and Technology, 2017, 33(2):99-106.
[16] FAN W L, QIAN M C.Characterization of aroma compounds of Chinese "Wuliangye" and "Jiannanchun" liquors by aroma extract dilution analysis[J].Journal of Agricultural and Food Chemistry, 2006, 54(7):2 695-2 704.
[17] XIAO Z B, YU D, NIU Y W, et al.Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose[J].Journal of Chromatography B, 2014, 945-946:92-100.
[18] ZHU S K, LU X, JI K L, et al.Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Analytica Chimica Acta, 2007, 597(2):340-348.
[19] LI D N, HUANG W, WANG C X, et al.The complete genome sequence of the thermophilic bacterium Laceyella sacchari FBKL4.010 reveals the basis for tetramethylpyrazine biosynthesis in Moutai-flavor Daqu[J].Microbiology Open, 2019, 8(12):e922.
[20] QIAO C C, RYAN PENTON C, LIU C, et al.Key extracellular enzymes triggered high-efficiency composting associated with bacterial community succession[J].Bioresource Technology, 2019, 288:121576.
[21] ZHAO X X, LIU Y H, SHU L, et al.Study on metabolites of Bacillus producing soy sauce-like aroma in Jiang-flavor Chinese spirits[J].Food Science & Nutrition, 2020, 8(1):97-103.
[22] 汪文鹏, 李永博, 吴树坤,等.高温大曲中产吡嗪芽孢杆菌的分离鉴定及发酵产物分析[J].中国酿造, 2017, 36(6):63-66.
WANG W P, LI Y B, WU S K, et al.Isolation and identification of pyrazine-producing Bacillus from high-temperature Daqu and analysis of its fermentation products[J].China Brewing, 2017, 36(6):63-66.
[23] 杨帆,林琳,王和玉,等.茅台大曲中3株芽孢杆菌代谢产物的比对分析[J].酿酒科技,2011(8):42-43;46.
YANG F, LIN L, WANG H Y, et al.Comparative analysis of the metabolites of three Bacillus strains in Maotai Daqu starter[J].Liquor-Making Science and Technology, 2011(8):42-43;46.
[24] 鲁珍, 刘家扬, 谌馥佳,等.高温大曲中高产糖化酶菌株的筛选鉴定及固态发酵条件优化[J].湖南农业科学, 2016(4):1-4.
LU Z, LIU J Y, CHEN F J, et al.Filtering and identifying of high-yield glucoamylase strains from high temperature Daqu and optimization of solid state fermentation conditions[J].Hunan Agricultural Sciences, 2016(4):1-4.
[25] YANG F, LIU Y F, CHEN L Q, et al.Genome sequencing and flavor compound biosynthesis pathway analyses of Bacillus licheniformis isolated from Chinese Maotai-flavor liquor-brewing microbiome[J].Food Biotechnology, 2020, 34(3):193-211.
[26] HUANG Y G, WU Q, XU Y.Isolation and identification of a black Aspergillus strain and the effect of its novel protease on the aroma of Moutai-flavoured liquor[J].Journal of the Institute of Brewing, 2014, 120(3):268-276.