泻剂结肠是由于长期应用刺激性泻剂,损害结肠神经系统,导致肠神经退行性变化[1-3],出现胃肠动力障碍,对泻剂反应性下降,使病人对泻剂产生依赖性或者泻剂成瘾的一种状况,常见于饱受便秘困扰的中老年人。在我国,随着生活节奏加快、膳食结构的改变及精神压力激增,便秘的发病率逐年上升并趋于低龄化,严重威胁人类的生活质量[4]。诸如番泻叶、大黄、芦荟等一系列刺激性泻药由于见效快、成本低饱受便秘患者青睐,患者为缓解便秘,长期使用刺激类泻剂,随着病程的进展,泻剂的服用量与泻下效果成反比,最终失去导泻作用,形成“泻剂结肠”,严重者甚至可发展为结肠黑变病甚至是结肠癌。但目前消费者对于这类泻药的副作用了解甚少,且国内对于泻剂结肠的报道较少,很少引起消费者尤其是便秘人群的关注。因此,刺激性泻药仍是很多家庭出现便秘症状时的首要选择,长此以往,泻剂结肠患者将越来越多,而目前对于泻剂结肠的治疗并无有效手段,严重患者需进行结肠切除术来缓解症状。
目前,益生菌作为辅助治疗手段在消化系统乃至神经退行性疾病方面发挥着重要作用[5-6],双歧杆菌作为缓解便秘的有效辅助治疗手段,具有良好的通便效果[7-9],且在治疗神经退行性疾病方面具有巨大的潜力。因此,益生菌在缓解泻剂结肠患者便秘的同时,有望修复泻剂结肠患者受损的肠神经,将从根本上缓解泻剂结肠。而目前的研究中,两歧双歧杆菌是缓解便秘常用的有效菌种,但其对于泻剂结肠的具体作用还未有探究。本实验通过长期服用番泻叶提取物导致的泻剂结肠小鼠模型,研究两歧双歧杆菌FGSYC45M3对泻剂结肠的缓解作用,以期为泻剂结肠治疗补充有效的益生菌诊疗方案。
1 材料与方法
1.1 试剂与仪器
番泻叶提取物,西安旭煌生物技术有限公司;枸橼酸莫沙必利胶囊,上海新黄河制药有限公司;活性炭粉、免疫荧光试剂盒,生工生物工程(上海)股份有限公司;阿拉伯树胶粉、乙酸、丙酸、丁酸,国药集团化学试剂公司;小鼠胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)ELISA试剂盒、小鼠乙酰胆碱酯酶(acetylcholinesterase,AChE)ELISA试剂盒,上海酶联生物科技有限公司;Anti-S100 beta抗体,Abcam(中国);PCR扩增引物以及合成序列,上海桑尼生物有限公司;反转录试剂盒、HiScript III RTSuperMix for qPCR试剂盒,南京诺唯赞生物科技有限公司。
PB300-N电子天平,Mettler Toledo;真空冷冻干燥机,美国LABCONCO公司;GC-MS、Milli-Q水净化系统,密理博(中国)有限公司;Multiscan Go多功能酶标仪,美国 Thermo公司;CFX Connect Real-time System实时荧光定量基因扩增仪,伯乐公司;Pannoramic MIDI数字切片扫描仪,匈牙利 3DHistech。
1.2 菌株培养活化
本实验用菌两歧双歧杆菌FGSYC45M3(Bifidobactirum bifidum)来源于江南大学生物技术中心菌种保藏库。
取-80 ℃冷冻保藏的菌液,用一次性接种环蘸取少量菌液在MRS固体培养基上划线分离,37 ℃厌氧培养48 h,挑取单菌落接种于液体MRS培养基中,37 ℃培养20 h,以2%接种量传代2次进行活化并扩大培养24 h,以转速6 000 r/min,4 ℃下离心15 min收集菌泥,无菌生理盐水洗涤2次后用10%脱脂乳重悬至6×109 CFU/mL,分装于保菌管-80 ℃冻存。
1.3 动物实验设计
7周龄的SPF级雄性C57BL/6 J小鼠24只,购于江苏集萃药康生物科技股份有限公司,动物伦理审查编号:JN.No20190330c0780620。饲养环境温度(23±2)℃,相对湿度(50±10)%,12 h光照12 h黑夜更替。小鼠随机分为4组:对照组、模型组、药物对照莫沙必利组(莫沙必利组)和两歧双歧杆菌FGSYC45M3组(FGSYC45M3),每组6只。适应饲养1周 后开始灌胃,前12周空白组每天灌胃0.2 mL无菌水,其他组灌胃0.2 mL番泻叶提取物(9 g/L), 每天浓度加倍,直至50%小鼠出现腹泻症状后保持剂量灌胃,至80%小鼠恢复正常后继续加倍灌胃,至50%小鼠腹泻,持续以上3个循环,并停药1周,造模结束(该过程时间为13周)。14周开始进行为期3周的治疗,空白组与模型组每天灌胃0.2 mL脱脂乳(100 g/L),药物对照莫沙必利组灌胃0.2 mL脱脂乳重悬的莫沙必利悬液(200 g/L),两歧双歧杆菌FGSYC45M3组灌胃0.2 mL脱脂乳(100 g/L)重悬的菌液(6×109 CFU/mL)。
1.4 实验指标测定
1.4.1 泻剂结肠小鼠肠道转运功能相关指标测定
治疗结束后第2天,每只小鼠灌胃0.2 mL墨汁,记录从灌胃开始至排出首粒黑便时间。
墨汁按照文献[10]的方法配制:将100g阿拉伯胶与800 mL水混合均匀,加热煮沸至溶液透明,再加入活性炭50 g,煮沸3次。待溶液冷却后,用水稀释定容至1 000 mL,4 ℃保存。
将每只小鼠放入垫有吸水纸的笼盒中收集粪便,称重后冻干,按照公式(1)计算粪便含水量:
粪便含水量![]()
(1)
小鼠处死采集组织前,每只小鼠灌胃0.2 mL墨汁,30 min后处死小鼠,打开腹腔,剪取胃至盲肠肠段,测量幽门至盲肠上端为 “小肠总长度”,幽门至墨汁前沿为“墨汁推进距离”,按照公式(2)计算小肠推进率:
小肠推进率![]()
(2)
1.4.2 小鼠结肠组织S100 beta免疫荧光染色
小鼠石蜡切片的制作参照文献[11]的方法,按照免疫荧光试剂盒说明书进行S100 beta荧光染色,评价结肠组织中神经胶质细胞的数量。使用Pannoramic MIDI 数字切片扫描仪扫描切片拍照,每个样品使用软件Caseview放大40倍随机截取6个视野,使用软件ImageJ统计样品的阳性表达面积。
1.4.3 小鼠结肠组织GDNF,AChE水平测定
用预冷的磷酸缓冲盐溶液冲洗结肠组织,去除附着的粪便以及残留血液,剔除周围脂肪组织,称重后剪碎,将剪碎的组织按照质量比1∶9在组织破碎仪上进行破碎,以转速6 000 r/min离心5 min,取上清液,按照说明书提供的方法进行测定,通过软件Graphpad分析结果。
1.4.4 小鼠结肠组织c-kit、AQP4、AQP8基因转录水平测定
采用qRT-PCR法测定小鼠结肠组织中相关基因转录水平。取小鼠结肠组织,按照说明书提供的Trizol法提取结肠总RNA,按照反转录试剂盒说明书将小鼠结肠总RNA反转录为cDNA。通过PrimerBank查找小鼠c-kit、AQP4、AQP8和GAPDH基因的引物序列,由上海桑尼生物科技有限公司合成引物,引物序列如表1所示。
表1 基因引物序列
Table 1 Gene primer sequence

目的基因引物序列(5'-3')c-kitF:5'- GCAGGTTGTCCAACTTATTGAGA -3'R:5'- GCAGTTTGCCAAGTTGGAGT-3'AQP4F:5'- AGTCACCACGGTTCATGGAAA -3'R:5'- CATGCTGGCTCCAGTATAATTGA-3'AQP8F:5'- ACACCAATGTGTAGTATGGACCT-3'R:5'- TGACCGATAGACATCCGATGAAG-3'GAPDHF:5'- TCCTGCACCACCAACTGCT-3'R:5'- GTCAGATCCACGACGGACACA-3'
以cDNA为模板,GAPDH基因为内参,按照iScript III RTSuperMix for qPCR试剂盒说明书进行qRT-PCR实验,通过CFX96Manager软件分析结果,Graphpad作图分析。
1.4.5 小鼠粪便中短链脂肪酸(short chain fatty acids,SCFAs)的测定
收集到的小鼠粪便冻干后参照文献[12]的方法进行浸泡、酸化,用无水乙醚萃取后使用GC-MS测定粪便中的SCFAs含量。使用软件Xcalibur分析结果。
2 结果与分析
2.1 两歧双歧杆菌FGSYC45M3提高泻剂结肠小鼠结肠转运能力并提高粪便含水量
泻剂结肠是由于患者长期服用刺激性泻药导致的肠神经系统受损,结肠传输障碍,临床表现为顽固型便秘[1]。因此我们结合首粒黑便时间和小肠推进率来反应肠道转运能力,并辅以粪便含水量表征小鼠造模情况,并评价两歧双歧杆菌FGSYC45M3的缓解效果。
小鼠首粒黑便时间反映的是整个消化道的转运时间,而小肠推进率反应的是小肠的转运能力。由图1可知,造模后小鼠小肠推进率无明显差异,而首粒黑便时间显著延长,即全肠道转运能力明显下降,可知模型组小鼠存在明显的结肠转运障碍,且粪便含水量明显下降,小鼠造模成功。灌胃FGSYC45M3进行治疗后,小鼠首粒黑便时间显著缩短,粪便含水量提高,且无论从首粒黑便时间还是粪便含水量,两歧双歧杆菌FGSYC45M3的效果均优于药物对照莫沙必利,说明FGSYC45M3治疗可以显著提高泻剂结肠小鼠的结肠转运能力,提高粪便含水量,缓解泻剂结肠。

a-首粒黑便时间;b-小肠推进率;c-粪便含水量
图1 各处理组小鼠肠道转运功能
Fig.1 Intestine transmission function of mice
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1(与模型组比较);#表示P<0.05,##表示P<0.01,###表示P<0.001,####表示P<0.000 1(与对照组比较)(下同)
2.2 两歧双歧杆菌FGSYC45M3对肠神经系统的影响
泻剂结肠与普通便秘的区别在于患者具有长期服用泻剂史或使用泻剂成瘾,导致肠神经损伤。有研究发现,泻剂结肠存在明显的肠神经系统损伤,包括肠神经元变性以及慢波起搏消失[1,13]。肠神经系统主要由肠神经元和肠神经胶质细胞组成。其中神经胶质细胞的数量是肠神经元的4倍。这些胶质细胞包绕在神经元之外,为神经元提供营养和保护,并调节神经信号传递和肠道稳态[14]。S100 beta是神经胶质细胞的特征性表达蛋白[15],可通过免疫荧光测定小鼠结肠中特征蛋白S100 beta的表达来评价泻剂结肠小鼠结肠神经胶质细胞数量。由图2可知,番泻叶提取物的长期作用导致泻剂结肠小鼠结肠组织中胶质细胞减少,说明长期的番泻叶刺激大肠致神经胶质细胞凋亡,无法支持神经系统正常功能从而影响肠道转运,两歧双歧杆菌FGSYC45M3可恢复泻剂结肠小鼠结肠中胶质细胞的数量,而药物对照莫沙必利虽有恢复胶质细胞数量的趋势,但差异并不显著。研究发现,微生物群可以驱动肠神经胶质细胞的更新,对于维持生理条件下的胃肠道功能至关重要[14],而莫沙必利是通过5-HT4受体作用缓解泻剂结肠[2],或许对于神经数量的影响并不直接,推测两歧双歧杆菌FGSYC45M3或其代谢产物能够刺激胶质细胞前体细胞的分化,重建肠神经胶质网络,从而缓解泻剂结肠。
GDNF在体内广泛分布,大量文献证明,GDNF具有神经支持和保护作用,并能促进神经元修复与再生,可以保护和修复多巴胺能神经元,有研究发现,GDNF处理可以增加肠道神经元数量并为神经元提供营养支持,提高肠道运动能力[16-17]。本研究中,泻剂结肠小鼠结肠中GDNF含量明显减少(图3),结合图2结果,我们认为长期的泻药刺激导致胶质细胞数量减少,GDNF分泌量减少导致神经受损。两歧双歧杆菌FGSYC45M3处理可显著提高泻剂结肠小鼠结肠中GDNF的含量,且作用效果与药物莫沙必利一致,考虑药物莫沙必利可以刺激产生GDNF,而两歧双歧杆菌能够增加结肠胶质细胞数量,通过胶质细胞表达的Toll样受体和G蛋白偶联受体识别肠道菌群及其产物提高GDNF分泌量,从而修复受损神经,加快神经组织更新,恢复正常的肠神经功能,从而缓解泻剂结肠。
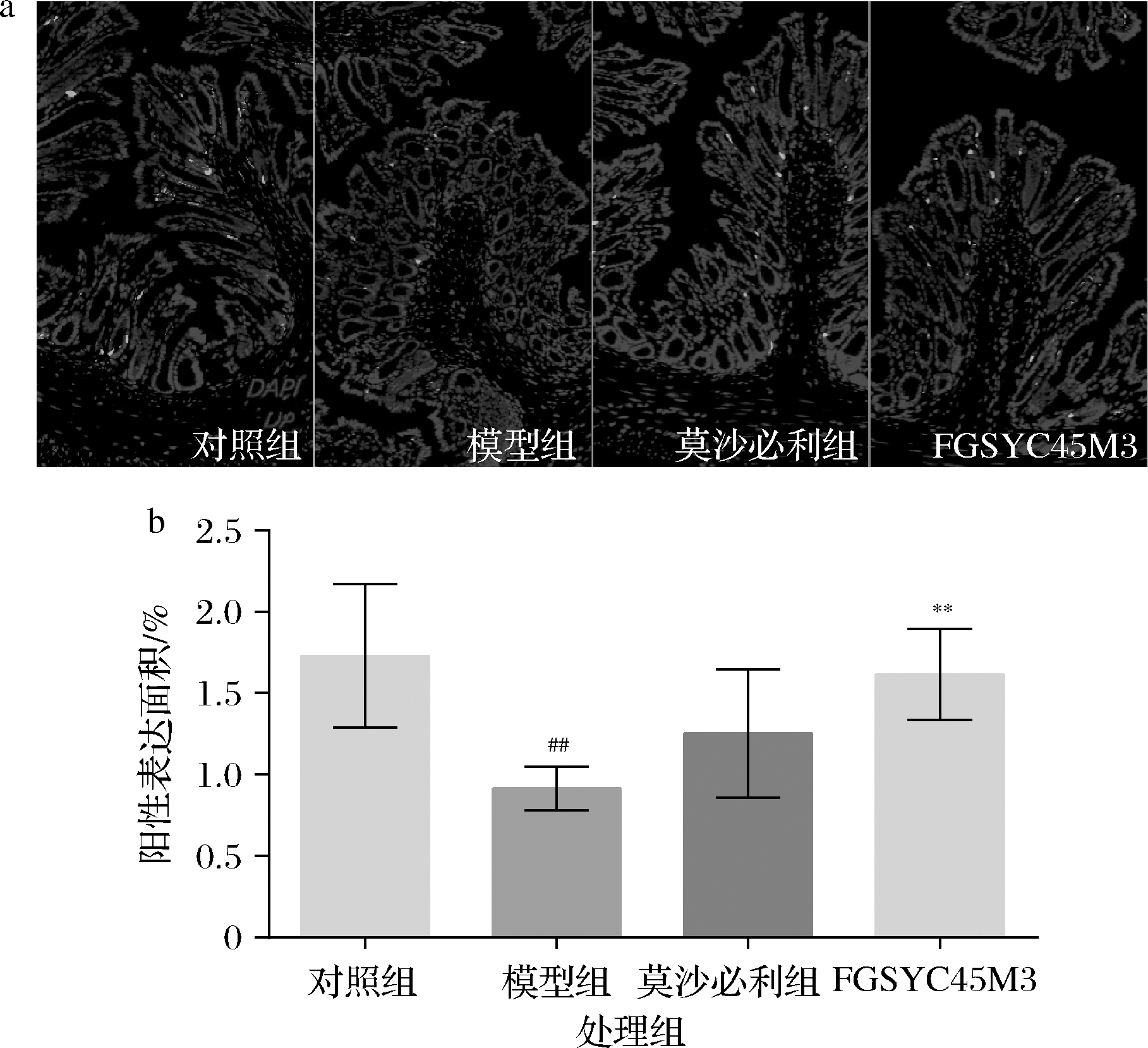
a-各组小鼠结肠免疫荧光染色;b-小鼠结肠免疫荧光阳性表达面积
图2 结肠组织中S100 beta蛋白表达量
Fig.2 Expression of the marker protein S100 beta in colon
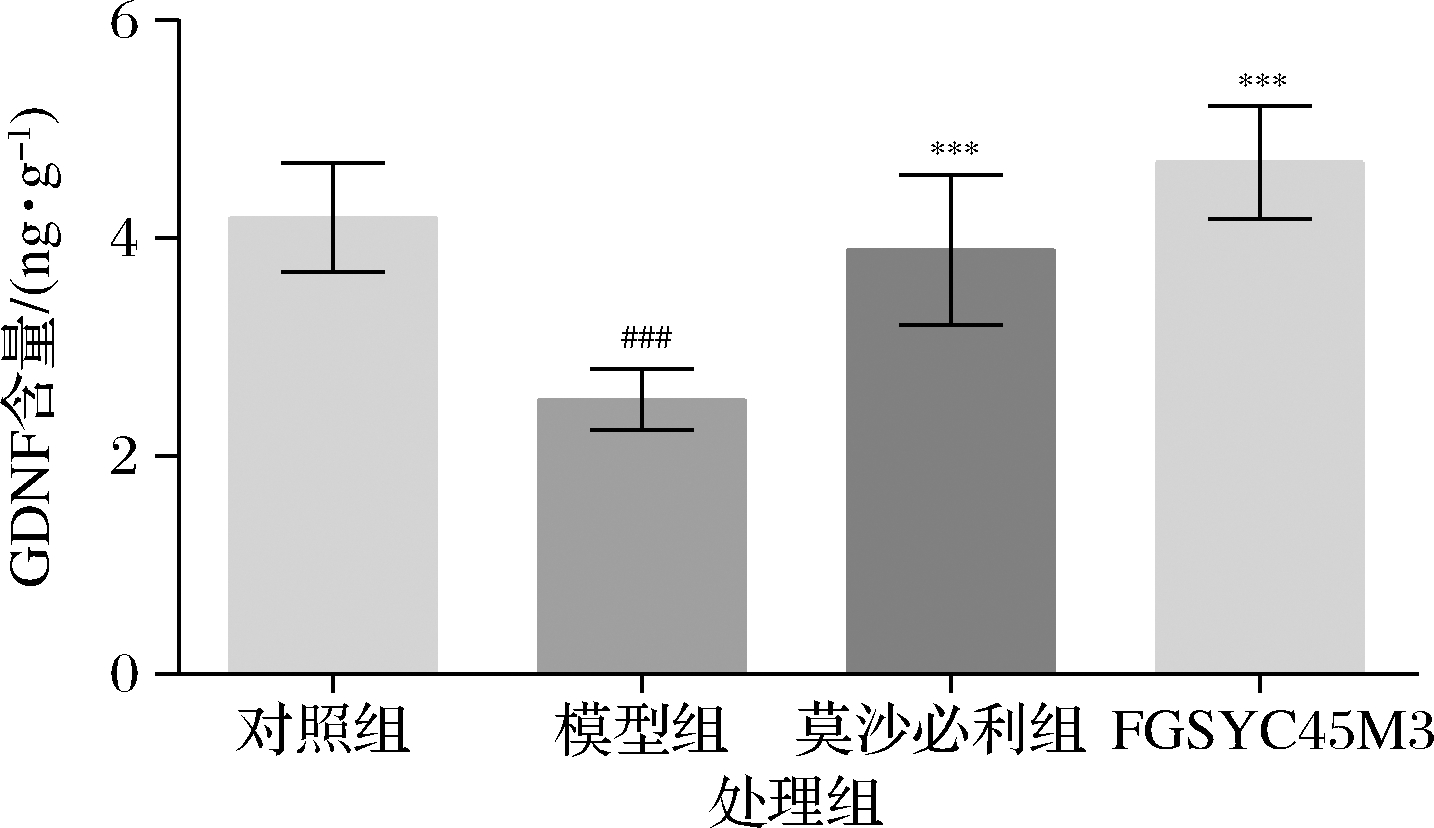
图3 小鼠结肠中GDNF含量
Fig.3 Content of GDNF in colon
AChE是由黑质多巴胺能神经元分泌的一种神经传导关键酶,参与神经信号在生物体内的正常传递,其在神经突触中降解神经递质乙酰胆碱已得到充分的研究[18],也有研究发现,AChE在肠道发育中起关键作用,能促进神经元发育和神经再生。PICKETT等[19]发现阻断AChE具有神经毒性,敲低AChE的表达导致非洲爪蟾和斑马鱼肠道发育异常,说明AChE的功能是肠道发育所必须的。SPERLING等[20]的研究发现AChE可以通过与层黏连蛋白结合促进神经突生长。在本研究中,泻剂结肠小鼠结肠中AChE含量显著减少(图4),提示黑质多巴胺能神经元分泌不足,胆碱能神经元信号传递异常,影响神经发育,两歧双歧杆菌FGSYC45M3处理恢复了AChE含量,这与前人的研究结果是一致的[21],且对于AChE的提高效果优于对照药物莫沙必利,推测FGSYC45M3或其代谢物参与某种途径影响了AChE的分泌,促进神经发育和再生,从而缓解泻剂结肠。

图4 小鼠结肠中AChE含量
Fig.4 Content of AChE in colon
Cajal间质细胞(interstitial cells of Cajal,ICC)是胃肠道运动的起搏细胞,提供促进肠道蠕动的慢波,而慢波是肠平滑肌蠕动的限速步骤,调控肠道动力,因此,对于ICC的研究仍作为评价肠道转运功能的热点[22]。c-kit受体是ICC特有的表面识别受体,通过对c-kit基因表达定量,可以反应肠道中ICC的数量。张燕等[1]的研究发现,长期使用泻剂严重影响ICC的形态数量和功能,进而影响肠道传输功能。这与我们的结论是一致的,由图5可知,泻剂结肠小鼠c-kit转录水平明显降低,说明长期的番泻叶刺激导致ICC细胞数量减少,影响肠道慢波传递,使肠道失去动力,且结合上文的神经相关指标,泻剂结肠小鼠神经信号传导存在异常,更加重了肠道转运受阻。药物莫沙必利虽有恢复趋势但效果并不显著,而灌胃FGSYC45M3可以恢复ICC数量,改善肠道转运功能,但是具体的作用途径还有待探究。
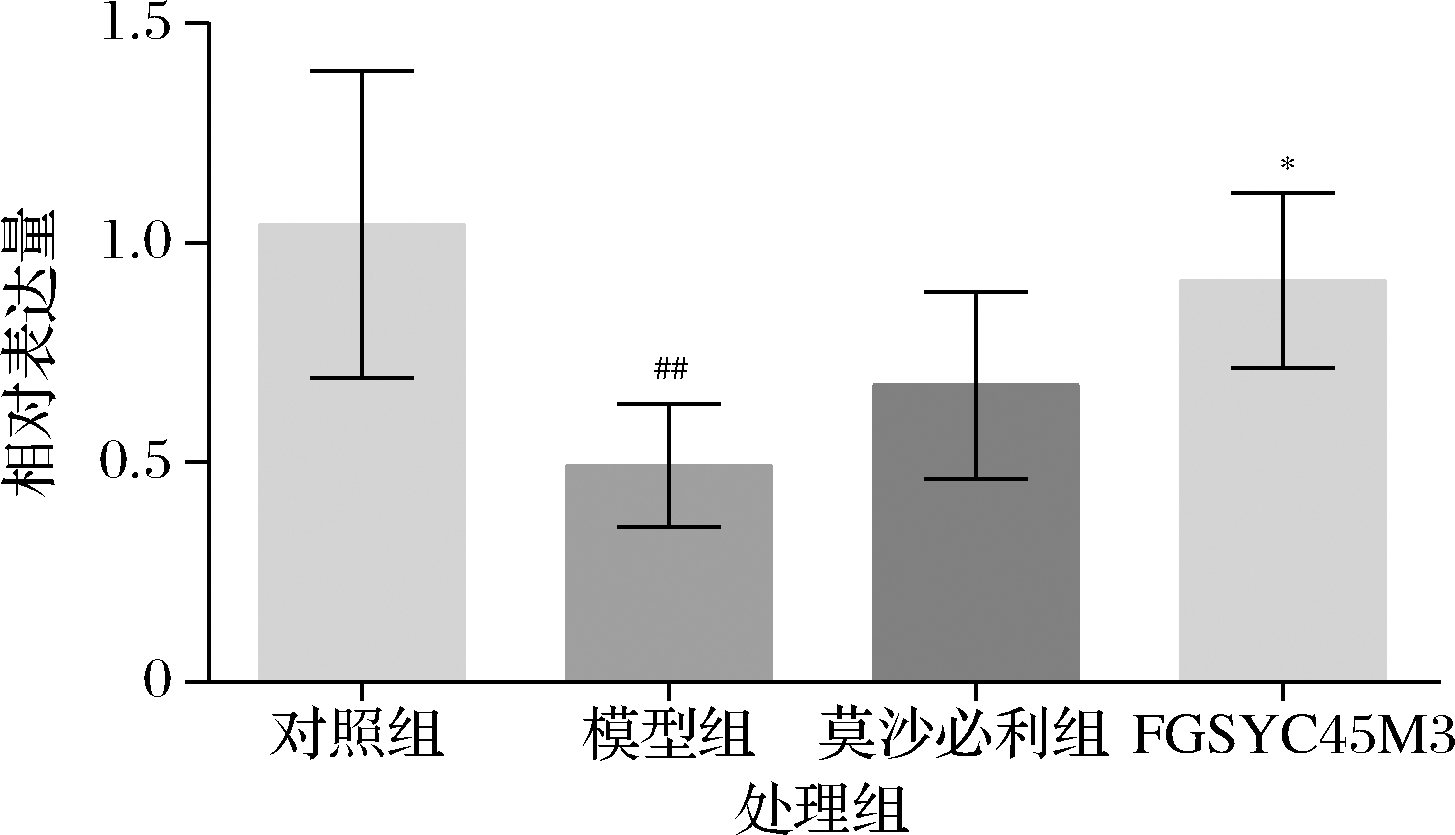
图5 小鼠结肠c-kit基因表达量
Fig.5 Relative transcription of c-kit gene in colon
2.3 两歧双歧杆菌FGSYC45M3对泻剂结肠小鼠水份吸收的影响
水通道蛋白(aquaporins,AQPs)是胃肠道中水分跨细胞运输的主要途径,参与肠道水液平衡。有研究发现,AQP4基因敲除小鼠的粪便含水量增加,而AQPs在便秘患者中高表达,使便秘患者粪便脱水干结,不易排出[23]。有学者认为,番泻苷短期刺激会下调结肠中AQPs的表达导致腹泻,而长期刺激会使AQPs表达增加[24],这可能是便秘患者对于番泻叶逐渐耐受的原因之一。由图6可知,泻剂结肠小鼠AQP4和AQP8基因转录水平均高于对照组,肠道吸水能力变强,使其粪便含水量对应变低,这也与图1我们得到的结果一致,两歧双歧杆菌FGSYC45M3处理能够降低泻剂结肠小鼠中AQP4和AQP8的表达量,虽然对于AQP8的效果不及药物莫沙必利,但是对于AQP4的作用可以达到莫沙必利的效果,且整体对于AQP4和AQP8的降低均具有显著差异,说明对于水分吸收方面,两歧双歧FGSYC45M3和莫沙必利一样可以减少结肠水分吸收,提高粪便含水量,刺激结肠蠕动,使粪便更易排除,从而缓解泻剂结肠患者的便秘症状。

a- AQP4;b- AQP8
图6 小鼠结肠AQP4基因、AQP8基因表达量
Fig.6 Relative transcription of AQP4 gene and AQP8 gene in colon
2.4 两歧双歧杆菌FGSYC45M3对粪便中SCFAs含量的影响
SCFAs是由肠道微生物组发酵中产生的,参与调节肠道屏障和免疫功能。有研究发现,粪便中乙酸、丙酸和丁酸的量与肠道转运时间显著相关,且SCFAs的水平变化是由于肠道菌群变化引起的[25-26]。
SCFAs中尤其丁酸是结肠细胞首选的能量底物,且丁酸可以恢复GDNF的量,显著增加胆碱能神经元的比例,增加结肠环形肌的收缩反应[25-26]。在本研究中,泻剂结肠小鼠粪便中SCFAs尤其是丁酸的水平下调,或许是泻剂结肠肠道动力失调的原因之一。灌胃FGSYC45M3 可以显著提高粪便中SCFAs的水平(图7),且效果明显优于药物莫沙必利。结合以上结果,考虑是FGSYC45M3的定植改变了肠道环境,使肠道菌群产SCFAs增多,从而提高肠道转能力,缓解泻剂结肠。

a-粪便中乙酸含量;b-粪便中丙酸含量;c-粪便中丁酸含量;d-粪便中总酸(乙酸+丙酸+丁酸)含量
图7 小鼠粪便中SCFAs含量
Fig.7 Contents of different short-chain fatty acids in the feces
3 结论
本研究使用的两歧双歧杆菌FGSYC45M3能够有效增加泻剂结肠小鼠肠神经胶质细胞和ICC细胞数量,提高GDNF分泌量,重建受损的肠神经;增加粪便中SCFAs的含量,增强肠道转运功能;降低泻剂结肠小鼠AQP4和AQP8基因的表达,提高粪便含水量,且让人惊喜的是,该菌的综合作用效果优于药物莫沙必利,能在缓解泻剂结肠便秘的基础上,重建肠神经功能。基于本研究结果,两歧双歧FGSYC45M3可以更好的应用于临床,治疗由于长期服用番泻叶导致的泻剂结肠。
[1] 张燕, 李红岩.泻剂引起结肠壁形态学改变的临床意义[J].中国临床解剖学杂志, 2004, 22(4):405-407;416.
ZHANG Y, LI H Y.The clinical significance of rhubarb causing the morphological changes in colon wall[J].Chinese Journal of Clinical Anatomy,2004,22(4):405-407;416.
[2] 徐毅, 王诗怡, 范一宏, 等.枳实水提物对大鼠泻剂结肠肠壁神经丛的影响及机制研究[J].中华中医药杂志, 2017, 32(2):761-766.
XU Y,WANG S Y,FAN Y H, et al.Effects and mechanism of aqueous extracts of Fructus Aurantii Immaturus (FAI) on intestinal plexus in cathartic colon of rats[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(2):761-766.
[3] JOO J S, EHRENPREIS E D, GONZALEZ L, et al.Alterations in colonic anatomy induced by chronic stimulant laxatives:The cathartic colon revisited [J].Journal of Clinical Gastroenterology, 1998, 26(4):283-286.
[4] 蓝海波,魏雨,甘华田, 等.《2017版便秘的分度与临床策略专家共识》解读[J].结直肠肛门外科,2020,26(3):257-259.
LAN H B, WEI Y, GAN H T, et al.Interpretation of 2017 edition expert consensus of severity and treatment strategy for constipation[J].Journal of Colorectal & Anal Surgery, 2020,26(3):257-259.
[5] NIESLER B, KUERTEN S, DEMIR I E, et al.Disorders of the enteric nervous system-A holistic view [J].Nature Reviews Gastroenterology & Hepatology, 2021,18(6):393-410.
[6] HEISS C N, OLOFSSON L E.The role of the gut microbiota in development, function and disorders of the central nervous system and the enteric nervous system [J].Journal of Neuroendocrinology, 2019, 31(5):e12684.
[7] WANG L L, CHEN C L, CUI S M, et al.Adhesive bifidobacterium induced changes in cecal microbiome alleviated constipation in mice [J].Frontiers in Microbiology, 2019, 10:1 721.
[8] WANG L L, HU L, XU Q, et al.Bifidobacterium adolescentis exerts strain-specific effects on constipation induced by loperamide in BALB/c Mice [J].International Journal of Molecular Sciences, 2017, 18(2):318.
[9] IBARRA A, LATREILLE-BARBIER M, DONAZZOLO Y, et al.Effects of 28-day Bifidobacterium animalis subsp. lactis HN019 supplementation on colonic transit time and gastrointestinal symptoms in adults with functional constipation:A double-blind, randomized, placebo-controlled, and dose-ranging trial [J].Gut Microbes, 2018, 9(3):236-251.
[10] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究[D].无锡:江南大学, 2017.
WANG L L, Study of the effects and mechanisms of bifidobacteria on constipation alleviation[D].Wuxi:Jiangnan University,2017.
[11] 王俊通. 产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用 [D].无锡:江南大学, 2016.
WANG J T, Ameliorating effects of CLA-producing lactic acid bacteria on DSS-induced colitis in mice [D].Wuxi:Jiangnan University,2016.
[12] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制 [D].无锡:江南大学, 2015.
MAO B Y, Effects of functional oligosaccharides on the gut bacteria and the mechanism [D].Wuxi:Jiangnan University,2015.
[13] BASSOTTI G, VILLANACCI V, MAURER C A, et al.The role of glial cells and apoptosis of enteric neurones in the neuropathology of intractable slow transit constipation [J].Gut, 2006, 55(1):41-46.
[14] KABOURIDIS P S, LASRADO R, MCCALLUM S, et al.Microbiota controls the homeostasis of glial cells in the gut lamina propria [J].Neuron, 2015, 85(2):289-295.
[15] VERGNOLLE N, CIRILLO C.Neurons and glia in the rnteric nervous system and epithelial barrier function [J].Physiology, 2018, 33(4):269-280.
[16] MAHATO A K, KOPRA J, RENKO J M, et al.Glial cell line-derived neurotrophic factor receptor rearranged during transfection agonist supports dopamine neurons in vitro and enhances dopamine release in vivo [J].Movement Disorders, 2020, 35(2):245-255.
[17] WANG H, HUGHES I, PLANER W, et al.The timing and location of glial cell line-derived neurotrophic factor expression determine enteric nervous system structure and function [J].Journal of Neuroscience, 2010, 30(4):1 523-1 538.
[18] 陈颖颖. 抑制乙酰胆碱酯酶对视网膜炎症保护作用及机制的研究 [D].南昌:南昌大学, 2016.
CHEN Y Y.Protective effect and mechanism of inhibiting acetylcholinesterase on retinal inflammation [D].Nanchang:Nanchang University,2016
[19] PICKETT M A, DUSH M K, NASCONE-YODER N M.Acetylcholinesterase plays a non-neuronal, non-esterase role in organogenesis [J].Development, 2017, 144(15):2 764-2 770.
[20] SPERLING L E, KLACZINSKI J, SCHÜETZ C, et al.Mouse acetylcholinesterase enhances neurite outgrowth of rat R28 cells through interaction with laminin-1 [J].PloS One, 2012, 7(5):e36683.
[21] 王琳琳, 王刚, 张灏, 等.具粘附特性的动物双歧杆菌对便秘模型小鼠血清中胃肠调节肽水平的影响 [J].中国食品学报, 2019, 19(6):13-20.
WANG L L,WANG G,ZHANG H, et al.The effect of bifidobacterium animalis with adhesive properties on the levels of gastrointestinal peptide neurotransmitter in serum of mice with constipation [J].Journal of Chinese Institute of Food Science and Technology,2019,19(6):13-20.
[22] 陈绪勇. 巨噬细胞活化对先天性巨结肠Cajal间质细胞及肠道电活动的影响 [D].武汉:华中科技大学, 2017.
CHEN X Y.The effects of macrophage activation on phenotype change of ICCs and colon electrical activity in hirschsprung′s disease [D].Wuhan:Huazhong University of Science and Technology,2017.
[23] IKARASHI N, KON R, SUGIYAMA K.Aquaporins in the colon as a new therapeutic target in diarrhea and constipation [J].International Journal of Molecular Sciences, 2016, 17(7):1 172.
[24] CAO Y X, HE Y, WEI C, et al.Aquaporins alteration profiles revealed different actions of senna, sennosides, and sennoside a in diarrhea-rats [J].International Journal of Molecular Sciences, 2018, 19(10):3 210.
[25] BARICHELLO T, GENEROSO J S, SIM ES L R, et al.Sodium butyrate prevents memory impairment by re-establishing BDNF and GDNF expression in experimental pneumococcal meningitis [J].Molecular Neurobiology, 2015, 52(1):734-740.
ES L R, et al.Sodium butyrate prevents memory impairment by re-establishing BDNF and GDNF expression in experimental pneumococcal meningitis [J].Molecular Neurobiology, 2015, 52(1):734-740.
[26] SUPLY E, DE VRIES P, SORET R, et al.Butyrate enemas enhance both cholinergic and nitrergic phenotype of myenteric neurons and neuromuscular transmission in newborn rat colon [J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2012, 302(12):1 373-1 380.