葡萄酒酿造是以酿酒酵母(Saccharomyces cerevisiae)主导的一系列复杂的微生物代谢和生物转化过程,其细胞活力对发酵酒样中代谢产物的形成具有重要影响[1]。S.cerevisiae生命周期较短,快速衰老会导致发酵不彻底,挥发性化合物的合成和分泌能力大大降低,从而严重影响葡萄酒的香气与感官品质[2]。氧化应激是导致细胞损伤、衰老和死亡的主要原因之一[3]。S.cerevisiae具有一定的氧化应激反应能力,可以通过多种途径保护自身免受各种胁迫,如通过抗氧化酶的水平,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等来体现其对氧化应激的适应性反应;也可以通过产生谷胱甘肽(glutathione,GSH)等非酶类自由基清除剂,保护细胞不被氧化[4-5]。甘露聚糖及其衍生物在体外可以高效清除多种自由基,其中清除超氧阴离子自由基的能力接近维生素C,具有良好的抗氧化活性[6]。RODRIGUEZ-NOGALES等[7]通过添加甘露聚糖和商业酵母制剂,增加了起泡葡萄酒的抗氧化性能。同时,外源性添加甘露聚糖对葡萄酒香气复杂性和风格独特性也具有积极影响。COMUZZO等[8]研究表明,添加低质量浓度的甘露聚糖可以增加葡萄酒中酯类物质含量,而较高质量浓度(500 mg/L)会增加羧酸含量,带给葡萄酒不愉快的气味。李惠琳等[9]比较了4种酵母多糖对霞多丽干白葡萄香气的影响,结果显示甘露聚糖可增加葡萄酒香气的浓郁度和复杂性。总体而言,目前关于酵母甘露聚糖对葡萄酒香气品质提升方面的研究较多,但关于甘露聚糖如何通过影响S.cerevisiae生长及抗氧化性,从而改变酒体香气合成释放的内在机制研究鲜有报道。
本研究以模拟葡萄汁为原料,考察外源性添加甘露聚糖对S.cerevisiae菌株生长及细胞完整性的影响,初步探讨酒精发酵过程中S.cerevisiae菌株抗氧化活性的动态变化规律,以期为进一步研究甘露聚糖对葡萄酒发酵香气的调控机制提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母Aroma White,意大利Enartis公司;甘露聚糖MP 60,安琪酵母股份有限公司。
ATP酶、SOD活性测定试剂盒、活性氧(reactive oxygen species, ROS)、GSH、丙二醛(malondialdehyde, MDA)检测试剂盒,南京建成生物工程研究所;纤维二糖、磷酸氢二铵、酒石酸氢钾、柠檬酸、磷酸氢二钾等试剂均为分析纯,天津光复化工研究所。
1.2 仪器与设备
SCIENTZ-ⅡD超声破碎机,宁波新芝生物科技有限公司;H2050R高速冷冻能够离心机,湘仪离心机仪器有限公司;Genesis 10s紫外-可见分光光度计,美国Thermo Scientific公司;日立F-4700荧光分光光度计,日立高新技术公司;Bluepard生化培养箱,上海一恒科学仪器有限公司;DK-S12电热恒温水浴锅,上海森信试验仪器有限公司。
1.3 实验方法
1.3.1 模拟葡萄汁的配制
参考祝霞等[10]的方法。葡萄糖200 g/L、纤维二糖0.2 g/L、磷酸氢二铵1.5 g/L、酒石酸氢钾2.5 g/L、L-苹果酸3.0 g/L、柠檬酸0.2 g/L、磷酸氢二钾1.14 g/L、 硫酸镁1.23 g/L。
1.3.2 甘露聚糖对酿酒酵母菌株生物量和活力的影响
在2 L的模拟葡萄汁(2.5 L棕色罐)中,分别添加100、200、300、400、500 mg/L的甘露聚糖(编号分别为MP1~MP5),以不添加酵母多糖为对照(CK)。按照推荐用量0.2 g/L接种Aroma White,25 ℃ 控温发酵,每隔24 h测定模拟汁中酵母细胞的生物量(OD600),绘制菌株生长曲线。每个样品设置3组平行,结果取平均值。下同。
在模拟葡萄汁中分别添加100、200、300、400、500 mg/L(MP1~MP5)的甘露聚糖,以不添加酵母多糖为对照(CK),25 ℃控温发酵。根据前期预实验结果,自接种开始2、4、7 d分别对应菌株生长的前、中、后期,参照文献[11]酵母活力测定方法,检测3个生长时期酵母菌株活力,分析甘露聚糖对S.cerevisiae细胞活力的影响。
1.3.3 酵母细胞抗氧化活性测定
1.3.3.1 酵母细胞中ATP酶活性测定
参照符安[12]的方法并做修改,收集酵母细胞,3 500 r/min 离心10 min,倾倒上清液,用5 mL生理盐水(0.9%)洗涤3次后称重,加入生理盐水,冰水浴超声破碎(4 ℃,40%功率,开启5 s,停止7 s,共计1 min), 制成0.063 g/mL的匀浆,按照试剂盒说明书进行测定。
1.3.3.2 酵母细胞中SOD活性测定
收集酵母细胞,用20倍体积的PBS,1 000 r/min离心10 min洗涤酵母细胞。重复2次后,再加入20倍 体积的生理盐水以3 500 r/min离心10 min,冰水浴条件下超声破碎,制成10%的细胞匀浆,再将匀浆稀释5倍,按照试剂盒说明书进行测定。
1.3.3.3 酵母细胞中ROS含量测定
取模拟汁,离心10 min收集细胞,用PBS洗涤2次,再用PBS重悬,按照试剂盒说明书加入荧光探针(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA),在最佳波长500 nm,最佳发射波长525 nm处进行荧光检测。
1.3.3.4 酵母细胞中MDA含量测定
参照1.3.3.2的方法制成10%的组织匀浆,再将匀浆稀释5倍,按照试剂盒说明书进行测定。
1.3.3.5 酵母细胞及模拟汁中GSH含量测定
取模拟汁发酵液10 mL,3 500 r/min离心10 min,取上清液,按照试剂盒说明书测定GSH含量。按照1.3.3.2 的方法,制成10%的组织匀浆,进行酵母细胞中GSH含量测定。
1.4 数据分析
使用Microsoft Excel 2007对试验所得数据进行整理,使用IBM SPSS Statistics 19.0进行多重比较(Duncan法,P<0.05),用平均值±标准偏差来表示实验结果。
2 结果与分析
2.1 甘露聚糖对酿酒酵母菌株生物量和活力的影响
由图1可知,与对照相比,甘露聚糖有效延长了酒精发酵过程中S.cerevisiae菌株的对数生长期和稳定期。随着甘露聚糖浓度的增加,S.cerevisiae菌株生长越快,当质量浓度大于300 mg/L时,促进作用较MP3处理组降低。
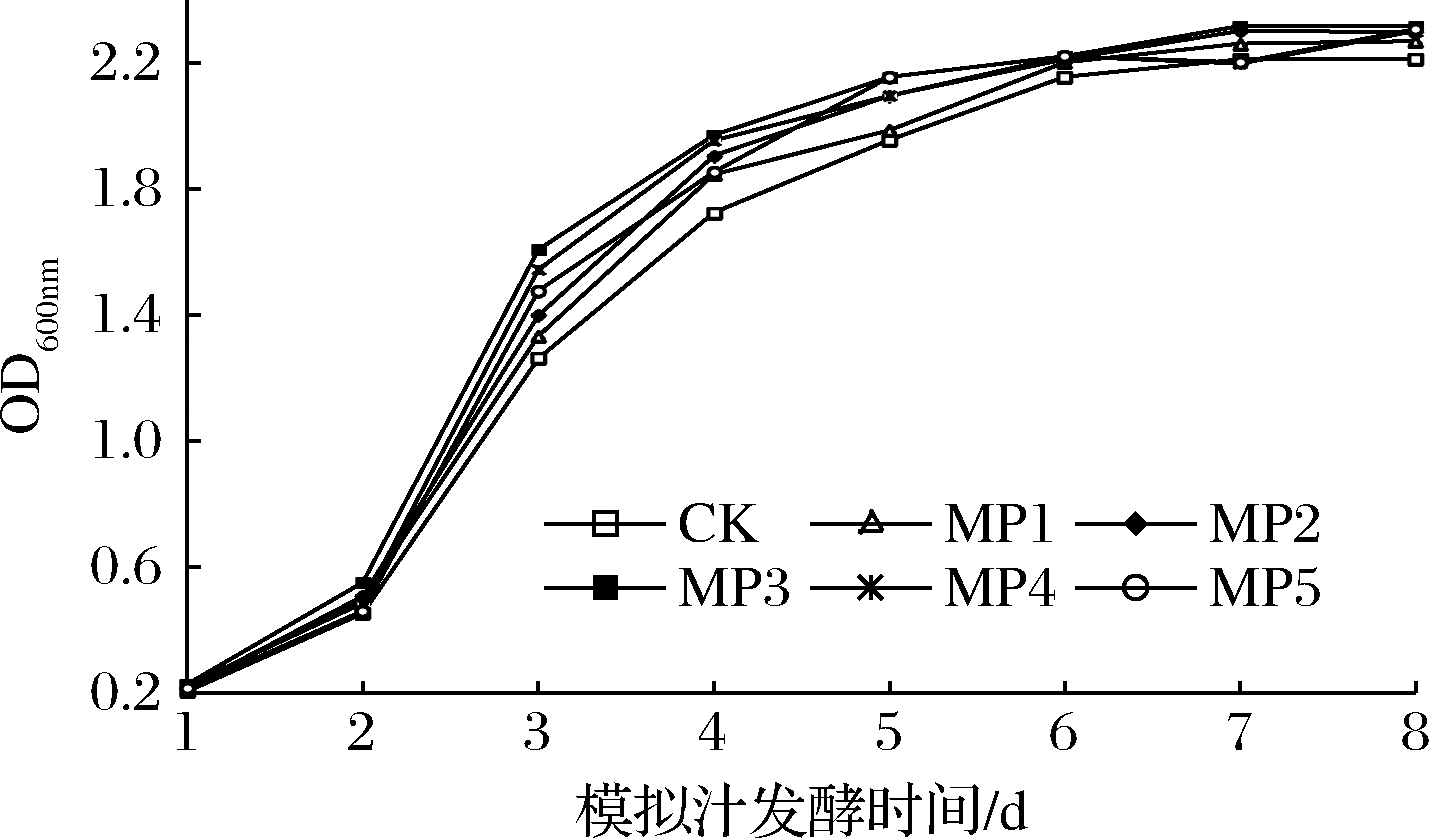
图1 甘露聚糖对酿酒酵母菌株生物量的影响
Fig.1 Effects of mannan on the biomass of S.cerevisiae strains
由图2可知,MP3处理组比对照组显著增加了酵母活力(P<0.05),尤其使酒精发酵前期和中期的葡萄糖诱发质子流(glucose induced proton electric,GIPE)值增加了8.2%和10.1%;MP1和MP2处理组,对不同酒精发酵时期酵母菌株活力无显著差异(P>0.05);MP4和MP5处理组,在酒精发酵初期反而降低了酵母活力,故选择200、300、400 mg/L的添加量测定S.cerevisiae细胞通透率及抗氧化指标。

图2 甘露聚糖对酿酒酵母菌株活力的影响
Fig.2 Effects of mannan on the viability of S.cerevisiae strains
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2 甘露聚糖对酿酒酵母细胞中ATP酶活性的影响
ATP又称能量货币,是细胞内能量的主要载体。而ATP酶是真核细胞在有氧条件下产生细胞ATP的重要酶,存在于组织细胞膜上,在物质运送、能量转换及信息传递方面具有重要作用[13]。由图3所示,随着酒精发酵的进行,酵母细胞中ATP酶活性呈下降趋势,是由于酒精发酵过程中产生酒精、有机酸等物质使酵母的生存环境逐渐恶劣,细胞活力逐渐下降。与对照相比,甘露聚糖的添加显著增加了酒精发酵不同时期酵母细胞中ATP酶的活性。在酒精发酵第3天时ATP酶活性由高到低分别为MP3(21.35 U/mg)>MP2(18.81 U/mg)>MP4(17.07 U/mg)>CK(15.35 U/mg),MP3处理组较对照组增加了39.1%(P<0.05)。综上所述,在酒精发酵前添加甘露聚糖有利于提高酵母细胞中ATP酶的活性,尤其是在酒精发酵中期,增加了酵母细胞的抗逆性反应。
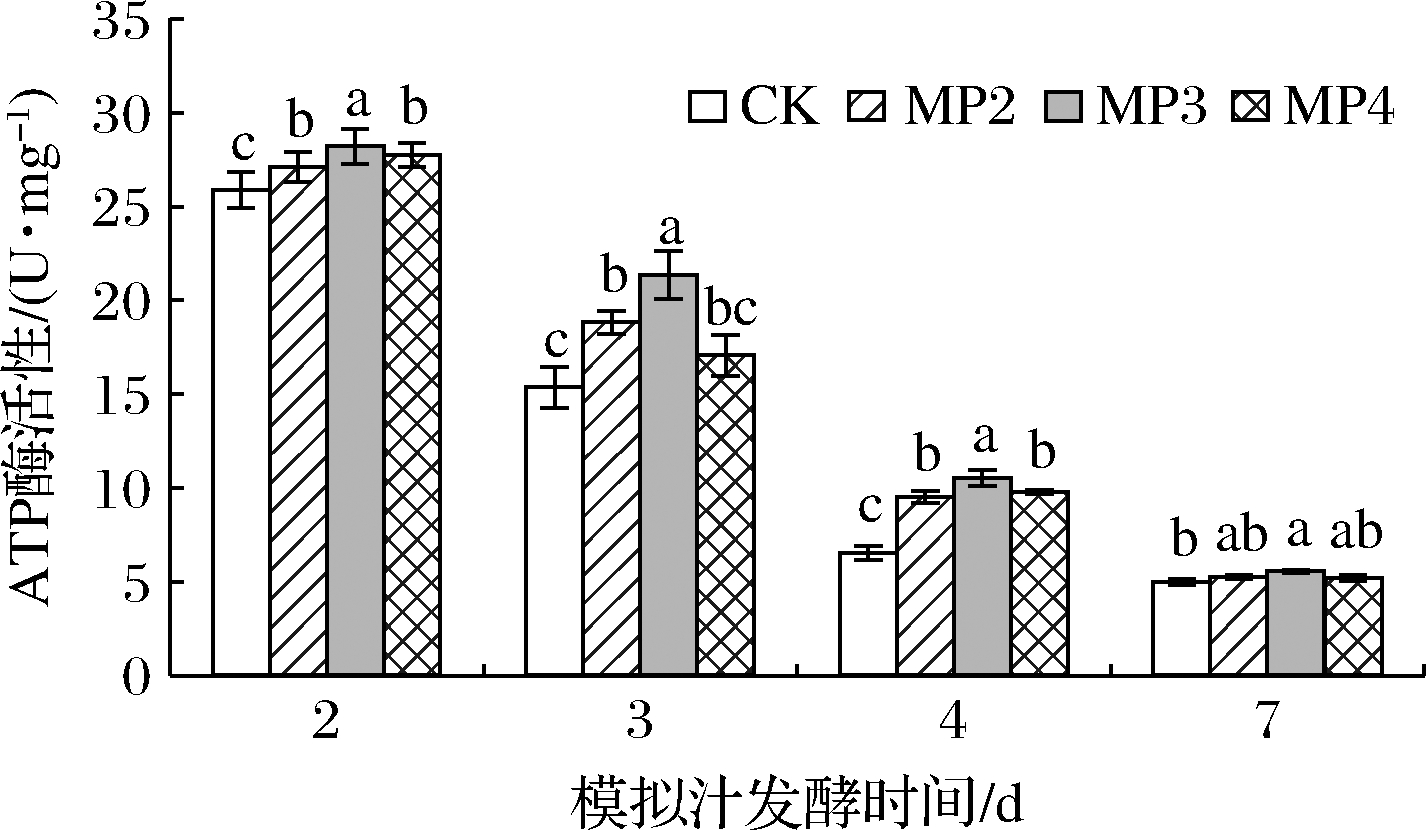
图3 甘露聚糖对酿酒酵母细胞中ATP酶活性的影响
Fig.3 Effects of mannan on ATPase activity in S.cerevisiae strain cells
2.3 甘露聚糖对酿酒酵母细胞中SOD活性的影响
酵母可以通过多种途径保护自身免受各种胁迫(包括氧化应激),清除H2O2、超氧阴离子自由基等[3],如通过抗氧化酶,包括SOD、CAT、GSH-Px等的水平来体现对氧化应激的适应性反应;也可以通过产生GSH清除溶液中的氧化剂,从而提高细胞的抗氧化水平。图4为酒精发酵前添加不同浓度的甘露聚糖对酵母细胞中SOD活性的影响。由图4可知,随着酒精发酵的进行,酵母细胞中SOD活性呈下降趋势。在酒精发酵不同时期对照组与处理组SOD的活性均无显著性差异(P>0.05),可见甘露聚糖的添加并未对S.cerevisiae细胞中SOD活性产生影响。
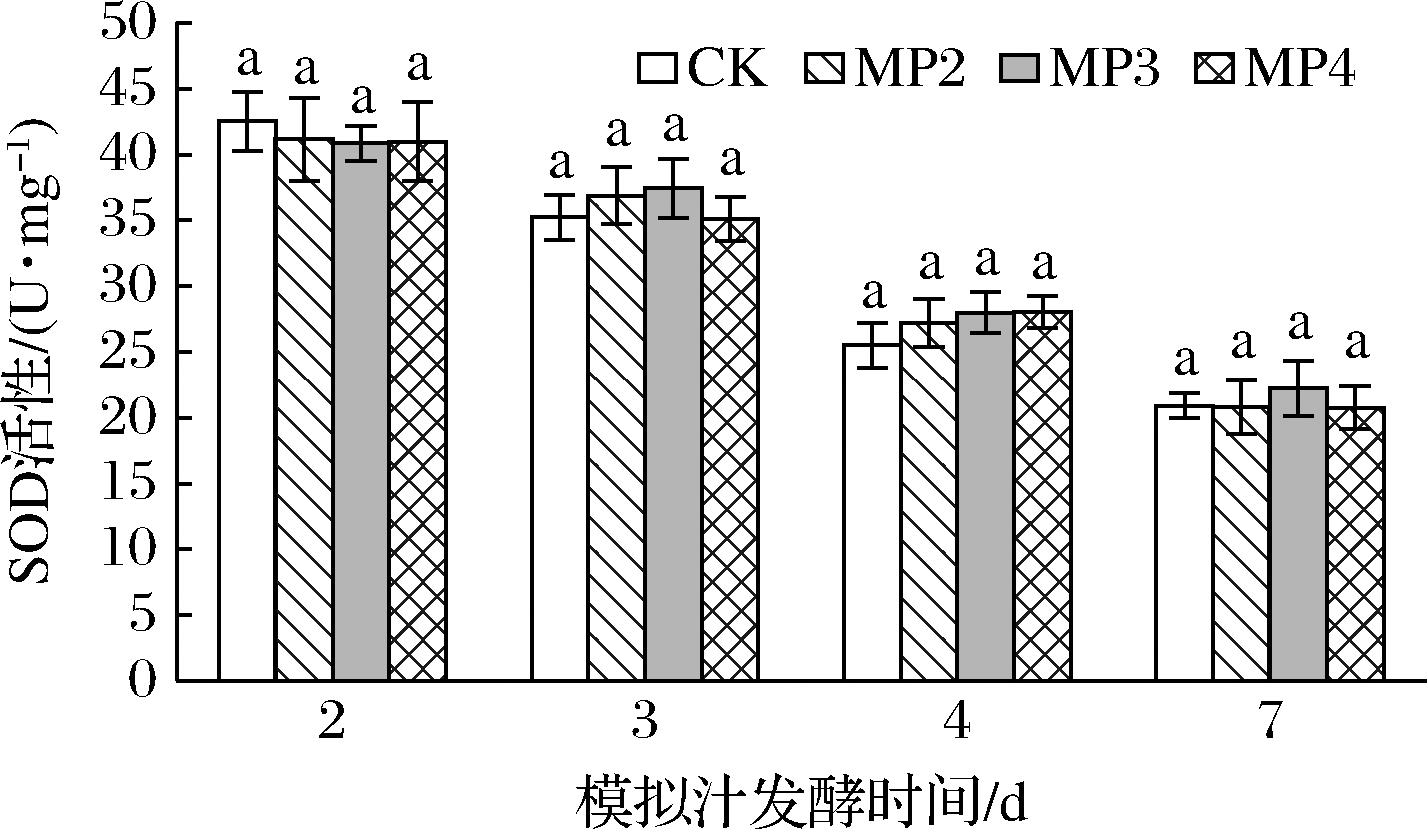
图4 甘露聚糖对酿酒酵母细胞中SOD活力的影响
Fig.4 Effects of mannan on SOD activity in S.cerevisiae strain cells
2.4 甘露聚糖对酿酒酵母细胞中活性氧的影响
少量ROS是酵母菌株正常生理代谢所必需的[14-16]。但酵母细胞内ROS过量积累会导致细胞损伤甚至死亡[17-19]。由图5可知,在酒精发酵过程中,酵母细胞中的ROS先上升,随着酒精发酵末期酵母的死亡而快速降低,在酒精发酵进行的第2、3、4天中处理组都显著低于对照组。在酒精发酵第4天,MP3处理组中ROS含量较对照组显著降低了27.5%; 酒精发酵末期处理组与对照组无显著差异。综上所述,甘露聚糖有利于降低酒精发酵前期和中期S.cerevisiae细胞中的ROS含量,且MP3处理组酵母细胞ROS含量最低,有利于降低酵母细胞结构的损伤,提高S.cerevisiae菌株抗逆性。

图5 甘露聚糖对酿酒酵母细胞中ROS的影响
Fig.5 Effects of mannan on ROS in S.cerevisiae strain cells
2.5 甘露聚糖对酿酒酵母细胞中丙二醛含量的影响
MDA是ROS作用于脂质发生过氧化反应的终产物之一,通常将其作为膜脂过氧化作用强弱的一个重要标志[20]。由图6可知,在酒精发酵过程中,S.cerevisiae细胞中MDA逐渐积累,且在酒精发酵第4天后,MDA含量大幅增加。在酒精发酵前期处理组与对照组不存在显著差异,是因为在对数增长期酵母发酵活力良好。酒精发酵第4天时,MDA含量为MP2(7.05 mg/g)

图6 甘露聚糖对酿酒酵母细胞中MDA含量的影响
Fig.6 Effects of mannan on MDA content in S.cerevisiae strain cells
2.6 甘露聚糖对酿酒酵母细胞和模拟汁谷胱甘肽含量的影响
在生物体内起重要生理作用的是GSH,它与氧化型谷胱甘肽一起维持和调节细胞的氧化还原状态[21-22]。它是一种内源性抗氧化物质,在葡萄酒酒精发酵期间,能够有效防止葡萄酒中酚类物质的氧化,保护葡萄酒的芳香物质和色泽[23]。由图7可知,酵母细胞中GSH含量在酒精发酵前期到中期呈上升趋势,而在酒精发酵中期到后期呈下降趋势,可能是由于酒精发酵初期酵母生存环境较好,未激发细胞的抗逆性反应。在酒精发酵初期,处理组酵母细胞中GSH含量与对照组不存在显著性差异,而在酒精发酵的中期和后期GSH含量明显增加。酒精发酵第3天时MP3处理组GSH含量最高,达到99.33 mg/g,较对照组增加了21.9%。第4天时细胞中GSH含量为MP3>MP2>MP4>CK,MP3处理组为62.26 mg/g,与对照组相比显著增加了24.2%;酒精发酵末期,MP3、MP2和MP4处理组酵母细胞中GSH含量较对照组增加了70.1%、51.9%和31.9%。由图8可知,与对照组相比,处理组模拟汁中GSH含量在酒精发酵的不同时期均高于对照组,但均未达到显著性差异。综上所述,在酒精发酵前添加甘露聚糖可显著促进酵母细胞中GSH的合成,而对胞外GSH的分泌影响较小。因此,添加酵母多糖可增加酵母菌株的抗氧化能力,且添加质量浓度为300 mg/L时效果最佳。

图7 甘露聚糖对酿酒酵母细胞中GSH含量的影响
Fig.7 Effect of mannan on GSH content in S.cerevisiae cells
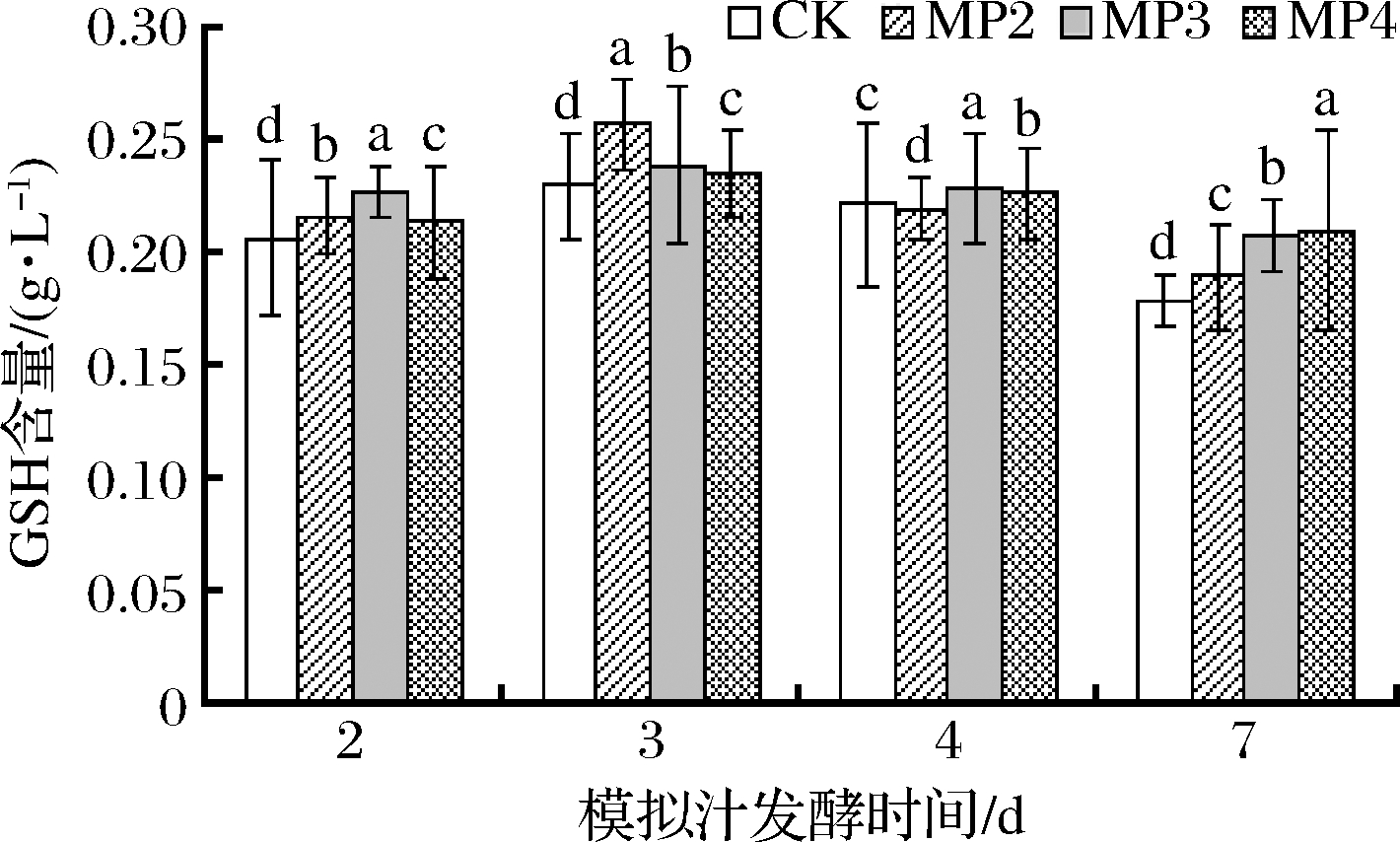
图8 甘露聚糖对模拟汁中GSH含量的影响
Fig.8 Effect of mannan on GSH content of simulated fermentations
3 讨论
卢新军等[23]指出,在酒精发酵过程中添加酵母细胞壁提取物可促进S.cerevisiae的生长繁殖,减轻乙醇对酵母的抑制甚至毒害作用,促进酵母的生理活性及生长代谢。ALSTEENS等[24]研究表明酵母细胞壁提取物可以通过提供不饱和脂肪酸和甾醇等营养物质促进葡萄汁和麦芽汁的快速完全发酵。 NGELES等[25]研究表明酵母提取物中的主要活性成分是甘露聚糖,它可通过清除有毒的发酵产物,如中链脂肪酸或赭曲霉毒素A等,减少这些物质对酵母菌株的抑制作用,增加酵母菌株活力。郭守东[26]也在相关的研究结果中得出类似的结论。LUBBERS等[27]指出中链脂肪酸可以穿过酵母细胞质膜,使细胞质中ROS积累,导致酵母细胞结构受损,发酵活力降低。本研究结果表明,甘露聚糖可缩短S.cerevisiae菌株生长的迟滞期,有利于酵母菌株的快速适应和生长繁殖,对细胞活力具有显著的提升作用(P<0.05)。
NGELES等[25]研究表明酵母提取物中的主要活性成分是甘露聚糖,它可通过清除有毒的发酵产物,如中链脂肪酸或赭曲霉毒素A等,减少这些物质对酵母菌株的抑制作用,增加酵母菌株活力。郭守东[26]也在相关的研究结果中得出类似的结论。LUBBERS等[27]指出中链脂肪酸可以穿过酵母细胞质膜,使细胞质中ROS积累,导致酵母细胞结构受损,发酵活力降低。本研究结果表明,甘露聚糖可缩短S.cerevisiae菌株生长的迟滞期,有利于酵母菌株的快速适应和生长繁殖,对细胞活力具有显著的提升作用(P<0.05)。
S.cerevisiae菌株在酒精发酵过程中会产生的乙醇、毒素等物质能抑制酵母菌株的代谢,使酵母细胞中ROS积累,从而破坏S.cerevisiae细胞结构的完整性,导致其代谢活力下降[28]。本实验研究发现在酒精发酵前添加甘露聚糖,使酵母细胞中ATP酶活性显著增加,ROS和MDA含量降低,GSH含量增加,且添加量为300 mg/L效果最好。SIES[29]指出,细胞自身防御氧化的途径主要有2条,其中酶系防御体系主要通过抗氧化物酶清除自由基,如SOD、CAT等,而非酶系防御体系主要是通过产生GSH和金属硫蛋白等还原性物质与自由基发生氧化还原反应来清除自由基,进而保护细胞不被氧化。结合本实验中甘露聚糖能促进细胞中GSH的合成,表明甘露聚糖可能是通过非酶系防御体系途径来提高S.cerevisiae细胞抗氧化性。有研究发现胶红酵母粗多糖纯化后各组分对羟自由基和超氧阴离子自由基具有很强的清除能力,且效果高于维生素C[30]。研究还发现甘露聚糖可以清除ABTS阳离子自由基、羟自由基、DPPH自由基、超氧阴离子自由基和螯合Fe2+[8]。以上研究都是从清除自由基的基础上研究多糖的抗氧化性,本实验证实了甘露聚糖可通过增加ATP酶活性和GSH含量,并清除ROS和MDA含量来提高抗氧化性,提高S.cerevisiae的细胞活力。
4 结论
本实验以模拟葡萄汁为原料,研究甘露聚糖对S.cerevisiae菌株生长及抗氧化活性的影响。结果表明,甘露聚糖在S.cerevisiae菌株酒精发酵的全过程中均对酵母细胞活力具有显著的提升作用(P<0.05); 外源添加300 mg/L甘露聚糖的处理组中酵母细胞的ATP酶显著高于对照组(P<0.05),而SOD活性不存在显著差异(P>0.05);在酵母菌株生长中后期,外源添加甘露聚糖的处理组中ROS、MDA含量显著低于对照组(P<0.05),并且酵母细胞内的GSH含量显著高于对照组(P<0.05),即添加甘露聚糖可通过促进酵母细胞中GSH的合成来清除细胞内过量的ROS、MDA,提高酵母细胞的抗氧化能力,并且质量浓度为300 mg/L时抗氧化能力最强。
[1] 战吉宬, 曹梦竹, 游义琳, 等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学, 2020, 53(19):4 057-4 069.
ZHAN J C, CAO M Z, YOU Y L, et al.Research advance on the application of non-Saccharomyces in winemaking[J].Scientia Agricultura Sinica, 2020, 53(19):4 057-4 069.
[2] CAPECE A, PTRAFESA R, SIESTO G, et al.Selected indigenous Saccharomyces cerevisiae strains as profitable strategy to preserve typical traits of Primitivo wine[J].Fermentation, 2019, 5(4):87.
[3] 陈伟平, 杨琼洁, 卫星. 蚕蛹油对D-半乳糖模型小鼠学习记忆及氧化应激的影响[J]. 浙江大学学报(医学版), 2013, 42(6):620-624;631.
CHEN W P, YANG Q J, WEI X. Effects of chrysalis oil on learning, memory and oxidative stress in D-galactose-induced ageing model of mice[J]. Journal of Zhejiang University (Medical Sciences), 2013, 42(6):620-624;631.
[4] 王义华, 徐梅珍, 江萍, 等.二种酵母多糖的纯化、鉴定及抗氧化性质分析[J].食品科学, 2004, 25(3):33-36.
WANG Y H, XU M Z, JIANG P, et al.Purification, identification and anti-oxidative analysis of two yeast polysaccharides[J].Food Science, 2004, 25(3):33-36.
[5] LIU Y, HUANG G L.The derivatization and antioxidant activities of yeast mannan[J].International Journal of Biological Macromolecules, 2018, 107:755-761.
[6] 杨学山, 祝霞, 李颍, 等.正交试验优化葡萄酒泥酵母甘露聚糖提取工艺及其体外抗氧化作用[J].食品科学, 2015, 36(18):69-74.
YANG X S, ZHU X, LI Y, et al.Optimization of extraction process and in vitro antioxidant activities of mannan from waste wine yeast[J].Food Science, 2015, 36(18):69-74.
[7] RODRIGUEZ-NOGALES J M, FERN NDEZ-FERN
NDEZ-FERN NDEZ E, G
NDEZ E, G MEZ M, et al.Antioxidant properties of sparkling wines produced with β-glucanases and commercial yeast preparations[J].Journal of Food Science, 2012, 77(9):1 005-1 010.
MEZ M, et al.Antioxidant properties of sparkling wines produced with β-glucanases and commercial yeast preparations[J].Journal of Food Science, 2012, 77(9):1 005-1 010.
[8] COMUZZO P, TAT L, TONIZZO A, et al.Yeast derivatives (extracts and autolysates) in winemaking:Release of volatile compounds and effects on wine aroma volatility[J].Food Chemistry, 2006, 99(2):217-230.
[9] 李惠琳, 王婧, 许引虎, 等.不同酵母多糖对霞多丽干白葡萄酒品质的影响[J].食品与发酵工业, 2018, 44(4):142-153.
LI H L, WANG J, XU Y H, et al. Effects of different yeast polysaccharides on quality of chardonnay dry white wine[J].Food and Fermentation Industries, 2018, 44(4):142-153.
[10] 祝霞, 刘琦, 赵丹丹, 等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学, 2019, 40(16):115-123.
ZHU X, LIU Q, ZHAO D D, et al.Effect of different winemaking conditions on fermentation aroma production by Saccharomyces cerevisiae[J].Food Science, 2019, 40(16):115-123.
[11] 刘建民, 张梁, 丁重阳, 等.应用 AP法评价工业酒精酵母的活力[J].中国酿造, 2008, 27(14):34-37.
LIU J M, ZHANG L, DING Z Y, et al.Assessment of the vitality of industrial alcohol yeast by AP test[J].China Brewing, 2008, 27(14):34-37.
[12] 符安. 全氟辛酸对酿酒酵母的生理毒性作用[D].广州:暨南大学, 2016.
FU A.Physiological toxicity of pentadecafluorooctanoic acid on Saccharomyces cerevisiae[D].Guangzhou:Jinan University, 2016.
[13] KABALEESWARAN V, PURI N, WALKER J E, et al.Novel features of the rotary catalytic mechanism revealed in the structure of yeast F1 ATPase[J].The EMBO Journal, 2006, 25(22):5 433-5 442.
[14] TEMPLE M D, PERRONE G G, DAWES I W.Complex cellular responses to reactive oxygen species[J].Trends in Cell Biology, 2005, 15(6):319-326.
[15] YALCINKAYA T, UZILDAY B, OZGUR R, et al.Lipid peroxidation-derived reactive carbonyl species (RCS):Their interaction with ROS and cellular redox during environmental stresses[J].Environmental and Experimental Botany, 2019, 165:139-149.
[16] MEKOUE NGUELA J, PONCET-LEGRAND C, SIECZKOWSKI N, et al.Interactions of grape tannins and wine polyphenols with a yeast protein extract, mannoproteins and β-glucan[J].Food Chemistry, 2016, 210:671-682.
[17] FABRIZIO P, BATTISTELLA L, VARDAVAS R, et al.Superoxide is a mediator of an altruistic aging program in Saccharomyces cerevisiae[J].The Journal of Cell Biology, 2004, 166(7):1 055-1 067.
[18] LAUN P, PICHOVA A, MADEO F, et al.Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis[J].Molecular Microbiology, 2001, 39(5):1 166-1 173.
[19] GUO W Y, GU X L, TONG Y Q, et al.Protective effects of mannan/β-glucans from yeast cell wall on the deoxyniyalenol-induced oxidative stress and autophagy in IPEC-J2 cells[J].International Journal of Biological Macromolecules, 2019, 135:619-629.
[20] SCHAFER F Q, BUETTNER G R.Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J].Free Radical Biology & Medicine, 2001, 30(11):1 191-1 212.
[21] GANGULY D, SRIKANTH C V, KUMAR C, et al.Why is glutathione (a tripeptide) synthesized by specific enzymes while TSH releasing hormone (TRH or thyroliberin), also a tripeptide, is produced as part of a prohormone protein[J].Iubmb Life, 2003, 55(9):553-554.
[22] PRIMA A, HARA K Y, DJOHAN A C, et al.Glutathione production from mannan-based bioresource by mannanase/mannosidase expressing Saccharomyces cerevisiae[J].Bioresource Technology, 2017, 245:1 400-1 406.
[23] 卢新军, 张方方, 许引虎.酵母细胞壁对葡萄酒中酵母发酵代谢的影响[J].酿酒科技, 2015(4):49-51;57.
LU X J, ZHANG F F, XU Y H.Effects of yeast cell wall on yeast fermentation & metabolism of grape wine[J].Liquor-Making Science & Technology, 2015(4):49-51;57.
[24] ALSTEENS D, DUPRES V, MC EVOY K, et al.Structure, cell wall elasticity and polysaccharide properties of living yeast cells, as probed by AFM[J].Nanotechnology, 2008, 19(38):384005.
[25]  NGELES POZO-BAY
NGELES POZO-BAY N M,
N M, ![]() I, MORENO-ARRIBAS M V.Scientific evidences beyond the application of inactive dry yeast preparations in winemaking[J].Food Research International, 2009, 42(7):754-761.
I, MORENO-ARRIBAS M V.Scientific evidences beyond the application of inactive dry yeast preparations in winemaking[J].Food Research International, 2009, 42(7):754-761.
[26] 郭守东. 微生物胞外多糖的结构及其抗氧化活性研究[D].青岛:中国海洋大学, 2010.
GUO S D.Structural characteristics of microbial exopolysaccharides and their antioxidant activities[D].Qingdao:Ocean University of China, 2010.
[27] LUBBERS S, VERRET C, VOILLEY A.The effect of glycerol on the perceived aroma of a model wine and a white wine[J].LWT- Food Science and Technology, 2001, 34(4):262-265.
[28] 郭玉文, 曹婧然, 何立杰.细胞水平的抗氧化机制研究进展[J].医学综述, 2016, 22(1):13-16.
GUO Y W, CAO J R, HE L J.Research progress in antioxidation mechanism on cellular level[J].Medical Recapitulate, 2016, 22(1):13-16.
[29] SIES H.Glutathione and its role in cellular functions[J].Free Radical Biology & Medicine, 1999, 27(9-10):916-921.
[30] 康雨芳, 陈雪峰, 常相娜, 等.胶红酵母胞外多糖镇痛及抗氧化作用的研究[J].食品科技, 2018, 43(2):212-217.
KANG Y F, CHEN X F, CHANG X N, et al.Analgesic and antioxidant effects of extracellular polysaccharide from Rhodotorula mucilaginosa[J].Food Science and Technology, 2018, 43(2):212-217.