蓝莓又称越橘,杜鹃花科越橘属多年生落叶或常绿灌木,被世界卫生组织认为是抗氧化性最强的水果之一,常被誉为“浆果之王”[1]。蓝莓果实中含有丰富的花青素, 花青素被认为是蓝莓抗氧化、视力保护、抗癌、抗辐射、抗衰老、增强免疫力等作用的主要物质基础[2]。花青素能够破坏细菌表面细胞膜,从而使细菌内容物渗漏,最终导致细菌的死亡,因此,对于致病菌有良好的抑制作用[3]。ZHOU等[4]用蓝莓花青素处理细菌,细菌的核酸漏出量和蛋白质释放量显著增加,且细菌数量明显降低[5]。同时,蓝莓中的酚类物质对多种致病菌均有抑制作用,尤其对于金黄色葡萄球菌、大肠杆菌、沙门氏菌等常见致病菌有很强的抑制作用。酚类物质可以通过改变细胞膜流动性来使细胞通透性增加,从而使细胞内容物流出,导致细胞新陈代谢紊乱[6]。在酸性环境下,非极性酚类化合物质的酚羟基电离度减小,疏水性增强,通过溶解在细胞膜的脂类和和蛋白质的疏水区域来破坏细胞膜完整性[7]。
已有研究发现,德式乳杆菌保加利亚亚种可通过水解α-乳白蛋白和β-乳球蛋白,有效降低乳清蛋白的过敏性。此外,保加利亚乳杆菌发酵还可提高α-乳白蛋白和β-乳球蛋白的消化率,降低乳清蛋白的抗原性。德氏乳杆菌保加利亚亚种和嗜热链球菌联合发酵对降低甜乳清和脱脂乳中的β-乳球蛋白抗原性也非常有效[8]。但对乳清蛋白发酵以及乳清蛋白和蓝莓汁共发酵产物的抑菌特性研究较少[9],目前本课题组发现乳清蛋白蓝莓混合汁发酵可以提高体系颜色稳定性和抗氧化能力的保持[10-11]。由于乳酸菌被称为公认安全(generally recognized as safe,GRAS)菌株,所以乳酸菌产物称为GRAS物质已经广泛应用于多个国家的食品保鲜领域[12]。保加利亚乳杆菌[13]、德氏乳杆菌保加利亚亚种[14]、嗜热链球菌[15]植物乳杆菌[16],可产生细菌素等杀菌物质,可对大肠杆菌、金黄色葡萄球菌,单核细胞增生李斯特菌等产生抑制作用[17-18]。副干酪乳杆菌在发酵过程中,可有效抑制大肠杆菌和金黄色葡萄球菌。
目前的蓝莓风味酸奶,主要是在酸奶发酵结束后,将蓝莓果浆与酸奶混合后包装,蓝莓的主要成分基本在贮藏期间被微生物利用。在较低的pH环境下,蓝莓很难被微生物充分发酵。本文利用乳酸菌发酵乳清蛋白蓝莓汁混合物,通过测定抑菌圈的大小、碱性磷酸酶(alkaline phosphatase,AKP)含量、电导率初步探索乳酸菌发酵蓝莓乳清蛋白体系对3种致病菌(金黄色葡萄球菌、沙门氏菌和枯草芽孢杆菌)的抑制效果,为乳清蛋白蓝莓汁混合乳酸菌发酵产物作为新型天然抗菌剂提供理论依据,未来可以在功能食品,食品包装,医药等领域应用。
1 材料与方法
1.1 主要试剂
保加利亚乳杆菌134、嗜热链球菌99、副干酪乳杆菌W125和植物乳杆菌67、指示菌(金黄色葡萄球菌、枯草芽孢杆菌和沙门氏菌),江苏乳品生物技术与安全控制重点实验室;乳清蛋白粉(蛋白含量80%),上海昊岳食品科技有限公司提供;2019年成熟的大兴安岭野生蓝莓(51° 55′ N, 124°34′ E);AKP试剂盒,南京建成生物工程研究所。
1.2 样品预处理
(1)原料的选择:选择包装完好,冷藏良好的新鲜罐装蓝莓,提前解冻。取蓝莓果肉与果汁混合物100 g倒入榨汁机中然后加水,打开开关。过滤:将榨汁机中的蓝莓汁倒出,用纱布进行过滤,重复过滤3次。(2)调配:过滤液加去离子水定容至600 mL,使得蓝莓与水的质量比为1∶5。加入乳清粉:向调配液中加入6%的乳清蛋白以及6%白砂糖。调pH至6.5和7.0。(3)灭菌:将配制成的蓝莓乳清蛋白饮料置于95 ℃水浴锅水浴灭菌5 min。(4)接菌发酵:分别接入保加利亚乳杆菌、嗜热链球菌混合菌种以及植物乳杆菌、副干酪乳杆菌混合菌种,混合菌种中的2种菌以1∶1混合,接种量为2%(活菌数为7 lgCFU/mL),样品置于37 ℃恒温箱培养[10]。(5)样品:共计6组样品,如表1所示。
表1 实验样品分组
Table 1 Experimental sample groups

样品123456原料蓝莓乳清蛋白蓝莓+乳清蛋白蓝莓乳清蛋白蓝莓+乳清蛋白接入的菌种副干酪乳杆菌副干酪乳杆菌副干酪乳杆菌保加利亚乳杆菌保加利亚乳杆菌保加利亚乳杆菌植物乳杆菌植物乳杆菌植物乳杆菌嗜热链球菌嗜热链球菌嗜热链球菌
1.3 实验方法
1.3.1 抑菌圈测定
将30 mL灭菌的LB琼脂培养基(琼脂质量分数2%)倾注于直径为90 mm的无菌培养皿中,保持水平待其凝固作为底层,取稀释好的致病菌菌液100 μL均匀涂布于吹干的平板上,用直径10 mm的无菌打孔器在菌层打孔后,用无菌镊子将孔中央培养基夹出,使其形成直径10 mm的圆孔,向孔洞内加入待测样品200 μL。将平板放置20 ℃培养箱,扩散过夜,之后37 ℃培养10 h后观察有无抑菌圈形成,并测量其抑菌直径。
1.3.2 碱性磷酸酶测定
取1.3.1中所制菌液的上清液,依照碱性磷酸酶试剂盒说明书测定金黄色葡萄球菌培养液的AKP活性,分别测量3次取平均值。
1.3.3 电导率测定
取1.3.1中所制菌液的上清液,用酶标仪在450 nm测金黄色葡萄球菌培养液、枯草杆菌培养液以及沙门氏菌培养液电导率(OD450nm值)。
1.4 实验数据处理
每个试验重复3次,结果表示为平均值±偏差。数据统计分析采用SPSS 11.5软件(P<0.05表示差异显著,P>0.05表示差异不显著),采用Origin 8.5 画图。相同字母表示差异不显著,不同字母表示差异显著。
2 结果与分析
2.1 发酵液对金黄色葡萄球菌抑菌圈大小测定结果
由图1可知,蓝莓和乳清蛋白混合发酵体系对金黄色葡萄球菌的抑制能力显著高于乳清蛋白,蓝莓单独发酵体系(P<0.05)。
图1中0 d表示为发酵结束时。蓝莓加乳清蛋白和混合菌种一起发酵的产物对金黄色葡萄球菌抑制性能较高。保加利亚乳杆菌和嗜热链球菌混合蓝莓和乳清蛋白发酵在贮藏第12天时对金黄色葡萄球菌的抑制能力显著增加(P<0.05),抑菌直径为188 mm,比0 d时高出67%。副干酪乳杆菌和植物乳杆菌混合蓝莓发酵对金黄色葡萄球菌的抑制能力在贮藏第4天和第12天抑菌能力显著低于(P<0.05)保加利亚乳杆菌和嗜热链球菌混合发酵。乳清蛋白混合保加利亚乳杆菌和嗜热链球菌发酵抑菌能力显著高于副干酪乳杆菌和植物乳杆菌混合发酵(P<0.05)。因此混合保加利亚乳杆菌和嗜热链球菌的发酵液比对应的混合副干酪乳杆菌和植物乳杆菌的发酵液抑菌性能要好,不同微生物菌种利用底物代谢产物不同导致抑菌性能的差别。保加利亚乳杆菌和嗜热链球菌产酸主要是乳酸,而甲酸和乙酸的产量相对干酪乳杆菌较少,而甲酸和乙酸的抑菌能力强于乳酸。这说明乳酸菌所产生的酸的抑菌能力影响是部分原因,还与底物的种类和发酵产物有关,包括多酚类,肽类以及多酚和肽类形成的复合物,从图1可知,在贮藏第12天时,乳清蛋白和蓝莓混合保加利亚乳杆菌和嗜热链球菌抑菌能力强于对应的混合副干酪乳杆菌和植物乳杆菌的发酵液(P<0.05)。

图1 乳清蛋白蓝莓发酵体系对金黄色葡萄球菌菌体抑菌效果
Fig.1 Bacteriostatic effect of whey protein or blueberry juice fermentation system on Staphylococcus aureus
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2 金黄色葡萄球菌培养液AKP测定结果
由图2可知,蓝莓和混合菌种以及金黄色葡萄球菌的培养液中AKP含量较高,混合菌种为副干酪乳杆菌和植物乳杆菌时,AKP质量浓度在2 d时最高为0.203 mg/mL,而乳清蛋白和混合菌种以及金黄色葡萄球菌培养液中AKP含量较低,混合菌种为保加利亚乳杆菌和嗜热链球菌时,在2 d时最低为0.007 mg/mL,原因是蓝莓中大量的花青素等多酚物质对金黄色葡萄球菌的影响较大,并且起主导作用。
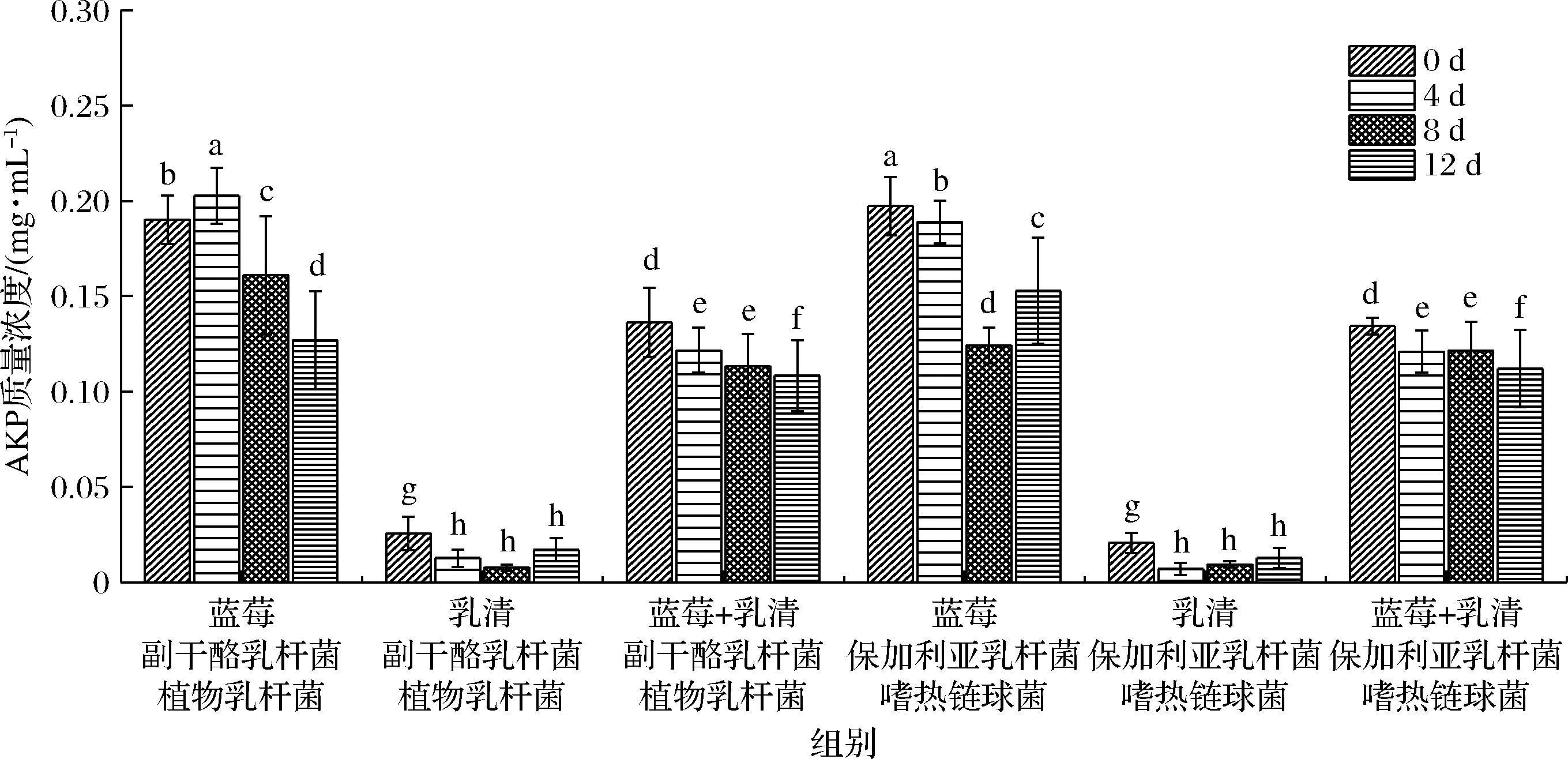
图2 乳清蛋白蓝莓发酵体系对金黄色葡萄球菌菌体培养液AKP浓度的影响
Fig.2 Effect of whey protein or blueberry juice fermentation system on AKP concentration in culture medium of Staphylococcus aureus
研究显示,以植物乳杆菌L.plantarum J26为发酵蓝莓汁。发酵后酚类含量提高了43.42%。高效液相色谱法检测蓝莓汁中主要含有花青素、花青素氯化物、天葵青素和芍药青素4种花青素,植物乳杆菌J26发酵的蓝莓汁对α-葡萄糖苷酶和α-淀粉酶的抑制作用均增强。表明蓝莓和混合菌种发酵产物能对金黄色葡萄球菌产生较大影响,使得金黄色葡萄球菌的细胞壁和细胞膜产生严重的破坏,从而导致AKP的流出。由图2可知,不同菌种在同一条件下的培养液中AKP浓度相差不大,表明这2种混合菌种在对金黄色葡萄球菌细胞膜和细胞壁的影响能力相当。此外,花青素可以进入膜内,降低单核增生乳杆菌、金黄色葡萄球菌、肠炎链球菌和副溶血性弧菌的AKP、ATP酶和SOD活性,从而抑制病原菌的生长。AKP失活可以通过控制去磷酸化进程来阻止细胞分化,有研究报道AKP的含量或活性可以调节Ca2+代谢。花青素处理后AKP活性降低,可能导致Ca2+浓度升高,Ca2+与钙结合蛋白、相关离子通道和基于磷酸盐的能量代谢有关。ATP酶是另一种基本代谢酶。较低的ATP酶水平可能导致ATP从病原体流出,阻碍呼吸代谢。一些研究也表明,蓝莓中可用的花青素可能通过增加ATP从病原体细胞质流出来发挥作用。通过测定ATP的变化发现肉桂精油抑制了大肠杆菌和金黄色葡萄球菌的呼吸。
2.3 金黄色葡萄球菌培养液电导率测定结果
细菌细胞膜承担着菌体Na+、K+ 等小分子物质交换与信息传递等生理功能,菌体的电导率反应细胞膜的通透性的变化。
由图3可知,蓝莓混合保加利亚乳杆菌和嗜热链球菌与金黄色葡萄球菌的混合培养液电导率较高,OD450nm在12 d时最高为0.402,乳清蛋白和混合菌种以及金黄色葡萄球菌培养液电导率最低。主要是因为蓝莓中的花青素等酚类物质有较强的抑菌性能,从而导致金黄色葡萄球菌细胞膜的破坏以及电导率的升高。但是,由于乳清蛋白与混合菌种的培养液电导率的值通常在0.1~0.2,表示2种乳酸菌的发酵产物都能对金黄色葡萄球菌产生一定影响,即对金黄色葡萄球菌的细胞膜有一定的破坏性。
2.4 发酵液对枯草芽孢杆菌抑菌圈大小测定结果
枯草芽孢杆菌厚壁、折光性强、有抗逆性的休眠体,具有耐高温能力和抗辐射能力,是在食品工业中经常遇到的污染菌,它们可以引起果蔬、粮食、乳制品、肉类、鱼类、禽类、蛋类以及罐头食品变质,导致一些食源性疾病和食物中毒。由图4可知,6种混合发酵产物对枯草芽孢杆菌都有一定抑制能力,从2种混合菌种的发酵产物对枯草芽孢杆菌的抑菌圈来看,保加利亚乳杆菌和嗜热链球菌混合蓝莓和乳清蛋白的发酵产物对枯草芽孢杆菌的抑菌圈整体上要高于副干酪乳杆菌和植物乳杆菌混合蓝莓和乳清蛋白的发酵产物对枯草芽孢杆菌的抑菌圈。蓝莓和乳清蛋白和混合菌种发酵产物对枯草芽孢杆菌的抑菌圈较大,最高能达到200 mm左右,最低76 mm。蓝莓和混合菌种发酵产物以及乳清蛋白和混合菌种发酵产物对枯草芽孢杆菌也有一定抑制能力,混合副干酪乳杆菌和植物乳杆菌的样品抑菌圈在50~100 mm,而混合保加利亚乳杆菌和嗜热链球菌的样品抑菌圈在100 mm 左右。在贮藏第4天时,乳清蛋白和蓝莓汁合保加利亚乳杆菌和嗜热链球菌发酵体系对枯草芽孢杆菌的抑制能力高于副干酪乳杆菌和植物乳杆菌的发酵体系(P<0.05)。由图3可知,发酵产物随着时间的变化对枯草芽孢杆菌的抑制能力大致呈现先升后降的趋势,在第4天时达到最高。

图3 乳清蛋白蓝莓发酵产物对金黄色葡萄球菌菌体培养液电导率的影响
Fig.3 Effect of whey protein and blueberry juice fermentation system on the electrical conductivity for culture medium of Staphylococcus aureus

图4 乳清蛋白蓝莓发酵体系对枯草芽孢杆菌抑菌效果
Fig.4 Bacteriostatic effect of whey protein and blueberry juice fermentation system on Bacillus subtilis
2.5 枯草芽孢杆菌培养液电导率测定结果
由图5可知,蓝莓混合保加利亚乳杆菌和嗜热链球菌与枯草芽孢杆菌培养液电导率最高,且在第4天时,电导率值达到最高,最高值为0.410。
乳清蛋白与混合菌种和枯草芽孢杆菌的混合培养液的电导率最低,0 d时最低值为0.121。说明乳清蛋白乳酸菌发酵后的对枯草芽孢杆菌的抑制作用低于蓝莓发酵产物,但随着贮藏时间的延长,抑菌作用逐渐升高。蓝莓中含有丰富的花青素等酚类物质,对枯草芽孢杆菌细胞膜有较强的破坏作用,从而导致电导率的升高。蓝莓经植物乳杆菌和副干酪乳杆菌发酵后对枯草芽孢杆菌电导率的影响与保加利亚乳杆和嗜热链球菌混合发酵体系相比差异不显著(P>0.05)。由图5可知,乳清蛋白和2种混合菌种的发酵产物也可以增加枯草芽孢杆菌培养液的电导率,但低于蓝莓单独混合乳酸菌发酵产物。主要是部分多酚类物质与蛋白或者肽类结合,通过氢键或者共价键结合,降低了对枯草芽孢杆菌的破坏作用。

图5 乳清蛋白蓝莓发酵体系对枯草芽孢杆菌培养液电导率影响
Fig.5 Effect of whey protein and blueberry juice fermentation system on the electrical conductivity of Bacillus subtilis
2.6 发酵液对沙门氏菌抑菌圈大小测定结果
研究表明,蓝莓提取物具有较强的抗菌作用,使膜形态扭曲,细胞内容物渗漏。细胞质成分聚集,在细胞内形成广泛的中空区域。抑制基因转录,破坏细胞膜结构和能量转运。
蓝莓中提取的4种酚类化合物(绿原酸、鞣花酸、槲皮素和槲皮素-3-半乳糖苷)对沙门氏菌具有一定的抑制作用。绿原酸通过阻止丙酮酸代谢而抑制了细菌的能量代谢。同时野生蓝莓的原花青素被认为具有抗黏附特性,特别强调防止微生物黏附到肠道上皮组织。一般来说,酚类化合物在低pH条件下可以通过非特异性力量与微生物外膜上的蛋白质复合,如氢键和疏水效应,共价键的形成,并改变Na+/H+反转运体系统,降低细菌在低渗透环境下的耐受性。由图6可知,6种混合发酵产物对沙门氏菌都有一定抑制能力,蓝莓加乳清蛋白和混合菌种的发酵产物对沙门氏菌的抑菌圈较大,且副干酪乳杆菌和植物乳杆菌混合蓝莓加乳清蛋白的发酵产物对沙门氏菌的抑菌性能更加突出,抑菌圈在贮藏12 d时最高能达到222 mm。乳清蛋白混合保加利亚乳杆菌和嗜热链球菌混合的发酵产物对沙门氏菌的抑菌性能也较好,而且在贮藏期间,抑菌能力逐渐升高,说明乳清蛋白蓝莓混发酵的产物在贮藏期间不断变化,而这种变化有助于抑菌能力的提高。在贮藏第12天时,乳清蛋白蓝莓混合副干酪乳杆菌和植物乳杆菌以及乳清蛋白混合保加利亚乳杆菌和嗜热链球菌发酵抑菌能力无显著差异(P>0.05)。乳清蛋白混合保加利亚乳杆菌和嗜热链球菌发酵体系的抑菌能力显著高于副干酪乳杆菌和植物乳杆菌发酵体系(P<0.05)。在4 d的时候最高能达到185 mm。而蓝莓在发酵结束贮藏第12天,混合副干酪乳杆菌和植物乳杆菌发酵体系抑菌能力显著高于保加利亚乳杆菌和嗜热链球菌发酵体系(P<0.05)。乳清蛋白混合保加利亚乳杆菌和嗜热链球菌发酵体系对沙门氏菌的抑菌性能在贮藏期间有下降趋势,主要是乳清蛋白进一步被微生物分解,分解产物的抑菌能力降低。

图6 乳清蛋白蓝莓发酵产体系对沙门氏菌抑菌效果
Fig.6 Bacteriostatic effect of whey protein and blueberry juice fermentation system on Salmonella
2.7 沙门氏菌培养液电导率测定结果
由图7可知,沙门氏菌与蓝莓和混合菌种混合培养液电导率较高,混合菌种为副干酪乳杆菌和植物乳杆菌时,在12 d时达到最高为0.40。表明在蓝莓经过乳酸菌发酵后,使细菌细胞膜遭到破坏,通透性增大,细胞内Na+、K+等电解质外渗到培养液,使菌液电导率增加。

图7 乳清蛋白蓝莓发酵体系对沙门氏菌菌体培养液电导率影响
Fig.7 Effect of whey protein and blueberry juice fermentation system on the electrical conductivity of Salmonella culture medium
说明,蓝莓混合发酵体系对沙门氏菌的抑制主要表现为破坏菌体结构,主要是蓝莓中的多酚类,花色苷,黄酮类物质在经过乳酸菌发酵后,活性成分进一步提高,因此抑菌能力提高[11]。同时乳清蛋白与混合菌种(保加利亚乳杆菌和嗜热链球菌)和沙门氏菌混合培养液的电导率最低,最低值为0.146。原因是蓝莓的花青素等酚类物质具有较强抑菌性,能够对沙门氏菌细胞膜产生较强破坏,从而使电导率提升。另外,蓝莓,蓝莓和乳清蛋白混合发酵都有助于多酚及花色苷含量的稳定和提升。在4 d时,各培养液的电导率基本达到最高值。蓝莓乳清蛋白混合乳酸菌发酵体系电导率低于蓝莓乳酸菌发酵体系,而抑菌圈大于蓝莓发酵体系,说明乳清蛋白蓝莓混合发酵体系主要表现为抑菌,而蓝莓发酵体系主要表现为杀菌作用。
3 结论
本文利用蓝莓和乳清蛋白和副干酪乳杆菌、植物乳杆菌、保加利亚乳杆菌以及嗜热链球菌混合发酵,测定发酵体系的抑菌特性。研究显示,以上6种发酵产物对3种致病菌都有不同程度的抑制作用。结果显示,尽管蓝莓乳清蛋白混合发酵体系的抑菌圈大于蓝莓、乳清蛋白单独发酵体系,但从电导率结果看,蓝莓发酵体系对致病菌的抑制效果更好,表明蓝莓中的花青素等酚类物质经过乳酸菌发酵对致病菌有着较好的抑制能力。由于6种发酵体系发酵结束时,pH无显著差别,因此产酸抑菌对本研究不同样品所产生的不同的抑菌能力影响不显著。乳清蛋白蓝莓混合乳酸菌发酵体系主要表现的是抑菌作用,其杀菌效果低于蓝莓单独发酵体系。未来研究将集中对蓝莓以及蓝莓乳清蛋白混合发酵抑菌产物进行分离和结构鉴定来制作天然抗菌剂。
[1] 韩鹏祥, 张蓓, 冯叙桥, 等.蓝莓的营养保健功能及其开发利用[J].食品工业科技, 2015, 36(6):370-375;379.
HAN P X, ZHANG B, FENG X Q, et al.Nutritional and health functions of blueberry and its development and utilization[J].Science and Technology of Food Industry, 2015, 36(6):370-375;379.
[2] 李兴元. 蓝莓花青素、多酚类物质的分离纯化与生物活性研究[D].天津:天津大学, 2012.
LI X Y.Investigation on separation, purification and biological activity of anthocyanins and polyphenols in blueberry[D].Tianjin:Tianjin University, 2012.
[3] 孙希云, 赵秀红, 张琦, 等.红树莓花色苷粗提物抗氧化性能与抑菌作用研究[J].食品工业科技, 2009,30(3):132-135.
SUN X Y, ZHAO X H, ZHANG Q, et al.Study on the ability to antioxidantion and bacteriostasis of crude extract of red raspberry anthocyanins[J].Science and Technology of Food Industry, 2009,30(3):132-135.
[4] ZHOU T T, WEI C H, LAN W Q, et al.The effect of Chinese wild blueberry fractions on the growth and membrane integrity of various foodborne pathogens[J].Journal of Food Science, 2020, 85(5):1 513-1 522.
[5] LACOMBE A, WU V C H.The potential of berries to serve as selective inhibitors of pathogens and promoters of beneficial microorganisms[J].Food Quality and Safety, 2017, 1(1):3-12.
[6] LACOMBE A, WU V, TYLER S, et al.Antimicrobial action of the American cranberry constituents;phenolics, anthocyanins, and organic acids, against Escherichia Coli O157:H7[J].International Journal of Food Microbiology, 2010, 139 (1-2):102-107.
[7] 王亚丽, 李颖畅, 马春颖, 等.蓝莓叶多酚提取物对3种细菌的抑菌活性[J].食品与发酵工业, 2015, 41(3):163-167.
WANG Y L, LI Y C, MA C Y, et al.Study on antimicrobial activity of blueberry leaf polyphenol against three microorganisms[J].Food and Fermentation Industries, 2015, 41(3):163-167.
[8] 陈嘉琪, 崔树茂, 唐鑫, 等.德式乳杆菌保加利亚亚种的乳清蛋白利用能力比较[J].食品与发酵工业, 2020, 46(7):28-34.
CHEN J Q, CUI S M, TANG X, et al.Comparison of whey protein hydrolytic ability of Lactobacillus delbrueckii subsp.bulgaricus[J].Food and Fermentation Industries, 2020, 46(7):28-34.
[9] YADAV J S S, YAN S, PILLI S, et al.Cheese whey:A potential resource to transform into bioprotein, functional/nutritional proteins and bioactive peptides[J].Biotechnology Advances, 2015, 33(6):756-774.
[10] 王文琼, 孙志勇, 黄冬成, 等.乳酸菌发酵蓝莓乳清混合体系体外抗氧化特性分析[J].现代食品科技, 2021, 37 (1):142-149.
WANG W Q, SUN Z Y, HUANG D C, et al.Antioxidant properties analysis in vitro of lactic acid bacteria fermentation blueberry and whey mixture system[J].Modern Food Science and Technology, 2021, 37 (1):142-149.
[11] 王文琼, 孙志勇, 黄冬成, 等.乳酸菌发酵对乳清蛋白蓝莓果汁体系特性的影响[J].食品与发酵工业, 2020, 46(13):42-48.
WANG W Q, SUN Z Y, HUANG D C, et al.Effect of lactic acid bacteria fermentation on the characteristics of whey protein /blueberry juice system[J].Food and Fermentation Industries, 2020, 46(13):42-48.
[12] 高鹏. 广谱抗菌乳酸菌的分离鉴定及细菌素的提取、纯化及结构鉴定[D].南京:南京农业大学, 2016.
GAO P.Isolation and identification of LAB strains with a broad-spectrum antibacterial activity and extraction purification and identification of the bacteriocin[D].Nanjing:Nanjing Agricultural University, 2016.
[13] 陈华, 彭浩, 胡方兴, 等.德氏乳杆菌保加利亚亚种发酵产物对常见病原菌的抑制作用[J].国际检验医学杂志, 2020, 41(23):2 899-2 900; 2 907.
CHEN H, PENG H, HU F X, et al.Inhibitory effect of fermentation products of Lactobacillus delbrueckii subsp.bulgaricus on common pathogens[J].International Journal of Laboratory Medicine, 2020, 41(23):2 899-2 900; 2 907.
[14] ABEDI D, FEIZIZADEH S, AKBARI V, et al.In vitro anti-bacterial and anti-adherence effects of Lactobacillus delbrueckii subsp. bulgaricus on Escherichia coli[J].Research in Pharmaceutical Sciences, 2013, 8(4):260-268.
[15] ARENA M P, SILVAIN A, NORMANNO G, et al.Use of Lactobacillus plantarum strains as a bio-control strategy against food-borne pathogenic microorganisms[J].Front Microbiol, 2016, 7:464.
[16] PERAL M C, HUAMAN MARTINEZ M A, VALDEZ J C.Bacteriotherapy with Lactobacillus Plantarum in burns[J].International Wound Journal, 2009, 6(1):73-81.
[17] 孙小涵, 孙洪浩, 陈秀秀, 等.具有抑菌活性植物乳杆菌的筛选及抑菌物质的特性分析[J].养猪, 2020(6):18-20.
SUN X H, SUN H H, CHEN X X, et al.Screening of Lactobacillus plantarum with antimicrobial activity and characterization of antimicrobial substances[J].Swine Production, 2020(6):18-20.
[18] GUO J H, BROSNAN B, FUREY A, et al.Antifungal activity of Lactobacillus against Microsporum canis, Microsporum gypseum and Epidermophyton floccosum[J].Bioengineered, 2012, 3(2):104-113.