溶菌酶又称胞壁质酶,是一种普遍存在于植物、动物和微生物中具有杀菌活性的蛋白[1]。溶菌酶通过水解作用切断N-乙酰胞壁酸与N-乙酰葡萄糖胺之间的β-1,4糖苷键[2], 破坏微生物细胞壁肽聚糖支架, 在内部渗透压的作用下使细胞胀裂, 引起细菌裂解, 从而起到防腐和杀菌作用[3]。革兰氏阳性菌细胞壁主要成分是肽聚糖,革兰氏阴性菌细胞壁外层大部分是脂多糖,内层才含有少量肽聚糖,因此溶菌酶对革兰氏阳性菌的作用效果远大于革兰氏阴性菌[4]。溶菌酶作为一种天然抗菌蛋白[5],不会产生细菌耐药性、对人体无毒副作用,同时还具有抗病毒[6]、抗炎症[7]、抗肿瘤[8]、增强免疫力[9]等特性,溶菌酶现已成功应用于食品防腐、化妆品、畜牧饲料以及医药[10-13]等领域。提高溶菌酶对革兰氏阴性菌的作用,及其广谱杀菌能力成为了目前的学术研究热点[14],围绕溶菌酶的非胞壁质酶活性进行改造是开发新型广谱溶菌酶的有效途径之一[15]。
巴斯德毕赤酵母(Pichia pastoris)广泛用于生产具有医疗或工业价值的重组蛋白,目前已有上千种蛋白在毕赤酵母系统中成功表达[16]。毕赤酵母具有甲醇诱导的强启动子AOX1,可严格调控外源基因的表达[17]。同时相较于原核表达系统,真核表达系统有高效的蛋白质翻译后修饰和加工的能力,可以使表达的重组蛋白具有较理想的生物活性。毕赤酵母中多采用整合型表达载体,酵母的染色体与已被转入含有目的基因的载体发生同源重组,且有概率发生基因多拷贝,外源蛋白的表达量会随着基因拷贝数的增加而增加[18]。
目前已经在酿酒酵母(Saccharomyces cerevisiae)中发现自主复制序列(ARS)可用于穿梭质粒[19]。CAMATTARI等[20]从乳酸克鲁维酵母(Kluyveromyces lactis)中分离并经过人工优化得到452 bp的panARS(自主复制序列)(下文简写为pARS),基于pARS序列的游离型表达载体成功表达蛋白,与整合型克隆相比,游离型克隆表现出较低的克隆间变异和较高的克隆内变异,这是一种有利于重组蛋白的表达和筛选获得快速有效的游离型质粒。本研究通过人工合成人溶菌酶基因序列与pARS基因序列,插入到pPICZαA表达载体中,构建一种游离型表达人溶菌酶的毕赤酵母工程菌,为突变筛选新型广谱人溶菌酶奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
毕赤酵母X33购自武汉淼灵生物科技有限公司;溶壁微球菌由本实验室保存;One step ZTOPO-Blunt/TA载体、大肠杆菌TOP10购自北京庄盟国际生物基因科技有限公司;pPICZαA载体由本实验室保存;人溶菌酶hLYZ基因、酵母自主复制序列pARS、引物由上海生工生物工程技术服务有限公司合成。
1.1.2 试剂和酶
抗生素zeocin、抗His标签一抗、HRP标记羊抗鼠二抗、电致化学发光 (electrochemiluminescence,ECL)Plus超敏发光液,北京索莱宝科技有限公司;PrimeSTAR® HS(Premix)、Xho I、Not I、In-Fusion酶,宝生物工程(大连)有限公司;T4 DNA连接酶、Pci Ⅰ,NEB(北京)有限公司;核酸分子量Marker,北京全式金生物技术有限公司;蛋白质Marker,Thermo Fisher Scientific;质粒小量提取试剂盒、胶回收试剂盒,Omega Bio-Tek公司;快速SDS-PAGE凝胶制备试剂盒、5 ×蛋白上样缓冲液、酵母质粒小量提取试剂盒,北京庄盟国际生物基因科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)法蛋白质定量试剂盒,天根生化科技(北京)有限公司公司;其他试剂均为市售分析纯。
1.1.3 培养基
低盐LB培养基(5.0 g/L氯化钠、5.0 g/L酵母浸粉、10.0 g/L胰蛋白胨,1 mol/L NaOH调至pH 7.5),YPD培养基(10.0 g/L酵母浸粉、20.0 g/L蛋白胨、20.0 g/L葡萄糖),YPDS培养基(10.0 g/L酵母浸粉、20.0 g/L蛋白胨、20.0 g/L葡萄糖、1 mol/L山梨醇),BMGY培养基[10.0 g/L酵母浸粉、20.0 g/L蛋白胨、0.1 mol/L磷酸钾缓冲液(pH 6.0)、13.4 g/L 无氨基酵母氮源(yeast nitrogen base W/O amino acids,YNB)、10.0 g/L甘油、4.0×10-4g/L生物素],BMMY培养基[10.0 g/L酵母浸粉、20.0 g/L蛋白胨、0.1 mol/L 磷酸钾缓冲液(pH 6.0)、13.4 g/L YNB、5.0 g/L甲醇、4.0×10-4g/L生物素]。固体培养基在对应液体培养基的基础配方上加1.5%~2.0%(质量分数)的琼脂。
1.1.4 仪器与设备
C1000 Touch PCR仪、PowerPac HC蛋白电泳仪、MicroPulser电穿孔仪,美国Bio-Rad公司;DYY-6C核酸电泳仪、WD-9403D紫外分析仪,北京市六一仪器厂;BioSpectrum®510 Imaging System紫外凝胶成像仪,美国UVP公司;CT15RE台式微量冷冻离心机,日本日立公司;Centrifuge 5810R台式高速离心机,德国Eppendorf公司;Milli-Q Reference超纯水仪,德国默克公司;DL-CJ-2 N超净工作台,北京东联哈尔仪器制造有限公司;AG CH-4103振荡培养箱,瑞士INFORS公司;Blue pard恒温生化培养箱,上海一恒科学仪器有限公司;UV-3200紫外可见分光光度计,上海美谱达仪器有限公司;FiveEasy PH计,瑞士Mettler Toledo公司;BSA223S分析天平,德国Sartorius公司; KTA pure蛋白纯化仪,美国GE公司。
KTA pure蛋白纯化仪,美国GE公司。
1.1.5 引物设计
根据人溶菌酶序列hLYZ设计引物F1和R1,在F1的5′端添加Xho I酶切位点,在R1的5′端添加Not I酶切位点、终止密码子TAA及6×His标签。根据来源于乳酸克鲁维酵母的自主复制序列pARS及pPICZαA载体上15 bp同源序列设计引物F2和R2,并在F2和R2的5′端均添加Pci Ⅰ酶切位点。引物序列见表1。
表1 引物序列
Table 1 Primer sequences
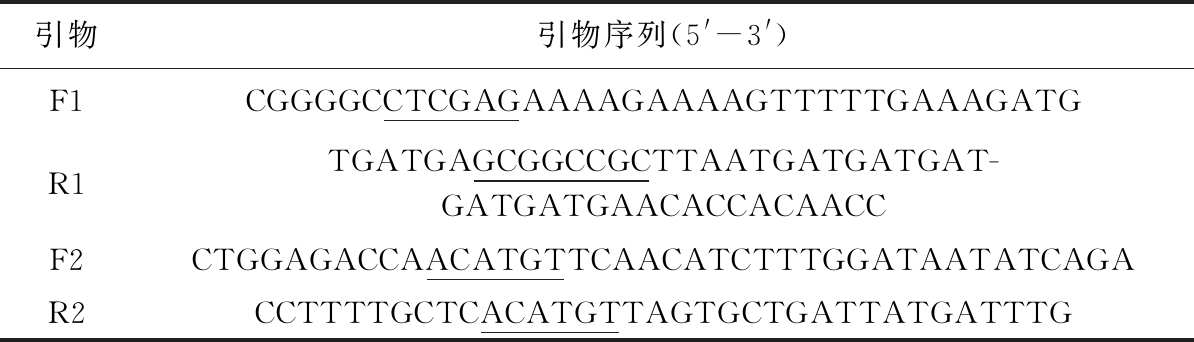
引物引物序列(5'-3')F1CGGGGCCTCGAGAAAAGAAAAGTTTTTGAAAGATGR1TGATGAGCGGCCGCTTAATGATGATGAT-GATGATGAACACCACAACCF2CTGGAGACCAACATGTTCAACATCTTTGGATAATATCAGAR2CCTTTTGCTCACATGTTAGTGCTGATTATGATTTG
1.2 实验方法
1.2.1 表达载体pPICZαA-hLYZ-pARS的构建
根据GenBank上发表的人溶菌酶基因序列及毕赤酵母密码子偏爱性人工合成人溶菌酶基因。以pUC57-hLYZ为模板扩增并回收片段,将目的片段与One step ZTOPO-Blunt/TA载体连接,构建载体T-hLYZ。
以人工合成的pARS序列为模板扩增并回收片段,将目的片段与经过Pci Ⅰ线性化后的pPICZαA质粒通过In-Fusion酶进行无缝连接,构建载体pPICZαA-pARS。
利用XhoI和Not I对T-hLYZ和pPICZαA-pARS载体双酶切,胶回收正确位置目的片段,T4 DNA连接酶16 ℃过夜连接,构建重组质粒pPICZαA-hLYZ-pARS,质粒转至大肠杆菌TOP10感受态,利用菌落PCR筛选阳性转化子,扩增质粒测序正确后待转化毕赤酵母。
1.2.2 重组载体的电转化及毕赤酵母的筛选
将毕赤酵母X33单克隆经摇瓶培养、冰浴、离心、1 mol/L山梨醇重悬处理后得到毕赤酵母X33感受态细胞。取10 μL重组游离型质粒pPICZαA-hLYZ-pARS和10 μL经Sac I线性化处理的空载体pPICZαA,分别与80 μL毕赤酵母X33感受态混合,冰浴后将混合液转移至0.2 cm预冷的电转杯中电击(1.5 kV,4~6 ms),电击结束后立即加入预冷的1 mol/L 山梨醇溶液并转入离心管,30 ℃静置培养 1 h 后加入500 μL YPD液体培养基静置复苏1 h。取200 μL复苏液涂布于含zeocin(100 μg/mL)抗性的YPDS筛选平板上,30 ℃恒温培养3~4 d直至长出单菌落,利用菌落PCR鉴定阳性转化子,以转化空载体pPICZαA的毕赤酵母作为负对照。
1.2.3 重组游离型毕赤酵母的表达
将成功转化游离型重组质粒pPICZαA-hLYZ-pARS的单克隆接种于30 mL BMGY培养基中,30 ℃、250 r/min振荡培养至OD600=2~6(约16 h),室温下4 000 r/min离心10 min收集菌体,用100 mL BMMY培养基重悬至OD600=1左右,30 ℃、250 r/min振荡培养,每隔12 h取样0.5 mL,并补加甲醇至终体积分数为0.5%,培养至72 h时,将菌液转移至离心管中,4 000 r/min 离心10 min,分离上清液和菌体于-20 ℃备用。
1.2.4 重组人溶菌酶的鉴定
上清液样品用甲醇-氯仿浓缩处理:V(上清液)∶V(甲醇)∶V(氯仿)∶V(超纯水)=1∶4∶1∶4配制,剧烈振荡后冰浴、离心,除去上层甲醇相与下层氯仿相,得到中间层蛋白,适量甲醇重悬后2次离心,除去残留甲醇后室温晾干,用适量尿素溶解蛋白得到上清浓缩液。
将上清液浓缩液与5×蛋白上样缓冲液混合,煮沸后离心,取上清液进行SDS-PAGE检测。SDS-PAGE结束后,采用湿转法100 V转聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,用含5%(质量分数)脱脂奶粉的TBST封闭2 h,抗His标签一抗(1∶5 000 稀释)4 ℃孵育过夜,TBST洗膜3次、每次10 min,辣根过氧化物酶(horseradish peroxidase, HRP)标记羊抗鼠二抗(1∶4 000稀释)室温摇动孵育1 h,TBST洗膜6次、每次5 min,配制新鲜ECL发光工作液孵育3 min于曝光仪下显色拍照。
1.2.5 重组人溶菌酶的酶活性测定
利用比浊法对溶菌酶活性进行测定[21]。挑取经过2次划线的溶壁微球菌单克隆,接种于LB液体培养基,振荡培养18 h后,离心菌液并用磷酸盐缓冲液(pH 6.2)洗涤菌体,重悬至OD450=0.8。准确称取2 mL 溶壁微球菌菌悬液置于1 cm比色皿中,将比色皿放入已预热的紫外可见分光光度计中,迅速加入0.1 mL重组毕赤酵母发酵液,快速混匀并计时,记录反应15、75 s时OD450的读数,酶活性计算如公式(1)所示:
溶菌酶酶活性![]()
(1)
式中:ΔOD450为75、15 s时的反应液吸光度值的差值;样品量为每0.1 mL标准酶液中含溶菌酶的体积。
1.2.6 重组人溶菌酶的浓缩与纯化
离心重组毕赤酵母发酵72 h后的发酵液,60%饱和度硫酸铵沉淀酵母表达上清液(每100 mL上清液加入36.1 g固体硫酸铵),一边加硫酸铵一边用磁力搅拌器缓慢搅拌,浑浊后于4 ℃静置1 h以上,15 000 r/min 离心20 min,移去上清液,用适量超纯水溶解蛋白沉淀。
浓缩后的蛋白溶液用0.22 μm滤膜过滤,将脱盐柱(HiTrapTM Desalting 5 mL)与 KTA蛋白纯化仪相连,在脱盐Buffer(0.15 mol/L NaCl,0.02 mol/L PBS,pH 7.0)2 mL/min条件下对蛋白溶液进行脱盐处理。
KTA蛋白纯化仪相连,在脱盐Buffer(0.15 mol/L NaCl,0.02 mol/L PBS,pH 7.0)2 mL/min条件下对蛋白溶液进行脱盐处理。
脱盐后的样品经镍亲和层析柱(HisTrap HP 1 mL)洗脱得到纯化的人溶菌酶。再次利用脱盐柱对纯化后的人溶菌酶处理以除去高浓度咪唑。
1.2.7 重组人溶菌酶的浓度测定
利用BCA蛋白质定量试剂盒测定纯化、脱盐除咪唑后的人溶菌酶,根据已知浓度的牛血清白蛋白(bovine albumin ,BSA)用缓冲液稀释不同浓度制作标准曲线,通过样品在562 nm处的吸光值计算蛋白浓度。
2 结果与分析
2.1 表达载体pPICZαA-hLYZ-pARS的构建与验证
利用引物F1、R1通过PCR扩增得到目的基因序列hLYZ,将PCR产物回收后与One step ZTOPO-Blunt/TA载体连接,转化至大肠杆菌TOP10中,菌落PCR鉴定为阳性克隆后提取重组质粒T-hLYZ。利用引物F2、R2通过PCR扩增得到酵母自主复制序列pARS,将回收后的PCR产物与线性化后的pPICZαA质粒通过In-Fusion酶无缝连接,转化至大肠杆菌TOP10中,菌落PCR鉴定为阳性克隆后提取重组质粒pPICZαA-pARS。
对克隆载体T-hLYZ和游离型毕赤酵母表达载体pPICZαA-pARS分别进行Xho I和Not I双酶切。将酶切产物进行1%琼脂糖凝胶电泳验证,结果见图1,回收正确条带处目的基因片段与pPICZαA-pARS载体片段。利用T4 DNA连接酶过夜连接2个片段,连接产物转化至大肠杆菌TOP10中。经菌落PCR验证及DNA序列测序证明成功构建游离型表达载体pPICZαA-hLYZ-pARS,经华大基因测序,结果正确。构建的表达载体图谱如图2所示。

M1、M2-核酸分子量marker;1~2-Xho I、Not I双酶切T-hLYZ;3~4-Xho I、Not I双酶切pPICZαA-pARS;
图1 酶切体系电泳图
Fig.1 Electrophoresis of digestion system

图2 pPICZαA-hLYZ-pARS质粒图谱
Fig.2 The vector map of pPICZαA-hLYZ-pARS
2.2 重组载体在毕赤酵母X33的电转化及筛选
重组表达载体pPICZαA-hLYZ-pARS电转至毕赤酵母X33后以游离形态存在于酵母中。在含zeocin(100 μg/mL)的YPDS平板上筛选长势较好的转化子进行菌落PCR,得到的阳性转化子接种于2 mL含zeocin的YPD中过夜培养,用酵母质粒小量提取试剂盒提取游离质粒后利用pPICZαA通用引物扩增目的片段,由图3的鉴定结果可证明基因被成功转入毕赤酵母中且重组载体为游离型。
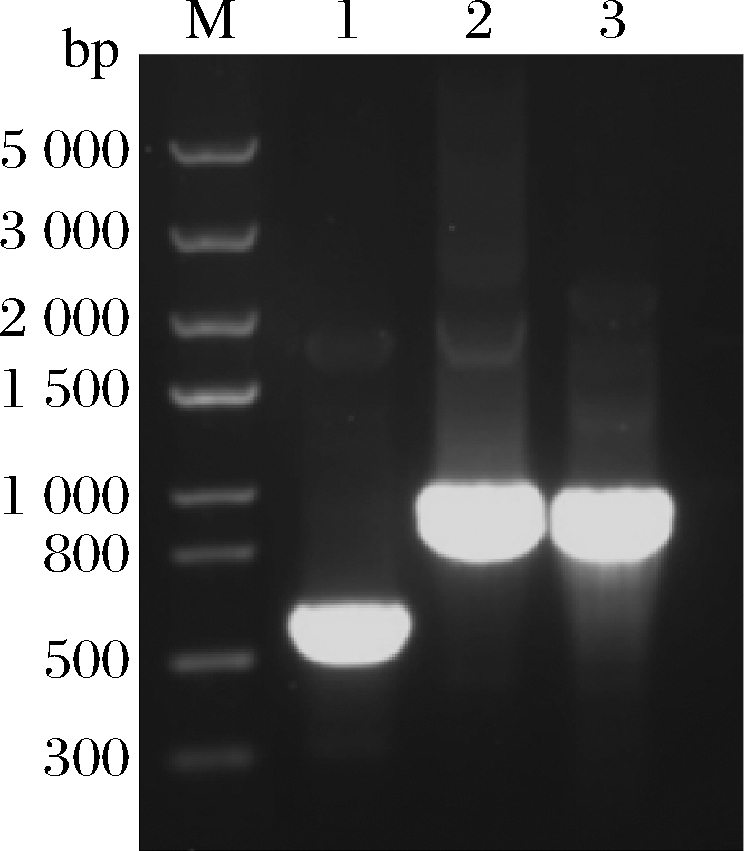
M-核酸分子量marker;1-转入pPICZαA的X33菌落PCR;2~3-转入pPICZαA-hLYZ-pARS的X33质粒PCR
图3 pPICZαA-hLYZ-pARS游离质粒PCR验证电泳图
Fig.3 Verification of episomal vector of pPICZαA-hLYZ-pARS in X33 transformants
2.3 蛋白电泳及Western Blot检测
取重组酵母72 h摇瓶诱导表达上清浓缩液做电泳鉴定,同时以转入空载体pPICZαA毕赤酵母诱导上清浓缩液作为负对照,进行SDS-PAGE分析。蛋白电泳结束后湿转法转PVDF膜,进行Western Blot鉴定,结果如图4所示。
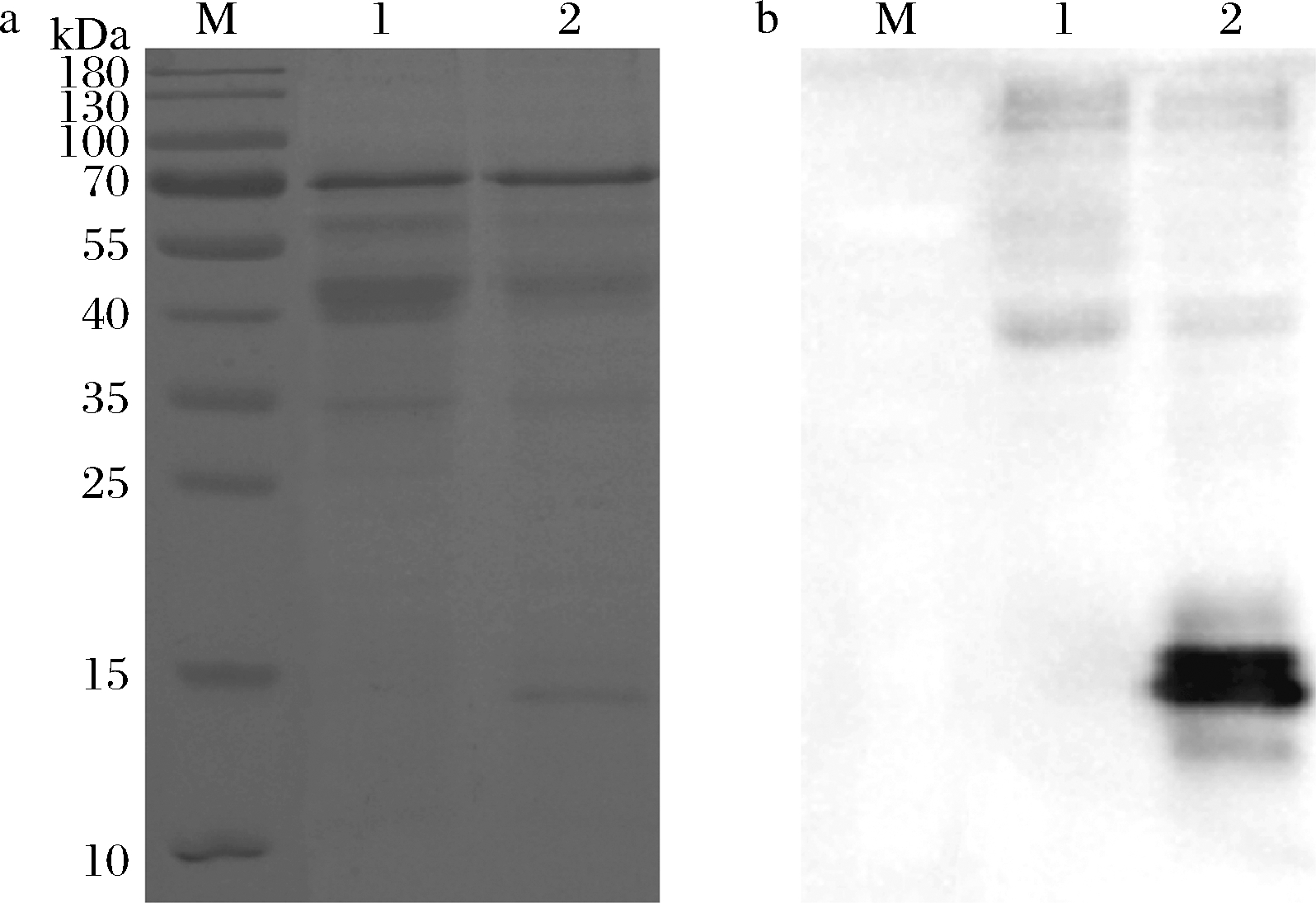
M-蛋白分子量marker;1-空载体;2-pPICZαA-hLYZ-pARSa-SDS-PAGE图;b-Western Blot图
图4 重组酵母表达人溶菌酶的SDS-PAGE图及Western Blot鉴定
Fig.4 SDS-PAGE and Western Blot of recombinant yeast expressing human lysozyme
2.4 人溶菌酶的酶活性检测
经比浊法分别对重组酵母发酵0、12、24、36、48、60、72 h的上清液进行酶活性测定,同时以转入空载体的酵母发酵液作为负对照。经过公式计算酶活性,结果如图5所示,证明重组人溶菌酶具有生物活性,酶活性最高在发酵72 h,可达340 U/mL。
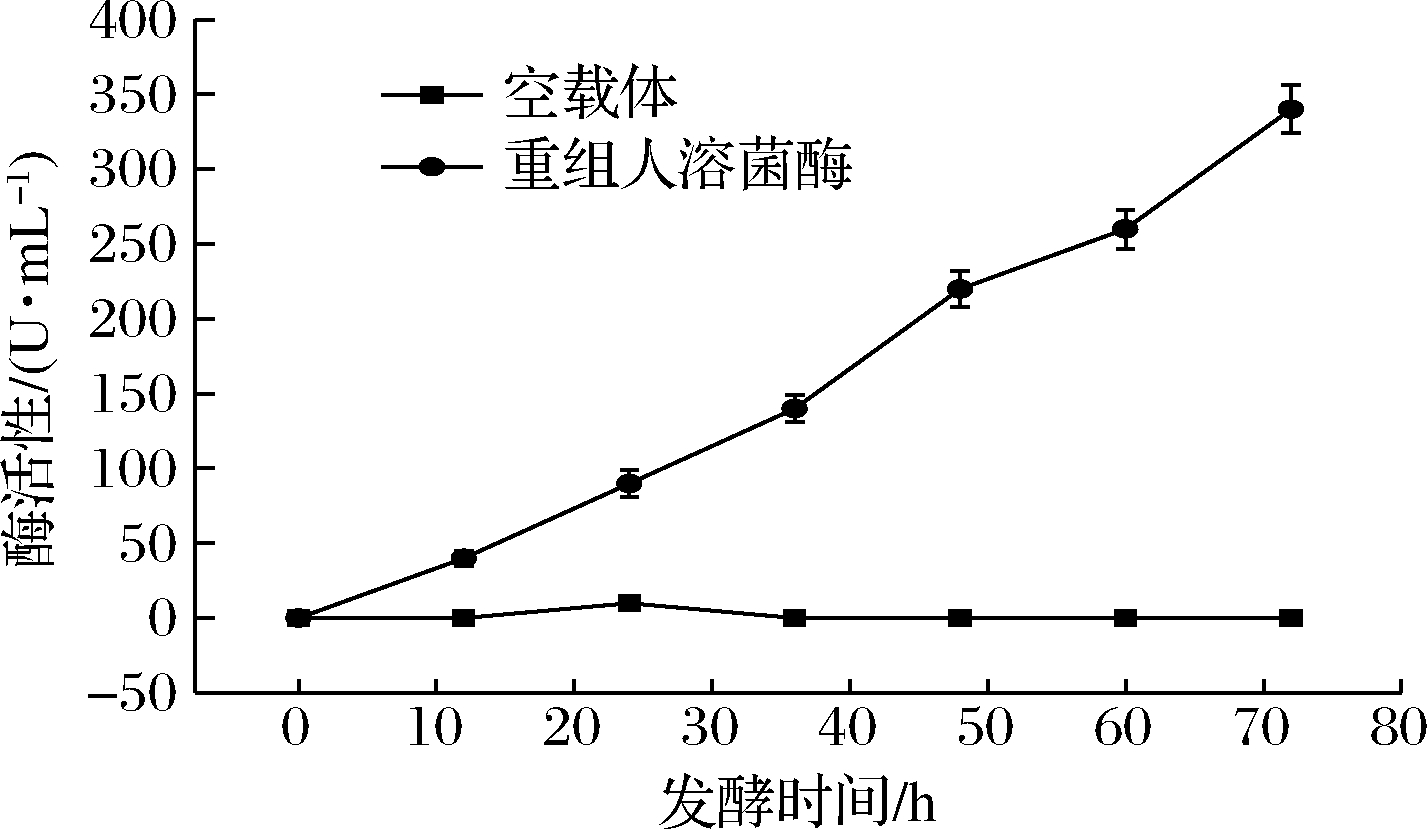
图5 重组人溶菌酶的酶活性测定
Fig.5 Determination of recombinant human lysozyme activity
2.5 人溶菌酶的纯化、活性检测及浓度测定
在0.6 mol/L咪唑条件下,重组人溶菌酶被洗脱出来,SDS-PAGE蛋白电泳结果如图6所示,在14.7 kDa 左右有条带,与人溶菌酶理论分子质量大小一致。纯化后的人溶菌酶经比浊法测定后,酶活性可达到1 070 U/mL。利用BCA法,并以BSA为标品绘制标准曲线,经562 nm处样品吸光度值计算所得人溶菌酶蛋白质量浓度为0.954 mg/mL。
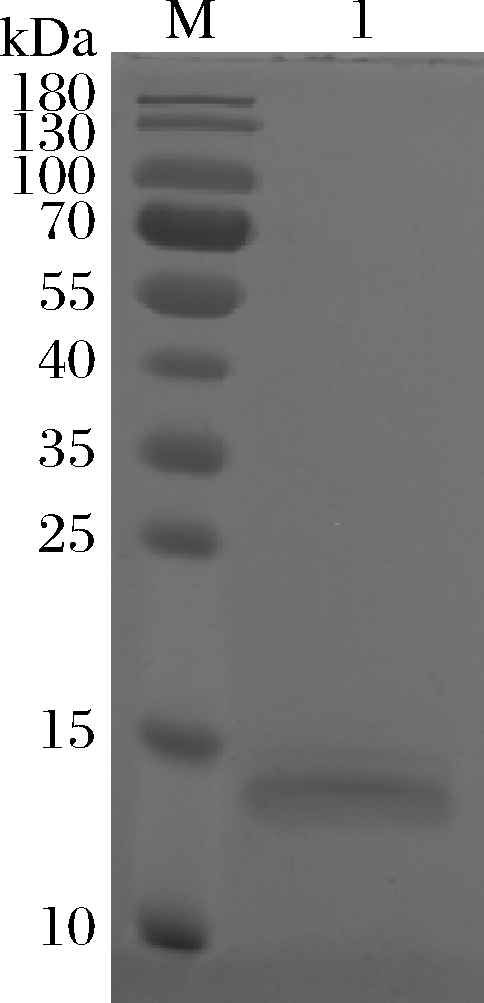
M-蛋白分子量marker;1-纯化后的重组人溶菌酶
图6 重组人溶菌酶纯化后SDS-PAGE结果
Fig.6 SDS-PAGE results of recombinant human lysozyme after purification
3 结论与讨论
研究显示,来自乳酸克鲁维酵母的pARS序列可成功用于构建毕赤酵母质粒,CAMATTARI等[20]利用pARS序列构建的游离质粒能在毕赤酵母中自主复制,且稳定性达到97%;谷洋[22]比较了5种ARSs(来自毕赤酵母的PARS1、PpARS2、mitoARS,来自酿酒酵母的ScARS和来自乳酸克鲁维酵母的pARS)作为复制子时,对质粒转化效率、质粒拷贝数及稳定性的影响,其中pARS稳定性和拷贝数最高。
人溶菌酶在毕赤酵母中表达多为整合型,很少利用游离型,这是因为游离型质粒不能自主复制且极不稳定,但整合型质粒会以1%~10%的概率通过同源重组插入酵母染色体中产生多拷贝子,对突变文库筛选产生干扰。添加自主复制序列的游离质粒,改善了以往普遍游离质粒的缺点,能够在细胞中自主复制、稳定传代。本研究将乳酸克鲁维酵母中的自主复制序列(pARS)与酵母整合型分泌表达载体pPICZαA连接,构建得到游离型表达载体pPICZαA-pARS,电转至毕赤酵母表达菌株X33中。经甲醇诱导72 h,比浊法测得发酵上清液酶活性可达340 U/mL。发酵上清液浓缩纯化后经SDS-PAGE和Western Blot分析,在14.7 kDa有目的条带。虽然游离型重组酵母表达人溶菌酶活性不如整合型高,但游离型重组载体适用于基因突变文库的构建和筛选,不受多拷贝子的影响,可以利用高通量筛选方法筛选出杀菌作用效果更加明显的溶菌酶突变体,为改造开发新型广谱人溶菌酶奠定了基础。
[1] 李红, 易建中, 刘成倩, 等.简述溶菌酶的研究现状[J].国外畜牧学(猪与禽), 2016, 36(6):99-101.
LI H, YI J Z, LIU C Q, et al.The research status of lysozyme[J].Animal Science Abroad (Pigs and Poultry), 2016, 36(6):99-101.
[2] SALAZAR O, ASENJO J A.Enzymatic Lysis of microbial cells[J].Biotechnology Letters, 2007, 29(7):985-994.
[3] 俞其林, 励建荣.溶菌酶及其应用[J].农产品加工, 2007(8):78-80;84.
YU Q L, LI J R.Lysozyme (EC3.2.1.17) and it′s application[J].Academic Periodical of Farm Products Processing, 2007(8):78-80;84.
[4] SAURABH S, SAHOO P.Lysozyme:An important defence molecule of fish innate immune system[J].Aquaculture Research, 2008, 39(3):223-239.
[5] RUBIO C A. The natural antimicrobial enzyme lysozyme is up-regulated in gastrointestinal inflammatory conditions[J].Pathogens, 2014, 3(1):73-92.
[6] 庞恋苏, 李亚男.重组人溶菌酶的研究进展[J].中华老年口腔医学杂志, 2017, 15(5):306-309.
PANG L S, LI Y N.Research progress of recombinant human lysozyme[J].Chinese Journal of Geriatric Dentistry, 2017, 15(5):306-309.
[7] 梁爱华, 大野尚仁, 宿前利郎.鸡蛋清溶菌酶与β-内酰胺类抗生素联合应用对大肠埃希氏菌生物特性的影响[J].中国抗生素杂志, 2001, 26(5):371-374.
LIANG A H, DAYE S R, SUQIAN L L.Effects of egg white lysozyme combined with β-lactam antibiotics on biological characteristics of Escherichia coli O111:B4[J].Chinese Journal of Antibiotics, 2001, 26(5):371-374.
[8] ZHENG Y, LIU Z Q, WANG L L, et al.A novel tumor necrosis factor in the Pacific oyster Crassostrea gigas mediates the antibacterial response by triggering the synthesis of lysozyme and nitric oxide[J].Fish and Shellfish Immunology, 2020, 98:334-341.
[9] LONG Y R, LIN S, ZHU J T, et al.Effects of dietary lysozyme levels on growth performance, intestinal morphology, non-specific immunity and mRNA expression in weanling piglets[J].Animal Science Journal, 2016, 87(3):411-418.
[10] 李智高, 毛永杨, 苏涛, 等.新型微生物源天然食品防腐剂的抑菌效果分析[J].食品安全导刊, 2018(36):79.
LI Z G, MAO Y Y, SU T, et al.Antimicrobial effect of natural food preservatives derived from new microorganism[J].Food Safety Guide, 2018(36):79.
[11] 吕玉涛. 几种天然生物防腐剂及其在化妆品中的应用现状[J].现代盐化工, 2019, 46(4):74-75+101.
LYU Y T.Several natural biological preservatives and their application in cosmetics[J].Modern Salt and Chemical Industry, 2019, 46(4):74-75;101.
[12] 王飒爽, 陈海宝, 武嘉平, 等.绿色添加剂溶菌酶在畜禽生产中的应用研究进展[J].饲料研究, 2020, 43(5):142-145.
WANG S S, CHEN H B, WU J P, et al.Research advances in application of green additives lysozyme in livestock and poultry production[J].Feed Research, 2020, 43(5):142-145.
[13] HUANG Z F, LU J, YE Y L, et al.Effects of dietary Chinese herbal medicines mixture on growth performance, digestive enzyme activity and serum biochemical parameters of European eel, Anguilla anguilla[J].Aquaculture Reports, 2020, 18:100510.
[14] ZHAO H, TANG J Y, CAO L, et al.Characterization of bioactive recombinant antimicrobial peptide parasin I fused with human lysozyme expressed in the yeast Pichia pastoris system[J].Enzyme and Microbial Technology, 2015, 77:61-67.
[15] 温赛, 刘怀然, 续丹丹.溶菌酶及其分子改造研究进展[J].中国生物工程杂志, 2015, 35(8):116-125.
WEN S, LIU H R, XU D D.Advances in research on lysozyme and strategies for new antimicrobial activity[J].China Biotechnology, 2015, 35(8):116-125.
[16] ÇELIK E, ÇALIK P.Production of recombinant proteins by yeast cells[J].Biotechnology Advances, 2012, 30(5):1 108-1 118.
[17] HOUARD S,HEINDERYCKX M,BOLLEN A.Engineering of non-conventional yeasts for efficient synthesis of macromolecules:The methylotrophic genera[J].Biochimie, 2002, 84(11):1 089-1 093.
[18] CLARE J J, RAYMENT F B, BALLANTINE S P, et al.High-level expression of tetanus toxin fragment C in Pichia pastoris strains containing multiple tandem integrations of the gene[J].Bio/Technology, 1991, 9(5):455-460.
[19] LIACHKO I, DUNHAM M J.An autonomously replicating sequence for use in a wide range of budding yeasts[J].FEMS Yeast Research, 2014, 14(2):364-367.
[20] CAMATTARI A, GOH A, YIP L Y, et al.Characterization of a panARS-based episomal vector in the methylotrophic yeast Pichia pastoris for recombinant protein production and synthetic biology applications[J].Microbial Cell Factories, 2016, 15(1):139.
[21] 李晓颖, 高恩, 杨金芳, 等.重组人溶菌酶活性检测方法研究[J].中国新药杂志, 2019, 28(9):1 070-1 074.
LI X Y, GAO E, YANG J F, et al.The study for activity detection method of recombinant human lysozyme [J].Chinese Journal of New Drugs, 2019, 28(9):1 070-1 074.
[22] 谷洋. 毕赤氏酵母中高效表达人血清白蛋白及基因编辑新技术的研究[D].杭州:浙江大学, 2019.
GU Y.Efficient production of human serum albumin and novel genome editing technology in Pichia pastoris [D].Hangzhou:Zhejiang University, 2019.