灵芝(Ganoderma lucidum)是隶属于担子菌亚门、灵芝菌科、灵芝属[1]的食药用真菌。灵芝中含有蛋白质、多糖、三萜等活性物质,多糖是其最主要的活性物质之一,具有抗肿瘤、抗氧化和降血糖[2]等作用,可用于食品[3-4]和医疗[5-7]等多个行业。
灵芝多糖的合成过程与细菌类似,可总结为核苷酸糖(糖供体)的合成,糖链的连接和多糖的胞外输出(涉及胞外多糖)。多糖合成途径中的酶种类丰富,已有研究证明了糖供体合成途径中的酶对多糖合成的调控作用。例如,过表达磷酸葡萄糖变位酶[8],可使灵芝胞内外多糖产量分别提高9.1%和39.2%;此外,过表达半乳糖激酶和尿苷二磷酸(uridine diphosphate,UDP)-葡萄糖焦磷酸化酶[9],使蛹虫草多糖产量分别提高了28.57%和21.43%。然而,关于食药用真菌中参与糖链连接的糖基转移酶研究报道较少。糖基转移酶是多糖合成中的关键酶,负责许多结构复杂的化合物的生物合成[10],可催化糖供体和受体以特定的键连接。国内外对细菌多糖合成中的糖基转移酶的研究已较为成熟,细菌O-多糖生物合成的起始底物为GalNAc-PP-Und,李磊[11]经化学合成该底物后,使用相关糖基转移酶实现了“RU-PP-Und”的顺序合成。LAMOTHE等[12]研究发现,德氏乳杆菌的epsE基因编码一种磷酸-葡萄糖基转移酶,可启动胞外多糖的生物合成。这些也为食药用真菌中糖链合成的研究提供了参考。
尽管灵芝多糖合成中糖供体的合成途径已较为清晰,但对于灵芝多糖合成中另一个重要环节——糖链连接的认识仍不清晰。本课题组通过对灵芝进行全基因组序列注释和全基因组转录水平分析,挖掘得到了一系列参与糖链延伸的糖基转移酶[13]。针对其中一个葡萄糖基转移酶GL24971展开了进一步的研究,发现其功能为以UDP-葡萄糖为供体,催化葡聚糖链延伸。因此本研究以GL24971为研究对象,初步探究它对灵芝多糖合成的影响。通过该研究可进一步完善灵芝多糖的合成途径,为针对大型真菌使用分子生物学手段提高多糖产量提供思路;同时也为探究灵芝多糖合成中其他的糖基转移酶的作用机制提供参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株、质粒和培养基
灵芝菌株Ganoderma lucidum 5.26,中国普通微生物菌种保藏中心(China General Microbiological Culture Collection Center,CGMCC);大肠杆菌BL21(DE3)、克隆质粒PMD19T(Simple)、质粒pAN7-1、质粒p1300-1,本实验室保存;实验中所用的gpdi启动子,Tsdh终止子均从灵芝基因组DNA克隆获得。
灵芝发酵培养基(g/L):无氨基酵母氮源(yeast nitrogen base without amino acids,YNB)5.0,蛋白胨5.0,KH2PO4 4.5,MgSO4·7H2O 2.0,葡萄糖20.0;
CYM培养基:麦芽糖10.0 g/L,蛋白胨2.0 g/L,酵母粉2.0 g/L,KH2PO4 4.6 g/L,MgSO4·7H2O 0.5 g/L,葡萄糖20.0 g/L,甘露醇0.6 mol/L;
丝状真菌通用培养基(g/L):蛋白胨10.0,酵母粉5.0,KH2PO4 1.0,MgSO4·7H2O 1.0,维生素B1 0.1,葡萄糖20.0。
1.1.2 主要试剂和仪器
YNB、潮霉素、维生素B1,上海源叶生物科技有限公司;Biospin 多糖多酚植物总RNA提取试剂盒(无DNA残留型),杭州博日科技股份有限公司;ClonExpress® MultiS One Step Cloning Kit、HiScript® Ⅲ 1 st Strand cDNA Synthesis Kit(+gDNA wiper)、ChamQ Universal SYBR qPCR Master Mix,南京诺唯赞生物科技股份有限公司;Nikon SMZ25显微镜,南京斯高谱仪器有限公司;TCS SP8激光共聚焦显微镜,德国徕卡公司;qTOWER3G实时荧光定量基因扩增仪,美国Bio-Rad公司;酶标仪,美国TECAN公司;GC-2030AF气相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 灵芝糖基转移酶基因GL24971的扩增
提取灵芝的RNA并将其反转录为cDNA,以灵芝cDNA为模板,设计引物,扩增得到糖基转移酶基因GL24971。
1.2.2 重组质粒的构建及转化
为构建潮霉素表达盒gpdi-hmb-Tsdh,从质粒pAN7-1上克隆得到潮霉素抗性基因hmb,将启动子gpdi,潮霉素抗性表达框hmb及终止子Tsdh连接到质粒PMD19T,获得重组质粒exp-Hmb。
为构建糖基转移酶表达盒gpdi-GL24971-eGFP-CaMV,从质粒p1300-1上克隆获得增强型绿色荧光蛋白eGFP和终止子CaMV,将启动子gpdi,基因GL24971,eGFP及终止子CaMV连接到在EcoR V单克隆位点线性化的质粒exp-Hmb,获得重组质粒exp-GL24971-eGFP。
从斜面培养基中接种灵芝到灵芝发酵培养基中,于30 ℃,150 r/min条件下培养7 d后,转接到新的灵芝发酵培养基中,25 ℃静置培养4 d。
灵芝原生质体的制备及其转化参照文献[14]进行。静置培养后的灵芝菌丝转入灭菌的50 mL离心管,4 ℃,6 500 r/min离心5 min,去上清液;加适量无菌水和0.6 mol/L甘露醇洗涤菌体,离心去上清液,余少量液体分装至提前称重5 mL离心管,每管用0.6 mol/L甘露醇补足3 mL,室温,10 000 r/min离心10 min后去上清液,称湿菌体质量,加入溶壁酶与蜗牛酶,振荡打散,置于30 ℃,150 r/min酶解2.5 h后过滤,滤液分装在1.5 mL离心管中,4 ℃,3 500 r/min离心10 min去上清液,加入1 mL预冷的无菌PTC缓冲液,重悬沉淀,离心去上清液,吸取适量PTC缓冲液补足200 μL,重悬沉淀,取10 μL原生质体用于显微镜观察,余下原生质体加入PTC缓冲液补足200 μL。取未加待转化质粒的原生质体涂至未添加潮霉素的CYM固体平板用于复生,剩余的原生质体用于转化:加入10 μg待转化质粒,混匀,冰上静置10 min;加入200 μL 聚乙二醇(polyethylene glycol,PEG)缓冲液,混匀,冰上静置10 min,重复1次;最后加入800 μL PEG缓冲液,混匀,30 ℃培养箱中静置30 min。室温,4 000 r/min离心10 min,去上清液,加入1 mL的CYM液体培养基,混匀,25 ℃后培养2 d后涂至含80 mg/mL潮霉素的CYM固体平板。
1.2.3 转化菌株的培养
将转化平板上菌落接种到新的丝状真菌通用培养基固体平板上,拍照记录其生长状况;挑取菌丝制片并使用激光共聚焦显微镜观察菌丝中是否有绿色荧光。
将转化菌株接种至灵芝发酵培养基中液体培养,30 ℃,150 r/min培养14 d后,转接至新的灵芝发酵培养基中,30 ℃,150 r/min培养5~8 d,发酵结束后离心获得菌体,用去离子水冲洗3次后在真空冷冻干燥机中冻干,获得干燥菌体,测定菌体干重作为其生物量,拍照记录菌球形态。
1.2.4 相对转录水平分析
将液态发酵7 d的新鲜菌体用去离子水冲洗3次,挤干菌球内水分,根据说明书提取灵芝RNA,将其反转录为cDNA后,经实时荧光定量PCR检测分析基因相对转录水平。
1.2.5 胞内外多糖测定及单糖组分分析
胞外多糖测定:参照苯酚-硫酸法[15]。通过离心分离菌丝体和发酵液,取1 mL发酵液,加入3 mL无水乙醇,混匀后4 ℃过夜,10 000 r/min离心5 min,去上清液,用75%乙醇洗涤沉淀,去上清液,晾干残留乙醇,加入4 mL水复溶沉淀,10 000 r/min离心5 min,取2 mL上清液液作为待测样品。
胞内多糖测定:将冻干后的菌体研磨成粉末,称取20~30 mg冻干的菌体粉末,加入4 mL水,沸水煮3 h后10 000 r/min离心5 min,取1 mL上清液液加入3 mL无水乙醇,后续同胞外多糖测定方法。
单糖组分分析参照文献[16]进行。离心分离菌丝体和发酵液,取适量发酵液加入3倍体积无水乙醇,混匀后4 ℃过夜,离心去上清液,沉淀用75%乙醇洗涤3次后,加适量去离子水复溶,液体冻干后得到胞外粗多糖;称取适量菌粉后加水煮沸3 h,离心后获得上清液,加入3倍体积无水乙醇,后续操作同胞外粗多糖,最后获得胞内粗多糖。取适量冻干的多糖加入2 mL 1 mol/L的硫酸,105 ℃水解8 h,冷却后加BaCO3中和至中性,10 000 r/min离心10 min后取上清液,水洗沉淀2次,合并上清液,加1 mg肌醇作内标,冻干后即为水解单糖;称取冻干的水解单糖加20 mg/mL的溶于吡啶的盐酸羟胺0.5 mL,90 ℃反应30 min,冷却后加0.5 mL乙酸酐,90 ℃反应30 min,样品冷却后离心取上清液,送样进行分析。
1.2.6 细胞壁组成成分测定
真菌细胞壁的主要成分为几丁质和β-葡聚糖[17],为分析过表达葡萄糖基转移酶GL24971对细胞壁造成的影响,测定了这2种成分是否发生变化。
β-1,3-葡聚糖的测定参考苯胺蓝荧光检测法[18]。称取40~50 mg冻干菌体,加2 mL 1 mol/L NaOH,52 ℃水浴30 min,10 000 r/min离心10 min,取0.5 mL上清液作为待测样品,加入1.85 mL苯胺蓝混合液,52 ℃水浴30 min,取样品于405 nm、460 nm的条件下检测其荧光值。β-1,3-葡聚糖含量表示为单位菌体的相对荧光百分比。
几丁质测定参考文献[19-20]的方法。称取40~50 mg冻干菌体,加入3 mL饱和KOH溶液,130 ℃反应1 h,冷却后加入预冷的75%乙醇8 mL,振荡悬浮,冰浴15 min;加入0.9 mL质量分数为13.3% 硅藻土 54 s,振荡悬浮,4 ℃,10 000 r/min离心5 min;使用10 mL预冷的40%乙醇和去离子水冲洗沉淀,离心去上清液,加入30 mL去离子水,混合均匀,取0.5 mL作为待测样品。将0.5 mL水、5% NaNO2、5% KH2PO4加入0.5 mL样品中,混匀,10 000 r/min离心10 min,取0.5 mL样品,加入0.5 mL 质量分数为12.5%的氨基磺酸铵,振荡5 min;加入0.5 mL质量浓度为5 mg/mL的3-甲基-2-苯并噻唑酮腙盐酸盐水合物,混合后沸水加热3 min;冷却后加入0.5 mL质量分数为0.83%的FeCl3,室温静置30 min,检测650 nm处的吸光值。
2 结果与分析
2.1 目的基因的扩增及重组质粒的构建
以灵芝cDNA为模板,扩增得到葡萄糖基转移酶基因GL24971,结果如图1-a所示,基因片段GL24971的条带位置与理论大小一致,为2 229 bp,图1-b为重组过表达质粒exp-GL24971-eGFP,可用于转化至灵芝原生质体。
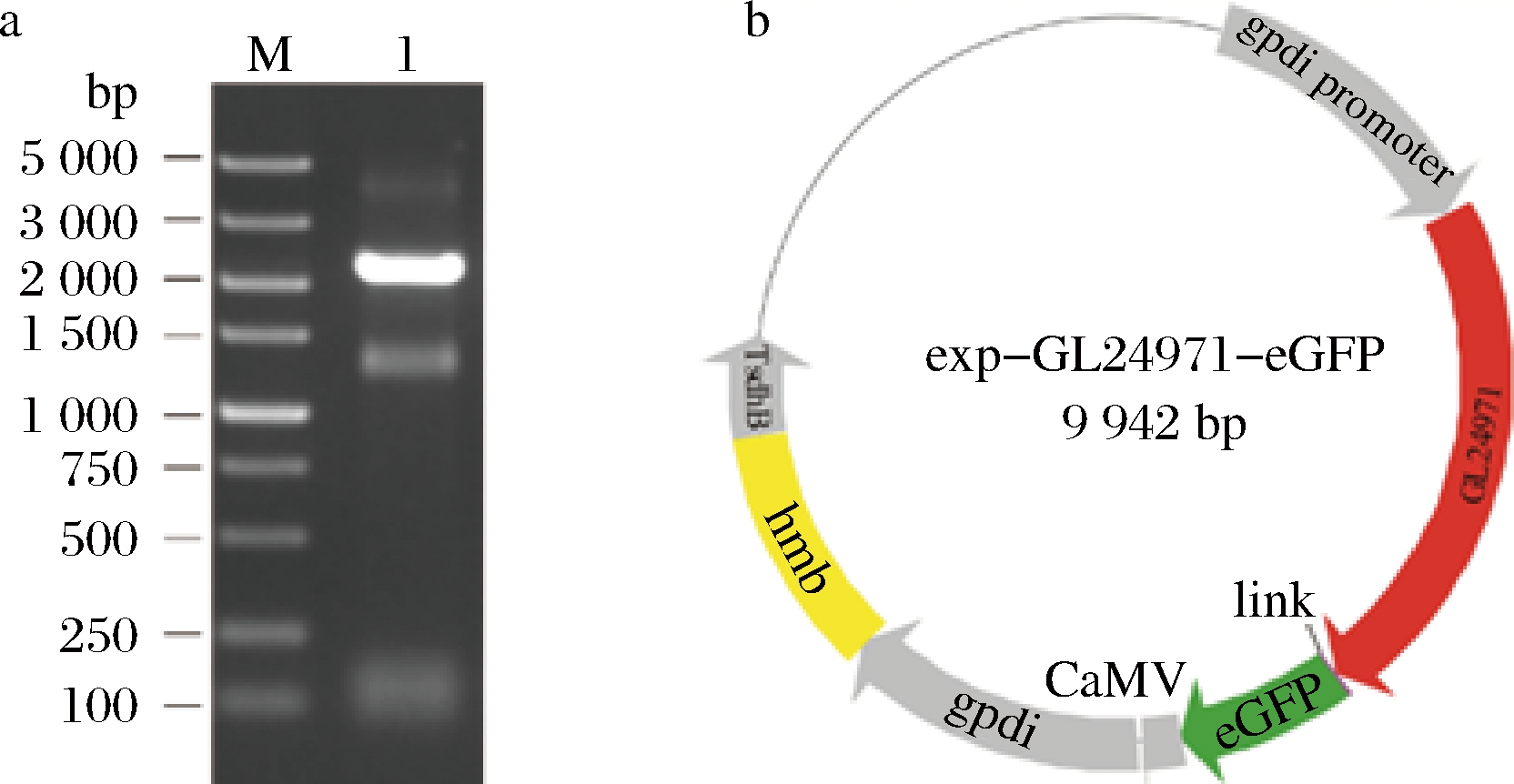
a-GL24971基因扩增结果;b-重组质粒图谱
M-DNA Marker;1-GL24971
图1 重组质粒的构建
Fig.1 Construction of recombinant plasmid
2.2 重组质粒转化至灵芝原生质体
通过PEG转化法,将构建成功的重组质粒exp-GL24971-eGFP转化至灵芝原生质体,以未转化重组质粒的原生质体为对照。原生质体复生板和转化板出现菌落(图2-a),说明原生质体制备成功;在激光共聚焦显微镜下观察到转化菌株的菌丝体中有绿色荧光(图2-b),说明表达融合蛋白GL24971-eGFP的重组质粒成功转入原生质体,且融合蛋白成功表达并分布于胞质。挑取30株重组菌,接种于含有潮霉素的丝状真菌通用培养基固体平板上传代,挑选能够稳定遗传的菌株,进行转录水平分析。
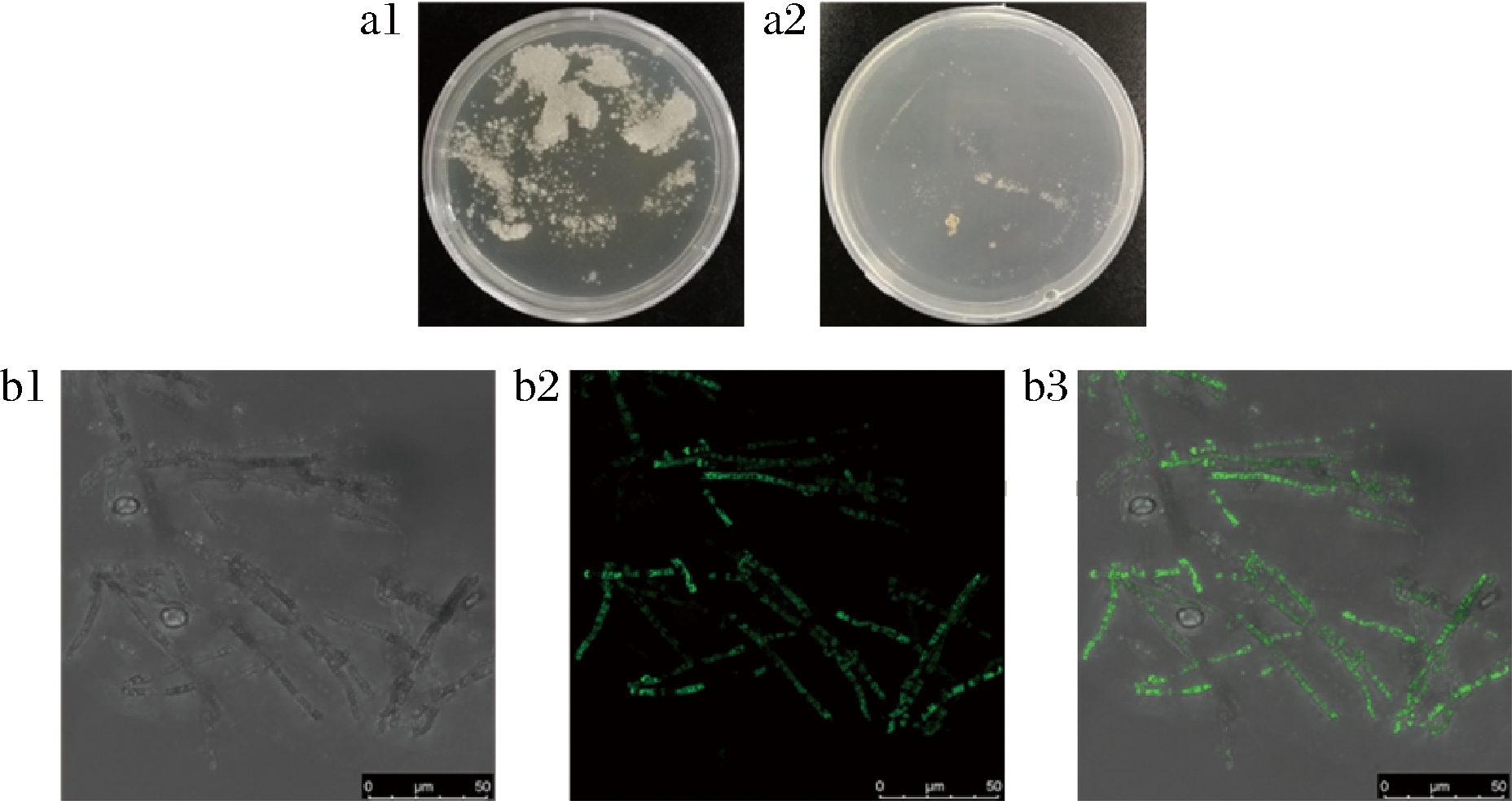
a-转化菌株菌落状态:a1-原生质体复生;a2-转化板;
b-荧光验证:b1-明场;b2-荧光场;b3-叠加场
图2 重组质粒转化及融合蛋白表达
Fig.2 Transformation of recombinant plasmid and expression of fusion protein
2.3 转录水平分析
将9株可稳定遗传的转化菌株液态培养7 d后,收集新鲜样品,提取灵芝RNA,以原始菌株为对照,测定葡萄糖基转移酶GL24971的转录水平,结果如图3所示,其中转化菌株T1与T2的相对转录水平分别提高了124.5%与210.7%,因此后续实验进一步针对这2株转化子展开研究。

图3 转化菌株相对转录水平分析
Fig.3 Analysis of relative transcription level
注:不同的小写字母表示组间差异显著(P<0.05)(下同)
2.4 转化菌株的培养
将转化菌株T1与T2在平板培养后拍照记录其生长状况。转化菌株在无抗板上生长较快,在含抗生素的平板上的生长受到抑制。在含抗生素的平板中,T1与T2在培养到第7天时,T2可以观察到明显的菌丝生长,而T1此时还未观察到菌丝(图4-a~4-d),可能是T2转录水平高于T1,使得抗性能更快更多的积累,导致菌落生长情况产生差异。
T1与T2液体发酵5~8 d后测定其生物量和菌球形态。由图4-e可知,T1与T2的最大生物量分别为3.31与4.16 mg/mL,相比于原始菌株在第8天时的生物量6.65 mg/mL,分别降低了50.2%与37.5%。观察菌球形态发现,原始菌株菌球形态不规则,呈絮状且较松散,表面粗糙,而T1与T2菌球紧实,基本为球形且表面较光滑(图4-f~4-h)。

a-T1(抗生素平板);b-T1(无抗平板);c-T2(抗生素平板);d-T2(无抗平板);e-菌株生物量;f-原始菌株形态;g-转化菌株T1形态;h-转化菌株T2形态
图4 转化菌株生长情况
Fig.4 Growth of transformed strains
2.5 胞内外多糖及单糖组分测定
转化菌株发酵到第5天时开始测定胞内外多糖产量。结果显示,T1与T2的单位菌体胞外多糖最大产量分别为0.07与0.06 mg/mg(图5-a),分别提高了132.4%与70.0%,胞内多糖产量均为0.03 mg/mg,分别降低了10.7%与37.4%(图5-b)。
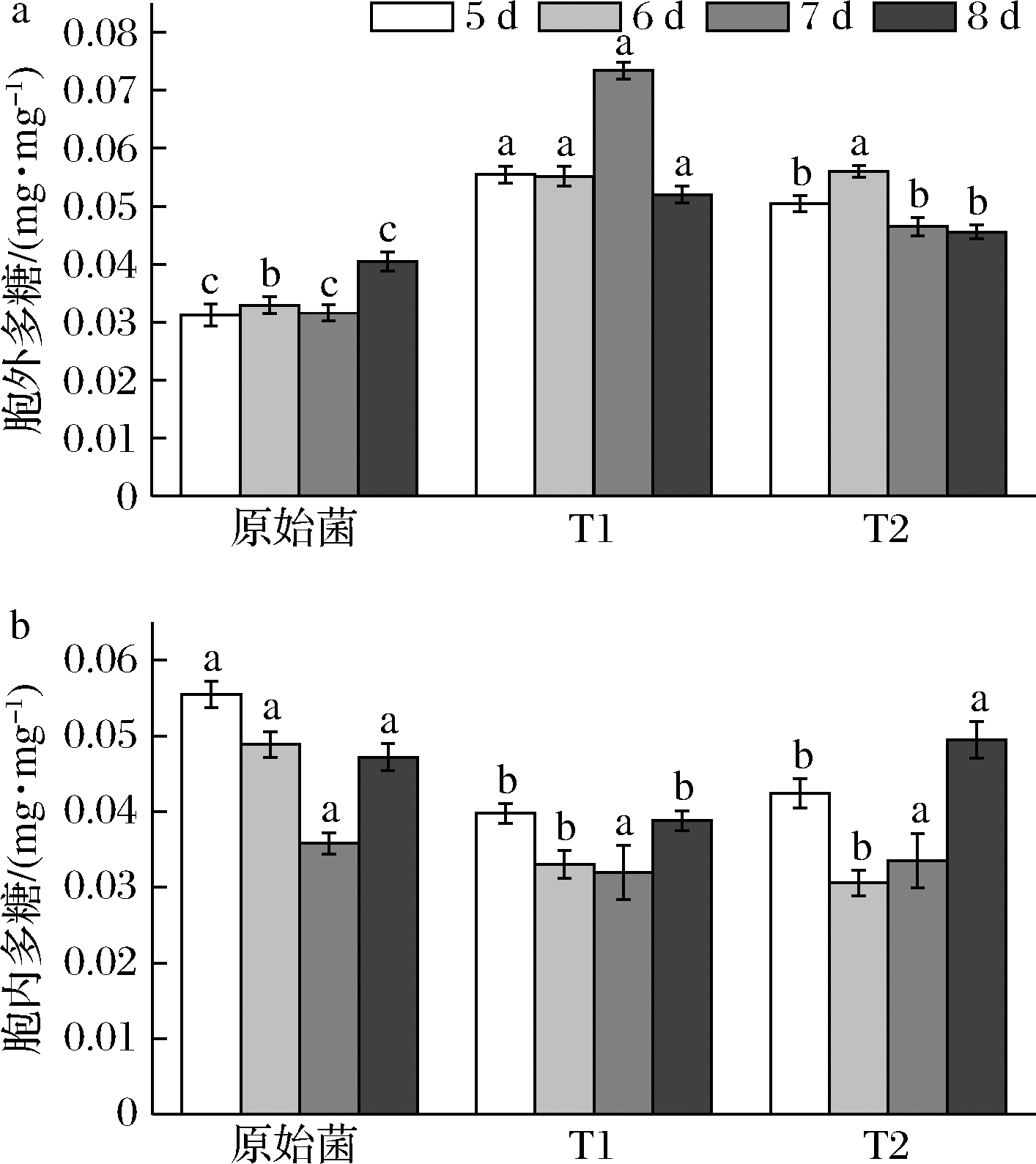
a-胞外多糖;b-胞内多糖
图5 多糖产量
Fig.5 Production of polysaccharides
为分析过表达GL24971对多糖中单糖组分的影响,测定了胞内外粗多糖的单糖组分。表1显示,原始菌株的胞外多糖组分中含有甘露糖、葡萄糖、半乳糖,而T1与T2菌株的胞外多糖组分中葡萄糖的比例提高,且几乎未检测到半乳糖的存在。胞内多糖单糖组成结果显示(表2),在原始菌株和转化菌株的胞内多糖组分中均检测到木糖、甘露糖、葡萄糖、半乳糖,其中木糖所占比例较小,且转化菌株中半乳糖含量明显降低。葡萄糖基转移酶基因GL24971的过表达使得大量UDP-葡萄糖被合成和利用,因此多糖中葡萄糖的比例得到提高。同时,根据糖供体合成途径可知,UDP-葡萄糖可在UDP-葡萄糖4-差向异构酶的作用下被转化为UDP-半乳糖,由于UDP-葡萄糖被葡萄糖基转移酶GL24971大量消耗,使得其流向UDP-半乳糖合成的量减少,从而导致胞内外多糖中半乳糖组分的比例出现下降。
表1 胞外多糖中的单糖组成 单位:%(摩尔百分比)
Table 1 Monosaccharide composition of extracellular polysaccharides

单糖5 d6 d7 d8 dWTT1T2WTT1T2WTT1T2WTT1T2甘露糖50.3471.2755.0538.6014.2347.8845.8432.7949.2751.7157.6050.35葡萄糖35.9228.7344.9552.4085.7752.1222.2967.2146.1519.9042.4049.65半乳糖13.74--8.99--31.87-4.5828.40--
注:“-”表示不存在或百分比小于0.01%,“WT”表示原始菌株
表2 胞内多糖单中的糖组成 单位:%(摩尔百分比)
Table 2 Monosaccharide composition of intracellular polysaccharides
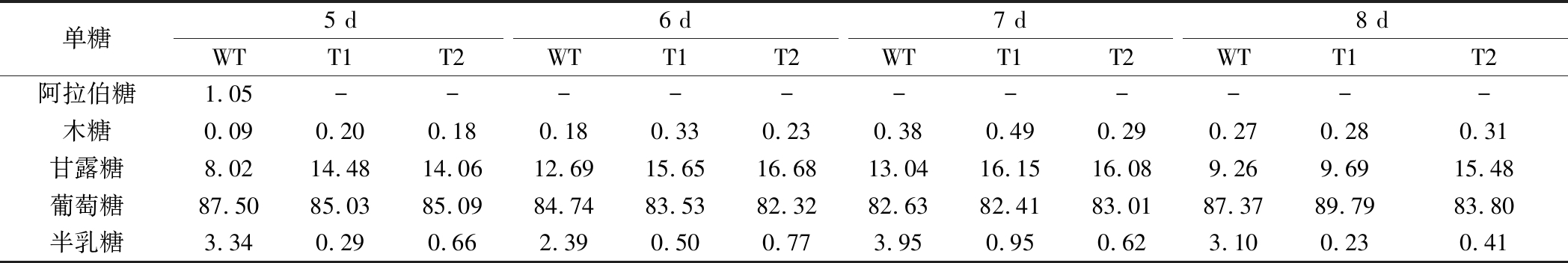
单糖5 d6 d7 d8 dWTT1T2WTT1T2WTT1T2WTT1T2阿拉伯糖1.05-----------木糖0.090.200.180.180.330.230.380.490.290.270.280.31甘露糖8.0214.4814.0612.6915.6516.6813.0416.1516.089.269.6915.48葡萄糖87.5085.0385.0984.7483.5382.3282.6382.4183.0187.3789.7983.80半乳糖3.340.290.662.390.500.773.950.950.623.100.230.41
2.6 细胞壁成分分析
几丁质和葡聚糖为灵芝细胞壁的主要成分,为分析灵芝细胞壁成分的变化,菌体中几丁质和β-1,3-葡聚糖含量测定结果见图6。菌株T1和T2的几丁质和β-1,3-葡聚糖含量均下降。β-葡聚糖作为真菌细胞壁外层的主要成分,在细胞壁的外部结构中起着重要作用,几丁质具有很高的抗张强度,有助于细胞壁的完整性[21];几丁质和β-1,3-葡聚糖含量的降低会对细胞壁的完整性造成损害[22]。因此,转化菌株的几丁质与β-1,3-葡聚糖含量的降低,影响了细胞壁的完整性,促进多糖分泌至胞外,从而提高了单位菌体胞外多糖的含量。
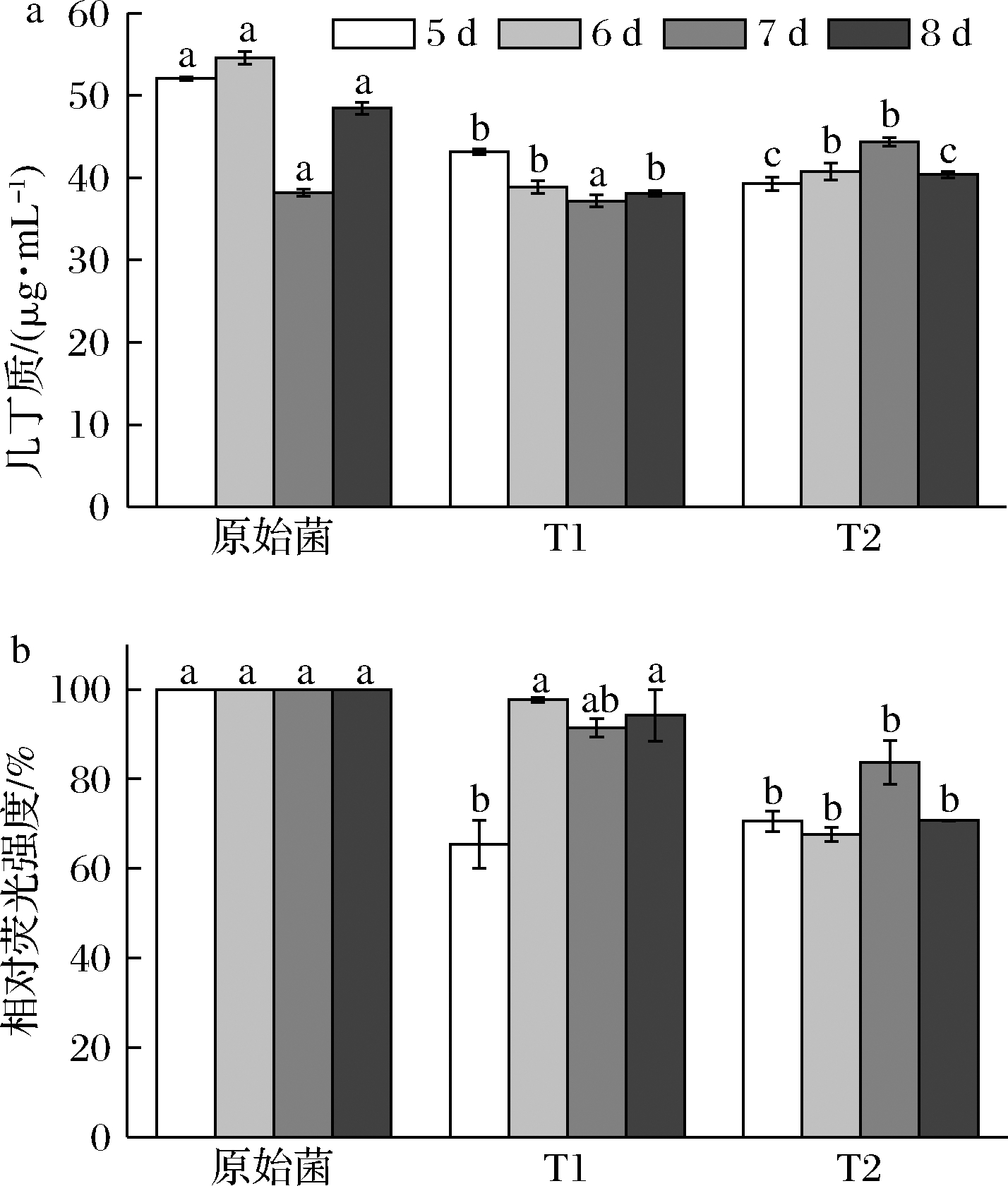
a-几丁质;b-β-1,3-葡聚糖
图6 细胞壁成分含量
Fig.6 Content of cell wall components
3 结论与讨论
在课题组前期对灵芝的全基因组序列注释和全基因组转录水平分析中,发现了转录水平上调的基因GL24971,该基因编码葡萄糖基转移酶。在灵芝中过表达该基因后,转化菌株的生物量降低了37.5%,为4.16 mg/mL;单位菌体胞外多糖最大产量可达到0.07 mg/mg,提高了132.4%;胞内多糖产量为0.03 mg/mg,降低了10.7%;在分析单糖组分后发现,过表达菌株的胞外多糖中葡萄糖比例提高且半乳糖比例基本降低到无法检出,胞内多糖中半乳糖比例显著降低,葡萄糖基转移酶GL24971的过表达使得大量UDP-葡萄糖被合成和利用,因此多糖中葡萄糖的比例得到提高。同时,根据糖供体合成途径可知,UDP-葡萄糖可在UDP-葡萄糖-4-差向异构酶的作用下转化为UDP-半乳糖,由于UDP-葡萄糖被葡萄糖基转移酶GL24971大量消耗,使得其流向UDP-半乳糖合成的量减少,从而导致胞内外多糖中半乳糖组分的比例出现下降;过表达菌株细胞壁中几丁质含量和β-1,3-葡聚糖的含量均下降,可能导致细胞壁的完整性受到损害,促使多糖更多地分泌至胞外,从而提高了单位菌体胞外多糖的产量。这些研究结果表明葡萄糖基转移酶GL24971在多糖合成和细胞形态方面都具有重要的影响,这进一步完善了灵芝多糖复杂的合成途径,也为后续研究灵芝中的糖基转移酶提供了参考。
[1] 徐锦堂.中国药用真菌学[M].北京:中国协和医科大学联合出版社,1997.
XU J T.Chinese Medicinal Mycology[M].Beijing:China Union Medical University Press,1997.
[2] 张奇茹,丁重阳,周哲敏,等.葡萄糖-1-磷酸对灵芝多糖合成的影响[J].生物加工过程,2017,15(4):9-14.
ZHANG Q R,DING Z Y,ZHOU Z M,et al.Effects of glucose-1-phosphate on the biosynthesis of Ganoderma lucidum polysaccharide[J].Chinese Journal of Bioprocess Engineering,2017,15(4):9-14.
[3] BOH B.Ganoderma lucidum:A potential for biotechnological production of anti-cancer and immunomodulatory drugs[J].Recent Patents on Anti-Cancer Drug Discovery,2013,8(3):255-287.
[4] 裴智鹏,郑雪艳,何冰芳,等.灵芝-黄芪双向发酵菌质多糖的分离纯化及生物活性研究[J].生物加工过程,2019,17(5):521-529.
PEI Z P,ZHENG X Y,HE B F,et al.Isolation,identification and immunological activity of polysaccharides from Ganoderma-Astragalus bidirectional fermentation[J].Chinese Journal of Bioprocess Engineering,2019,17(5):521-529.
[5] 谢怡琼,王琪瑞,孙思雅,等.灵芝的药理作用和临床应用研究进展[J].临床医学研究与实践,2020,5(10):191-193.
XIE Y Q,WANG Q R,SUN S Y,et al.Research progress on the pharmacological effects and clinical applications of Ganoderma lucidum[J].Clinical Research and Practice,2020,5(10):191-193.
[6] 邹玉莲,甘陈灵,李鹏.灵芝多糖现代药理学研究进展[J].海峡药学,2018,30(8):28-30.
ZOU Y L,GAN C L,LI P.Progress in modern pharmacology of Ganoderma lucidum polysaccharides[J].Strait Pharmaceutical Journal,2018,30(8):28-30.
[7] 林志彬.灵芝的临床应用研究进展(摘要)[J].食药用菌,2015,23(5):280-281.
LIN Z B.Research progress on clinical application of Ganoderma lucidum[J].Edible and Medicinal Mushrooms,2015,23(5):280-281.
[8] 李瑞勤,王琼,沈梦烨,等.α-PGM过表达对灵芝多糖发酵的影响[J].食品与生物技术学报,2019,38(11):18-24.
LI R Q,WANG Q,SHEN M Y,et al.Effects of overexpression of α-PGM on Ganoderma lucidum polysaccharide fermentation[J].Journal of Food Science and Biotechnology,2019,38(11):18-24.
[9] 徐妍.农杆菌介导蛹虫草多糖生物合成关键酶基因的克隆与表达[D].杭州:浙江工业大学,2020.
XU Y.Cloning and expression of key enzyme gene of Cordyceps militaris polysaccharide synthesis by Agrobacterium[D].Hangzhou:Zhejiang University of Technology,2020.
[10] ÜNLIGIL U M,RINI J M.Glycosyltransferase structure and mechanism[J].Current Opinion in Structural Biology,2000,10(5):510-517.
[11] 李磊.细菌多糖和糖蛋白生物合成途径及相关酶类研究[D].济南:山东大学,2010.
LI L.Studies on the biosynthesis of bacterial polysaccharides,glycoproteins and enzymes involved in the pathways[D].Jinan:Shandong University,2010.
[12] LAMOTHE G,JOLLY L,MOLLET B,et al.Genetic and biochemical characterization of exopolysaccharide biosynthesis by Lactobacillus delbrueckii subsp.bulgaricus[J].Archives of Microbiology,2002,178(3):218-228.
[13] 王琼.基于组学技术的灵芝三萜和多糖高产机制解析[D].无锡:江南大学,2020.
WANG Q.Analysis of triterpenoid and polysaccharide high yield mechanism in Ganoderma lucidum based on omics technology[D].Wuxi:Jiangnan University,2020.
[14] LOU H W,YE Z W,YU Y H,et al.The efficient genetic transformation of Cordyceps militaris by using mononuclear protoplasts[J].Scientia Horticulturae,2019,243:307-313.
[15] DUBOIS M,GILLES K,HAMILTON J K,et al.A colorimetric method for the determination of sugars[J].Nature,1951,168(4 265):167.
[16] 王琼.灵芝菌丝体培养中多糖组分的变化与相关酶活性分析[D].无锡:江南大学,2013.
WANG Q.Effect of polysacchairdes composition and the related enzymatic analysis in Ganoderma lucidum submerged culture[D].Wuxi:Jiangnan University,2013.
[17] RUIZ-HERRERA J,ORTIZ-CASTELLANOS L.Cell wall glucans of fungi.A review[J].The Cell Surface,2019,5:100022.
[18] NITSCHKE J,MODICK H,BUSCH E,et al.A new colorimetric method to quantify β-1,3-1,6-glucans in comparison with total β-1,3-glucans in edible mushrooms[J].Food Chemistry,2011,127(2):791-796.
[19] FORTWENDEL J R,JUVVADI P R,PINCHAI N,et al.Differential effects of inhibiting chitin and 1,3-β-d-glucan synthesis in ras and calcineurin mutants of Aspergillus fumigatus[J].Antimicrobial Agents and Chemotherapy,2009,53(2):476-482.
[20] MA Z B,XU M M,WANG Q,et al.Development of an efficient strategy to improve extracellular polysaccharide production of Ganoderma lucidum using L-phenylalanine as an enhancer[J].Frontiers in Microbiology,2019,10:2306.
[21] KARELIN A A,TSVETKOV Y E,NIFANTIEV N E.Synthesis of oligosaccharides related to cell wall polysaccharides of the fungi Candida and Aspergillus[J].Russian Chemical Reviews,2017,86(11):1 073-1 126.
[22] KOLL R R,REINHOLD B B,PETR
R R,REINHOLD B B,PETR KOV
KOV E,et al.Architecture of the yeast cell wall:β(1→6)-glucan interconnects mannoprotein,β(1→3)-glucan,and chitin[J].Journal of Biological Chemistry,1997,272(28):17 762-17 775.
E,et al.Architecture of the yeast cell wall:β(1→6)-glucan interconnects mannoprotein,β(1→3)-glucan,and chitin[J].Journal of Biological Chemistry,1997,272(28):17 762-17 775.