黄酒是中国民族特色的酒精饮料[1],其典型特征是越陈越香。长期贮存陈酿是生产高品质黄酒必须的工艺环节,但由于黄酒中含有丰富的糖类、氨基酸及多肽等营养物质,易造成微生物污染生长,故在陈酿过程中时常出现酸败变质现象[2-6],给黄酒产业造成严重的经济损失[7-8]。
根据黄酒酸败现象的不同,黄酒酸败主要分为醋酸酸败和乳酸酸败[9],其中乳酸酸败是造成高酒精度陈酿黄酒出现酸败现象的主要原因,而乳杆菌(Lactobacillus)是引起乳酸酸败的主要微生物。在密闭环境中、较高酒精度(18%,体积分数)条件下,乳酸酸败时常发生。刘文容等[10]首次采用未培养技术与可培养技术相结合的方法,明确了食果糖乳杆菌(L.fructivorans)和耐酸乳杆菌(L.acetotolerans)为引起陈酿黄酒发生酸败的主要微生物。章志超等[11]在确定从酸败黄酒中分离得到的酸败微生物为食果糖乳杆菌后,优化了食果糖乳杆菌的最佳培养条件:在pH值为5.4的MRS固体培养基上,加入质量分数为0.08%的L-半胱氨酸和体积分数为9%的乙醇,30 ℃下培养。但目前,对黄酒陈酿酸败微生物的生物学特征的相关研究较少,对酸败微生物的生理生化特征认识不清,缺乏控制黄酒酸败微生物的有效措施,这已成为黄酒产业发展的限制因素[12-13]。
贮存陈酿过程的微生物酸败是酒精饮料行业中普遍存在的问题。日本学者研究清酒微生物酸败现象发现,食果糖乳杆菌和同型腐酒乳杆菌(L.homohiochi)是导致清酒贮存陈酿酸败的主要微生物[14-16],这2种酸败微生物都具有很高的酒精耐受度,两者适宜生长的pH值都大约在4.5~5.0[17-18]。食果糖乳杆菌具有较好的耐热性,在巴氏灭菌结束后仍可能继续存活[19-20]。研究啤酒微生物酸败现象发现,导致啤酒酸败的主要酸败微生物是耐酸乳杆菌,这类酸败微生物具有很强的乙醇耐受性和酒花耐受性[21-22]。由于对啤酒和清酒酸败微生物生物学特征的系统研究,目前啤酒和日本清酒中都建立了针对这类酸败微生物的有效控制方法体系。
针对黄酒贮存陈酿过程中存在的酸败微生物的生物学特征认识不清的问题,本研究通过对黄酒陈酿关键酸败微生物——食果糖乳杆菌和耐酸乳杆菌的生理生化特征进行分析,包括营养需求、糖分消耗、生长温度耐受、酒精耐受等4个方面,为黄酒陈酿过程中酸败微生物的科学控制提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
菌种:食果糖乳杆菌(Lactobacillus fructivorans)和耐酸乳杆菌(Lactobacillas acetotolerans),江南大学酿造微生物与应用酶学实验室保藏;正常黄酒酒样,绍兴某黄酒厂按照传统绍兴黄酒酿造工艺酿造。
1.1.2 试剂和仪器
无水乙醇,国药集团化学试剂有限公司;甲瓦龙酸,北京百灵威科技有限公司;MRS培养基,美国Oxoid公司;厌氧培养盒、厌氧产气袋,日本三菱瓦斯化学株式会社;全波长酶标仪,Thermo公司。
1.1.3 培养基
粉末状MRS培养基:8.0 g牛肉膏,20.0 g葡萄糖,10.0 g蛋白胨,2.0 g柠檬酸三铵,0.2 g MgSO4,2.0 g K2HPO4,5.0 g乙酸钠,0.05 g MnSO4,4.0 g酵母提取物,1 mL山梨醇单油酸酯,终pH调至5.7。
添加甲瓦龙酸的MRS培养基:5.0 mg甲瓦龙酸,52.0 g粉末状MRS培养基,800~850 mL无菌水,150~200 mL无水乙醇,终pH调至5.0。
培养基灭菌条件:115 ℃灭菌20 min。
1.2 实验方法
1.2.1 黄酒关键酸败微生物理化特征分析
1.2.1.1 酸败微生物营养需求分析
本研究用生态板(Biolog-ECO)方法探究了黄酒酸败微生物的营养需求情况。首先取10 mL黄酒酸败微生物培养液(处于对数生长期),经1 000 r/min离心5 min后,将细胞沉淀置于装有接种液的10 mL通用(general purpose,GP)管中重悬混匀,再取100 μL上述重悬液转移到GP2微孔板中(GP2微孔板中有氨基酸、有机酸糖类等95种底物),最后将微孔板置于厌氧、30 ℃环境中培养72 h后,在波长为590 nm下测定吸光度,并与以水为底物的A1微孔板在相同情况下测定的吸光度作差值,得到酸败微生物对各种营养物质的吸收情况。
1.2.1.2 酸败微生物对不同含量还原糖利用情况分析
首先取未发生酸败的黄酒酒样,将酒样糖含量分别调至2、5、10 g/L,再在酒样中接种2%的酸败微生物培养液(处于对数生长期),在厌氧、30 ℃条件下培养46 d,同时在培养过程中测定黄酒中糖度和酸度的变化情况。
1.2.1.3 酸败微生物温度耐受分析
首先取未发生酸败的黄酒酒样,将酒样糖含量调至10 g/L,保证微生物可正常生长,再在黄酒酒样中接种2%的酸败微生物培养液(处于对数生长期),最后将上述酒样置于温度分别为11、20、25、30、35和40 ℃下,厌氧培养20 d后,测定不同温度下培养得到的黄酒在波长为600 nm下的吸光度,判断温度变化对黄酒酸败微生物生长产生的影响。
1.2.1.4 酸败微生物酒精耐受分析
首先在MRS-甲瓦龙酸培养基中添加无水乙醇,将各个培养基的酒精度(体积分数)分别调到14%、18%、20%、23%、25%和30%,再在培养基中接种2%的酸败微生物培养液(处于对数生长期),最后在厌氧、30 ℃条件下培养2周,测定培养基中酸败微生物数量和还原糖变化量,探究酸败微生物在不同酒精度培养基中的生长状况。根据工厂的实际生产情况,首先取未发生酸败的黄酒酒样(酒精度为14%)添加无水乙醇,将黄酒的酒精度分别调到14%、18%、20%、23%、25%和30%,再在黄酒中接种2%的黄酒酸败微生物培养液(处于对数生长期),最后在厌氧、30 ℃条件下培养2周,测定黄酒中酸败微生物数量和还原糖变化量,探究酸败微生物在不同酒精度黄酒中的生长状况。
2 结果与分析
2.1 酸败微生物营养需求特征解析
选择耐酸乳杆菌30-1、19-1-1和食果糖乳杆菌13-2、7-2进行实验,培养结束后,接种不同酸败微生物的GP2微孔板与以水为底物的A1微孔板在波长590 nm下的吸光度差值变化情况如下表1所示。
表1 酸败微生物对不同营养物质的利用情况
Table 1 The use of different nutrients by spoilage microbes
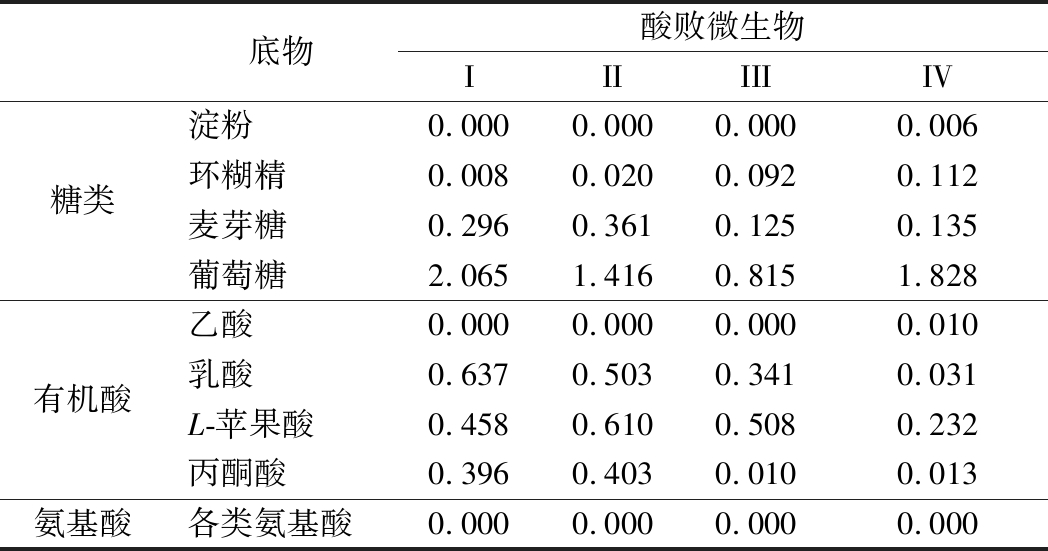
底物酸败微生物IIIIIIIV糖类淀粉0.0000.0000.0000.006环糊精0.0080.0200.0920.112麦芽糖0.2960.3610.1250.135葡萄糖2.0651.4160.8151.828有机酸乙酸0.0000.0000.0000.010乳酸0.6370.5030.3410.031L-苹果酸0.4580.6100.5080.232丙酮酸0.3960.4030.0100.013氨基酸各类氨基酸0.0000.0000.0000.000
注:I-耐酸乳杆菌30-1;II-耐酸乳杆菌19-1-1;III-食果糖乳杆菌13-2;IV-食果糖乳杆菌7-2
酸败微生物主要以糖类作为能源物质,能够消耗部分有机酸,基本不消耗氨基酸。在糖类中,酸败微生物对葡萄糖的利用能力最强,对麦芽糖的利用能力次之,可以利用少量环糊精,几乎不利用淀粉作为能源物质;在有机酸中,可以利用部分乳酸、L-苹果酸、丙酮酸,几乎不利用乙酸。耐酸乳杆菌对麦芽糖的利用能力明显高于食果糖乳杆菌,而食果糖乳杆菌对环糊精的利用能力则更强。传统黄酒中含有糖分、有机酸及氨基酸等营养物质,这些营养物质特别是糖类能够为酸败微生物的生长提供有利条件,因此可以通过控制黄酒中糖分的含量来抑制酸败微生物的生长。本研究还发现,黄酒中酸败微生物与日本清酒中的酸败微生物在营养需求上具有一定的相似性。日本清酒中的酸败微生物也是主要利用葡萄糖作为能源物质,还能够消耗丙酮酸、柠檬酸、苹果酸等有机酸作为营养物质[16]。
2.2 还原糖含量对黄酒关键酸败微生物的影响
比较黄酒酸败关键微生物在不同糖含量黄酒中糖分消耗和酸度的变化情况,如图1和图2所示。在不同糖分含量的黄酒中,2类微生物的生长趋势大体一致,黄酒的有机酸含量均随着还原糖的消耗而上升,说明2类酸败微生物代谢黄酒中的糖分生成了有机酸。糖代谢和有机酸生成曲线显示黄酒中的还原糖含量越高,酸败微生物代谢产生的有机酸含量就会越高,当黄酒中的总酸含量达到一定浓度时,就会发生酸败现象,因此可以通过调节黄酒糖度来控制黄酒中的有机酸含量,预防黄酒发生酸败。黄酒陈酿过程中酸败现象的发生和黄酒发酵过程是相似的。在黄酒发酵过程中,乳酸菌代谢糖类产生乳酸,导致黄酒中酸度上升,当酸度达到一定浓度时,黄酒就会发生酸败现象[23]。

a-还原糖含量2 g/L;b-还原糖含量5 g/L;c-还原糖含量10 g/L
图1 还原糖含量黄酒对耐酸乳杆菌30-1代谢的影响
Fig.1 The effects of reducing sugar content in Huangjiu on the metabolism of L.acetotolerans 30-1
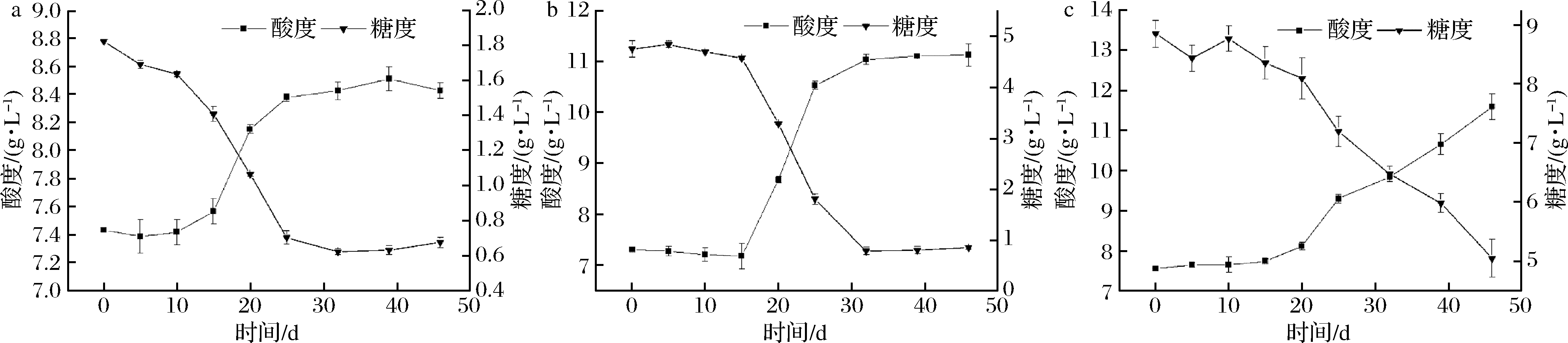
a-还原糖含量2 g/L;b-还原糖含量5 g/L;c-还原糖含量10 g/L
图2 还原糖含量黄酒对食果糖乳杆菌13-21代谢的影响
Fig.2 The effects of reducing sugar content in Huangjiu on the metabolism of L.fructivorans 13-21
2.3 温度对黄酒关键酸败微生物的影响
分析黄酒中2类关键酸败微生物在不同温度下的生长情况。如图3和图4所示,在20~30 ℃,2种酸败微生物菌体浓度较高,生长情况较好,而在11和40 ℃条件下,2种酸败微生物几乎不能生长。在11 ℃的低温环境下,酸败微生物的生命活动受到影响,生长受到抑制。在40 ℃条件下,培养得到的黄酒中几乎不存在酸败微生物,表明在该温度下长时间培养会导致酸败微生物死亡。为验证该结论的一般性,从上述两类酸败菌中分别挑选8株菌株,将微生物培养液(处于生长对数期)接种到正常陈酿的黄酒中,再将黄酒置于30、40 ℃条件下,厌氧培养,观察记录酸败微生物的生长状况,所得结果如表2所示。在30 ℃条件下,2种酸败微生物的生长状况良好,而在40 ℃条件下,2种酸败微生物几乎不能生长,从而验证了上述结论的一般性。因此,通过控制黄酒在较低的储藏温度或在黄酒杀菌过程中优化杀菌的温度、时间等参数能够一定程度上抑制酸败微生物的生长,防止黄酒酸败现象的发生。这与章志超等[11]从酸败黄酒中分离得到的食果糖乳杆菌在温度方面的单因素试验结果基本吻合。分离得到的食果糖乳杆菌在30 ℃时生长得最快,当温度升高时,食果糖乳杆菌的生长逐渐受到抑制,可计数菌落逐渐减少。
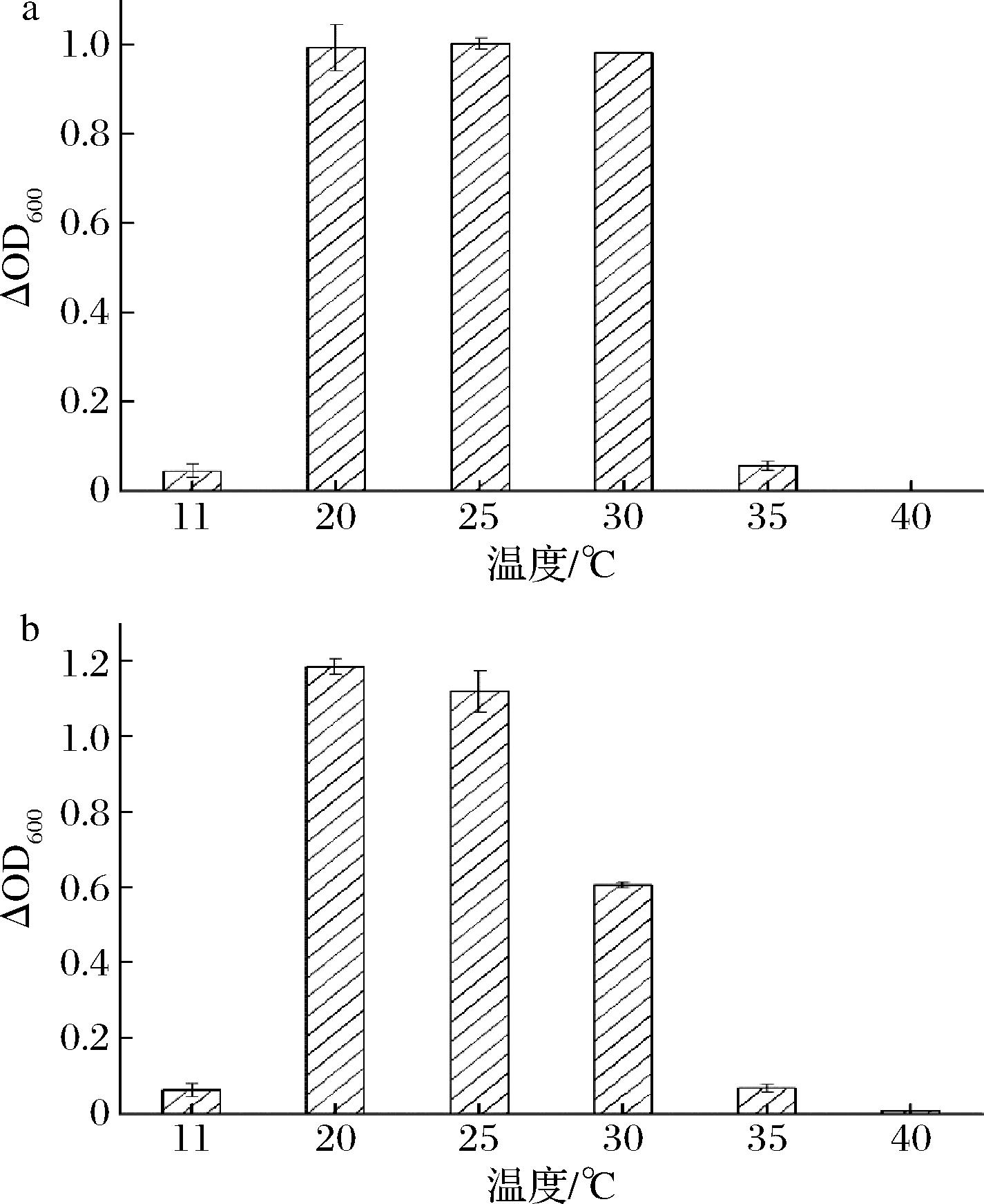
a-耐酸乳杆菌7-2;b-耐酸乳杆菌19-1-1
图3 耐酸乳杆菌在不同温度下的生长状况
Fig.3 The growth of L.acetotolerans at different temperatures
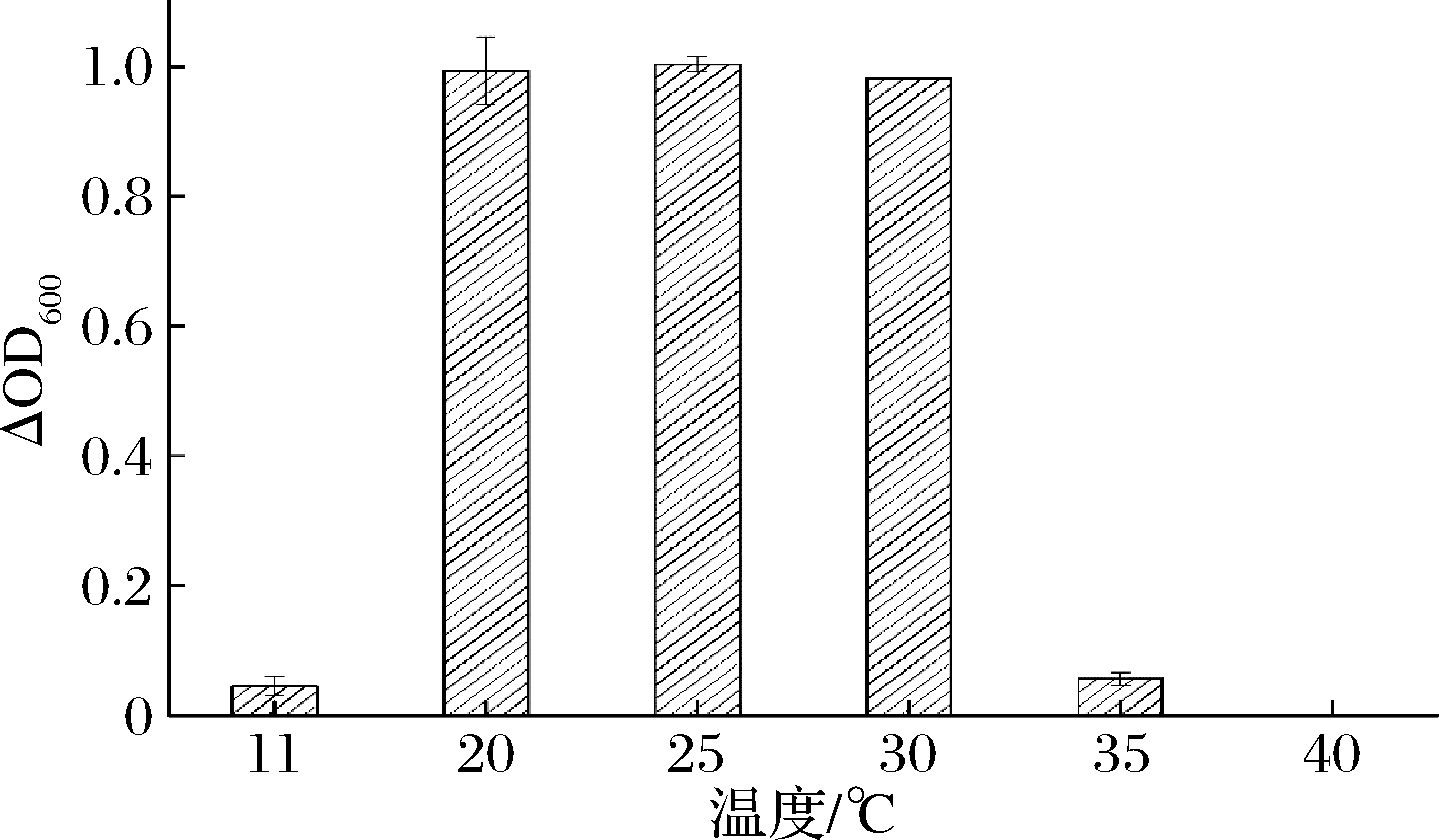
图4 食果糖乳杆菌7-2在不同温度下的生长状况
Fig.4 The growth of L.fructivorans 7-2 at different temperatures
表2 耐酸乳杆菌和食果糖乳杆菌在不同温度下的生长状况
Table 2 The growth of L.fructivorans and L.acetotolerans at different temperatures

耐酸乳杆菌温度/℃3040食果糖乳杆菌温度/℃30406-4+++-6-1+++++-8-1++-6-2+++++-15-2++-6-3+++++-16-3++++-7-1+++++-17-2+++-7-2+++++-18-1++++-7-3+++++-31-2+++-13-1+++++-XH-3++-13-2+++++-
注:+++++:0.25≤ΔOD600<0.30;++++:0.20≤ΔOD600<0.25;+++:0.15≤ΔOD600<0.20;++:0.10≤ΔOD600<0.15;+:0.05≤ΔOD600<0.10;-:ΔOD600<0.05
2.4 酒精度对黄酒关键酸败微生物的影响
选择耐酸乳杆菌30-1、19-1-1和食果糖乳杆菌13-2、7-2进行实验,培养结束后,不同酒精度培养基中酸败微生物数量及还原糖变化量的测定结果如表3和图5所示。结果表明,在低酒精度(14%,体积分数)下酸败微生物的生长能力很强,2种酸败微生物的数量增加较多,对还原糖的消耗量较大,有明显的生长迹象。随着培养基中的酒精度上升,耐酸乳杆菌和食果糖乳杆菌的生长逐渐受到抑制。当酒精度达到23%(体积分数)时,培养基中的2种酸败微生物仍然能够生长产酸。当酒精度达到25%(体积分数)以上时,培养基中的2种酸败微生物不存在生长迹象,生长明显受到抑制。
表3 不同酒精度培养基中酸败微生物的数量 单位:个/mL
Table 3 The number of spoilage microbes in different alcohol medium
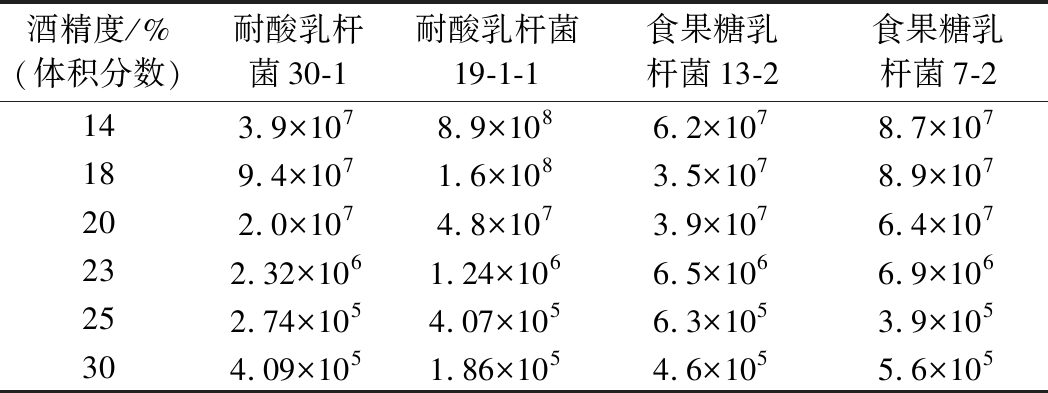
酒精度/%(体积分数)耐酸乳杆菌30-1耐酸乳杆菌19-1-1食果糖乳杆菌13-2食果糖乳杆菌7-2143.9×1078.9×1086.2×1078.7×107189.4×1071.6×1083.5×1078.9×107202.0×1074.8×1073.9×1076.4×107232.32×1061.24×1066.5×1066.9×106252.74×1054.07×1056.3×1053.9×105304.09×1051.86×1054.6×1055.6×105
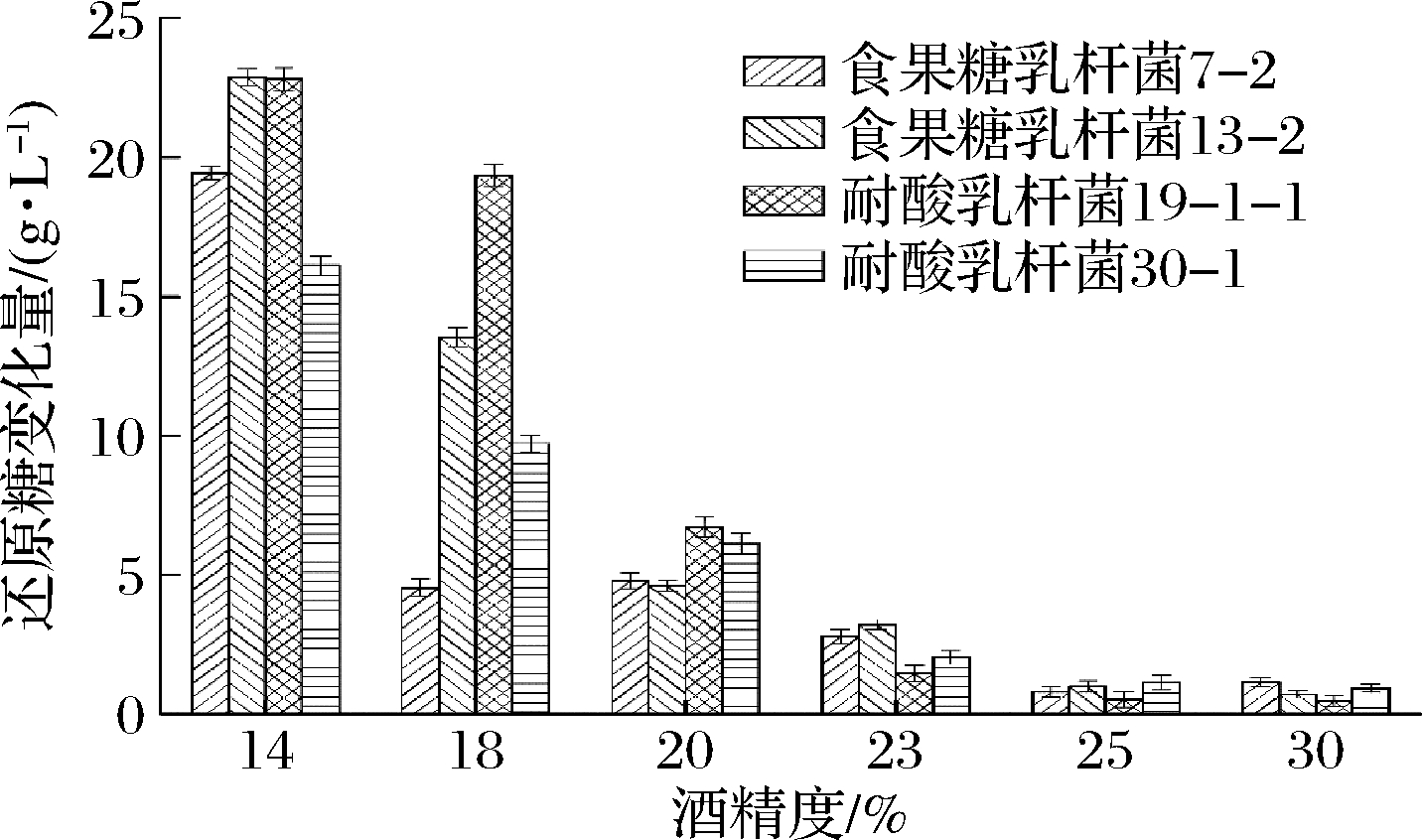
图5 不同酒精度培养基中微生物对还原糖的消耗情况
Fig.5 The consumption of reducing sugars by spoilage microbes in different alcoholic medium
为了验证黄酒酸败微生物在真实黄酒中的酒精耐受性,根据工厂的实际生产情况,分析不同酒精度黄酒中酸败微生物数量及还原糖变化量的测定结果。如表4和图6所示,与食果糖乳杆菌7-2、13-1相比,耐酸乳杆菌19-1-1、30-1在黄酒中具有更强的生长能力。在较低酒精度下,黄酒中耐酸乳杆菌的数量最多,对还原糖的消耗量较高,最高可达到17.86 g/L;而食果糖乳杆菌在不同酒精度黄酒中的数量相对较少,对还原糖的消耗量相对较低,都在4.5 g/L以下。当酒精度达到23%(体积分数)时,黄酒中的2种酸败微生物仍然能够生长产酸。当酒精度达到25%(体积分数)以上时,黄酒中的2种酸败微生物不存在生长迹象,生长明显受到抑制。从以上的结果分析可以得到,食果糖乳杆菌和耐酸乳杆菌对酒精的耐受能力很强,在低酒精度下有较强的生长能力,在23%(体积分数)的酒精度下仍存在生长迹象,在25%(体积分数)的酒精度下生长受到抑制作用。与黄酒酸败微生物相似,啤酒和日本清酒的酸败微生物也具有较高的酒精耐受性,清酒酸败微生物可达20%(体积分数)以上的酒精耐受性[16];而食醋中的微生物和黄酒酸败微生物相反,几乎不具有酒精耐受性[24]。
表4 不同酒精度黄酒中酸败微生物的数量 单位:个/mL
Table 4 The number of spoilage microbes in Huangjiu with different alcoholicity
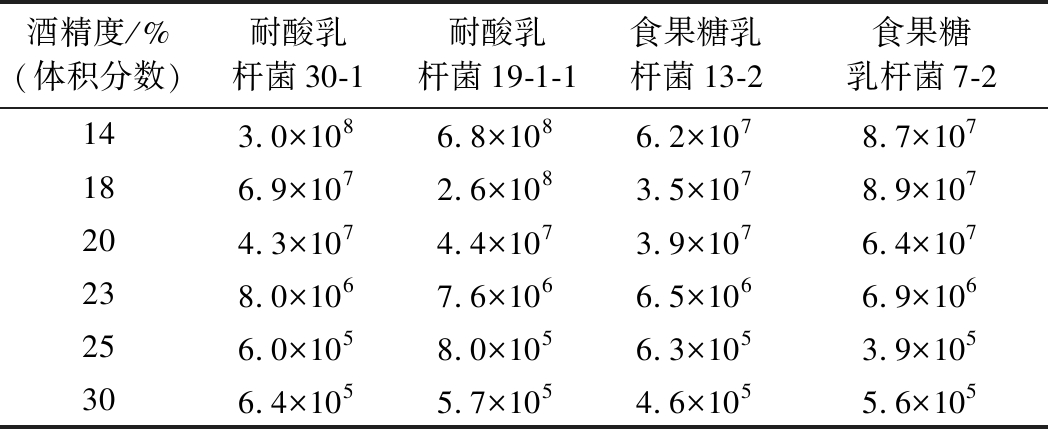
酒精度/%(体积分数)耐酸乳杆菌30-1耐酸乳杆菌19-1-1食果糖乳杆菌13-2食果糖乳杆菌7-2143.0×1086.8×1086.2×1078.7×107186.9×1072.6×1083.5×1078.9×107204.3×1074.4×1073.9×1076.4×107238.0×1067.6×1066.5×1066.9×106256.0×1058.0×1056.3×1053.9×105306.4×1055.7×1054.6×1055.6×105
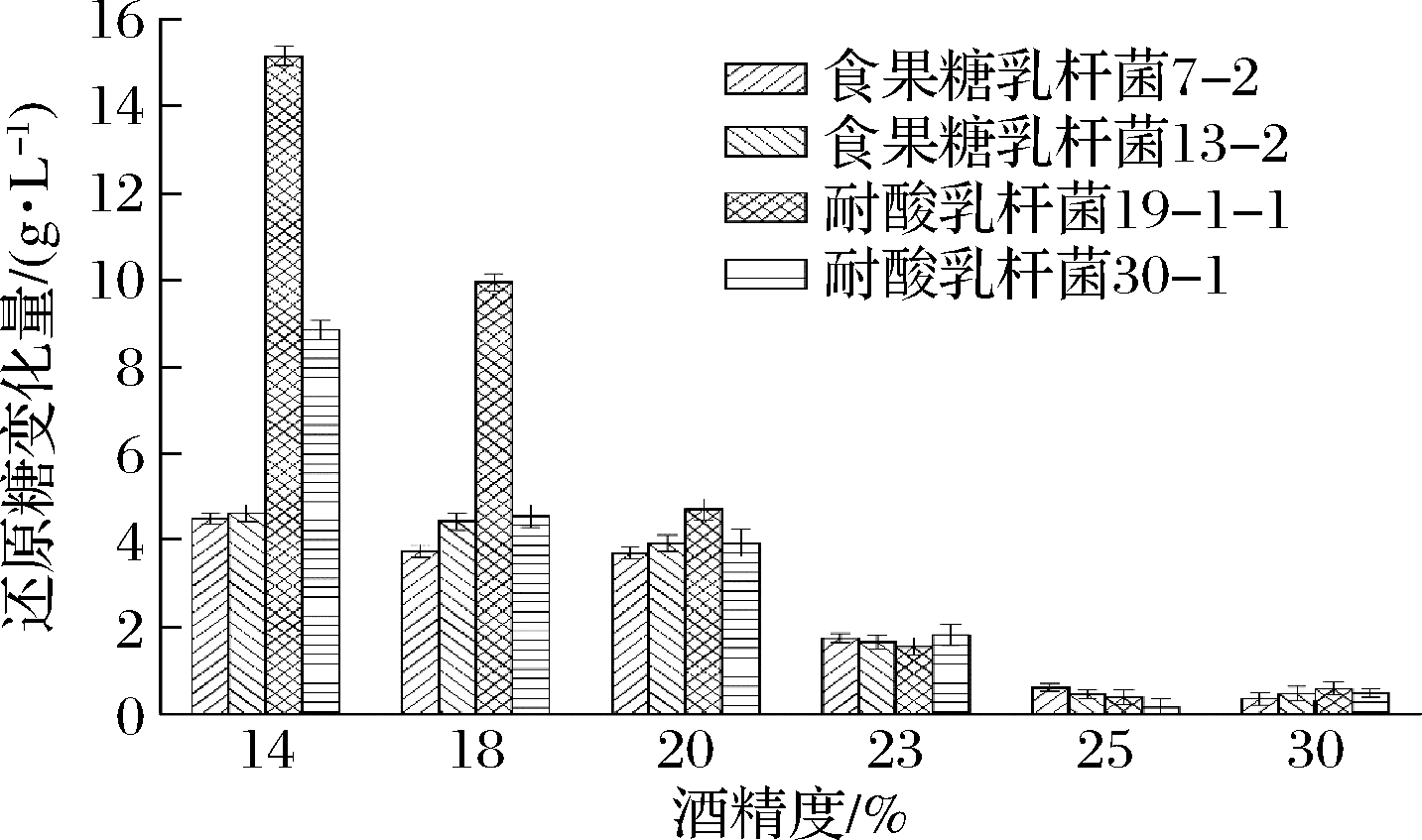
图6 不同酒精度正常陈酿黄酒中微生物对还原糖的消耗情况
Fig.6 The consumption of reducing sugars by spoilage microbes in Huangjiu with different alcoholicity
3 结论
本研究从微生物营养需求、糖分消耗、生长温度耐受、酒精耐受4个方面探究了黄酒陈酿关键酸败微生物的生物学特征。黄酒酸败微生物主要以糖类作为能源物质,能够利用部分有机酸,不利用氨基酸,其中对葡萄糖的利用能力最强。黄酒酸败微生物会利用酒体中的还原糖产酸,低糖条件下,酸败微生物代谢产生的有机酸含量不足以导致黄酒发生酸败。黄酒酸败微生物在20~30 ℃生长能力极强,在11和40 ℃下,生长受到明显的抑制。黄酒酸败微生物的酒精耐受性极强,在低酒精度下,有利于酸败微生物的生长;在23%(体积分数)的酒精度下,酸败微生物仍存在生长迹象;在25%(体积分数)的酒精度下,酸败微生物的生长受到抑制。因此,通过控制黄酒的糖浓度、酒精度以及储存温度可有效预防黄酒酸败。以上对黄酒陈酿酸败微生物生物学特征的研究,为控制黄酒酸败微生物生长提供了一定的理论基础。
[1] CHEN S,XU Y,QIAN M C.Aroma characterization of Chinese rice wine by gas chromatography-olfactometry,chemical quantitative analysis,and aroma reconstitution[J].Journal of Agricultural and Food Chemistry,2013,61(47):11 295-11 302.
[2] 杨国军.黄酒的陈化[J].酿酒科技,2006(6):74-76.
YANG G J.Aging of yellow rice wine[J].Liquor-Making Science & Technology,2006(6):74-76.
[3] 王益翔. 浅谈黄酒的陈酿[J].酿酒科技,1999(3):56-57.
WANG Y X.Elementary introduction ofstorematurity of yellow rice wine[J].Liquor-Making Science & Technology,1999(3):56-57.
[4] 许荣年, 鲍忠定,潘兴祥,等.黄酒的陈化[J].酿酒,2003,30(2):50-52.
XU R N,BAO Z D,PAN XX,et al.Maurtization of Chinese rice wine[J].Liquor Making,2003,30(2):50-52.
[5] 杨国军. 黄酒陈化揭秘[J].中国酿造,2006,25(7):48-49.
YANG G J.Study on the maturation of rice wine[J].China Brewing,2006,25(7):48-49.
[6] 汪建国, 汪琦.黄酒醪酸败原因分析及预防措施[J].中国酿造,2005,24(8):36-39.
WANG J G,WANG Q.Analysis and preventive measure of fermentation broth deterioration of rice wine[J].China Brewing,2005,24(8):36-39.
[7] 祁传林. 大罐贮存黄酒出现变质酸败的因素及控制[J].酿酒科技,2005(2):111-112.
QI C L.Causes of deterioration & rancidity of yellow rice wine storaged in big pots and the relative control measures[J].Liquor-Making Science & Technology,2005(2):111-112.
[8] 范伟国, 张艳梅,乔新建,等.大容量不锈钢罐贮存黄酒的研究及应用[J].酿酒科技,2014(5):67-70.
FAN W G,ZHANG Y M,QIAO X J,et al.Research on the storage of yellow rice wine by high-capacity stainless steel tanks[J].Liquor-Making Science & Technology,2014(5):67-70.
[9] 林茂丛. 黄酒酸败问題初探[J].中国酿造,1993,12(5):44-46.
LIN M C.A preliminary study on the spoiled yellow rice wine[J].China Brewing,1993,12(5):44-46.
[10] 刘文容, 陈双,徐岩.黄酒贮存酸败关键微生物的分离鉴定[J].微生物学通报,2018,45(1):120-128.
LIU W R,CHEN S,XU Y.Identification and characterization of spoilage microorganisms in aging Chinese rice wine by culture-independent and culture-dependent technologies[J].Microbiology China,2018,45(1):120-128.
[11] 章志超,吴鑫,朱应飞.导致黄酒酸败的食果糖乳杆菌的分离、鉴定及其检测条件优化[J].食品科学,2018,39(20):161-166.
ZHANG Z C,WU X,ZHU Y F.Isolation,identification and growth optimization of Lactobacillus fructivorans causing rancidity of Chinese rice wine[J].Food Science,2018,39(20):161-166.
[12] 毛青钟, 张水娟,鲁瑞刚,等.黄酒仓库贮存坛酒的酸败原因及控制措施研究[J].酿酒,2009(4):42-46.
MAO Q Z,ZHANG S J,LU R G,et al.Yellow rice wine storage warehouse altar wine rancidity of the reasons for research and control,measures[J].Liquor Making,2009(4):42-46.
[13] 鲁长华,寿泉洪.传统黄酒生产后酵大罐贮存研究初探[J]. 酿酒科持,2006(11):66-67.
LU C H,SHOU H Q.Investigation on secondary Ferm entataion of traditional yellow rice wine in big pot storage[J].Liquor Making Science & Technology,2006(11):66-67.
[14] NAKAMURA J,MINAMI M,HAMACHI M.Immunochemical classification of hiochi bacteria and characterization of their cell surface antigens by means of specific anti-hiochi bacterial monoclonal antibodies[J].Seibutsu-Kogaku Kaishi-Journal of the Society for Fermentation and Bioengineering,1996,74(2):A83-A90.
[15] LYHS U,KORKEALA H,BJORKROTH J.Identification of lactic acid bacteria from spoiled,vacuum-packaged ‘gravad’ rainbow trout using ribotyping[J].International Journal of Food Microbiology,2002,72(1-2):147-153.
[16] SUZUKI K,ASANO S,IIJIMA K,et al.Sake and beer spoilage lactic acid bacteria-A review[J].Journal of the Institute of Brewing,2008,114(3):209-223.
[17] NAKAGAWA T,SHIMADA M,MUKAI H,et al.Detection of alcohol-tolerant hiochi bacteria by PCR[J].Applied and Environmental Microbiology,1994,60(2):637-640.
[18] TANIGUCHI M,ISHIYAMA Y,TAKATA T,et al.Growth-inhibition ofhiochi bacteria in namazake (raw sake) by bacteriocins from lactic acid bacteria[J].Journal of Bioscience and Bioengineering,2010,109(6):570-575.
[19] KOBAYASHI F,IKEURA H,ODAKE S,et al.Inactivation of enzymes and Lactobacillus fructivorans in unpasteurized sake by a two-stage method with low-pressure CO2 microbubbles and quality of the treated sake[J].Innovative Food Science and Emerging Technologies,2013,18:108-114.
[20] KOBAYASHI F,SUGAWARA D,TAKATOMI T,et al.Inactivation of Lactobacillus fructivorans in physiological saline and unpasteurised sake using CO2 microbubbles at ambient temperature and low pressure[J].International Journal of Food Science and Technology,2012,47(6):1 151-1 157.
[21] SUZUKI K,IIJIMA K,SAKAMOTO K,et al.A review of hop resistance in beer spoilage lactic acid bacteria[J].Journal of the Institute of Brewing,2007,112(2):173-191.
[22] GAROFALO C,OSIMANI ![]() V,et al.The occurrence of beer spoilage lactic acid bacteria in craft beer production[J].Journal of Food Science,2015,80(12):M2 845-M2 852.
V,et al.The occurrence of beer spoilage lactic acid bacteria in craft beer production[J].Journal of Food Science,2015,80(12):M2 845-M2 852.
[23] 孔小勇, 王鹏举.黄酒发酵过程中酸败现象的研究[J].酿酒科技,2011(8):47-50.
KONG X Y,WANG P J.Research on rancidity in the fermentation process of yellow rice wine[J].Liquor-Making Science & Technology,2011(8):47-50.
[24] 翟磊, 苏姣姣,刘洋,等.食醋中污染菌的分离与鉴定[J].生物技术通报,2016,32(3):198-202.
ZHAI L,SU JJ,LIU Y,et al.Isolation and identification of microorganisms from spoilage vinegar[J].Biotechnology Bulletin,2016,32(3):198-202.