酸乳在储藏、运输、销售和消费过程中,pH值会持续降低,出现酸味过重、乳清分离等一系列感官品质下降的问题,即后酸化现象[1],直接影响酸乳货架期及乳酸菌的活菌数量。
对于抗后酸化的研究,目前主要集中在改变加工工艺、基因工程技术及诱变育种3个方面。通过调整发酵酸乳中球菌与杆菌的比例(1.5∶1),能有效地减轻酸乳的后酸化,但易受到其他条件影响,效果不稳定[2]。巴氏杀菌或瞬时高温灭菌技术是以降低乳酸菌的活菌数(<106 CFU/mL)为代价,抑制乳酸菌利用乳糖发酵产酸,极大地降低了酸乳的益生功能。研究人员利用载体 pGhost9:ISS1,经复制型转座构建保加利亚乳杆菌突变体,得到3株具有抗后酸化能力的保加利亚乳杆菌菌株[3-4],其生物学性状稳定,回复突变率低,但外源DNA转化困难且存在应用困境。
诱变育种是目前选育抗后酸化菌株最为有效的途径,包括物理诱变、化学诱变、原生质体融合等。韩雪等[5]采用紫外线对保加利亚乳杆菌和嗜热链球菌进行诱变处理,得到低温敏感型突变菌株,能有效抑制酸乳的后酸化,但存在可见光修复问题,最适条件有待进一步研究。罗红霞等[6]对乳酸菌进行原生质体融合,利用青霉素进行筛选,获得2株在贮藏过程中后酸化程度明显减弱的菌株,但融合子的不稳定性、杂种细胞间的异源基因相互排斥等问题仍有待解决。利用新霉素对保加利亚乳杆菌进行诱变,可筛选出H+-ATPase弱化菌株,当酸度超过阈值时,乳酸菌产酸能力显著下降[7]。此外,将紫外线诱变和1.5%硫酸二乙酯复合诱变结合,突变菌株能抗酸乳后酸化[8]。
研究认为,H+-ATP酶活性与转运H+能力有关,H+-ATPase弱化菌株的本质是酸敏菌株[7],即在正常的酸度下H+-ATPase正常行使其功能,保持乳酸菌的耐酸性;当酸度超过阈值时H+-ATPase酶活性显著弱化,乳酸菌产酸能力则显著下降。
本研究采用常压室温等离子体(atmospheric and room temperature plasma,ARTP)[9]对菌株进行诱变处理,结合新霉素筛选得到低H+-ATP酶活性突变株,测定突变菌生长特性并进行酸奶发酵实验,以期得到具有抗后酸化能力的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
副干酪乳杆菌(Lactobacillus paracasei) B15由新疆特殊环境微生物实验室分离、鉴定及保藏。
1.1.2 试剂与培养基
新霉素、PCR Master Mix扩增试剂盒、Bradford蛋白检测试剂盒、溶菌酶、Na2ATP、HCl、钼酸铵、H2SO4、甲苯、Na2SO3、对甲基氨基苯酚,生工生物工程(上海)股份有限公司;MRS琼脂、MRS肉汤,青岛海博生物技术有限公司。
1.2 仪器与设备
ARTP-II诱变系统,无锡源清天木生物科技有限公司;电热恒温培养箱,上海一恒科学仪器有限公司;PCR仪,美国Bio-Rad;pH计,德国Sartoris;Fresco17离心机,Thermo Fisher Scientific Inc.;电泳仪、凝胶成像系统,北京六一生物科技有限公司;分光光度计,上海科华生物工程有限公司。
1.3 实验方法
1.3.1 ARTP诱变
将L.paracasei B15接种至MRS肉汤中进行活化与扩大培养,离心收集对数生长期的菌体,根据已有研究[10-11],将菌体稀释为5×106 CFU/mL后进行ARTP诱变。将10 μL菌悬液均匀涂布于金属板上,放置在ARTP诱变系统样品处理室,与气流端口间距调整到2 mm[12]。ARTP的工作参数如下:射频功率输入100 W;工作气体纯氦的流量10 L/min[13]。在控制上述条件的情况下,设置对照组,将涂有菌悬液的金属板以不同处理时间(0、10、15、20、30、45、60、90 s)暴露在处理端口下。结束诱变后,用无菌生理盐水洗脱样品,再以梯度稀释方法将不同浓度的悬液涂布于MRS琼脂平板上,从而测定ARTP诱变剂量。对照组和实验组均将在37 ℃培养48 h,致死率按公式(1)计算:
致死率![]()
(1)
式中:S,对照培养基上的单菌落数;M,每个处理组培养基上的菌落数,单位均为菌落形成单位(colony formal units,CFUs)[14]。
1.3.2 突变菌株的筛选
选择85%致死率对应的时间(30 s)作为ARTP诱变处理时间[15],将处理后的菌株同样使用梯度稀释法进行稀释。将稀释后的悬液(100 μL)涂布在添加了不同质量浓度新霉素(100、200、300、400、500 mg/L)MRS琼脂平板上,而未添加新霉素MRS琼脂平板则作为空白对照。在相同条件下(37 ℃,48 h)培养,记录单菌落数,阳性筛选率按公式(2)计算:
阳性筛选率![]()
(2)
式中:S′,不含新霉素的对照组MRS琼脂平板菌落计数;M′,不同浓度新霉素MRS琼脂平板单菌落数。
选择阳性筛选率50%以上的平板所对应的新霉素浓度作为突变菌株的筛选条件,将从MRS琼脂平板上获得的突变菌株接种于MRS肉汤(3 mL)中,进行下一步的筛选和验证。通过筛选获得的菌株在-80 ℃超低温冰箱进行保存。
1.3.3 初步筛选具有抗后酸化潜力的突变株
1.3.3.1 生长状况和pH值测定
将筛选得到的突变株和对照组均接种于同样培养条件下的MRS肉汤中,接种量3%,37 ℃培养24 h,每隔2 h取样1次,测定OD660 nm与pH值的变化。
1.3.3.2 H+-ATP酶的提取与活性测定
将对照组与突变株均接种到MRS肉汤(3 mL)中进行活化,37 ℃下培养48 h,将菌液(10 mL)离心(8 000 r/min,10 min,4 ℃)后弃上清液,加入50 μL甲苯和500 μL含10 mmol/L MgSO4溶液的Tris-HCl缓冲液,37 ℃静置5 min后在-80 ℃冷冻2 h。重复完成冻融操作后9 000 r/min离心10 min,重悬溶液后再次加入400 μL Tris-HCl缓冲液[16]。
按照H+-ATP酶活性检测试剂盒测定方法,将50 μL Na2ATP(0.1 mol/L)加入酶提取液中开始反应,37 ℃条件下,静置20 min,加入600 μL HCl(0.1 mol/L)终止反应。将溶液置于冰浴中进行冷却,离心(6 000 r/min,4 ℃,10 min)后收集上清液。加入2.0 mL着色剂30 min后测定OD660 nm,得到磷含量[17]。本实验中蛋白定量测定采用Bradford蛋白检测试剂盒进行检测。H+-ATP酶活性以U/mg表示,即每个活性单位U定义为1 mg H+-ATP酶粗提物在1 min内将ATP分解成1 mol无机磷酸盐[18-19]。
1.3.4 突变株的抗后酸化特性验证
将筛选得到的具有抗后酸化潜力的突变株活化后接种于MRS肉汤(3 mL)中,37 ℃培养24 h。将1 mL菌液接种于相同条件下的MRS肉汤(300 mL)中,扩增培养48 h。取30 mL培养液,5 000 r/min离心10 min后弃上清液,重悬于30 mL磷酸缓冲溶液(PBS,pH 7.4)。菌体和PBS以1∶1的比例制备菌悬液,放入4 ℃环境下进行保存。
全脂牛奶(100 mL)在42 ℃下预热,加入制备好的菌悬液(5×106 CFU/mL)进行接种,搅拌均匀后42 ℃培养至完全凝乳。发酵完成后4 ℃进行贮藏。
测定发酵0、1、5、10、15、20 d的发酵乳pH值和酸度的变化[20]。pH的变化将直接使用精密pH计(±0.01)在室温条件下进行测定。酸度则选择国标法(GB 5009.239—2016)进行检测:将10.0 g的发酵乳样品与20.0 mL蒸馏水和2.0 mL的酚酞乙醇(0.5%)混合均匀,使用NaOH(0.100 mol/L)标准溶液进行滴定,指示反应终点为微红并30 s内不褪色[21]。记录整个反应过程中NaOH标准滴定液的消耗量(mL)。发酵乳的酸度计算如公式(3)所示:
酸度![]()
(3)
式中:c,NaOH标准溶液浓度,mol/L;V1,滴定过程中消耗的NaOH标准溶液的体积,mL;V0,空白实验所消耗NaOH标准溶液的体积,mL;m,发酵乳样品的质量,g。常数0.1为酸度理论定义的NaOH摩尔浓度,单位为mol/L[22-23],即滴定酸度(°T)为发酵牛奶消耗的0.100 mol/L NaOH标准溶液的体积。
1.3.5 突变株遗传稳定性
将突变株接种至MRS肉汤(5 mL)中,于37 ℃下培养18 h进行活化。将活化菌株在MRS肉汤中连续传代9次,37 ℃下培养24 h。12 ℃下储藏6 d,检测pH值和酸度两项指标的变化以确定突变株是否具有遗传稳定性。
2 结果与分析
2.1 ARTP诱变处理时间的确定
根据ARTP诱变的操作原理,处理时间是达到剂量依赖性致死率的关键因素[24]。L.paracasei B15致死率如图1所示,当辐照时间达到45 s时,菌株的致死率为96%;当ARTP诱变时间延长至60 s以上后,细胞的致死率约为99%。
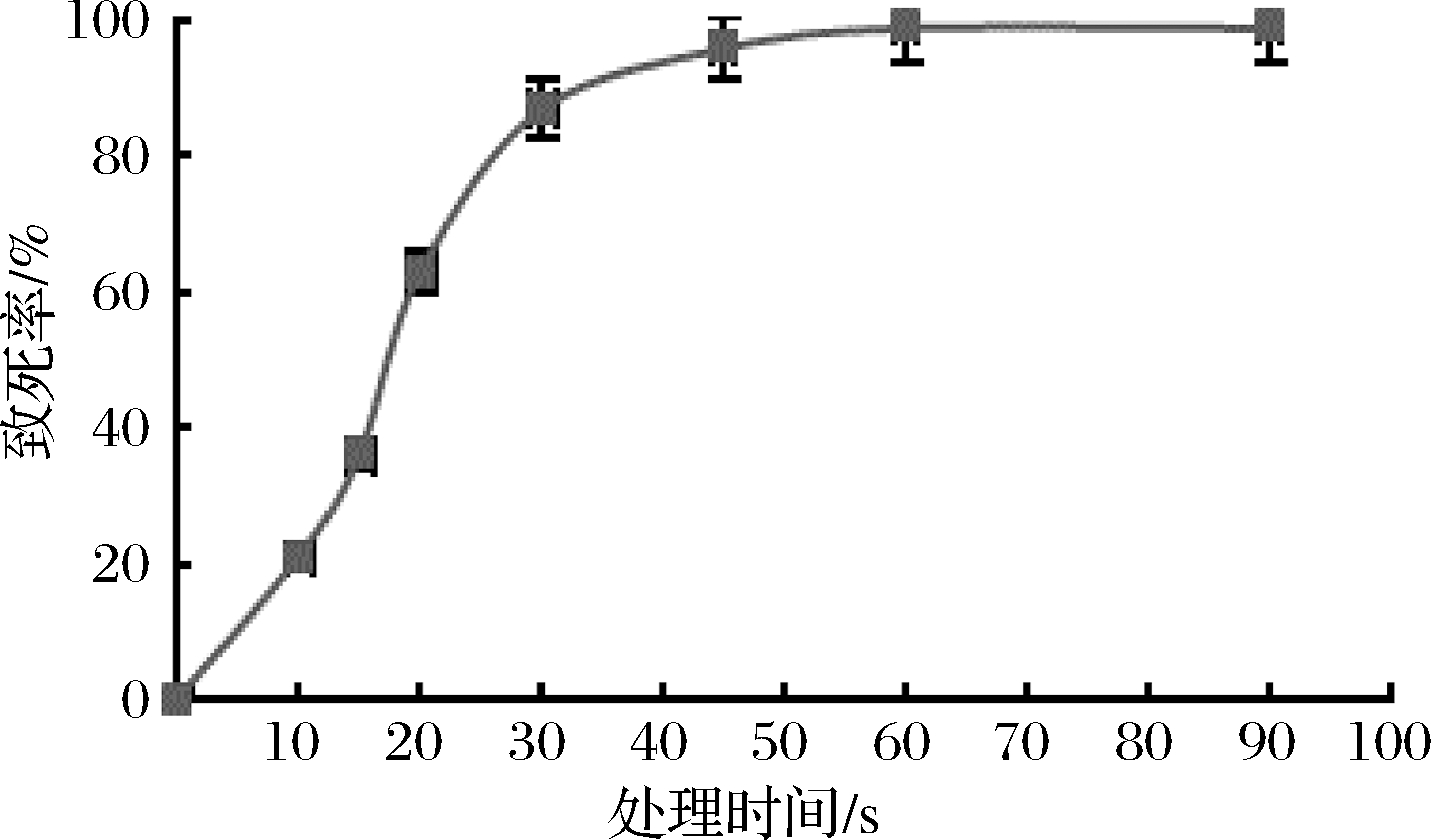
图1 L.paracasei B15在ARTP不同处理时间下的致死率
Fig.1 Lethality rate of L.paracasei B15 under different mutagenic time of atmospheric and room temperature plasma treatment(ARTP)
根据已有的研究,当ARTP诱变的致死率在90%左右时,阳性诱变率较之其他致死率对应的处理时间下明显更高[25-26]。因此,选择87%致死率对应的30 s作为ARTP诱变的最佳处理时间。
2.2 抗后酸化突变菌株的筛选
2.2.1 新霉素筛选突变菌株
基于新霉素对高H+-ATP酶活性菌株的抑制作用,本实验将不同浓度的新霉素溶液加入MRS琼脂平板作为选择培养基。将可在平板上生长的菌株记录为阳性菌株,通过设置不添加新霉素的空白对照组进行阳性筛选和概率计算。当新霉素质量浓度为300 mg/L时,阳性率最高可达62%(图2)。以往的研究表明,联合诱变处理的突变率和阳性突变率高于单处理诱变[27]。因此,在ARTP诱变的基础上,向MRS琼脂平板中添加300 mg/L新霉素可以认定是筛选H+-ATP酶活性较低的突变菌株的合适方法。
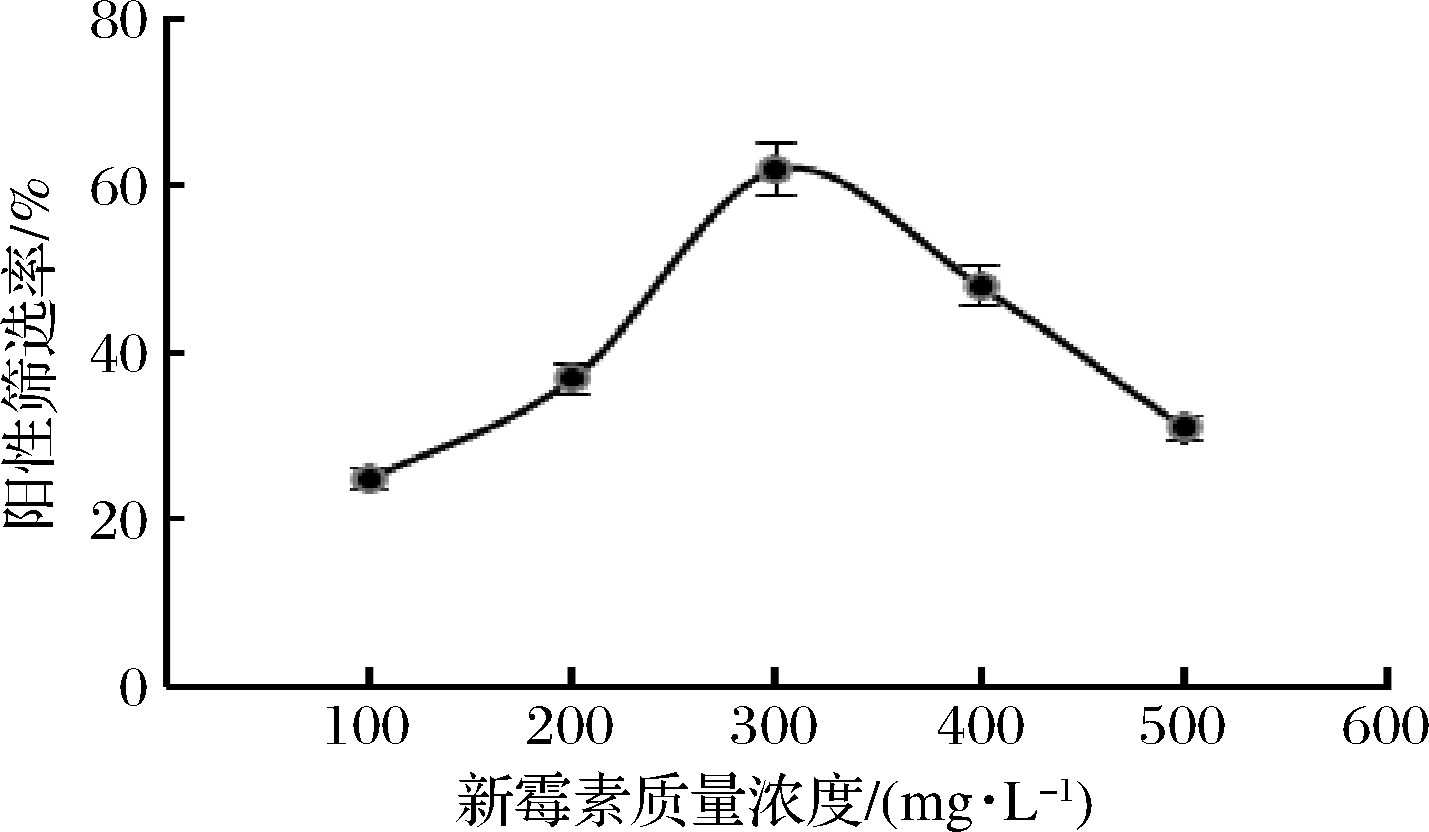
图2 不同浓度新霉素下阳性突变株筛选率
Fig.2 Effects of mutagenesis on positive survival rate in candidate strains with different concentration of neomycin
2.2.2 抗后酸化突变菌株生长特性和H+-ATP酶活性
通过ARTP诱变结合300 mg/L新霉素筛选,共获得7株突变株,其对数生长期均出现在培养8 h后,晚于对照组2 h左右(图3)。突变株BJT-5、BJT-6和BJT-7的生长速率明显降低,稳定期的生物量是其他菌株的1/2左右。
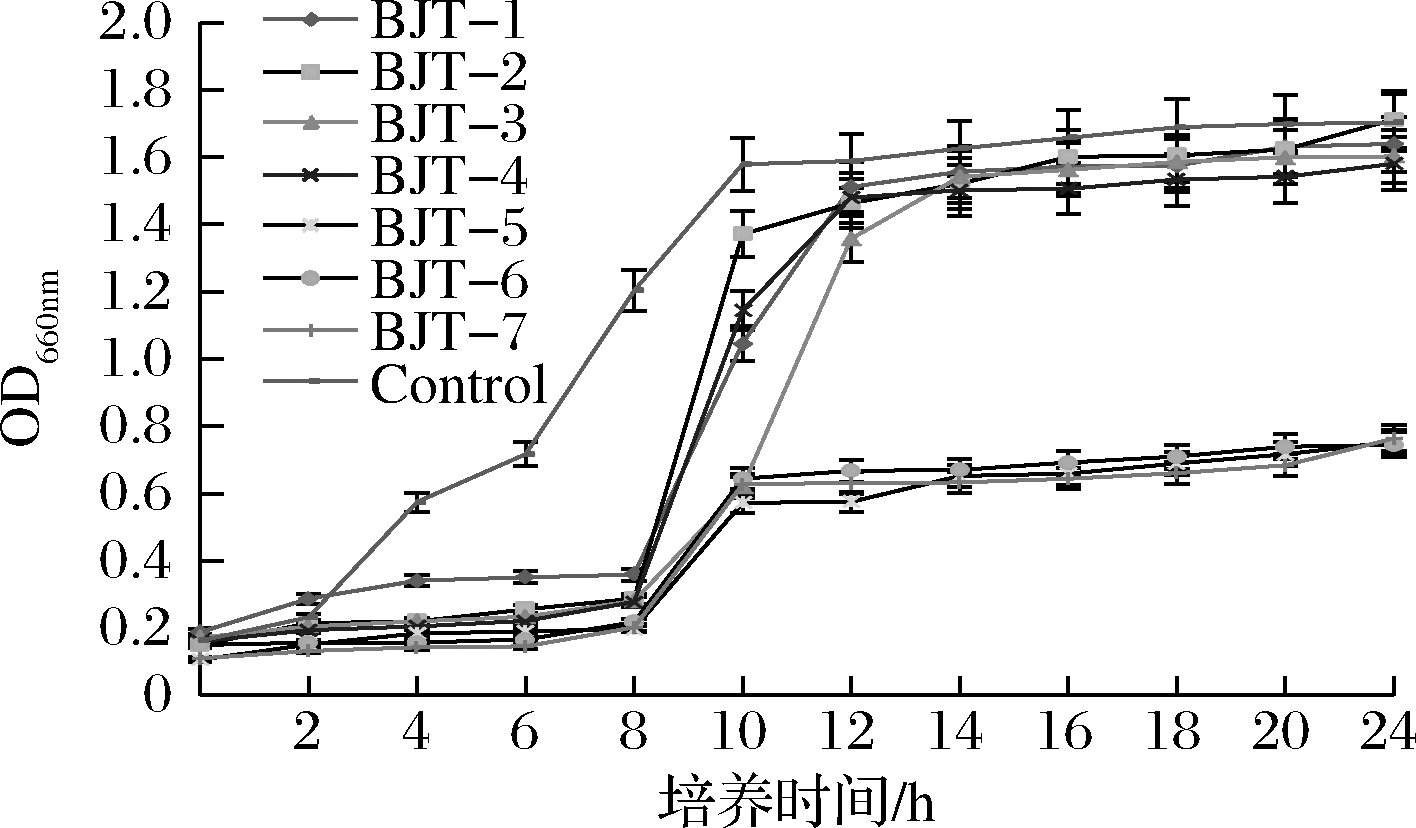
图3 B15及突变株的生长曲线
Fig.3 Growth curves of B15 and mutants during culture period
突变菌株培养8 h后,培养基pH值出现快速下降(图4),与图3中菌株对数生长期的时间一致,即菌体的代谢旺盛时期,代谢产物产物的迅速积累造成pH值的快速下降。突变株BJT-7在培养10 h后,pH值趋于稳定,最低为4.74,pH值变化最小,有较强的抗后酸化能力。
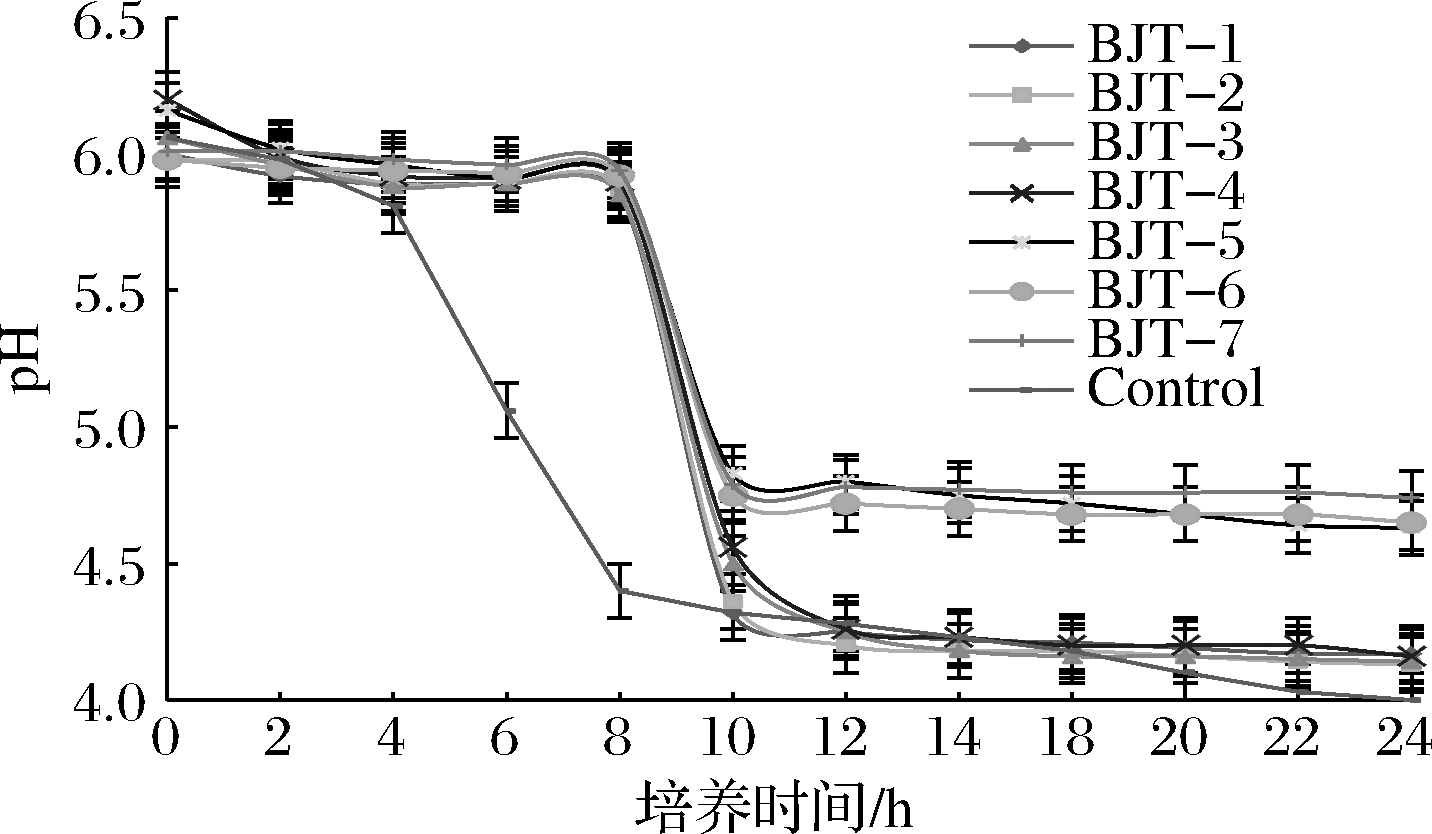
图4 B15及突变株在培养阶段pH的变化
Fig.4 pH of B15 and the mutants during culture period
如图5所示,突变菌株的H+-ATP酶活性均低于对照组的原始菌株。突变菌株BJT-7的H+-ATP酶活性最低,为0.57 U/mg,对照组原始菌株的H+-ATP酶活性是BJT-7的3.09倍。由此推测,菌株生长能力可能与H+-ATP酶活性有关,突变株H+-ATP酶活性的降低,降低了菌株底物的磷酸化水平,导致ATP产量下降,生长速率降低,产酸能力降低,这与已有研究结果一致[28]。结果表明,ARTP联合新霉素的筛选方法能够有效筛选出H+-ATP酶活性较低的菌株。
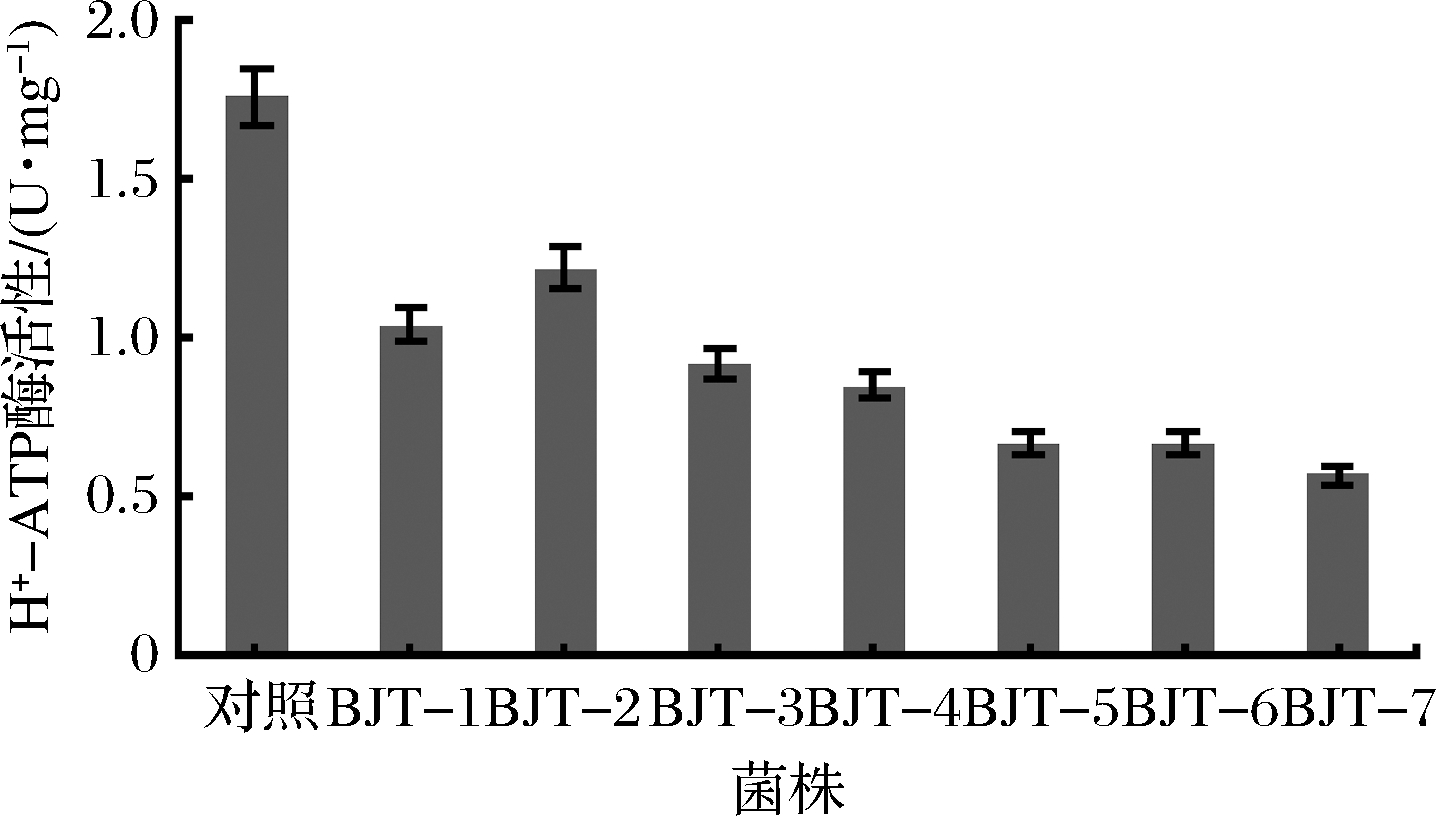
图5 突变株与B15的H+-ATP酶活性
Fig.5 The H+-ATPase activity of the mutants and B15
2.3 突变菌株抗后酸化能力的验证
在全脂牛乳中接种菌悬液进行发酵(37 ℃,48 h),待完全凝乳后测定4 ℃冷藏下发酵乳的pH值及酸度。图6表明,各突变株处理组1 d内pH变化均不明显,对照组稍有下降。
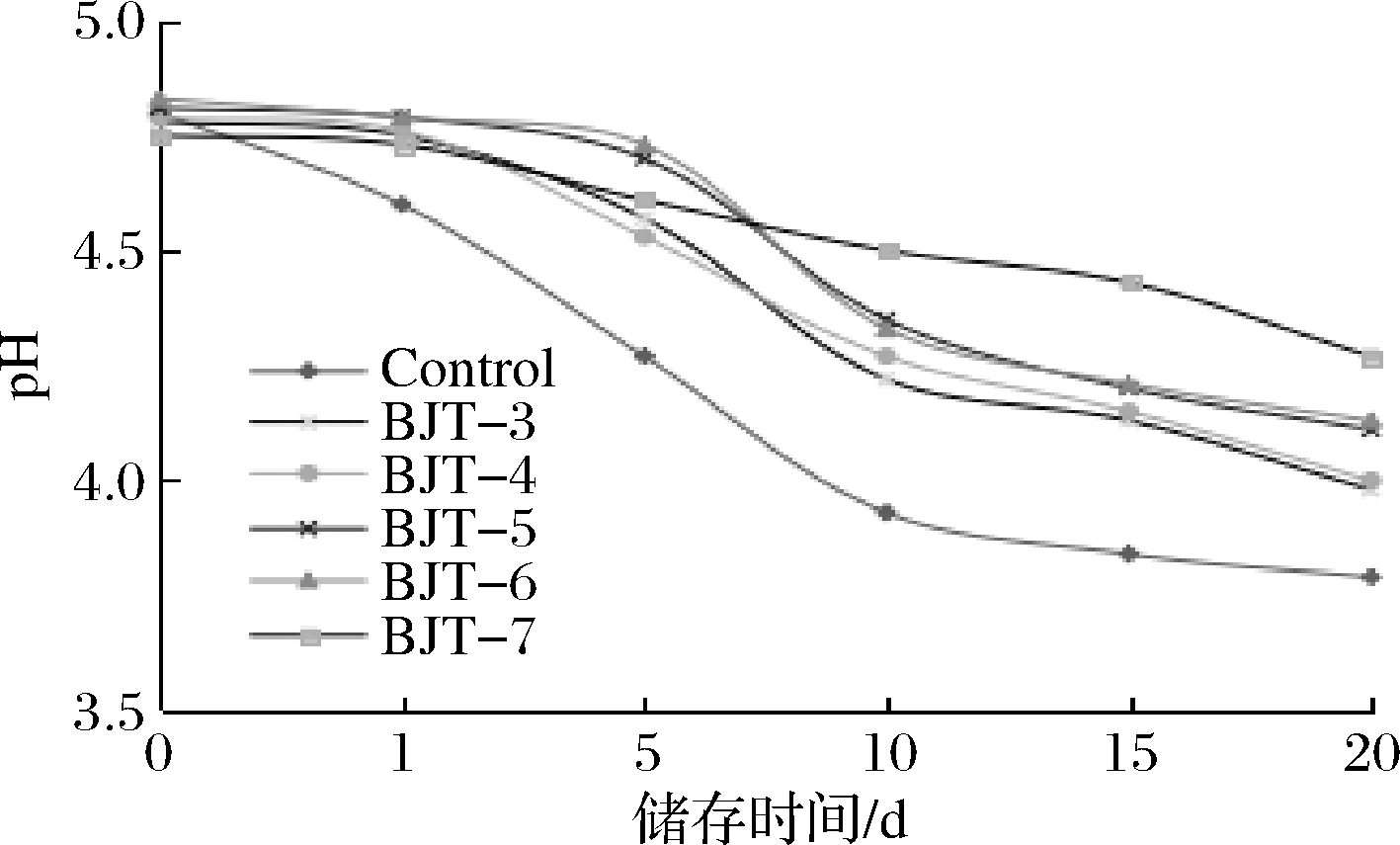
图6 发酵乳pH变化曲线
Fig.6 pH of fermented milk during storage
1~10 d,均为各处理pH值下降最快的时期,其中对照组变化幅度达到0.67,BJT-7变化幅度最小,为0.23。20 d时,对照组pH最低,为3.79,BJT-7的pH值最高,为4.27。
由图7可知,对照组的酸度在储存期间始终在上升,至20 d达到88 °T左右。突变株BJT-5和BJT-6在0~5 d期间酸度变化较小,5~10 d出现酸度增长的对数期,但后续酸度增加趋缓。突变株BJT-7在整个存储过程中酸度变化幅度最小,20 d时酸度为73 °T。随着各处理组pH值的下降,其酸度相应上升。
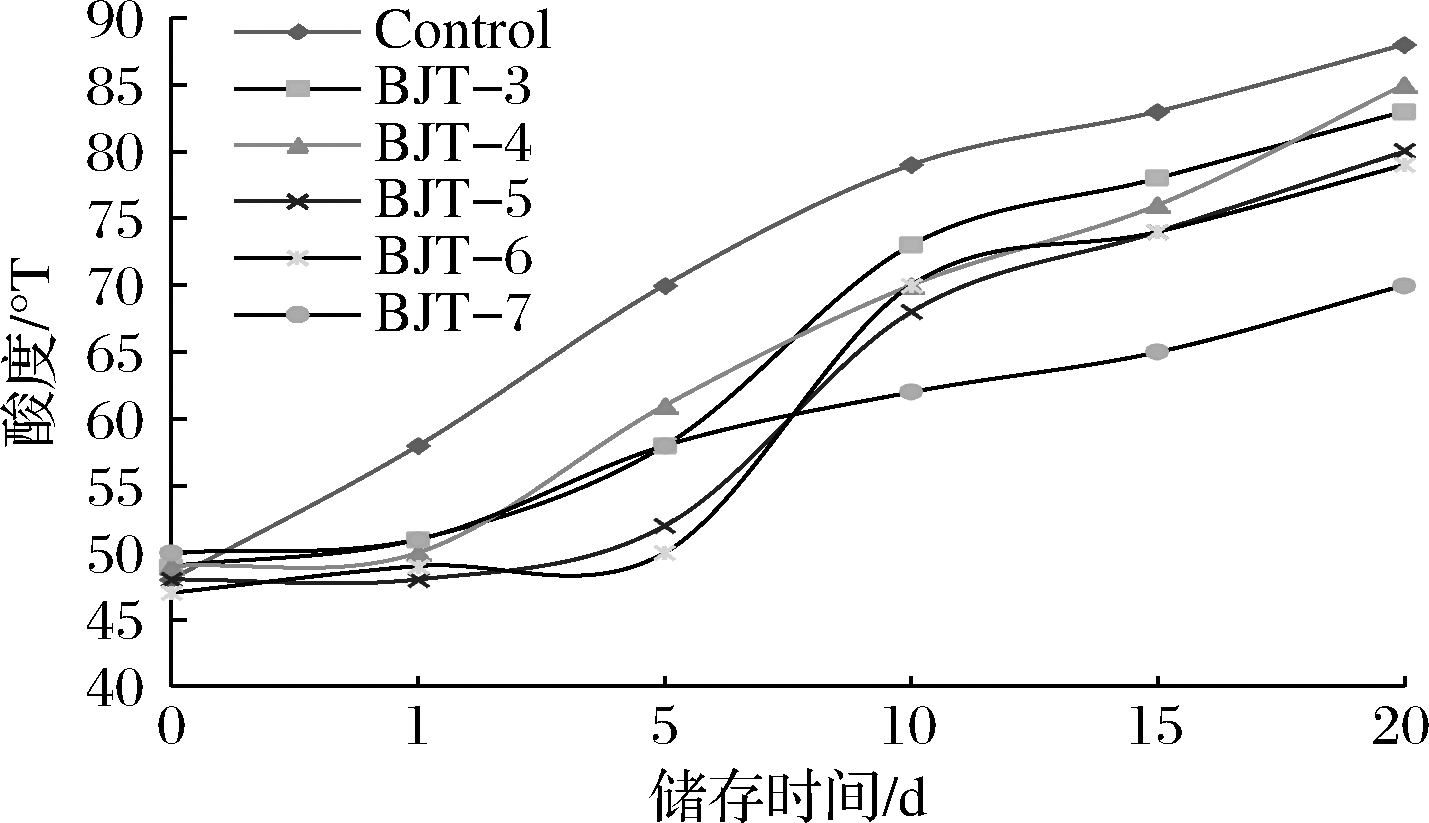
图7 发酵乳酸度变化曲线
Fig.7 The acidity curve of fermented milk during storage
通过ARTP结合新霉素筛选能够得到储藏期间无明显酸度上升或延迟出现较大酸度变化的菌株,即能够得到具有抗后酸化特性的菌株。
2.4 突变菌株遗传稳定性
将突变株BJT-7在MRS培养基中连续传代培养9代,在12 ℃条件下储藏6 d,测定其pH和滴定酸度,结果表明菌株BJT-7具有较好的稳定遗传性(表1)。
表1 BJT-7菌株遗传稳定性
Table 1 Genetic stability of BJT-7
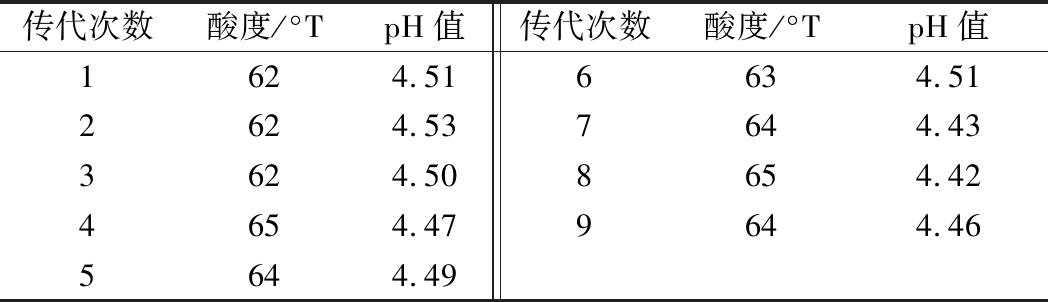
传代次数酸度/°TpH值传代次数酸度/°TpH值1624.516634.512624.537644.433624.508654.424654.479644.465644.49
3 结论
本文采用ARTP诱变处理结合新霉素筛选,获得7株L.paracasei突变菌株,其中菌株BJT-7经全脂牛乳发酵在20 d储藏期间几乎无明显酸度上升,且酸度低于70 °T,具有较好的遗传稳定性,为获得抗后酸化能力强的酸乳发酵菌株提供了新方法。
[1] 郭清泉.酸奶制品在贮存过程发生后酸化的机理及控制措施的研究[D].哈尔滨:东北农业大学,2001.
GUO Q Q.Study on the mechanism of postacidification of the plain yogurt during storage and the methods to control it[D].Harbin:Northeast Agricultural University,2001.
[2] TORRIANIA S,GARDINIB F,GUERZONIC M E,et al.Use of response surface methodology to evaluate some variables affecting the growth and acidification characteristics of yoghurt cultures[J].International Dairy Journal,1996,6(6):625-636.
[3] 李晨,郭鑫,卢海强,等.德式乳杆菌保加利亚亚种thyA基因缺陷型菌株的构建[J].中国食品学报,2015,15(11):23-28.
LI C,GUO X,LU H Q,et al.Construction of Lactobacillus delbrueckii subsp.bulgaricus thyA-null strains[J].Journal of Chinese Institute of Food Science and Technology,2015,15(11):23-28.
[4] 李晨,赵云,郭鑫,等.利用pGhost系统筛选抗后酸化保加利亚乳杆菌[J].中国食品学报,2015,15(4):56-62.
LI C,ZHAO Y,GUO X,et al.Construction of anti-postacidification mutants of Lactobacillus delbrueckii subsp. bulgaricus using pGhost system[J].Journal of Chinese Institute of Food Science and Technology,2015,15(4):56-62.
[5] 韩雪,张兰威,张爽,等.弱后酸化酸奶发酵菌株的紫外诱变选育[J].中国酿造,2011(1):127-130.
HAN X,ZHANG L W,ZHANG S,et al.Screening of yogurt starter strains with low post-acidification capacity by ultraviolet mutagenesis[J].China Brewing,2011(1):127-130.
[6] 罗红霞,陈志刚,黄彦芳,等.原生质体融合技术选育弱后酸化乳酸菌菌株的研究[J].中国乳品工业,2010,38(1):8-11.
LUO H X,CHEN Z G,HUANG Y F,et al.Screening of the weak postacidification Lactobacillus strains using protolast fusion technology[J].China Dairy Industry,2010,38(1):8-11.
[7] 王雪妮,陈明,孙春玲,等.保加利亚乳杆菌H+-ATPase 弱化菌株的诱变选育[J].中国乳品工业,2013,41(8):8-11;28.
WANG X N,CHEN M,SUN C L,et al.Mutation breeding of H+-ATPase deficient mutant of Lactobacillus delbrueckii subsp.Bulgaricus[J].China Dairy Industry,2013,41(8):8-11;28.
[8] 杜磊,袁超.酸乳发酵中抗后酸化菌株的选育[J].食品科技,2014,39(12):38-42.
DU L,YUAN C.Breeding of an anti-postacidification strain in yogurt fermentation[J].Food Science and Technology,2014,39(12):38-42.
[9] NYABAKO B A,FANG H,CUI F J,et al.Enhanced acid tolerance in Lactobacillus acidophilus by atmospheric and room temperature plasma(ARTP) coupled with adaptive laboratory evolution(ALE)[J].Applied Biochemistry and Biotechnology,2020,191(4):1 499-1 514.
[10] 蔡静静,张亚川,李谞,等.新疆伊犁地区乳制品中乳酸菌发酵和益生特性及其复合发酵方案优化[J].食品科学,2020,41(18):172-179.
CAI J J,ZHANG Y C,LI X,et al.Fermentation and probiotic properties of lactic acid bacteria isolated from dairy products in Yili,Xinjiang and optimization of their mixtures for mixed-culture fermentation[J].Food Science,2020,41(18):172-179.
[11] COSTA G M,PAULA M M,BAR O C E,et al.Yoghurt added with Lactobacillus casei and sweetened with natural sweeteners and/or prebiotics:Implications on quality parameters and probiotic survival[J].International Dairy Journal,2019,97:139-148.
O C E,et al.Yoghurt added with Lactobacillus casei and sweetened with natural sweeteners and/or prebiotics:Implications on quality parameters and probiotic survival[J].International Dairy Journal,2019,97:139-148.
[12] 邢新会,张翀,张雪,等.常压室温等离子体(ARTP)微生物诱变育种机理研究及设备集成[C].中国酶工程与糖生物工程学术研讨会论文集.镇江:中国微生物学会酶工程专业委员,2015.
XING X H,ZHANG C,ZHANG X,et al.Research on the mechanism of microbial mutagenesis breeding and equipment integration of atmospheric and room temperature plasma(ARTP)[C].Proceedings of Chinese Symposium on Enzyme Engineering and Sugar Bioengineering.Zhenjiang:Enzyme Engineering Committee of Chinese Society for Microbiology,2015.
[13] ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology,2014,98(12):5 387-5 396.
[14] 叶坚.应用常压室温等离子体诱变技术选育蛋白质谷氨酰胺酶高产菌株[D].上海:华东师范大学,2018.
YE J.Mutagenesis breeding of protein glutaminase high-producing strains by atmospheric room temperature plasma(ARTP)[D].Shanghai:East China Normal University,2018.
[15] 李英英,杭海峰,庄英萍,等.常压常温等离子体(ARTP)诱变选育顶头孢霉高产菌[J].中国抗生素杂志,2017,42(11):945-950.
LI Y Y,HANG H F,ZHUANG Y P,et al.High throughput screening of high-yield cephalosporin C producing strain by mutagenesis using atmospheric and room temperature plasma(ARTP)[J].Chinese Journal of Antibiotics,2017,42(11):945-950.
[16] 孙懿琳.弱后酸化保加利亚乳杆菌菌株的筛选及其后酸化机理[D].哈尔滨:东北农业大学,2013.
SUN Y L.The screening and research on the mechanism of Lactobacillus bulgaricus with low-postacidification ability[D].Harbin:Northeast Agricultural University,2013.
[17] 汪天,李娟,郭世荣,等.外源多胺对低氧胁迫下黄瓜幼苗根系生长及H+-ATP酶和H+-焦磷酸酶活性的影响[J].植物生理与分子生物学学报,2005(6):637-642.
WANG T,LI J,GUO S R,et al.Effects of exogenous polyamines on the growth and activities of H+-ATPase and H+-PPase in cucumber seedling roots under hypoxia stress[J].Acta Photophysiologica Sinica,2005(6):637-642.
[18] 张祥.低H+-ATPase活性植物乳杆菌突变菌的筛选及其调控机制的研究[D].杭州:浙江科技学院,2017.
ZHANG X.Isolation,characterization and the mechanism of the H+-ATPase-defective mutants from Lactobacillus plantarum[D].Hangzhou:Zhejiang University of Science and Technology,2017.
[19] ONGOL M P,SAWATARI Y,EBINA Y,et al.Yoghurt fermented by Lactobacillus delbrueckii subsp.bulgaricus H+-ATPase-defective mutants exhibits enhanced viability of Bifidobacterium breve during storage[J].International Journal of Food Microbiology,2007,116(3):358-366.
[20] 杨行.新疆传统酸奶乳酸菌分离鉴定及在驴乳酸奶研制中的应用[D].喀什:喀什大学,2020.
YANG H.Isolation and identification of lactic acid bacteria from Xinjiang traditional yogurt and its application in the development of donkey milk yogurt[D].Kashi:Kashi University,2020.
[21] 廖长生,余志坚,曹永强.一种酸奶制备工艺中的酸度滴定装置:CN209563435U[P].2019-11-01.
LIAO C S,YU Z J,CAO Y Q.An acidity titration device in yogurt preparation process:CN209563435U[P].2019-11-01.
[22] 文鹏程,曹磊,马瑞娟,等.甘南牧区牦牛曲拉中乳酸菌的分离、鉴定及性能研究[J].食品工业科技,2020,41(13):112-117.
WEN P C,CAO L,MA R J,et al.Isolation,identification and characterization of lactic acid bacteria from Qula in Gannan[J].Science and Technology of Food Industry,2020,41(13):112-117.
[23] 刘文龙,钱娟娟,王兴吉,等.ARTP与紫外线复合诱变选育高产酸性蛋白酶菌株的研究[J].食品与发酵科技,2018,54(6):5-8.
LIU W L,QIAN J J,WANG X J,et al.Study on selected breeding of high-yielding strains of producing acidic protease by UV/ARTP mutagenesis[J].Food and Fermentation Sciences & Technology,2018,54(6):5-8.
[24] 徐冬梅,李亚英,崔海波,等.雷帕霉素菌株的常压室温等离子体(ARTP)诱变选育[J].基因组学与应用生物学,2020,39(1):159-164.
XU D M,LI Y Y,CUI H B,et al.Mutagenesis and breeding of rapamycin strain by atmospheric pressure and room temperature plasma(ARTP)[J].Genomics and Applied Biology,2020,39(1):159-164.
[25] SUN X,LI P F,LIU X S,et al.Strategies for enhanced lipid production of Desmodesmus sp.mutated by atmospheric and room temperature plasma with a new efficient screening method[J].Journal of Cleaner Production,2020,250:119 509.
[26] 周德龙,牛春,张萍.常压室温等离子体(ARTP)诱变及工艺优化筛选螺旋霉素高产菌株[J].内蒙古科技与经济,2016(24):96-98;101.
ZHOU D L,NIU C,ZHANG P.Screening strains with high spiramycin yield by atmospheric and room temperature plasma(ARTP) mutagenesis and process optimization[J].Inner Mongolia Science Technology&Economy,2016(24):96-98;101.
[27] AN J,GAO F L,MA Q Y,et al.Screening for enhanced astaxanthin accumulation among Spirulina platensis mutants generated by atmospheric and room temperature plasmas[J].Algal Research,2017,25:464-472.
[28] 陈霞,孙志宏,张文弈,等.酸胁迫对干酪乳杆菌H+-ATP酶基因表达的影响[J].微生物学通报,2007(3):479-482.
CHEN X,SUN Z H,ZHANG W Y,et al.Expression of H+-ATPase gene associated with different acidic condition in Lactobacillus casei[J].Microbiology,2007(3):479-482.