鱼露是一种以低值鱼虾为原料,经过长时间自然发酵制得的调味品,具有独特的风味和营养价值。鱼露味道鲜美,富含氨基酸、有机酸、微量元素以及抗氧化活性物质等成分[1],备受东南亚以及我国南方沿海一带人民的喜爱。我国鱼露的生产过程是将新鲜的鱼与高浓度的盐(质量分数20%~30%)混合,通过耐盐性、嗜盐性微生物和鱼体自身所含的酶将鱼蛋白分解成肽和氨基酸,最终形成一种清澈的琥珀色液体[2]。鱼露完全依靠自然发酵,需要12~24个月,生产周期长,是目前鱼露生产企业面临的难题。
采用加菌或加酶发酵是目前鱼露快速发酵常用的方法。有研究者将可以产生多种高活性酶且安全性较高的微生物菌株应用到鱼露发酵过程中。SUN等[3]添加Aspergillus oryzae OAY1进行鱼露发酵,虽然发酵速度有所提高,但失去了鱼露的特征风味,同时容易污染杂菌,造成腐败变质。为避免杂菌污染,国内外对快速发酵鱼露的研究主要集中于从鱼露发酵过程中筛选产蛋白酶菌株作为发酵剂,分析菌种发酵对鱼露发酵速度以及各项理化指标的影响。目前,从鱼露等传统发酵食品中筛选到的菌属主要包括乳杆菌属(Lactobacillus sp.)[4-5]、枝芥孢杆菌属(Virgibacillus sp.)[6-8]、平球菌属(Planococcus sp.)[9]、嗜盐杆菌属(Halobacterium sp.)[10]、四联球菌属(Tetragenococcus sp.)[11-13]等。但由于上述菌株产酶能力低,在高盐环境下失活等限制因素,未能实现在鱼露发酵产业中的应用。采用添加蛋白酶制剂发酵鱼露时,其种类主要为中性、碱性蛋白酶等商用酶制剂,酶解效果差、耐盐能力低、应用成本高,缺少适合鱼露发酵的专用酶制剂。
本研究利用透明圈法从鱼露发酵液中筛选到了1株产蛋白酶且耐盐的菌株B-2,采用VITEK 2 COMPACT细菌鉴定系统和16S rRNA基因序列分析分别对其进行生理生化和分子生物学鉴定,利用扫描电子显微镜观察菌株在不同盐度下的形态变化,评价菌株的耐盐能力,并分别对培养基成分和发酵条件进行了优化。
1 材料与方法
1.1 材料与试剂
1.1.1 鱼露发酵液样品
不同发酵时间下的鱼露发酵液,汕头鱼露厂有限公司。
1.1.2 试剂
豆粕、酪蛋白、酪氨酸标准品,北京索莱宝生物科技有限公司;Na2CO3、NaCl、三氯乙酸,上海麦克林生化科技有限公司;福林-酚试剂,国药集团化学试剂有限公司;VITEK 2 BCL卡,法国生物梅里埃公司。
1.1.3 培养基
初筛平板培养基(g/L):胰蛋白胨5.0,酵母膏粉2.5,葡萄糖1.0,琼脂15.0,脱脂奶粉30.0,蒸馏水1 000 mL,pH (7.0±0.2)。
液态发酵培养基(g/L):蛋白胨10.0,酵母膏粉5.0,NaCl 5.0,葡萄糖1.0,蒸馏水1 000 mL,pH 7.0±0.2。
1.2 实验方法
1.2.1 菌株筛选
初筛采用水解圈的方法:将鱼露发酵液用无菌生理盐水稀释,取100 μL稀释的鱼露发酵液均匀涂布于初筛平板培养基,于37 ℃恒温培养箱培养直至有透明圈出现。挑取透明圈直径较大的菌落进行分离纯化。通过测定蛋白酶活力进行复筛:将纯化后的菌株分别进行液体发酵培养,发酵温度为37 ℃,摇床转速为180 r/min,发酵时间为24 h。筛选出产蛋白酶活力最高的菌株在4 ℃冰箱保藏。
1.2.2 菌株鉴定
用接种环将新鲜培养的细菌在聚苯乙烯试管壁上研磨,用无菌水(含4.5 g/L NaCl)将菌液浊度调至1.8~2.0 MCF。将BCL卡片和菌株悬浊液一同放入VITEK 2 COMPACT细菌鉴定仪。
菌株B-2的分子生物学鉴定采用16S rRNA基因测序(北京六合华大基因科技有限公司)的方法。选择与B-2基因序列相似度较高且为同一菌属的标准菌株,然后使用Clustal W进行多序列对比分析。在MEGA 5.1软件中选择邻位相连法(Neighbor-Joining)进行系统发育进化树的构建。
1.2.3 菌株在不同盐环境下细胞形态和生长情况
菌株B-2种子液以2%的接种量分别接种到含0、50、100、150、200、300 g/L NaCl的发酵培养基中,在37 ℃、180 r/min下培养48 h。发酵液离心后弃去上清液,菌体经过清洗、固定、脱水、冷冻干燥等步骤,在扫描电子显微镜下观察细胞形态。采用干重法评价菌株在不同盐环境下生长情况。将在不同盐浓度下培养的发酵液于12 000 r/min离心10 min,菌体用无菌超纯水洗涤1次,110 ℃烘箱烘至恒重后称质量,计算菌体生物量(g/L)。
1.2.4 培养基成分优化
1.2.4.1 碳源种类及浓度
分别以1 g/L的淀粉、麦芽糖、果糖、蔗糖、乳糖、葡萄糖为发酵培养基中的碳源,其他成分不变。各培养基发酵液中产蛋白酶活力最高的成分确定为最适碳源。同时研究不同碳源含量对蛋白酶活力的影响,确定最适碳源添加量。
1.2.4.2 氮源种类及浓度
在上述培养基的基础上,分别以5 g/L的脱脂奶粉、酪蛋白、豆粕、牛肉膏、硫酸铵、蛋白胨作为发酵培养基中的氮源。各培养基发酵液中产蛋白酶活力最高的成分确定为最适氮源。同时研究不同氮源含量对蛋白酶活力的影响,确定最适氮源添加量。
1.2.4.3 NaCl质量浓度
在上述培养基的基础上,添加NaCl进行发酵,NaCl的质量浓度分别设为0、5、10、15、20、25 g/L,测定发酵液中蛋白酶活力,确定最适NaCl添加量。
1.2.4.4 响应面优化培养基成分
在单因素实验的基础上,以果糖(A)、豆粕(B)、NaCl(C)质量浓度为因素,发酵液中蛋白酶活力(Y)为响应值,利用响应面软件中的Box-Behnken法,设计3因素3水平的实验,确定培养基中各成分的添加量。
1.2.5 发酵条件优化
1.2.5.1 pH
在最适培养基条件下,将培养基pH分别调至6、7、8、9、10、11,通过发酵液产蛋白酶活力的大小,探究菌株最适产酶pH。
1.2.5.2 温度
在上述条件下,将菌株B-2置于25、30、35、40、45、50 ℃的温度下培养,通过测定发酵液中蛋白酶活力的大小,探究菌株最适产酶温度。
1.2.5.3 接种量
在上述条件下,分别将接种量设置为1%、2%、3%、4%、5%,通过测定发酵液中蛋白酶活力的大小,探究菌株最适产酶接种量。
1.2.5.3 响应面优化培养基成分
在单因素实验的基础上,以pH(X1)、温度(X2)、接种量(X3)为因素,发酵液中蛋白酶活力(Y)为响应值,利用响应面软件中的Box-Behnken法,设计3因素3水平的实验,确定菌株最适发酵条件。
1.2.6 发酵条件优化
菌株产蛋白酶活力的测定均采用福林法
1.2.7 统计分析
每组实验重复测定3次,然后使用SPSS 20.0对实验数据进行单因素方差分析(one-way ANOVA),使用Tukey法检验数据差异性(P<0.05)。
2 结果与分析
2.1 菌株筛选及鉴定
从鱼露发酵液中初筛得到16株能够产生明显透明圈的菌株(图1)。
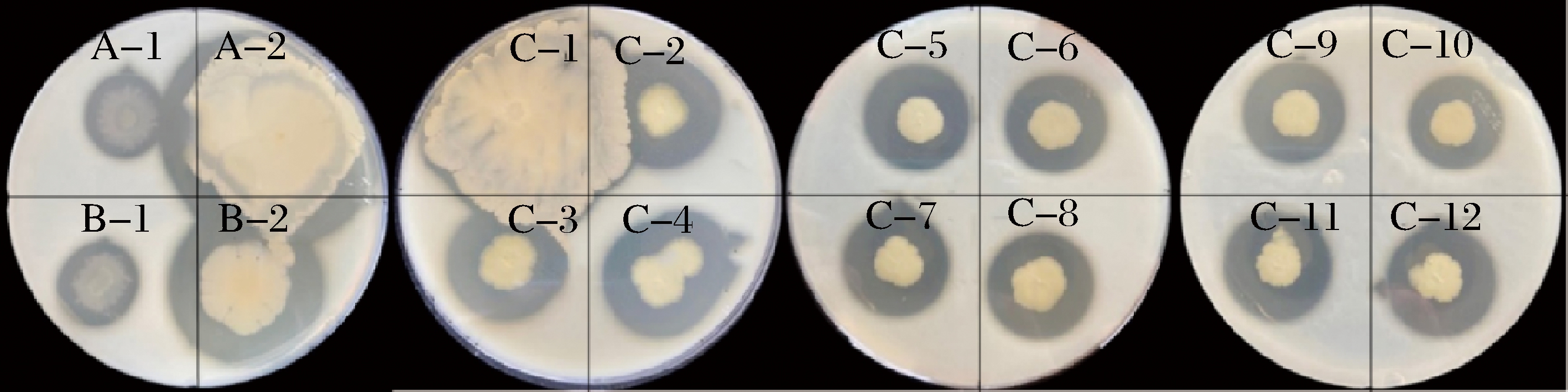
图1 鱼露中产蛋白酶菌株水解透明圈形态
Fig.1 Protease hydrolyzed transparent circles of the primary screening strains in fish sauce
复筛结果显示,发酵9个月的鱼露中分离出的菌株B-2产蛋白酶活力最高,达到28.05 U/mL(图2)。
菌株B-2的生理生化鉴定结果如表1所示,其符合芽胞杆菌的特征反应,初步确定菌株B-2属于芽胞杆菌属(Bacillus)。
进一步的菌株B-2基因测序结果显示,其与多种Bacillus的菌株高度相似。利用B-2基因序列与相近的标准菌株构建系统发育进化树,菌株B-2的16S rRNA基因序列与Bacillus subtilis NCIB 3610的距离最近(图3),两者同源性为100%。结合菌株B-2特征反应和16S rRNA基因序列,确定该菌为Bacillus subtilis,并命名为Bacillus subtilis B-2。目前,已经从鱼露发酵液中筛选到B.megaterium[13]、B.piscicolaNR1-3-2T[14],B.licheniformis RKK-04[15]等其他芽胞杆菌属,但是对于枯草芽胞杆菌的筛选较少。本研究也是近年来,首次从中国传统发酵鱼露中筛选到B.subtilis。
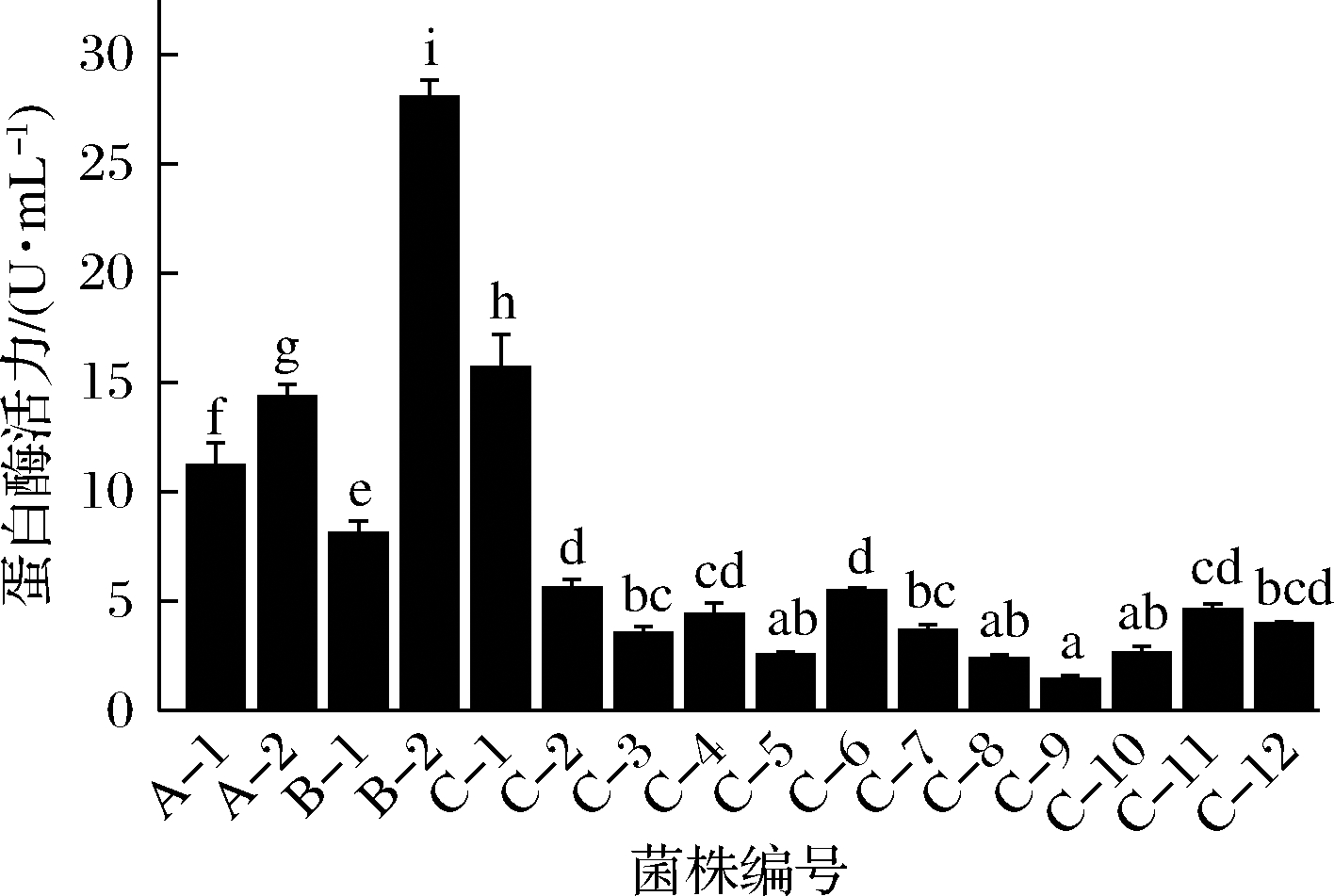
图2 筛选菌株的产蛋白酶活力测定
Fig.2 Protease activity of the strains
表1 利用VITEK 2 COMPACT细菌鉴定系统分析菌株B-2的生理生化特征
Table 1 Physiological and biochemical characteristics of strain B-2 tested by VITEK 2 COMPACT

试验结果试验结果试验结果试验结果β-木糖苷酶+APPA+D-甘露糖+菊粉+L-赖氨酸芳胺酶-环糊精-D-松三糖-D-葡萄糖+L-天冬氨酸芳胺酶-D-半乳糖-氨基葡萄糖-D-核糖+亮氨酸芳胺酶(-)糖原+古老糖(+)腐胺同化-苯丙氨酸芳胺酶+肌醇+L-鼠李糖-在6.5%NaCl生长+L-脯氨酸芳胺酶-吡喃葡萄糖苷酸化+β-葡糖苷酶+对卡那霉素耐药+β-半乳糖苷酶(+)ELLMAN-β-甘露糖苷酶_对竹桃霉素耐药+L-吡咯烷酮芳胺酶+甲基-D-木糖苷-磷酰胆碱_七叶苷水解+α-半乳糖苷酶+α-甘露糖苷酶-丙酮酸盐+红四氮唑+丙氨酸芳胺酶-麦芽三糖(+)α-葡糖苷酶-对多粘菌素耐药-酪氨酸芳胺酶-甘氨酸芳胺酶+D-塔格糖-乙酰氨基葡糖苷酶-D-甘露醇+D-海藻糖+
注:+,阳性反应;-,阴性反应;(+),弱阳性反应;(-),弱阴性反应

图3 利用Neighbor-Joining构建菌株B-2系统发育进化树
Fig.3 Phylogenetic tree of strain B-2 constructed by Neighbor-Joining method
2.2 菌株耐盐性
菌株B-2在不同盐含量下的产酶情况如图4-a所示。培养12 h,菌株生成的菌落较小,分解蛋白质较少、产生透明圈较小、产酶较少,可能是由于培养时间太短,菌株还未完全生长;培养24 h,各平板上均有较明显的透明圈出现,其中不含NaCl的平板上透明圈最为明显,含100 g/L NaCl的平板上透明圈最小;培养48 h,含50和100 g/L NaCl平板中透明圈进一步扩大,说明菌株B-2在0~100 g/L NaCl环境中均生长并产生蛋白酶。
在不同盐环境下对应的扫描电镜细胞形态如图4-b所示。当在不含盐的环境下培养时,菌株B-2呈杆状,细胞大小(长×宽)为1.44 μm×540 nm,表面光滑,细胞结构完整;当在50 g/L的NaCl环境下培养时,细胞虽无明显破裂,但细胞变短至1.02 μm×663 nm,呈短杆状;当在100 g/L的NaCl环境下培养时,高环境的渗透压对细胞形态影响较大,细胞被拉长到11.5 μm×658 nm,呈长条状且细胞结构有轻微破裂。

a-产酶情况;b-细胞形态
图4 菌株B-2在高盐条件下产蛋白酶特性、形态特征
Fig.4 Protease production,morphological characteristics of strain B-2 under high salinity
当NaCl含量超过150 g/L时,细胞表面形成明显褶皱,大小和形态与不加盐时无显著变化。由此推断,在0~100 g/L NaCl质量浓度下,细胞代谢旺盛,能够通过改变自身形态来应对不同盐浓度环境。而当NaCl质量浓度超过150 g/L时,细胞代谢受到显著抑制,并对细胞造成一定损害。
进一步研究了不同盐环境下菌株B-2的生长情况,结果如图5所示。随着NaCl含量增加,生物量呈下降趋势,但与初始接种量相比,在200 g/L的条件下菌株的生物量依然显著增加,在300 g/L的条件下菌株依然能够缓慢生长。结果表明,该菌株具有很强的耐盐性,在200~300 g/L的盐环境下仍能够保持生长和代谢。与其他已报道的产蛋白酶菌株相比,菌株B-2具有较强的耐盐特性,为缩短鱼露发酵时间,提高生产效率提供了一种新的发酵剂。
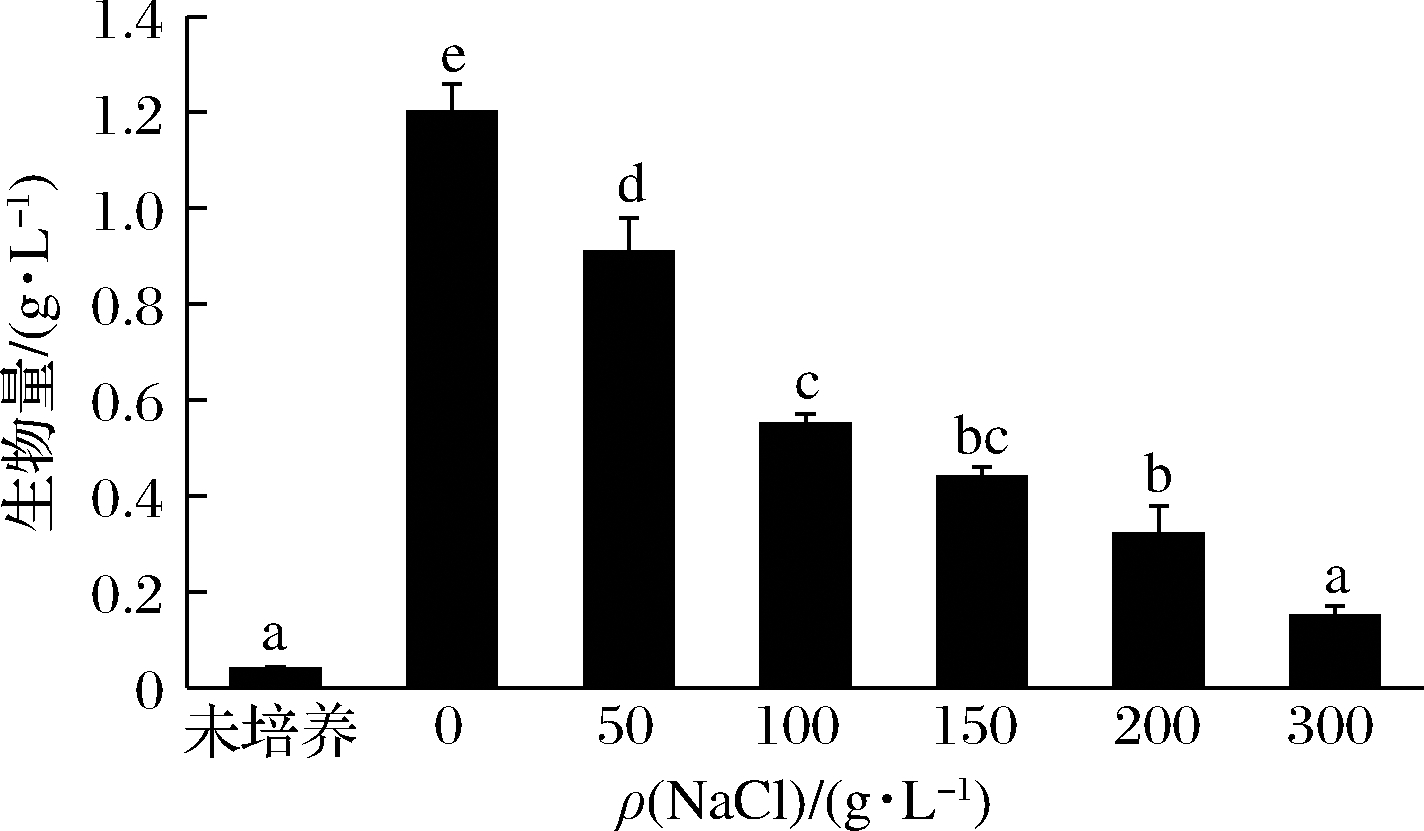
图5 菌株B-2在不同盐条件下生物量
Fig.5 Biomass of strain B-2 under different salinity
2.3 培养基成分优化
2.3.1 碳源种类及浓度
图6-a显示,以果糖作为碳源时,发酵液中产蛋白酶活力最大值为30.60 U/mL。这与产蛋白酶菌株B.luteus H11[16]的研究结果一致。果糖含量太低导致微生物营养不足,影响生长代谢;果糖含量太高导致渗透压增大,影响菌株生长和产酶。通过测定果糖含量对菌株产酶的影响发现,当果糖含量为0.5 g/L时的蛋白酶活力最高(图6-b),达到49.77 U/mL。因此,以0.5 g/L的果糖作为优化培养基的碳源。
2.3.2 氮源种类及浓度
不同种类氮源对菌株B-2产蛋白酶活力的影响如图6-c所示。当培养基中分别添加蛋白胨、酪蛋白、豆粕等有机氮与硫酸铵等无机氮时,菌株B-2所产蛋白酶的活力存在显著差异。该菌株对无机氮利用率较差、产蛋白酶活力低,对有机氮利用率较好,产蛋白酶活力普遍较高。当以成本最低的豆粕作为培养基碳源时,蛋白酶的活力最高,达到63.25 U/mL,且发酵液具有独特的大豆清香味。本研究结果与产蛋白酶的B.subtilis WB600[17]研究结果一致。豆粕中含有多种蛋白质、无机盐、维生素和促生长因子,与其他氮源相比,营养更丰富,更能促进蛋白酶的生成。通过测定豆粕含量对菌株产酶的影响,发现当豆粕含量为15 g/L时,蛋白酶活力达到97.63 U/mL(图6-d)。因此,培养基中豆粕的添加量为15 g/L。
2.3.3 NaCl浓度
Na+可以维持细胞渗透压,是微生物发酵培养基中的必要成分。图6-e表明当培养基中NaCl为5 g/L时,蛋白酶活力最高,为103.38 U/mL;NaCl为10 g/L时,蛋白酶活力略有下降;NaCl质量浓度超过25 g/L时,测定蛋白酶活力值为仍超过57 U/mL,表明该菌在高盐条件具有较稳定的产蛋白酶能力。因此,确定菌株B-2产酶优化培养基最适NaCl质量浓度为5 g/L。
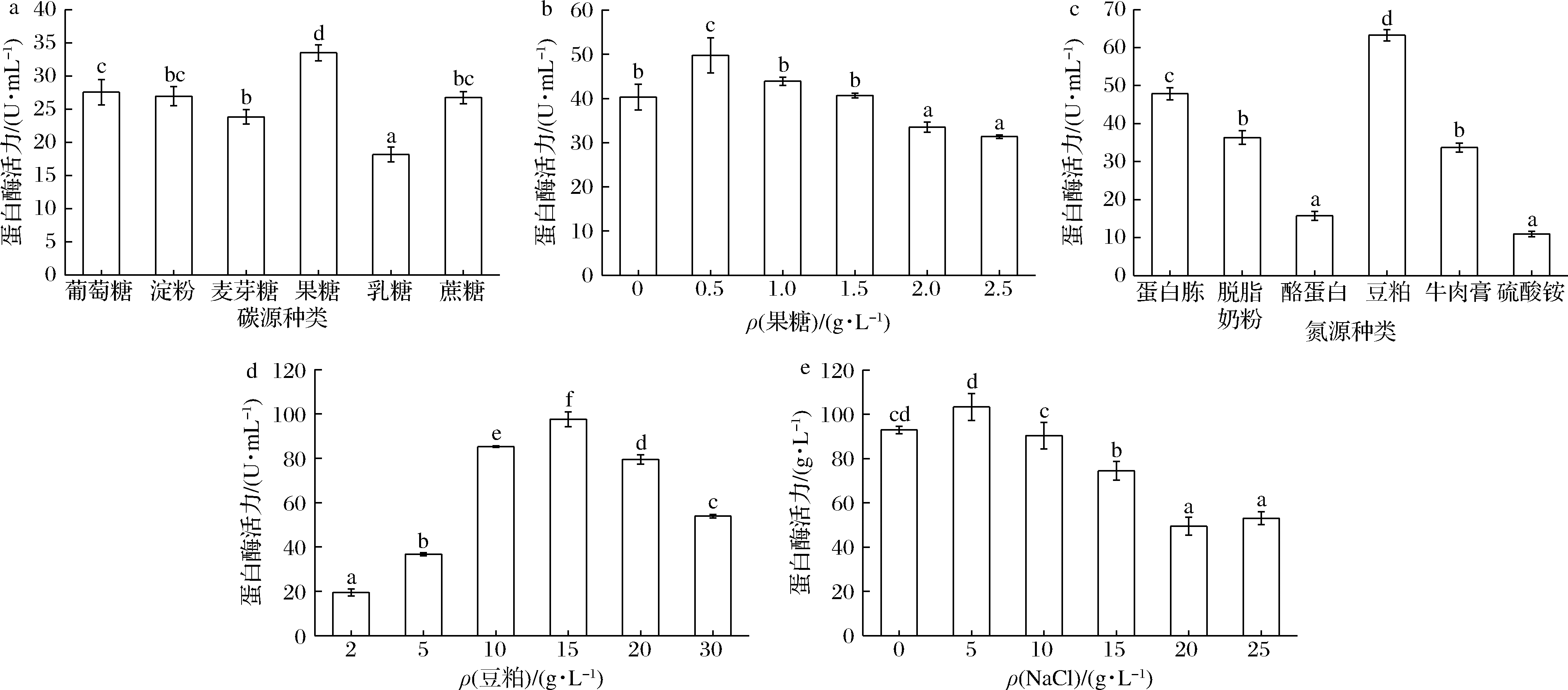
a-碳源种类;b-果糖浓度;c-氮源种类;d-豆粕浓度;e-NaCl浓度对蛋白酶活力的影响
图6 培养基成分单因素实验
Fig.6 Single factor experiment of medium compositions
2.3.4 响应面优化培养基成分
根据单因素的实验结果,以果糖质量浓度(A)、豆粕质量浓度(B)、NaCl质量浓度(C)为响应面实验的3个因素,以蛋白酶活力(Y)为响应值,采用Box-Behnken法设计的实验方案[18]和实验结果如表2所示。
表2 培养基成分响应面设计方案及结果
Table 2 Response surface design scheme and results of medium compositions
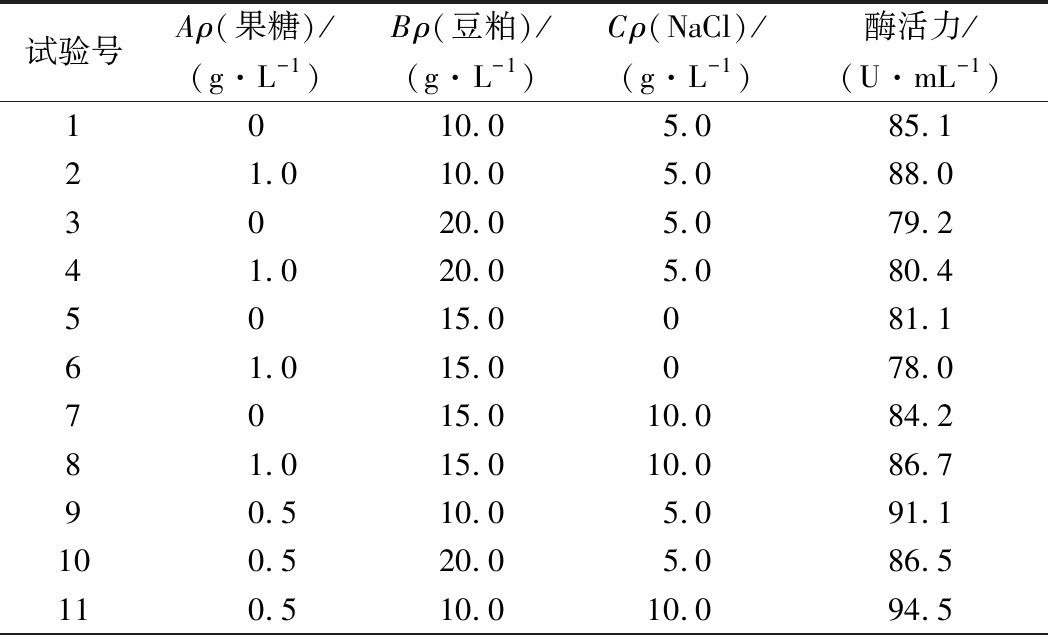
试验号Aρ(果糖)/(g·L-1)Bρ(豆粕)/(g·L-1)Cρ(NaCl)/(g·L-1)酶活力/(U·mL-1)1010.05.085.121.010.05.088.03020.05.079.241.020.05.080.45015.0081.161.015.0078.07015.010.084.281.015.010.086.790.510.05.091.1100.520.05.086.5110.510.010.094.5
续表2
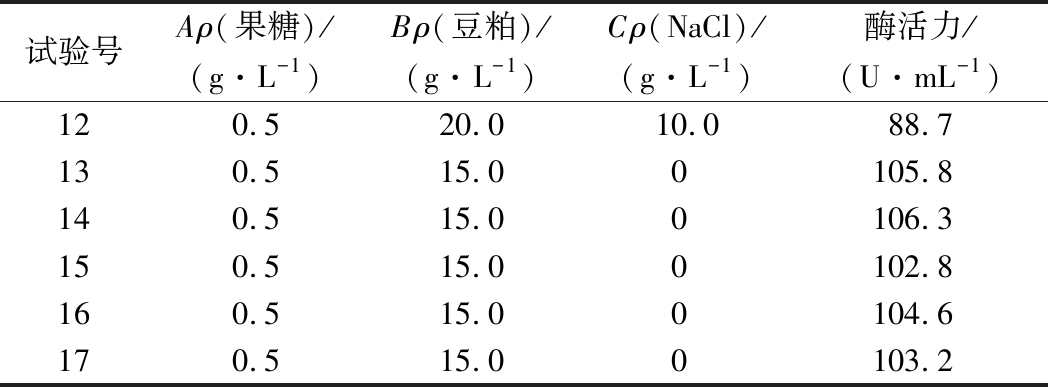
试验号Aρ(果糖)/(g·L-1)Bρ(豆粕)/(g·L-1)Cρ(NaCl)/(g·L-1)酶活力/(U·mL-1)120.520.010.088.7130.515.00105.8140.515.00106.3150.515.00102.8160.515.00104.6170.515.00103.2
果糖、豆粕、NaCl质量浓度与蛋白酶活力之间的关系可以用多元二次回归方程表示:Y=104.54+2.17A-2.99B+0.44C-0.30AB+1.39AC-0.43BC-7.50A2-6.84B2-14.53C2。培养基中果糖0.57 g/L、豆粕13.88 g/L、NaCl 5.13 g/L时,预测蛋白酶的酶活力最高可达105.04 U/mL。
由表3中方差分析可得,该模型P<0.000 1,失拟项P=0.411 7>0.05,说明该模型可以准确的反映3因素与响应值之间的关系。同时,该模型R2=0.988 6,说明该模型与实验拟合程度好,利用该方程预测的不同条件下蛋白酶活力实验误差小,因此可以用此模型进行分析和预测。根据F值大小,各个因素对菌株产酶的影响顺序为:B(豆粕质量浓度)>A(果糖质量浓度)>C(NaCl质量浓度)。利用响应面优化后的培养基进行了3次验证实验,蛋白酶酶活平均值为106.41 U/mL,非常接近模型的预测值,表明实验得到的模型可以用于预测实际值。
表3 培养基成分响应面分析实验方差分析
Table 3 Analysis of variance in the response surface analysis of medium compositions
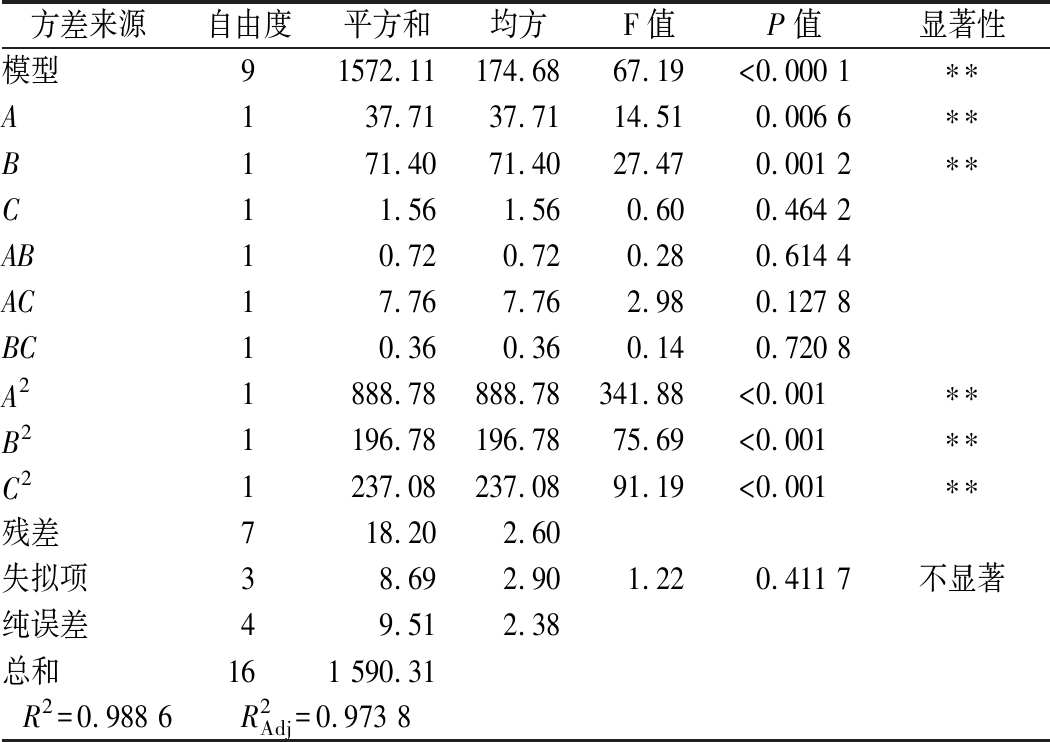
方差来源自由度平方和均方F值P值显著性模型91572.11174.6867.19<0.000 1∗∗A137.7137.7114.510.006 6∗∗B171.4071.4027.470.001 2∗∗C11.561.560.600.464 2AB10.720.720.280.614 4AC17.767.762.980.127 8BC10.360.360.140.720 8A21888.78888.78341.88<0.001∗∗B21196.78196.7875.69<0.001∗∗C21237.08237.0891.19<0.001∗∗残差718.202.60失拟项38.692.901.220.411 7不显著纯误差49.512.38总和161 590.31R2=0.988 6 R2Adj=0.973 8
注:*差异显著(P<0.05);**差异极显著(P<0.01)
2.4 发酵条件优化
2.4.1 pH值
pH可以改变培养基成分的离子化程度,影响营养物质的吸收,同时可以调节细胞膜的电负性和渗透性,影响转运和代谢过程[19]。图7-a显示了菌株B-2在pH 6~11蛋白酶活力的变化。在弱酸性环境下(pH=6)产酶较低,可能是因为在弱酸性环境下,各种金属的溶解度很高,这些金属很容易穿过细胞膜,造成不良的氧化还原反应,破坏细胞膜,导致细胞死亡[20]。当pH为7~9,蛋白酶活力逐渐增加,因此该菌株产蛋白酶类型为碱性蛋白酶。当pH为9时,蛋白酶活力最高,为157.71 U/mL。当pH超过10,蛋白酶活力迅速下降。研究发现,B.subtilis产蛋白酶活力最适pH普遍在7~9,B.subtilis UMN-26[21]最适pH为7,B.subtilis Ve1[22]最适pH为8,而菌株B-2的最适pH与吴海波等[23]的研究结果相似,均在pH为9时有最大酶活力。因此,确定菌株B-2最适pH为9。
2.4.2 温度
微生物细胞中的糖类、脂质、蛋白质等营养物质都需要在酶的催化作用下分解,而各种酶的催化作用均需要适宜的温度,因此温度对微生物代谢过程有重要影响[24]。图7-b显示,随着温度的升高酶活力逐渐增大,30 ℃时达到峰值,为177.33 U/mL。培养温度30~40 ℃时,酶活力下降趋势缓慢,表明该菌对高温具有较强适应性,即使在50 ℃下培养,蛋白酶活力仍能达到90.02 U/mL。因此,确定菌株B-2最佳发酵温度为30 ℃。中国传统鱼露通常是在(30±2) ℃的环境下,露天发酵而成。菌株最适温度和鱼露发酵温度一致,有利于菌株B-2在鱼露快速发酵中的应用。
2.4.3 接种量
适宜的接种量可以有效提高发酵速度,在工业应用时,可以有效的节约时间和成本。接种量太小,菌体密度未达到生长要求,造成微生物生长缓慢;接种量太大则会造成菌体密度过大,菌株生长时供氧不足,影响生长,造成产酶下降。由图7-c可知,当接种量为4%时,酶活力达到最大值190.36 U/mL。研究发现,从大豆发酵食品中分离出的B.subtilis W1[25]最适接种量与本实验一致,均为4%。因此,确定菌株B-2最佳接种量为4%。
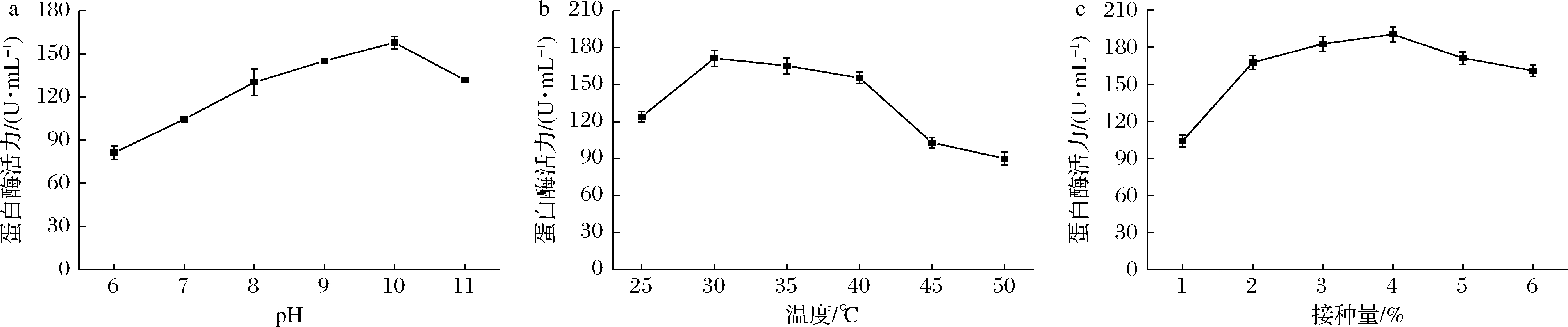
a-pH;b-温度;c-接种量
图7 发酵条件单因素实验
Fig.7 Single factor experiment of fermentation conditions
2.4.4 响应面优化发酵条件
根据发酵条件单因素实验结果,以pH(X1)、温度(X2)、接种量(X3)为响应面实验的3个因素,以蛋白酶酶活力(Y)为响应值,采用Box-Behnken试验设计实验方案和结果如表4所示。pH、温度、接种量与蛋白酶活力之间的关系可以用如下多元二次回归方程表示:Y=190.29+15.18A+13.86B+13.41C-14.70AB-1.40AC+9.53BC-21.78A2-53.26B2-7.41C2。当pH为9.4、温度为28.4 ℃、接种量为4.9%时,预测蛋白酶活力理论得率可达201.88 U/mL。
表4 发酵条件响应面设计方案及结果
Table 4 Response surface design scheme and results of fermentation conditions
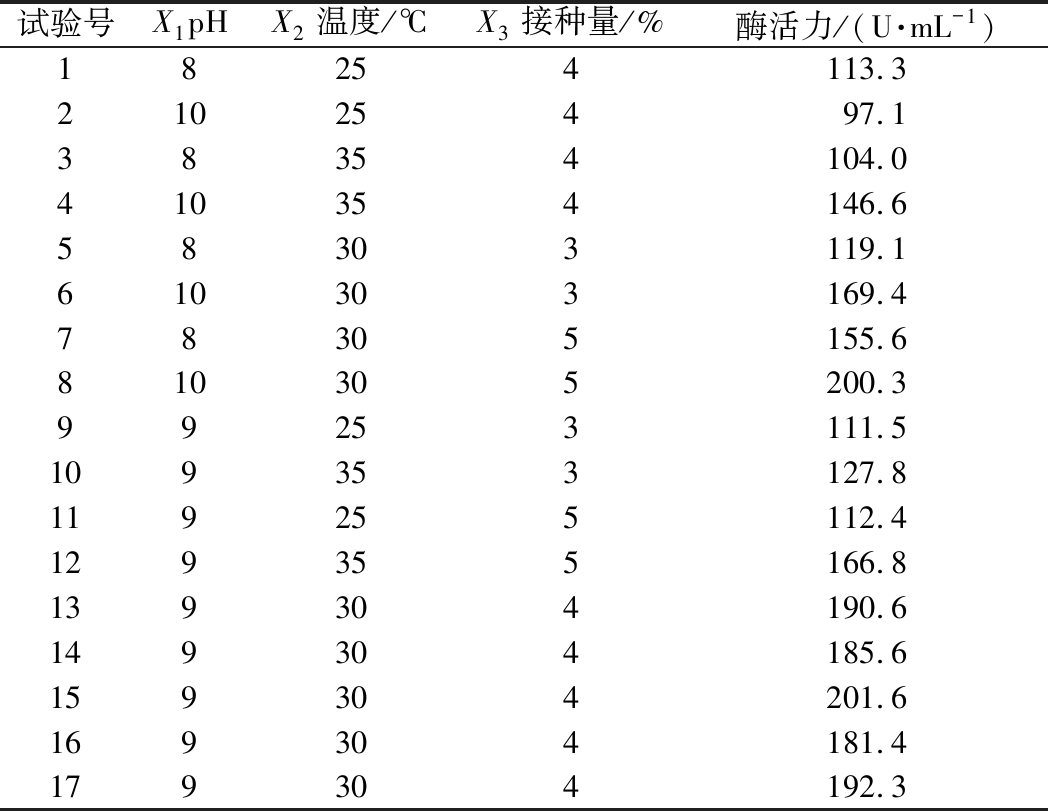
试验号X1pHX2温度/℃X3接种量/%酶活力/(U·mL-1)18254113.321025497.138354104.0410354146.658303119.1610303169.478305155.6810305200.399253111.5109353127.8119255112.4129355166.8139304190.6149304185.6159304201.6169304181.4179304192.3
发酵条件方差分析结果如表5所示,整体模型P=0.007<0.01,失拟项P=0.087 6>0.05,可知该模型回归极显著,失拟项不显著。该模型中的R2=0.988 6说明拟合程度较好,能较好的预测不同条件下蛋白酶活力,因此可以用此模型进行分析和预测。根据F值大小,各个因素对菌株产酶的影响顺序为:X1(pH)>X2(温度)>X3(接种量)。利用经响应面优化后的发酵条件进行了3次验证实验,蛋白酶酶活力平均值为200.63 U/mL。与预测值基本一致,表明该模型准确性和实用性较高,能够较好地预测蛋白酶活力。
表5 发酵条件响应面分析实验方差分析
Table 5 Analysis of variance in the response surface analysis of fermentation conditions

方差来源自由度平方和均方F值P值显著性模型92 346.322 346.3215.930.007∗∗X111 842.241 842.2412.510.009 5∗∗X211 537.351 537.3510.440.014 4∗X311 439.161 439.169.770.016 7∗X1X21864.36864.365.870.045 9∗X1 X317.847.840.0530.824 2X2 X31362.90362.902.460.160 5X2111 997.981 997.9813.560.007 8∗∗X22111 943.0211 943.0281.07<0.000 1∗∗
续表5
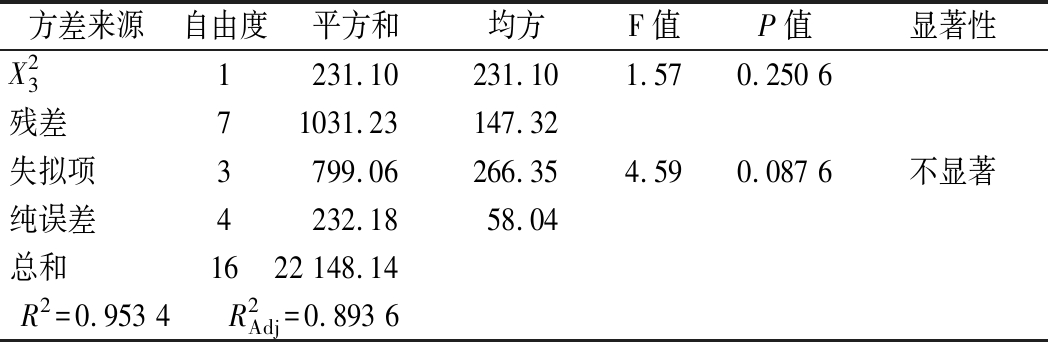
方差来源自由度平方和均方F值P值显著性X231231.10231.101.570.250 6残差71031.23147.32失拟项3799.06266.354.590.087 6不显著纯误差4232.1858.04总和1622 148.14R2=0.953 4 R2Adj=0.893 6
注:*差异显著(P<0.05);**差异极显著(P<0.01)
B.subtilis具有强大的产酶系统,能够利用葡萄糖、蛋白质等营养物质,在生长过程分泌中性、碱性蛋白酶、脂肪酶、纤维素酶等多种胞外酶[26]。同时,B.subtilis作为一种安全性极高的发酵剂,在发酵食品中有诸多应用。PONGSETKUL等[27]从泰国咸虾酱中筛选到1株产蛋白酶菌株B.subtilis K-C3,在发酵前接种该菌株可以有效提高虾酱的发酵速率。相比而言,本研究筛选到的B.subtilis B-2具有更高的产蛋白酶活力,通过添加该菌有望提高传统鱼露的发酵效率,而且通过对蛋白酶的分离纯化,有望开发出一种适合于鱼露发酵生产的专用酶制剂。
3 结果与讨论
本文从鱼露发酵液中分离到1株耐盐且产蛋白酶的菌株,经生理生化鉴定和16S rRNA分子生物学鉴定,该细菌为Bacillus subtilis,并命名为Bacillus subtilis B-2。利用扫描电子显微镜观察菌株在不同盐环境下的形态,并分析其生长情况,发现该菌株具有很强的耐盐性,在200~300 g/L的盐环境下仍能够保持生长和代谢,并维持较为完整的细胞结构。优化后的培养基成分为果糖0.57 g/L、豆粕13.88 g/L、NaCl 5.13 g/L,最适发酵条件为pH 9.4、温度28.4 ℃、接种量4.9%。在此条件下生长的菌株产蛋白酶活力是原来的7.15倍。与其他菌株相比,B.subtilis B-2具有高耐盐性和产蛋白酶活性,因此该菌株及其产生的蛋白酶有望开发成鱼露专用发酵菌剂和酶制剂。
[1] 李春生,王悦齐,李来好,等.传统鱼露发酵过程中细菌群落演替及对其挥发性风味形成的影响分析[J].食品科学,2018,39(24):85-92.
LI C S,WANG Y Q,LI L H,et al.Bacterial community succession during fermentation of Chinese fish sauce and its effect on formation of volatile flavor components[J].Food Science,2018,39(24):85-92.
[2] WANG Y Q,LI C S,LI L H,et al.Effect of bacterial community and free amino acids on the content of biogenic amines during fermentation of yu-lu,a Chinese fermented fish sauce[J].Journal of Aquatic Food Product Technology,2018,27(4):496-507.
[3] SUN J N,YU X H,FANG B H,et al.Effect of fermentation by Aspergillus oryzae on the biochemical and sensory properties of anchovy(Engraulis japonicus) fish sauce[J].International Journal of Food Science & Technology,2016,51(1):133-141.
[4] 黄紫燕,刘春花,罗婷婷,等.鱼露发酵液中产蛋白酶乳酸菌的筛选及其添加应用[J].食品与发酵工业,2010,36(11):88-92.
HUANG Z Y,LIU C H,LUO T T,et al.Screening of proteinase-producing lactic acid bacteria from fish sauce and the application[J].Food and Fermentation Industries,2010,36(11):88-92.
[5] KARPARVAR N,SAFAEI H J,DERAKHSHANDEH A,et al.Isolation and identification of lactic acid bacteria from a traditional fermented fish sauce(Mahyaveh) in Fars province,Iran[J].International Journal of Nutrition Sciences,2019,4(1):49-53.
[6] SINSUWAN S,RODTONG S,YONGSAWATDIGUL J.Production and characterization of NaCl-activated proteinases from Virgibacillus sp.SK33 isolated from fish sauce fermentation[J].Process Biochemistry,2008,43(2):185-192.
[7] MONTRIWONG A,RODTONG S,YONGSAWATDIGUL J.Detergent-stable salt-activated proteinases from Virgibacillus halodenitrificans SK1-3-7 isolated from fish sauce fermentation[J].Applied Biochemistry and Biotechnology,2015,176(2):505-517.[PubMed]
[8] KUMAUNANG M,SANCHART C,SUYOTHA W,et al.Virgibacillus halodenitrificans MSK-10P,a potential protease-producing starter culture for fermented shrimp paste(Kapi) production[J].Journal of Aquatic Food Product Technology,2019,28(8):877-890.
[9] GAO R C,ZHOU J,LENG W J,et al.Screening of a Planococcus bacterium producing a cold-adapted protease and its application in low-salt fish sauce fermentation[J].Journal of Food Processing and Preservation,2020,44(8):e14625.
[10] AKOLKAR A V,DURAI D,DESAI A J.Halobacterium sp.SP1(1) as a starter culture for accelerating fish sauce fermentation[J].Journal of Applied Microbiology,2010,109(1):44-53.
[11] 伍蓉莉.嗜盐四联球菌的筛选及其发酵特性研究[D].广州:华南农业大学,2018.
WU R L.Isolation of salt-tolerant lactic acid bacteria in fish sauce and the research of its metabolic characteristics[D].Guangzhou:South China Agricultural University,2018.
[12] CHUEA-NONGTHON C,RODTONG S,YONGASAWATDIGU L J,et al.Draft genome sequences of Tetragenococcus muriaticus strains 3MR10-3 and PMC-11-5 isolated from Thai fish sauce during natural fermentation[J].Genome Announcements,2017,5(15):e00 198-17.
[13] FU X T,YOU S G,KIM S M,et al.Characterization of a salt-tolerant acid protease produced by Bacillus megaterium KLP-98 and its potential as a fermentation starter for the manufacture of fish sauce[J].Journal of Food Biochemistry,2008,32(3):279-298.
[14] DAROONPUNT R,ITOH T,KUDO T,et al.Bacillus piscicola sp.nov.,isolated from Thai fish sauce(Nam-pla)[J].International Journal of Systematic and Evolutionary Microbiology,2016,66(3):1 151-1 155.
[15] TOYOKAWA Y,TAKAHARA H,REUNGSANG A,et al.Purification and characterization of a halotolerant serine proteinase from thermotolerant Bacillus licheniformis RKK-04 isolated from Thai fish sauce[J].Applied Microbiology and Biotechnology,2010,86(6):1 867-1 875.
[16] KALWASINS K A,AGNIESZKAL,JANKIEWIC U,et al.Alkaline and halophilic protease production by Bacillus luteus H11 and its potential industrial applications[J].Food Technology and Biotechnology,2018,56(4):553-561.
[17] 冒鑫哲,彭政,周冠宇,等.枯草芽孢杆菌高产角蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(17):138-144.
MAO X Z,PENG Z,ZHOU G Y,et al.Optimized fermentation for improving keratinase production by Bacillus subtilis WB600[J].Food and Fermentation Industries,2020,46(17):138-144.
[18] 陈茏,杨俊,马毛毛,等.产蛋白酶菌株的筛选及以菜籽粕为氮源的产酶条件优化[J].食品科学,2021,42(4):115-121.
CHEN L,YANG J,MA M M,et al.Strain screening and optimization of fermentation conditions for protease production using rapeseed meal as a nitrogen source[J].Food Science,2021,42(4):115-121.
[19] 王东,荣家萍,唐自钟,等.响应面法优化枯草芽孢杆菌产中性蛋白酶的发酵条件[J].基因组学与应用生物学,2016,35(1):143-151.
WANG D,RONG J P,TANG Z Z,et al.Response surface method optimization of fermentation conditions for Bacillus subtilis producing neutral protease[J].Genomics and Applied Biology,2016,35(1):143-151.
[20] VARELA E,MING T E.Effect of pH and oxalate on hydroquinone-derived hydroxyl radical formation during brown rot wood degradation[J].Applied and Environmental Microbiology,2003,69(10):6 025-6 031.
[21] 刘杨柳,魏东东,刘燕,等.枯草芽孢杆菌发酵蟹壳粉产蛋白酶的研究[J].食品研究与开发,2017,38(24):174-180;224.
LIU Y L,WEI D D,LIU Y,et al.Research on fermentation of crab powder for proteinase production by Bacillus subtilis[J].Food Research and Development,2017,38(24):174-180;224.
[22] PATEL R,DODIA M,SINGH S P.Extracellular alkaline protease from a newly isolated haloalkaliphilic Bacillus sp.:Production and optimization[J].Process Biochemistry,2005,40(11):3 569-3 575.
[23] 吴海波,江连洲,赵英,等.发酵低温豆粕生产碱性蛋白酶的工艺研究[J].食品工业科技,2011,32(3):195-200.
WU H B,JIANG L Z,ZHAO Y,et al.Alkaline protease produced by Bacillus Subtilis with defatted soy flour[J].Science and Technology of Food Industry,2011,32(3):195-200.
[24] 卢超,陈景鲜,王国霞,等.枯草芽孢杆菌L07产中性蛋白酶发酵条件优化[J].食品与发酵工业,2020,46(16):148-153.
LU C,CHEN J X,WANG G X,et al.Optimization of fermentation conditions for the production of neutral protease by Bacillus subtilis L07[J].Food and Fermentation Industries,2020,46(16):148-153.
[25] 刘晓艳,封健,韩傲,等.高产中/碱性蛋白酶的枯草芽孢杆菌W1菌株的筛选及条件优化[J].现代食品科技,2020,36(4):157-163.
LIU X Y,FENG J,HAN A,et al.Isolation and optimization of Bacillus subtilis W1 strain with high neutral/alkaline protease activity[J].Modern Food Science and Technology,2020,36(4):157-163.
[26] GAUVRY E,MATHOT A G,COUVERT O,et al.Effects of temperature,pH and water activity on the growth and the sporulation abilities of Bacillus subtilis BSB1[J].International Journal of Food Microbiology,2021,337:108915.
[27] PONGSETKUL J,BENJAKUL S,SUMPAVAPOL P,et al.Bacillus subtilis K-C3 isolated from Thai salted shrimp paste(Kapi):Its extracellular enzymes and use as a starter culture in Kapi production[J].Journal of Food Biochemistry,2018,42(6):1-12.