微藻含有丰富的多不饱和脂肪酸、蛋白质、多糖、维生素和矿物质等营养物质,在食品领域有着广泛的应用,如可作为烘焙食品、饮料、冰淇淋以及婴儿配方食品等多种食品的原料。此外,微藻还有生物量生产效率高、培养条件简单、光合作用效率高、营养物质含量高等优点[1]。但由于微藻细胞的体积较小(直径约为1~50 μm),且大规模培养条件下细胞浓度较低(0.1~5 g/L),使得微藻的收获难度较大、成本较高。虽然通过高密度发酵培养可以提高微藻细胞密度,但仍存在一些缺陷,如糖耗高、藻细胞质量较低等,因而小球藻高密度发酵培养还有待进一步研究。而一般微藻收获步骤的成本占总生产成本的20%~30%[2],因此亟需开发快速高效的微藻收获技术。目前,收获微藻的方法有3类:物理法、化学法、生物法。离心、过滤、干燥[3-4]等物理法成本高昂、能耗较大;Fe2(SO4)3、Al2(SO4)3、聚乙烯亚胺、聚丙烯酰胺等[5-6]化学试剂法虽然能收获微藻但会对环境造成污染;而生物法成本低、效率高、可生物降解、对环境无毒无害,所以生物法可以实现对微藻的快速、高效、无污染收获。目前使用的生物絮凝剂主要是细菌[7-8]与真菌,但从效果而言,真菌的收获效果优于细菌,因为真菌的结构比细菌更稳定,真菌的菌丝可以形成致密的网络结构[9],使微藻细胞与真菌形成一个稳定的复合体,增强收获结构,促进微藻细胞的收集,从而收获更多的微藻生物量。
常用于收获微藻的丝状真菌有黑曲霉、米曲霉、烟曲霉、青霉、木霉、毛霉等[10-12]。其中应用最广泛的丝状真菌为黑曲霉。因为黑曲霉不仅可以快速成球完成对微藻的收获,还可以提高收获的微藻细胞质量,此外黑曲霉具有生长活力高、成本低、絮凝效果好且菌丝结构较为稳定、易于形成颗粒等优点[13-14],所以使用黑曲霉收获微藻是一种绿色、高效、快速、可持续的收获方法。本研究使用生物安全性好的黑曲霉(Aspergillus niger ATCC 1015)对普通小球藻(Chlorella vulgaris FACHB-8)进行收获。黑曲霉ATCC 1015是食品安全性好的工业微生物菌株,目前已经用于柠檬酸、葡萄糖酸等食品组分的生产,所以使用黑曲霉ATCC 1015可为微藻在食品领域的广泛应用奠定基础。此外,通过黑曲霉ATCC 1015可生产纤维素酶、木聚糖酶、淀粉酶、蛋白酶、糖化酶、果胶酶、柠檬酸合成酶等多种酶[15-17],在淀粉加工、发酵、酿造、饮料生产等领域发挥了巨大的作用[18-19]。因此,使用该菌株收获小球藻是一种安全、无污染、可持续的收获方法。最后,本研究考察了不同共培养条件对黑曲霉ATCC 1015收获普通小球藻的影响并培养条件进行优化,为快速高效收集微藻细胞提供依据。
1 材料与方法
1.1 材料与设备
黑曲霉(Aspergillus niger ATCC 1015),美国典型微生物保藏中心;普通小球藻(Chlorella vulgaris FACHB-8),为绿藻门小球藻属单细胞绿藻,中国科学院淡水藻种库。化学试剂均为国产分析纯,国药化学试剂上海公司。
722S紫外分光光度计,上海精密科学仪器有限公司;CX40光学显微镜,奥林巴斯公司;TQZ-312全温振荡器,上海精宏实验设备有限公司。
1.2 培养基与溶液
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):称取3.7 g PDA固体溶于100.0 mL去离子水,121 ℃、15 min灭菌后备用。
改良BG-11培养基配方(g/L):葡萄糖2.0、K2HPO4·3H2O 0.04、MgSO4·7H2O 0.075、CaCl2·2H2O 0.036、柠檬酸0.006、柠檬酸铁铵0.006、EDTA 0.001、NaNO3 1.5、Na2CO3 0.02、微量元素混合液(1.0 mL),115 ℃、20 min灭菌后备用。
微量元素混合物(g/L):H3BO3 2.86、MnCl2·4H2O 1.81、ZnSO4·7H2O 0.222、Na2MoO4·2H2O 0.39、CuSO4·5H2O 0.079、CoCl2·6H2O 0.05,用1 mol/L盐酸调pH至 7.1。
CCM培养基(g/L):葡萄糖 10.0、NH4Cl 2.0、KH2PO4 2.0、MgSO4·7H2O 0.5、FeSO4·7H2O 0.02,115 ℃、20 min灭菌后备用。
葡萄糖溶液(g/L):称取20.0 g葡萄糖溶于100.0 mL去离子水,115 ℃、20 min灭菌后备用。
1.3 实验方法
1.3.1 孢子悬液的制备
将黑曲霉从保藏管中接种至PDA平板上,28 ℃培养7 d,将10 mL无菌水倒入黑曲霉的PDA平板上,轻轻振摇后使用涂布棒进行刮取,然后倒入灭菌的锥形瓶中。重复3次即得到高浓度的孢子悬液,在锥形瓶中加10~20 mL无菌水稀释并振荡使孢子均匀分布,用紫外分光光度计在620 nm处测定其吸光度。
1.3.2 普通小球藻培养与菌藻共培养
普通小球藻培养:将普通小球藻液在装有100 mL改良BG-11培养基的三角瓶(250 mL)内,100 r/min,25 ℃,培养7~14 d。如需转接,按1∶5(藻液∶培养基)的比例进行再次转接培养。
菌藻共培养:取20 mL新鲜藻液于50 mL离心管中离心,8 000 r/min,5 min,弃上清液,将离心后的藻细胞加入培养基中,在680 nm处测定吸光度,再取稀释好的孢子悬浮液(1.26 OD620)加入培养基中,如图1所示,设置温度为28 ℃,0~24 h,转速为130 r/min,24~48 h,转速为150 r/min,共培养24 h后再添加200 g/L葡萄糖营养液5 mL至培养基内,48 h后在680 nm处测定溶液的吸光度,并按公式(1)计算收获率。
收获率![]()
(1)

图1 黑曲霉孢子收获微藻的过程
Fig.1 Harvesting process of microalgae by A.niger spores
1.3.3 生长曲线与收获时间的确定
按1.3.2的共培养方法进行共培养,间隔4 h取样测定溶液的吸光度并在显微镜下观察菌丝球与菌藻体的形态。
1.3.4 培养条件优化
按1.3.2的共培养方法对转速、pH(2、3、4、5、6)、葡萄糖添加量(10、15、20、25 g/L)、FeSO4添加量(0.02、0.04、0.06、0.08、0.10 g/L)、MgSO4添加量(0.2、0.4、0.6、0.8、1.0 g/L)、CaCl2添加量(0.1、0.2、0.3、0.4、0.5 g/L)、初始孢子浓度(100、200、300、400、500 个/μL)、初始微藻浓度(0.2、0.3、0.4、0.5、0.6、0.7、0.8 OD680)等条件进行优化。
1.4 数据分析
本研究所有实验均进行3次平行实验,利用Microsoft Visio 2016绘制流程图,Origin 9.1软件绘制所有数据图,利用IBM SPSS Statistics 25软件对数据进行统计学分析,并采用Duncan法进行多重比较。
2 结果与分析
2.1 不同时间的微藻生长情况与收获率
当黑曲霉与微藻共培养时,微藻能够利用葡萄糖进行高密度发酵生长,所以微藻的生物量增加。如图2-a所示,在0~4 h内,微藻液浓度由0.48 OD680下降至0.36 OD680,说明该时间内微藻浓度降低。这是由于小球藻生长缓慢,菌丝球吸附速率大于小球藻生长速率。而4~24 h,微藻浓度由0.36 OD680上升至0.52 OD680,微藻浓度达到最大值,说明该时间段内小球藻生长较快,菌丝球吸附速率小于小球藻生长速率,小球藻增长量大于菌丝球吸附量。而在24~36 h,虽然微藻浓度持续下降,但其收获率却持续升高,如图2-b所示,收获率升高至36.51%,其原因可能是此阶段黑曲霉孢子已逐渐萌发生长出菌丝形成菌丝球,大量的菌丝将小球藻吸附于表面,并通过剪切力将吸附了小球藻的菌丝缠绕形成菌藻颗粒体,收获更多的藻细胞,提高收获率。所以小球藻生长量小于菌丝吸附量时,小球藻的收获率不断升高,在48 h达到最大值,为70.54%。
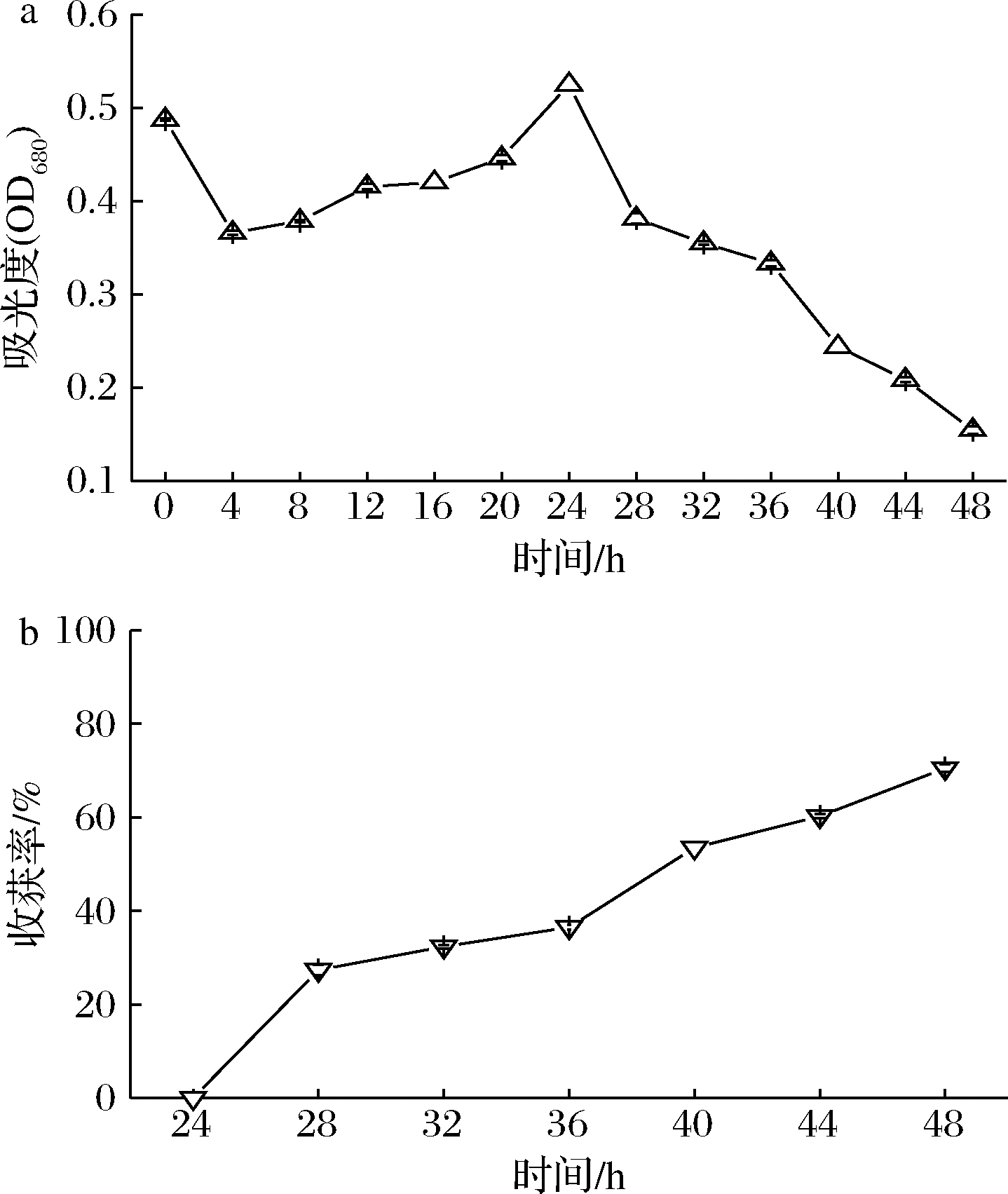
a-微藻吸光度;b-收获率
图2 共培养过程中微藻生长情况与收获率
Fig.2 Growth and harvesting ratio of microalgae during co-culture process
2.2 不同培养时间的黑曲霉形态
黑曲霉孢子是凝聚型[20-21]孢子,所谓凝聚型孢子是指多个孢子首先聚集、膨胀,再生长出菌丝,最后菌丝聚集缠绕形成菌丝球的孢子。如图3所示,孢子在0~8 h内首先通过相互碰撞聚集在一起形成孢子聚集体,孢子聚集体在8~16 h内萌发,萌发形成的菌丝利用更多的表面积吸附没有萌发的孢子,在16~32 h 内快速生成完整的菌丝,最后在32~48 h形成完整的菌丝球。

图3 不同培养时间的黑曲霉形态
Fig.3 Morphology of A.niger at different times
并且由图3黑曲霉孢子的成球时间可知,48 h即可成球,当使用黑曲霉孢子与小球藻共培养时,48 h即可成球收获微藻,因此使用黑曲霉收获小球藻的时间可以设置为48 h。
2.3 转速优化
黑曲霉是好氧菌,在成球过程中需要一定的氧气。转速大小对于溶液中氧气含量有显著影响,因此转速对于黑曲霉孢子生成菌丝球收获微藻具有显著影响。如图4所示,当48 h连续130 r/min时,因转速较低,溶液中溶氧量少以及溶氧的不均匀使得菌丝生长较慢。并且在较低转速下菌丝体所受剪切力较小,无法产生高剪切力使萌发的孢子去除周围多余的菌毛分散形成单独的菌丝球,相互之间缠绕得不紧密,使得菌丝球结构松散、球径大,所以对微藻的收获率较低,为33.74%。而当使用连续48 h较高转速150 r/min时,在培养初期,高转速不利于孢子聚集萌发形成菌丝球,会使孢子分散在培养基中形成直径较小的菌丝球,收获微藻的效率最低,仅为17.66%。因此,连续48 h的130 r/min与150 r/min并不能实现黑曲霉对微藻的高效率收获,所以本实验对共培养过程使用混合转速130 r/min(0~24 h)与150 r/min(24~48 h)进行培养。因为初始的低转速有利于孢子聚集萌发生成菌丝形成菌丝球,随后高转速产生高剪切力与较高的溶氧量使萌发的孢子去除周围多余的菌毛分散形成单独的菌丝球,从而提高微藻的收获率,收获率最高可达76.58%(P<0.05),所以混合转速130 r/min(0~24 h)与150 r/min(24~48 h)最适合黑曲霉孢子对微藻的收获。
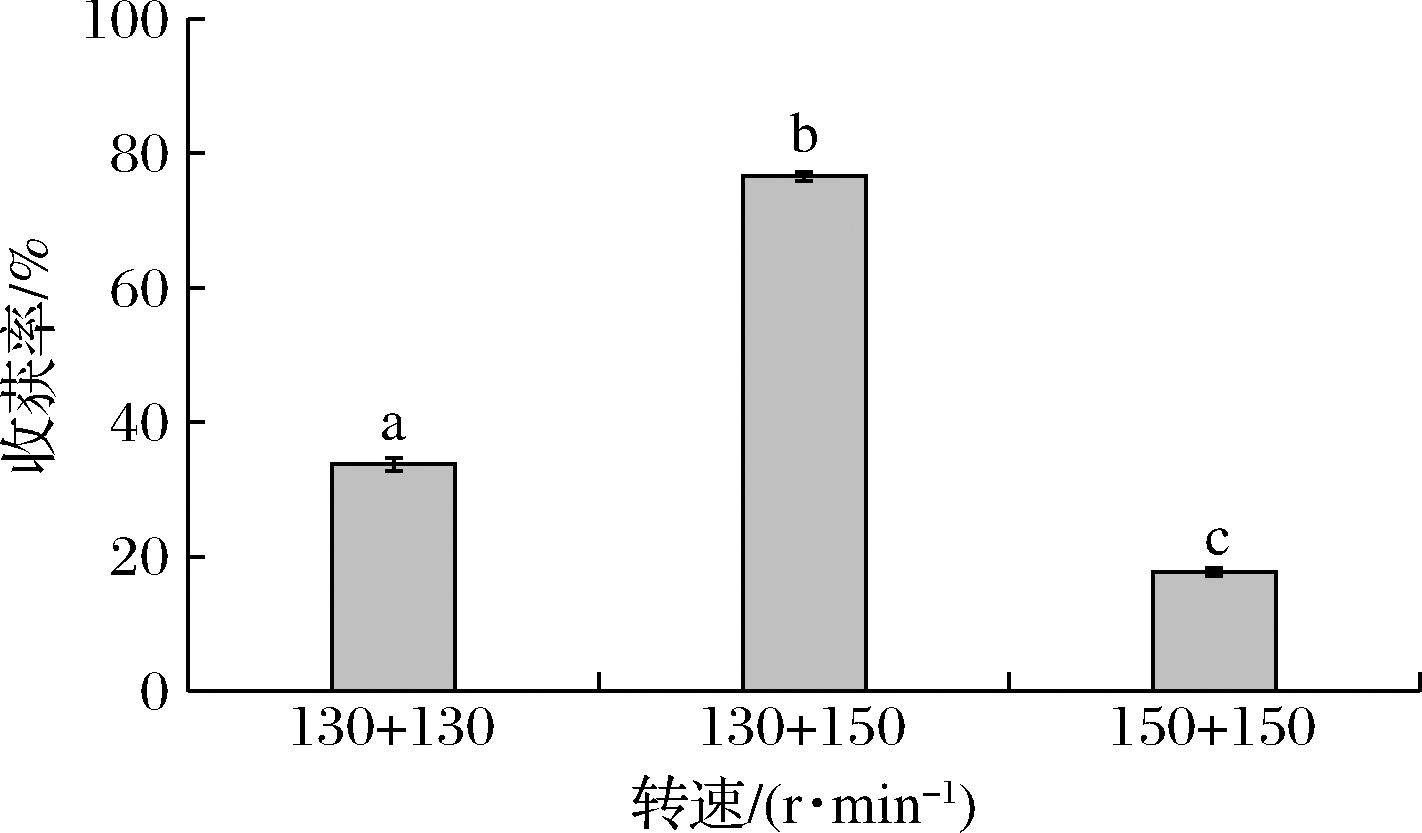
图4 转速对收获率的影响
Fig.4 Effect of rotating speed on harvesting ratio
注:不同字母表示组间差异显著(P<0.05)(下同)
2.4 初始pH优化
pH是影响孢子凝聚萌发成菌丝球的重要因素,因为孢子具有pH依赖性,所以当改变培养基pH时对于黑曲霉收获微藻具有显著的影响。如图5所示,当初始pH为2时,由于培养基的酸性较强,会抑制微藻的生长,不利于黑曲霉孢子与微藻的生长,所以难以形成菌丝球,只有明显的菌丝生成,收获率较低,为27.30%。而随着初始pH的升高,pH为3、4、5时均可形成菌丝球,pH为3时形成的菌丝球质量最好、生物量最大,收获微藻的生物量也最多,收获率最高为47.51%。而当pH为4、5时,收获率分别为39.07%和11.98%,生成的菌丝球小,不均匀,韧性差,因此其收获效率较低。随着初始pH的持续升高,当pH为6时,收获率则降为0,原因可能是此时pH仅有利于微藻的生物量增长,不利于黑曲霉孢子的生长,因此收获率最低。未调节培养基pH(对照组pH为4.5)的微藻收获率可达77.72%,与实验组相比有显著差异(P<0.05),表明此时的pH环境最适合黑曲霉孢子与微藻的生长,且此时形成的菌丝球质量高、均匀性好,生物量最大,收获微藻的生物量也更多,因此未调节pH的初始培养基(对照组pH为4.5)最适合黑曲霉孢子和微藻的共培养。

图5 初始pH对收获率的影响
Fig.5 Effects of initial pH value on harvesting ratio
2.5 葡萄糖添加量优化
黑曲霉可以利用甘露醇、葡萄糖、木聚糖和蔗糖等多种碳源进行生长,但葡萄糖最易作为碳源。黑曲霉孢子在含有葡萄糖的培养基中培养48 h即可快速形成菌丝球。如图6-a所示,随着葡萄糖质量浓度不断升高,收获率先升高后降低,在20 g/L时收获效率最高,为38.24%,这是由于葡萄糖质量浓度的升高能够显著促进微藻的生长,微藻的生物量显著增加(P<0.05),此时孢子无足够的碳源促进其菌丝球直径的增长,因此生成的菌丝球直径小、数量多、韧性差,收获率较低;而当采用分批补充葡萄糖(10+10)的策略时,分批添加的收获率显著高于单次添加(P<0.05),可达到83.19%。这是由于采用分批添加策略时,初始的低葡萄糖浓度有利于微藻的生长、孢子的萌发和菌丝的生成,不会产生高葡萄糖浓度促进微藻生长而不利于黑曲霉孢子生长的现象,此时孢子已经逐渐聚集萌发形成菌丝球,而后期添加的葡萄糖量有助于菌丝球直径的增长以及菌丝的形成,可以显著提高收获率。所以采用分批添加葡萄糖的策略最适合黑曲霉与微藻的共培养。而如图6-b所示,24~48 h收获率随着葡萄糖质量浓度的增加而不断提高,添加8 g/L即可获得82.31%的收获率,与添加10 g/L的收获率83.04%无显著差异(P<0.05),所以24~48 h补充8 g/L的葡萄糖即可。
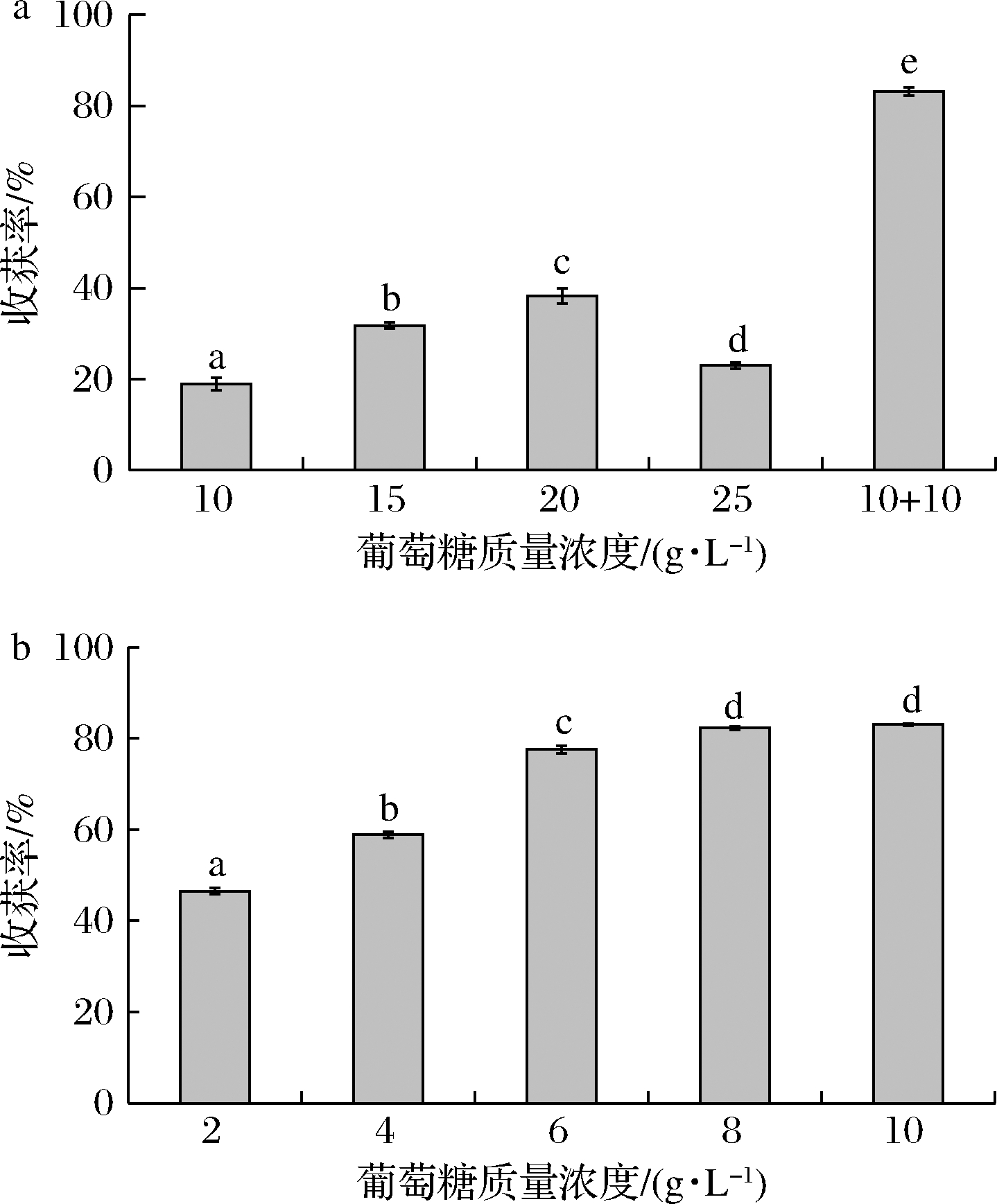
a-初始葡萄糖浓度对收获率的影响;
b-24 h后添加的葡萄糖浓度对收获率的影响
图6 不同葡萄糖添加方式对收获率的影响
Fig.6 Effects of different glucose addition strategies on harvesting ratios
综上,采用分批添加葡萄糖的策略最适合黑曲霉与微藻的共培养,选择0~24 h的10 g/L的葡萄糖质量浓度和24~48 h再添加8 g/L的葡萄糖的碳源条件最适合黑曲霉孢子对微藻的收获。
2.6 FeSO4、MgSO4、CaCl2添加量的优化
不同的金属离子种类与浓度对黑曲霉收获微藻过程有不同的影响。如图7-a所示,当FeSO4质量浓度为0.02 g/L时,微藻的收获率最高,为66.70%。而随着FeSO4质量浓度的不断升高,小球藻的收获率不断降低(P<0.05),质量浓度为0.1 g/L时,收获率最低,为37.98%。这是因为Fe2+与菌丝球的大小相关,当培养基中的Fe2+浓度增加,孢子形成的菌丝球数量将减少且生成的菌丝球大小极不均匀。因此菌丝球捕获的藻细胞数目减少,收获率降低显著(P<0.05),所以FeSO4的最适添加量为0.02 g/L。如图7-b所示,当MgSO4质量浓度为0.2 g/L时,收获率最低为68.62%。随着MgSO4质量浓度的不断升高,收获率显著提高(P<0.05),当MgSO4质量浓度为1.0 g/L时,收获率最高为80.45%。这是因为Mg2+能够促进菌丝球数量增多,且生成的菌丝球大小均匀、表面光滑、分散性好,并且Mg2+在培养初期的孢子聚合过程中能够起到促进生长作用,可加快菌丝球的形成,缩短菌丝球的形成时间与小球藻的收获时间。虽然Mg2+可以促进菌丝球数目的增长,提高微藻的收获率,但是随着浓度的增加,菌丝球的体积逐渐减小,因此高浓度的Mg2+浓度不利于菌丝球体积的增长,但较低的浓度也不利于收获。因此最适合菌丝球收获小球藻的MgSO4质量浓度为0.5 g/L。如图7-c所示,随着Ca2+浓度的增加,收获率先升高后降低。当CaCl2添加量为0.3 g/L,收获率最高,为77.08%。而不添加Ca2+(对照组)的收获率为85.02%,显著高于添加Ca2+的实验组(P<0.05),其原因为培养基的pH较低,当向培养基中加入Ca2+会导致真菌和微藻的Zeta电位产生较大差异。
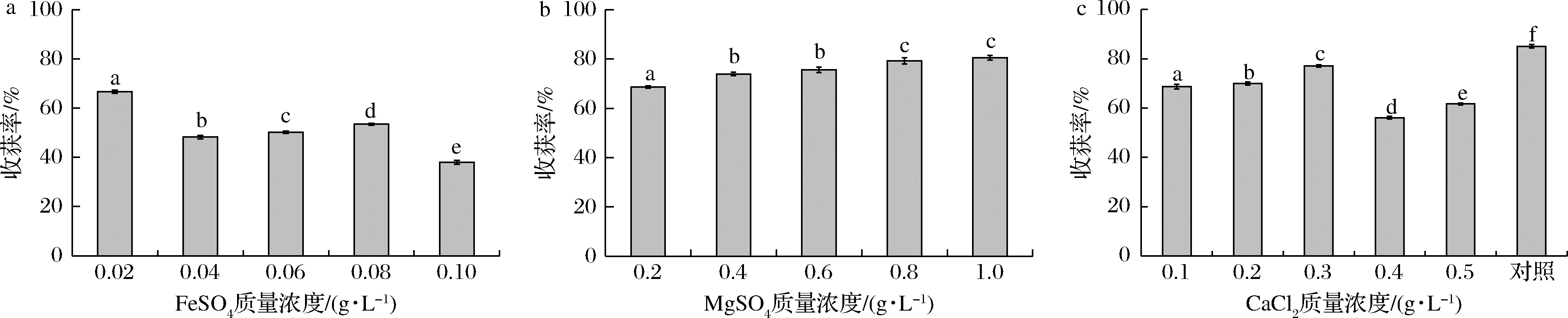
a-FeSO4;b-MgSO4;c-CaCl2
图7 FeSO4、MgSO4、CaCl2添加量对收获率的影响
Fig.7 Effects of FeSO4,MgSO4,CaCl2 supplemental amount on harvesting ratio
因此Ca2+并不能促进菌丝球对小球藻的絮凝,因此无需向培养基中添加Ca2+以促进黑曲霉菌丝球收获小球藻。
2.7 初始孢子浓度优化
当向培养基中接种黑曲霉孢子时,孢子浓度对微藻的收获率有显著影响,当接种量较小时,生成的菌丝球不足以收获所有的微藻细胞,因此收获率较低。如图8所示,如接种量为1×107 个/mL时,收获率仅为38.70%,而随着孢子接种量的不断增加,收获率不断提高(P<0.05)。这是因为随着孢子浓度的升高,生成的菌丝球数不断增多,收获的藻细胞数不断增加,收获率逐渐升高。当孢子浓度为5×107 个/mL,收获率可达73.56%。所以适当增加孢子的数目可以提高收获率,有利于菌-藻体的形成。当加入的孢子数过量时,孢子与藻细胞共同竞争碳源,孢子会消耗大部分碳源,小球藻将无法获得足够的碳源支持其生长,因此最适初始孢子浓度为5×107 个/mL,菌藻数量比为1∶70(表1)。
表1 不同孢子体积的菌藻数量比
Table 1 Fungal spores-algal ratios of different fungal volumes

孢子悬浮液体积/μL100200300400500初始孢子浓度/(个·mL-1)1×1072×1073×1074×1075×107n(菌∶藻比)1∶3501∶1751∶1171∶981∶70
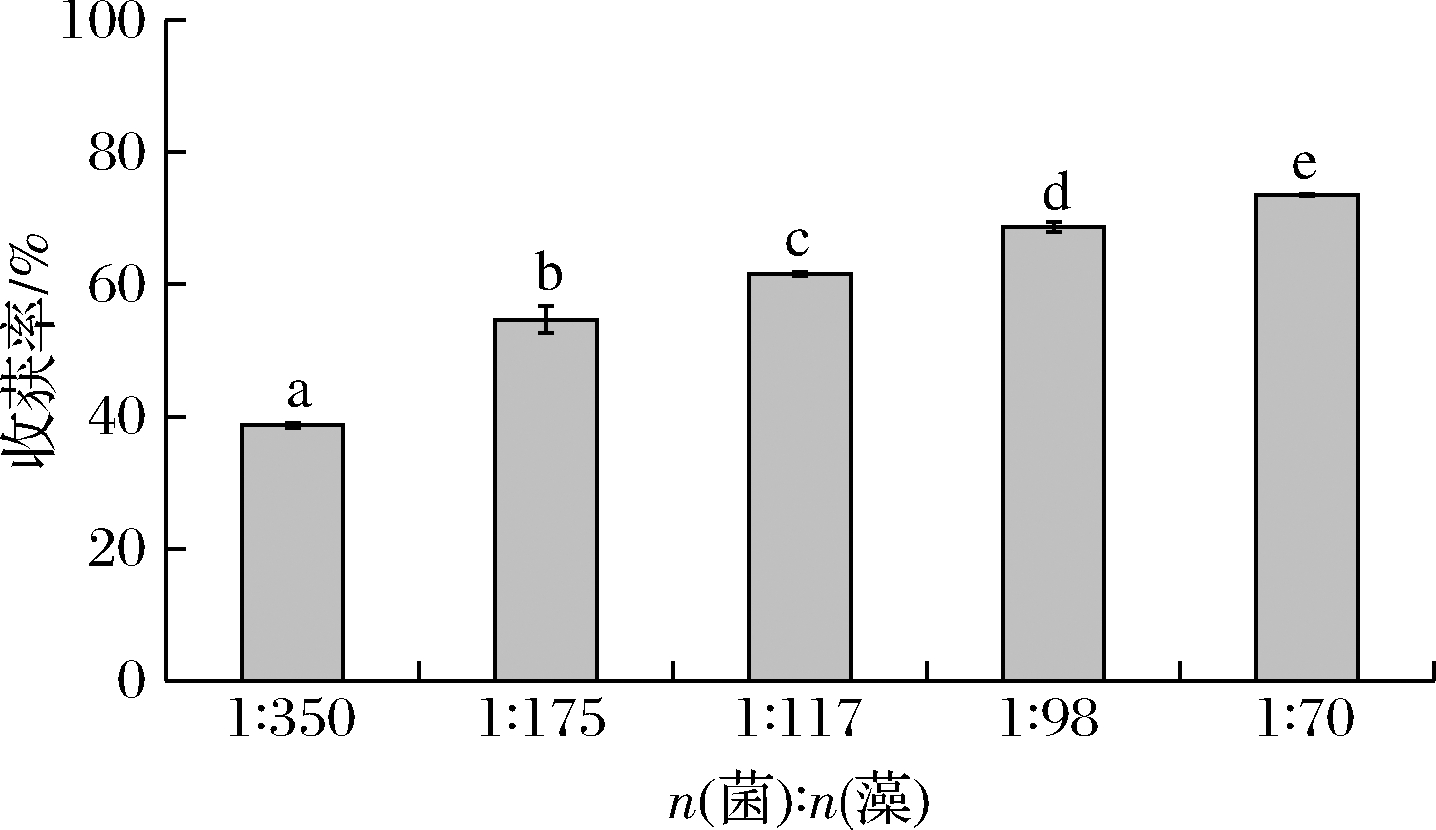
图8 菌藻比对收获率的影响
Fig.8 Effects of fungal spores-algal ratios on harvesting ratio
2.8 初始微藻浓度优化
初始微藻浓度对微藻的收获率具有显著影响。如图9所示。当初始微藻浓度为0.20 OD680时,收获率仅为43.09%。随着微藻浓度的不断升高,收获率显著提高(P<0.05),当浓度为0.80 OD680时,收获率最高,为88.79%。

图9 初始藻液吸光度对收获率的影响
Fig.9 Effect of initial absorbances of algal cultivation on harvesting ratio
这是因为随着微藻浓度的增加,菌丝球收获的藻细胞数不断增多,收获率逐渐升高。这表明增加藻细胞数有利于菌-藻体的形成,提高收获率。但是当藻细胞的浓度过高时,需要更多的碳源,剩下的碳源无法支持孢子形成菌丝球导致收获率不再升高,所以本研究中最适的初始藻液浓度为0.80 OD680,藻细胞浓度为3.4×106 个/mL。
3 结论与讨论
由于不同应用条件下黑曲霉收获微藻的影响因素较多,如pH、温度、摇速、培养时间、金属离子种类与浓度、碳源种类与浓度、菌藻比、初始真菌孢子浓度、初始微藻细胞浓度、光照种类与光源波长等因素。因此为了实现黑曲霉对微藻快速高效收获可以对共培养的多个条件进行优化。如GULTOM等[22]通过共培养实验发现成球时间为3、5、7 d,但本研究中黑曲霉2 d即可成球并对微藻进行收获,可以大幅度缩短收获微藻的时间,实现对微藻的快速收获。而毕生雷等[23]通过对霉菌收集异养小球藻的培养条件进行的优化虽然可以有效收集部分藻细胞,但并不能实现高效率的收获。因此本研究在其基础上对混合转速进行了优化,结果表明,混合转速的收获效果优于单一转速,通过混合转速可以实现对微藻的高效收获。此外,不同的金属离子[24]对黑曲霉的成球以及收获微藻有不同的影响,如Fe2+可致菌丝球数量较少且大小极不均匀。Mg2+不仅能促进菌丝球数量增多,且生成的菌丝球大小均匀、表面光滑。Ca2+可以通过调节神经磷酸酶信号通路[25]影响疏水性和细胞壁完整性从而影响黑曲霉生物膜的形成。因此通过对金属离子浓度进行优化可以最大限度的减少金属离子的添加,减少污染与降低成本。由结果可知,较高的葡萄糖浓度会促进小球藻的快速增长,促进黑曲霉孢子与小球藻对碳源形成竞争关系,不利于黑曲霉孢子的成球以及微藻的收获。所以通过葡萄糖浓度的优化可以减少葡萄糖添加量、降低成本、提高收获率,分批添加的收获率显著高于一次添加,因为采用分批补充葡萄糖的策略,可以很好地缓解黑曲霉孢子与小球藻对葡萄糖的竞争关系,最大限度提高微藻收获率,实现对微藻的高效收获。此外,通过对初始孢子及微藻浓度的优化可以使收获率最高达88.79%,因此通过对菌藻共培养条件进行优化能够快速、高效地收集大部分藻细胞。
但由于本研究微藻的收获率没有达到100%,因此还需对黑曲霉与小球藻共成球的机制进一步分析以提高黑曲霉对小球藻的收获率,达到快速高效收获小球藻的目的。目前关于黑曲霉与小球藻之间的作用力主要分为静电相互作用、疏水相互作用、盐桥作用3类,因此未来可以分析静电相互作用、疏水相互作用[21]、盐桥作用[26-27]在黑曲霉和微藻共培养过程中是否存在及其变化规律,建立培养条件与作用力的关系,并对培养条件进一步优化,建立低成本、高效率、可持续收获的微藻收获体系。此外,因为黑曲霉ATCC 1015是重要的工业生产菌株,目前已经广泛应用于淀粉加工、饮料、柠檬酸等食品物质的生产。而普通小球藻具有高蛋白、低脂肪、低糖、低热量以及维生素、矿物质元素含量丰富的优点[28],并且小球藻中含有高含量的EPA和DHA以及亚麻酸等必需脂肪酸,它不仅具有促生长作用,而且还可增强机体免疫力。因此本实验中的黑曲霉与小球藻的混合物在饮料、奶粉、保健品、食品酶等食品领域具有广泛的应用前景。两者的混合物不仅可以提高蛋白质、必需脂肪酸、维生素和微量元素等的含量,还可以极大程度地丰富食物的营养价值,使营养更趋于平衡,但关于黑曲霉与小球藻混合物的回收以及如何在食品领域的安全应用还需进一步研究分析。
[1] KARPAGAM R,RAJ K J,ASHOKKUMAR B,et al.Characterization and fatty acid profiling in two fresh water microalgae for biodiesel production:Lipid enhancement methods and media optimization using response surface methodology[J].Bioresource Technology,2015,188:177-184.
[2] ZHANG J G,HU B.A novel method to harvest microalgae via co-culture of filamentous fungi to form cell pellets[J].Bioresource Technology,2012,114:529-535.
[3] LEI X Q,CHEN Y,SHAO Z Z,et al.Effective harvesting of the microalgae Chlorella vulgaris via flocculation-flotation with bioflocculant[J].Bioresource Technology,2015,198:922-925.
[4] SALIM ![]() M H,WIJFFELS R H.Ratio between autoflocculating and target microalgae affects the energy-efficient harvesting by bio-flocculation[J].Bioresource Technology,2012,118:49-55.
M H,WIJFFELS R H.Ratio between autoflocculating and target microalgae affects the energy-efficient harvesting by bio-flocculation[J].Bioresource Technology,2012,118:49-55.
[5] ALJUBOORI A H R,UEMURA Y,THANH N T.Flocculation and mechanism of self-flocculating lipid producer microalga Scenedesmus quadricauda for biomass harvesting[J].Biomass and Bioenergy,2016,93:38-42.
[6] LAMA S,MUYLAERT K,KARKI T B,et al.Flocculation properties of several microalgae and a cyanobacterium species during ferric chloride,chitosan and alkaline flocculation[J].Bioresource Technology,2016,220:464-470.
[7] LI Y,XU Y T,LIU L,et al.First evidence of bioflocculant from Shinella albus with flocculation activity on harvesting of Chlorella vulgaris biomass[J].Bioresource Technology,2016,218:807-815.
[8] NDIKUBWIMANA T,ZENG X H,LIU Y,et al.Harvesting of microalgae Desmodesmus sp.F51 by bioflocculation with bacterial bioflocculant[J].Algal Research,2014,6:186-193.
[9] ZHANG J G,ZHANG J N.The filamentous fungal pellet and forces driving its formation[J].Critical Reviews in Biotechnology,2016,36(6):1 066-1 077.
[10] BHATTACHARYA A,MATHUR M,KUMAR P,et al.A rapid method for fungal assisted algal flocculation:Critical parameters & mechanism insights[J].Algal Research,2017,21:42-51.
[11] CHOI Y N,CHO H U,UTOMO J C,et al.Efficient harvesting of Synechocystis sp. PCC 6803 with filamentous fungal pellets[J].Journal of Applied Phycology,2016,28(4):2 225-2 231.
[12] SRINUANPAN S,CHAWPRAKNOI A,CHANTARIT S,et al.A rapid method for harvesting and immobilization of oleaginous microalgae using pellet-forming filamentous fungi and the application in phytoremediation of secondary effluent[J].International Journal of Phytoremediation,2018,20(10):1 017-1 024.
[13] 刁宁宁,钱柳伊,张建国,等.黑曲霉菌丝球吸附毕赤酵母的条件优化[J].工业微生物,2015,45(4):7-11.
DIAO N N,QIAN L Y,ZHANG J G,et al.Optimization of conditions for Aspergillus niger pellets adsorbing Pichia pastoris[J].Industrial Microbiology,2015,45(4):7-11.
[14] OLIVEIRA H R,BASSIN I D,CAMMAROTA M C.Bioflocculation of cyanobacteria with pellets of Aspergillus niger:Effects of carbon supplementation,pellet diameter,and other factors in biomass densification[J].Bioresource Technology,2019,294:122167.
[15] 胡学智.曲霉(霉菌)蛋白酶早期研究的回顾[J].工业微生物,2020,50(6):56-60.
HU X Z.Retrospect of early studies on protease from Aspergillus[J].Industrial Microbiology,2020,50(6):56-60.
[16] 张超凤,汪雨晨,陈卫平,等.柚子皮黑曲霉的分离鉴定及产酶特性研究[J].微生物学杂志,2017,37(3):22-27.
ZHANG C F,WANG Y C,CHEN W P,et al.Identification and characterization of Aspergillus niger isolated from pomelo peel[J].Journal of Microbiology,2017,37(3):22-27.
[17] 朱强,王瑞鑫,吴铖迪,等.黑曲霉SP7-2固态发酵产生淀粉糖化酶工艺优化[J].食品与发酵工业,2019,45(8):98-102.
ZHU Q,WANG R X,WU C D,et al.Optimized solid fermentation for Aspergillus niger SP7-2 producing glucoamylase[J].Food and Fermentation Industries,2019,45(8):98-102.
[18] 潘菲,董彪,刘婷,等.黑曲霉Aspergillus niger NCUF413.1对特香型白酒酿造出酒率和风味的影响[J].食品与发酵工业,2020,46(1):23-29.
PAN F,DONG B,LIU T,et al.Effect of Aspergillus niger NCUF413.1 on liquor yield and flavor components of special-flavor Baijiu[J].Food and Fermentation Industries,2020,46(1):23-29.
[19] 黄楠,周波,叶童,等.黑曲霉H9-30全细胞催化合成低聚异麦芽糖[J].食品与发酵工业,2019,45(10):36-41.
HUANG N,ZHOU B,YE T,et al.Synthesis of isomaltooligosaccharides by whole-cell Aspergillus niger H9-30[J].Food and Fermentation Industries,2019,45(10):36-41.
[20] 黄勋娟,刁宁宁,张建国.黑曲霉菌丝球的形成及应用研究综述[J].食品与发酵工业,2014,40(11):171-176.
HUANG X J,DIAO N N,ZHANG J G.Review on the formation of Aspergillus niger pellets and its application[J].Food and Fermentation Industries,2014,40(11):171-176.
[21] 卢俊文,张良慧,张建国.静电作用和疏水作用对黑曲霉孢子凝聚的影响[J].工业微生物,2017,47(6):31-37.
LU J W,ZHANG L H,ZHANG J G.Combination effects of zeta potential and hydrophobicity on Aspergillus niger spore aggregation[J].Industrial Microbiology,2017,47(6):31-37.
[22] GULTOM S O,ZAMALLOA C,HU B.Microalgae harvest through fungal pelletization-co-culture of Chlorella vulgaris and Aspergillus niger[J].Energies,2014,7(7):4 417-4 429.
[23] 毕生雷,王方方,张成明,等.培养条件对霉菌收集异养小球藻细胞的影响[J].食品与发酵科技,2015,51(4):34-38.
BI S L,WANG F F,ZHANG C M,et al.Optimization of extraction process of microalgae oil[J].Food and Fermentation Technology,2015,51(4):34-38.
[24] ZAMALLOA C,GULTOM S O,RAJENDRAN A,et al.Ionic effects on microalgae harvest via microalgae-fungi co-pelletization[J].Biocatalysis and Agricultural Biotechnology,2017,9:145-155.
[25] LIU L,YU B,SUN W J,et al.Calcineurin signaling pathway influences Aspergillus niger biofilm formation by affecting hydrophobicity and cell wall integrity[J].Biotechnology for Biofuels,2020,13:54.
[26] LI Y,XU Y T,LIU L,et al.Flocculation mechanism of Aspergillus niger on harvesting of Chlorella vulgaris biomass[J].Algal Research,2017,25:402-412.
[27] 李海健,周化岚,Sarman Oktovianus Gultom,等.基于文献计量的微藻收获技术研究分析[J].工业微生物,2020,50(1):49-55.
LI H J,ZHOU H L,GULTOM S,et al.Research analysis of microalgae harvesting technology based on bibliometrics[J].Industrial Microbiology,2020,50(1):49-55.
[28] 王慧岭,张晋阳,罗建涛,等.微藻在食品领域的应用[J].安徽农业科学,2018,46(17):44-47.
WANG H L,ZHANG J Y,LUO J T,et al.Application of microalgae in food field[J].Journal of Anhui Agricultural Sciences,2018,46(17):44-47.