火麻是桑科植物大麻(Cannabis sativa L.)一年生草本植物,又称汉麻、线麻等[1]。火麻的叶子中富含大麻酚类物质,其中Δ9-四氢大麻酚(tetrahydrocannabinol,THC)具有致幻性和毒性[2],对人的中枢神经系统和心血管系统有不利影响,曾一度被限制种植和利用。现如今已培育出低含毒量的火麻品种,其中THC含量低于0.3%的被称为工业大麻,已获准合法种植。火麻拥有非常高的利用价值,火麻籽油、火麻蛋白以及大麻二酚(cannabidiol,CBD)等具有优秀的生理功能和营养价值受到研究者的广泛关注[3],同时推动了全球工业火麻市场的增长。
火麻籽中约含有30%~50%的油脂,受种植气候条件及种植地区不同的影响,品种之间存在一定的差异[4]。未脱壳火麻籽油是一种黄绿色油状液体,经脱壳处理的火麻籽油呈现金黄色,具有特殊的火麻清香味[5]。火麻籽油富含不饱和脂肪酸,约占脂肪酸组成的90%,其中多不饱和脂肪酸含量约占70%[6]。火麻油中富含亚油酸和α-亚麻酸[7],分别占脂肪酸组成的 50%~70%和 15%~25%[8],具有抗炎症、抗血栓形成、抗心律失常和降血脂等作用[9]。火麻籽油中n-6和n-3脂肪酸的比例约为3∶1,这种比例平衡在植物油中比较罕见,对人类健康最为有益[10]。此外,火麻籽油中生育酚和叶绿素较为丰富,其中γ-生育酚的含量最高,在油脂中有极强的抗氧化作用。火麻籽油被大量应用于烘焙及烹饪领域,是奶酪、甜点等的重要原料[11],此外还广泛应用于化妆品等化工领域,具有广阔的应用前景。
目前提取火麻籽油的主要方法是压榨法和浸出法,压榨法原理和设备简单,缺点是提取效率低和副产物利用率低;浸出法提油效率较压榨法显著提升,但缺点是溶剂残留率高,后续需要繁琐的精炼工艺,总提取周期长。水媒法是一种新兴高效的同时提取食用油和蛋白质的方法,又分为水代法、水酶法等[12],水媒法提取过程中能够直接通过分离得到的油脂叫做清油或游离油。国内外目前仅有少数水酶法提取火麻籽油的报道。王欢等[13]采用水酶法提取火麻籽油,最终游离油得率达到51.09%。侯真真等[14]探究不同酶对水酶法提取火麻籽油的影响,最终通过响应面优化提油率达到75.64%。水代法与水酶法相比不使用大量酶制剂,大大降低生产成本,但是在油脂提取过程中会产生大量乳状液,渣相残留油脂比例高等问题限制了油脂的提取效率[15],因此水代法常常需要对原料进行预处理。常见的预处理方法主要有高温蒸煮法、微波法和超声波法等[16]。张伟光等[17]研究发现超声处理显著提高了冬瓜籽油得率,DICKEY等[18]研究发现玉米胚芽在酸性溶液中高温蒸煮处理后可以显著提高油脂得率。本实验目的旨在通过研究对火麻籽仁的预处理,降低渣相残油率与乳状液含量的同时提高游离油得率,进一步提升水代法提取火麻籽油工艺的效率。
1 材料与方法
1.1 材料与设备
脱壳火麻籽仁,产自云南巴马;木瓜蛋白酶(9.1×104 U/g),南宁庞博生物工程有限公司;中性蛋白酶7 L(8.5×104 U/g),杰能科(中国)生物工程有限公司;枯草杆菌蛋白酶(15.7×104 U/g)、碱性蛋白酶2.4 L(16.7×104 U/g),诺维信(中国)生物技术有限公司;其余化学试剂均为分析纯,国药集团化学试剂有限公司。
DFY-500 摇摆式高速中药粉碎机,浙江林大机械公司;LXJ-IIB 低速离心机,上海安亭仪器厂;SZC-101自动脂肪测定仪,上海纤检仪器有限公司;KQ5200DE超声清洗器,昆山市超声仪器公司;精细研磨设备(实验室自制);84-1磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;Zeiss LSM 710激光共聚焦显微镜,德国卡尔蔡司;S3500激光粒度仪,美国Microtrac公司;MP-501A超级恒温循环槽,上海一恒科学仪器有限公司;GC—2010型气相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 预处理水代法提取火麻籽油工艺流程
预处理→干燥→火麻仁粗粉碎→精细粉碎→水代法提取→三相分离→乳状液破乳→收集总油
1.2.2 火麻籽的预处理
超声波处理:称取火麻籽250 g,按料液比1∶1(g∶g)加入去离子水,在功率100 W条件下超声处理1 h,然后于60 ℃烘箱中干燥至水分含量10%以下,干燥后的火麻籽置于通风处晾凉后装于自封袋备用。
酸浸处理:称取火麻籽250 g,按料液比1∶1(g∶g)加入 0.3 mol/L的柠檬酸溶液,在 25 ℃下搅拌混合浸泡6 h,然后做干燥处理,于60 ℃烘箱中干燥至水分含量10%以下。干燥后的火麻籽置于通风处晾凉后装于自封袋备用。
酸浸超声处理:称取火麻籽250 g,按料液比1∶1(g∶g)加入 0.3 mol/L的柠檬酸溶液,置于功率100 W条件下超声处理1 h,然后做干燥处理,于60 ℃烘箱中干燥至水分含量10%以下。干燥后的火麻籽置于通风处晾凉后装于自封袋备用。
1.2.3 火麻籽的粉碎及粒径的测定
选用高速中药粉碎机对预处理完毕的火麻籽进行剪切粉碎,每次30 s,共粉碎3次。经过高速中药粉碎机处理后的样品再使用实验室精细研磨设备粉碎处理5~7次,得到精细粉碎的火麻籽浆料。
取0.5 g 粉碎完成的火麻籽样品,加入装有10 mL丙酮的50 mL离心管中,漩涡振荡1 min后,置于4 ℃冰箱中静置2 h,离心后去除丙酮,沉淀用去离子水复溶后,使用激光粒度仪进行粒径的测定。
1.2.4 火麻籽的激光共聚焦显微镜分析
首先对火麻籽进行激光共聚焦显微镜观察前的固定处理。用2%戊二醛-多聚甲醛溶液固定24 h,然后用0.2 mol/L PBS缓冲液(pH 7.2)冲洗3次。使用OOCT包埋机包埋亚麻籽仁,并置于-80 ℃冰箱加固。使用冷冻切片机将其切成16 μm的薄片,置于载玻片上,依此使用尼罗红和异硫氰酸荧光素进行避光染色,分别使用10×和20×的物镜进行观察和图像采集。
1.2.5 水代法提取中油脂残留率的测定
水相中油脂的测定:取水相10 g于毛氏管中,加入1.5 mL氨水后再加入10 mL乙醇、25 mL乙醚和25 mL石油醚,静置分层,将有机相置于圆底烧瓶。重复上述步骤2次。将收集完成后的圆底烧瓶置于85 ℃水浴中蒸干,之后于105 ℃烘箱中干燥至恒重。
渣相中油脂的测定:收集渣相于105 ℃烘箱中干燥,然后用粉碎机研磨成粉状,取2 g左右样品于自动索氏抽提器中测定脂肪含量。程序完毕后取出索氏盒烘干至恒重。
火麻籽总油脂含量按照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中方法测定。
水相残油率/%=(水相油脂含量/总油脂含量)×100
(1)
渣相残油率/%=(渣相油脂含量/总油脂含量)×100
(2)
油脂残留率/%=水相残油率+渣相残油率
(3)
1.2.6 水代法工艺条件的优化
称取100 g火麻籽浆料于夹套反应器中,按料液比1∶4(g∶g)加入去离子水,调节恒温循环槽温度至60 ℃,用稀释后的NaOH溶液调节pH至9.0,反应2 h后离心(5000×g,15 min),分离出油相、乳状液、水相和渣相。
通过料液比、提取pH、温度和提取时间的单因素实验对水代法的工艺进行优化。
1.2.6.1 料液比
参考上述方法,具体步骤有所调整。固定其他条件不变,探究不同料液比(g∶g)(1∶1、1∶2、1∶3、1∶4、1∶5)对油脂在各相分布及残油率的影响,综合确定最佳料液比。
1.2.6.2 pH
参考上述方法,具体步骤有所调整。固定其他条件不变,探究不同pH(8、9、10、11、12)对油脂在各相分布及残油率的影响,综合确定最佳pH。
1.2.6.3 提取温度
参考上述方法,具体步骤有所调整。固定其他条件不变,探究不同提取温度(40、50、60、70 ℃)对油脂在各相分布及残油率的影响,综合确定最佳提取温度。
1.2.6.4 提取时间
参考上述方法,具体步骤有所调整。固定其他条件不变,探究不同提取时间(1.0、1.5、2.0、2.5、3.0 h)对油脂在各相分布及残油率的影响,综合确定最佳提取时间。
1.2.7 酶法破乳
冷冻解冻破乳:在-18 ℃冷冻24 h,40 ℃条件下解冻1 h,5 000 r/min离心15 min,取上层清油根据公式(4)计算破乳率。
酶法破乳:取一定量的乳状液加入夹套反应器里进行反应,分别添加不同的酶,在酶对应的最适温度和pH条件下进行酶解反应2 h。反应结束后,5 000 r/min 离心15 min,取上层清油根据公式(4)计算破乳率。
破乳率![]()
(4)
1.2.8 火麻籽油品质分析
火麻籽油的酸价根据GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》中方法测定;过氧化值根据GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中方法测定;碘值根据GB/T 5532—2008《动植物油脂 碘值的测定》中方法测定;水分及挥发物根据GB 5009.236—2016《食品安全国家标准 动植物油脂水分及挥发物的测定》中方法测定。氧化稳定性根据GB/T 21121—2007《动植物油脂 氧化稳定性的测定(加速氧化测试)》测定。亚麻籽油脂肪酸组成的测定按照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》中方法。
1.2.9 数据处理
所有结果均以平均值±标准偏差(SD)表示,所有样品均做3次平行实验。用Origin Pro 8.5软件作图。
2 结果与分析
2.1 预处理方式对水代法提取火麻籽油的影响
不同预处理条件对水代法提取火麻籽油的影响如图1所示。未处理火麻籽经水代法提取后清油得率仅有47.41%,乳状液中油脂含量高达40.61%,由此可见直接进行水代法提取会导致清油得率偏低,后续处理繁琐等问题。对火麻籽单独进行超声波处理和酸液浸泡处理后,清油得率分别上升到65.22%和77.48%,乳状液中油脂含量下降至28.25%和15.36%。ZHANG等[19]研究了酸浸预处理对亚麻籽水代法提油的影响,发现可以显著提高清油得率,与本实验结果一致。对火麻籽进行酸浸-超声的复合处理后,清油得率进一步提高至82.23%,不仅乳状液中油脂含量下降至12.30%,渣相残油率也从单一酸浸处理的4.23%下降至2.14%。HUANG等[20]研究大豆分离蛋白时发现,单独酸处理时,其溶解性显著下降;而酸超声复合处理时,其溶解度无明显变化,且证实了较大的聚集蛋白在超声和酸的联合作用下发生较大程度的解离。由此推测可能是由于超声和酸的协同作用导致了火麻籽蛋白结构的改变,从而减少了乳状液的形成。
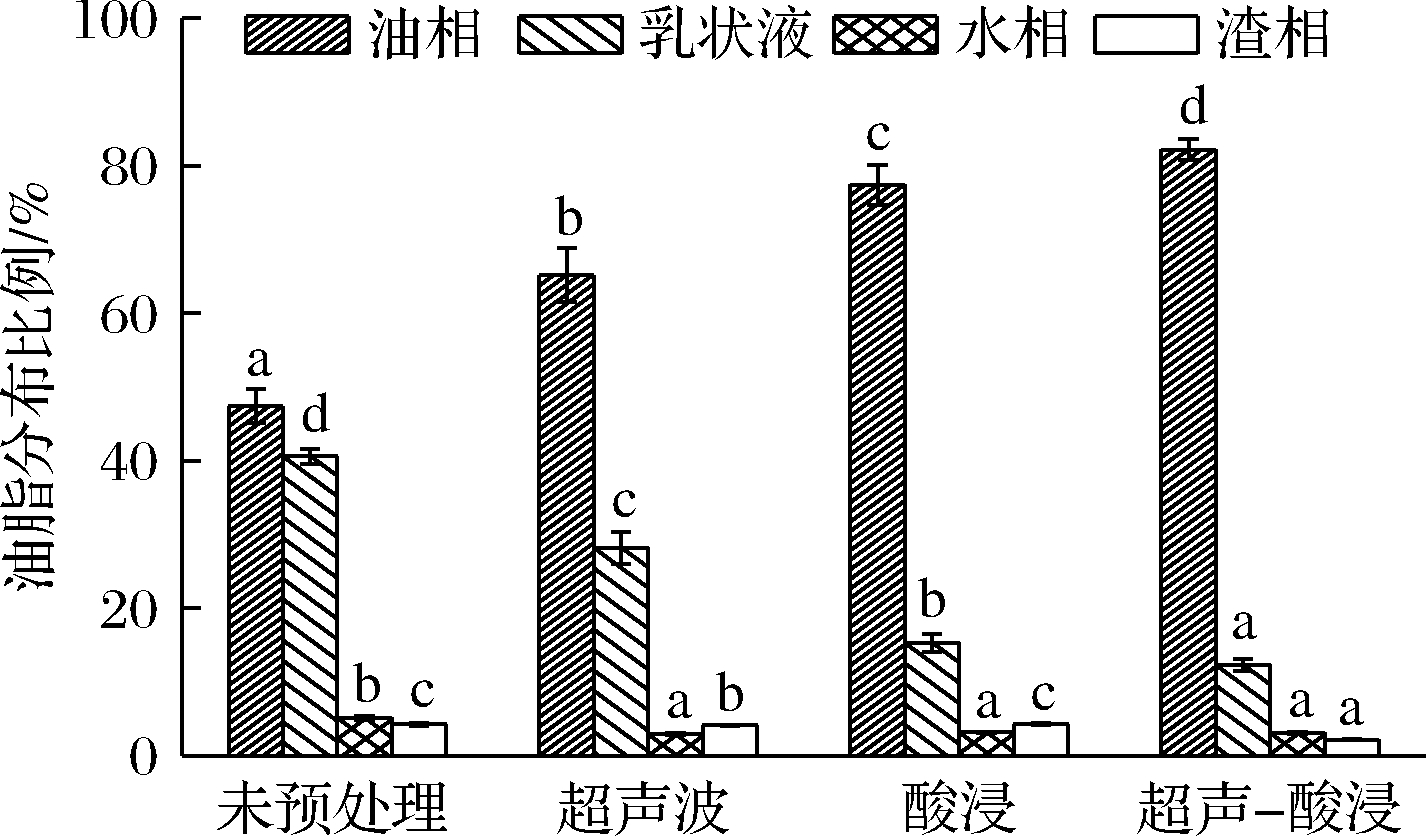
图1 预处理方式对水代法提取火麻籽油的影响
Fig.1 Effect of pretreatment methods on extraction of hemp seed oil by AEP
2.2 预处理对粉碎频次及粒径的影响
粒径的大小对水媒法提取食用油技术至关重要。ROSENTHAL等[21]研究发现物料的破碎程度与水代法提取油脂的效率成正相关。粉碎过程会破除植物细胞的细胞壁并释放出油脂,粒径的大小将直接影响水媒法的提油效率。图2为不同预处理方式对粉碎频次及粒径的影响,可以看出未处理组火麻籽经3次剪切粉碎和7次精细粉碎后粒径为27.81 μm。经过预处理后,火麻籽的粒径都有不同程度的减小。其中酸浸-超声预处理组经过3次剪切粉碎和7次精细粉碎,最终平均粒径约为12.13 μm。推测可能是由于超声波处理破坏了火麻籽细胞的完整性,让细胞壁更容易分解,同时加快了酸的传质使其更快到达细胞内部。

图2 粉碎方式与频次对火麻籽平均粒径的影响
Fig.2 Effect of crushing mode and frequency on average particle size of hempseed
注:A1~A3表示剪切粉碎及次数,B1~B7表示精细粉碎及次数
2.3 酸浸超声预处理对火麻籽微观结构的影响
图3为酸浸超声预处理前后火麻籽的激光共聚焦显微照片。未处理的火麻籽细胞轮廓清晰可见,蛋白体大量聚集并包裹油脂体,油脂体散乱分布。经过酸浸超声预处理后,火麻籽细胞结构遭到一定程度的破坏,油脂体大量聚集,蛋白体颗粒变小且散乱分布于聚集的油脂体中,蛋白结构的变化可能导致不易与油脂形成乳状液。激光共聚焦结果结合粒径分析表明,酸浸超声复合预处理对水代法提取火麻籽油有显著的促进作用。

a-未处理火麻籽;b-酸浸超声预处理火麻籽
注:O-油脂体;P-蛋白体
图3 火麻籽酸浸超声预处理前后激光共聚焦显微图像
Fig.3 Confocal micrograph of hempseed after pretreatments
2.4 超声辅助水代法工艺优化
通过预处理的预实验和粉碎结果的表征,酸浸超声预处理能够显著改善水代法的提油效率。因此,选用酸浸超声预处理的火麻籽原料,针对水代法工艺条件中提取pH、料液比、提取温度和提取时间进行工艺优化。
2.4.1 pH值
pH对水代法提取火麻籽油的影响见图4。pH的变化对火麻籽油的提取影响较大,MCNUTT等[22]研究发现pH值影响了植物蛋白在各相的分布,进而影响油脂的提取效率。pH值由8增加到12,清油得率先增大再减小,同时油脂残留率先减小后增大。当pH为10时,清油得率最高为83.61%,油脂残留率最低为4.53%。综上,确定超声辅助水代法提取火麻籽油的最佳pH值为10。
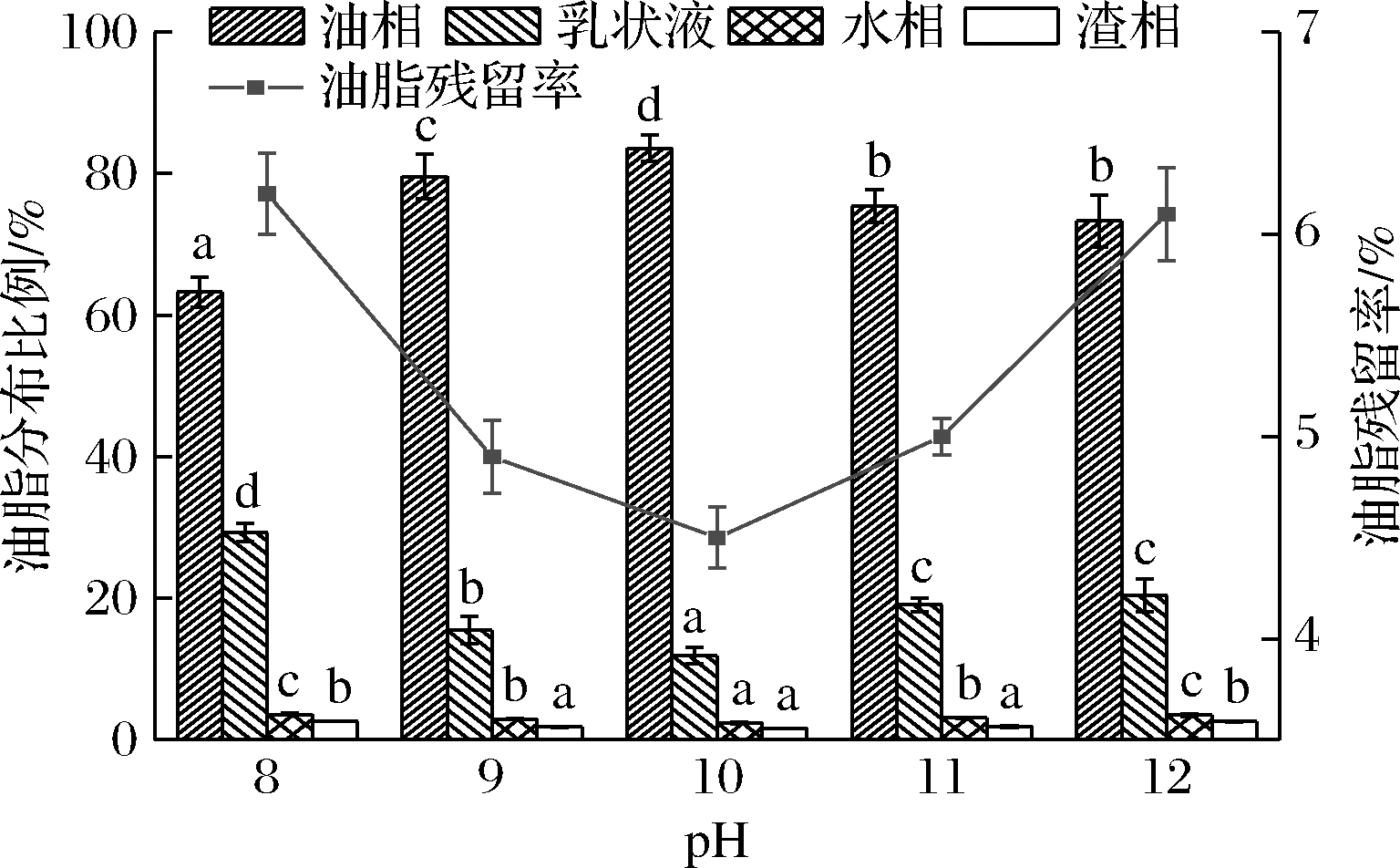
图4 pH对水代法提取火麻籽油的影响
Fig.4 Effect of pH on extraction of hempseed oil by AEP
2.4.2 料液比
料液比对水代法提取火麻籽油的影响见图5。在低料液比条件下,料液比对油脂残留率和油相比例影响显著,清油得率随料液比的增加而提高,油脂残留率逐渐减少,这可能是由于低料液比的情况下反应体系黏稠,浆料与水接触不完全导致油脂不能被完全提取。

图5 料液比对水代法提取火麻籽油的影响
Fig.5 Effect of hempseed to water ratio on extraction of hempseed oil by AEP
当料液比为1∶3(g∶g)时清油得率达到高水平,为82.16%,同时油脂残留率为5.00%。当料液比继续提高,对清油得率和油脂残留率影响不显著。因此在考虑成本和效率的前提下,选择1∶3的料液比作为水代法的反应条件。
2.4.3 提取时间
提取时间对水代法提取火麻籽油的影响见图6。随着提取时间的增长,清油得率先增加后减少,这可能是由于长时间反应使水相中蛋白和油脂结合的几率增大,进而导致乳状液的生成。当提取时间为1.5 h时,清油得率达到最高为83.62%,油脂残留率为4.12%。尽管反应2.5 h后,油脂残留率下降至3.40%,相比1.5 h下降了0.72%左右,但是清油得率也下降了约5.5%。考虑到工艺时间成本和整体效率,选择反应时间1.5 h作为合适的提取时间。
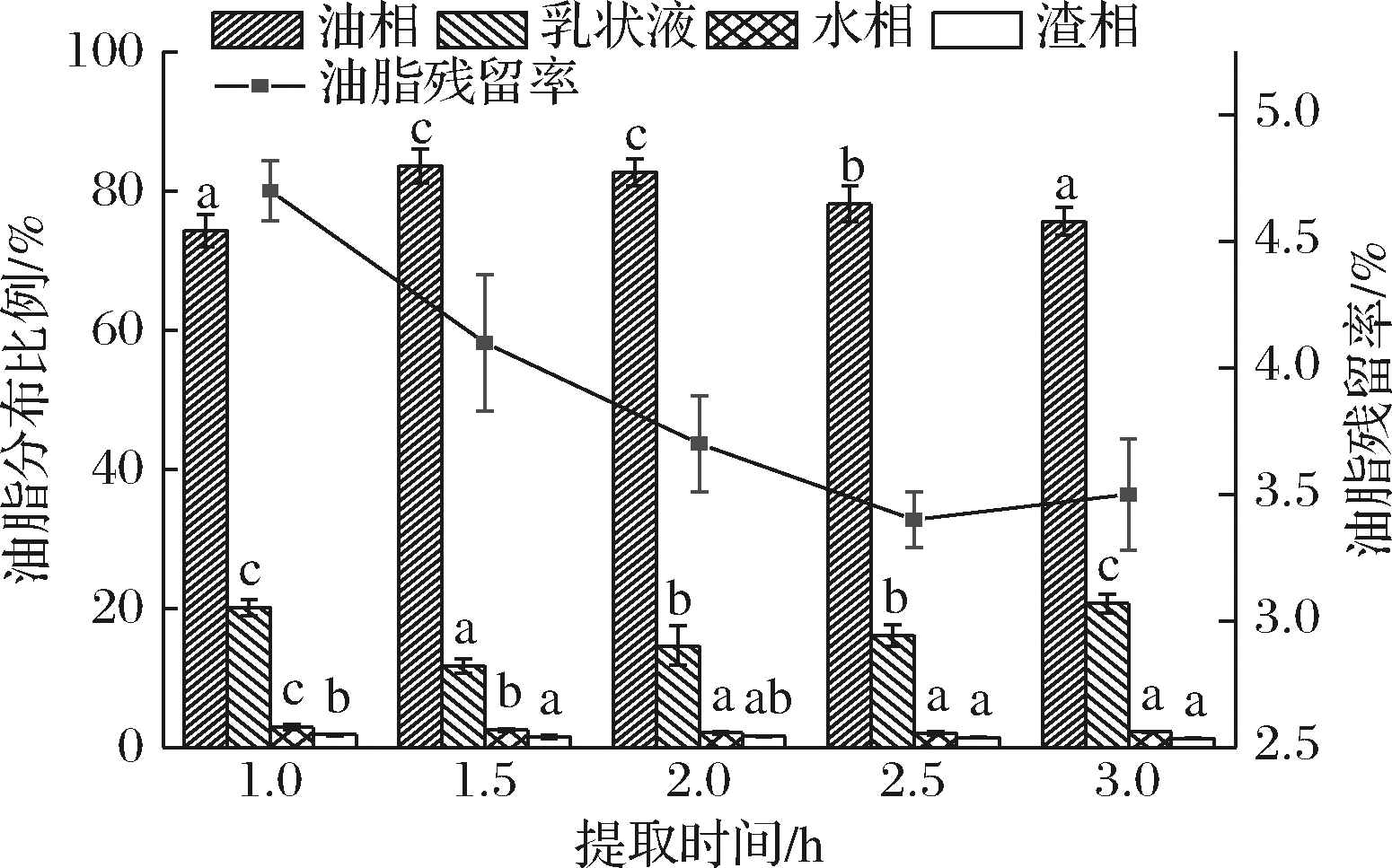
图6 提取时间对水代法提取火麻籽油的影响
Fig.6 Effect of extraction time on extraction of hempseed oil by AEP
2.4.4 提取温度
提取温度对水代法提取火麻籽油的影响见图7。当提取温度小于60 ℃时,随着温度的上升油脂残留率逐渐降低,同时清油得率显著提高,60 ℃时清油得率为83.62%,油脂残留率为3.84%。这可能是由于温度升高导致分子运动加剧,油脂能够更好地从体系中游离出来,不易形成乳状液。
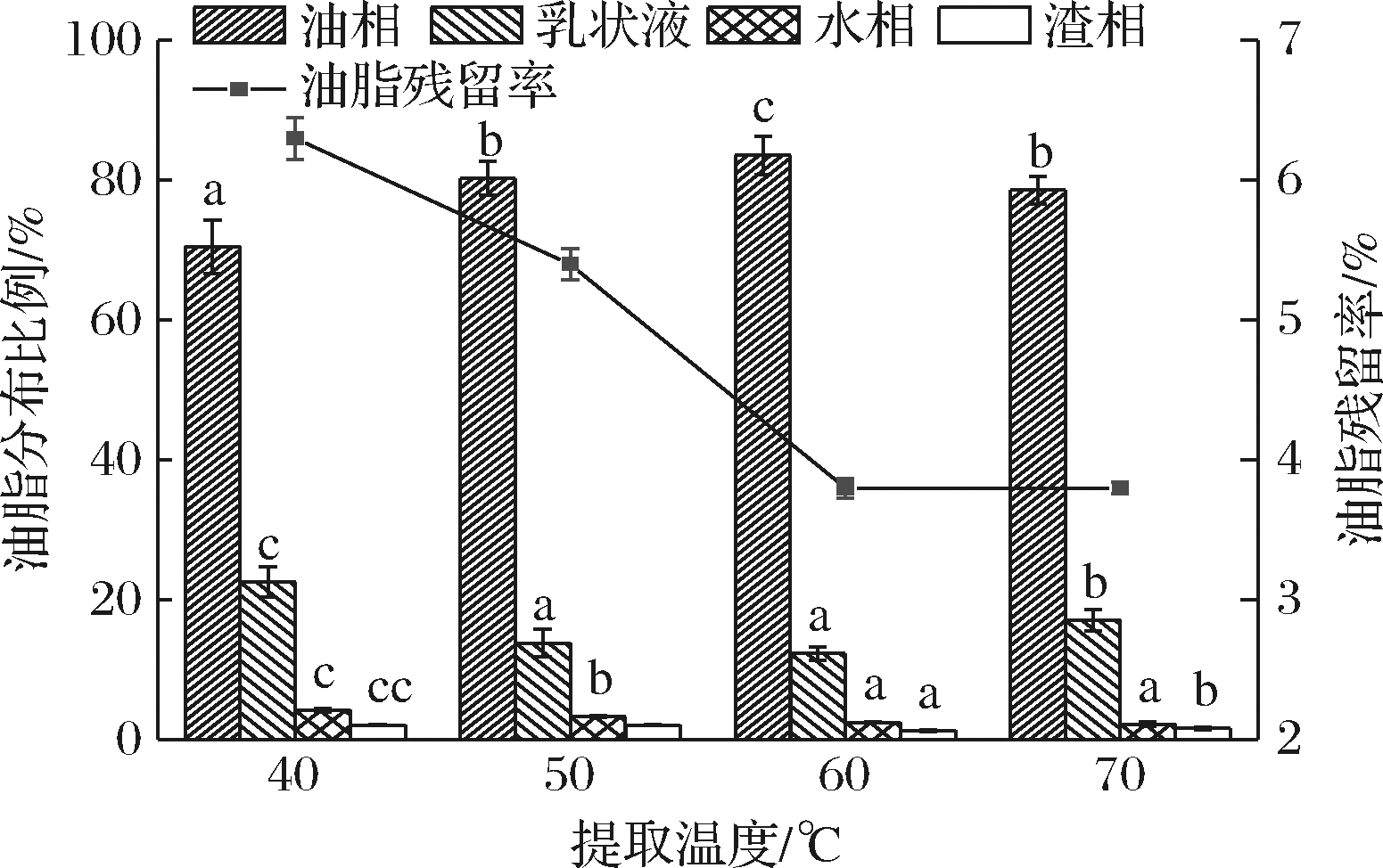
图7 提取温度对水代法提取火麻籽油的影响
Fig.7 Effect of extraction temperature on extraction of hempseed oil by AEP
温度继续升高至70 ℃后,清油得率显著下降至78.64%,推测可能是温度过高导致部分蛋白性质的改变。综合考虑,确定水代法的最适提取温度为60 ℃。
2.4.5 乳状液的破除
选择冷冻解冻破乳和4种不同的酶法破乳,破乳率如图8所示。其中,破乳率较高的是枯草杆菌蛋白酶和冷冻解冻破乳,破乳率分别为98.34%和96.05%。考虑到枯草杆菌蛋白酶适宜偏碱性的条件,破乳时无需调节pH,而冷冻解冻破乳耗时长、成本高,综合考虑选择枯草杆菌蛋白酶进行破乳。

1-枯草杆菌蛋白酶;2-冷冻破乳;3-木瓜蛋白酶;
4-碱性蛋白酶2709;5-中性蛋白酶7L
图8 不同处理对乳状液破除的影响
Fig.8 Demulsification rate of emulsion with different treatments
2.4.6 最佳工艺验证
综上,最佳工艺条件为:料液比1∶3(g∶g),pH值10.0,提取温度60 ℃,提取时间1.5 h。所得乳状液使用枯草杆菌蛋白酶破乳。进行3次平行实验,最终总油得率为(95.36±0.73)%。证明本实验所采用的酸浸超声辅助水代法提取火麻籽油具有一定的可行性。
2.5 火麻籽油品质分析
2.5.1 火麻籽油基本品质指标
比较了市售压榨火麻籽油以及预处理前后水代法提取火麻籽油的基本指标。实验结果表明,市售压榨火麻籽油和预处理前后水代法提取火麻籽油的碘值、挥发性成分和氧化诱导时间无显著性差异。
表1 预处理对火麻籽油基本理化指标的影响
Table 1 Effects of pretreatments on basic physicochemical indexes of hempseed oil
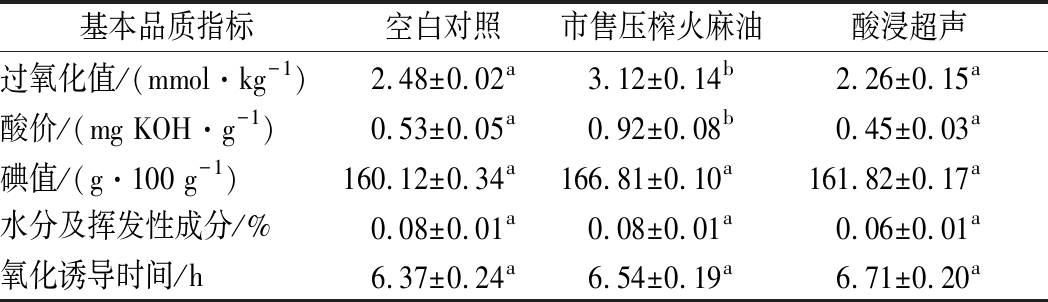
基本品质指标空白对照市售压榨火麻油酸浸超声过氧化值/(mmol·kg-1)2.48±0.02a3.12±0.14b2.26±0.15a酸价/(mg KOH·g-1)0.53±0.05a0.92±0.08b0.45±0.03a碘值/(g·100 g-1)160.12±0.34a166.81±0.10a161.82±0.17a水分及挥发性成分/%0.08±0.01a0.08±0.01a0.06±0.01a氧化诱导时间/h6.37±0.24a6.54±0.19a6.71±0.20a
注:同一行不同字母表示具有显著性差异(P<0.05),下同
过氧化值是评判油脂被氧化程度的指标,酸浸超声辅助水代法全程条件温和,其过氧化值为2.26 mmol/kg,显著低于市售压榨火麻籽油(3.12 mmol/kg)。所有指标均符合国家食用油标准,表明酸浸超声辅助水代法提取的火麻籽油品质较好,具有一定的应用价值。
2.5.2 火麻籽油脂肪酸分析
预处理对火麻籽油脂肪酸组成的影响如表2所示。各预处理组与对照组间的脂肪酸组成均无显著性差异,表明酸浸超声预处理对火麻籽油脂肪酸组成无明显影响。PORTO等[23]研究了超临界萃取法对火麻籽油的影响,脂肪酸组成与本实验基本一致。经酸浸超声预处理后,火麻籽油中不饱和脂肪酸含量约占90%,其中多不饱和脂肪酸占78.24%。
表2 不同预处理对火麻籽油脂肪酸组成的影响 单位:%
Table 2 Effects of different pretreatments on fatty acid composition of hempseed oil
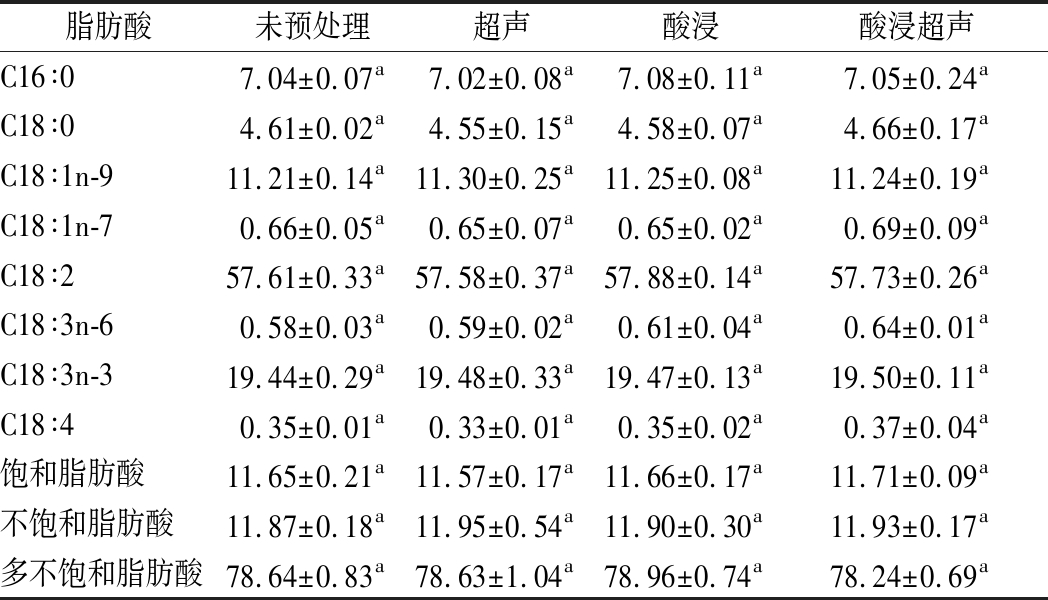
脂肪酸未预处理超声酸浸酸浸超声C16∶07.04±0.07a7.02±0.08a7.08±0.11a7.05±0.24aC18∶04.61±0.02a4.55±0.15a4.58±0.07a4.66±0.17aC18∶1n-911.21±0.14a11.30±0.25a11.25±0.08a11.24±0.19aC18∶1n-70.66±0.05a0.65±0.07a0.65±0.02a0.69±0.09aC18∶257.61±0.33a57.58±0.37a57.88±0.14a57.73±0.26aC18∶3n-60.58±0.03a0.59±0.02a0.61±0.04a0.64±0.01aC18∶3n-319.44±0.29a19.48±0.33a19.47±0.13a19.50±0.11aC18∶40.35±0.01a0.33±0.01a0.35±0.02a0.37±0.04a饱和脂肪酸11.65±0.21a11.57±0.17a11.66±0.17a11.71±0.09a不饱和脂肪酸11.87±0.18a11.95±0.54a11.90±0.30a11.93±0.17a多不饱和脂肪酸78.64±0.83a78.63±1.04a78.96±0.74a78.24±0.69a
3 结论
酸浸超声协同预处理后的火麻籽,经过3次剪切粉碎和7次精细粉碎后平均粒径减小到12.13 μm,表明酸浸超声预处理对火麻籽的细胞结构造成了一定的破坏。结合激光共聚焦显微镜照片结果分析,原本聚集的蛋白体变得散乱,且蛋白体颗粒变小,油脂体大量聚集,可以推测火麻籽蛋白的部分结构发生了改变。
酸浸超声预处理对水代法提取火麻籽油影响显著,清油得率进一步提高至82.23%,乳状液中油脂含量下降至12.30%,渣相残油率也从单一酸浸处理的4.23%下降至2.14%。
对水代法进行工艺优化的结果为:料液比1∶3(g∶g),pH值10.0,提取温度60 ℃,提取时间1.5 h。所得乳状液使用枯草杆菌蛋白酶破乳,破乳率可达到98.34%。经最佳工艺多次验证,最终总油得率可达到(95.36±0.73)%。
对酸浸超声辅助水代法所提取的火麻籽油进行品质分析,结果表明火麻籽油品质良好,符合国家标准;脂肪酸组成与对照组无明显差异。说明该工艺具有一定的应用与研究价值。
[1] FIORINI D,SCORTICHINI S,BONACUCINA G,et al.Cannabidiol-enriched hemp essential oil obtained by an optimized microwave-assisted extraction using a central composite design[J].Industrial Crops and Products,2020,154:112688.
[2] CITTI C,PACCHETTI B,VANDELLI M A,et al.Analysis of cannabinoids in commercial hemp seed oil and decarboxylation kinetics studies of cannabidiolic acid(CBDA)[J].Journal of Pharmaceutical and Biomedical Analysis,2018,149:532-540.
[3] RANALLI P,VENTURI G.Hemp as a raw material for industrial applications[J].Euphytica,2004,140(1-2):1-6.
[4] CALLAWAY J C.Hempseed as a nutritional resource:An overview[J].Euphytica,2004,140(1-2):65-72.
[5] OOMAH B D,BUSSON M,GODFREY D V,et al.Characteristics of hemp(Cannabis sativa L.) seed oil[J].Food Chemistry,2002,76(1):33-43.
[6] GOLDBERG E M,GAKHAR N,RYLAND D,et al.Fatty acid profile and sensory characteristics of table eggs from laying hens fed hempseed and hempseed oil[J].Journal of Food Science,2012,77(4):S153-S160.
[7] MATTH US B,BRÜHL L.Virgin hemp seed oil:An interesting niche product[J].European Journal of Lipid Science and Technology,2008,110(7):655-661.
US B,BRÜHL L.Virgin hemp seed oil:An interesting niche product[J].European Journal of Lipid Science and Technology,2008,110(7):655-661.
[8] KAUL N,KREML R,AUSTRIA J A,et al.A comparison of fish oil,flaxseed oil and hempseed oil supplementation on selected parameters of cardiovascular health in healthy volunteers[J].Journal of the American College of Nutrition,2008,27(1):51-58.
[9] SIMOPOULOS A P.The importance of the ratio of Omega-6/Omega-3 essential fatty acids[J].Biomedicine & Pharmacotherapy,2002,56(8):365-379.
[10] 刘天毅.低四氢大麻酚火麻油的提取及品质评价[D].无锡:江南大学,2017.
LIU T Y.Extraction of hemp seed oil with low THC content and its quality evaluation[D].Wuxi:Jiangnan University,2017.
[11] LESON G,PLESS P,GROTENHERMEN F,et al.Evaluating the impact of hemp food consumption on workplace drug tests[J].Journal of Analytical Toxicology,2001,25(8):691-698.
[12] 杨瑞金,倪双双,张文斌,等.水媒法提取食用油技术研究进展[J].农业工程学报,2016,32(9):308-314.
YANG R J,NI S S,ZHANG W B,et al.Summarization on vegetable oil extraction technology by aqueous medium method[J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(9):308-314.
[13] 王欢,李杨,江连洲,等.水酶法提取火麻籽油的工艺优化及其脂肪酸组成分析[J].食品科学,2013,34(22):27-32.
WANG H,LI Y,JIANG L Z,et al.Optimization of aqueous enzymatic extraction of hemp seed oil and analysis of its fatty acid composition[J].Food Science,2013,34(22):27-32.
[14] 侯真真,吴雪辉.水酶法提取火麻籽油工艺研究[J].食品工业科技,2014,35(3):195-198.
HOU Z Z,WU X H.Aqueous enzymatic extraction of hemp seed oil[J].Science and Technology of Food Industry,2014,35(3):195-198.
[15] LAWHON J T,MANAK L J,RHEE K C,et al.Production of oil and protein food products from raw peanuts by aqueous extraction and ultrafiltration[J].Journal of Food Science,1981,46(2):391-395.
[16] 盖晴晴.水酶法提取牡丹籽油工艺改进及水相蛋白特性研究[D].无锡:江南大学,2020.
GAI Q Q.Process improvement on aqueous enzymatic extraction of peony seed oil and investigation on protein properties[D].Wuxi:Jiangnan University,2020.
[17] 张伟光,赵国君.超声波辅助法提取山茶油工艺的研究[J].粮油食品科技,2015,23(4):29-31.
ZHANG W G,ZHAO G J.Study on extraction of Camellia oil by ultrasonic technique[J].Science and Technology of Cereals,Oils and Foods,2015,23(4):29-31.
[18] DICKEY L C,KURANTZ M J,PARRIS N.Oil separation from wet-milled corn germ dispersions by aqueous oil extraction and aqueous enzymatic oil extraction[J].Industrial Crops and Products,2008,27(3):303-307.
[19] ZHANG W B,PENG H Y,SUN H,et al.Effect of acidic moisture-conditioning as pretreatment for aqueous extraction of flaxseed oil with lower water consumption[J].Food and Bioproducts Processing,2020,121:20-28.
[20] HUANG L R,DING X N,DAI C H,et al.Changes in the structure and dissociation of soybean protein isolate induced by ultrasound-assisted acid pretreatment[J].Food Chemistry,2017,232:727-732.
[21] ROSENTHAL A,PYLE D L,NIRANJAN K.Simultaneous aqueous extraction of oil and protein from soybean:Mechanisms for process design[J].Food and Bioproducts Processing,1998,76(4):224-230.
[22] MCNUTT J,HE Q.Development of biolubricants from vegetable oils via chemical modification[J].Journal of Industrial and Engineering Chemistry,2016,36:1-12.
[23] DA PORTO C,DECORTI D,TUBARO F.Fatty acid composition and oxidation stability of hemp(Cannabis sativa L.) seed oil extracted by supercritical carbon dioxide[J].Industrial Crops and Products,2012,36(1):401-404.