豆清液是指在传统豆制品生产过程中蹲脑与压榨过程中产生的上清液,俗称黄浆水[1]。据研究豆清液中营养丰富,含有大豆异黄酮0.2 mg/g、总糖9.9 mg/g、蛋白质6.5 mg/g、脂肪3.6 mg/g、总固形物2.5 Brix[2],豆清饮料以豆清液为主要原料,通过添加辅料,菌种进行发酵而成[3],研究表明通过微生物发酵可以将豆清饮料中糖苷型异黄酮转化为具有更强抗氧化活性的苷元型异黄酮[4],有利于豆清饮料抗氧化活性和生物利用度的提高[5-6]。TU等[7]利用康普茶菌群将大豆乳清转化为一种新型的功能性饮料,随着异黄酮苷元含量的增加,发酵之后抗氧化活性、抑菌性增强。杜欣[4]运用乳酸菌发酵豆清液,发酵后的豆清液清除DPPH自由基和ABTS阳离子自由基的能力明显大于未发酵。豆清液发酵成饮料可以大批量的解决豆清液排放问题,提升其利用价值。
传统评价生物活性的方法主要是通过有机试剂进行萃取,最大限度地提取活性物质,测定物质的含量以及进行功能性评价[7]。植源性食物中活性成分的摄入与整个胃肠道的生物利用率,是评估其对人类健康的生物学意义的关键因素。活性成分在消化过程中含量与成分会受到胃肠道的pH、温度、时间、酶、抑制剂、增强剂或其他因素的影响[8]。在胃肠环境中,物质的结构会转化成不同形式,物理及化学性质发生改变[9]。经胃肠消化后,食物中的抗氧化活性成分及其活力可能会发生变化[10]。纯度高或单一的物质运用体外模拟消化方法可以避免食物中其他成分的干扰[11]。
本研究以豆清液为主要原料,添加鼠李糖乳杆菌、肠膜明串珠菌、克鲁维酵母进行发酵,并对豆清饮料配方辅料麦芽汁、麦芽糖、低聚果糖、酒花添加量进行优化,得到最佳配方,再运用体外模拟胃肠消化的方法,探究豆清饮料在消化过程中大豆异黄酮、有机酸的变化规律,分析消化过程中的抗氧化活性,以期为豆清液的综合利用及新型饮料开发提供理论支撑。
1 材料与方法
1.1 材料与试剂
豆清液、克鲁维酵母(Kluyveromyces marxianus)、明串珠菌(Leuconostoc marxianus)、鼠李糖乳杆菌(Lactobacillus rhamnosus),豆制品加工与安全控制湖南省重点实验室提供;大麦芽、麦芽糖、低聚果糖、酒花均为市售;胃蛋白酶(15 000 U/g)、胰酶(250 000 U/g)、猪胆盐,国药集团化学试剂有限公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥97.0%)、L-乳酸、L-酒石酸、柠檬酸、丙酮酸、黄豆黄素、大豆苷、大豆苷元、染料木素、染料木苷、黄豆黄素苷元,北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器设备
pH S-3C型pH计,上海理达仪器厂;SW-CJ-2FD型双人单面垂直净化工作台,江苏通净净化设备有限公司;IS-RDD3型台式恒温振荡器,苏州捷美电子有限公司;MASTER-20T型手持式糖度仪,上海右一时代仪器公司;UV-1780型紫外可见分光光度计,日本岛津公司;ULtiMate 3 000 型高效液相色谱仪,美国赛默飞有限公司;SB-5 200 DTD型超声清洗机,宁波新芝生物科技股份有限公司;RE-5 299型旋转蒸发器,巩义市予华有限责任公司;VELOCITY 18R 型高速冷冻离心机,澳大利亚 Dynamica 公司。
1.3 实验方法
1.3.1 生产工艺流程
豆清液过滤→添加配料→调节pH→灭菌→接种→发酵→离心→灭菌→包装→豆清饮料
1.3.2 操作要点
豆清液中添加低聚果糖、麦芽汁、酒花、麦芽糖,用食用级柠檬酸钠或者柠檬酸调节pH为6.0,在105 ℃下灭菌8 min。菌种分别在MRS培养基上进行活化,分别接种于5 mL灭菌的豆清液培养基中进行驯化,对已驯化的微生物分别先后以3%的接种量,于28 ℃,24 h培养条件下进行100、500 mL两级扩大培养。进行活菌计数,克鲁维酵母、明串珠菌、鼠李糖乳杆菌按照体积比1∶1∶1的比例进行复配,最终将菌液浓度调整为108 CFU/mL。在60 r/min、28 ℃下发酵22 h,然后3 000 r/min离心20 min,在70 ℃下杀菌20 min。
1.4 豆清饮料配方工艺优化
1.4.1 单因素试验
以糖酸比以及感官评价为指标,采用单因素试验,分别选择低聚果糖添加量为5%、4%、3%、2%、1%(质量分数);麦芽汁质量分数分别为3%、4%、5%、6%、7%;酒花质量分数为0.01%、0.02%、0.03%、0.04%、0.05%;麦芽糖质量分数为4%、5%、6%、7%、8%。
1.4.2 响应面实验
根据以上4组单因素试验结果。以麦芽汁、麦芽糖、低聚果糖、酒花添加量为影响因素,以总酸、pH、可溶性固形物、还原糖为响应值,将各指标进行归一化处理,赋予其不同的权重系数进行多指标综合评分[12-13]。权重系数分别为总酸0.3、可溶性固形物0.3、pH 0.2、还原糖0.2。
1.5 豆清饮料体外模拟消化
1.5.1 模拟胃消化
胃消化过程:均匀取600 mL豆清饮料置于1 L锥形瓶中,用盐酸调节pH至2.0,加入1.2 g NaCl,0.756 g胃蛋白酶,充分溶解,置于37 ℃、150 r/min恒温振荡器中振摇2 h,分别于0、30、60、90、120 min取60 mL胃消化液,-20 ℃下保存,分析前溶解[14-15]。表6、图3、4、5、6、7横坐标1、2、3、4、5代表在胃消化0、30、60、90和120 min。
1.5.2 模拟肠消化
肠道消化过程:取上述步骤的模拟胃消化完的样品,NaOH溶液调节溶液体系至pH 7.0,加入40 mg胰蛋白酶和250 mg胆盐,充分溶解之后置于37 ℃、150 r/min恒温振荡器中振摇2 h,分别于0、30、60、90、120 min取60 mL胃消化液,-20 ℃下保存,分析前溶解[14-15]。表6、图3、4、5、6、7横坐标6、7、8、9、10表示在肠消化0、30、60、90和120 min。
1.6 检测方法
1.6.1 总酸
参照GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》中酸碱滴定法进行测定,以乳酸计[16]。
1.6.2 可溶性固形物
手持式糖度仪直接测定[17]。
1.6.3 pH
pH计直接测定。
1.6.4 还原糖
3,5-二硝基水杨酸比色法[18]测定。
1.6.5 糖酸比
可溶性固形物与总酸的比值[19]。
1.6.6 感官评价
选择10~15名同学作为受试者。受试者经专业培训之后选取感官敏锐的10人作为产品的品评人员。具体评分如表1,最终结果取均值。
表1 感官评价表
Table 1 Sensory evaluation form

评价项目评价标准分值(分)外观颜色澄清透明,呈现黄绿色,无沉淀与悬浮物15~20(20%)澄清透明,色泽呈现绿色,有悬浮物10~15颜色暗淡,呈现黄褐色,有沉淀且浑浊0~10香气香气纯正,清爽柔和,淡果香味、豆香味、酒香味20~30(30%)无明显的果香味、酒香、豆香,有明显枣香气10~20酒香、豆香不足,有很明显的枣香0~10口感有汽水刹口感、口感柔和、酸甜适中、协调20~30(30%)刹口感不足、口味偏酸、有苦涩味、味道不协调10~20无刹口感、酸涩、令人不悦0~10典型性有典型性、风格良好、回味无穷15~20(20%)有典型香味、有点苦涩味10~15无明显典型风格、苦涩味留存时间太久0~10
1.6.7 大豆异黄酮
参照GB/T 23788—2009《保健食品中大豆异黄酮的测定方法 高效液相色谱法》[20],并做一定调整,取15 mL样品转移到锥形瓶中,加入35 mL 80%甲醇,室温超声处理提取1 h。将样品提取液在5 000 r/min下离心12 min,离心之后的样品进行旋转蒸发浓缩,用10%甲醇溶液定容至10 mL容量瓶,均匀取1 mL样品提取液在10 000 r/min下离心10 min,吸取1 mL 离心后的液体通过0.45 μm的滤膜,供高效液相色谱仪测定,每组实验重复3次。色谱柱参数:流动相A为0.1%乙酸溶液、流动相B为0.1%乙酸乙腈溶液、波长260 nm、流速1 mL/min、柱温40 ℃、进样量20 μL。
表2 大豆异黄酮回归方程
Table 2 Regression equation of soybean isoflavones

大豆异黄酮回归方程决定系数大豆苷y=1.037 6x+0.095 4R2=0.996 4黄豆黄苷y=3.018 5x+0.139 5R2=0.996 9染料木苷y=1.407 9x+0.182 5R2=0.995 3大豆苷元y=1.449 8x+0.296 5R2=0.995 0黄豆黄素y=1.432 0x+0.146 4R2=0.996 4染料木素y=1.316 7x+0.312 5R2=0.997 2
1.6.8 有机酸
参考王容等[21]的方法,并稍作修改,取样液5 mL,在10 000 r/min下离心20 min,取上清液1 mL,过0.22 μm滤膜,供高效液相色谱仪测定。液相色谱条件:色谱柱为CAPE-CELL PAK MG-C18柱(4.6 mm×250 mm,5 μm),柱温30 ℃,检测波长210 nm,流动相V(甲醇):V(0.01 mol/L KH2PO4溶液,pH 2.65)=3∶97;流速1.0 mL/min;进样量20 μL。
表3 有机酸回归方程
Table 3 Regression equation of organic acids

有机酸回归方程决定系数乳酸y=695.88x-0.133 6R2=0.999 1柠檬酸y=14.932x+0.154 7R2=0.993 5富马酸y=38.685x+0.400 5R2=0.999 5琥珀酸y=96.446x+0.052R2=0.999 8
1.6.9 抗氧化活性
ABTS阳离子自由基清除能力、·OH清除率参考XIAO等的方法进行测定[22]。
1.7 数据处理
实验结果每组重复3次,数据采用Excel 2017、Origin 2018和IBM SPSS Statistics 22.0进行图像绘制及处理。
2 结果与分析
2.1 单因素试验结果
由图1可知,随着低聚果糖的增加,豆清饮料中的可溶性固形物增加,产酸速度先增加,后减少,当低聚糖的添加量为4%时,此时是微生物最适的糖度,此时产酸增加,消耗糖的速度增加,糖酸比从(2.67±0.010)减少至(2.51±0.031),感官评分值最高,综合选择最适低聚果糖为4%。
麦芽汁的添加增加豆清饮料的固形物含量,随着麦芽汁添加量的增加,糖酸比减少,产酸速度增加,当麦芽汁添加量为5%时,此时感官评分最高,综合选择最适麦芽汁添加量5%。
酒花具有抑菌的功效,随着酒花的增加,糖酸比增加,微生物产酸减少,但是当酒花添加量达到0.01%时开始有抑菌的功效。因为酒花的添加,有植物的清香,但有苦味,所以感官评分呈现下降趋势,添加量为0.01%时的感官评分最高,选择最适酒花含量0.01%。
随着麦芽糖含量的增加,豆清饮料的可溶性固形物含量增加,从(7.95±0.041)增加至(10.50±0.000) Brix,产酸量不断累积,但是产酸速度与糖的消耗速度不一致,当麦芽糖添加量为5%时,感官评分最高,酸甜适口,综上选择最适麦芽糖添加量5%。

a-低聚糖;b-麦芽汁;c-酒花;d-麦芽糖
图1 单因素试验结果
Fig.1 Results of one-factor-at-a-time experiments
注:不同字母代表不同水平之间有显著性差异(P<0.05)
2.2 响应面实验
2.2.1 响应面分析与结果
响应面分析如表4所示。
表4 响应面实验设计及结果
Table 4 Experimental design and results for response surface analysis
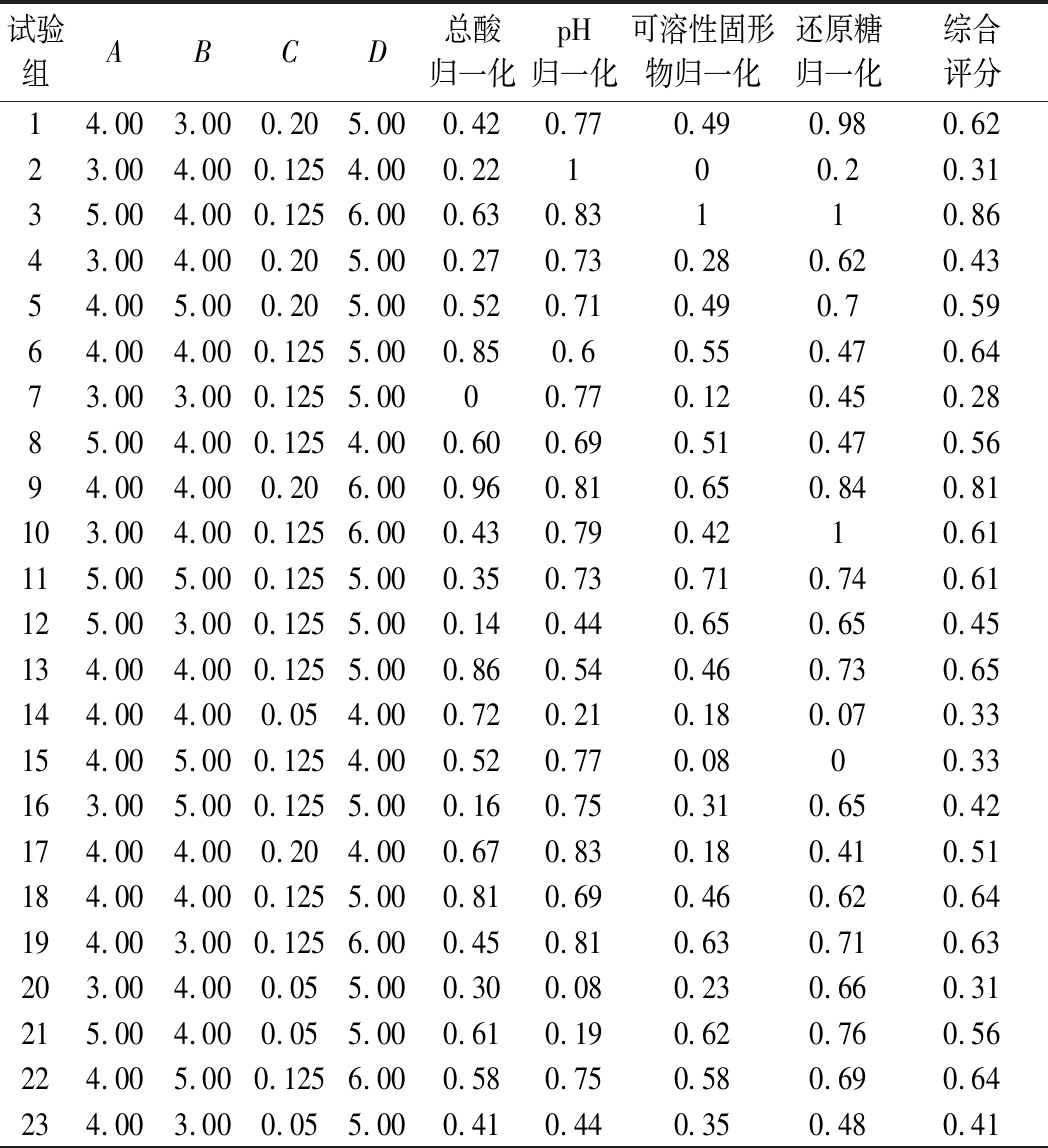
试验组ABCD总酸归一化pH归一化可溶性固形物归一化还原糖归一化综合评分14.003.000.205.000.420.770.490.980.6223.004.000.1254.000.22100.20.3135.004.000.1256.000.630.83110.8643.004.000.205.000.270.730.280.620.4354.005.000.205.000.520.710.490.70.5964.004.000.1255.000.850.60.550.470.6473.003.000.1255.0000.770.120.450.2885.004.000.1254.000.600.690.510.470.5694.004.000.206.000.960.810.650.840.81103.004.000.1256.000.430.790.4210.61115.005.000.1255.000.350.730.710.740.61125.003.000.1255.000.140.440.650.650.45134.004.000.1255.000.860.540.460.730.65144.004.000.054.000.720.210.180.070.33154.005.000.1254.000.520.770.0800.33163.005.000.1255.000.160.750.310.650.42174.004.000.204.000.670.830.180.410.51184.004.000.1255.000.810.690.460.620.64194.003.000.1256.000.450.810.630.710.63203.004.000.055.000.300.080.230.660.31215.004.000.055.000.610.190.620.760.56224.005.000.1256.000.580.750.580.690.64234.003.000.055.000.410.440.350.480.41
续表4
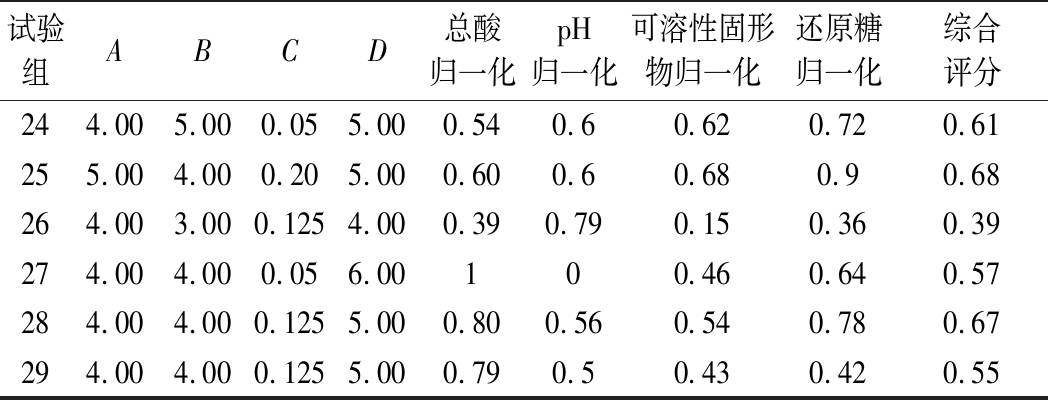
试验组ABCD总酸归一化pH归一化可溶性固形物归一化还原糖归一化综合评分244.005.000.055.000.540.60.620.720.61255.004.000.205.000.600.60.680.90.68264.003.000.1254.000.390.790.150.360.39274.004.000.056.00100.460.640.57284.004.000.1255.000.800.560.540.780.67294.004.000.1255.000.790.50.430.420.55
2.2.2 响应面回归模型建立与方差分析
利用Design-Expert 8.0.6软件对各因素进行回归分析,回归方程的预测模型:
Y=0.63+0.11A+0.035B+0.071C+0.14D+5.00E-003AB+0.000AC+0.000AD-0.058BC+0.018BD+0.015CD-0.077A2-0.089B2-0.033C2-0.018D2
以综合评分为响应值进行方差分析,结果见表5。
表5 回归方程系数及显著性检验结果
Table 5 Analysis results of significance test of the regression coefficients
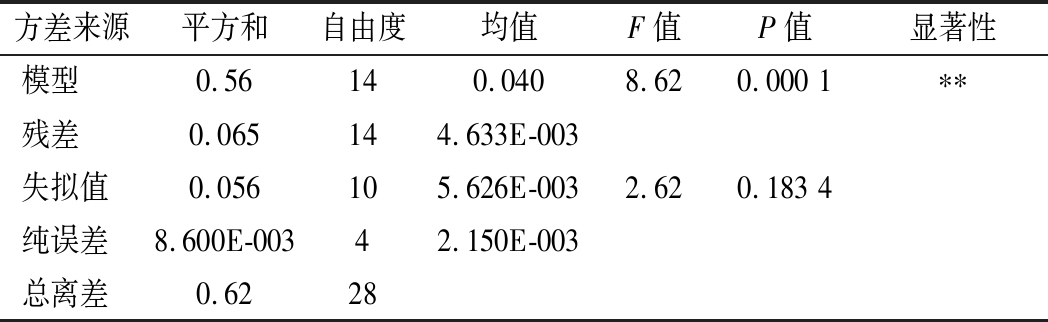
方差来源平方和自由度均值F值P值显著性模型0.56140.0408.620.000 1∗∗残差0.065144.633E-003失拟值0.056105.626E-0032.620.183 4纯误差8.600E-00342.150E-003总离差0.6228
注:**差异极显著(P<0.01);*差异显著(P<0.05)
显著性检验结果显示,回归模型差异极显著P<0.000 1,失拟值不显著P=0.183 4>0.05,相关系数R2=0.896 0,表明回归方程拟合度较高,该模型可以很好地对工艺参数进行预测。
2.2.3 验证实验结果
由响应面软件可以得到最佳的预测组合是低聚果糖4.74%,麦芽汁3.99%,酒花0.02%,麦芽糖添加量6%,此时的综合评价分数最高为0.847 7分。综合实际情况进行调整低聚果糖5%,麦芽汁4%,酒花0.02%,麦芽糖添加量6%,此时综合评分(0.82±0.025)分。
2.3 豆清饮料体外模拟消化结果分析
2.3.1 有机酸变化
如表6所示,豆清液中初始的酸主要以乳酸为主,是在加工过程中乳酸菌代谢产生或是豆腐的凝固剂酸浆带入。在体外模拟消化过程中无水柠檬酸的含量占比约64%,主要起到调节pH的作用。乳酸占比约18%,可能是植物乳杆菌主要进行了柠檬酸代谢,自身通过2-羟基羧酸盐转运蛋白运输柠檬酸盐,柠檬酸盐在柠檬酸裂解酶复合物催化下转化为草酰乙酸盐,再经草酰乙酸脱羧酶脱羧产生丙酮酸最后生成乳酸及芳香化合物[23]。琥珀酸与富马酸分别占比约12%、5%,主要是乳酸菌与酵母菌进行了三羧酸循环,形成的中间产物。豆清饮料在胃肠消化过程中,乳酸、无水柠檬酸、富马酸、琥珀酸的含量变化不明显(P>0.05),SERRE等[24]研究发现,在体外消化的过程中,测量的3种主要有机酸(柠檬酸、苹果酸和奎宁酸)的浓度保持不变,与该研究一致。
有机酸是小分子亲水化合物,在植物食品中如果模拟消化液中含有细胞壁降解酶,亲和力不同的有机
表6 体外模拟消化过程中有机酸含量变化 单位:g/L
Table 6 Changes in organic acid content during in vitro simulated digestion
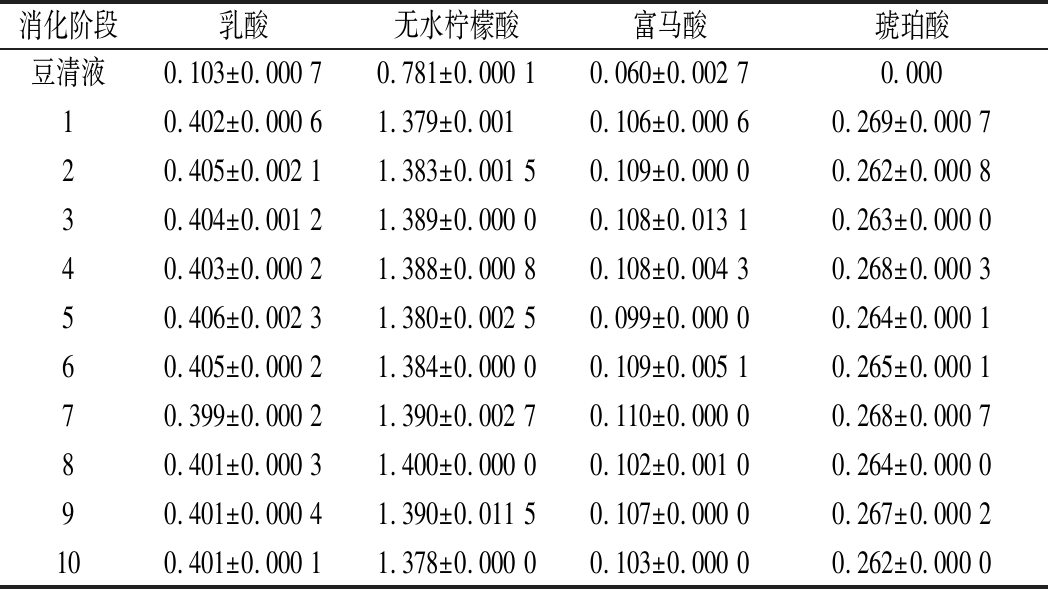
消化阶段乳酸无水柠檬酸富马酸琥珀酸豆清液0.103±0.000 70.781±0.000 10.060±0.002 70.00010.402±0.000 61.379±0.0010.106±0.000 60.269±0.000 720.405±0.002 11.383±0.001 50.109±0.000 00.262±0.000 830.404±0.001 21.389±0.000 00.108±0.013 10.263±0.000 040.403±0.000 21.388±0.000 80.108±0.004 30.268±0.000 350.406±0.002 31.380±0.002 50.099±0.000 00.264±0.000 160.405±0.000 21.384±0.000 00.109±0.005 10.265±0.000 170.399±0.000 21.390±0.002 70.110±0.000 00.268±0.000 780.401±0.000 31.400±0.000 00.102±0.001 00.264±0.000 090.401±0.000 41.390±0.011 50.107±0.000 00.267±0.000 2100.401±0.000 11.378±0.000 00.103±0.000 00.262±0.000 0
酸矿物质(钾和钙)的细胞壁基质或其他化合物(例如果胶)较容易得到释放[25]。豆清液中上述物质含量极低,所以豆清饮料在消化过程中有机酸的含量变化不明显。
2.3.2 大豆异黄酮的变化
豆清液中大豆异黄酮各组分的含量如图2所示。其中,大豆异黄酮苷占主要比例,含量达到(114.65±0.10) mg/kg,黄酮苷元含量只有(8.55±0.03) mg/kg。体外模拟胃消化0 h时,此时黄酮苷(75.85±0.08) mg/kg,黄酮苷元(36.85±0.06) mg/kg(图5)。可知豆清液可以通过微生物发酵将黄酮苷转化为功能活性更强的黄酮苷元[4,7]。
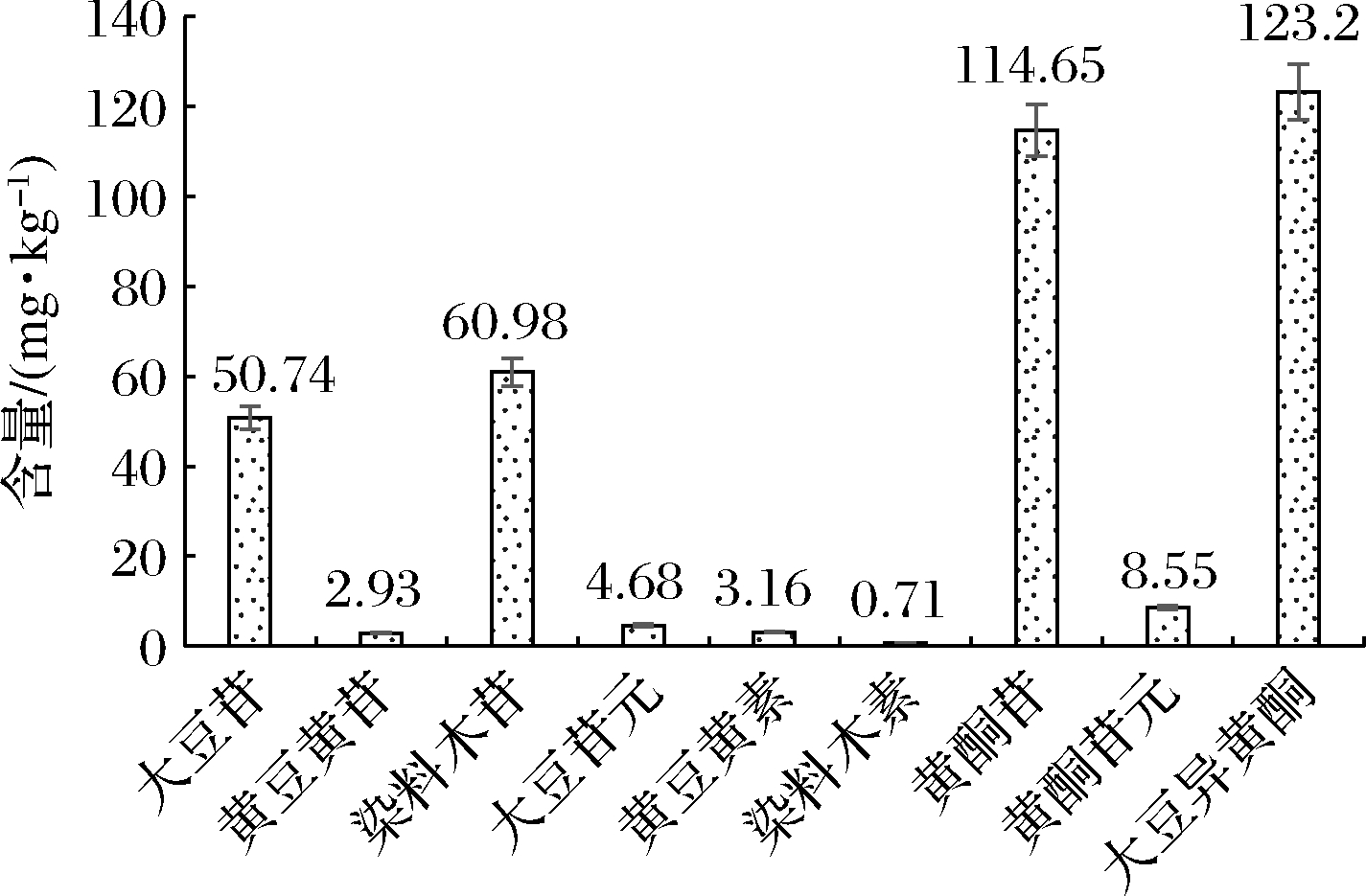
图2 豆清液中大豆异黄酮各组分的含量
Fig.2 Content of soybean isoflavones in soybean whey
由图3可知,大豆苷、黄豆黄苷与染料木苷的变化趋势一致,在胃消化90 min时,大豆苷最高含量达到(40.56±0.07) mg/kg、黄豆黄苷(0.64±0.06) mg/kg、染料木苷(44.00±0.11) mg/kg。在肠道消化30 min时达到最高值,然后呈现递减趋势。黄酮苷主要在模拟胃消化过程中释放,模拟肠消化过程中有少量减少,主要存在以下原因:(1)胃蛋白酶和胰蛋白酶会促使蛋白质羧基的断裂,水解了与多酚氢键或疏水结合的蛋白质,蛋白质水解之后,与蛋白质共价和非共价结合的黄酮可能被释放;(2)胰酶(胰蛋白酶、胰凝乳蛋白酶、胰脂肪酶等)水解了多酚与细胞壁纤维素、半纤维素和木质素等结合的酯键,释放出结合多酚;(3)在振荡与低pH环境中降低粒径,有利于物质的释放;(4)在低pH环境中,降低了分子之间的作用力,结合型黄酮会发生水解,水解过程中增大物质的溶解性,大部分黄酮在离解条件下,容易与氧气结合,发生氧化反应,所以在胃消化过程中,黄酮苷含量降低,肠道中pH值比较高,多酚物质不稳定发生降解[26-28]。图4中,大豆苷元、染料木素、黄豆黄素在肠液中含量高,整体含量比黄酮苷低,图5中,黄酮苷在消化过程中呈递减趋势,黄酮苷元呈现增加趋势。主要是大豆异黄酮中苷元约占异黄酮总量的2%,其余均是结合型大豆异黄酮或者糖苷型黄酮[29]。且苷元的主要形式是由大豆异黄酮苷水解形成。所以黄酮苷元的变化趋势与黄酮苷的变化趋势相反。有机酸在一定程度可以催化黄酮苷的转换,研究报道,乳酸水溶液浓度2.0 mol/L,水解率可达100%、柠檬酸水溶液浓度为1.6 mol/L,水解率达到90%以上[30-31]。
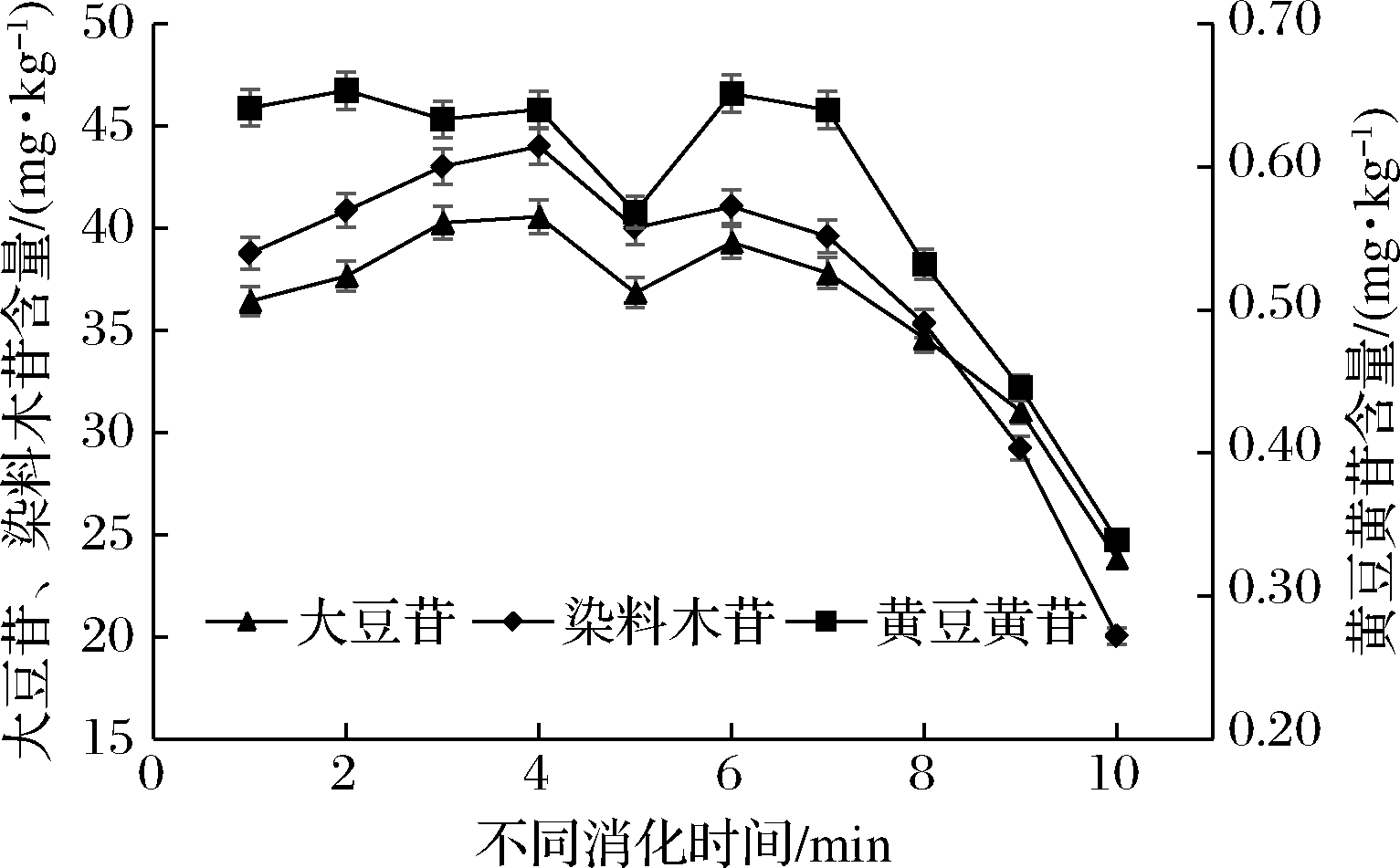
图3 模拟胃、肠消化过程中大豆苷、染料木苷、黄豆黄苷含量变化
Fig.3 Changes of daidzin,genistin and glycitin during simulated gastric and intestinal digestion

图4 模拟胃、肠消化过程中大豆苷元、染料木素、黄豆黄素含量变化
Fig.4 Changes of daidzein,genistein and glycitein during simulated gastric and intestinal digestion

图5 模拟胃、肠消化过程中黄酮苷、黄酮苷元、大豆异黄酮含量变化
Fig.5 Changes of isoflavone glycosides,isoflavone aglycones and soybean isoflavone during simulated gastric and intestinal digestion
2.3.3 相关性
根据表7的豆清饮料品质指标之间的相关性分析表明:不同的抗氧化评价方法中,ABTS阳离子自由基清除能力与·OH清除能力存在显著相关性。ABTS阳离子自由基清除能力与大豆苷、黄豆黄苷、染料木苷、黄酮苷呈极显著负相关关系(r为-0.800、-0.873、-0.832、-0.821),ABTS阳离子自由基清除能力与染料木素、黄酮苷元呈极显著正相关关系(r为0.840、0.790),即ABTS阳离子自由基清除能力越强,黄酮苷元含量越高,黄酮苷型含量越低;ABTS阳离子自由基清除能力法对豆清饮料中的大豆异黄酮的抗氧化活性的评价更合理。大豆苷与黄豆黄苷、染料木苷、黄酮苷、总黄酮呈显著正相关关系(r为0.954、0.993、0.998、0.847),与染料木素、黄酮苷元呈显著负相关关系(r为-0.818、-0.695),黄豆黄苷与染料木苷、黄酮苷呈现显著相关性(r为0.959、0.960),与染料木素、黄酮苷元呈现显著负相关(r为-0.853、-0.773),黄酮苷与染料木素与黄酮苷元呈现显著负相关(r为-0.853、-0.725),染料木素与黄酮苷元呈现显著正相关(r为0.922),综合可以看到,大豆异黄酮苷的变化与其组成的各个物质的变化呈现显著的正相关性,与黄酮苷元呈现显著的负相关性,可以得到黄酮苷元主要是由黄酮苷水解得到。
表7 豆清饮料品质指标之间的相关性分析
Table 7 Analysis of correlation between quality indexes of soybean whey beverage
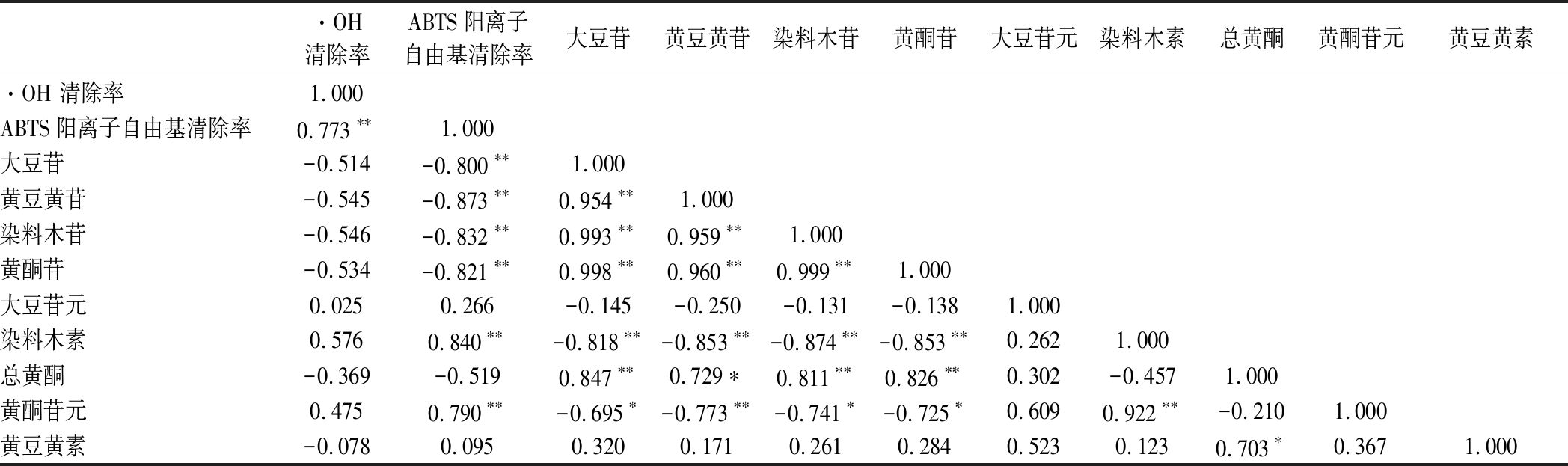
·OH 清除率ABTS阳离子自由基清除率大豆苷黄豆黄苷染料木苷黄酮苷大豆苷元染料木素总黄酮黄酮苷元黄豆黄素·OH 清除率1.000ABTS阳离子自由基清除率0.773∗∗1.000大豆苷-0.514-0.800∗∗1.000黄豆黄苷-0.545-0.873∗∗0.954∗∗1.000染料木苷-0.546-0.832∗∗0.993∗∗0.959∗∗1.000黄酮苷-0.534-0.821∗∗0.998∗∗0.960∗∗0.999∗∗1.000大豆苷元0.0250.266-0.145-0.250-0.131-0.1381.000染料木素0.5760.840∗∗-0.818∗∗-0.853∗∗-0.874∗∗-0.853∗∗0.2621.000总黄酮-0.369-0.5190.847∗∗0.729∗0.811∗∗0.826∗∗0.302-0.4571.000黄酮苷元0.4750.790∗∗-0.695∗-0.773∗∗-0.741∗-0.725∗0.6090.922∗∗-0.2101.000黄豆黄素-0.0780.0950.3200.1710.2610.2840.5230.1230.703∗0.3671.000
注:**差异极显著(P<0.01);*差异显著(P<0.05)
2.3.4 抗氧化
由图6可知,ABTS阳离子自由基清除率在胃消化120 min时,清除率达到最高87.8%,在肠消化过程中,ABTS阳离子自由基清除率达到100%,当ABTS阳离子自由基清除活性超过饱和极限时,其清除活性不会随着活性物质浓度的增加而增加。由图7可以看到,·OH清除率在每个阶段的清除率无显著变化(P>0.05)。由于豆清液中本身存在功能活性物质,ABTS阳离子自由基清除率与·OH清除率均比较高,但是均低于发酵之后的豆清饮料,这与豆清饮料发酵之后生成的活性物质存在密切联系。
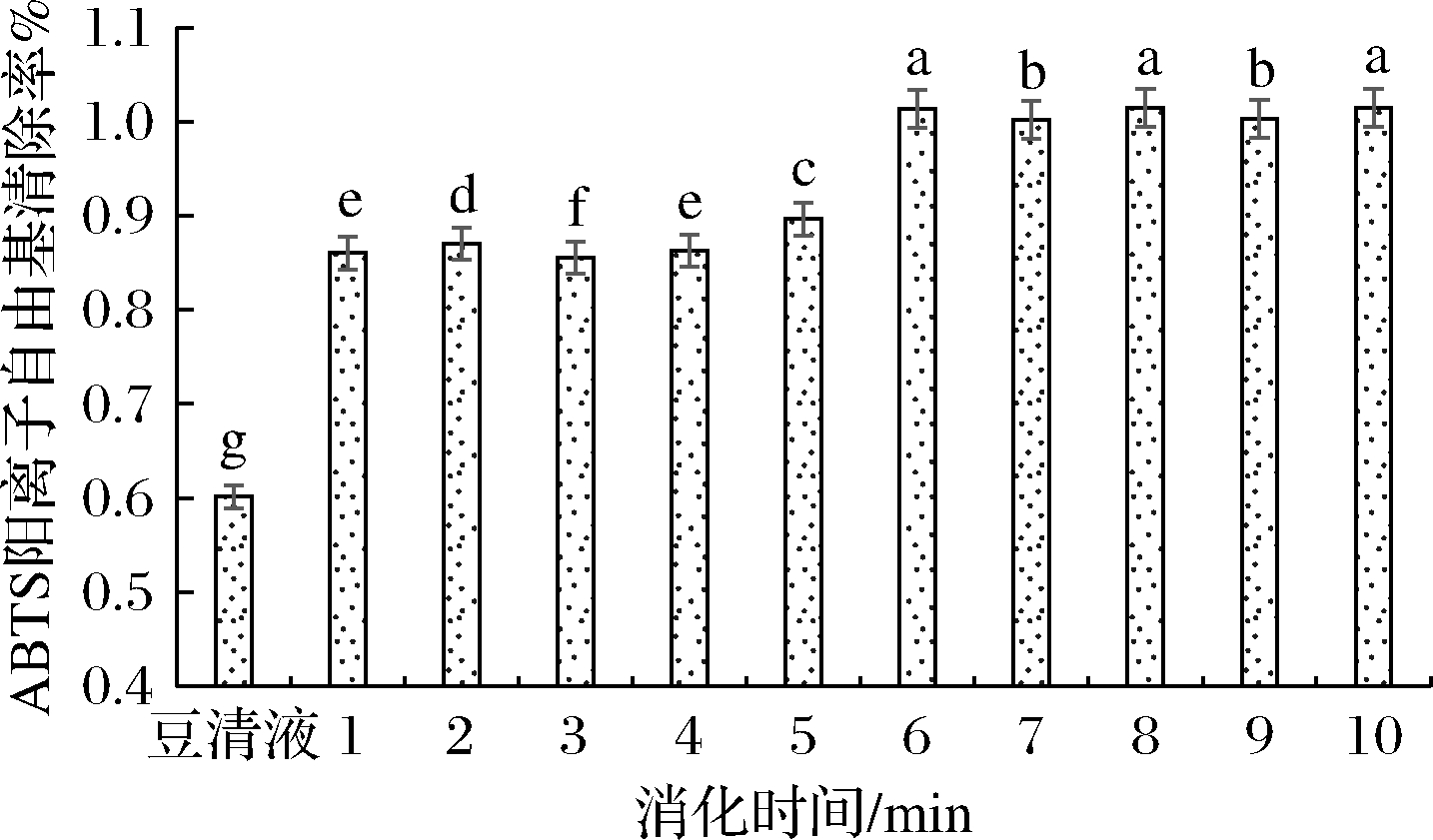
图6 模拟胃、肠消化过程中ABTS阳离子自由基清除率
Fig.6 ABTS+ cation free radical scavenging rate during simulated gastric and intestinal digestion
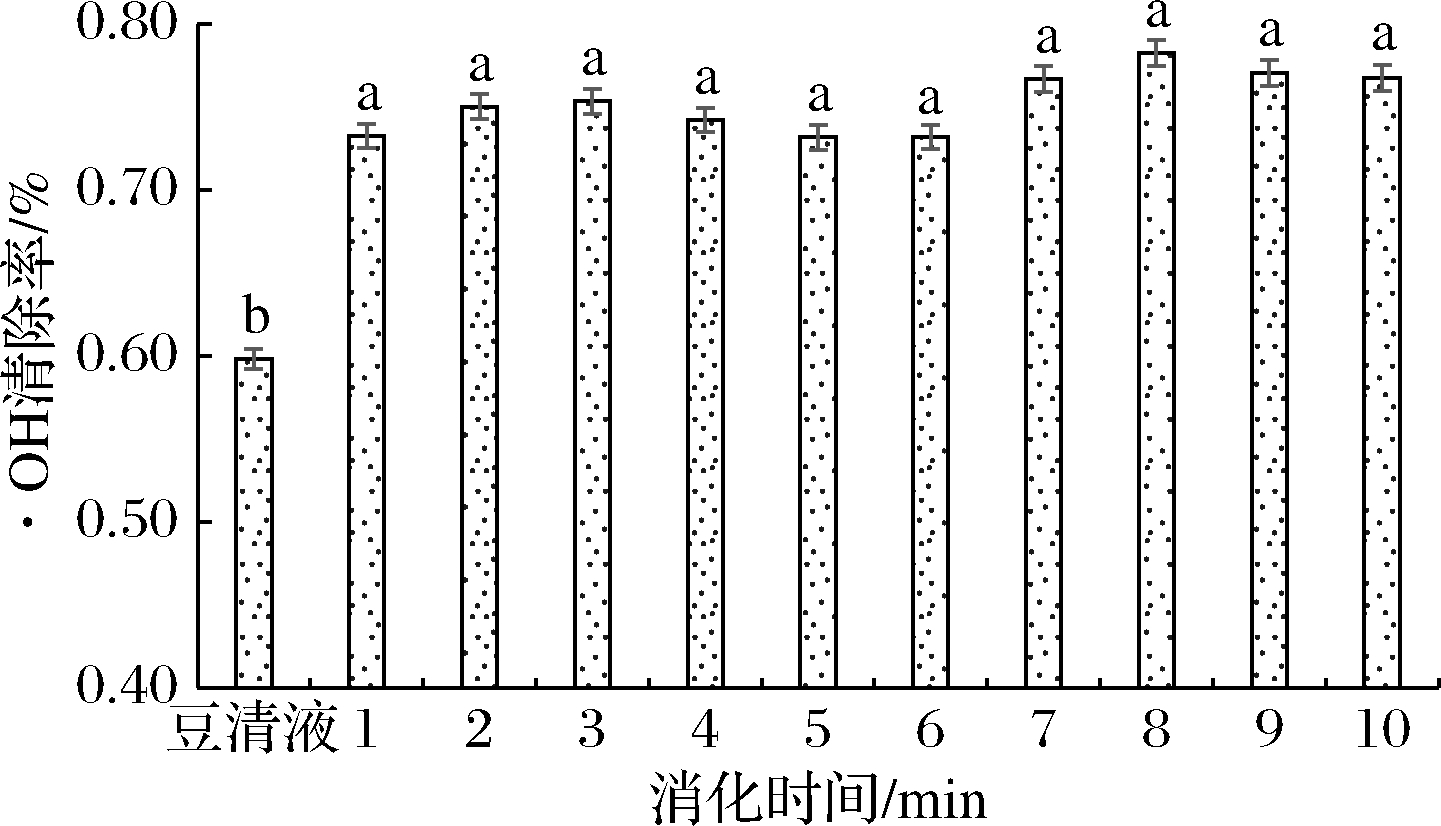
图7 模拟胃、肠消化过程中的·OH清除率
Fig.7 Hydroxy radicals scavenging rate during simulated gastric and intestinal digestion
豆清液进行发酵的抗氧化效应,是由多种具有抗氧化活性的物质通过不同机制协同作用的结果。豆清液中含有多种酚类物质,通过发酵提高了抗氧化活性,可能是在发酵过程中,蛋白质大分子物质进行水解、酚类物质进行降解、大豆异黄酮发酵具体包括以下2个方面:一方面,乳酸菌分泌胞外酶,胞外酶能够将外源大分子蛋白质,水解为具有抗氧化活性的多肽。另一方面,微生物产生β-葡萄糖苷酶,可以将异黄酮糖苷转化为具有更强抗氧化活性的异黄酮苷元,小分子的异黄酮苷元更易被肠道吸收[4]。通过相关性得到ABTS阳离子自由基清除力与异黄酮苷元呈现显著相关性(P<0.05),·OH清除力可能与发酵过程产生的多肽有关。
豆清液中的大豆异黄酮发挥抗氧化作用主要包括3条途径,一是发酵菌株产β-葡萄糖苷酶,可以将异黄酮糖苷转化为异黄酮苷元,增强抗氧化活性;二是大豆异黄酮的酚羟基能和自由基进行结合,清除自由基或抑制自由基链式反应发生[4];三是增加抗氧化酶的活性,如过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶,降低促氧化酶的活性,如还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶,从而起到对机体的抗氧化作用[32]。
3 结论
实验考察了低聚果糖、麦芽汁、酒花、麦芽糖添加量对豆清饮料品质的影响,分析了豆清饮料的各个品质指标之间的相关性并对配方进行优化。结果表明,低聚果糖添加量5%,麦芽汁4%,酒花0.02%,麦芽糖6%,此时综合评分(0.82±0.025)分,豆清饮料酸甜适口,有淡淡的酒香与麦芽香味。模拟消化过程中在胃消化90 min时,大豆苷含量最高达到(40.56±0.07) mg/kg、黄豆黄苷(0.64±0.06) mg/kg、染料木苷(44.00±0.11) mg/kg。在肠消化90 min时,大豆苷元含量最高达到(20.60±0.01) mg/kg、黄豆黄素(7.20±0.09) mg/kg、染料木素(33.06±0.07) mg/kg。大豆异黄酮苷的变化与其组成的各个物质的变化呈现显著的正相关性,与苷元型的黄酮呈现显著的负相关性,可以得到苷元型黄酮主要是由黄酮苷水解得到。有机酸在体外模拟消化过程中无明显变化(P>0.05);豆清饮料清除ABTS阳离子自由基及·OH能力的变化趋势相似,其中肠消化液抗氧化能力比胃消化液强。
[1] 孔彦卓,尹乐斌,雷志明,等.豆清液综合利用研究进展[J].现代农业科技,2017(1):247-249.
KONG Y Z,YIN L B,LEI Z M,et al.Research progress on comprehensive utilization of soybean processing wastewater[J].Modern Agricultural Science and Technology,2017(1):247-249.
[2] 赵冬梅,刘凌,张京健.豆制品生产中高浓度废水的检测与分析[J].食品与发酵工业,2006,32(1):68-71.
ZHAO D M,LIU L,ZHANG J J.Detection and analysis of the concentrated waste water from soybean processes[J].Food and Fermentation Industries,2006,32(1):68-71.
[3] 欧红艳,赵良忠,王容,等.多菌株协同发酵豆清饮料工艺优化[J].食品安全质量检测学报,2020,11(16):5 635-5 640.
OU H Y,ZHAO L Z,WANG R,et al.Optimization of multi-strain co-fermentation process for Douqing beverage[J].Journal of Food Safety & Quality,2020,11(16):5 635-5 640.
[4] 杜欣.发酵黄浆水的抗氧化和抑菌活性研究[D].广州:华南理工大学,2014.
DU X.Studies on antioxidant and bacteriostatic activities of fermented soybean wheys[D].Guangzhou:South China University of Technology,2014.
[5] WEI Q K,CHEN T R,CHEN J T.Using of Lactobacillus and Bifidobacterium to product the isoflavone aglycones in fermented soymilk[J].International Journal of Food Microbiology,2007,117(1):120-124.
[6] PYO Y H,LEE T C,LEE Y C.Effect of lactic acid fermentation on enrichment of antioxidant properties and bioactive isoflavones in soybean[J].Journal of Food Science,2005,70(3):S215-S220.
[7] TU C H,TANG S J,AZI F,et al.Use of kombucha consortium to transform soy whey into a novel functional beverage[J].Journal of Functional Foods,2019,52:81-89.
[8] LIANG L H,WU X Y,ZHAO T,et al.In vitro bioaccessibility and antioxidant activity of anthocyanins from mulberry(Morus atropurpurea Roxb.) following simulated gastro-intestinal digestion[J].Food Research International,2012,46(1):76-82.
[9] RYAN L,PRESCOTT S L.Stability of the antioxidant capacity of twenty-five commercially available fruit juices subjected to an in vitro digestion[J].International Journal of Food Science & Technology,2010,45(6):1 191-1 197.
[10] BOUAYED J,HOFFMANN L,BOHN T.Total phenolics,flavonoids,anthocyanins and antioxidant activity following simulated gastro-intestinal digestion and dialysis of apple varieties:Bioaccessibility and potential uptake[J].Food Chemistry,2011,128(1):14-21.
[11] CHEN Y X,CHANG S K C,ZHANG Y,et al.Gut microbiota and short chain fatty acid composition as affected by legume type and processing methods as assessed by simulated in vitro digestion assays[J].Food Chemistry,2020,312.DOI:10.1016/j.foodchem.2019.126040.
[12] 池春欢,汪云友,陈厚荣.多指标综合评分法优化辣椒热泵-微波联合干燥工艺[J].食品与发酵工业,2018,44(6):172-179.
CHI C H,WANG Y Y,CHEN H R.Optimization of chili heat pump-microwave combined drying process with multi-index comprehensive grading method[J].Food and Fermentation Industries,2018,44(6):172-179.
[13] 田震,肖亚冬,徐亚元,等.香葱叶柄超声热风干燥工艺优化及品质分析[J].核农学报,2020,34(10):2 235-2 243.
TIAN Z,XIAO Y D,XU Y Y,et al.Optimization of ultrasound pretreatment combined hot-air drying process and quality analysis of chive(Allium ascalonicum)petiole[J].Journal of Nuclear Agricultural Sciences,2020,34(10):2 235-2 243.
[14] 刘静敏,史静兰,鲁江,等.体外模拟胃肠消化过程中四种茶叶活性成分及抗氧化性变化规律[J].食品工业科技,2020,41(1):301-306.
LIU J M,SHI J L,LU J,et al.Changes of active constituents and antioxidant properties of four kinds of tea during gastrointestinal digestion in vitro[J].Science and Technology of Food Industry,2020,41(1):301-306.
[15] MINEKUS M,ALMINGER M,ALVITO P,et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function,2014,5(6):1 113-1 124.
[16] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008 食品中总酸的测定[S].北京:中国标准出版社,2009.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,National Standardization Administration of China.GB/T 12456—2008 Determination of total acid in food[S].Beijing:Standards Press of China,2009.
[17] 石磊,田祖光.不同提取方法对苦菜浸提液可溶性固形物含量的影响[J].食品工业,2018,39(5):66-70.
SHI L,TIAN Z G.The effect of soluble components from Lxeris chinensis with different extractions[J].The Food Industry,2018,39(5):66-70.
[18] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
ZHAO K,XU P J,GU G Y.Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method[J].Food Science,2008,29(8):534-536.
[19] ZHOU Y,HE W Z,ZHENG W L,et al.Fruit sugar and organic acid were significantly related to fruit Mg of six Citrus cultivars[J].Food Chemistry,2018,259:278-285.
[20] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23788—2009 保健食品中大豆异黄酮的测定方法 高效液相色谱法[S].北京:中国标准出版社,2009.
General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,National Standardization Administration of China.GB/T 23788—2009 Determination of soy isoflavones in health-care food High performance liquid chromatography[S].Beijing:Standards Press of China,2009.
[21] 王容,赵良忠,李明,等.米酸汤在发酵过程中品质变化及发酵动力学研究[J].食品与发酵工业,2020,46(1):82-90.
WANG R,ZHAO L Z,LI M,et al.Study on the quality change and fermentation kinetics of rice sour soup during fermentation[J].Food and Fermentation Industries,2020,46(1):82-90.
[22] XIAO Y,WANG L X,RUI X,et al.Enhancement of the antioxidant capacity of soy whey by fermentation with Lactobacillus plantarum B1-6[J].Journal of Functional Foods,2015,12:33-44.
[23] 易鑫,谈安群,欧阳祝,等.植物乳杆菌混菌发酵对梁平柚果酒理化性质及风味影响[J].食品与发酵工业,2021,47(11):180-187.
YI X,TAN A Q,OUYANG Z,et al.Effects of Lactobacillus plantarum mixed fermentation on the physicochemical properties and flavor ofLiangping pomelo wine[J].Food and Fermentation Industries,2021,47(11):180-187.
[24] SERRE E,BOUTIN Y,LANGEVIN M E,et al.Deacidification of cranberry juice protects against disruption of in vitro intestinal cell barrier integrity[J].Journal of Functional Foods,2016,26:208-216.
[25] 封易成,牟德华.体外模拟胃肠消化过程中山楂的活性成分及抗氧化性规律[J].食品科学,2018,39(7):139-145.
FENG Y C,MOU D H.Changes in active components and antioxidant activity of hawthorn during simulated gastrointestinal digestion in vitro[J].Food Science,2018,39(7):139-145.
[26] 从彦丽,彭梦雪,刘冬,等.柑橘在体外模拟胃肠消化过程中总多酚、总黄酮及总抗氧化活性的变化规律[J].食品科学,2016,37(17):96-103.
CONG Y L,PENG M X,LIU D,et al.Changes in total polyphenols,total flavonoids and antioxidant activity of Citrus during in vitro gastrointestinal digestion process[J].Food Science,2016,37(17):96-103.
[27] 倪香艳,钟葵,佟立涛,等.糙米体外消化过程中酚类物质含量及抗氧化活性[J].食品科学,2018,39(16):105-111.
NI X Y,ZHONG K,TONG L T,et al.Changes in polyphenols content and antioxidant activity during in vitro digestion of brown rice[J].Food Science,2018,39(16):105-111.
[28] 刘冬,万红霞,赵旭,等.小麦不同部位在体外模拟消化过程中抗氧化活性的变化规律[J].现代食品科技,2016,32(4):94-99;113.
LIU D,WAN H X,ZHAO X,et al.Changes in antioxidant activity in different parts of wheat during in vitro simulated digestion[J].Modern Food Science and Technology,2016,32(4):94-99;113.
[29] FARAJ A,VASANTHAN T.Soybean isoflavones:Effects of processing and health benefits[J].Food Reviews International,2004,20(1):51-75.
[30] 谭乃迪,于丽颖,张鹏.乳酸催化大豆异黄酮糖苷水解的工艺研究[J].食品工业,2016,37(3):21-23.
TAN N D,YU L Y,ZHANG P.Synthetic research of soybean isoflavone glycoside hydrolyzed into isoflavone aglucon by lactic acid catalysis[J].The Food Industry,2016,37(3):21-23.
[31] 于丽颖,成乐琴.柠檬酸催化大豆异黄酮糖苷水解苷元的工艺研究[J].江苏农业科学,2014,42(11):294-296.
YU L Y,CHENG L Q.Catalytic hydrolysis of aglycones by citric acid with soybean isoflavone glycosides[J].Jiangsu Agricultural Sciences,2014,42(11):294-296.
[32] KAMPKÖTTER A,CHOVOLOU Y,KULAWIK A,et al.Isoflavone daidzein possesses no antioxidant activities in cell-free assays but induces the antioxidant enzyme catalase[J].Nutrition Research,2008,28(9):620-628.