高尿酸血症是由于体内嘌呤代谢紊乱而导致的一种代谢性疾病。当体内肝脏产生尿酸的量超出肾脏的排泄能力时,就会导致血清尿酸水平升高,从而引起高尿酸血症[1]。当血清尿酸水平过饱和时,尿酸盐容易在关节、软骨和肾脏等组织中沉积,形成尿酸盐结晶,最终导致痛风的产生[2]。此外,高尿酸血症也与高脂血、高血压、二型糖尿病和心血管疾病等疾病的发生有着密切的关系[3]。据不完全统计,我国高尿酸血症的患病率约为13%,其中男性为18.5%,明显高于女性,且沿海和经济发达地区高尿酸血症患病率高达20%以上,已达到或接近欧美发达国家水平[4]。目前临床上主要使用别嘌呤醇、非布斯坦等药物进行有效的治疗,然而这些药物会产生严重的副作用,如头痛发热、过敏反应、高血压、慢性肾炎、心血管疾病、关节及肌肉骨骼功能障碍等,且治疗费用较高[5]。因此开发出具有较少的不良反应和更加经济的新型降尿酸药物是目前亟待解决的问题。目前,多酚、黄酮、皂苷类等天然提取物,蛋白酶解物及多肽,益生菌等已被证明具有降尿酸活性[6]。与其他生物活性物质相比,多肽往往表现出较高的活性、稳定性和特异性,且容易吸收,可以进行批量生产且成本较低[7]。食源性生物活性肽来源广泛且安全性高,从食物蛋白源中开发降尿酸活性肽,在预防与治疗高尿酸血症及痛风方面具有较高的研究价值和广阔的应用前景[8]。黄嘌呤氧化酶(xanthine oxidase,XOD)是嘌呤代谢中的关键酶,催化黄嘌呤或次黄嘌呤氧化生成尿酸[9],因此,XOD活性过高会加快尿酸的生成,造成高尿酸血症。此外,在XOD的再氧化过程中,还会产生内源性活性氧,包括超氧自由基和过氧化氢,会对组织造成氧化损伤[10],对机体造成进一步的损害。因此,抑制XOD活性可以阻止生物体从嘌呤到尿酸的生物合成,从而有效降低血清尿酸含量以及血管氧化应激反应[11]。
卵形鲳鲹(Trachinotus ovatus)又称金鲳鱼,为暖水性中上层洄游鱼类,广泛分布于我国南海、日本沿海、地中海、印度洋等热带亚热带海域,在我国广东、海南已进行大规模的人工养殖[12]。2016年,我国卵形鲳鲹年养殖产量达12万t以上[13]。卵形鲳鲹富含蛋白质、脂肪、脂肪酸、氨基酸等多种营养成分,且必需氨基酸及不饱和脂肪酸比例较高[14],具极佳的保健及综合利用开发价值。目前,鲣鱼[15]、秋刀鱼[16]、鲨鱼软骨[17]、海参[18]等海产品中已经提取出具有XOD抑制活性的多肽,本文对卵形鲳鲹XOD抑制肽的制备进行了研究,并对其肽分子质量分布及氨基酸组成进行了分析,以期为卵形鲳鲹降尿酸活性产品的研发提供指导。
1 材料与方法
1.1 材料与试剂
卵形鲳鲹(选择体长为20 cm左右,质量为500 g左右,产地为湛江的个体),广州华润万家超市,取鱼肉,洗净后放入绞肉机中绞成肉糜,置于聚乙烯袋中于-20 ℃冻藏备用。
中性蛋白酶(≥100 U/mg)、木瓜蛋白酶(≥1 500 U/mg)、复合蛋白酶(≥90 U/mg)、碱性蛋白酶(≥200 U/mg)、胰酶(≥4 000 U/g),合肥博美生物科技有限公司;黄嘌呤、黄嘌呤氧化酶,美国Sigma公司;三氟乙酸,上海阿拉丁生化科技股份有限公司;乙腈、甲醇,美国BCR;氢氧化钠、盐酸、硫酸、硫酸铜、硫酸钾,广州化学试剂厂;磷酸氢二钠、磷酸二氢钠,上海源叶生物科技有限公司;甲醛,广东广试试剂科技有限公司。
1.2 仪器与设备
GB204电子天平,瑞士梅特勒-托利多公司;3K30台式高速冷冻离心机,德国Sigma公司;KjeltecTM 2300蛋白自动分析仪,丹麦福斯分析仪器公司;THZ-82水浴恒温振荡器,金坛市精达仪器制造厂;809 Titrando自动电位滴定仪,瑞士万通公司;Sunrise-basic Tacan SUNRISE吸光酶标仪,瑞士TECAN公司;Alpha1-4真空冷冻干燥机,德国Christ公司;N-EVAP24氮吹仪,美国ORGANOMATION公司;Agilent 1100液相色谱仪,美国安捷伦科技公司;LC-20AD高效液相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 卵形鲳鲹XOD抑制肽的制备
取一定质量的卵形鲳鲹鱼糜于锥形瓶中,按1∶3(g∶mL)的料液比加入去离子水,混合均匀后调节至所需pH,加入一定比例的酶(以鱼糜质量计),在不同实验条件下酶解。酶解结束后,沸水浴灭酶15 min,冷却,于4 ℃、6 793 r/min条件下离心20 min,收集上清液,冷冻干燥后得到卵形鲳鲹XOD抑制肽,于-20 ℃保存备用。
1.3.2 蛋白酶的筛选
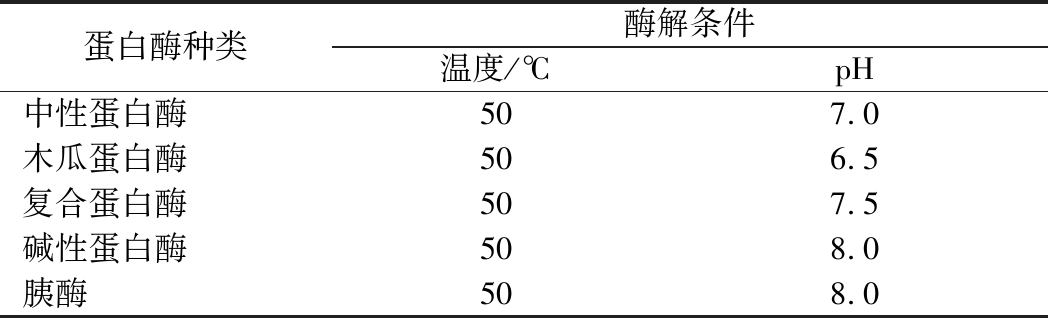
取10 g鱼糜加入30 mL去离子水,选用中性蛋白酶、木瓜蛋白酶、碱性蛋白酶、复合蛋白酶、胰酶在各自最适pH和温度下酶解6 h,加酶量为0.3%。以水解度和XOD抑制活性为指标筛选出最佳蛋白酶。不同酶的最佳酶解温度和pH如表1所示。
表1 不同蛋白酶的酶解条件
Table 1 Hydrolysis conditions of different proteases
蛋白酶种类酶解条件温度/℃pH中性蛋白酶507.0木瓜蛋白酶506.5复合蛋白酶507.5碱性蛋白酶508.0胰酶508.0
1.3.3 单因素试验
按1.3.1方法进行酶解、制备,以水解度(degree of hydrolysis,DH)和XOD抑制活性为指标,分别考察中性蛋白酶的酶解时间(1、2、4、6、8 h)、酶解温度(40、45、50、55、60 ℃)、酶解pH(6.0、6.5、7.0、7.5、8.0)、加酶量(质量分数0.1%、0.2%、0.3%、0.4%、0.5%)以及料液比(g∶mL)(1∶1、1∶2、1∶3、1∶4、1∶5)5个因素对2个指标的影响。
1.3.4 响应面法优化实验
根据单因素试验结果,选取酶解时间(A)、加酶量(B)以及酶解温度(C)为响应因素,以水解度和XOD抑制活性为响应值,根据Box-Behnken原理设计3因素3水平实验,优化XOD抑制肽的最佳制备工艺。实验因素及水平设计见表2。
表2 响应面实验因素和水平
Table 2 Factors and levels in response surface design

水平因素酶解时间(A)/h加酶量(B)/%酶解温度(C)/℃-120.150040.255160.360
1.3.5 水解度测定
采用甲醛电位滴定法测定酶解后上清液中氨基酸态氮质量,采用凯氏定氮法(参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》)测定原料中总氮质量,水解度按公式(1)计算。
(1)
1.3.6 XOD抑制活性测定
于96孔酶标板中依次加入50 μL待测样品溶液(20 g/L),50 μL黄嘌呤氧化酶溶液(0.05 U/mL),混匀,37 ℃孵育30 min,加入150 μL黄嘌呤溶液(0.40 mmol/L)启动反应,记录6 min内反应体系在290 nm处吸光值的动力学变化,以pH 7.4磷酸缓冲盐溶液(phosphate buffer solution,PBS)做空白对照。XOD抑制活性按公式(2)计算。
XOD抑制率![]()
(2)
式中:dA,吸光度;dt,时间;(dA/dt)空白,未加抑制剂的反应速率;(dA/dt)样品,加抑制剂的反应速率。
1.3.7 肽分子质量分布测定
将冻干粉稀释至2 g/L,采用高效体积排阻色谱法(high performance size exclusion chromatography,HPSEC)测定肽分子质量分布。检测条件:色谱柱为TSK-GELG2000SWXL(7.8 mm×300 mm);流动相A是含体积分数0.1%三氟乙酸的乙腈溶液,流动相B是超纯水配制的体积分数为0.1%三氟乙酸溶液,洗脱比例为V(A)∶V(B)=20∶80;进样体积10 μL;流速0.5 mL/min;检测波长214 nm。将标准品细胞色素C(12 400 Da)、杆菌肽(6 511.83 Da)、抑肽酶(1 422.69 Da)、氧化型谷胱甘肽(612.63 Da)、还原型谷胱甘肽(307.3 Da)用流动相配制成质量浓度为2 g/L的混合液,过0.22 μm微孔滤膜后按上述方法进行分析,根据标准品出峰时间分析样品的分子质量分布。
1.3.8 氨基酸组成测定
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》酸水解法测定17种基本氨基酸;参考GB/T 18246—2019《饲料中氨基酸的测定》碱水解法测定色氨酸。
1.4 数据分析
采用Origin 2019软件绘图,实验数据利用Excel 2019和SPSS Statistics 22.0进行统计分析,以单因素ANOVA法及Duncan多重比较分析组间差异性,P<0.05表示有显著性差异。
2 结果与分析
2.1 蛋白酶筛选结果
用5种不同蛋白酶酶解得到的XOD抑制肽其水解度和XOD抑制活性如表3所示。由于酶的专一性,不同蛋白酶具有不同的酶切位点和酶解产物,因此酶解效果和产物活性具有明显差异[19]。从水解度来看,复合蛋白酶的水解程度最好,胰蛋白酶次之,其余3种酶的水解程度相对较低,这可能与卵形鲳鲹蛋白中氨基酸组成及排列方式有关。然而这2种酶解产物的XOD抑制活性低,中性蛋白酶酶解产物虽水解度较低,但具有最高的抑制率,达到61.94%,显著高于其他酶解产物。因此,综合考虑选取中性蛋白酶为本研究最佳用酶进行一下步实验优化。
表3 不同蛋白酶对水解度和XOD抑制活性的影响
Table 3 Effect of different proteases on degree of hydrolysis and XOD inhibition activity

蛋白酶水解度/%XOD抑制活性/%中性蛋白酶13.67±0.15b61.94±1.5d木瓜蛋白酶14.02±0.060c52.56±0.37c复合蛋白酶17.09±0.047e44.44±0.44b碱性蛋白酶12.68±0.10a45.81±0.90b胰酶16.21±0.058d33.12±0.17a
注:不同字母代表样品间的显著性差异(P<0.05)
2.2 单因素试验结果
2.2.1 酶解时间对水解度和XOD抑制活性的影响
如图1-a所示,水解度随酶解时间的延长而增加,4 h后增加趋势有所减缓。这主要是随着反应的进行,酶的作用位点逐渐减少,底物浓度降低,因而水解度的增幅程度有所减缓[20]。由于中性蛋白酶作用于底物的水解程度较低,在酶解的8 h内并未到达反应终点。各时间段的XOD抑制活性差异不大,4 h酶解产物的XOD抑制活性最高,达到62.02%,显著高于2 h(P<0.05),但与6 h的XOD抑制活性无显著差异。综合时间及经济成本考虑,选择4 h为最佳酶解时间。
2.2.2 酶解温度对水解度和XOD抑制活性的影响
如图1-b所示,随着酶解温度的升高,水解度呈现先上升后下降的趋势,在其最适温度50 ℃时达到最大。水解度反映着酶催化生成肽链的能力,当酶解温度超过酶促反应最适温度时,酶本身蛋白质结构的分子热能增加,多重弱非共价键相互作用破裂的机会增加,导致酶变性,从而使酶活性降低[21]。50 ℃时酶解产物的水解程度达到最高,而XOD抑制活性却低于55 ℃,这可能是由于较高的水解程度破坏某些氨基酸残基,因而降低了其活性。因此选择55 ℃为最佳酶解温度。
2.2.3 酶解pH对水解度和XOD抑制活性的影响
中性蛋白酶的最适pH介于6.0~7.5,如图1-c所示,当pH为6.5~7.5时,pH 7.0组与pH 6.5组、pH 7.0组和 pH 7.5组的XOD抑制活性都没有显著性差异。因此在pH 6.5~7.5对酶解效果影响不大,考虑到工业生产的实际应用,确定酶解的最佳pH为7.0。
2.2.4 加酶量对水解度和XOD抑制活性的影响
如图1-d所示,随着加酶量的增加,底物与酶的接触几率增大,水解程度和酶解产物也随之增加。当加酶量为0.2%时XOD抑制活性最高,与其他组分具有显著性差异(P<0.05),因此选择0.2%为最佳加酶量。
2.2.5 料液比对水解度和XOD抑制活性的影响
如图1-e所示,随着料液比的增加,水解程度逐渐增加,当料液比为1∶3(g∶mL)时逐渐趋于平缓。底物浓度高可增加酶与底物的接触面积,从而促进反应的进行,然而当底物浓度过高时,反应体系过于黏稠,影响了蛋白酶的分散性和活性物质的释放,因而减弱了酶解效果[22]。当料液比达到1∶2(g∶mL)后,各组间的XOD抑制活性没有显著差异,说明料液比对其影响不大,综合考虑选择最佳料液比为1∶3(g∶mL)。
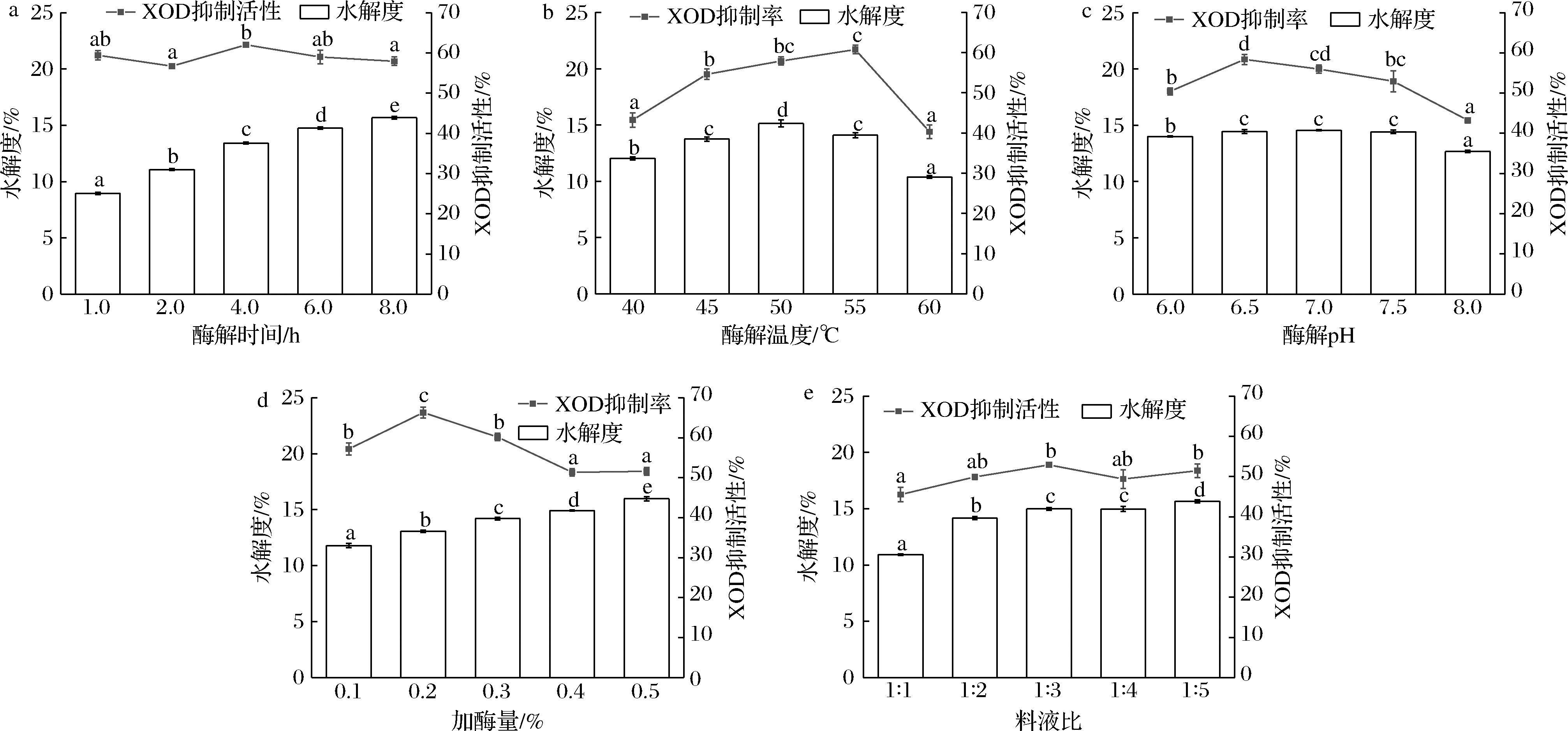
图1 时间、温度、pH、加酶量、料液比对水解度和XOD抑制活性的影响
Fig.1 Effects of enzymatic hydrolysis time,temperature,pH,enzyme dosage,and liquid-material ratio on the degree of hydrolysis and XOD inhibition activity
注:图中的不同字母表示在P<0.05范围内存在显著性差异
2.3 响应面试验分析
2.3.1 实验设计及结果
由单因素试验结果发现,pH和料液比对酶解效果的影响不明显,因而本研究选择酶解时间(A)、加酶量(B)、酶解温度(C)3个条件进一步优化,固定酶解pH为7.0,料液比为1∶3(g∶mL)。实验设计及水解度和XOD抑制活性结果见表4。以XOD抑制活性为主要指标,水解度为辅助指标,当酶解时间为4h,加酶量为0.2%,酶解温度为55℃时结果最佳。
表4 响应面实验设计及结果
Table 4 Experimental design and results for response surface methodology
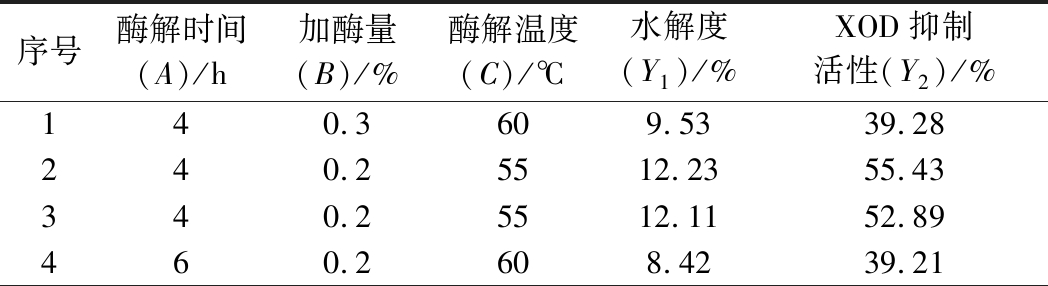
序号酶解时间(A)/h加酶量(B)/%酶解温度(C)/℃水解度(Y1)/%XOD抑制活性(Y2)/%140.3609.5339.28240.25512.2355.43340.25512.1152.89460.2608.4239.21
续表4
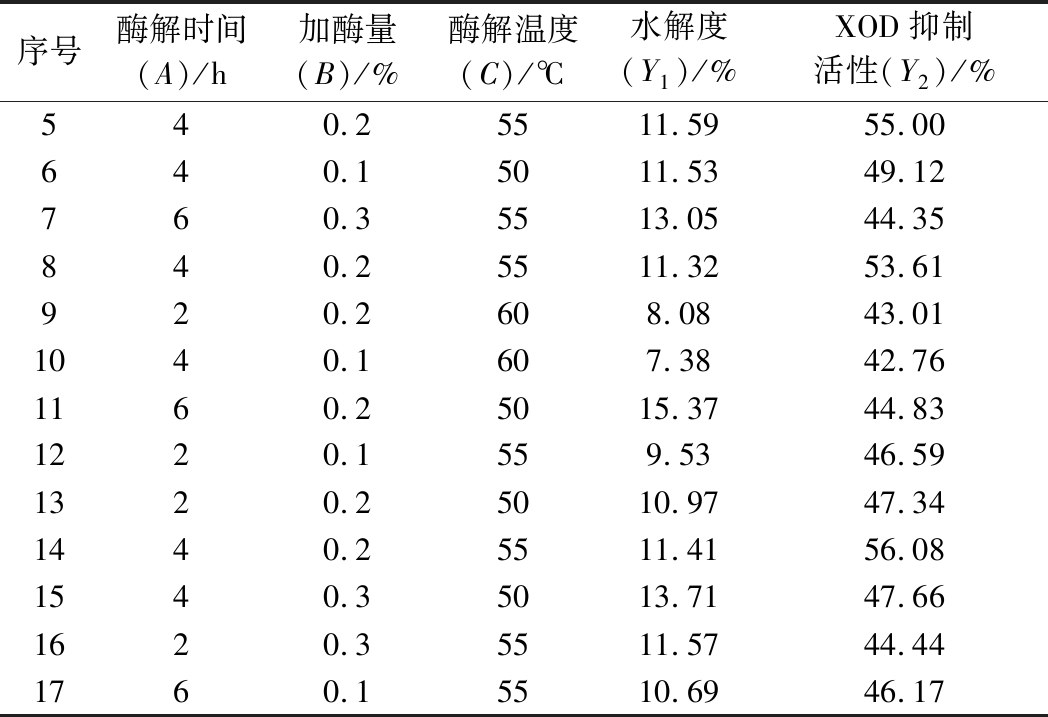
序号酶解时间(A)/h加酶量(B)/%酶解温度(C)/℃水解度(Y1)/%XOD抑制活性(Y2)/%540.25511.5955.00640.15011.5349.12760.35513.0544.35840.25511.3253.61920.2608.0843.011040.1607.3842.761160.25015.3744.831220.1559.5346.591320.25010.9747.341440.25511.4156.081540.35013.7147.661620.35511.5744.441760.15510.6946.17
2.3.2 响应面优化模型的建立及方差分析
利用Design-Expert 10软件对表4中的结果进行多元回归拟合,得到水解度和XOD抑制活性对于酶解时间(A)、加酶量(B)、酶解温度(C)的二次回归方程:Y1=11.73+0.92A+1.09B-2.27C+0.082AB-1.02AC-(6.963E+003)BC-0.17A2-0.35B2-0.85C2,R2=0.977 2;Y2=54.60-0.85A-1.11B-3.09C+0.081AB-0.32AC-0.50BC-5.16A2-4.05B2-5.84C2,R2=0.969 9。对拟合的回归模型方程进行方差分析及显著性检验,结果见表5。研究发现,各因素对水解度和XOD抑制活性影响的强弱顺序为温度>加酶量>时间,A、B、C、AC、C2对水解度的影响为极显著(P<0.01);C、A2、B2、C2对XOD抑制活性的影响为极显著(P<0.001)。结果表明回归模型与实验结果的拟合度较好,模型构建合理,可用于蛋白水解度和酶解产物XOD抑制活性的分析和预测。
表5 回归模型方差分析
Table 5 Variance analysis of the regression model
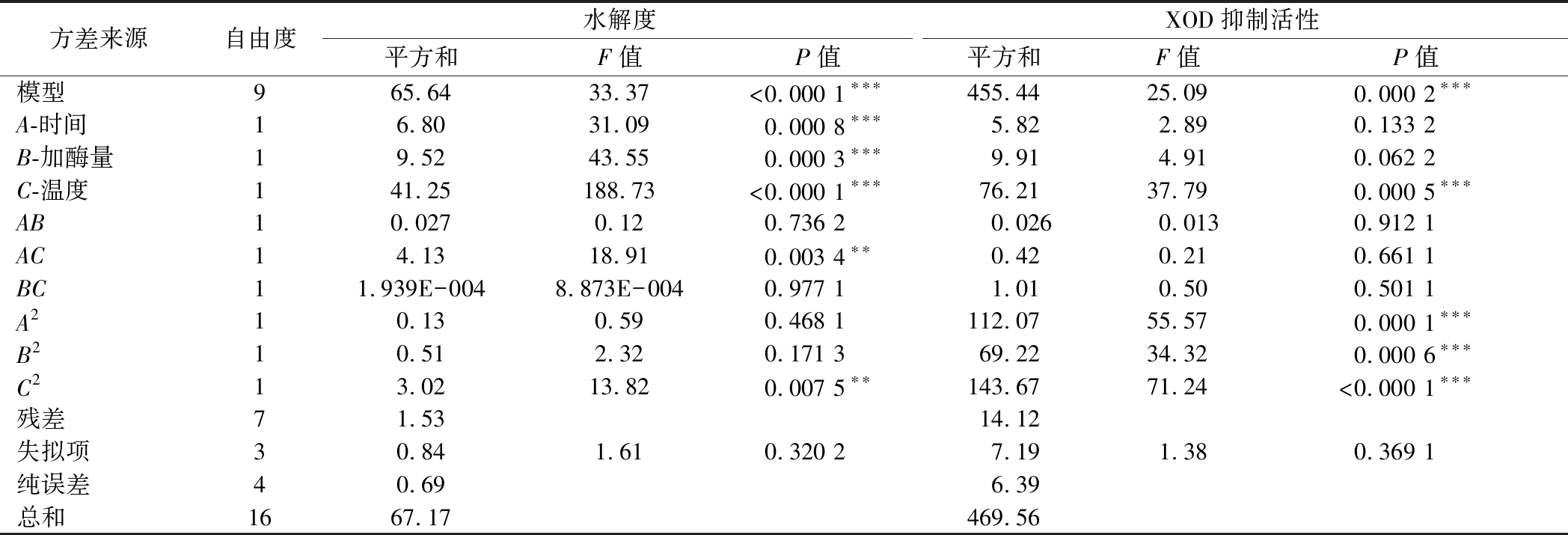
方差来源自由度水解度XOD抑制活性平方和F值P值平方和F值P值模型965.6433.37<0.000 1∗∗∗455.4425.090.000 2∗∗∗A-时间16.8031.090.000 8∗∗∗5.822.890.133 2B-加酶量19.5243.550.000 3∗∗∗9.914.910.062 2C-温度141.25188.73<0.000 1∗∗∗76.2137.790.000 5∗∗∗AB10.0270.120.736 20.0260.0130.912 1AC14.1318.910.003 4∗∗0.420.210.661 1BC11.939E-0048.873E-0040.977 11.010.500.501 1A210.130.590.468 1112.0755.570.000 1∗∗∗B210.512.320.171 369.2234.320.000 6∗∗∗C213.0213.820.007 5∗∗143.6771.24<0.000 1∗∗∗残差71.5314.12失拟项30.841.610.320 27.191.380.369 1纯误差40.696.39总和1667.17469.56
注:***,P<0.001;**,P<0.01
2.3.3 响应面交互作用分析
曲面图中曲线的陡峭程度了反映各个因素对响应值影响的大小,曲线越陡,影响越大;响应图中等高线的形状反映了2因素间交互作用的显著性,形状越陡,说明交互作用越显著[23]。由图2可知,在各因素中,温度对水解度的影响最为显著,加酶量和时间对水解度的影响相对较小。酶解时间、加酶量和酶解温度的两两交互作用不显著。由图3可知,加酶量与酶解时间和酶解温度的交互作用均显著,酶解时间和温度2因素间的交互作用对XOD抑制活性的影响相对次之。

a-加酶量和时间交互作用;b-温度和时间交互作用;c-温度和加酶量交互作用
图2 各因素相互作用对水解度影响的响应面及等高线图
Fig.2 Response surface and contour lines of interaction of factors on the degree of hydrolysis

a-加酶量和时间交互作用;b-温度和时间交互作用;c-温度和加酶量交互作用
图3 各因素相互作用对XOD抑制活性影响的响应面及等高线图
Fig.3 Response surface and contour lines of interaction of factors on XOD inhibition activity
2.3.4 响应面模型优化及验证
综合响应面优化结果及现实因素,确定卵形鲳鲹鱼糜最佳酶解工艺如下,酶解时间3.85 h,加酶量0.19%,酶解温度54 ℃。对应的的水解度及XOD抑制活性的预测值分别为12.03%和55.10%。为了验证模型预测的准确性,用此优化条件重复试验3次,实际得到的水解度和XOD抑制活性值分别为11.82%和52.41%。由此可见,该回归模型可以较好地预测卵形鲳鲹蛋白的酶解情况。
2.4 肽分子质量分布分析
大量研究表明,小分子质量的多肽具有更高的XOD抑制活性。HE等[24]通过乙醇分级将鲣鱼酶解冻干产物TPH分为2组,发现醇溶性组分富含分子质量<1 000 Da的肽段且XOD抑制活性显著高于其余2个组分。LI等[15]用尺寸排阻凝胶色谱对鲣鱼酶解物的分离组分进一步纯化,发现分子质量<1 000 Da的肽段组分其XOD抑制活性显著高于其他组分。MUROTA等[25]研究发现,醇溶性组分的鲨鱼软骨蛋白酶解物的肽分子质量分布于300~7 000 Da,经体内外实验验证,该组分可提高大鼠血清XOD抑制活性,但其本身在较高浓度下也没有体外XOD抑制活性,这说明乙醇溶性组分中的肽段在消化、吸收和代谢过程中可能转化为具有XOD抑制活性的小肽段。卵形鲳鲹酶解产物肽分子质量分布如图4所示,分子质量<1 000 Da的肽段高达53.57%,显著高于其他组分;其次为分子质量1 000~3 000 Da的肽段,占比为40.35%;分子质量<3 000 Da的肽段占据总量的93.92%。肽分子质量分布结果表明,卵形鲳鲹酶解物的XOD抑制活性可能主要来源于分子质量<3 000 Da的肽段。

图4 卵形鲳鲹酶解产物HPLC色谱图以及分子质量分布图
Fig.4 HPLC chromatogram of hydrolysates of Trachitus ovatus and its molecular weight distribution
2.5 氨基酸组成分析
已有研究证实,蛋白质或多肽的氨基酸的组成决定了其生物活性[26]。XOD活性位点附近氨基酸残基能形成疏水空腔,某些氨基酸能进入疏水空腔,与XOD中的氨基酸残基间以疏水相互作用、氢键、静电相互作用、范德华力等作用力发生竞争性或非竞争性结合,从而改变其空间结构,进而抑制XOD活性,达到减少尿酸生成的效果[8]。该疏水空腔是XOD抑制剂发挥抑制作用的重要区域,疏水性较强的肽段可能更易通过疏水相互作用进入此区域,从而影响钼碟呤中心的催化活性。由表6可知,卵形鲳鲹原料中总疏水氨基酸占氨基酸总量的30.68%,酶解后的产物其总疏水氨基酸占比提高至36.95%,其中含量较高的为亮氨酸和苯丙氨酸,其次为缬氨酸和异亮氨酸,这可能与XOD抑制活性有关。李宇娟等[27]的研究也表明,富含疏水氨基酸肽段组分的XOD抑制活性显著高于其他组分,本研究结果与其具有相似性,都说明了疏水氨基酸可能在多肽的XOD抑制活性中发挥着重要的作用。
表6 卵形鲳鲹鱼肉及酶解物的氨基酸组成 单位:%
Table 6 Amino acid compositions of T.ovatus and its hydrolysates
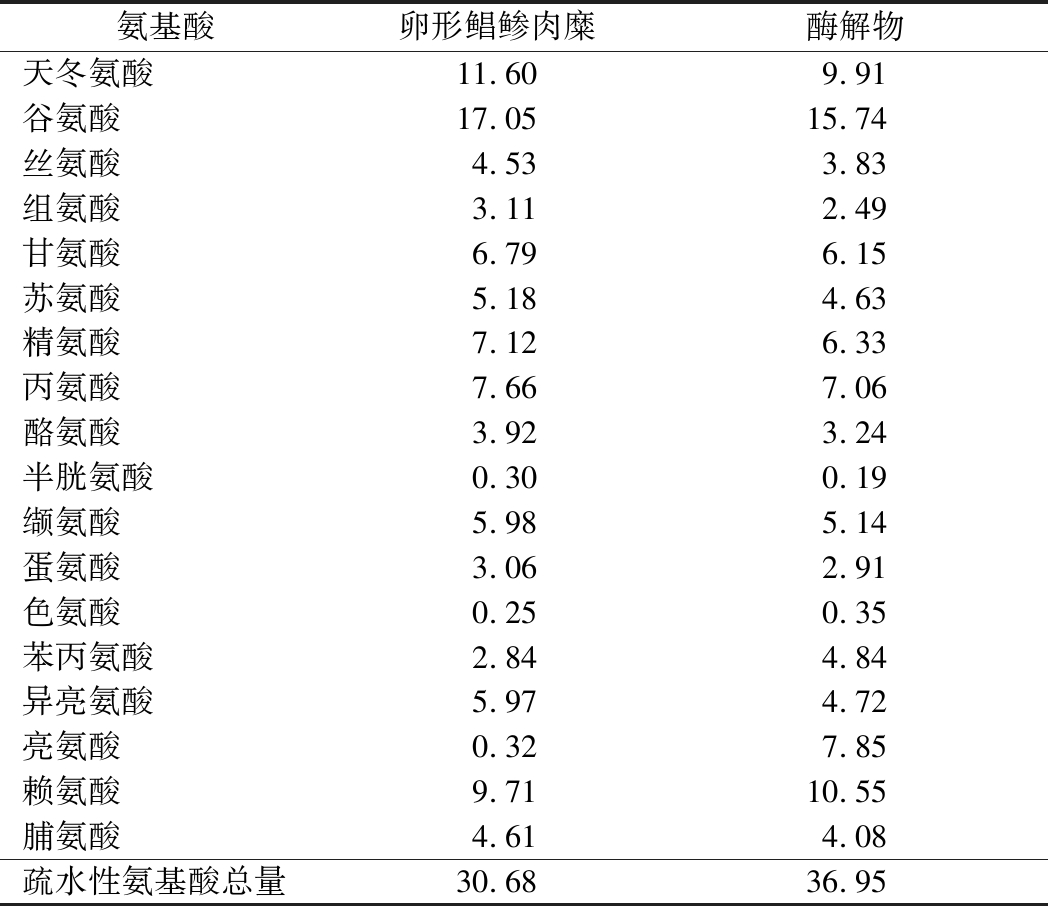
氨基酸卵形鲳鲹肉糜酶解物天冬氨酸11.609.91谷氨酸17.0515.74丝氨酸4.533.83组氨酸3.112.49甘氨酸6.796.15苏氨酸5.184.63精氨酸7.126.33丙氨酸7.667.06酪氨酸3.923.24半胱氨酸0.300.19缬氨酸5.985.14蛋氨酸3.062.91色氨酸0.250.35苯丙氨酸2.844.84异亮氨酸5.974.72亮氨酸0.327.85赖氨酸9.7110.55脯氨酸4.614.08疏水性氨基酸总量30.6836.95
注:疏水氨基酸包括:丙氨酸、缬氨酸、蛋氨酸、色氨酸、苯丙氨酸、异亮氨酸、亮氨酸、脯氨酸
3 结论与讨论
本研究比较了5种酶对卵形鲳鲹鱼糜蛋白水解度和XOD抑制活性的影响。基于单因素试验,采用Box-Behnken设计分析,确定了以卵形鲳鲹为原料制备XOD抑制肽的最佳酶解工艺:采用中性蛋白酶,料液比为1∶3(g∶mL),酶解温度为54 ℃,pH为7.0,酶解时间为3.85 h,加酶量为0.19%。在此条件下测得水解度和XOD抑制活性值分别为11.82%和52.41%,与预测值基本相符,说明在该实验范围内建立的二次线性回归模型准确有效,具有一定的参考价值。肽分子质量及氨基酸分析结果表明,具有高XOD抑制活性的卵形鲳鲹酶解产物大多为分子质量<3 000 Da的肽段,且亮氨酸、苯丙氨酸等疏水性氨基酸含量较高。本研究表明,卵形鲳鲹是制备XOD抑制肽较为理想的原料来源,制备得到的产物活性较高,可为卵形鲳鲹高值化利用提供方法和技术指导。
[1] YE Y,ZHANG Y,WANG B,et al.CXCR1/CXCR2 antagonist G31P inhibits nephritis in a mouse model of uric acid nephropathy[J].Biomedicine & Pharmacotherapy,2018,107:1 142-1 150.
[2] ROCK K L,KATAOKA H,LAI J J.Uric acid as a danger signal in gout and its comorbidities[J].Nature Reviews Rheumatology,2013,9(1):13-23.
[3] ZURLO A,VERONESE N,GIANTIN V,et al.High serum uric acid levels increase the risk of metabolic syndrome in elderly women:The PRO.V.A study[J].Nutrition Metabolism and Cardiovascular Diseases,2016,26(1):27-35.
[4] 时红,张莉芸,张改连,等.基于互联网的健康教育对高尿酸血症病人的影响[J].护理研究,2021,35(6):1 103-1 105.
SHI H,ZHANG L Y,ZHANG G L,et al.Influence of health education based on internet on patients with hyperuricemia[J].Chinese Nursing Research,2021,35(6):1 103-1 105.
[5] AGARWAL V,HANS N,MESSERLI F H.Effect of allopurinol on blood pressure:A systematic review and meta-analysis[J].Journal of Clinical Hypertension,2013,15(6):435-442.
[6] 蒋林宏,杨锡洪,谢静雯,等.降尿酸天然生物活性物质作用机制研究进展[J].食品与机械,2020,36(8):210-216.
JIANG L H,YANG X H,XIE J W,et al.Research progress on the mechanism of uric acid-lowering natural bioactive compounds[J].Food & Machinery,2020,36(8):210-216.
[7] LIU N X,WANG Y,YANG M F,et al.New rice-derived short peptide potently alleviated hyperuricemia induced by potassium oxonate in rats[J].Journal of Agricultural and Food Chemistry,2019,67(1):220-228.
[8] 胡晓,周雅,杨贤庆,等.食物蛋白源降尿酸活性肽的研究进展[J].食品与发酵工业,2020,46(4):287-293.
HU X,ZHOU Y,YANG X Q,et al.Research progress on anti-hyperuricemic peptides obtained from food proteins[J].Food and Fermentation Industries,2020,46(4):287-293.
[9] RAMALLO I A,ZACCHINO S A,FURLAN R L E.A rapid TLC autographic method for the detection of xanthine oxidase inhibitors and superoxide scavengers[J].Phytochemical Analysis,2006,17(1):15-19.
[10] OHTA Y,MATSURA T,KITAGAWA A,et al.Xanthine oxidase-derived reactive oxygen species contribute to the development of D-galactosamine-induced liver injury in rats[J].Free Radical Research,2007,41(2):135-144.
[11] UNNO T,SUGIMOTO A,KAKUDA T.Xanthine oxidase inhibitors from the leaves of Lagerstroemia speciosa(L.) Pers[J].Journal of Ethnopharmacology,2004,93(2-3):391-395.
[12] 林川,何永姑,王小兵.卵形鲳鲹深海网箱养殖渔获模式的研究[J].热带生物学报,2018,9(4):363-369.
LIN C,HE Y G,WANG X B.Development of net cage-based deep sea aquaculture and catch models for trachinotus ovatus[J].Journal of Tropical Biology,2018,9(4):363-369.
[13] 李远友,李孟孟,汪萌,等.卵形鲳鲹营养需求与饲料研究进展[J].渔业科学进展,2019,40(1):167-177.
LI Y Y,LI M M,WANG M,et al.Research advances in nutritional requirement and feed of Trachinotus ovatus[J].Progress in Fishery Sciences,2019,40(1):167-177.
[14] 戴梓茹,钟秋平,林美芳,等.金鲳鱼营养成分分析与评价[J].食品工业科技,2013,34(1):347-350.
DA Z R,ZHONG Q P,LIN M F,et al.Nutritional component analysis and quality evaluation of golden pompano[J].Science and Technology of Food Industry,2013,34(1):347-350.
[15] LI Y J,KANG X Y,LI Q Y,et al.Anti-hyperuricemic peptides derived from bonito hydrolysates based on in vivo hyperuricemic model and in vitro xanthine oxidase inhibitory activity[J].Peptides,2018,107:45-53.
[16] 赵谋明,徐巨才,刘洋,等.秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺优化[J].农业工程学报,2015,31(14):291-297.
ZHAO M M,XU J C,LIU Y,et al.Technology optimization on preparation of XOD inhibition peptide from Saury[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(14):291-297.
[17] MUROTA I,TAMAI T,BABA T,et al.Uric acid lowering effect by ingestion of proteolytic digest of shark cartilage and its basic fraction[J].Journal of Food Biochemistry,2010,34(1):182-194.
[18] WAN H T,HAN J J,TANG S S,et al.Comparisons of protective effects between two sea cucumber hydrolysates against diet induced hyperuricemia and renal inflammation in mice[J].Food & Function,2020,11(1):1 074-1 086.
[19] 李银娟.低苦味大豆抗氧化肽的制备及应用[D].广州:华南理工大学,2013.
LI Y J.Preparation and application of low bitter soybean antioxidant pepide[D].Guangzhou:South China University of Technology,2013.
[20] DONG S Y,ZENG M Y,WANG D F,et al.Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2008,107(4):1 485-1 493.
[21] 滕超,王中月,李秀婷,等.生产高纯度低聚木糖的酶筛选及其水解条件优化[J].中国食品学报,2018,18(6):104-111.
TENG C,WANG Z Y,LI X T,et al.Screening of high-producing xylooligosaccharide enzyme and its best conditions of enzymatic hydrolysis[J].Journal of Chinese Institute of Food Science and Technology,2018,18(6):104-111.
[22] 张杨,胡磊,汪少芸,等.响应面优化酶解法制备蒲公英籽蛋白抗氧化肽工艺[J].食品工业科技,2016,37(5):258-262.
ZHANG Y,HU L,WANG S Y,et al.Optimization of enzymolysis technology for preparation of antioxidant peptides from dandelion seeds-derived proteins by response surface methodology[J].Science and Technology of Food Industry,2016,37(5):258-262.
[23] 吴燕燕,赵志霞,李来好,等.响应面法优化复合咸味剂腌制罗非鱼片的工艺[J].水产学报,2019,43(2):532-546.
WU Y Y,ZHAO Z X,LI L H,et al.Process of optimizing compound salt agent pickled tilapia fillets by response surface methodology[J].Journal of Fisheries of China,2019,43(2):532-546.
[24] HE W W,SU G W,SUN-WATERHOUSE D,et al.In vivo anti-hyperuricemic and xanthine oxidase inhibitory properties of tuna protein hydrolysates and its isolated fractions[J].Food Chemistry,2019,272:453-461.
[25] MUROTA I,TAMAI T,BABA T,et al.Moderation of oxonate-induced hyperuricemia in rats via the ingestion of an ethanol-soluble fraction of a shark cartilage proteolytic digest[J].Journal of Functional Foods,2012,4(2):459-464.
[26] ZHENG L,DONG H Z,SU G W,et al.Radical scavenging activities of Tyr-,Trp-,Cys-and Met-Gly and their protective effects against AAPH-induced oxidative damage in human erythrocytes[J].Food Chemistry,2016,197:807-813.
[27] 李宇娟.鲣鱼降尿酸肽的制备分离、结构表征及功效机制研究[D].广州:华南理工大学,2019.
LI Y J.Preparation,isolation,structural characterization,and the effect mechanism of uric acid-lowering peptides derived from bonito[D].Guangzhou:South China University of Technology,2019.