大鲵(Andrias davidianus)又称娃娃鱼,属于两栖纲、隐腮鲵科,世界现存最大的两栖动物,国家二级水生野生保护动物[1-2]。大鲵为长江中上游地区所有,主要产于陕西汉中、湖北、湖南张家界、浙江丽水等地区[3]。大鲵的营养和药用价值均很高,肉质蛋白质高、脂肪含量较低[4-5]。目前,随着大鲵工厂化繁殖和养殖技术日渐成熟,大鲵资源成功进入市场,其开发利用越来越受到人们的关注[6-7]。
冰藏保鲜是广泛应用于水产品保鲜的一种方法,它是利用冰或冰水达到降温的目的[8]。微冻保鲜的温度一般是在生物体冰点以下1~2 ℃的温度带,这时鱼体内大部分自由水被冻结,酶的活性降低,微生物细胞的生理生化活动和繁殖也受到了影响,从而使水产品在较长时间内保持新鲜度,延缓鱼体腐败变质[9]。前人[10-11]的研究表明微冻贮藏能够较好地保持鱼肉的新鲜度以及品质。
目前关于大鲵的研究大都集中在肌肉、皮肤[12]、黏液[13]和功能因子[14]等方面,而关于在冰藏和微冻的条件下品质变化的报道很少。本实验以大鲵肌肉为实验原料,以冰藏和微冻贮藏作为对比,通过测定贮藏过程中色差、pH值、汁液流失率、挥发性盐基氮(total volatile base nitrogen,TVB-N)、硫代巴比妥酸(thiobarbituric acid,TBA)、挥发性成分等指标并观察肌肉微观结构,研究大鲵肌肉在冰藏和微冻贮藏下品质的变化。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 材料与试剂
大鲵,浙江山鼎大鲵研发有限公司,体重(2.5±0.5)kg,体长(60±4.4)cm,均为同龄大鲵。
实验试剂:盐酸标准滴定溶液(分析纯),上海市计量测试研究院;氧化镁、溴甲酚绿、2-硫代巴比妥酸、三氯乙酸等试剂,国药集团化学试剂有限公司;4%多聚甲醛溶液,生工生物工程(上海)股份有限公司。
1.1.2 仪器与设备
Seven2Go pH计,梅特勒仪器(上海)有限公司;FMB20制冰机,上海贺帆仪器有限公司;Kjeltec8400全自动凯氏定氮仪,丹麦FOSS公司;TMS-Pro质构仪,美国FTC公司;UV-1102紫外分光光度计,上海天美仪器有限公司;Eclipse 80i生物显微镜,日本尼康仪器有限公司;H-1850R台式高速冷冻离心机,湖南湘怡实验室仪器开发有限公司;HYC-310S医用冷藏箱,青岛海尔生物医药股份有限公司。
1.2 实验方法
1.2.1 原料处理
将人工养殖的大鲵运输至实验室,电击晕厥,用85 ℃左右的水漂烫60 s,刮去皮肤表面黏液,去除内脏、四肢、头部、尾部,用冰水洗净[15]。将大鲵肌肉切成30 g大小的鱼块,用吸水纸擦干表面的水分,分装于聚乙烯材质的自封袋中,将一部分样品降温至冰的熔点附近,装入覆盖约10 cm碎冰的泡沫箱中,再将表面覆盖约10 cm碎冰,放到7 ℃左右冰柜中贮藏,每隔12 h换一次冰,确保环境温度为0 ℃;另一部分贮藏到(-2±0.4)℃的冰箱中,每3 d测定其各项指标。
1.2.2 冰点的测定
参照刘欣荣等[16]的方法稍加改动,将大鲵肌肉置于-20 ℃的冰箱中,将热电偶的温度探头插进肌肉中心,纪录温度每变化1 ℃对应的时间,绘制温度时间曲线,当温度由逐渐下降转为一段相对稳定期时,该温度即为大鲵肉的冰点。
1.2.3 菌落总数的测定
依据GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数》,测定大鲵肌肉菌落总数。
1.2.4 TVB-N的测定
依据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,测定大鲵肌肉TVB-N值。
1.2.5 TBA值的测定
参照刘会省等[17]的方法,取10 g大鲵肌肉于锥形瓶中,向锥形瓶中加入50 mL的三氯乙酸(质量分数7.5%),浸提30 min,过滤,离心5 min,取5 mL上清液,向上清液中加入5 mL 0.02 mol/L的硫代巴比妥酸,然后90 ℃恒温水浴加热40 min,再离心取上清液,分别在532、600 nm处测上清液吸光值(A532、A600),TBA值计算如公式(1)所示:
(1)
1.2.6 汁液流失率的测定
参考FENG等[18]的方法,称量样品贮藏前的质量,贮藏一定时间后取出样品解冻,擦干肉表面的水分,称其质量,记录初始样品的质量和解冻后的质量,汁液流失率计算如公式(2)所示:
汁液流失率/%=(大鲵肉初始质量-解冻后的质量)/初始质量×100
(2)
1.2.7 质构的测定
由于大鲵肌肉无法制备成大小一致的几何形状,不宜使用P50探头,需通过较小的柱形探头以不破坏样品结构并保持固定接触面积的前提下进行变压缩测试。选用P5探头进行质构特性的测定,测量模式为TPA,重复测量4次,取平均值。测定参数:测试前的速度1 mm/s,测试速度5 mm/s,测试后的速度10 mm/s,测试距离10 cm,触发力20 g。
1.2.8 pH的测定
参考文献[19]的方法稍加改动,称取已经切碎的大鲵肉2 g,加入20 mL的水,均质,放置30 min,用pH计进行测定。
1.2.9 肌肉微观结构的测定
参照袁小敏[20]的方法,将样品切成1 cm×1 cm×1 cm左右的小块,用4%的多聚甲醛溶液固定,用水洗去固定液,用体积分数50%、70%、80%、95%乙醇梯度脱水1 h,用吸水纸擦干,再用100%乙醇浸泡1 h,浸蜡,包埋,将组织蜡块用切片机切成厚度为5 μm的薄片,用苏木素-伊红(HE)染色法染色,在光学显微镜下观察。
1.3 数据处理
实验数据用Excel 2010进行统计,采用SPSS 16.0、Excel和Origin 8.0软件进行绘图。
2 结果与分析
2.1 冰点分析
从大鲵肌肉的降温曲线可看出,前27 min迅速下降,30 min后出现了一段相对稳定的时期(图1),这个时期大鲵肉内部大部分水冻成冰,放出热量,所以温度几乎无变化,120 min后温度继续快速下降。所以可以得到大鲵肌肉的冰点为(0.1±0.1)℃,本实验把-2 ℃设为大鲵肌肉微冻贮藏的温度。
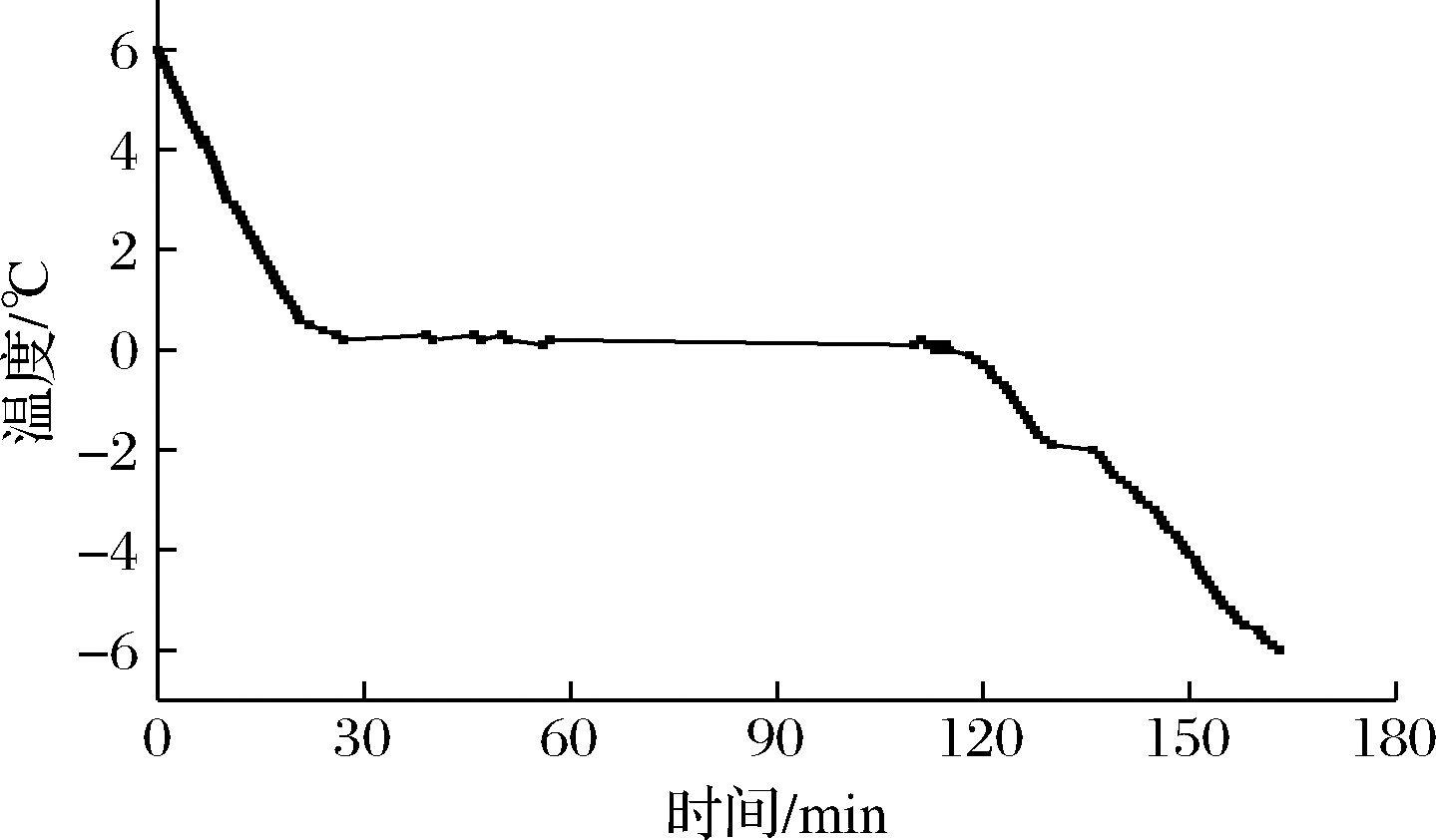
图1 大鲵肌肉的冻结曲线
Fig.1 The freezing temperature curve of A.davidianus muscle
2.2 菌落总数的变化
大鲵肌肉菌落总数的变化如图2所示。2种贮藏温度下大鲵肌肉菌落总数均是随着贮藏时间的延长而增加,冰藏组的菌落总数高于微冻组,这可能是因为冰藏温度高,微生物繁殖较快,低温能够延缓微生物的生长。冰藏组贮藏24 d时,菌落总数已超过6 lgCFU/g。在贮藏结束时2组均超过了6 lgCFU/g,均不可食用。
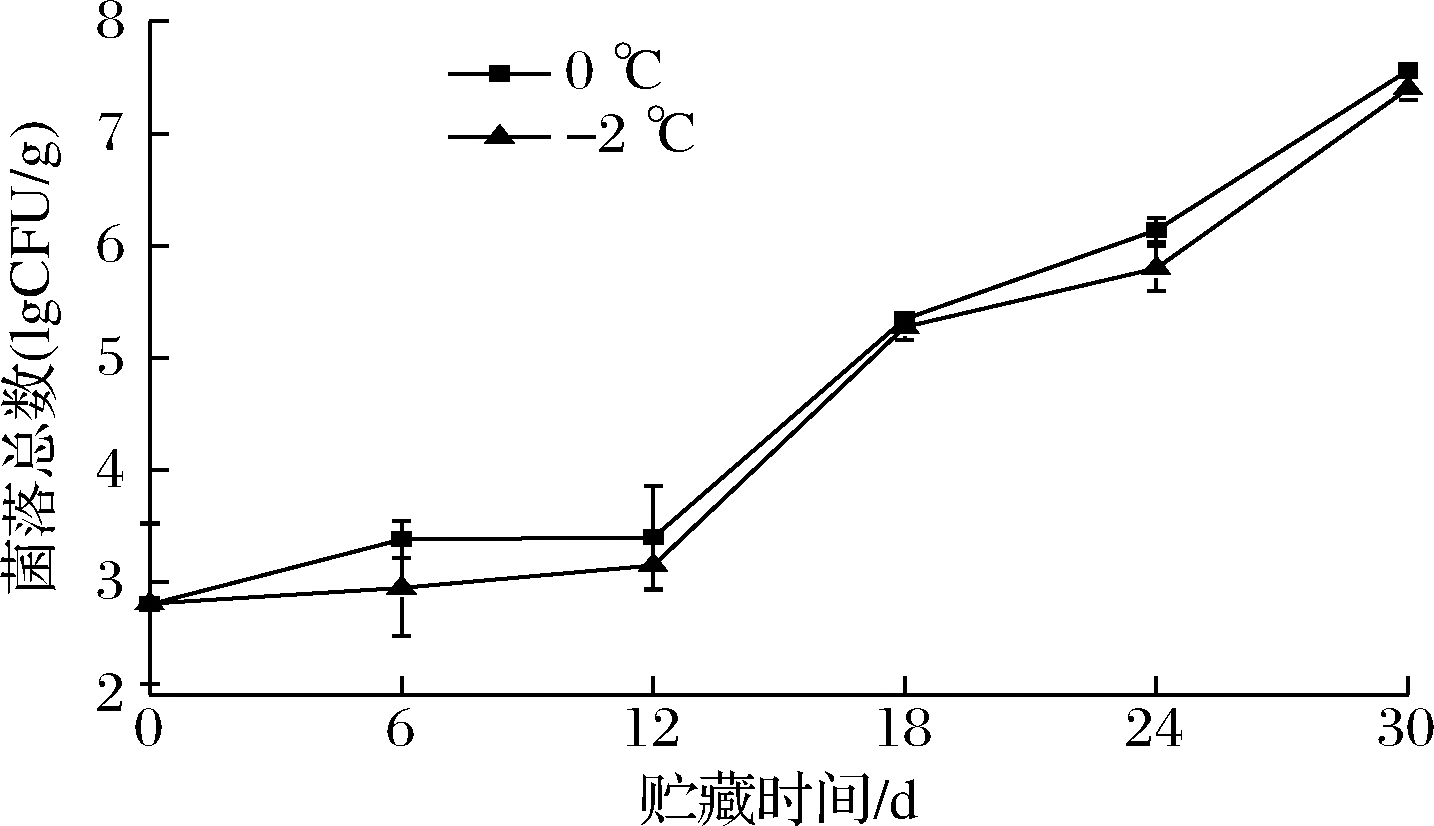
图2 大鲵肌肉在冰藏和微冻贮藏过程中菌落总数的变化
Fig.2 Changes in aerobic plate count of A.davidianus muscle during ice and micro-frozen storage
2.3 TVB-N值的变化
TVB-N是评价水产品品质好坏的重要指标,新鲜水产品含有丰富的蛋白质,在微生物和内源酶的作用下分解产生二甲胺、三甲胺等氨类物质以及其他的氨类化合物,这些物质都被称为TVB-N[21]。如图3所示,新鲜大鲵肌肉TVB-N值为(6.96±0.18)mg/100 g,大鲵肌肉冰藏初期TVB-N值变化不明显,后期增长速率升高;冰藏条件下TVB-N从第21天开始增长速率加快,微冻贮藏条件下TVB-N从第27天开始增长速率变快,但没有冰藏组增长快。根据食品安全标准GB 2733—2015《鲜、冻动物性水产品》,淡水鱼虾中TVB-N的含量≤20 mg/100 g[11]。冰藏组在第33 天时,TVB-N值达到(24.82±0.62)mg/100 g,已变质不可食用,微冻贮藏还在国标规定范围内。这可能因为微冻能抑制微生物的生长和降低内源酶的活性,使蛋白质无法分解出氨类化合物。微冻贮藏条件下可以延缓大鲵肌肉腐败变质,保持鱼的品质。

图3 大鲵肌肉在冰藏和微冻贮藏过程中TVB-N值的变化
Fig.3 Changes in TVB-N of A.davidianus muscle during ice and micro-frozen storage
2.4 TBA值的变化
硫代巴比妥酸值是评价水产品脂肪氧化程度的指标,脂肪氧化产生的丙二醛能与硫代巴比妥酸试剂反应生成粉红色化合物[16]。一般情况下,脂肪由于温度、酶和蛋白质而发生氧化,氧化程度越大,TBA值越高,鱼肉新鲜度越差。大鲵贮藏期间TBA的变化如图4所示,冰藏组的大鲵肉在贮藏前期没有明显的变化,从21 d开始增长速率有明显的上升,冰藏至33 d时TBA值达到(0.623±0.008)mg/100 g。微冻组TBA值前期变化趋势不明显,从27 d开始增长速率上升,贮藏到33 d时达到(0.49±0.03) mg/100 g。微冻在一定程度上能够降低脂肪氧化的速度,这是因为微冻温度比冰藏温度低,能够抑制脂肪氧化酶的活性。
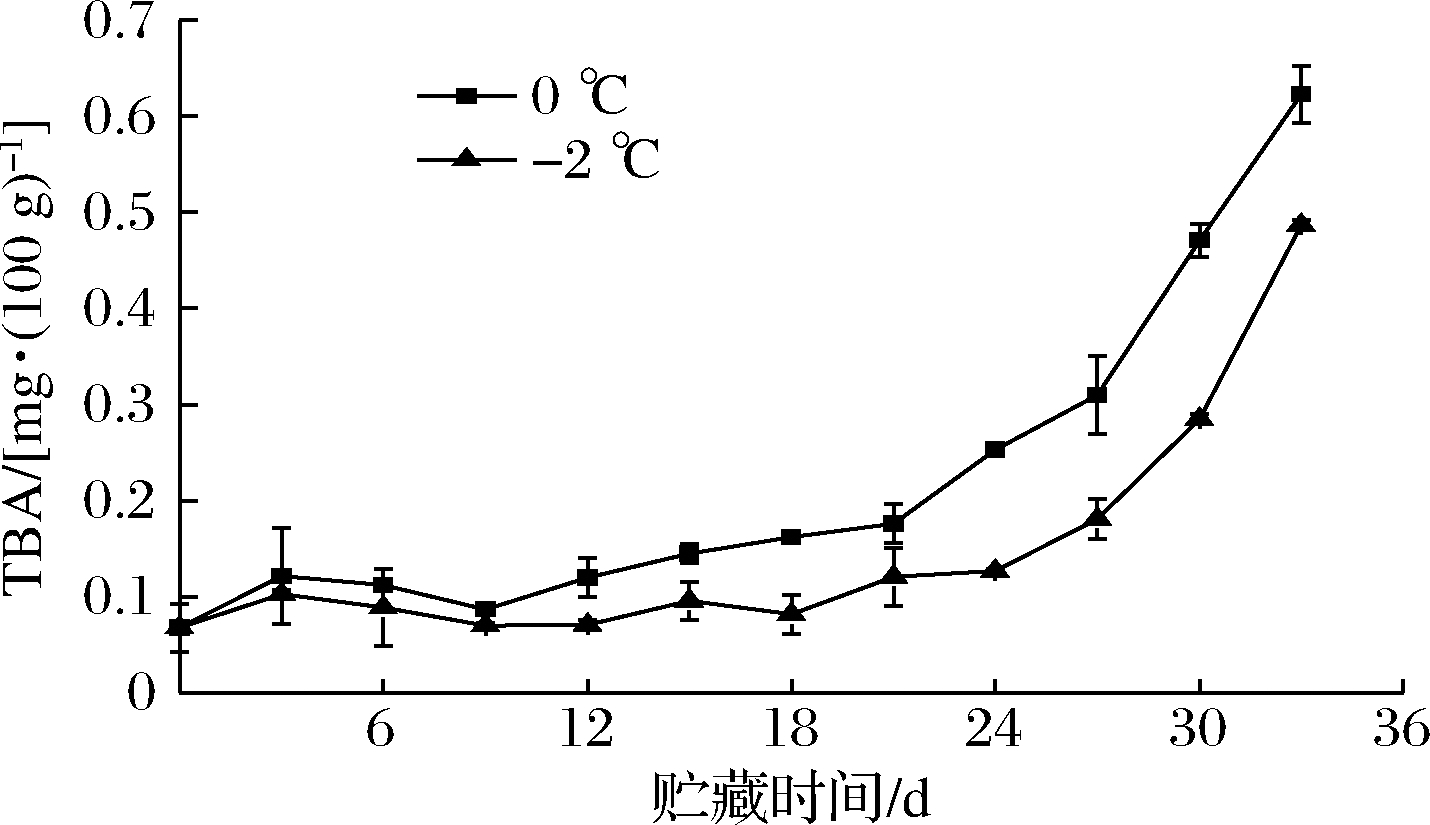
图4 大鲵肌肉在冰藏和微冻贮藏过程中TBA值的变化
Fig.4 Changes in TBA of A.davidianus muscle during ice and micro-frozen storage
2.5 汁液流失率的变化
汁液流失率是衡量鱼肉持水能力的一个标准。由图5可知,在冰藏和微冻贮藏过程中大鲵肌肉汁液流失率呈现上升的趋势,并且前期上升比较快,贮藏至24 d时,上升趋势较缓,贮藏结束时冰藏汁液流失率为32.41%,微冻贮藏为26.11%。这可能与蛋白质等大分子物质发生降解有关,肌肉内部水分流出,使其持水力下降。在整个贮藏过程中冰藏组的汁液流失率要略高于微冻贮藏,说明微冻保藏效果比冰藏好,这可能与微冻温度更低有关,能够延缓肌肉组织分解,降低蛋白酶的活力,从而使蛋白质降解速率变慢。微冻贮藏能够延缓鱼肉汁液流失。
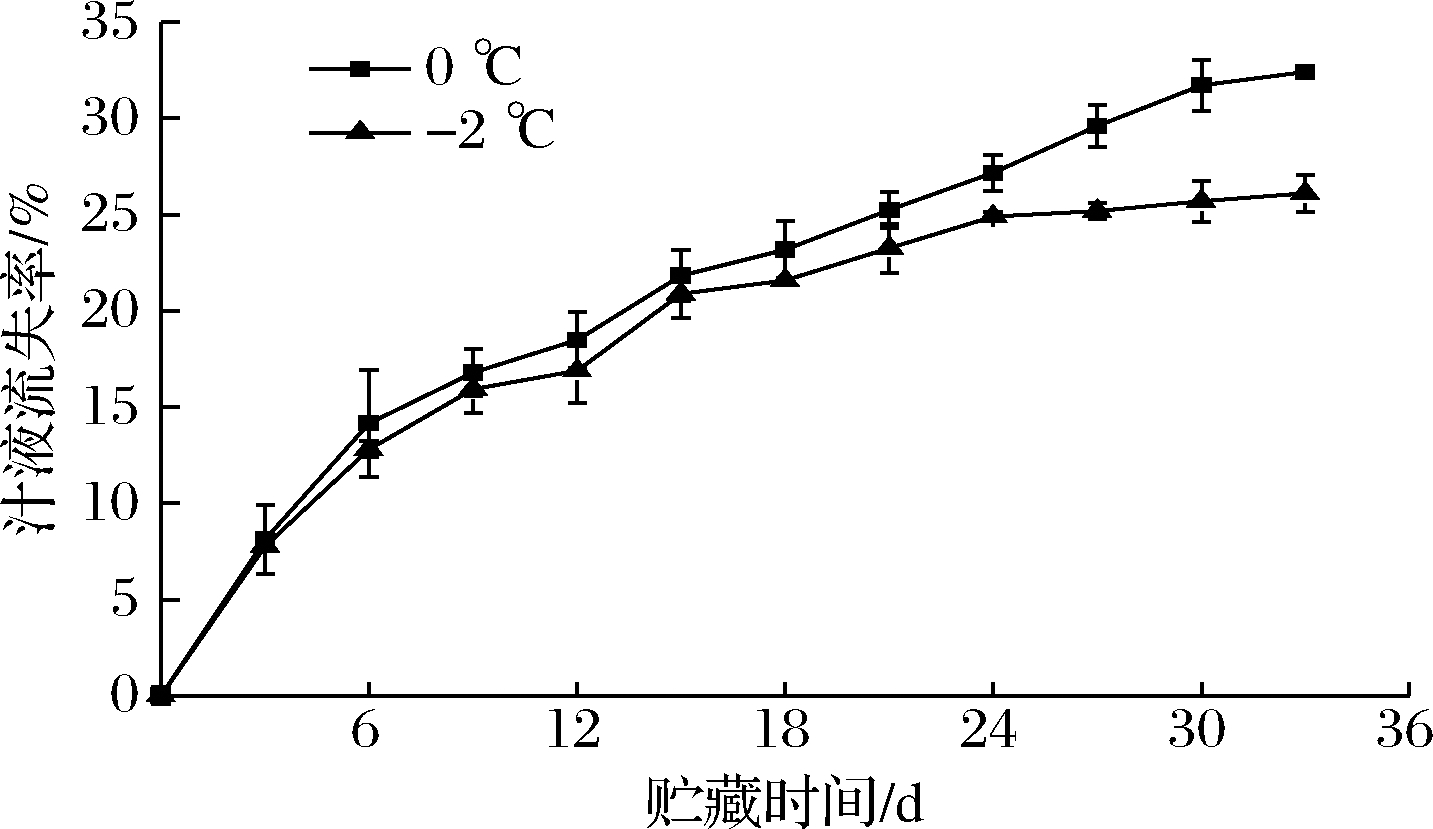
图5 大鲵肌肉在冰藏和微冻贮藏过程中汁液流失率值的变化
Fig.5 Changes in water loss of A.davidianus muscle during ice and micro-frozen storage
2.6 质构的变化
质构特性是反应鱼肉品质的指标。硬度、胶着性、咀嚼性以及回复性都是测定鱼肉质构常用的指标。相悦等[22]的研究表明冰藏过程中花鲈鱼硬度、胶着性和咀嚼性等指标均呈现下降的趋势,口感质量降低。表1是冰藏和微冻贮藏大鲵肌肉在贮藏期的硬度、胶着性、咀嚼性和回复性的变化趋势。冰藏和微冻贮藏条件下大鲵肌肉的硬度分别下降了50%、40%;胶着性分别下降了48%、42%;咀嚼性分别下降了47%、40%;回复性分别下降了33%、35%;硬度均是在27 d时出现显著降低,冰藏条件下,胶着性和咀嚼性都是在21 d时呈现显著下降的趋势,而微冻贮藏条件下,胶着性没有明显下降的点,咀嚼性在27 d时呈现明显下降的趋势,这是因为肌原纤维蛋白发生降解,肌肉组织结构被破坏。
表1 大鲵肌肉在冰藏和微冻贮藏过程中质构变化
Table 1 Change in texture of A.davidianus muscle during ice and micro-frozen storage
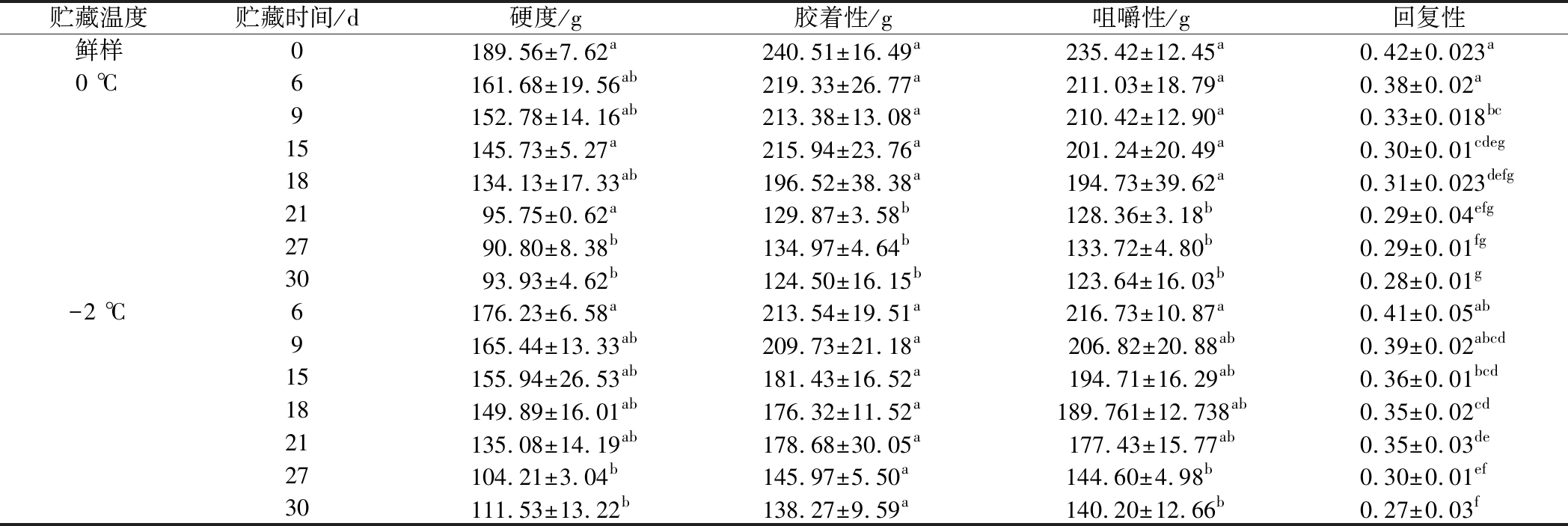
贮藏温度贮藏时间/d硬度/g胶着性/g咀嚼性/g回复性鲜样0189.56±7.62a240.51±16.49a235.42±12.45a0.42±0.023a0 ℃6161.68±19.56ab219.33±26.77a211.03±18.79a0.38±0.02a9152.78±14.16ab213.38±13.08a210.42±12.90a0.33±0.018bc15145.73±5.27a215.94±23.76a201.24±20.49a0.30±0.01cdeg18134.13±17.33ab196.52±38.38a194.73±39.62a0.31±0.023defg2195.75±0.62a129.87±3.58b128.36±3.18b0.29±0.04efg2790.80±8.38b134.97±4.64b133.72±4.80b0.29±0.01fg3093.93±4.62b124.50±16.15b123.64±16.03b0.28±0.01g-2 ℃6176.23±6.58a213.54±19.51a216.73±10.87a0.41±0.05ab9165.44±13.33ab209.73±21.18a206.82±20.88ab0.39±0.02abcd15155.94±26.53ab181.43±16.52a194.71±16.29ab0.36±0.01bcd18149.89±16.01ab176.32±11.52a189.761±12.738ab0.35±0.02cd21135.08±14.19ab178.68±30.05a177.43±15.77ab0.35±0.03de27104.21±3.04b145.97±5.50a144.60±4.98b0.30±0.01ef30111.53±13.22b138.27±9.59a140.20±12.66b0.27±0.03f
注:同一列中不同字母表示有显著差异(P<0.05)
2.7 pH值变化
图6为冰藏和微冻贮藏过程中大鲵肌肉pH值的变化,大鲵肌肉pH值在贮藏前期呈现先下降后上升的趋势,这可能因为大鲵死后的僵直期,大鲵肌肉内部糖原降解产生大量ATP、乳酸和磷酸肌酸等酸性物质,导致鱼肌肉pH值下降[23];在解僵和自溶期,由于酶和微生物的作用,肌肉中的蛋白质产生碱性化合物,导致大鲵肌肉pH值呈现上升的趋势。冰藏条件下pH值在第3 天降到最低值6.04,微冻贮藏条件下第6 天降到最低值5.94,在贮藏后期冰藏条件下大鲵肌肉pH上升速率比微冻贮藏快,这是由于微冻贮藏降低了酶的活性,分解蛋白质的速度减慢,氨等碱性物质生成减少。冰藏组在贮藏24 d后pH又开始下降,可能因为产酸菌成为优势菌,使其pH值下降,而微冻贮藏还是上升的趋势,可能是因为微冻温度低,微生物生长缓慢,主要以蛋白质分解成碱性物质为主导,微冻贮藏27 d时pH值较低,可能是因为环境因素和个人操作原因导致异常。

图6 大鲵肌肉在冰藏和微冻贮藏过程中pH值的变化
Fig.6 Changes in pH of A.davidianus muscle during ice and micro-frozen storage
2.8 肌肉微观组织结构的变化
图7是大鲵在贮藏过程中鲜样、冰藏以及微冻贮藏肌肉组织微观结构的对比图。从图中可以看出,新鲜大鲵肌肉的肌肉组织完好,组织清晰。贮藏到第15 天时,组织结构有破裂,肌肉组织的完整性比新鲜鱼肉低;贮藏到33 d时,肌原纤维被分解,肌纤维束断裂,肌肉组织结构被破环,微冻贮藏比冰藏破裂更严重。冰藏温度比微冻贮藏温度高,冰藏主要由于蛋白酶的作用,结构蛋白和肌原纤维蛋白被分解,肌肉纤维结构劣化;微冻贮藏大鲵肌肉组织破裂主要因为细胞内产生大小不同的冰晶,对细胞造成机械损害,导致肌束断裂。

a-鲜样;b-冰藏15 d;c-微冻15 d;d-冰藏33 d;e-微冻33 d
图7 大鲵肌肉在冰藏和微冻贮藏过程中肌肉组织结构的变化
Fig.7 Changes in muscle tissue structure of A.davidianus during ice and micro-frozen storage
3 结论
本实验研究了在冰藏(0 ℃)和微冻(-2 ℃)贮藏过程中大鲵肌肉品质的变化。在冰藏和微冻贮藏过程中,大鲵肌肉的TVB-N、TBA以及汁液流失率都显示上升的趋势,温度越低,上升的越慢;菌落在贮藏结束时均已超过限定值,不可食用。冰藏组在贮藏结束时,TVB-N超过国家限值,微冻贮藏仍在可接受范围内;冰藏条件下大鲵肌肉pH值第3 天降到最低值,微冻条件下第6 天降到最低值;大鲵肌肉硬度、胶着性、咀嚼性以及回复性均呈现下降,温度越高,下降越快;观察其微观结构,微冻贮藏与冰藏都使大鲵肌肉肌纤维组织结构断裂。与冰藏相比,微冻贮藏较好地保持了大鲵肌肉品质。本文仍有不足之处,对大鲵肌肉品质变化研究不够深入,后面的研究将从蛋白质变化机理,气味物质等方面进一步探究大鲵肌肉品质变化的机理。
[1] 曹宇,殷梦光,李灿.大鲵的营养成分开发利用现状综述[J].贵阳学院学报(自然科学版),2015,10(3):40-44.
CAO Y,YIN M G,LI C.The exploitation status on the nutrient content of A.davidianus[J].Journal of Guiyang University(Natural Sciences),2015,10(3):40-44.
[2] WANG X M,ZHANG K J,WANG Z H,et al.The decline of the Chinese giant salamander Andrias davidianus and implications for its conservation[J].Oryx,2004,38(2):197-202.
[3] 王立新,郑尧,艾闽,等.中国大鲵皮肤营养成分分析[J].淡水渔业,2011,41(1):92-95;91.
WANG L X,ZHENG Y,AI M,et al.Analysis of nutritional components in the skin of Chinese giant salamander(Andrias davidianus)[J].Freshwater Fisheries,2011,41(1):92-95;91.
[4] 杨玉凤.大鲵的药用价值及人工养殖[J].北京农业,2004(1):28.
YANG Y F.Medicinal value and artificial breeding of Andrias davidianus[J].Beijing Agriculture,2004(1):28.
[5] 王金华,汪俊,李灿.子二代商品大鲵不同可食部位营养成分分析[J].肉类研究,2012,26(5):34-36.
WANG J H,WANG J,LI C.Analysis of nutritional composition of different edible parts of F2 generation of commercial Andrias davidianus[J].Meat Research,2012,26(5):34-36.
[6] 李伟龙,罗莉,李虹,等.中国大鲵人工养殖技术研究进展[J].中国渔业质量与标准,2018,8(5):18-24.
LI W L,LUO L,LI H,et al.Advance on the artificial breeding technologies of Chinese giant salamander(Andrias davidianus)[J].Chinese Fishery Quality and Standards in China,2018,8(5):18-24.
[7] 胡云峰,崔瀚元,路敏,等.不同温度对气调小包装生鲜大鲵分割肉货架品质的影响[J].肉类工业,2014(11):32-35.
HU Y F,CUI H Y,LU M,et al.Effect of different temperatures on quality of giant salamander cutting meats during its shelf-life in small modified atmosphere packaging[J].Meat Industry,2014(11):32-35.
[8] 吴锁连,康怀彬,李冬姣.水产品保鲜技术研究现状及应用进展[J].安徽农业科学,2019,47(22):4-6;33.
WU L S,KANG H B,LI D J.Research status and application progress of fresh-keeping technology of aquatic products[J].Journal of Anhui Agricultural Sciences,2019,47(22):4-6;33.
[9] 刘大松.草鱼肉在微冻和冰藏保鲜中的品质变化及其机理[D].无锡:江南大学,2012.
LIU D S.Quality changes of grass carp muscle during partial-frozen and iced storage[D].Wuxi:Jiang Nan University,2012.
[10] 陈依萍,崔文萱,高瑞昌,等.冷藏与微冻贮藏过程中鲟鱼肉品质变化[J].渔业科学进展,2020,41(1):178-186.
CHEN Y P,CUI W X,GAO R C,et al.Changes in quality of sturgeon fillet during 4 ℃ and-3 ℃ partial freezing storage[J].Progress in Fishery Sciences,2020,41(1):178-186.
[11] 刘明爽,李婷婷,马艳,等.真空包装鲈鱼片在冷藏与微冻贮藏过程中的新鲜度评价[J].食品科学,2016,37(2):210-213.
LIU M S,LI T T,MA Y,et al.Freshness evaluation of vacuum packaged perch fillets during refrigeration and partial freezing[J].Food Science,2016,37(2):210-213.
[12] 王茁.不同育龄大鲵肌肉和皮肤营养成分测定研究[J].现代农业科技,2017(10):228-229.
WANG Z.Nutrient composition determination of muscle and skin in different childbearing age of giant salamander[J].Modern Agricultural Science and Technology,2017(10):228-229.
[13] 王茁.不同育龄人工流水和仿生态养殖大鲵粘液营养成分研究[J].陕西农业科学,2015,61(11):71-73.
WANG Z.Nutrient composition of mucus in artificial running water and simulated ecological culture of Andrias davidianus[J].Shaanxi Journal of Agricultural Sciences,2015,61(11):71-73.
[14] 耿敬章,李新生,党娅,中国大鲵营养成分和功能因子研究进展[J].氨基酸和生物资源,2013,35(2):9-12.
GENG J Z,LI X S,DANG Y,et al.Progress on nutrition and functional factors in Chinese giant salamander[J].Amino Acids & Biotic Resources,2013,35(2):9-12.
[15] 贾亦森.冷鲜大鲵分割肉加工及保鲜技术研究[D].天津:天津科技大学,2016.
JIA Y S.Research on processing and preservation of chilled giant salamander meat[D].Tianjin:Tianjin University of Science and Technology,2016.
[16] 刘欣荣,申亮,齐凤生,等.微冻保鲜对红鳍东方鲀贮藏品质的影响[J].食品与发酵工业,2020,46(18):128-135.
LIU X R,SHEN L,QI F S,et al.Effects of micro-frozen storage on the quality of Takifugu rubripes[J].Food and Fermentation Industries,2020,46(18):128-135.
[17] 刘会省,迟海,杨宪时,等.解冻方法对船上冻结南极磷虾品质变化的影响[J].食品与发酵工业,2014,40(2):51-54.
LIU H X,CHI H,YANG X S,et al.Effect of different thawing methods on quality changes of frozen Antarctic krill(Euphausia superba) on ship[J].Food and Fermentation Industries,2014,40(2):51-54.
[18] FENG X N,BANSAL N,YANG H S.Fish gelatin combined with chitosan coating inhibits myofibril degradation of golden pomfret(Trachinotus blochii) fillet during cold storage[J].Food Chemistry,2016,200:283-292.
[19] CROPOTOVA J,MOZURAITYTE R,STANDAL I B,et al.Superchilled,chilled and frozen storage of Atlantic mackerel(Scomber scombrus) fillets-changes in texture,drip loss,protein solubility and oxidation[J].International Journal of Food Science & Technology,2019,54(6):2 228-2 235.
[20] 袁小敏.低温保鲜冰对罗非鱼片保鲜效果影响的研究[D].上海:上海海洋大学,2017.
YUAN X M.Effect of partial freezing ice on keeping freshness of Nile tilapia(Oreochromis niloticus) fillets[D].Shanghai:Shanghai Ocean University,2017.
[21] OCA O-HIGUERA V M,MAEDA-MART
O-HIGUERA V M,MAEDA-MART NEZ A N,MARQUEZ-R
NEZ A N,MARQUEZ-R OS E,et al.Freshness assessment of ray fish stored in ice by biochemical,chemical and physical methods[J].Food Chemistry,2011,125(1):49-54.
OS E,et al.Freshness assessment of ray fish stored in ice by biochemical,chemical and physical methods[J].Food Chemistry,2011,125(1):49-54.
[22] 相悦,孙承锋,李来好,等.花鲈冰藏过程中肌原纤维蛋白生化特性与新鲜度变化的相关性[J].水产学报2021,45(2):283-295.
XIANG Y,SUN C F,LI L H,et al.Correlation between changes in freshness and protein biochemical properties of Lateolabrax japonicas during iced storage[J].Journal of Fisheries of China,2021,45(2):283-295.
[23] HERN NDEZ M D,L
NDEZ M D,L PEZ M B,
PEZ M B, LVAREZ A,et al.Sensory,physical,chemical and microbiological changes in aquacultured meagre(Argyrosomus regius) fillets during ice storage[J].Food Chemistry,2009,114(1):237-245.
LVAREZ A,et al.Sensory,physical,chemical and microbiological changes in aquacultured meagre(Argyrosomus regius) fillets during ice storage[J].Food Chemistry,2009,114(1):237-245.