乳糖是由一分子半乳糖和一分子葡萄糖缩合而成的一种双糖,其甜度约为蔗糖的17%[1]。乳糖可以促进新陈代谢,有助于肠道内的乳酸菌繁殖增长以及肠道内矿物质的吸收,抑制肠内有害细菌的繁殖增长,防止龋齿[2]。近些年来,随着我国乳业的快速发展,乳制品质量也暴露出各种隐患,其中牛乳中掺假尤为严重[3],快速、准确地测定乳制品所包含的成分对保证乳制品品质、防止掺假以及保障人民身体健康具有重要的意义。由于乳糖在牛乳中含量比较稳定,通常为4.5%~5.0%[4],掺假物的添加容易使乳糖的含量发生较为明显的变化,因此,原料乳中是否存在掺假行为可以通过测定牛乳中乳糖含量进行初步判断[5]。此外,根据低乳糖牛奶工艺研究发现,我国成人肠道缺乏乳糖酶人群占比大于90%,他们无法将乳制品中的乳糖转化为半乳糖和葡萄糖,饮用正常乳糖含量乳制品后,会引起胃胀气、痉挛、消化不良和腹痛腹泻等一系列不适症状(即乳糖不耐症)[6]。为满足众多乳糖不耐症消费者的需求,低乳糖乳制品应运而生并深受广大消费者和食品市场欢迎,低乳糖产品未来具有十足的市场发展空间。国标GB 28050—2011《食品安全国家标准 预包装食品营养标签通则》明确规定:低乳糖,乳糖含量≤2 g/100 g(mL);无乳糖,乳糖含量≤0.5 g/100 g(mL),但是目前市场上存在虚假声称的低乳糖和无乳糖奶制品,损害了消费者的合法权益,严重阻碍了中国乳业可持续健康发展。
目前乳品中乳糖含量的检测主要采用国标GB 5413.5—2010《食品安全国家标准 婴幼儿食品和乳品中乳糖、蔗糖的测定》,即莱因—埃农氏法(滴定法)和高效液相色谱法,另外还有分光光度法[7]、酶电极法[8]、酶-比色法[9]以及近红外光谱法[10]等。莱茵-埃农氏法(滴定法)所使用的试剂具有一定腐蚀性且对操作人员的操作技能要求较高,耗时长、操作繁琐,滴定终点肉眼不易判断,易产生误差,结果不太准确。直接滴定法应用于复杂食品基质中存在多种还原糖的情况,测定结果在一定程度上会受到干扰,测定结果准确性不足。高效液相色谱法虽然可以避免还原糖对于检测的干扰,但其显著缺点是耗时长、分析成本较高、示差折光检测器的选择性、重复性和稳定性不足,尤其对于食品复杂基质中乳糖的分析较为困难。分光光度法虽然灵敏度较高,但对检测条件的要求比较严格,样品需在碱性条件下起显色反应,操作繁琐。酶电极法分析比较容易受葡萄糖、蔗糖等其他还原糖的干扰。酶-比色法灵敏度较高,但显著缺点是测定时间长,时效性难以保证,不易推广[2]。近红外光谱法需要大量样本建立预测模型,建立模型过程比较复杂,费时费力,且操作人员需要具备较强的数据分析建模能力[11];此外,由于水分子对红外具有较强的吸收,会在一定程度上干扰液体样品的检测[2],测定结果准确性不足。故亟需开发一种能够对牛奶中乳糖含量进行快速、准确且高效的定量检测方法。
基于上述问题,本研究采用核磁共振(nuclear magnetic resonance,NMR)波谱仪,基于脉冲宽度(pulse length based concentration determination,PULCON)[12-14]外标和内标[15-16]定量法,建立一种快速、准确、高效的牛奶中乳糖含量定量检测方法。
1 材料与方法
1.1 材料与仪器
Amicon Ultra-15超滤管,Merck,Ireland;3-(三甲基硅基)氘代丙酸钠[sodium-3-(trimethylsilyl) propionate-2,2,3,3-d4,TSP,98%],CIL;乳糖标准品(D-lactose,≥99.5%),Sigma;重水(D2O,99.9%),Sigma-Aldrich公司;柠檬酸(99%),Vetec;乙酸(≥99.5%),天津市大茂化学试剂厂;烟酰胺(≥99%),CNW Technologies;不同品牌牛奶样品购买于电商平台和北京市某大型超市。
Bruker Avance III HD 400M波谱仪、Bruker SampleJet 5 mm高通量核磁管、Bruker pH自动调节装置BTpH,Bruker Biospin,Rheinstetten,德国;Bruker 582位自动进样器,SampleJet;Vortex-5涡旋混合器,海门市其林贝尔仪器制造有限公司;AB204-N天平,METTLER TOLEDO,瑞士。
1.2 实验方法
1.2.1 乳糖标准储备液、外标、内标及TSP溶液的配制
乳糖标准储备液:用天平精确称取0.512 g乳糖标准品于10 mL容量瓶,用含5%乙酸的水溶液定容,摇匀后得到51.2 g/L乳糖标准储备液。用移液管准确量取5.0 mL质量浓度51.2 g/L乳糖标准储备液于10 mL容量瓶,用含5%乙酸的水溶液定容,摇匀后得到25.6 g/L的乳糖标准溶液。采用相同的方法,依次得到12.8、6.4、3.2、1.6、0.8、0.4、0.2、0.1和0.05 g/L乳糖标准溶液。采用5.0 mL含5%乙酸的水溶液作为空白对照组。
外标溶液:用天平精确称取0.2 g柠檬酸标准品于100 mL容量瓶,用蒸馏水定容,摇匀后得到2.0 g/L柠檬酸标准溶液。
内标溶液:用天平精确称取0.5 g烟酰胺标准品于50 mL容量瓶,用重水定容,摇匀后得到质量浓度10.0 g/L烟酰胺标准溶液。
TSP溶液:用天平精确称取0.5 g TSP标准品于50 mL容量瓶,用重水定容,摇匀后得到10.0 g/L TSP标准溶液。
1.2.2 样品制备
取20.0 mL牛奶样品,加入1.0 mL 乙酸,8 000 r/min离心5 min,弃去脂肪和蛋白相,取上清液5.0 mL加入到Amicon Ultra-15超滤管,离心5 min。然后从超滤离心管底部取1.0 mL清澈的水相于样品管中,加入100 μL TSP溶液和100 μL烟酰胺溶液,采用涡旋混合器振荡混匀。取0.6 mL混合液于NMR管待测。
1.2.3 1H NMR测定参数
采用PA BBI 400S1 H-BB-D-05 Z探头,NMR的共振频率为400.13 MHz,仪器检测温度为300 K,Bruker Top Spin 2.1软件采集1H NMR图谱数据,检测信号时间3.984 6 s,延迟时间4.0 s,每次自由感应衰减扫描次数为16,空扫描次数为4,谱宽15.1 ppm,采样点数为65 536(64K),谱线加宽因子为0.3 Hz。以TSP(δ= 0 ppm)作为化学位移的零点。采用Bruker标准的脉冲序列(noesygppr1 d)用于水(δ= 4.8 ppm)特征峰信号抑制。每批次样品检测前,等待5 min稳定检测温度。
1.2.4 1H NMR谱图预处理
采用MestReNova 12.0软件(Mestrelab Research S.L.,MestReNova(Mnova)NMR,USA)对1H NMR图谱进行傅里叶变换,基线矫正、相位调整和化学位移的定标。
1.2.5 定量分析
采用MestReNova软件qNMR定量模块,进行内标和外标定量分析[17]。
1.2.6 精密度分析
随机选取一份牛奶样品,采用1H NMR检测方法,同一天内重复测定5次,分析该方法的日内精密度;重复测定5 d,测定结果取每日测定量的平均值,进行方法的日间精密度分析。
1.2.7 加标回收率分析
在同一份牛奶样品中分别加入4份不同浓度水平的乳糖标品溶液,每个浓度水平平行重复5次,采用外标法和内标法进行定量分析,定量结果取5次重复测定的平均值,分别计算1H NMR方法的加标回收率及相对标准偏差(relative standard deviation,RSD)。
1.2.8 准确性分析
将1H NMR与国标GB 5413.5—2010《食品安全国家标准 婴幼儿食品和乳品中乳糖、蔗糖的测定》高效液相色谱法所得牛奶样品中乳糖的含量进行统计分析,进一步分析和验证1H NMR定量方法的准确性。
2 结果与分析
2.1 乳糖1H NMR谱中特征峰确认以及定量峰的选择
乳糖(D-lactose)是一种双糖,由一分子β-D-半乳糖和一分子α-D-葡萄糖在β-1,4-位形成糖苷键相连,乳糖在D2O中存在α和β两种构型[18-19],化学结构如图1所示。以TSP为内标,测定乳糖标准品的1H NMR谱,如图2所示,并对乳糖1H NMR谱特征信号峰进行归属(原子序号1′,δH = 4.44 ppm,1H,d,J=7.8 Hz),与相关文献报道一致[20],化学位移分布在δH 3.4~4.0 ppm的质子信号峰多发生重叠现象,难以归属,因此,δH 3.4~4.0 ppm质子信号峰不能用做定量特征峰分析。根据乳糖结构(图1),乳糖中葡萄糖基的端基质子存在α和β两种构型,且在D2O中可相互转化,不宜用于定量[18];α-D-半乳糖基的端基质子特征信号峰(δH 4.44 ppm)与样品中其他成分信号峰无重叠,仅裂分为双重峰,峰形尖锐,适合定量。
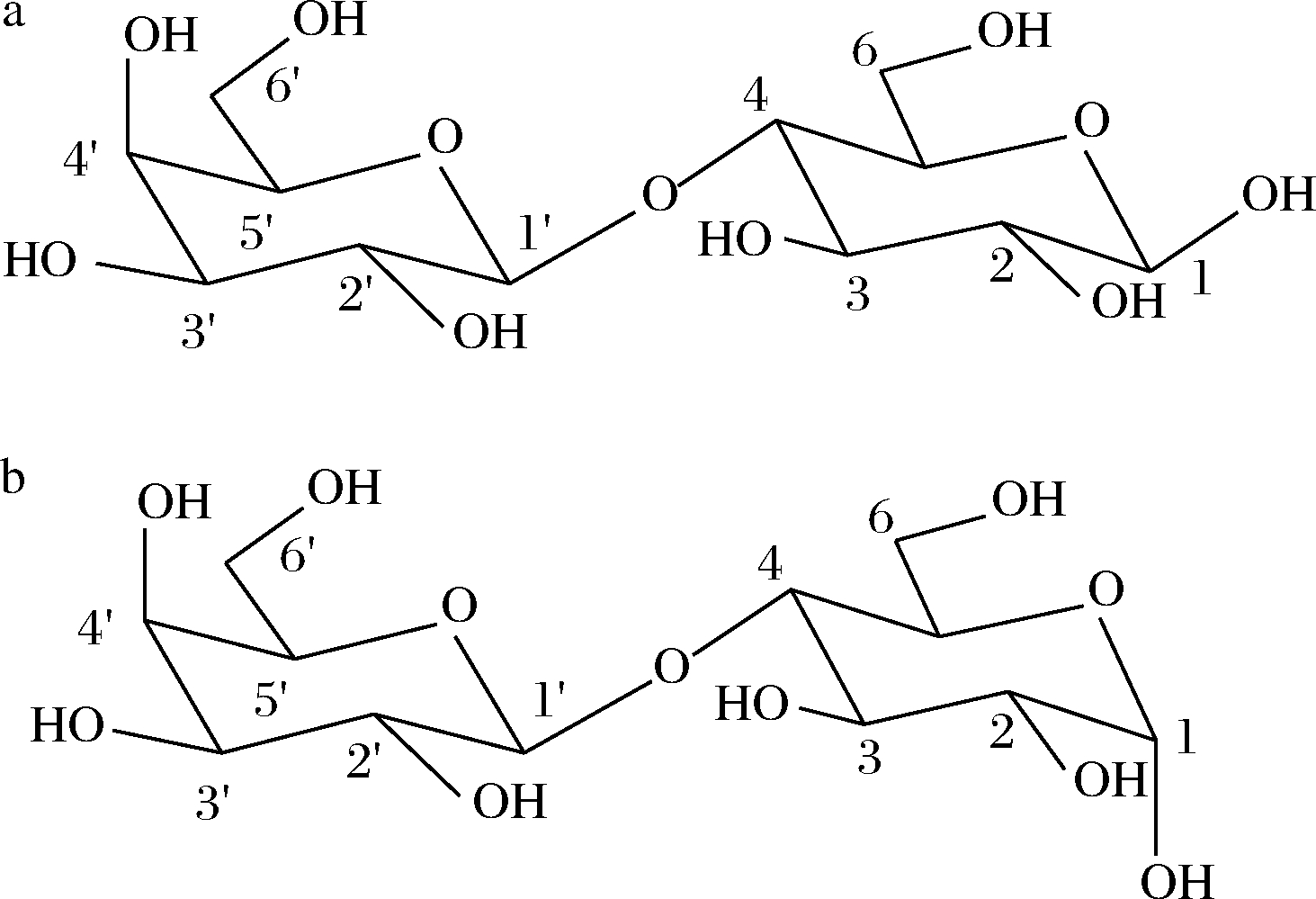
a-β乳糖;b-α乳糖
图1 乳糖在D2O中构型
Fig.1 Configurations of lactose in D2O
但由于α-D-半乳糖基的端基质子特征信号峰(δH 4.44 ppm)与基质水特征信号峰(δH 4.78 ppm)距离比较近,考虑到水峰压制可能对准确定量结果产生影响,本研究采用校正因子(cortect factor,CF)来校正水峰信号的压制对定量结果准确性的影响,与国内外文献报道一致[17,21];此外,MONAKHOVA等[20]也是选取α-D-半乳糖基的端基质子特征信号峰(δH 4.44 ppm)作为乳糖定量特征峰,基于核磁共振技术实现了普通牛奶和脱乳制品中乳糖含量的准确定量,因此,综合考虑后选取α-D-半乳糖基的端基质子特征信号峰(δH 4.44 ppm)作为牛奶样品中乳糖含量定量特征峰。
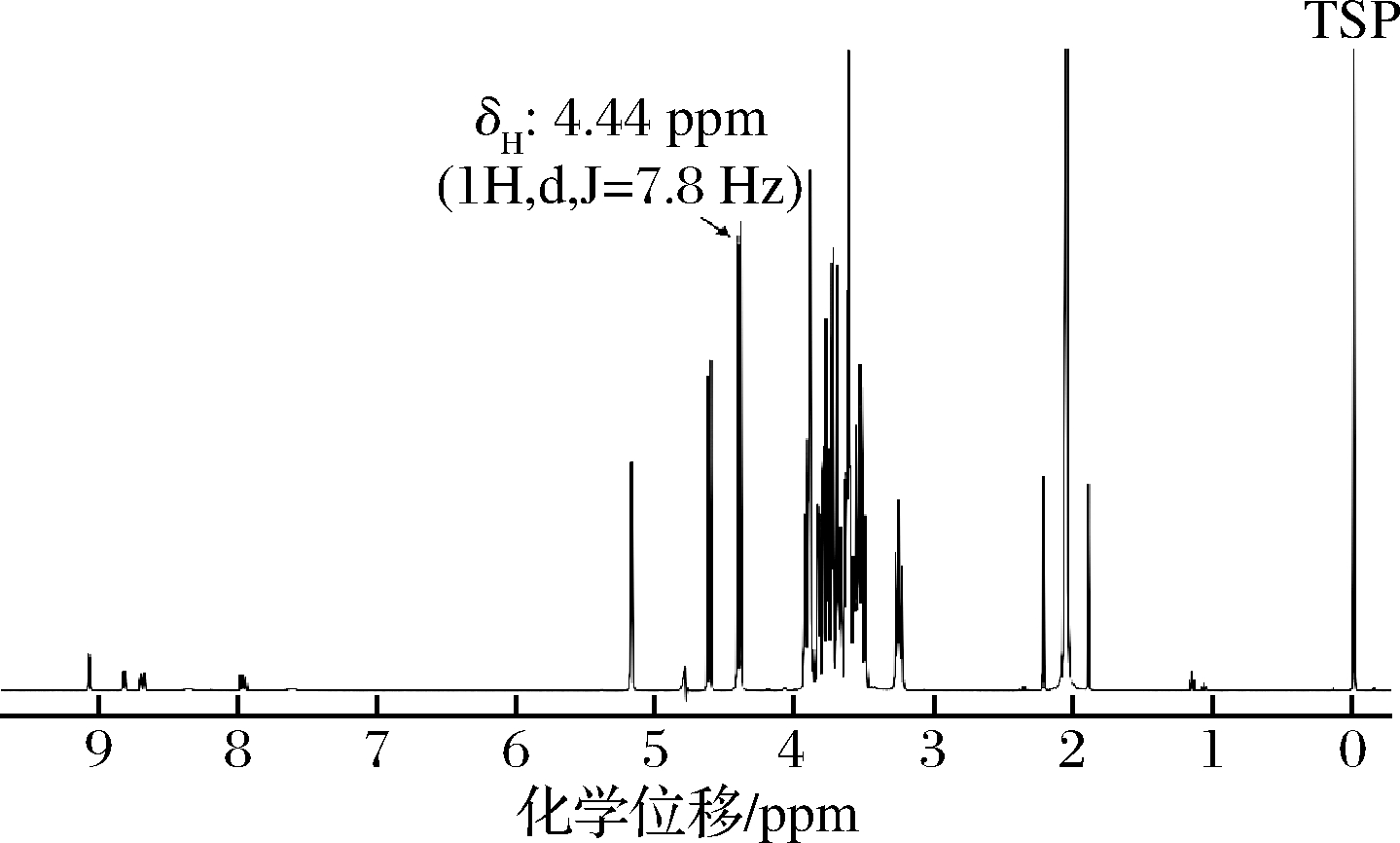
图2 以TSP为内标的乳糖1H NMR谱图
Fig.2 The1H NMR spectra of lactose with TSP as internal standard
2.2 内标和外标物的选择
外标和内标参考物的选择应当满足一般核磁定量检测对外标和内标物质的要求,其化学性质稳定,结构简单,在1H NMR图谱中具有独特的化学位移,易辨认识别,内标物不能与待测样品产生化学反应,易溶于待测样品,信号与待测样品信号无重叠。柠檬酸和烟酰胺完全满足以上条件,柠檬酸1H NMR图谱特征信号峰在δH 2.81和δH 2.96 ppm处2组特征信号双峰完全对称,如图3所示,易于辨认,积分准确。烟酰胺能溶于牛奶样品,烟酰胺1H NMR图谱在δH 9.17 ppm特征信号峰不与牛奶基质中各种其他化合物信号峰发生重叠,因此,选用柠檬酸和烟酰胺作为1H NMR定量方法的内标和外标参考物质。

图3 柠檬酸1H NMR谱图
Fig.3 The1H NMR spectra of citric acid
2.3 方法学考察
2.3.1 精密度分析
选取一份牛奶样品,采用1H NMR方法,同一天内重复测定5次,分析该方法的日内精密度;重复测定5 d,测定结果取每日测定量的平均值,进行内标法和外标法的日间精密度分析,结果如表1、表2所示。由表1、表2可知,以柠檬酸作为PULCON的外标参考物,方法的日内和日间精密度RSD分别为0.58%和0.56%;以烟酰胺作为内标参考物,方法的日内和日间RSD分别为0.42%和0.94%。内标法和外标方法的日内和日间RSD均小于1%;采用T检验法分析日内与日间同一牛奶样品中乳糖测定结果的差异性,统计结果表明日内与日间检测结果无显著性差异(P>0.05),以上表明1H NMR牛奶乳糖检测方法满足精密度的要求。
表1 外标法日间与日内精密度(n=5)
Table 1 Precision of intra-day and inter-day for external standard method(n=5)

类型乳糖测定值/(g·L-1)12345均值/(g·L-1)RSD/%日内33.733.533.833.333.533.60.58日间33.633.333.333.233.133.30.56
表2 内标法日间与日内精密度(n=5)
Table 2 Precision of intra-day and inter-day for internal standard method(n=5)

类型乳糖测定值/(g·L-1)12345均值/(g·L-1)RSD/%日内38.938.839.238.838.938.90.42日间38.639.038.638.138.238.50.94
2.3.2 加标回收率分析
2.3.2.1 外标法
在同一份牛奶样品中分别加入7.5、25.0、50.0 和100.0 g/L 4份不同浓度水平的乳糖标准品溶液,每个质量浓度水平平行重复5次,采用PULCON柠檬酸外标法进行定量分析,定量结果取5次重复测定的平均值,如表3所示。
表3 外标法回收率(n=5)
Table 3 Recovery of external standard method(n=5)
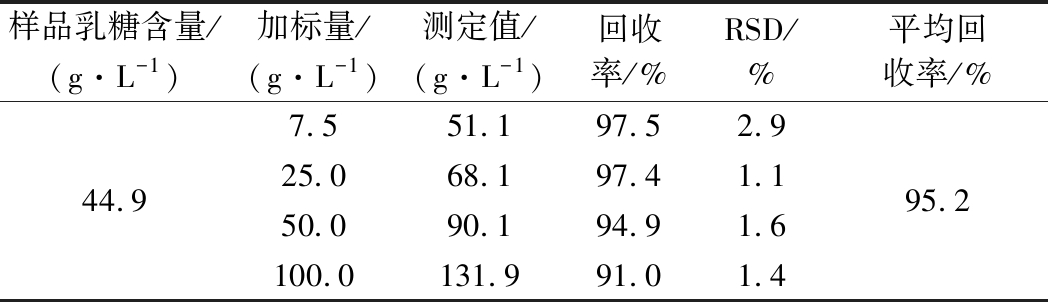
样品乳糖含量/(g·L-1)加标量/(g·L-1)测定值/(g·L-1)回收率/%RSD/%平均回收率/%44.97.551.197.52.925.068.197.41.150.090.194.91.6100.0131.991.01.495.2
由表3可知,在4个不同加标质量浓度水平下,PULCON柠檬酸外标法的回收率在91.0%~97.5%,其平均回收率为95.2%,且回收率的RSD为1.1%~2.9%,结果表明以柠檬酸作为PULCON外标参考物,1H NMR方法精确度良好,能够满足牛奶中乳糖含量的准确定量测定。
2.3.2.2 内标法
在同一份牛奶样品中分别加入7.5、25.0、50.0和100.0 g/L 4份不同浓度水平的乳糖标准品溶液,每个质量浓度水平平行重复5次,采用烟酰胺内标法进行定量分析,定量结果取5次重复测定的平均值,如表4所示。由表4可知,在4个不同加标质量浓度水平下,烟酰胺内标法的回收率为95.4%~99.5%,其平均回收率为97.6%,回收率的RSD为1.0%~1.7%,结果表明以烟酰胺作为内标参考物,1H NMR方法精确度良好,能够满足牛奶中乳糖含量的准确定量测定。
表4 内标法回收率(n=5)
Table 4 Recovery of internal standard method(n=5)
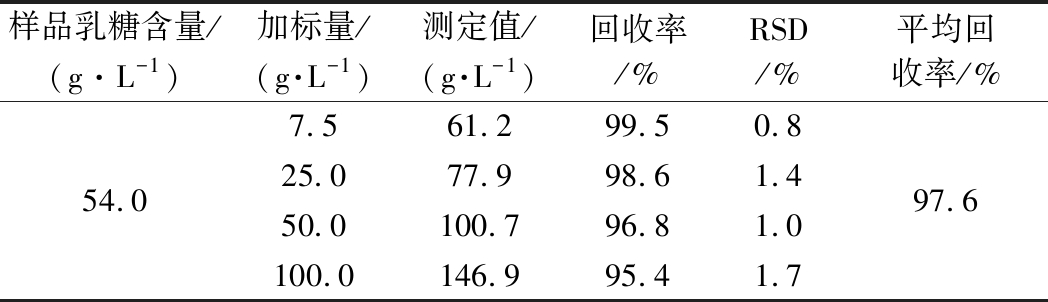
样品乳糖含量/(g·L-1)加标量/(g·L-1)测定值/(g·L-1)回收率/%RSD/%平均回收率/%54.07.561.299.50.825.077.998.61.450.0100.796.81.0100.0146.995.41.797.6
2.3.3 方法精确性分析
应用上述已经建立的1H NMR内标和外标定量方法和国标GB 5413.5—2010《食品安全国家标准 婴幼儿食品和乳品中乳糖、蔗糖的测定》高效液相色谱法分别对市售15个不同种类牛奶样品基质中的乳糖含量进行检测,每个样品平行前处理2次,每个样品重复测定2次,定量测定结果取平均值,结果如表5所示,进一步统计分析1H NMR法与国标法检测结果的差异。由表5可知,当牛奶中乳糖含量为0.80 g/L,国标GB 5413.5—2010高效液相色谱法未检出,1H NMR法有检出,产生差异的原因主要是由于国标GB 5413.5—2010高效液相色谱法[21]样品前处理规定液态试样称取2.5 g于50 mL容量瓶中,加入15 mL 50~60 ℃水溶解,用乙腈定容至刻度,静置后过滤。然后取5.0 mL过滤液于10 mL容量瓶中,用乙腈定容,至此样品已经稀释了约40倍,且引入了乙腈有毒试剂;然而1H NMR法样品前处理基本不稀释,因此1H NMR法比国标GB 5413.5—2010高效液相色谱法检测灵敏度更高。以国标高效液相色谱法测定结果为横坐标,分别以1H NMR柠檬酸外标和烟酰胺内标法的定量结果为纵坐标做线性回归,其线性回归系数R2分别为0.96和1.01,表明1H NMR与国标GB 5413.5—2010高效液相色谱法测定结果误差在±5%以内,满足方法的可行性验证要求,研究结果表明1H NMR定量法可以广泛用于市售不同种类牛奶中乳糖含量的准确测定。
表5 核磁共振波谱法与高效液相色谱法牛奶中乳糖测定结果 单位:g/L
Table 5 Lactose content in milk products by NMR and HPLC
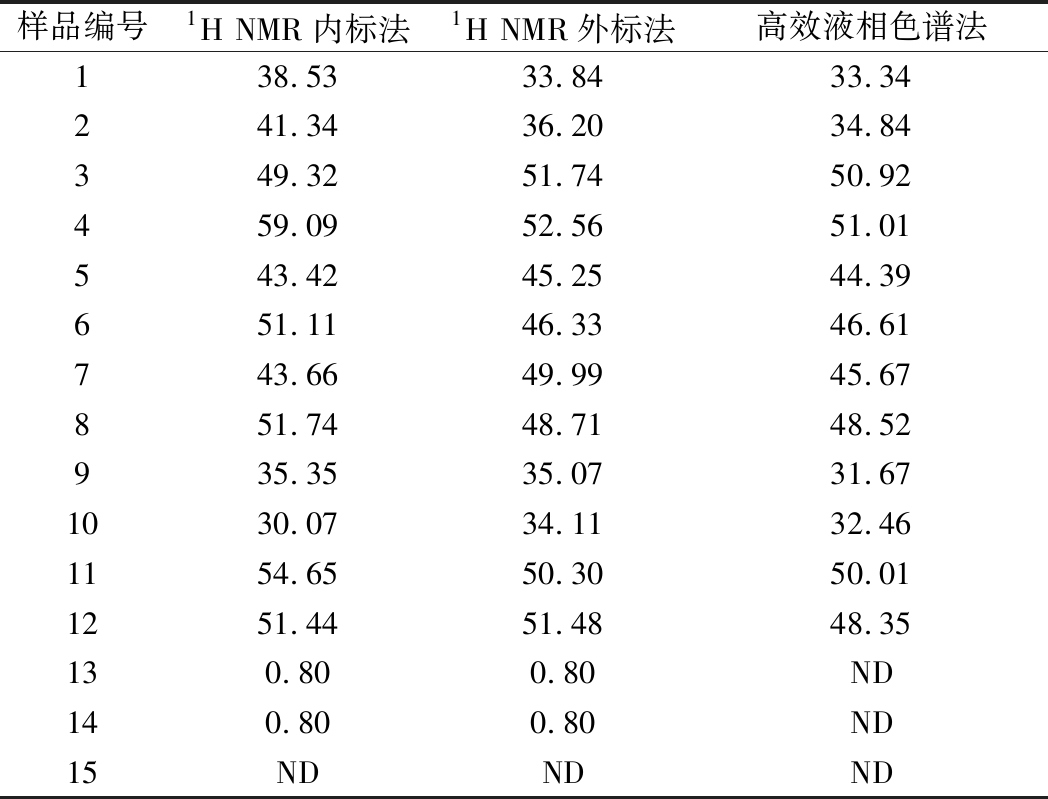
样品编号1H NMR内标法1H NMR外标法高效液相色谱法138.5333.8433.34241.3436.2034.84349.3251.7450.92459.0952.5651.01543.4245.2544.39651.1146.3346.61743.6649.9945.67851.7448.7148.52935.3535.0731.671030.0734.1132.461154.6550.3050.011251.4451.4848.35130.800.80ND140.800.80ND15NDNDND
注:ND为未检出
3 结论
本研究建立了1种1H NMR技术方法实现了快速准确定量检测牛奶中乳糖含量。该方法的检出限为0.05 g/L(S/N=3),定量限为0.2 g/L(S/N=10);在质量浓度0.05~25.60 g/L内线性关系良好(R2=0.99);烟酰胺内标法平均加标回收率为97.6%,日内与日间RSD分别为0.42%和0.94%;柠檬酸外标法平均加标回收率为95.2%,日内与日间RSD分别为0.58%和0.56%;1H NMR测定方法重现性好;1H NMR定量法和GB 5413.5—2010高效液相色谱法测定结果误差在±5%以内,测定结果准确。1H NMR定量法相比于GB 5413.5—2010莱因―埃农氏法,样品前处理操作简便,省时省力,无需使用腐蚀性试剂,大批量样品检测成本较低。相比于GB 5413.5—2010高效液相色谱法,样品无需稀释,不引入乙腈等有毒试剂,检测灵敏度高,能够满足对于牛奶中乳糖含量的检测要求,可广泛应用于牛奶制品质量控制和掺假鉴别。
[1] 管健.牛乳中乳糖的快速测定[J].中国乳品工业,1991,19(2):66-67.
GUAN J.A rapid method for determination of lactose in milk[J].China Dairy Industry,1991,19(2):66-67.
[2] 李梅梅.基于拉曼光谱生物样品中乳糖的检测及其应用[D].上海:上海师范大学,2015.
LI M M.Detection and application of lactose in biological samples based on Raman spectroscopy[D].Shanghai:Shanghai Normal University,2015.
[3] 郑秋鹛,刘希宋.中国乳业屡次事件引发的思考[J].学术交流,2008(12):125-128.
ZHENG Q P,LIU X S.Reflections on the frequent events in China's dairy industry[J].Academic Exchange,2008(12):125-128.
[4] 高亚滨.如何解决乳糖不耐症[J].中国乳品工业,1997,25(1):40-42.
GAO Y B.How to solve lactose intolerance[J].China Dairy Industry,1997,25(1):40-42.
[5] 张忠义,刘振林,范华峰.牛奶中乳糖的快速旋光仪测定[J].中国卫生检验杂志,2001(4):434-435.
ZHANG Z Y,LIU Z L,FAN H F.Rapid polarimeter determination of lactose in milk[J].Chinese Journal of Health Inspection,2001(4):434-435.
[6] 马夫侠,张晓东,秦翠霞.低乳糖牛奶的工艺参数研究[J].食品工业科技,2002,23(1):50-52.
MA F X,ZHANG X D,QIN C X.Study on processing parameter of low lactose -containing[J].Science and Technology of Food Industry,2002,23(1):50-52.
[7] 陶兆林,张世满,司友琳.分光光度法测定乳制品中的乳糖[J].中国卫生检验杂志,2001,11(1):50-51.
TAO Z L,ZHANG S M,SI Y L.Determination of lactose in dairy products by spectrophotometry[J].Chinese Journal of Health Inspection[J].Chinses Journal of Health Laboratory Technology,2001,11(1):50-51.
[8] AD NYI N,SZAB
NYI N,SZAB E E,V
E E,V RADI M.Multi-enzyme biosensors with amperometric detection for determination of lactose in milk and dairy products[J].European Food Research and Technology,1999,209(3-4):220-226.
RADI M.Multi-enzyme biosensors with amperometric detection for determination of lactose in milk and dairy products[J].European Food Research and Technology,1999,209(3-4):220-226.
[9] 刘美霞,张河霞,朱炜,等.试剂盒法检测低乳糖牛奶中乳糖质量分数的方法[J].中国乳品工业,2011,39(7):56-58.
LIU M X,ZHANG H X,ZHU W,et al.Kit method for determination of lactose content in low lactose milk[J].China Dairy Industry,2011,39(7):56-58.
[10] 唐玉莲.近红外光谱在乳制品成分快速检测方面的应用研究[J].乳业科学与技术,2009,32(4):190-194.
TANG Y L.Study on near infrared sepectroscopy technique for composition detection of dairy production[J].Journal of Dairy Science and Technology,2009,32(4):190-194.
[11] 李亚如,许佳翠,蔡耀荣,等.牛奶中乳糖含量的测定[J].当代化工,2017,46(5):1 014-1 016.
LI Y R,XU J C,CAI Y R,et al.Determination of lactose content in milk[J].Contemporary Chemical Industry,2017,46(5):1 014-1 016.
[12] HOULT D I,RICHARDS R E.The signal-to-noise ratio of the nuclear magnetic resonance experiment[J].Journal of Magnetic Resonance(1969),1976,24(1):71-85.
[13] HOULT D I.The principle of reciprocity in signal strength calculations-A mathematical guide[J].Concepts in Magnetic Resonance,2000,12(4):173-187.
[14] VAN DER KLINK J J.The NMR reciprocity theorem for arbitrary probe geometry[J].Journal of Magnetic Resonance,2001,148(1):147-154.
[15] BARANTIN L,PAPE A L,AKOKA S.A new method for absolute quantitation MRS metabolites[J].Magnetic Resonance in Medicine,1997,38(2):179-182.
[16] AKOKA S,BARANTIN L,TRIERWEILER M.Concentration measurement by proton NMR using the ERETIC method[J].Analytical Chemistry,1999,71(13):2 554-2 557.
[17] 吉鑫,樊双喜,杨彤晖,等.核磁共振法测定食品中水苏糖的含量[J].食品与发酵工业,2019,45(19):251-257.
JI X,FAN S X,YANG T H,et al.Quantitative determination of stachyose in foods by NMR[J].Food and Fermentation Industries,2019,45(19):251-257.
[18] HU F Y,FURIHATA K,ITO-ISHIDA M,et al.Nondestructive observation of bovine milk by NMR spectroscopy:Analysis of existing states of compounds and detection of new compounds[J].Journal of Agricultural and Food Chemistry,2004,52(16):4 969-4 974.
[19] 姜洁,李玮,路勇,等.核磁共振脉冲宽度法测定婴幼儿乳粉中乳糖、蔗糖含量[J].食品工业科技,2015,36(8):68-71;77.
JIANG J,LI W,LU Y,et al.Determination of lactose and sucrose in infant formula milk powder by PULCON 1H-NMR method[J].Science and Technology of Food Industry,2015,36(8):68-71;77.
[20] MONAKHOVA Y B,KUBALLA T,LEITZ J,et al.NMR spectroscopy as a screening tool to validate nutrition labeling of milk,lactose-free milk,and milk substitutes based on soy and grains[J].Dairy Science & Technology,2012,92(2):109-120.
[21] GODELMANN R,KOST C,PATZ C D,et al.Quantitation of compounds in wine using 1H NMR spectroscopy:Description of the method and collaborative study[J].Journal of AOAC INTERNATIONAL,2016,99(5):1 295-1 304.