保健食品是指具有特定保健功能或者以补充维生素、矿物质为目的的食品,适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品[1-3]。目前保健食品可以申报的功能有27类,其中缓解体力疲劳类保健食品就是通过保健食品中的功效成分对人体进行修复和调整,提升人体的精气神,缓解体力疲劳[4]。但是不法商家在利益的驱使下,通过添加一些化学药品到缓解体力疲劳类保健食品中来增强效果,尤以大量添加治疗临床勃起功能障碍的化学药物最为普遍,其中最容易添加的是拉非和那非类[5-7]。而这些西药必须在医生的指导下才能使用,过量的使用他达拉非或者西地那非,容易导致神经系统、心血管系统、呼吸系统出现异常等现象[8-10]。2020年四平市食品药品检验所共筛查壮阳类保健品206批,其中185批含有非法添加成分枸橼酸西地那非,检出率高达89.8%。因此对保健食品中的非法添加物质进行检测是非常有意义的[11]。
目前保健食品中禁限用物质的检测方法主要是色谱[12-13]、色谱质谱联用技术[14-15]和免疫分析技术[16-17]等。其中色谱技术包括高效液相色谱、气相色谱、离子色谱等,色谱质谱联用包括气质联用、液质联用等,均具有检测精密度高、准确性好等优点[18-19],但是需要专门的仪器设备,专人技术人员操作,并且前处理与检测时间长,适用于实验室小批量样品的检测。免疫分析检测包括放射性免疫分析技术、酶免疫分析技术和金标免疫分析技术等[20]。免疫分析方法均具有特异性强、灵敏度高、准确、快速、操作简便等优点[21-23],其中放射性免疫分析技术使用的放射性同位素存在辐射和污染,常规的酶联免疫检测与金标免疫检测一次只能检测一种违禁药物,若要对同一种物质的多种违禁药物同时进行检测需要进行多次实验,操作繁琐费时,因此,亟需建立一种能够同时检测多种违禁药物的新型检测方法。
本实验制备金标记他达拉非-西地那非单克隆抗体,建立他达拉非与西地那非联检速测卡,并对联检速测卡的灵敏度、准确性及稳定性进行实验。
1 材料和方法
1.1 材料与设备
他达拉非标准品、西地那非标准品,德国Dr.Ehrenstorfer公司;他达拉非(抗原11.3 mg/mL,抗体8.5 mg/mL)、西地那非(抗原14.5 mg/mL,抗体9.8 mg/mL),广州优抗多生物技术有限公司;羊抗鼠二抗(5 mg/mL),洛阳佰奥通实验材料中心;60份缓解疲劳类保健品样品,第三方检测单位。
牛血清白蛋白(bovine serum albumin,BSA),北京正将高科公司;氯金酸,国药集团化学试剂有限公司;聚乙二醇(polyethylene glycol,PEG)、三羟甲基氨基甲烷(Tris),北京鼎国生物;柠檬酸三钠、磷酸二氢钠、碳酸钾、磷酸氢二钠、磷酸二氢钠、甲醇,广州化学试剂厂;曲拉通100、聚乙烯吡咯烷酮(PVP40)、三(羟甲基)氨基甲烷、海藻糖、酪蛋白,广州国药中心;硝酸纤维素膜,Sartorius;玻璃纤维,韩感中国;吸水纸、pvc底板、铝箔袋,广州正明生物科技有限公司;表面活性剂S9(Tetronic1307)、表面活性剂S17(RHODASURF ON-870)、表面活性剂S21(BRIJ 35),扬州惠尔科技有限公司;吐温-20、吐温-100,默克化工技术(上海)有限公司。
R5DD-2连续点膜机,韩感;85-2数显恒温磁力搅拌器,常州越新仪器制作有限公司;HM3030三维划膜喷金仪、WM-100金标试纸分切机,上海金标生物科技有限公司;TGL-16M高速台式冷冻离心机,湖南湘仪实验设备有限公司;紫外分光光度仪,广州分析测试中心;JEM 1400透射电镜,日本电子株式会社;Nano Series Nano AS90型粒度测定仪,英国马尔文仪器有限公司;Agilent 1200液相色谱-6410 三重四极杆串联质谱仪,Agilent 公司。
1.2 试验方法
1.2.1 溶液的配制
PBS缓冲液(pH 7.2~7.4):称取7.9 g NaCl,0.2 g KCl,0.24 g KH2PO4和1.8 g K2HPO4,溶于800 mL蒸馏水中,用HCl溶液调节溶液pH值至7.4,最后加蒸馏水定容至1 L。保存于4 ℃冰箱中备用。
他达拉非标准工作液:精密称取10.00 mg他达拉非标准品用甲醇定容至10 mL,配制质量浓度为1 mg/mL的他达拉非标准储备液;精密移取5 mL储备液用PBS定容至50 mL,配制100 μg/mL的他达拉非标准工作液。
西地那非标准工作液:精密称取10.00 mg西地那非标准品用甲醇定容至10 mL,配制质量浓度为1 mg/mL的西地那非标准储备液;精密移取5 mL储备液用PBS溶液定容至50 mL,配制100 μg/mL的西地那非标准工作液。
重悬液:称取三羟甲基氨基甲烷(Tris)5.85 g,蔗糖2.5 g,海藻糖2.5 g,BSA 1 g溶于150 mL水中,再加入2 mL吐温-20。
1.2.2 胶体金溶液的制备
金溶胶的光散射性与溶胶颗粒的大小密切相关,一旦颗粒大小发生变化,光散射也随之发生改变,产生肉眼可见的显著的颜色变化,这就是金溶胶用于免疫沉淀或免疫凝集试验的基础[24-26]。
利用柠檬酸三钠还原法制备金纳米粒子,还原剂的含量与金纳米粒子的粒径大小密切相关。在其他条件保持不变的情况下,仅改变加入的柠檬酸三钠的含量,可制得不同颜色的金溶胶,即不同粒径的金溶胶。其中在紫红色向酒红色过渡的过程中,溶液最大吸收波长528 nm的吸光度峰值最高,为最好的金颗粒选择条件[25,27]。
柠檬酸三钠的含量优化:取6个150 mL的圆底烧杯进行铬酸浸泡后用纯水进行洗涤,随后分别加入质量分数0.01%氯金酸水溶液100 mL,用加热型磁力搅拌器加热至沸腾,在搅拌状态中于6个圆底烧杯中分别加入质量分数1%柠檬酸三钠水溶液0.3、0.45、0.7、1.0、1.5、2.0 mL,金黄色的氯金酸水溶液在5 min内变色,保持沸腾15 min后停止加热,冷却后用蒸馏水定容到原体积,通过紫外分光光度仪、透射电镜观察选择最佳颜色、吸收峰及粒径指标。
将最优的胶体金溶液装入棕色密封容量瓶中,避光4~10 ℃保存待用。
1.2.3 金标记他达拉非和西地那非单克隆抗体的制备
取6个1.5 mL的离心管,各吸取1 mL胶体金溶液于洁净离心管中,加入一定量0.1 mol/L碳酸钾溶液调节胶体金溶液pH值至6.5,混匀5 min后,在一系列装有1 mL胶体金溶液的试管中加入他达拉非/西地那非抗体量分别为0.1、0.2、0.4、0.6、0.8、1.0 μL,振荡混匀,室温放置20 min后,观察离心管颜色,使溶液颜色保持红色的最低浓度为最适抗体浓度。
在确定的最适金标抗体浓度中加入质量分数10% BSA封闭15 min;在冷冻离心机11 000 r/min离心15 min,去除上清液后加入100 μL重悬液(标记上的抗体胶体金,10倍浓缩),分别得到金标记他达拉非和西地那非单克隆抗体溶液。
1.2.4 金标抗体结合垫的制备
设定金标喷金仪仪器程序,喷金体积为3 μL/cm2,速度为100 mm/s,将烘干好的样品垫放置在喷金仪平台上,设定好仪器,分别将标记好的金标记他达拉非和西地那非单克隆抗体溶液均匀地喷在金垫上后在烘房(35~40 ℃)放置6 h,待测。
1.2.5 样品垫的制备
样品垫处理液的选择:制备20份基础液,取400 mL PBS液体,加入2.75 g海藻糖、1.5 g BSA、1.9 g酪蛋白、1 mL曲拉通100作为基础液。
配制不同浓度的吐温-100、吐温-20、表面活性剂S9、S17、S21作为样品垫处理液分别加入到基础液中,充分混匀,取适量的玻璃纤维完全浸泡,浸泡时间8~10 s,静置后50 ℃烘箱烘烤10 h至完全烘干,组装试剂卡后配合金标垫使用,对比不同样品垫处理液对胶体金免疫分析显色效果的影响,筛选合适的样品垫处理液体系。
1.2.6 划膜
配制他达拉非抗原划膜液:将原质量浓度他达拉非抗原(11.3 mg/mL)用质量分数1%海藻糖PBS溶液稀释至0.5 mg/mL(30 μL);
配制西地那非抗原划膜液:将原质量浓度西地那非抗原(14.5 mg/mL)用PBS稀释至0.3 mg/mL(30 μL);
配制二抗划膜液:将原质量浓度羊抗鼠二抗(5 mg/mL)用1%海藻糖5%甲醇PBS溶液稀释至1 mg/mL(60 μL)。
将配制好的划膜液倒吸在划膜针管上,硝酸纤维素膜粘在PVC底板上,放置于划膜仪平台,设定划膜仪主机程序,划膜宽度为0.8 μL/cm,速度为110 mm/s;将包被好的硝酸纤维素膜放置于温度35~40 ℃、湿度30%下的烘房或烘箱,烘干24~48 h,干燥后封袋保存备用,使他达拉非-OVA所划线标记为检测线T1,西地那非-OVA所划线标记为检测线T2,羊抗鼠二抗所划线标记为质控线C。
1.2.7 胶体金免疫层析他达拉非-西地那非联检速测卡组装
将样品垫、胶体金垫、已包被好抗原和二抗的硝酸纤维素(nitrocellulose filter,NC)膜、吸水纸依次粘贴到PVC底板上,切割成条,装卡封口密封,置于干燥器中常温保存备用。
该法将他达拉非偶联OVA,西地那非偶联OVA作为包被抗原分别划在NC膜上,当样品不含有他达拉非(西地那非)或含量低于其检测灵敏度时,金标垫上释放的金标记特异性抗体与NC膜上的他达拉非(西地那非)偶联OVA结合,因而被截留在该处显红色线。但当样品中他达拉非(西地那非)的含量高于其检测灵敏度时,金标记特异性抗体会先与他达拉非(西地那非)结合,当流到他达拉非(西地那非)偶联OVA检测线时,则仅有少量或没有金标记特异性抗体能与相应的包被抗原结合,此时在他达拉非(西地那非)上的检测线不显色或者颜色弱于质控线。无论样品中是否含有他达拉非(西地那非),金标记鼠源特异性单克隆抗体都能与质控线上的羊抗鼠二抗结合形成胶体金滞留而显红色。因此,结果的判定为当T线的颜色与C线的颜色一样或者强于C线时,结果为阴性;当T线的颜色弱于C线,或者无色时,结果为阳性;当C线无色时,则该试纸条无效。
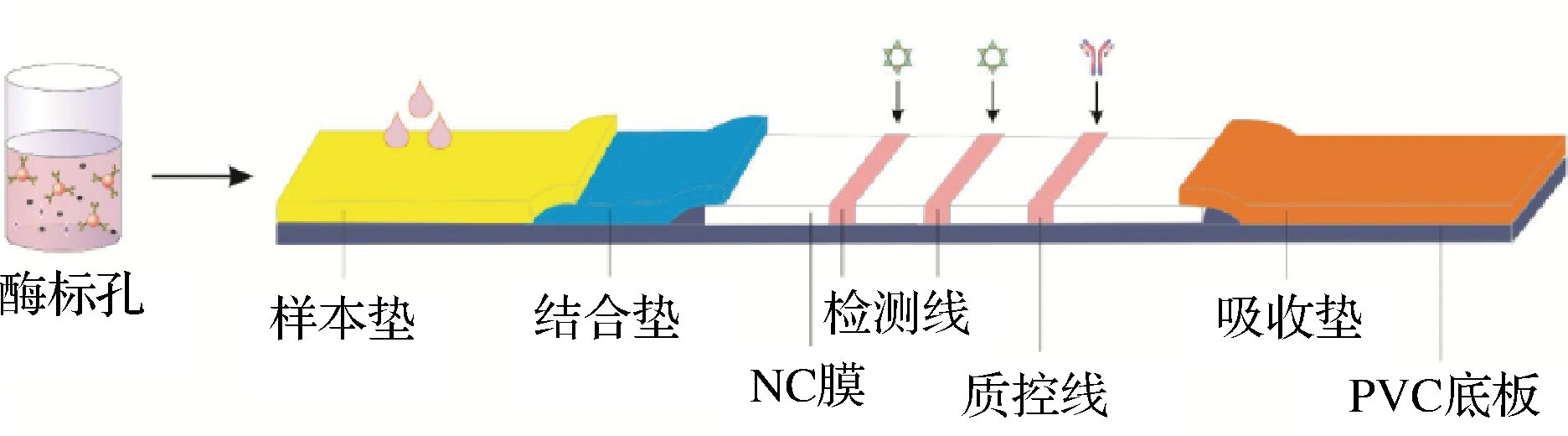
图1 试纸条结构示意图
Fig.1 Principle of the proposed colloidal gold based immunochromatography
1.2.8 样品制备
1.2.8.1 阴性样品的制备
采用第三方检测公司提供的40份他达拉非、西地那非阴性保健品样品。第三方检测公司依据质检总局发布的2014年第4批119项出入境检验检疫行业标准的通知“国质检认〔2014〕614号”,采用标准SN/T 4054—2014《出口保健食品中育亨宾、伐地那非、西地那非、他达那非的测定 液相色谱-质谱/质谱法》,用液质联用(HPLC-MS/MS)法对40份抗疲劳类保健样品(均为液体)进行测定,结果均为阴性。
1.2.8.2 他达拉非和西地那非加标阳性样品的制备
他达拉非(西地那非)加标阳性样品的制备:分别移取他达拉非(西地那非)标准工作液0.5、1、2 μL于999.0、998.0、996.0 μL阴性样品中混匀,配制成质量浓度为50、100、200 μg/L的他达拉非(西地那非)加标阳性样品。
1.2.8.3 实测阳性样品的准备
采用第三方检测公司提供的10份他达拉非与10份西地那非阳性保健品样品。第三方检测公司依据质检总局发布的2014年第4批119项出入境检验检疫行业标准的通知“国质检认〔2014〕614号”,采用标准SN/T 4054—2014,用HPLC-MS/MS法对20份抗疲劳类保健品样品(均为液体)进行测定,结果见表1。
表1 他达拉非与西地那非阳性样品结果 单位:μg/L
Table 1 Results for tadalafil and sildenafil positive samples

编号1234567891011121314151617181920他达拉非含量207216234256289212222235204240//////////西地那非含量//////////230226210247211258207204260237
注:编号1~10为他达拉非阳性保健品样品;编号11~20为西地那非阳性保健品样品;/表示未检出
1.2.9 灵敏度
分别用PBS溶液将他达拉非和西地那非标准品稀释至0、50、100、200 μg/L的样品液各10份。分别加100 μL于加样口,反应10 min,观察试纸条的显色情况,以T线显色最浅时的稀释度作为试纸条最低检测浓度。
1.2.10 假阳性率试验
采用他达拉非-西地那非联检速测卡对40份经HPLC-MS/MS检测为阴性的样品进行检测,并分别以含他达拉非/西地那非为0和100 μg/L的样品液作为阴性对照和阳性对照,计算假阳性率。
1.2.11 假阴性率试验
采用他达拉非-西地那非联检速测卡对40份阳性样品液(10份为200 μg/L他达拉非加标阳性样品,10份为200 μg/L西地那非加标阳性样品,10份他达拉非实测阳性样品,10份西地那非实测阳性样品)进行检测,并分别以含他达拉非/西地那非为0和100 μg/L的样品液作为阴性对照和阳性对照,计算假阴性率。
1.2.12 他达拉非-西地那非联检速测卡的重复性
测试基质为抗疲劳口服液,采用空白样品及他达拉非与西地那非添加量分别为200 μg/L的加标样本进行验证,取3个批号的检测卡进行检测,每一个水平10个平行,计算检出概率(probability of detection,POD)值(检出阳性结果次数占所有检测结果的比率)。
2 结果与分析
2.1 胶体金溶液的制备
由表2、图2可知,当1%柠檬酸加入量为1 mL时,制备的金溶胶颜色及粒径最适用于胶体金免疫层析检测,如此制备的金溶胶其可见光区最高吸收峰在525 nm。
2.2 金标记他达拉非-西地那非单克隆抗体的制备
胶体金溶液与不同质量浓度他达拉非-西地那非单克隆抗体结合,混匀静置后,通过颜色判断,使溶液保持通透红色,且使用量最低的为最适抗体质量浓度,最终确定他达拉非-西地那非单克隆抗体为8.5和7.84 μg/mL。
表2 氯金酸中柠檬酸三钠的加入量对金溶胶粒径的影响
Table 2 Effect of the amount of Trisodium citrate in chloroauric acid on the particle size of gold Sol
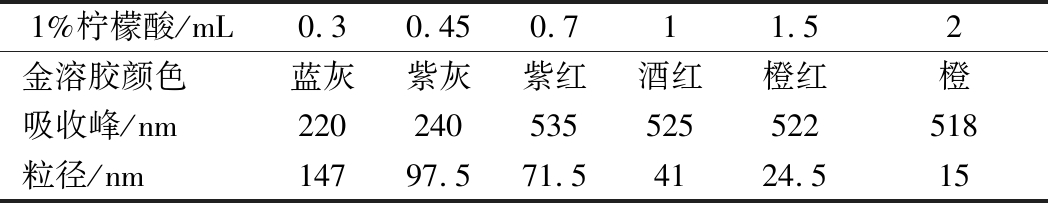
1%柠檬酸/mL0.30.450.711.52金溶胶颜色蓝灰紫灰紫红酒红橙红橙吸收峰/nm220240535525522518粒径/nm14797.571.54124.515

图2 金溶胶结合效果图
Fig.2 Results of Gold Sol binding effect
注:1~6分别表示1%柠檬酸0.3、0.45、0.7、1、1.5、2 mL
2.3 样品垫处理液的优化
处理液中加入表面活性剂可起到增溶的作用,促使分子的有效基团暴露并进行充分的反应,从而提升反应的灵敏度。由表3可知,基础液中添加不同的表面活性剂对样品测定时的显色效果影响较大,基础液中添加质量浓度为0.5%的吐温-20效果为最佳。
表3 不同表面活性剂的选择结果
Table 3 Selection results of different surfactant
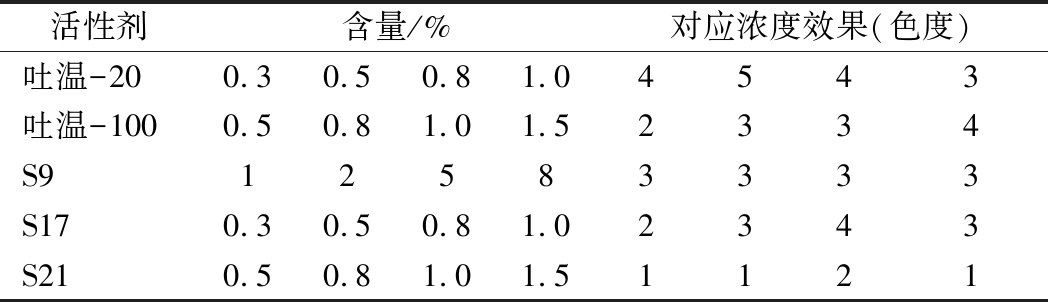
活性剂含量/%对应浓度效果(色度)吐温-200.30.50.81.04543吐温-1000.50.81.01.52334S912583333S170.30.50.81.02343S210.50.81.01.51121
2.4 灵敏度
如图3所示,他达拉非和西地那非在各梯度浓度下的显色检测呈现梯度变化。当他达拉非和西地那非质量浓度在200 μg/L时,2种检测物的检测线均无明显显色,质控线显色;2种检测物含量分别在50、100 μg/L时,检测线稍有显色,质控线显色;当样品中不含他达拉非和西地那非时,质控线和检测线都有明显的显色。这表明了所制备的胶体金免疫层析试纸条具有良好的敏感性与特异性,可判定该胶体金检

图3 梯度质量浓度显色结果
Fig.3 The results of color gradient concentration
测试纸卡对他达拉非和西地那非的检测限均为200 μg/L。此外,当滴液量为100~120 μL,判读结果无明显差异。但是当滴液量超过200 μL,胶体金试纸条会出现死金现象,或者层析垫因浸泡太多液体而出现假阳性。因此优选滴液量为100~120 μL。通过图3可知,检测卡的稳定性及色度辨析达到判读要求,可以实现现场快速检测,对监管检测工作提供便捷的检测利器。
2.5 假阳性率试验
对40份经HPLC-MS/MS法检测为阴性的样品进行检测,以他达拉非200 μg/L、西地那非200 μg/L为判定限进行判断,40份样品均为阴性,该40份样品的假阳性率为0,见图4。

图4 前10个样品显色结果
Fig.4 Color rendering results of the first 10 samples
2.6 假阴性率试验
他达拉非-西地那非联检速测卡对20份阳性样品进行检测,以他达拉非200 μg/L、西地那非200 μg/L为判定限进行判断,20份样品均为阳性,该20份样品的假阴性率为0,见表4。
表4 样品阳性样本检测结果
Table 4 Test results of positive samples
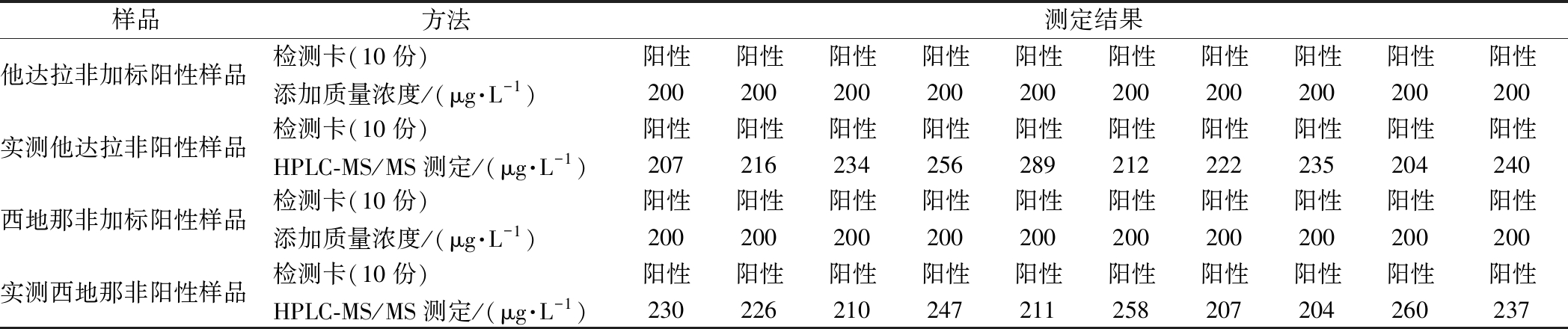
样品方法测定结果他达拉非加标阳性样品检测卡(10份)阳性阳性阳性阳性阳性阳性阳性阳性阳性阳性添加质量浓度/(μg·L-1)200200200200200200200200200200实测他达拉非阳性样品检测卡(10份)阳性阳性阳性阳性阳性阳性阳性阳性阳性阳性HPLC-MS/MS测定/(μg·L-1)207216234256289212222235204240西地那非加标阳性样品检测卡(10份)阳性阳性阳性阳性阳性阳性阳性阳性阳性阳性添加质量浓度/(μg·L-1)200200200200200200200200200200实测西地那非阳性样品检测卡(10份)阳性阳性阳性阳性阳性阳性阳性阳性阳性阳性HPLC-MS/MS测定/(μg·L-1)230226210247211258207204260237
2.7 他达拉非-西地那非联检速测卡的重复性测试
由表5可知,3个不同批次的他达拉非-西地那非联检速测卡的检测结果均未出现阳性反应,表明方法重复性较好。
表5 重复性测试结果
Table 5 Result of repeatability

试纸条批次POD 0 mg/LPOD 0.2 mg/L他达拉非POD 0.2 mg/L 西地那非101120113011
3 结论与讨论
目前还没有关于同时检测他达拉非与西地那非的免疫层析分析方法的报道。本文成功建立快速检测保健食品中非法添加抗疲劳药物他达拉非与西地那非联检速测卡,通过大量样本的测试,梯度浓度显色结果表明:他达拉非-西地那非联检速测卡的灵敏度分别为西地那非200 μg/L、他达拉非200 μg/L,质量浓度梯度性可以有效确认样本的半定量结果,整个检测时间不超过10 min。通过大批实际样品及加标样品的测试,假阳性率和假阴性率均为0,重复性好,达到预期的测试效果。同时通过测试,检测滴液量为100~120 μL。
该方法采用胶体金免疫层析技术,一个检测卡用于同一个样品中2种类似的违禁药物的检测,有效降低了制作成本,缩短检测时间,比单检技术更快捷方便,适应于抽检现场大批量的样品初筛。但是本研究没有体系化的测试检测卡的保质期,没法确保产品在长期保存条件下的稳定性,后续应进行保质期稳定性测试。
[1] 吴胜男,孙晓红,周艳,等.贵州省两城市居民保健食品知信行调查分析[J].现代预防医学,2017,44(7):1 191-1 193;1 197.
WU S N,SHUN X H,ZHOU Y,et al.Knowledge-Attitude-Practice of health food among residents in two cities of Guizhou[J].Modern Preventive Medicine,2017,44(7):1 191-1 193;1 197.
[2] 巩萍.营养相关慢性病人保健食品认知度和消费现状研究[D].济南:山东大学,2014.
GONG P.The study of congnition and consumption on health foods about patients with chronic disease related nutrition[D].Jinan:Shandong University,2014.
[3] 王浩,陈立功.中药在欧美国家注册管理概况[J].天津药学,2007,19(2):44-45;71.
WANG H,CHEN L G.Introduction of Chinese traditional medicine registration in EU and USA[J].Tianjin Pharmacy,2007,19(2):44-45;71.
[4] ROCHA T,AMARAL J S,OLIVEIRA M B P P.Adulteration of dietary supplements by the illegal addition of synthetic drugs:A review[J].Comprehensive Reviews in Food Science and Food Safety,2016,15(1):43-62.
[5] 曲晓宇,董雷,张四喜,等.HPLC-MS/MS法同时检测抗疲劳药物及保健品中非法添加的7种壮阳类化学药物[J].中国药房,2013,24(33):3 129-3 131.
QU X Y,DONG L,ZHANG S X,et al.Simultaneous detection of 7 illegal added anti-impotence medicines in anti-fatigue preparations and health care products by HPLC-MS/MS[J].China Pharmacy,2013,24(33):3 129-3 131.
[6] 龙凌云,李涛,邓永琪,等.HPLC-MS/MS法同时检测抗疲劳保健食品中非法添加的8种壮阳类化合物[J].农产品加工,2015(12):45-47.
LONG L Y,LI T,DENG Y Q,et al.Simultaneous detection of 8 illegal added anti-impotence medicines in anti-fatigue health care products by HPLC-MS/MS[J].Farm Products Processing,2015(12):45-47.
[7] 倪赞,张崇生.UPLC-MS/MS法测定补肾抗疲劳中成药及保健食品中非法添加的9种PDE-5抑制剂及其衍生物[J].中南药学,2018,16(9):1 295-1 299.
NI Z,ZHANG C S.Determination of 9 phosphodiesterase-5 inhibitors and its derivative illegally added to invigorant herbal medicines and dietary supplements by UPLC-MS/MS[J].Central South Pharmacy.September,2018,16(9):1 295-1 299.
[8] 徐硕,金鹏飞,徐文峰,等.补肾壮阳类药品中非法添加化学药物检测技术的研究进展[J].西北药学杂志,2017,32(5):677-680.
XU S,JIN P F,XU W F,et al.Research advances on analytical technologies of illegally adulterated chemical substances in medicines for invigorants[J].Northwest Pharmaceutical Journal,2017,32(5):677-680.
[9] ULLOA J,SAMBROTTA L,REDKO F,et al.Detection of a tadalafil analogue as an adulterant in a dietary supplement for erectile dysfunction[J].The Journal of Sexual Medicine,2015,12(1):152-157.
[10] 刘子雄,黄景辉,谭贵良,等.超高效液相色谱-串联质谱法测定保健食品中78种非法添加化学药物[J].现代食品科技,2020,36(12):283-292.
LIU Z X,HUANG J H,TAN G L,et al.Determination of 78 chemical drugs illegally added in health food by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Modern Food Science and Technology,2020,36(12):283-292.
[11] 黄朝辉,蔡丹丹,陈仲益,等.保健食品中他达拉非类似物去甲他达拉非的检测研究[J].中国药学杂志,2015,50(4):371-374.
HUANG Z H,CAI D D,CHEN Z Y,et al.Discovery of nortadalafil in health foods[J].Chinese Pharmaceutical Journal,2015,50(4):371-374.
[12] 林芳,李涛,王一欣,等.超高效液相色谱法同时测定降糖类保健食品中非法添加的13种化学药物[J].食品科学,2016,37(18):178-184.
LIN F,LI T,WANG Y X,et al.Simultaneous determination of 13 illegally added chemical drugs in hypoglycemic health foods by ultra performance liquid chromatography[J].Food Science,2016,37(18):178-184.
[13] 陈毓芳,林海丹,吴宏中,等.高效液相色谱法同时测定保健食品中11种功效成分[J].食品科学,2015,36(8):244-249.
CHEN Y F,LIN H D,WU H Z,et al.Simultaneous determination of 11 functional components in health foods by high performance liquid chromatography[J].Food Science,2015,36(8):244-249.
[14] ZHU X L,XIAO S,CHEN B,et al.Simultaneous determination of sildenafil,vardenafil and tadalafil as forbidden components in natural dietary supplements for male sexual potency by high-performance liquid chromatography-electrospray ionization mass spectrometry[J].Journal of Chromatography A,2005,1066(1-2):89-95.
[15] 许立,吴鸳鸯,寿林均,等.高效液相色谱-串联质谱法同时测定减肥类保健食品中27种违法添加化学药品[J].食品工业科技,2017,38(13):248-256;306.
XU L,WU Y Y,SHOU L J,et al.Simultaneous determination of 27 chemical drugs illegally added in slimming health food by high performance liquid chromatography-tandem mass spectrometry[J].Science and Technology of Food Industry,2017,38(13):248-256;306.
[16] 邓丽华.保健食品中他达那非类药物免疫检测方法研究[D].广州:华南农业大学,2 016.
DENG L H.Development of immunoassay for tadalafil and its analogues in health-care food[D].Guangzhou:South China Agricultural University,2016.
[17] 陈子键,曾道平,李美英,等.食品中褪黑素检测研究进展[J].食品工业,2015,36(11):233-238.
CHEN Z J,ZENG D P,LI M Y,et al.Advances in analytical method of melatonin in foods[J].The Food Industry,2015,36(11):233-238.
[18] 项昭保,伍晓玲,汪程远,等.色谱及其联用技术在保健食品非法添加药物检测中的应用研究进展[J].食品工业科技,2019,40(19):338-344.
XIANG Z B,WU X L,WANG C Y,et al.Research progress in the application of chromatography and its hyphenated techniques in the detection of illegally added drugs in health foods[J].Science and Technology of Food Industry,2019,40(19):338-344.
[19] 王静文,曹进,王钢力,等.保健食品中非法添加药物检测技术研究进展[J].药物分析杂志,2014,34(1):1-11.
WANG J W,CAO J,WANG G L,et al.Research progress on determination technologies for illegally added drugs in health food[J].Chinese Journal of Pharmaceutical Analysis,2014,34(1):1-11.
[20] 张丽霞,王学松.胶体金免疫层析技术在食品安全检测中的应用[J].广东化工,2021,48(1):180-181;163.
ZHANG L X,WANG X S.Application of colloidal gold immunochrom atography assay in food safety testing[J].Guangdong Chemical Industry,2021,48(1):180-181;163.
[21] 赵志高,骆骄阳,付延伟,等.免疫分析技术在农药残留分析中的研究进展及在中药中的应用展望[J].分析测试学报,2021,40(1):149-158.
ZHAO Z G,LUO J Y,FU Y W,et al.Research progress on immunoassay in pesticide residue analysis and its application prospect in chinese herbal medicine[J].Journal of Instrumental Analysis,2021,40(1):149-158.
[22] ZOU T T,YANG J Y,XU Z L,et al.Detection of tadalafil and its analogues in health wine and oral liquid by microwell lateral flow immunochromatography assay[J].Chinese Journal of Analytical Chemistry,2019,47(8):1 249-1 257.
[23] 刘源源,刘军,邹宇晓,等.抗疲劳功能食品检测评价研究进展及新思路[J].食品研究与开发,2016,37(2):209-213.
LIU Y Y,LIU J,ZOU Y X,et al.Research progress and new methods of detection and evaluation in anti-fatigue functional food[J].Food Research and Development,2016,37(2):209-213.
[24] 刘梯楼,孙双姣.金标记免疫共振散射光谱法测定牛初乳中免疫球蛋白G[J].湖南农业科学,2011(17):101-104.
LIU T L,SUN S J.Determination of IgG in bovine colostrum by using colloid gold labeling immune resonance scattering spectral assay[J].Hunan Agricultural Sciences,2011(17):101-104.
[25] 韩继美.胶体金免疫层析法对AFP、CEA和FN的快速检测[D].上海:上海师范大学,2009.
HAN J M.Development of rapid one-step colloidal gold immunochromatographic assay for detection of AFP,CEA and FN[D].Shanghai:Shanghai Normal University,2009.
[26] 刘会芹.免疫法检测D-二聚体的研究[D].青岛:青岛科技大学,2010.
LIU H Q.Study of D-dimer by immunity method[D].Qingdao:Qingdao University of Science and Technology,2010.
[27] 向知峰.基于胶体金标记的电化学免疫分析方法的研究[D].长沙:湖南师范大学,2005.
XIANG Z F.The study of the electrochemical immunoassay method based on the colloidal gold labeling[D].Changsha:Hunan Normal University,2005.