乳清是生产干酪时的副产物,乳清蛋白是生产干酪过程中进入乳清中的一类蛋白质,由浓缩工艺制备而得。乳清蛋白的功能性成分有乳球蛋白,乳白蛋白,免疫球蛋白,牛血清白蛋白(bovine serum albumin,BSA),另外,还有一些乳铁蛋白、乳过氧化酶、生长因子等具有特殊生物功能的成分,这些活性成分使乳清蛋白具备了有益于人体的诸多保健作用,因此是功能性食品的重要成分来源。在浓缩乳清蛋白时,选择合适的浓缩技术一方面可以有效的保留乳清蛋白的活性成分,另一方面可以节能减耗、降低成本。目前,膜浓缩技术已广泛应用于食品加工方面的研究。尽管该技术在对资源充分利用的同时达到了节能减排的效果,但是仍然存在膜污染等问题。如膜表面的膜孔堵塞和滤饼层的形成而引起膜污染,膜通量降低,导致生产率降低。因此迫切需要了解膜污染的形成机制以及开发有效的污染监测方法及预防策略,以预测和控制随时间变化的膜污染行为。
1 膜污染的形成及影响因素
膜污染形成过程可以分为3个阶段:第1阶段在超滤过程的前几分钟,小分子溶液不断透过膜,大分子溶质截留在膜表面,膜面的溶质浓度高于主体的浓度,形成浓度边界层,膜和溶液的界面上溶质浓度达到吸附的拟稳定状态[1];第2阶段在十几到几十分钟之间,溶质在膜表面和膜孔中不断吸附,膜通量迅速下降,该阶段对膜通量起控制作用,第3阶段为几十分钟后,随着溶质在膜表面的继续富集形成凝胶,膜通量下降速度比第2阶段要小[2]。
乳清废水中蛋白质主要包括β-乳球蛋白(β-lactoglobulin,β-LG)、α-乳清蛋白和BSA,此外还含有乳糖、矿物质和少量脂肪。乳清蛋白膜浓缩超滤过程中膜污染原因主要是乳清蛋白聚集体诱导或增强膜导致。这种现象是由于蛋白质-蛋白质和蛋白质-膜的相互作用力造成的,并且取决于不同的因素,例如pH,进料溶液的温度和组成,膜的特性(孔径和材料)以及操作条件(跨膜压力和错流速度)[3]。
1.1 pH对乳清蛋白超滤效果的影响
研究显示,在等于蛋白质等电点条件下膜污染严重[4-5]。通量在蛋白等电点处为最小值,而在较低和较高的pH值下通量均增加。主要是pH影响了原料液中蛋白质的溶解度和带电性,蛋白质在等电点处的溶解度最小,容易沉积吸附在膜表面[6]。BSA在不同pH条件下过滤,结果表明,初始通量和最终通量在pH 5时都显示出最小值,即在等电点处蛋白质的表面聚集和吸附表现出最大值。而在低于蛋白质的等电点处的pH发现了具有高通量和蛋白质传递值。同时发现过滤初期主要是蛋白质和膜的相互作用,而在过滤后期的高污染状态下,主要是蛋白质之间的相互作用导致膜污染增强[7]。另外,较低的溶液pH(pH 4和pH 5)下,由于静电吸引,BSA分子迅速而紧密地吸附在膜表面,随着溶液pH值的增加,静电排斥力越大,带负电的BSA分子在膜表面的吸附能力降低,逐渐形成滤饼层,膜通量更高[8]。ALMÉCIJA等[9]通过测量α-乳白蛋白(α-lactalbumin,α-LA)、β-LG、BSA、IgG和乳铁蛋白的通量-时间曲线以及截留率来评估pH对超滤过程的影响,在极端pH下(pH 3和pH 10)所有乳清蛋白和膜都具有相同的电荷符号(分别为正和负),由于排斥作用,膜污染降低。在pH 4和pH 5(最丰富的乳清蛋白的等电点附近),由于不带电的α-乳清蛋白,β-LG和BSA分子的聚集体沉积在膜上,膜污染严重。
因此,蛋白溶液pH对蛋白的溶解度以及超滤过程有着重要的影响,在高于或低于其pI的pH值下,蛋白质的净负电荷或正电荷有助于整体蛋白质的稳定性及膜运行时间的延长[10]。远离蛋白质等电点,使溶液中蛋白带有相同电荷,有助于降低超滤过程中蛋白质-蛋白质和蛋白质-膜之间的相互作用,增加膜通量,降低膜污染,延长膜运行时间。
1.2 温度对乳清蛋白超滤效果的影响
温度对蛋白在膜表面的沉积层结构有间接影响,如果排斥力较低,或由于热诱导疏水蛋白基团暴露于环境而引起范德华力增加,就会在膜表面形成致密的沉积层。对于热稳定性较低的BSA,随着温度升高,pH高于等电点时蛋白质吸附增加,而低于等电点时吸附不受影响。牛血清白蛋白变性会导致膜污染加剧,如果蛋白质疏水性增加,则蛋白质对固体表面(如膜)的吸附会增强。研究显示在乳清蛋白微滤过程中,温度≤10 ℃和>35 ℃时,因为吸附而导致的膜污染更易发生。10~30 ℃,污垢热阻与温度无关[11]。35~40 ℃,污垢热阻迅速提高。对于<20 ℃的过滤温度,通量下降是由于形成松散堆积的滤饼所致。温度>30 ℃时,平均污垢阻力和固体高度均增加,并形成了1个较高的总阻力(resistance force,RF)致密饼层。另一方面,由于乳清蛋白之间的排斥力随温度增加[12],导致污染阻力降低。高温下大量沉积物形成,过滤效率最低。当温度升高时,中性pH范围内的污染反应更强烈,这可能是由于硫醇/二硫化物反应速度加快和含钙蛋白质交联作用的结果。低温有助于蛋白超滤过程,5和13 ℃有助于蛋白有效结构的保留[13]。温度>50 ℃时,随着超滤时间的延长,就会在膜表面形成蛋白凝胶,发生不可逆的污染[14]。KENNETH等[15]研究了10、30和50 ℃下脱脂乳超滤(ultrafiltration,UF)过程中的通量下降行为。尽管通量较高,但在较高温度下进行超滤处理仍会导致较高的不可逆结垢率。在此温度范围内,污染物主要是由肽和α-LA组成的蛋白质,仅在50 ℃时存在少量β-LG,矿物质约占结垢物质的0.4%。可以认为,耐污垢性随加工温度的增加主要是由于α-LA沉积增加了膜孔污染,部分原因是在50 ℃时β-LG沉积。可能由于膜孔的热膨胀和β-LG的可逆构象变化。因此,乳清蛋白在超滤的过程中,通过提高温度可以短暂的提高膜通量,温度升高可以使膜孔径增加,提高膜通量,但是随着超滤时间的延长,温度的增加会使蛋白的疏水基团暴露,增加蛋白在膜表面的堆积,形成不可逆的污染。
1.3 跨膜压力(transmembrane pressure,TMP)对超滤效果影响
TMP对膜污染起着重要作用。低TMP下的膜过滤可以减轻污染和浓差极化,但通量较低。较高的TMP可以提高驱动力,提高初始通量但可能形成较大的浓差极化。JIANG等[16]研究了8 k,9 k和10 kPa 的TMP对膜过滤性能的影响。TMP为9 kPa的膜污染最小,而10 kPa的膜污染最大。推测膜污染主要由滤饼层模型引起,滤饼层模型也是10 kPa膜过滤的最重要的结垢机理。在8 k和10 kPa的TMP时,总抗污垢性主要来自于去除蛋白质,多糖大分子容易在膜表面聚集,导致可逆污染。蛋白质倾向于堵塞膜孔并导致不可逆的污染。在剪切应力[τ(w)]为45~341 Pa时,当施加极限跨膜压力时,通量显示随着壁面剪应力的增加几乎呈线性增加,并在临界τ(w)处达到峰值,τ(w)的进一步增加导致通量减小,直到稳定为止。结果发现,通量和蛋白质透过率都依赖于ΔPTM。当沉积层被压缩时,它对蛋白质的透过性降低[17]。β-LG和少量酪蛋白的渗透随着ΔPTM的增加而减少。随着ΔPTM的减小,通量逐渐减小。而高ΔPTM值可能会导致沉积层结构的不可逆改变,即沉积层中酪蛋白胶束的压缩形成蛋白质凝胶,最高跨膜压力决定了沉积层的结构以及过滤效率。在τ(w)恒定的情况下,沉积物的形成主要取决于初始施加的跨膜压力。此外,在恒定跨膜压力下壁面剪切应力的变化表明,在高τ(w)下孔隙相关的污染决定了过滤性能,而在低τ(w)时,则由沉积物相关的污染决定。
1.4 离子强度的影响
不同离子强度下蛋白质在超滤膜界面的微观作用行为显示,当离子浓度达到一定值,则会出现水合排斥力,削弱超滤膜与蛋白及蛋白与蛋白之间的相互作用力,进而导致超滤膜界面的蛋白质吸附沉积速率减缓,降低膜污染。DING等[18]为了系统地了解蛋白质的作用,在BSA存在情况下,研究了再生纤维素超滤膜(通常用于蛋白质分离)的性能,结果表明,由于BSA分子之间的强静电排斥力,在溶液高pH和低水温下可减轻膜污染。Na+和Ca2+均可增加膜通量。Ca2+在相邻的BSA分子之间起桥梁作用,可以通过与相邻蛋白质结合并减少其电荷来增强膜污染[19],Ca2+通过桥连效应将2个相邻羧基之间的离子桥形成BSA-Ca络合物,在Ca2+存在下,滤饼过滤模型是主要的膜污染模型。而Na+通过水合排斥力减轻了膜污染。对膜污染的影响顺序如下:Ca2+浓度>Na+浓度>pH>温度>胰蛋白酶浓度。此外,聚偏二氟乙烯超滤膜实验表明,Ca2+可以减少BSA引起的结垢。不同带电蛋白质微观作用力随离子强度(采用Na+)变化,观察蛋白质在膜表面吸附量及吸附层结构特征,结果表明,静电作用力是控制不同电性蛋白质膜污染的主要因素,但当BSA呈电中性和电负性时,离子强度达一定值时,Na+(水合阳离子)产生的水合排斥力则会减小蛋白质-蛋白质及蛋白质-膜之间的静电作用力,减轻膜污染。水合作用更易发生在BSA等电点处。由上可以看出,控制pH和离子强度是控制超滤过程中膜污染的重要因素[20]。
2 利用数学模型对膜污染问题的研究
通量的下降会对过滤过程生产率产生巨大影响,因此通过建立数学模型来预测膜通量的时间演变,将数学模型拟合到实验数据中。其中完全堵塞、中间堵塞、标准堵塞、滤饼形成等模型通常都被用来分析蛋白质过滤中的通量衰减问题。在利用这些模型进行研究的过程中,大多都表明了膜污染不仅仅是在膜表面形成,同时在也膜孔内沉积,而由于过滤条件的不同,污染的类型也随之改变。
2.1 串联阻力模型
在不同数学模型中,半经验模型既可以实现准确的预测,又可以确定主要的膜污染机制[21]。串联阻力模型是最常用的。CHOI等[22]采用串联阻力模型,表明了BSA吸附的微球在微滤过程中渗透通量下降,该模型考虑了2个污垢阻力:由于在膜表面形成滤饼层而产生的阻力和由于污垢分子在膜多孔结构内部的沉积。
CORBAT N-B
N-B GUENA等[23]使用3种截留分子质量和材料不同的超滤膜对不同蛋白质浓度的乳清模型溶液进行超滤。在本研究中串联阻力模型考虑了4种不同的阻力对渗透通量随时间的变化的贡献:原始的膜阻力,由于溶质在膜表面以及孔上的吸附引起的阻力,由于浓差极化引起的阻力,由于沉积的溶质分子形成的滤饼层的生长引起的阻力。因此,串联膜阻力模型如公式(1)所示:
GUENA等[23]使用3种截留分子质量和材料不同的超滤膜对不同蛋白质浓度的乳清模型溶液进行超滤。在本研究中串联阻力模型考虑了4种不同的阻力对渗透通量随时间的变化的贡献:原始的膜阻力,由于溶质在膜表面以及孔上的吸附引起的阻力,由于浓差极化引起的阻力,由于沉积的溶质分子形成的滤饼层的生长引起的阻力。因此,串联膜阻力模型如公式(1)所示:
(1)
式中:J,渗透通量;ΔP,跨膜压力;μ,进料溶液的黏度;Rm, 膜阻力;Rass,稳态吸附阻力;Rpss,稳态溶质浓差极化阻力;A,膜面积 ;m,沉积在膜表面的蛋白质含量;α0,比滤饼层阻力;b,溶质在膜表面的沉积速率;t,过滤时间。
为了确定在不同进料溶液和被测膜的结垢程度之间是否具有统计学上的显著差异,通过Statgraphics Centurion XVI软件进行了最小显著差异(least significant difference,LSD)测试。对于此分析,对每种膜和乳清模型溶液进行的每个超滤实验均重复10次,在所有情况下使用的置信区间为95%。拟合精度通过回归系数(R2)和标准偏差(standard deviation,SD)进行评估。在测试的所有膜和进料溶液中,由于吸附和浓差极化引起的阻力在操作的最初几分钟内占主导地位,是30 kDa膜结垢的主要原因。而滤饼形成导致的阻力在整个超滤时间内都增加了,这在15 kDa的膜过滤结束时尤为明显。串联阻力模型可以解释结垢阻力随时间的变化。进料溶液中蛋白质和盐的浓度越高,结垢程度越大。钙盐与乳清蛋白中的有机污垢分子中存在的羧基官能团特异性结合后,可以在有机污垢链之间形成桥梁,加速了带电有机分子的结垢,在膜表面形成了交联的结垢层,并形成严重膜污染。
2.2 组合模型
经典的膜污染模型通常可分为4种类型:膜孔堵塞,中间堵塞,膜孔收缩和滤饼过滤。在许多过滤过程中,单一的简单模型可能不足以给出良好的膜通量估算值。膜孔堵塞和滤饼模型的组合模型,用于蛋白质过滤中的蛋白质结垢[24]。由于最初阶段孔堵塞而引起的膜污染,以及由于在这些堵塞区域上形成饼层污染,导致膜污染的加聚,使膜阻力增加。同时,也有研究将膜孔堵塞和滤饼模型进行了一些改进用来描述错流过滤。CORBAT N-B
N-B GUENA等[23]使用了2个主要的结垢机理(完全堵塞和滤饼形成)和1个与时间相关的孔堵塞参数对渗透通量进行建模,该参数表示完全封闭的膜孔的分数,即被溶质分子堵塞的膜孔占总膜孔的比例。通过以下方法描述随时间变化的孔阻塞参数(α)的变化,其极限值(α0)和膜孔被完全堵塞的速率常数(b)。每种机理的方程式均取自适用于错流超滤的Hermia模型。
GUENA等[23]使用了2个主要的结垢机理(完全堵塞和滤饼形成)和1个与时间相关的孔堵塞参数对渗透通量进行建模,该参数表示完全封闭的膜孔的分数,即被溶质分子堵塞的膜孔占总膜孔的比例。通过以下方法描述随时间变化的孔阻塞参数(α)的变化,其极限值(α0)和膜孔被完全堵塞的速率常数(b)。每种机理的方程式均取自适用于错流超滤的Hermia模型。
下列数学方程式显示了Hermia模型适用于横流超滤以实现完全阻塞[公式(2)]和滤饼形成机理[公式(3)]以及在这项工作中开发的组合模型的一般方程式[公式(4)]:
JCPB=Jf+(Ji-Jf)exp(-KCPB·Jit)
(2)
(3)
Jmodel=α·JCPB+[1-α]·JCF·α=
α0(1-exp(-b·t))
(4)
式中:Ji,超滤试验开始时的实验渗透通量;Jf,超滤试验结束时的实验渗透通量;Jmodel,通过组合模型方程计算的渗透通量;JCPB,渗透通量用完整的孔阻塞方程计算;KCPB,完整的孔阻塞模型的Hermia常数;JCF,通过滤饼形成模型方程计算的渗透通量;KCF,滤饼形成模型的Hermia常数;α,孔阻塞模型参数;α0,孔隙阻塞参数的极限值;b,参数α增长的速率常数;t,过滤时间。
一旦获得了所有测试的进料溶液和膜的渗透通量数据,就可以使用基于Levenberg-Marquadt算法的最小二乘最小化曲线拟合方法(通过MathCad®软件的“Genfit”功能)。对于每种研究案例,计算回归系数和标准偏差以表示模型预测的准确性。为了概括获得的模型参数的值,使用Statgraphics Centurion XVI软件进行了多次回归分析,以将每个模型参数(KCPB,KCF,α0和b)与进料溶液特性(钙和蛋白质浓度)相关联。将钙和蛋白质浓度的值代入上述多元回归方程式,可以获得由组合模型预测的渗透通量下降,然后将其与实验数据进行比较。结果表明当在2 bar和2 ms-1下用5~30 kDa的膜对乳清模型溶液进行超滤时,该组合模型适合描述渗透通量的时间演变。并证实了组合模型适合于预测乳清模型溶液超滤中的渗透通量下降。但该文献中参数值并未能反映膜孔径变大而参数值变小的问题。
2.3 压力屈服流变模型
KARASU等[25]研究了用作模型流体的乳清蛋白浓缩物(whey protein concentrate,WPC)悬浮液的流变学。基于进料流所施加的剪切应力与所研究的流变学之间的关系确定污垢层顶部的浓度。体积分数大于凝胶点分数φgel的浓缩颗粒悬浮液形成网络,悬浮液的固相就会显示出正常的抗压缩应力。该应力称为压缩屈服应力Py。在压缩屈服应力模型中,结垢层的电阻αc随结垢层的局部体积分数φ而变化。
下列数学方程式通过将压缩屈服应力模型应用到LANDMAN等[26]提出的无端超滤中,建立了错流超滤渗透模型。该模型的详细说明如公式(5)所示:
体积分数之间的关系φ,和P 由公式(5)表示:
由公式(5)表示:
Py(φ)=0(0<φ≤φgel)
(5)
在该模型中,将结垢层顶表面的体积分数确定为屈服剪切应力等于剪切应力的体积分数。将模拟的预测值与实验结果进行比较。根据模拟结果,可观察到较高的TMP会使在结垢层中的颗粒之间形成更强的网络。另一方面,由于渗透过程的行为更为复杂。因此KARASU等[25]又对该模型进行了改进,在该模型中,认为通过孔堵塞机理引起的膜污染和可压缩滤饼层的发展同时发生。修改并耦合了孔隙阻塞模型和压缩屈服应力模型,以给出渗透通量的数值预测。为了构建模型,渗透过程分为3个部分:具有进料流的本体相,可压缩饼层和发生堵塞的膜。进料流施加的剪切应力与可压缩饼层顶部的体积分数有关。HO等[24]提出的孔隙堵塞模型适用于本研究。由于模型中的组合,每个计算步骤都需要迭代时间增量。通过改变孔隙堵塞因子α,蛋白质结垢的初始阻力Rp0和滤饼去除率υ作为模型参数来拟合模型。将基于模型的估计结果与实验结果进行比较,计算结果与实验数据拟合良好。根据本研究中提出的结果,可以得出结论,2种模型的组合使用能够解释整个错流过滤过程。
3 监测技术探究膜污染问题
通常根据渗透通量的减少或压力随时间的增加来监测膜结垢。常规技术没有提供关于结垢的位置、组成或数量的信息。膜结垢的原位实时监测可以提供有关结垢发展的动态信息。原位实时监控可理解为在线观察对信号变化的快速响应,并且无需将样品暴露于环境中。在线监测包括原位监测和在线监测。而原位监测包括将探针引入膜组件(侵入性)或通过该模块监测过程(非侵入性),以及在线监测手段以连续分析进料,截留物和/或渗透物流[27]。
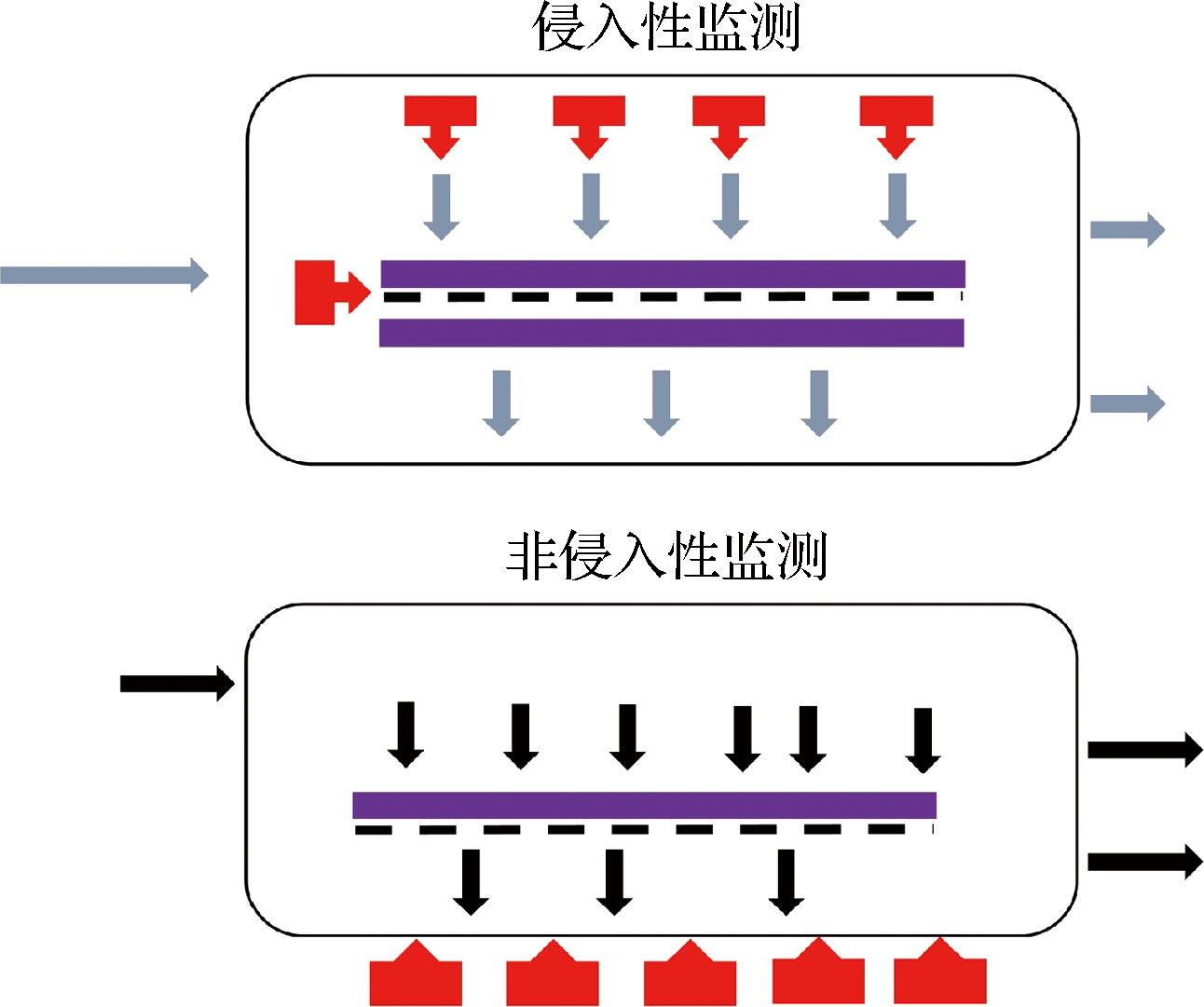
图1 侵入和非侵入性监测方法示意图
Fig.1 Schematic diagram of invasive and non-invasive monitoring methods
3.1 侵入性
3.1.1 红外光谱法
KOTTING等[28]研究表面时间分辨傅立叶变换红外差异光谱(Fourier transform infrared difference spectroscopy,FTIR)可以揭示蛋白质反应机理的大量分子细节。通过差异光谱的表现,可以从整个样品的背景吸光度中选择参与反应的蛋白质基团的吸光度带。可以用低至纳秒的时间分辨率监控吸光度的变化,并跟踪超过9个数量级的时间段。该技术可以提供与X射线结构分析互补的信息,包括:氢键、质子化状态、电荷分布,蛋白质反应的时间依赖性,对于揭示超滤过程中蛋白与蛋白,蛋白与膜之间的相互作用具有关键作用。
3.1.2 共聚焦激光扫描显微镜
共聚焦激光扫描显微镜(confocal laser scanning microscope,CLSM)是一种光学显微镜技术,具有比常规光学显微镜更好的轴向分辨率,并且可以在三维物体中提供不同深度的高分辨率图像。CLSM图像具可视化膜结构,污垢在孔内和膜表面的沉积以及对污垢和微生物的单独识别。图像分析是一种非常强大的工具,可以提供有关孔径、膜和滤饼厚度、粗糙度、缺陷大小和滤饼孔隙率等信息。但是,CLSM的缺点之一是穿透深度短[29]。ELSHEREEF等[30]开发了将膜样品平行于Z轴进行切片,以提供可以用CLSM分析的平坦横截面层以解决这一限制。CLSM正在成为一种辅助的表征方法,可被用于超滤过程中的在线表征。与普通的显微技术一起,提供可用于改善膜制造和工艺性能的信息。
3.2 非侵入性
3.2.1 荧光光谱监测法
ELSHEREEF等[30]提出通过利用荧光光谱法收集的数据和通过多元统计技术分析的内在蛋白质荧光来监测渗透液和截留液中蛋白质浓度的变化。使用光纤探针(optical fiber probe,FOP)采集渗透液和截留液在不同时间的多波长荧光光谱。通过FOP采集的数据和尺寸排阻色谱法测量的相应蛋白质浓度之间建立校正模型,开发了多元回归模型来预测α-LA,β-LG和BSA的浓度。与整个浓度范围(即0~0.50 g/L)的参考值相比,β-LG和α-LA浓度的模型预测相当合理。同时,在较小的浓度范围(0~0.10 g/L)内,对BSA浓度的模型预测显示是准确的。当样品中总蛋白质含量超过0.10 g/L时,对BSA浓度的模型预测将降低20%,这可能是由于蛋白质与蛋白质相互作用导致的荧光光谱非线性所致。对不同的pH值和跨膜压力值均显示出良好的预测。
3.2.2 紫外/可见反射光谱监测法
紫外/可见(UV/Vis)反射光谱仪使用紫外可见光谱范围内的光,并且基于电磁辐射和不透明表面之间的相互作用。光的光子能量将分子电子促进或激发到更高能量的轨道。这与荧光光谱相反,荧光光谱基于分子电子从激发态到基态的跃迁。紫外/可见反射光谱可以用来表征膜-溶液界面。从不透明表面反射的光可以由位于膜上方的光纤探头记录。吸收峰的波长给出了关于污垢中存在的官能团的定性信息,因此该方法可以用于确定污垢层的组成[31]。紫外/可见反射光谱是一种简单、快速、经济的技术,被开发用于实时监测,并有望提供信息,从而更好地理解膜污染[32]。GAO等[32]通过UV/Vis光谱与电化学阻抗光谱实现对过滤过程中界面区域的原位监测,研究超滤过程中离子强度对BSA污染的作用。研究发现,离子强度越高时膜污染越严重,并且持续时间越长。这主要是由于浓差极化(concentration polarization,CP)和电渗回流,导致膜表面附近的盐离子浓度升高,增加了过滤阻力,膜表面蛋白发生盐析现象。
3.2.3 流动电势监测技术
流动电势(streaming potential,SP)是由多孔材料的两侧之间的电动通量引起的电位差。当电解质由于跨膜的压力差(横向流电势)流过膜时,或者当电解质沿着膜流(切线流电势)流过时,就会发生这种现象。在横向流动时,有助于通过膜和污染层之间电动力学的相互作用测量Zeta电位。SP已被用于研究膜污染过程中Zeta电位对滤饼层形成、滤饼压缩和孔隙堵塞的响应。WANG等[33]调查了在微污染水处理中在线凝结膜污染监测中被污染膜的明显Zeta潜力。结果表明,在直接过滤过程和在线凝结超滤(coagulation ultrafiltration,C-UF)中,表观Zeta电位均与TMP一致。表观Zeta电位可能是监测膜污染的有用指标。TEYCHENE等[34]介绍了一种通过恒压电势测量在线监测膜污染的新方法,使电位值与过滤操作参数(如膜表面沉积质量或跨膜压力)相联系。本文研究了孔径约为0.1 μm的聚砜微滤膜被带负电的乳胶粒子悬浮液(粒径为200 nm)污染后的极压性能。结果表明,膜压和颗粒沉积质量对膜电位变化和结垢速率的影响是相似的,可以作为一种新的结垢指标。
3.2.4 光声光谱监测法
光声光谱法(photoacoustic spectroscopy,PAS)基于样品内部电磁辐射的吸收,并结合了光学光谱法和超声层析成像的功能。SEGAL等[35]结合傅立叶变换红外-PAS(Fourier transform infrared spectroscopy-photoacoustic spectroscopy,FTIR-PAS)和偏最小二乘(partial least-square,PLS)分析来定量研究多糖存在的情况下超滤膜上的蛋白质污染情况,通过FTIR-PAS对污染的膜进行直接分析,并使用PLS模型估算膜上存在的BSA量。结果表明该方法对BSA浓度估计值相关性很好,典型误差小于所研究范围的10%,与多糖浓度无关。可以进行实时原位测量,间接估算BSA的膜污染情况。光声光谱可被用于作为FTIR-ATR的替代品。
3.2.5 超声波时域反射仪
超声波时域反射仪(ultrasonic time domain reflectometer,UTDR)是一种声学技术,利用超声波的传输和反射在波传播的介质上提供信息,当超声波在2种介质中相遇,能量将被分割,产生反射波,相对于入射波,反射波的振幅取决于在媒介之间声波阻抗差。因此UTDR一般原理是利用膜和污染层之间阻抗差来引起超声波变化。UTDR已被证实能够以非侵入性和非破坏性的方式实时测量过滤过程中的结垢情况。但是,大多数先前的研究仅使用频率小于10 MHz的超声波在特定位置测量样品,这些问题不仅造成超声分辨率不足,无法敏感地区分细小厚度的污垢,而且也无法获得有关膜空间分布的有限信息。KUJUNDZIC 等[36]研究了频率为50 MHz、 f值为1.5、轴向和横向分辨率分别优于50和100 μm的高频超声系统,用于平板组件中膜污染层的检测。通过实验验证系统性能并研究结垢沉积在各种过滤条件下的分布。结果发现结垢沉积是时间和空间相关的过程,并且通过结合分析方法的高频超声图像可以灵敏和快速地评估结垢沉积。
3.2.6 电阻抗图谱技术
电阻抗图谱技术(electrical impedance spectroscopy,EIS)是一种原位在线监测膜污染过程的有力工具,利用电势变化引起系统电阻变化。可用于检测膜和污染层界面上的电导和电容变化。SIM等[37]研究了在RO过滤过程中对结垢过程进行原位EIS测量。研究介绍了利用EIS测量来表征恒流量运行下横流模块中的污垢。基本原理是,当将侧流连接到较大的螺旋缠绕模块上时,配备有用于阻抗谱测量的合适电极的横流反渗透电池可以充当较大系统的“canary”池,以指示运行期间反渗透性能的当前状态。模型的基础是二氧化硅、BSA及其二元混合物。建议EIS可用于膜行业中RO结垢的早期检测。冯芳芳等[38]采用电阻抗图谱技术结合Zeta电位原位表征中空纤维膜局部膜污染行为和膜污染迁移现象,进而对膜孔堵塞、滤饼层形成和滤饼层压实不同的污染阶段重新定义。
3.2.7 椭圆仪
椭偏法是一种光学技术,可用于检测,量化和导出有关各种表面上吸附过程的信息。在椭圆偏振法中,监测从表面反射的入射光和反射偏振光的相变和振幅比。椭圆光度法的应用通常仅限于在吸附/膜污染过程中折射率随时间变化的界面。而且,它没有提供具体的化学信息。因此,椭圆偏振法通常不能区分被吸附物和表面,或具有相似折射率的单个被吸附物。由于数据分析依赖于所研究表面的数学模型,计算可能会很复杂,并且结果的有效性很大程度上取决于理论模型。该方法需要良好的数学建模,限制了其适用性。但从理论上讲,在实际的膜过滤中,它通常可以监控膜污染的早期阶段。
3.2.8 小角度散射技术
小角度散射(small angle scattering,SAS)技术是在与远大于辐射波长的物体相互作用后,准直辐射束从其直线轨迹的小偏转或散射。散射的辐射被收集在1个区分角度的探测器中,提供有关样品内部结构的直接信息。两种常见的空间分析技术是小角X光散射(small angle X-ray scattering,SAXS)和小角中子散射(small angle neutron scattering,SANS)。SAXS技术在研究高分子材料的亚微观结构(纳米至数百纳米)方面具有独特的优势,是研究蛋白质结构的一种重要手段。DAVID等[39]使用酪蛋白超微滤池进行原位SAXS,可以探测酪蛋白胶束悬浮液前过滤过程中沉积层的结构分布和浓度分布。SAXS允许在距离膜表面280 μm~1 mm的酪蛋白胶束堆积层的结构,按照从几纳米到大约100 nm的长度尺度进行跟踪。JIN等[40]研究了使用设计的“SAXS错流US-偶联滤池”,通过多尺度表征研究了超声(ultrasonic,US)对脱脂奶错流超滤的影响。随着浓度的增加(从27到216 g/L),酪蛋白胶束悬浮液的流变行为发生了从牛顿到剪切变稀直至屈服应力出现的演化过程。通过实时SAXS测量,首次揭示了脱脂牛奶错流过滤过程中的浓度分布。在不改变酪蛋白胶束内部结构和膜选择性的情况下,应用超声(20 kHz,2 W/cm2)可显著提高浓缩层的渗透通量。该研究并未观察到超声波处理对酪蛋白胶束内部结构的影响,但可以监测过滤过程中浓缩层的演变。该方法由于数据分析较复杂,采集时间和可处理的样本量是其限制性因素。
4 展望
本文综述了乳清蛋白超滤浓缩过程中,各因素对蛋白质-蛋白质和蛋白质-膜之间的相互作用机制。改善超滤过程中单元操作和控制条件,提高膜通量,降低膜污染则有望节省大量成本投入,提高生产效率。本文介绍的部分对膜监测的方法还在开发阶段或已在医学、生物领域以及研究实验室中应用的监测技术,但未来可以应用在食品领域的膜浓缩过程监测。开发自动化的新仪器以及更有效的数据处理算法和化学计量学方法,从大数据中提取数学信息或统计处理方法,从而提高在线监测的准确度,更有效的控制膜污染的发生。期望在不久的将来对单个技术及其进一步的改进可以与人工智能相结合包括一些数据驱动模型,针对食品工业中膜浓缩过程的监测更加精准和方便。
[1] 王爱兵,李雅,李淑贤,等.超滤过程中膜污染控制和膜清洗的研究进展[J].河北工程大学学报(自然科学版),2009,26(2):98-102.
WANG A B,LI Y,LI S X,et al.The progress in search on controlling and cleaning of membrane pollution in ultrafiltration separation[J].Hebei University of Engineering(Natural Science Edition),2009,26(2):98-102.
[2] RINALDONI A N,TARAZAGA C C,CAMPDERR S M E,et al.Assessing performance of skim milk ultrafiltration by using technical parameters[J].Journal of Food Engineering,2009,92(2):226-232.
S M E,et al.Assessing performance of skim milk ultrafiltration by using technical parameters[J].Journal of Food Engineering,2009,92(2):226-232.
[3] 胡明,王培京.厌氧膜生物反应器膜污染解析及其控制方法研究进展[C].北京水问题研究与实践(2018年).北京:中国水利水电出版社,2019.
HU M,WANG P J.Research progress of membrane fouling analysis and control methods in anaerobic membrane bioreactor[C].Research and Practice on Beijing Water Problems(2018).Beijing:China Water & Power Press,2019.
[4] KOEHLER J A,ULBRICHT M,BELFORT G.Intermolecular forces between proteins and polymer films with relevance to filtration[J].Langmuir,1997,13(15):4 162-4 171.
[5] RICQ L,NARÇON S,DE REGGIANI J C,et al.Streaming potential and protein transmission ultrafiltration of single proteins and proteins in mixture:β-lactoglobulin and lysozyme[J].Journal of Membrane Science,1999,156(1):81-96.
[6] COVACEVICH H R,KOSIKOWSKI F V.Buffer,lactic fermentation,and rennet coagulation properties of skim milk retentates produced by ultrafiltration[J].Journal of Dairy Science,1979,62(2):204-207.
[7] HUISMAN I H,PR DANOS P,HERN
DANOS P,HERN NDEZ A.The effect of protein-protein and protein-membrane interactions on membrane fouling in ultrafiltration[J].Journal of Membrane Science,2000,179(1-2):79-90.
NDEZ A.The effect of protein-protein and protein-membrane interactions on membrane fouling in ultrafiltration[J].Journal of Membrane Science,2000,179(1-2):79-90.
[8] HOU L,WANG Z,SONG P.A precise combined complete blocking and cake filtration model for describing the flux variation in membrane filtration process with bsa solution[J].Journal of Membrane Science,2017,542 186-194.
[9] ALMÉCIJA M C,IB
 EZ R,GUADIX A,et al.Effect of pH on the fractionation of whey proteins with a ceramic ultrafiltration membrane[J].Journal of Membrane Science,2007,288(1-2):28-35.
EZ R,GUADIX A,et al.Effect of pH on the fractionation of whey proteins with a ceramic ultrafiltration membrane[J].Journal of Membrane Science,2007,288(1-2):28-35.
[10] NAVARRO-LISBOA R,HERRERA C,Z
 IGA R N,et al.Quinoa proteins(Chenopodium quinoa Willd.) fractionated by ultrafiltration using ceramic membranes:The role of pH on physicochemical and conformational properties[J].Food and Bioproducts Processing,2017,102:20-30.
IGA R N,et al.Quinoa proteins(Chenopodium quinoa Willd.) fractionated by ultrafiltration using ceramic membranes:The role of pH on physicochemical and conformational properties[J].Food and Bioproducts Processing,2017,102:20-30.
[11] STEINHAUER T,HANÉLY S,BOGENDÖRFER K,et al.Temperature dependent membrane fouling during filtration of whey and whey proteins[J].Journal of Membrane Science,2015,492:364-370.
[12] KÜHNL W,PIRY A,KAUFMANN V,et al.Impact of colloidal interactions on the flux in cross-flow microfiltration of milk at different pH values:A surface energy approach[J].Journal of Membrane Science,2010,352(1-2):107-115.
[13] JARTO I,LUCEY J A,SMITH K E.Impact of processing temperature on production of milk protein permeate during microfiltration of skim or whole milk[J].International Journal of Dairy Technology,2018,71(4):844-848.
[14] HARTINGER M,HEIDEBRECHT H J,SCHIFFER S,et al.Milk protein fractionation by means of spiral-wound microfiltration membranes:Effect of the pressure adjustment mode and temperature on flux and protein permeation[J].Foods,2019,8(6):180.
[15] NG K S Y,DUNSTAN D E,MARTIN G J O.Influence of processing temperature on flux decline during skim milk ultrafiltration[J].Separation and Purification Technology,2018,195:322-331.
[16] JIANG S H,ZHANG Y L,ZHAO F C,et al.Impact of transmembrane pressure(TMP) on membrane fouling in microalgae harvesting with a uniform shearing vibration membrane system[J].Algal Research,2018,35:613-623.
[17] SCHIFFER S,HARTINGER M,MATYSSEK A,et al.On the reversibility of deposit formation in low temperature milk microfiltration with ceramic membranes depending on mode of adjustment of transmembrane pressure and wall shear stress[J].Separation and Purification Technology,2020,247:116962.
[18] DING Y Y,MA B W,LIU H J,et al.Effects of protein properties on ultrafiltration membrane fouling performance in water treatment[J].Journal of Environmental Sciences,2019,77:273-281.
[19] TIAN J Y,ERNST M,CUI F Y,et al.Effect of different cations on UF membrane fouling by NOM fractions[J].Chemical Engineering Journal,2013,223:547-555.
[20] 邓东旭.离子强度对不同电性蛋白质超滤膜污染行为的影响机制研究[D].西安:西安建筑科技大学,2017.
DENG D X.Influence of ionic strength and different electrical protein on ultrafiltration membrane fouling mechanism[D].Xi’an:Xi’an University of Architecture and Technology,2017.
[21] SALAHI A,ABBASI M,MOHAMMADI T.Permeate flux decline during UF of oily wastewater:Experimental and modeling[J].Desalination,2010,251(1-3):153-160.
[22] CHOI S W,YOON J Y,HAAM S,et al.Modeling of the permeate flux during microfiltration of BSA-adsorbed microspheres in a stirred cell[J].Journal of Colloid and Interface Science,2000,228(2):270-278.
[23] CORBAT N-B
N-B GUENA M J,
GUENA M J, LVAREZ-BLANCO S,VINCENT-VELA M C.Ultrafiltration of whey:Membrane performance and modelling using a combined pore blocking-cake formation model[J].Journal of Chemical Technology & Biotechnology,2018,93(7):1 891-1 900.
LVAREZ-BLANCO S,VINCENT-VELA M C.Ultrafiltration of whey:Membrane performance and modelling using a combined pore blocking-cake formation model[J].Journal of Chemical Technology & Biotechnology,2018,93(7):1 891-1 900.
[24] HO C C,ZYDNEY A L.A combined pore blockage and cake filtration model for protein fouling during microfiltration[J].Journal of Colloid and Interface Science,2000,232(2):389-399.
[25] KARASU K,YOSHIKAWA S,KENTISH S E,et al.A model for cross-flow ultrafiltration of dairy whey based on the rheology of the compressible cake[J].Journal of Membrane Science,2009,341(1-2):252-260.
[26] LANDMAN K A,SIRAKOFF C,WHITE L R.Dewatering of flocculated suspensions by pressure filtration[J].Physics of Fluids A:Fluid Dynamics,1991,3(6):1 495-1 509.
[27] RUDOLPH G,VIRTANEN T,FERRANDO M,et al.A review of in situ real-time monitoring techniques for membrane fouling in the biotechnology,biorefinery and food sectors[J].Journal of Membrane Science,2019,588:117221.
[28] KÖTTING C,GERWERT K.Proteins in action monitored by time-resolved FTIR spectroscopy[J].Chemphyschem,2005,6(5):881-888.
[29] MARROQUIN M,VU A,BRUCE T,et al.Location and quantification of biological foulants in a wet membrane structure by cross-sectional confocal laser scanning microscopy[J].Journal of Membrane Science,2014,453:282-291.
[30] ELSHEREEF R,BUDMAN H,MORESOLI C,et al.Monitoring the fractionation of a whey protein isolate during dead-end membrane filtration using fluorescence and chemometric methods[J].Biotechnology Progress,2010,26(1):168-178.
[31] CHILCOTT T C,ANTONY A,LESLIE G.In situ electrical impedance characterization of fouling by calcium agents in reverse osmosis membrane systems using Maxwell Wagner and hydrodynamic models[J].Desalination,2017,403:64-79.
[32] GAO F,WANG J,ZHANG H W,et al.Role of ionic strength on protein fouling during ultrafiltration by synchronized UV-vis spectroscopy and electrochemical impedance spectroscopy[J].Journal of Membrane Science,2018,563:592-601.
[33] WANG J,YANG S S,GUO W S,et al.Characterization of fouling layers for in-line coagulation membrane fouling by apparent Zeta potential[J].RSC Advances,2015,5(128):106 087-106 093.
[34] TEYCHENE B,LOULERGUE P,GUIGUI C,et al.Development and use of a novel method for in line characterisation of fouling layers electrokinetic properties and for fouling monitoring[J].Journal of Membrane Science,2011,370(1-2):45-57.
[35] SEGAL Y,LINKER R,DOSORETZ C G.Quantitative estimation of protein fouling of ultra-filtration membranes by photoacoustic spectroscopy[J].Desalination,2011,271(1-3):231-235.
[36] KUJUNDZIC E,CRISTINA FONSECA A,EVANS E A,et al.Ultrasonic monitoring of early-stage biofilm growth on polymeric surfaces[J].Journal of Microbiological Methods,2007,68(3):458-467.
[37] SIM L N,WANG Z J,GU J,et al.Detection of reverse osmosis membrane fouling with silica,bovine serum albumin and their mixture using in situ electrical impedance spectroscopy[J].Journal of Membrane Science,2013,443:45-53.
[38] 冯芳芳.基于原位在线监测技术的膜污染行为的研究[D].天津:天津工业大学,2018.
FENG F F.Study on membrane fouling behavior based on in-situ online monitoring technology[D].Tianjin:Tianjin Polytechnic University,2018.
[39] DAVID C,PIGNON F,NARAYANAN T,et al.Spatial and temporal in situ evolution of the concentration profile during casein micelle ultrafiltration probed by small-angle X-ray scattering[J].Langmuir,2008,24(9):4 523-4 529.
[40] JIN Y,HENGL N,BAUP S,et al.Effects of ultrasound on cross-flow ultrafiltration of skim milk:Characterization from macro-scale to nano-scale[J].Journal of Membrane Science,2014,470:205-218.