腺苷,化学名为9-β-D-呋喃核糖基腺嘌呤[1],指由腺嘌呤的N-9与D-核糖的C-1通过β糖苷键连接而成的化合物,是用于合成三磷酸腺苷(adenosine triphosphate,ATP)、腺嘌呤、腺苷酸(adenosine monophosphate,AMP)、阿糖腺苷的重要中间体。腺苷可直接进入心肌经磷酸化生成腺苷酸,参与心肌能量代谢,同时还参与扩张冠状血管,增加冠脉血流量[2-4]。此外,腺苷还是一种抑制性神经传导物,在神经传递中起重要作用[5-6]。因此,腺苷在医学方面有着重要的作用。
腺苷的生产方法主要有化学合成法、RNA水解法和发酵法[7-8]。化学合成法合成腺苷存在着成本偏高、反应繁琐、收率低等一系列问题。RNA水解法同时会得到4种核苷物质[9],给后续的分离带来困难。发酵法生产腺苷成本较低、原料易得,产腺苷效率较高,因此在腺苷生产中占据绝对优势。但在腺苷发酵过程中,也存在着很多问题,比如腺苷发酵需要非常丰富的营养,使得腺苷发酵成本很高,发酵到了中后期菌体开始停止生长,耗糖速率变慢,产苷速率也变慢,使得腺苷发酵过程中有效的产苷周期很短,腺苷产量变低,糖苷转化率变低。为了进一步提高腺苷产量,延长产苷周期,提高糖苷转化率,本文开展膜偶联间歇透析发酵法生产腺苷的研究。利用5 L发酵罐,以Bacillus subtilis XGL(8-AGr+ His-+xan-+SGr)为出发菌株,将发酵罐与陶瓷膜分离装置相偶联,发酵一定时间后,发酵液经过陶瓷膜过滤后把浓缩菌体回收至发酵罐中,将透析滤液排出,再在发酵罐中补加新鲜的发酵培养基继续进行腺苷发酵[10-11]。通过膜偶联间歇透析发酵法,降低发酵液中的产物浓度,从而有效解除菌体的反馈抑制作用和副产物的毒害作用[12-14],补加的新鲜培养基可以为菌体的继续生长和产苷提供营养物质,从而增加菌体量,延长产苷周期,提高腺苷产量和糖苷转化率。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
Bacillus subtilis XGL(8-AGr+ His-+xan-+SGr),天津科技大学代谢工程研究室保藏菌株。
1.1.2 试剂
MnSO4· H2O,天津市化学试剂六厂;MgSO4·7H2O,天津市耀华化工厂;FeSO4·7H2O、葡萄糖,天津化学试剂三厂;KH2PO4·3H2O,天津塘沽化学试剂厂;黄嘌呤、组氨酸,北京索莱宝科技有限公司。以上试剂纯度均为99.9%。玉米浆(40%),河北梅花味精集团有限公司。
1.1.3 培养基
斜面培养基(g/L):牛肉膏10,葡萄糖2,NaCl 2.5,蛋白胨10,酵母粉5,黄嘌呤0.05,组氨酸0.05,琼脂条30。调pH至7.0~7.2,121 ℃,20 min灭菌。灭菌后分别制成试管斜面培养基和茄形瓶培养基。
种子培养基(g/L):葡萄糖25,豆饼水解液20,酵母粉5,MgSO4·7 H2O 0.4,维生素B1 0.001,维生素H 0.001,玉米干粉 25(121 ℃、20 min单独灭菌),KH2PO4 1.5,蛋白胨8,黄嘌呤0.1,组氨酸0.05。调pH至6.4~6.7,115 ℃,15 min灭菌。
发酵培养基(g/L):葡萄糖100,豆饼水解液50,酵母粉25,MgSO4·7H2O 5,维生素B1 0.002,维生素H 0.002,玉米干粉25(121 ℃、20 min 单独灭菌),味精12,K2HPO4 4.5,葡萄糖酸钠1.5,黄嘌呤0.1,组氨酸0.05,CaCl2 2,FeSO4·7H2O 0.006,MnSO40.006。调pH至7.0~7.2,115 ℃,15 min灭菌。
透析培养基(g/L):豆饼水解液50,酵母粉25,MgSO4·7H2O 5,维生素B1 0.002,维生素H 0.002,味精12,K2HPO44.5,葡萄糖酸钠1.5,黄嘌呤0.1,组氨酸0.05,CaCl22,FeSO4·7H2O 0.006,MnSO4 0.006。调pH至7.0~7.2,115 ℃,15 min灭菌。
1.2 仪器与设备
5 L自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;Agilent 1200高效液相色谱仪、Agilent C18(5 μm,250 mm × 416 mm),Agilent Technologies;752紫外分光光度计,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 样品处理方法
菌体量测定:每隔4 h取适量发酵液,灭菌生理盐水适当倍数稀释,通过分光光度计测定720 nm吸光度[11]。
发酵液中糖含量的测定:使用生物传感器进行检测,将取出的样品进行离心,离心后取上清液稀释100倍进行测定。
葡萄糖补加量测定:用电子称记录下每隔一定时间的80%的葡萄糖液补加量。
pH、温度、溶氧的测定:通过发酵罐上的自动控制器自动控制发酵液的pH、温度和溶氧,另外再用pH试纸进行pH测定与调试。
腺苷产量测定:高效液相色谱法定量检测发酵液中的腺苷浓度[15-17]。
发酵液预处理:取适量发酵液,用浓度为1 mol/L NaOH溶液稀释10倍,煮沸,13 000 r/min离心5~10 min,取上清液用去离子水稀释100倍过膜[1]。
液相色谱分离条件:柱温30 ℃;检测波长为259 nm,流动相总流量0.8 mL/min,色谱柱为 Kromasil C18柱(250 mm×416 mm,5 μm),流动相为V(乙腈)∶V(水)=(1∶9)[1]。
乙偶姻产量测定:见参考文献[18]。
1.3.2 培养方法
菌种活化与扩培:取1个斜面培养基,在无菌间中,将-80 ℃保菌管中保藏的菌种用接种环挑2~3环于斜面培养基中,在斜面培养基中涂匀,放至32 ℃的恒温培养箱中培养10~12 h。10~12 h后将斜面上的菌体挑取2~3环至茄形瓶培养基上进行再次活化与扩培,再次放至32 ℃恒温培养箱中培养10~12 h待用。
5 L发酵液种子培养方法:将装有发酵液的5 L发酵罐灭菌后,连接溶氧电极、pH电极、温度电极,通上无菌空气,调好发酵液的pH至7.0~7.2。用无菌水将茄形瓶培养基上的菌体冲洗下来,然后接种至5 L发酵罐中,定容至3 L。再次调好pH,调节发酵控制器,温度设置为32 ℃,pH设置为7.0,后续主要通过自动流加氨水调节pH;初始转速设置为200 r/min,初始通风量为 2 L/min,用泡敌消泡,培养 10~13 h 左右,菌体量生长至 OD600 nm为15时按15%的接种量接种发酵。
对照发酵:发酵过程中通过自动流加氨水调节pH,pH前期控制在7.0左右,后期控制在6.4左右。发酵罐自动控制温度、转速,过程中需要调节通风量将溶氧前期控制在30%~40%,后期控制在10%~20%。用生物传感分析仪测定发酵液中的糖浓度,后期糖浓度控制在0~10 g/L。后续如果糖浓度偏低通过自动流加80%的葡萄糖溶液进行过程补糖。
膜偶联间歇透析发酵:如图1所示,将发酵罐与陶瓷膜分离装置相偶联,发酵液经陶瓷膜过滤后截留菌体,把菌体重新流回罐中,把发酵液过滤出来,再在发酵罐中补加新配制的经过灭菌的发酵培养基[10-11],定容至3 L,新鲜培养基的量不低于发酵液的80%(体积分数),继续进行腺苷发酵。膜偶联透析时间和补加培养基的时间不计入发酵时间。
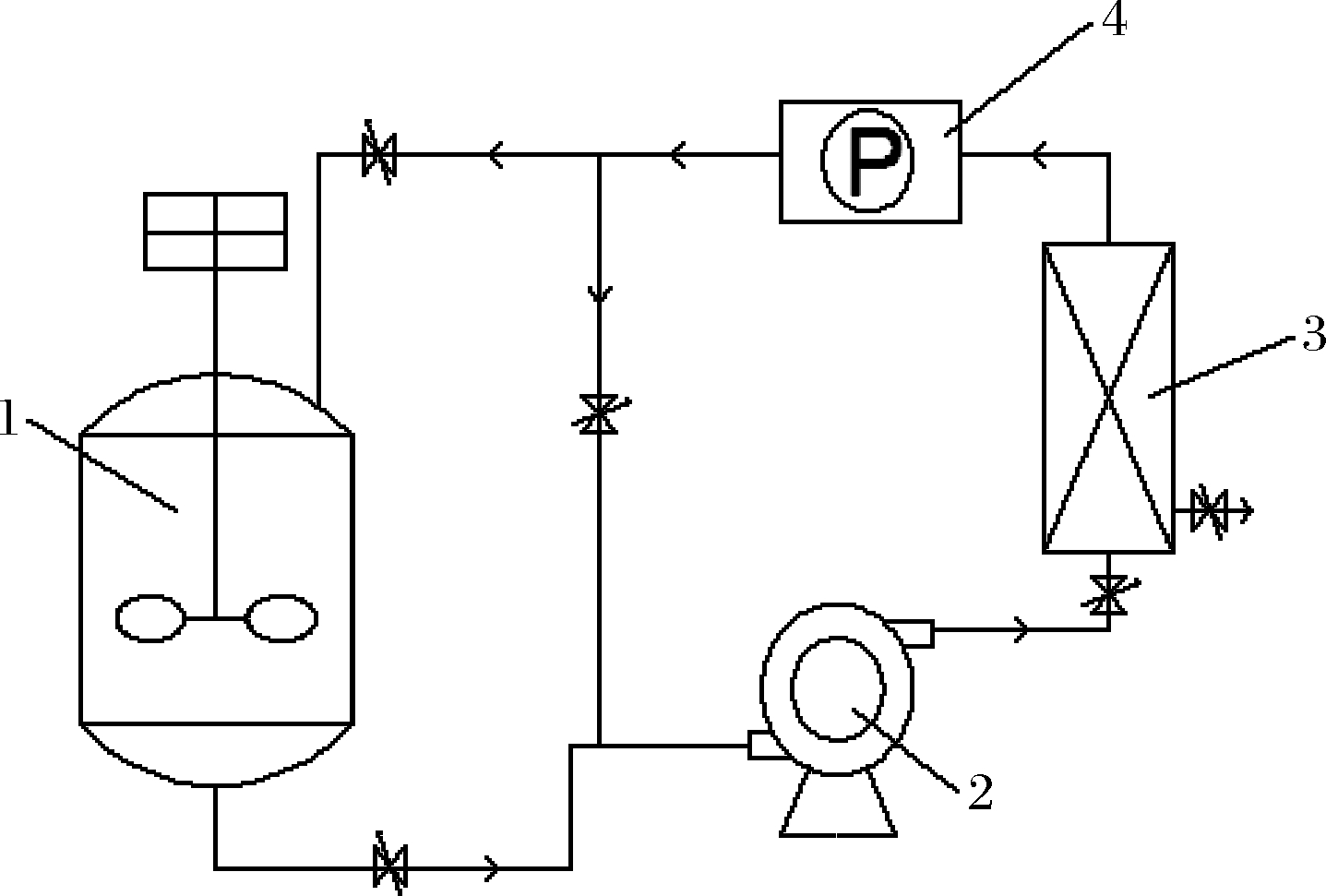
1-发酵罐;2-离心泵;3-陶瓷膜;4-蒸气发生器
图1 膜偶联间歇透析发酵装置
Fig.1 Membrane coupling batch dialysis fermentation device
酶活力测定:
(1)菌体收集:取培养至一定时期的枯草芽胞杆菌菌液10 mL,离心收集菌体,用pH 6.4(发酵过程中控制的实际pH值)的PBS缓冲液洗2次,最后重悬于相同的缓冲液中[9]。
(2)酶蛋白提取:将收获的细胞重悬于1 mL的pH 7.5、含 30%甘油的 50 mmol/L Tris-HCl 中[18]。采用高通量破碎法破碎细胞,6 200 r/min 工作20 s,液氮放置30 s,重复10次。于 4 ℃、10 000 r/min 离心15 min,上清液即为粗酶液。测总蛋白后置于冰上待测各酶活性。此外,可将酶液于-20 ℃保存[19]。
(3)腺苷琥珀酸合成酶活力的测定:向含有菌体的溶液中加入肌苷酸(inosine monophosphate,IMP)和天冬氨酸,终浓度分别为10 mmol/L和20 mmol/L。34 ℃,200 r/min培养3 h,利用HPLC法测定其中IMP含量的变化。计算单位时间内,菌体OD600变化为1时的IMP的转化速度[9]。胞内IMP含量的测定参考文献[9]的方法。
(4)磷酸核糖焦磷酸(phosphoribosyl pyrophosphate,PRPP)转移酶活力测定:参考文献[1]的方法。
1.4 计算公式
糖苷转化率按公式(1)计算:
糖苷转化率![]()
(1)
所有数据取3次数据的平均值,进行单因素方差分析。
2 结果与分析
2.1 膜偶联透析发酵对腺苷生产的影响
2.1.1 膜偶联透析发酵对菌体量、产苷量和发酵液中溶氧量的影响
如图2所示,在44 h进行膜偶联透析发酵,发酵至72 h菌体OD600 nm达到83.5,与正常发酵工艺相比菌体量提高了14.4%。发酵液内平均产苷39.32 g/L(腺苷平均产量=透析前后腺苷总产量/发酵液总体积。透析时为截留菌体,将0.6 L左右的发酵液流回发酵罐,因此发酵液总体积减少约0.6 L,下同),比正常发酵72 h后腺苷产量37.2 g/L,提高了5.7%。
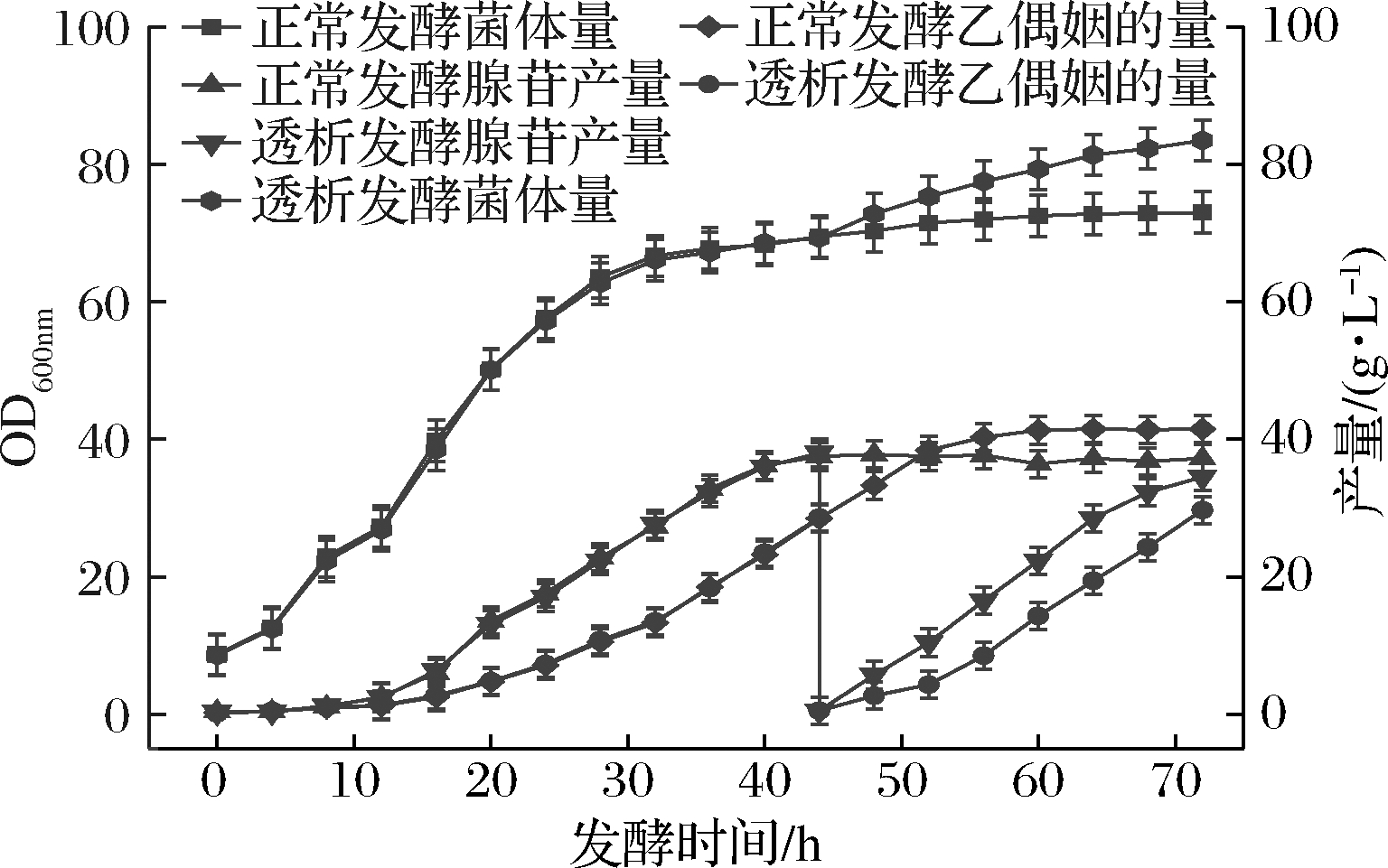
图2 正常发酵与透析发酵OD600 nm、腺苷产量和乙偶姻产量对比
Fig.2 Comparison of OD600 nm,adenosine production and acetoin production between normal and dialysis fermentation
膜偶联透析发酵与正常发酵工艺相比,加入了大量新鲜的培养基,提供充足的营养物质。又通过膜偶联透析分离出发酵液内高质量浓度的主产物和副产物,有效解除了菌体的反馈抑制作用和副产物的毒害作用,使得菌体能迅速恢复活力,继续高速率产苷。如图2所示,正常发酵72 h后副产物乙偶姻产量为41.5 g/L,透析发酵后其产量为31.8 g/L,明显下降。副产物乙偶姻通过糖酵解途径生成丙酮酸,再经催化作用生成,而腺苷的合成是通过戊糖磷酸途径合成,因此副产物的合成速度变慢会使得代谢流更多地流向腺苷的合成途径中,使得腺苷的合成量增多。正常发酵到后期由于腺苷和一些副产物产量的增多,发酵液内形成晶体,阻碍发酵罐内的供氧,使得发酵罐内溶氧降低,如图3所示,在44~48 h发酵液中溶氧降低,由图2可知44~48 h后菌体和产苷变缓。

图3 正常发酵与透析发酵通风量、溶氧量对比
Fig.3 Comparison of ventilation and dissolved oxygen between normal and dialysis fermentation
进行透析之后去除了大量的结晶,使发酵液内供氧充足,菌体恢复活力,同时产苷速率增加。所以,膜偶联透析发酵可以使菌体保持正增长,产苷速率保持一个较高水平。
2.1.2 膜偶联透析发酵对发酵过程中葡萄糖消耗速率的影响
如图4所示,正常发酵工艺中随着菌体的生长、繁殖和产苷速率的加快,葡萄糖的消耗速率也相应提高,在24~36 h处于较高水平,后期由于菌体量不再增长葡萄糖消耗速率变缓。透析后由于菌体恢复活力,葡萄糖消耗速率也有所增长。可见,膜偶联透析能够使菌体保持对数生长期的活力,处于一个持续生长、繁殖和产腺苷的状态,因此葡萄糖消耗速率也处于较高水平。膜偶联透析发酵后,采取葡萄糖流加的方式,使发酵液内残糖始终控制在0~10 g/L。
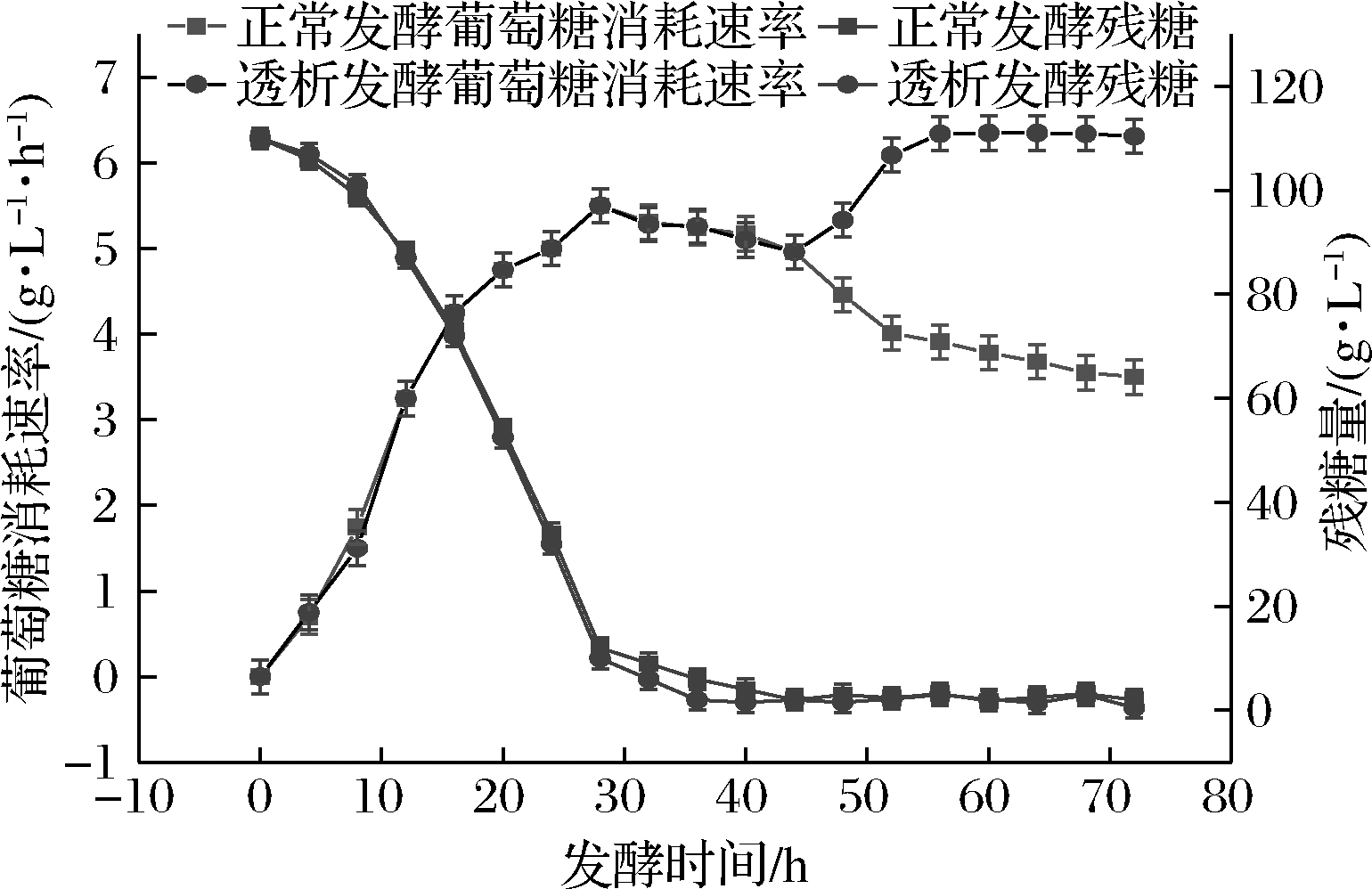
图4 正常发酵与透析发酵葡萄糖消耗速率和残糖量对比
Fig.4 Comparison of glucose consumption rate and residual sugar content between normal and dialysis fermentation
2.2 不同时期进行膜偶联透析对腺苷生产的影响
2.2.1 不同时期进行膜偶联透析对菌体生长和产苷的影响
为探究最适的膜偶联透析发酵时间,分4个时期(32、36、40、44 h)进行膜偶联透析发酵并进行对比。之所以选择这几个时期进行透析是因为如果透析发酵过早,菌体量较少,产苷有限;如果透析较晚,菌体活力较差,透析发酵效果不佳。
由图5-a可知32和36 h进行膜偶联透析发酵菌体OD600 nm分别达到了93.5和92.7,相比之下菌体量最多。这两个阶段进行膜偶联透析菌体量大是因为在进行透析时绝大部分菌体处于对数生长期,菌体活力较强,透析之后菌体仍处在对数期,生长速度较快。而在40和44 h进行膜偶联透析发酵时菌体处在稳定期,此时菌体生长相对较缓慢,发酵72 h菌体OD600 nm分别为87.2和83.5。
如图5-b所示,在32、36、40、44 h进行膜偶联透析时发酵液中平均产苷量分别为41.14、42.4、41.06、39.32 g/L。由此可见,在36 h进行透析发酵的总产苷量最大。
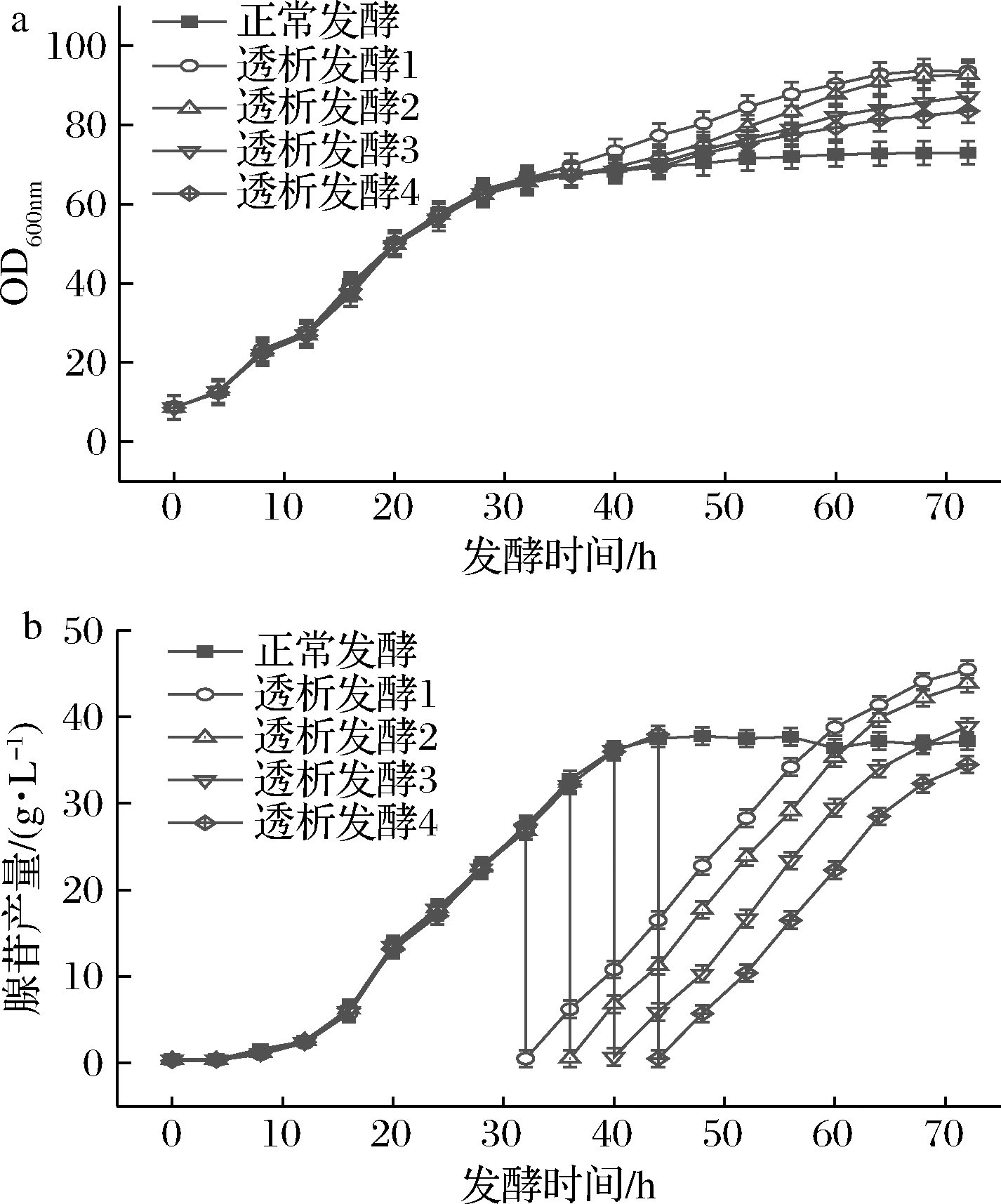
a-菌体生长;b-腺苷产量
图5 不同时间段透析发酵对菌体生长和腺苷产量的影响
Fig.5 Effect of dialysis fermentation in different periods on the growth and adenosine production of bacteria
注:透析发酵1、2、3、4分别代表在发酵的第32、36、40、44 h开始进行膜偶联透析发酵(下同)
2.2.2 不同时期进行膜偶联透析对葡萄糖消耗速率、糖苷转化率和副产物的影响
由图6可知,透析发酵后葡萄糖消耗速率变大,由于透析后采用葡萄糖流加的方式,所以残糖量基本保持稳定。由图7和表1可知,透析发酵2的糖苷转化率最高,达到24.12%。从图8可以看出进行透析发酵后乙偶姻的产量下降,其中透析发酵2中乙偶姻的产量最低。
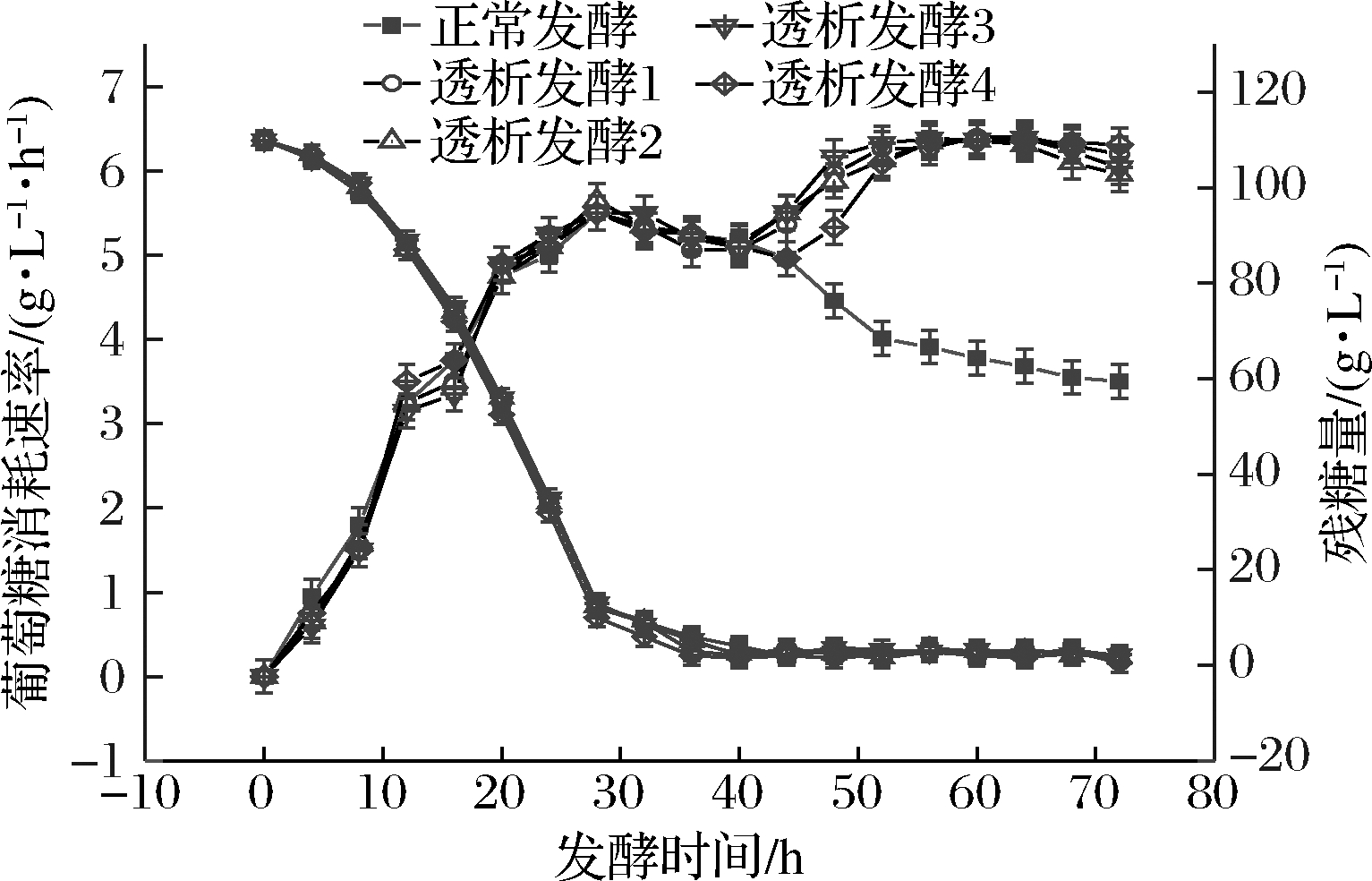
图6 不同时间段透析发酵对葡萄糖消耗速率和残糖量的影响
Fig.6 Effect of dialysis fermentation in different periods on the rate of glucose consumption and the amount of remaining glucose
可见在36 h进行膜偶联透析发酵最好,发酵36 h菌体OD达到一定的量,且菌体活力较强,产苷速率较快。若透析发酵较早,菌体还处在快速生长期,葡萄糖的分解更多地用于菌体的生长和繁殖,用于合成代谢产物的则减少。
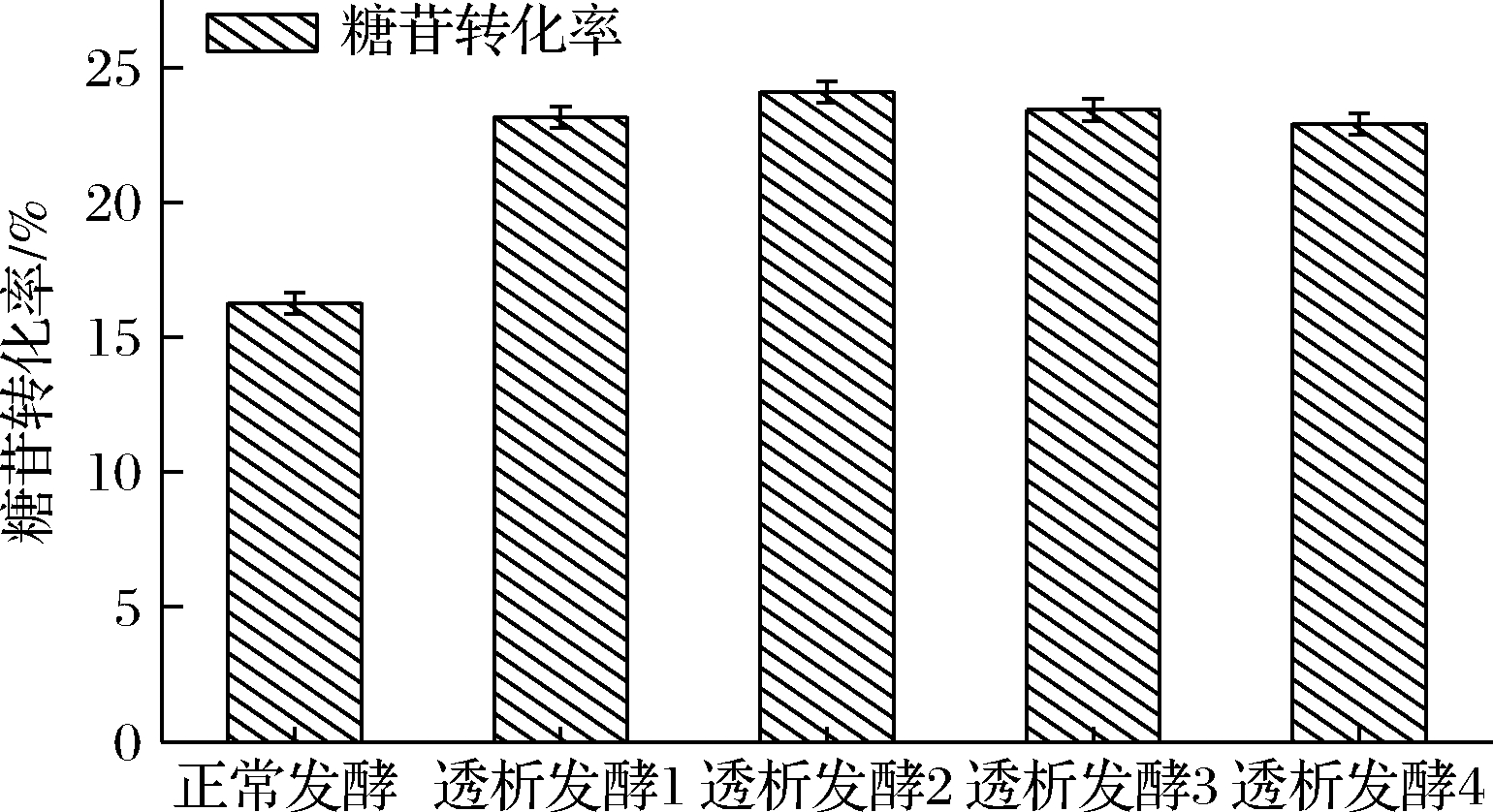
图7 不同时间段透析发酵的糖苷转化率
Fig.7 Conversion rate of glucose to adenosine in different periods of dialysis fermentation
表1 不同时期进行透析发酵的参数对比
Table 1 Comparison of the data of dialysis and fermentation in different periods
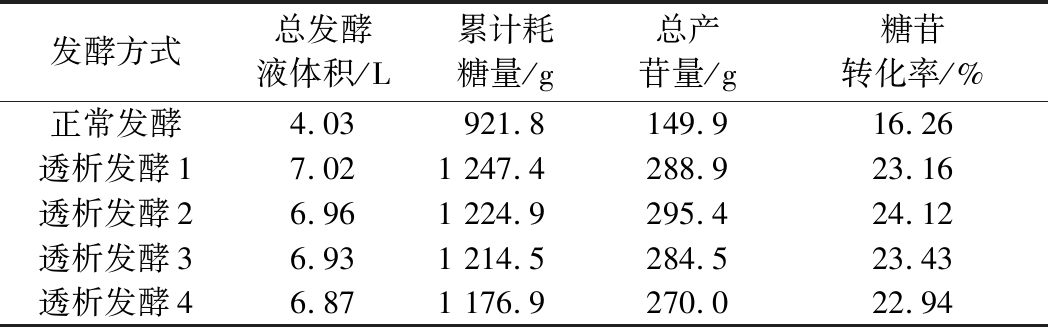
发酵方式总发酵液体积/L累计耗糖量/g总产苷量/g糖苷转化率/%正常发酵4.03921.8149.916.26透析发酵17.021 247.4288.923.16透析发酵26.961 224.9295.424.12透析发酵36.931 214.5284.523.43透析发酵46.871 176.9270.022.94
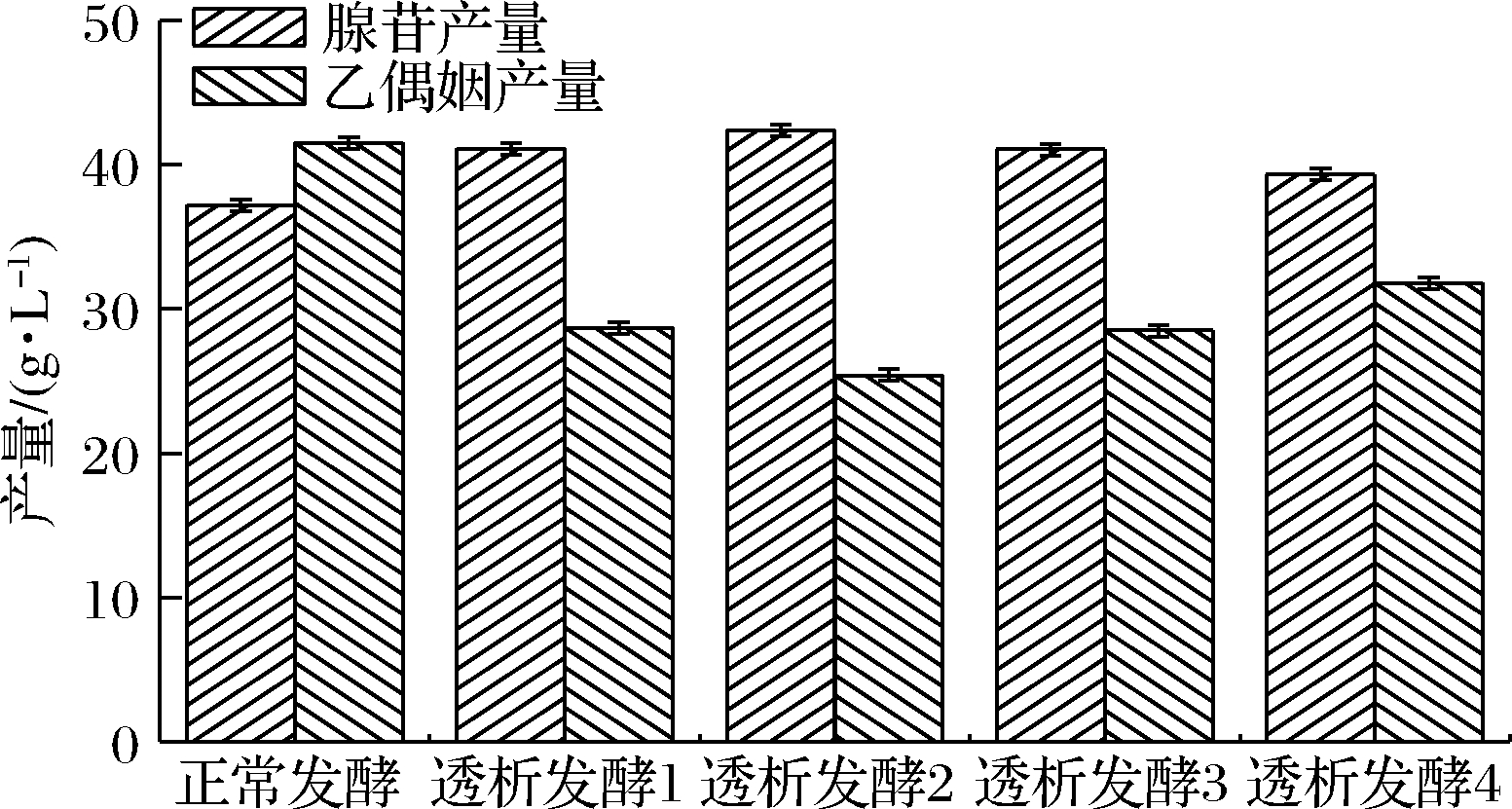
图8 不同时期进行透析发酵腺苷与乙偶姻产量对比
Fig.8 Production of adenosine and acetoin in dialysis fermentation at different periods
如果在后期进行透析发酵,菌体虽然耗糖降低,但同时产苷速率也相对变缓,因此总产苷量相对较少,糖苷转化率较低。
2.3 不同比例的透析培养基对腺苷发酵的影响
2.3.1 不同比例的透析培养基对腺苷发酵中菌体量和腺苷产量的影响
为了节约原料,减少发酵成本,在最适的膜透析时间下,设置了不同比例的新鲜培养基用于膜偶联间歇透析发酵的补加培养基,新鲜培养基的营养成分为3 L培养基的50%、60%、70%、80%(分别为透析发酵a、b、c、d)。由图9-a可知在不同比例的透析培养基中70%和80%的透析培养基发酵到72 h时菌体量最高,分别为90.5和92.6。如图9-b所示,进行膜透析前发酵液中腺苷产量几乎一样,在36 h进行透析后,透析发酵d产苷速率最快,发酵到72 h时产苷43.8 g/L,其次是透析发酵c,在发酵72 h时产苷42.1 g/L。透析发酵a和b最终产苷37.8、39.8 g/L。因此在70%、80%的新鲜培养基中菌体生长和产苷状况良好,两个比例的培养基进行透析后菌体量和产苷量几乎相同,为节约原料,降低发酵成本,应选择70%的透析培养基进行透析发酵。
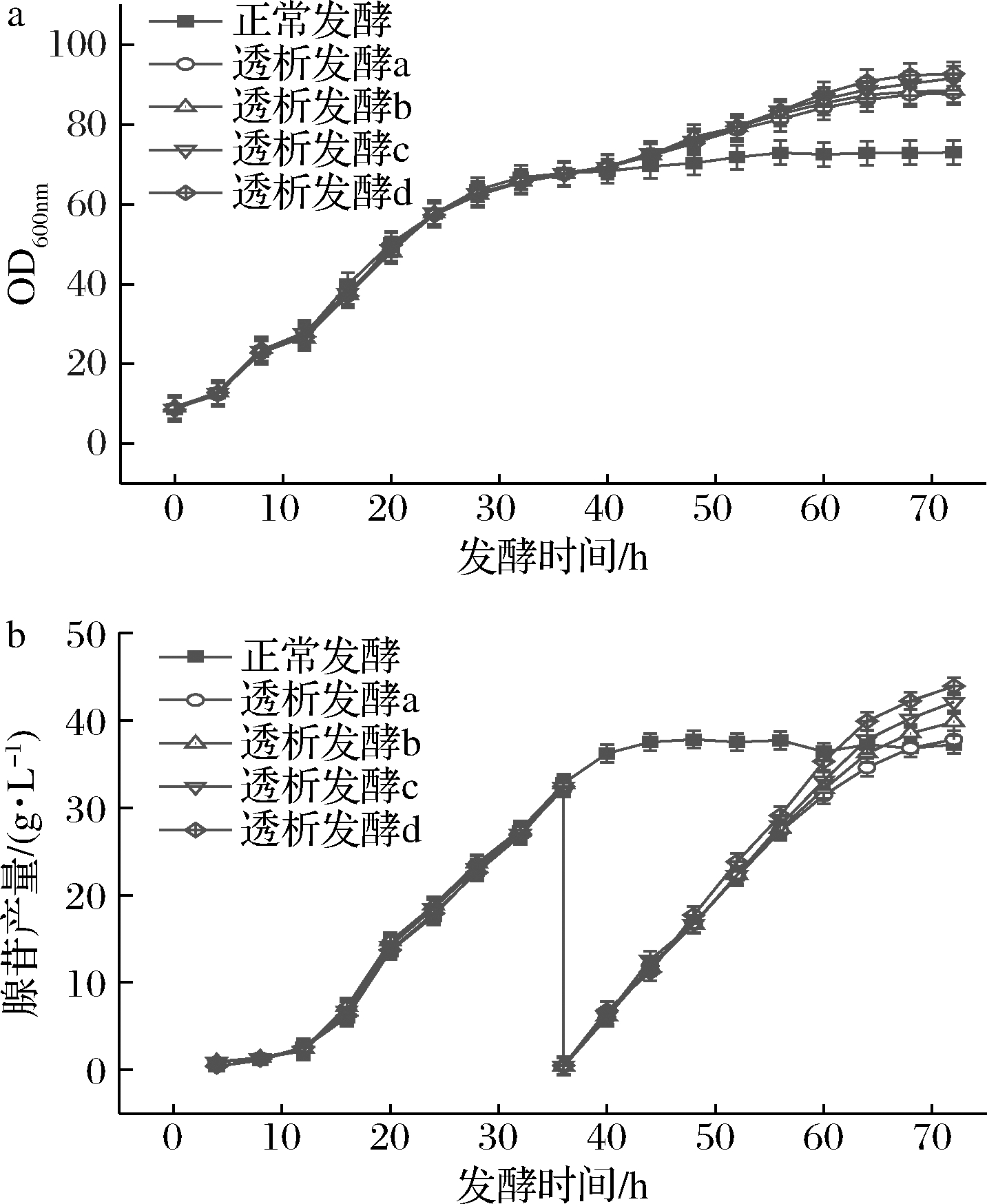
图9 不同比例的透析培养基对菌体量和腺苷产量的影响
Fig.9 Effect of different ratios of dialysis medium on growth and adenosine production of bacteria
注:透析发酵a、b、c、d分别为补加50%、60%、70%、80%的3 L培养基(下同)
2.3.2 不同比例的透析培养基对腺苷发酵中糖苷转化率的影响
由图10看出,发酵c和d中糖苷转化率最高,两种方案的糖苷转化率非常接近。更进一步证明在透析培养中应选择70%的透析培养基作为新鲜的透析发酵培养基,这样可以尽可能地节约资源,减少发酵成本。
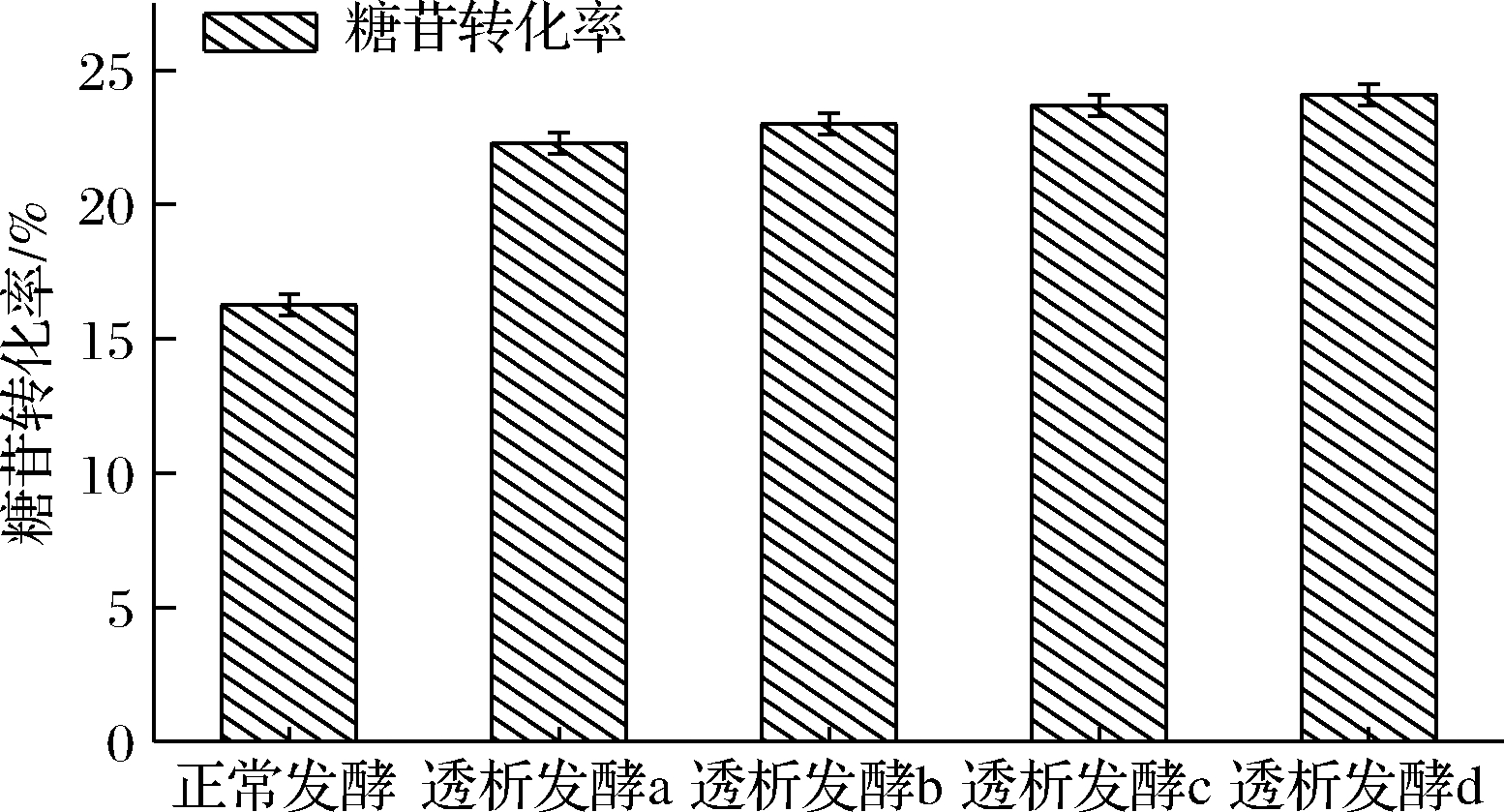
图10 不同比例的透析培养基对糖苷转化率的影响
Fig.10 The effect of different ratios of dialysis media on the rate of glucose conversion to adenosine
2.4 透析发酵中的酶活力
在枯草芽胞杆菌中参与嘌呤合成途径中有几个关键酶决定着产物生成速率的大小,其中非常重要的两个酶分别是PRPP转酰胺酶和腺苷琥珀酸合成酶。其中PRPP转酰胺酶由purF基因编码,催化嘌呤合成途径中的第1个反应,即PRPP与谷氨酰胺反应,转化为5-磷酸核糖胺(5-phosphoribosylamine,PRA),是嘌呤全合成途径中的关键酶,该酶活性的高低直接影响进入嘌呤合成途径的通量[20-22]。PRPP转酰胺酶的活性受到AMP和二磷酸腺苷(adenosine diphosphate,ADP)的特异性反馈抑制,且当腺嘌呤过量时,PRPP转酰胺酶的合成被阻遏,当腺嘌呤限量时,可解除对PRPP转酰胺酶的阻遏作用[9]。有研究表明提高PRPP转酰胺酶的酶活力可以有效提高嘌呤物质的产量[1]。
腺苷琥珀酸合成酶(adenylosuccinate synthase,Adss)该酶由purA基因编码,催化IMP和天冬氨酸通过还原作用结合为腺苷酸琥珀酸,此反应是AMP合成分支的第1个反应,是嘌呤合成途径中的限速步骤[23-26]。该酶仅特异性受AMP系物质的反馈阻遏[9]。
根据图9可知,进行膜透析后40~60 h是菌体生长和产苷的高峰期,为探究该段时间内菌体中PRPP转酰胺酶和Adss酶活力是否有所提升,选择在该时间段中任一时期进行菌体酶活力测定。发酵52 h分别对正常发酵工艺和透析发酵工艺进行取样,测发
酵液中PRPP转酰胺酶和Adss酶的活力,如图11所示,透析发酵后PRPP酶的活力为14.8 U/g,是正常透析发酵的1.9倍,Adss酶活力是正常透析发酵的1.8倍。两种酶活力均有所提高,因此经过透析发酵能有效地提高嘌呤合成途径中关键酶的活力,从而增加菌体活力,提高腺苷产量和糖苷转化率,延长产苷周期。
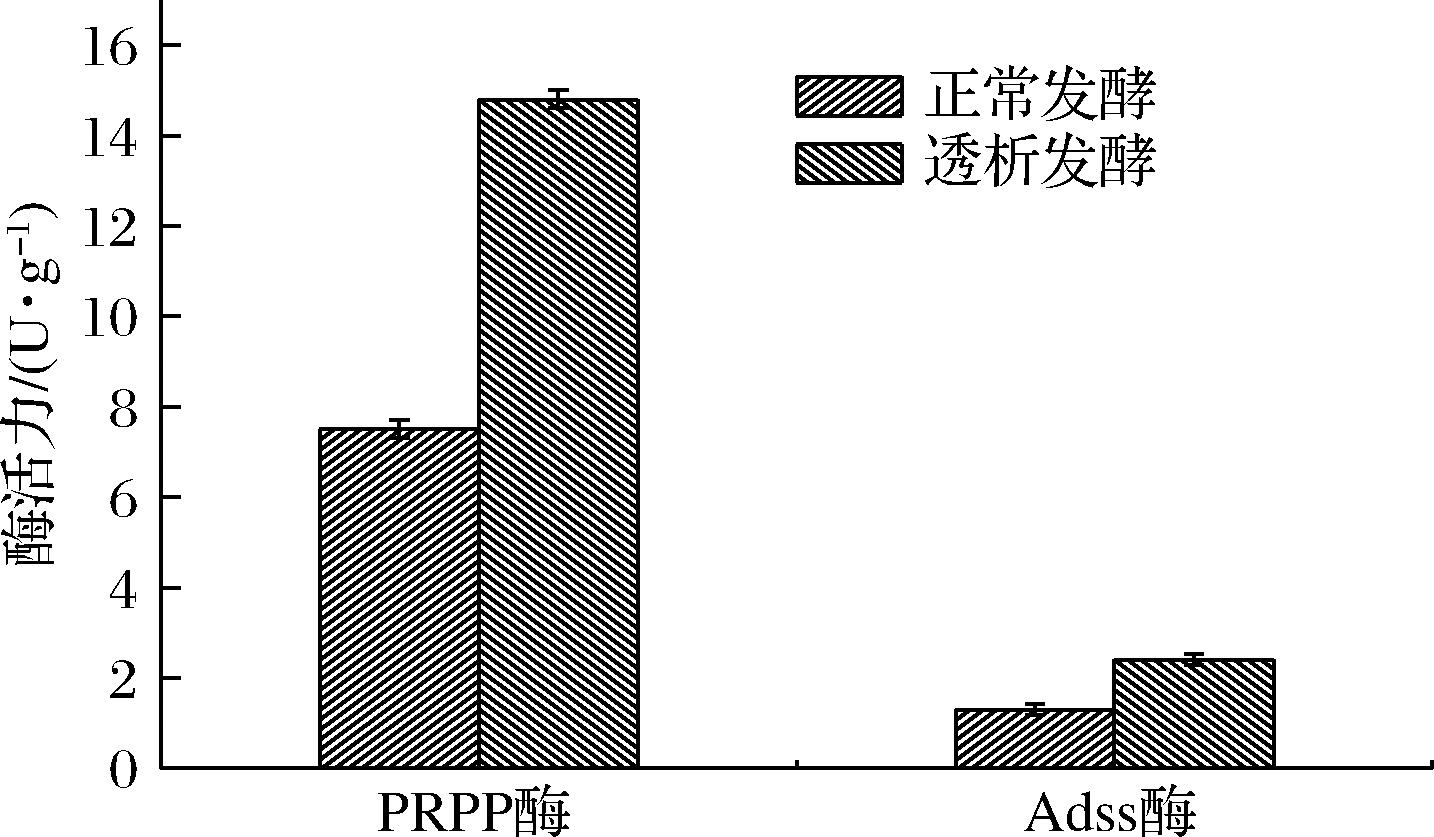
图11 PRPP酶和Adss酶活力对比
Fig.11 Comparison of PRPP enzyme and Adss enzyme activity
2.5 膜偶联间歇透析发酵对腺苷发酵的影响
为进一步提高腺苷生产速率,如图12和表2所示,在发酵至60 h时进行了第2次膜偶联透析发酵,与之前的正常发酵工艺和36 h进行膜偶联透析发酵工艺相比,膜偶联间歇透析发酵将发酵周期延长至96 h,OD600 nm达到了94.6,相比于进行一次透析发酵有所提高,腺苷产量由一次发酵72 h总产苷295.4 g,平均产苷42.4 g/L,提升到448.3 g,平均产苷44.2 g/L,糖苷转化率由24.1%提升到25.1%。
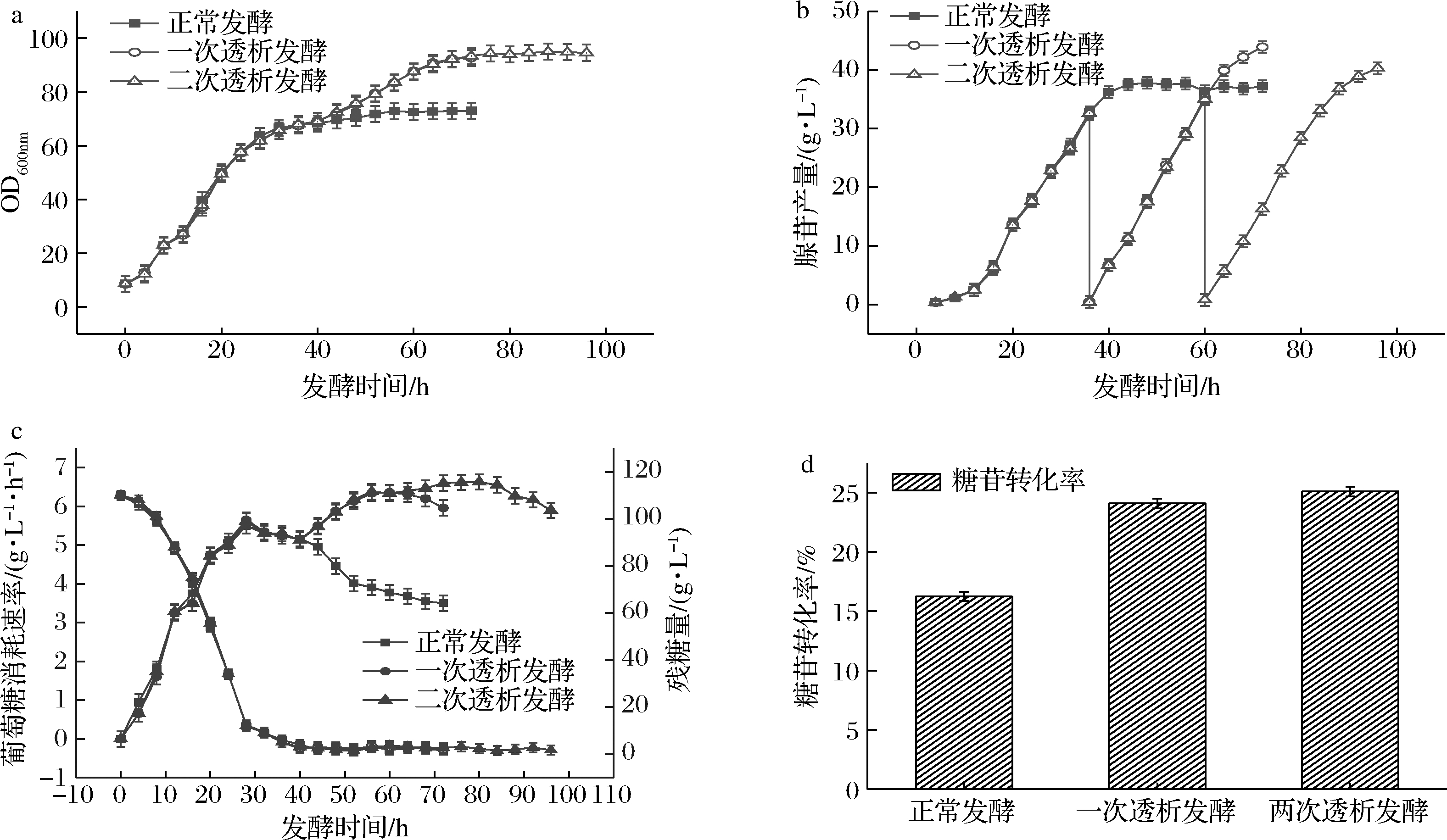
a-菌体量;b-腺苷产量;c-耗糖量;d-糖苷转化率
图12 间歇透析发酵对腺苷发酵过程中各参数的影响
Fig.12 Effect of intermittent dialysis fermentation on the parameters of adenosine fermentation
表2 膜偶联间歇透析发酵参数
Table 2 Membrane coupling batch dialysis fermentation parameters
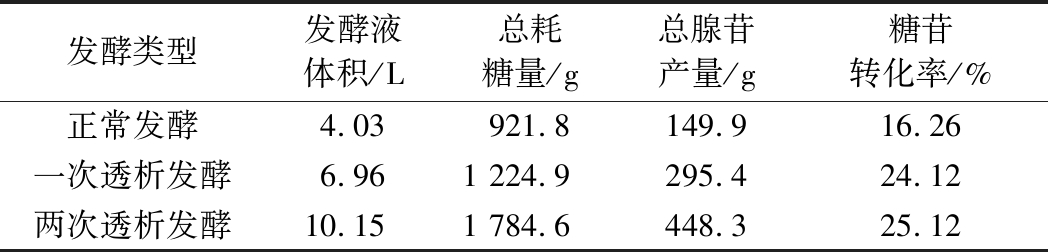
发酵类型发酵液体积/L总耗糖量/g总腺苷产量/g糖苷转化率/%正常发酵4.03921.8149.916.26一次透析发酵6.961 224.9295.424.12两次透析发酵10.151 784.6448.325.12
葡萄糖消耗速率在二次透析后也有所增加。因此通过二次透析可以再次提高腺苷产量,进一步提高糖苷转化率,使之达到一个较理想的菌体代谢水平和产苷水平。
3 结论
为提高发酵法生产腺苷的产量,延长产苷时间,提高糖苷转化率,本文以枯草芽孢杆菌为研究对象,分析了透析发酵对腺苷生产的影响,并确定了最优方案。分别在发酵36、60 h对发酵液进行2次膜偶联透析,使发酵周期延长至96 h,菌体OD600 nm提高到94.6,单批次产苷448.3 g,平均产苷44.2 g/L。糖苷转化率提高到25.1%。相比于正常发酵工艺产苷周期延长36~40 h,菌体量提高了29.6%,产量增加298.4 g,产苷强度增加7 g/L,副产物乙偶姻产量降低。在发酵52 h时检测透析发酵中PRPP转酰胺酶和腺苷琥珀酸合成酶活力,相比于正常发酵工艺均有所提高。由此可见通过膜偶联透析发酵解除了产物的反馈抑制作用,从而提高了嘌呤合成途径中相关酶的活性,进而使得菌体活力比较旺盛,降低了副产物乙偶姻的量,使得更多的碳源流向腺苷的合成,膜透析分离出发酵液中的结晶,使得发酵液中溶氧充足,使腺苷合成速率变大,糖苷转化率提高。目前透析发酵还存在一定的问题尚待解决,例如,每次透析时发酵液的体积控制精度差,透析过程中会造成部分菌体死亡等问题。如果这些问题能够得到很好的解决对于透析发酵提高产量将会有很大的帮助。
[1] 刘玥.腺苷生产菌XGL的定向改造及其发酵过程控制[D].天津:天津科技大学,2014.
LIU Y.Study on directed evolution of Bacillus subtilis XGL and optimization of adenosine fermentation process[D].Tianjin:Tianjin University of Science and Technology,2014.
[2] MAURER G,WILKENS J L,GRIESHABER M K.Modulatory effects of adenosine and adenine nucleotides on different heart preparations of the American lobster,Homarus americanus[J].Journal of Experimental Biology,2008,211(5):661-670.
[3] ZHANG Y,WERNLY B,CAO X,et al.Adenosine and adenosine receptor-mediated action in coronary microcirculation[J].Basic Research in Cardiology,2021,116(1):22.
[4] PROCOPIO M C,LAURO R,NASSO C,et al.Role of adenosine and purinergic receptors in myocardial infarction:Focus on different signal transduction pathways[J].Biomedicines,2021,9(2):204.
[5] LINDEN J.Adenosine in tissue protection and tissue regeneration[J].Molecular Pharmacology,2005,67(5):1 385-1 387.
[6] MAYNE M,SHEPEL P N,JIANG Y,et al.Dysregulation of adenosine A1 receptor-mediated cytokine expression in peripheral blood mononuclear cells from multiple sclerosis patients[J].Annals of Neurology,1999,45(5):633-639.
[7] SCHMID R D,HAMMELEHLE R.Pocket Guide to Biotechnology and Genetic Engineering[M].Weinheim:Wiley-VCH Verlag GmbH & Co.KGaA,2003.
[8] 张群.腺苷微生物发酵生产技术研究[J].食品与生物技术学报,2018,37(5):560.
ZHANG Q.Research on the production technology of adenosine by microbial fermentation[J].Journal of Food Science and Biotechnology,2018,37(5):560.
[9] 杜姗姗.腺苷工程菌的构建及其发酵过程优化[D].天津:天津科技大学,2013.
DU S S.Construction of adenosine engineering bacteria and optimization of fermentation process[D].Tianjin:Tianjin University of Science and Technology,2013.
[10] 徐达,梅漫莉,徐庆阳,等.生物素对L-缬氨酸发酵的影响[J].食品科学,2019,40(22):213-218.
XU D,MEI M L,XU Q Y,et al.Effect of biotin addition on microbial production of L-valine[J].Food Science,2019,40(22):213-218.
[11] 张玉富,熊海波,徐庆阳,等.生物素及膜偶联间歇透析发酵对黄色短杆菌生产L-亮氨酸的影响[J].食品与发酵工业,2019,45(9):15-20.
ZHANG Y F,XIONG H B,XU Q Y,et al.Effects of biotin and membrane coupled intermittent dialysis fermentation on the production of L-leucine by Brevibacterium flavum[J].Food and Fermentation Industries,2019,45(9):15-20.
[12] HUA X,CAO R,ZHOU X,et al.One-step continuous/semi-continuous whole-cell catalysis production of glycolic acid by a combining bioprocess with in situ cell recycling and electrodialysis[J].Bioresource Technology,2019,273:515-520.
[13] CAO R,XU Y.Efficient preparation of xylonic acid from xylonate fermentation broth by bipolar membrane electrodialysis[J].Applied Biochemistry and Biotechnology,2019,187(1):396-406.
[14] FOX S,BRUNER T,OREN Y,et al.Concurrent microbial reduction of high concentrations of nitrate and perchlorate in an ion exchange membrane bioreactor[J].Biotechnology and Bioengineering,2016,113(9):1 881-1 891.
[15] 张鑫喆,赵琳琳,徐方旭,等.HPLC不同流动相测定蛹虫草中虫草素和腺苷的比较[J].黑龙江农业科学,2018(4):130-132.
ZHANG X Z,ZHAO L L,XU F X,et al.Comparison of cordycepin and adenosine in Cordyceps militaris with different mobile phases by HPLC[J].Heilongjiang Agricultural Sciences,2018(4):130-132.
[16] 金文闻,陈雪敏,杨飘,等.国产玛咖中腺苷含量的高效液相色谱分析[J].食品科学,2016,37(12):148-151.
JIN W W,CHEN X M,YANG P,et al.Determination of adenosine in domestic maca by high performance liquid chromatography[J].Food Science,2016,37(12):148-151.
[17] 安超,马赛箭,薛文娇,等.HPLC法测定冬虫夏草菌丝体及发酵液中核苷类成分[J].食品研究与开发,2017,38(1):130-134.
AN C,MA S J,XUE W J,et al.HPLC determination of nucleosides of Cordyceps sinensis mycelium and fermentation broth[J].Food Research and Development,2017,38(1):130-134.
[18] 张显.高产乙偶姻枯草芽孢杆菌的代谢工程改造[D].无锡:江南大学,2013.
ZHANG X.Metabolic engineering and modification of acetoin high producing Bacillus subtilis[D].Wuxi:Jiangnan University,2013.
[19] 杨艳坤,王芬,孙杨,等.不同溶氧对谷氨酸棒杆菌代谢的影响[J].微生物学通报,2016,43(11):2 540-2 549.
YANG Y K,WANG F,SUN Y,et al.Effect of different dissolved oxygen concentrations on metabolism in Corynebacterium glutamicum[J].Microbiology China,2016,43(11):2 540-2 549.
[20] MALKOWSKI S N,ATILHO R M,GREENLEE E B,et al.A rare bacterial RNA motif is implicated in the regulation of the purF gene whose encoded enzyme synthesizes phosphoribosylamine[J].RNA,2020,26(12):1 838-1 846.
[21] BAZURTO J V,FARLEY K R,DOWNS D M.An unexpected route to an essential cofactor:Escherichia coli relies on threonine for thiamine biosynthesis[J].American Society for Microbiology,2016,7(1):e01840-15.
[22] KIM J H,KRAHN J M,TOMCHICK D R,et al.Structure and function of the glutamine phosphoribosylpyrophosphate amidotransferase glutamine site and communication with the phosphoribosylpyrophosphate site[J].Journal of Biological Chemistry,1996,271(26):15 549-15 557.
[23] LI B,YAN Z Y,LIU X N,et al.Increased fermentative adenosine production by gene-targeted Bacillus subtilis mutation[J].Journal of Biotechnology,2019,298:1-4.
[24] WANG X Y,WANG G L,LI X L,et al.Directed evolution of adenylosuccinate synthetase from Bacillus subtilis and its application in metabolic engineering[J].Journal of Biotechnology,2016,231:115-121.
[25] ASAHARA T,MORI Y,ZAKATAEVA N P,et al.Accumulation of gene-targeted Bacillus subtilis mutations that enhance fermentative inosine production[J].Applied Microbiology & Biotechnology,2010,87(6):2 195-2 207.
[26] 龚卫华,向卓亚,叶发银,等.笋壳醋酸木质素对葡萄糖透析延迟指数、发酵特性及酶活力的影响[J].食品与发酵工业,2017,43(12):55-60.
GONG W H,XIANG Z Y,YE F Y,et al.Effects of lignin from bamboo shoot shell on the glucose dialysis retardation index,fermentation property and enzyme activity[J].Food and Fermentation Industries,2017,43(12):55-60.