老陈醋是一种以大曲为发酵剂经自然固态发酵的传统发酵食品,是我国四大名醋之一。独特的酿造工艺赋予了老陈醋醇、香、绵、柔的风味与口感[1-2]。老陈醋的香气是评价其质量的重要依据[3],主要依靠不同种类的物质协同实现[4]。其中,香气浓郁的酯类物质在老陈醋独特香气形成中发挥了重要的作用[5]。在老陈醋所包含的酯类物质中,乙酸乙酯所占比例最高,占香气成分的60%以上[6]。因此,如何提高老陈醋中乙酸乙酯的含量对于进一步提升老陈醋的质量至关重要。在老陈醋的发酵过程中,乙酸乙酯主要来源于产酯酵母的代谢[7],这类酵母能够在生长过程中利用葡萄糖为底物代谢产生乙醇、乙酸,并在自身酯化酶的催化作用下合成乙酸乙酯[8]。因此,筛选高产酯酵母也就成为了科研工作的重点研究之一。
我国科研工作者在筛选高产酯酵母上做了大量的工作。陈嘉等[9]从山西老陈醋发酵过程的酒醅中分离筛选产酯酵母,得到的3株产酯酵母中,1株毕赤酵母Y14与大曲混合发酵后,酿制的老陈醋乙酸乙酯含量较对照组提高了1.3倍。董凯锋等[10]从水塔老陈醋大曲中分离得到1株产乙酸乙酯的异常威克汉姆酵母m12,其乙酸乙酯产量可以达到4.441 5 g/L。张杰等[11]从清香型小曲中筛选高产乙酸乙酯的酵母菌,得到1株异常毕赤酵母Y7,将其应用于清香型白酒的发酵中,其产乙酸乙酯含量为2.86 g/L,是传统工艺酿造清香型白酒乙酸乙酯含量的1.5倍。目前对高产酯酵母筛选及功能特性的研究,虽然在一定程度上提高了乙酸乙酯的产量,但仍然无法满足实际生产应用的需求。
本研究以通过来自不同食醋企业、白酒企业的醋醅、酒曲样品为分离源,以筛选具有高产乙酸乙酯性能的酵母菌株为目的,研究其发酵相关功能特性。同时,对其产酯条件进行优化,旨在为产酯酵母的工业化生产提供研究参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
样品来源:山西多家食醋企业提供的醋醅、大曲样品;四川白酒企业提供的酒曲和酒醅样品。
酵母浸出粉、蛋白胨、葡萄糖、孟加拉红培养基,北京奥博星生物技术有限责任公司;琼脂粉,Biotopped;无水乙醇,天津市大茂化学试剂厂;山梨醇,浙江凯维嘉生物科技有限公司;酵母基因组DNA提取试剂盒,天根生化科技(北京)有限公司;酵母菌PCR通用引物NL1和NL4、10×PCR buffer、dNTP、Taq DNA聚合酶、6×Loading Buffer,生工生物工程(上海)股份有限公司;安琪生香活性干酵母,湖北宜昌安琪酵母股份有限公司。
YPD液体培养基(g/L):酵母浸出粉 10.0,蛋白胨 20.0,葡萄糖 20.0,115℃灭菌30 min;
YPD固体培养基(g/L):酵母浸出粉 10.0,蛋白胨 20.0,葡萄糖 20.0,琼脂粉 20.0,115℃灭菌30 min;
孟加拉红培养基(g/L):蛋白胨 5.0,KH2PO4 1.0,MgSO4 0.5,葡萄糖 10.0,氯霉素 0.1,孟加拉红 0.033,琼脂 20.0,121℃灭菌20 min;
产酯培养基(g/L):酵母浸出粉10.0,蛋白胨20.0,葡萄糖80.0,115 ℃灭菌30 min。
高粱汁培养基[12]:100 g高粱粉碎后加入800 mL蒸馏水煮沸1 h,适温加入糖化酶与β-淀粉酶,于60 ℃水浴2~4 h,将过滤得到的滤液糖度调整为7°Brix。
1.1.2 仪器与设备
电子天平,梅特勒-托利多公司;微量移液枪,RAININ公司;立式电热压力蒸汽灭菌锅,上海申安医疗器械厂;LRH-250生化培养箱、涡旋振荡器,美国Scientific Industries有限公司;高速微量离心机,湖南恒诺仪器设备有限公司;Biosystems Model温度梯度PCR仪、Tanon1600凝胶成像仪,美国伯乐公司;BG-Power600电泳仪,北京百晶生物技术有限公司;双人单面超净工作台,苏州净化设备有限公司;Auto System XL气相色谱仪;CP-Wax 57CB毛细管色谱柱(50 m×0.25 mm×0.2 μm),美国Perkin Elmer公司。
1.2 方法
1.2.1 酵母菌的分离纯化
称取10 g样品(大曲、醋醅或酒醅)置于装有90 mL无菌蒸馏水的三角瓶中,28 ℃、150 r/min振荡培养30 min。吸取菌悬液1 mL于9 mL无菌蒸馏水中,并依次进行梯度稀释,配制成稀释倍数为10-2、10-3、10-4、10-5、10-6的菌悬液。分别取100 μL稀释倍数为10-4、10-5和10-6的菌悬液均匀涂布于孟加拉红培养基上,置于28 ℃恒温培养2~3 d[13-14]。挑取具有典型酵母菌落特征的单菌落于YPD固体培养基上划线分离纯化。将具有酵母菌特性的菌株转接于YPD斜面培养基中,于4 ℃进行保存备用[15]。
1.2.2 酵母菌株形态学鉴定
挑取保存于斜面培养基上的菌株,接种于YPD固体培养基上,28 ℃恒温培养2 d活化,观察菌落形态。同时,取少量菌体用于显微镜下镜检观察[16]。
1.2.3 酵母菌株分子鉴定
取1 mL活化的酵母菌液,离心收集菌体,收集到的菌体经磷酸缓冲液清洗。然后,利用酵母基因组提取试剂盒提取酵母菌基因组DNA,提取的基因组DNA质量通过核酸蛋白测定仪ND-1000进行检测。研究中以分离的不同酵母基因组DNA为模板,以NL1和NL4为引物[17],扩增26S rDNA目标基因对酵母菌株进行分子鉴定。用于扩增的PCR反应体系如下(25 μL):10×PCR buffer 2.5 μL;dNTP 2.0 μL,Taq DNA聚合酶0.3 μL,引物各1.0 μL;DNA模板1.0 μL;ddH2O 17.2 μL。PCR反应条件:95 ℃预变性4 min;95 ℃变性45 s;55 ℃退火45 s;72 ℃延伸1 min;35次循环;72 ℃修复延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测合格后,送生工生物工程(上海)股份有限公司测序,测序结果在NCBI数据库中进行同源性比对分析。
1.2.4 酵母菌株产乙酸乙酯能力测定
挑取保存的酵母菌株于YPD液体培养基中,于28 ℃、150 r/min活化24 h。然后以10%的接种量接种于100 mL 7°Brix高粱汁培养基中,于28 ℃、150 r/min培养5 d[18]。将酵母菌液再分别接种于产酯培养基和添加少量乙醇、乙酸的高粱汁培养基中,以同样的培养条件进行复筛。利用Auto System XL气相色谱仪对发酵液中的乙酸乙酯含量进行测定。分析条件:CP-Wax 57CB毛细管色谱柱(50 m×0.25 mm×0.2 μm);起始温度30 ℃,恒温5 min,以5 ℃/min程序升温至60 ℃,以6 ℃/min程序升温至120 ℃,恒温5 min,以8 ℃/min程序升温至210 ℃,恒温5 min;载气(高纯氮):流速1 mL/min,分流比为10∶1;氢气:流速为45 mL/min;空气:流速为450 mL/min;检测器温度:260 ℃;进样器温度:240 ℃;进样量:1 μL。
1.2.5 筛选菌株发酵相关特性研究
本研究从葡萄糖[19]、乙醇[20]、pH[21]、温度[22]耐受性4个方面考察酵母菌株的发酵相关特性。将活化的酵母菌液以2%的接种量分别接种于不同条件的YPD液体培养基中,置于摇床中振荡培养24 h。培养好的菌液于620 nm处测量其OD值。葡萄糖质量浓度梯度设置为100、200、300、400、500 g/L;乙醇体积分数梯度设置为6%、8%、10%、12%、14%;pH(用1 mol/L的盐酸进行调节)梯度设置为1.5、2、2.5、3、4;温度梯度设置为34、36、38、40和42 ℃。
1.2.6 酵母菌株产乙酸乙酯条件的研究
1.2.6.1 单因素发酵条件对乙酸乙酯产量的影响研究
为了探究葡萄糖浓度、温度、pH、发酵时间以及乙醇含量在发酵过程中对乙酸乙酯产量的影响,研究中将筛选出的酵母菌株按照不同发酵条件接种于高粱汁培养基中,于摇床中振荡培养,通过检测乙酸乙酯的含量来确定各个单因素的最佳条件范围[23-24]。培养基的pH值用1 mol/L的盐酸进行调节,乙酸乙酯的检测方法同1.2.4。
1.2.6.2 正交试验
在单因素试验的基础上,结合实际发酵情况,选取温度、pH值、乙醇含量(体积分数)3个因素,采用3因素3水平正交试验[25-27]来进一步考察对乙酸乙酯产量的影响,正交条件如表1所示。
表1 酵母产乙酸乙酯3因素3水平正交条件表
Table 1 Factors and levels of orthogonal test for the production of ethyl acetate
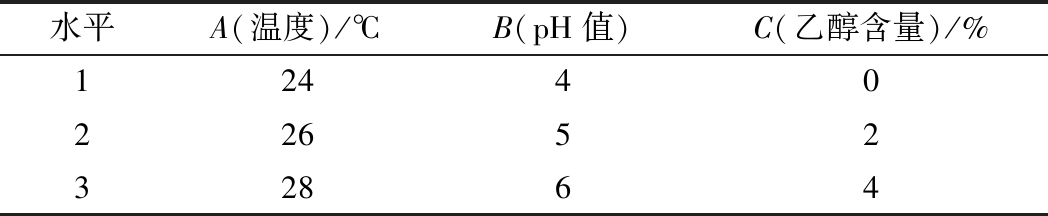
水平A(温度)/℃B(pH值)C(乙醇含量)/%124402265232864
1.2.7 数据处理
实验数据采用Origin及SPSS Statistics 26软件进行分析及作图。
2 结果与分析
2.1 酵母菌株的筛选与鉴定
结合菌落形态特征以及菌株镜检观察的结果,从醋醅和酒醅中初步筛选得到了14株菌株,编号为Y1~Y14,典型菌株平板划线图及镜检图见图1。筛选的酵母菌株菌落形态多为圆形,表面光滑、呈乳白色,部分表面有绒毛、呈奶油色。显微镜镜检结果表明,在40倍放大的条件下观察得到的酵母细胞形状为圆形、卵圆形及椭圆形。
a-Y10平板图;b-Y10平板图;c-Y12平板图;d-Y12平板图
图1 菌株Y10、Y12平板划线图及镜检图
Fig.1 Strain Y10,Y12 plate and microscopic images
在形态学观察的基础上,对所筛选出的14株菌进一步进行分子水平鉴定。PCR扩增26S rDNA产物的1%琼脂糖凝胶电泳结果见图2。扩增得到的片段大小在600 bp左右,符合目的产物要求。
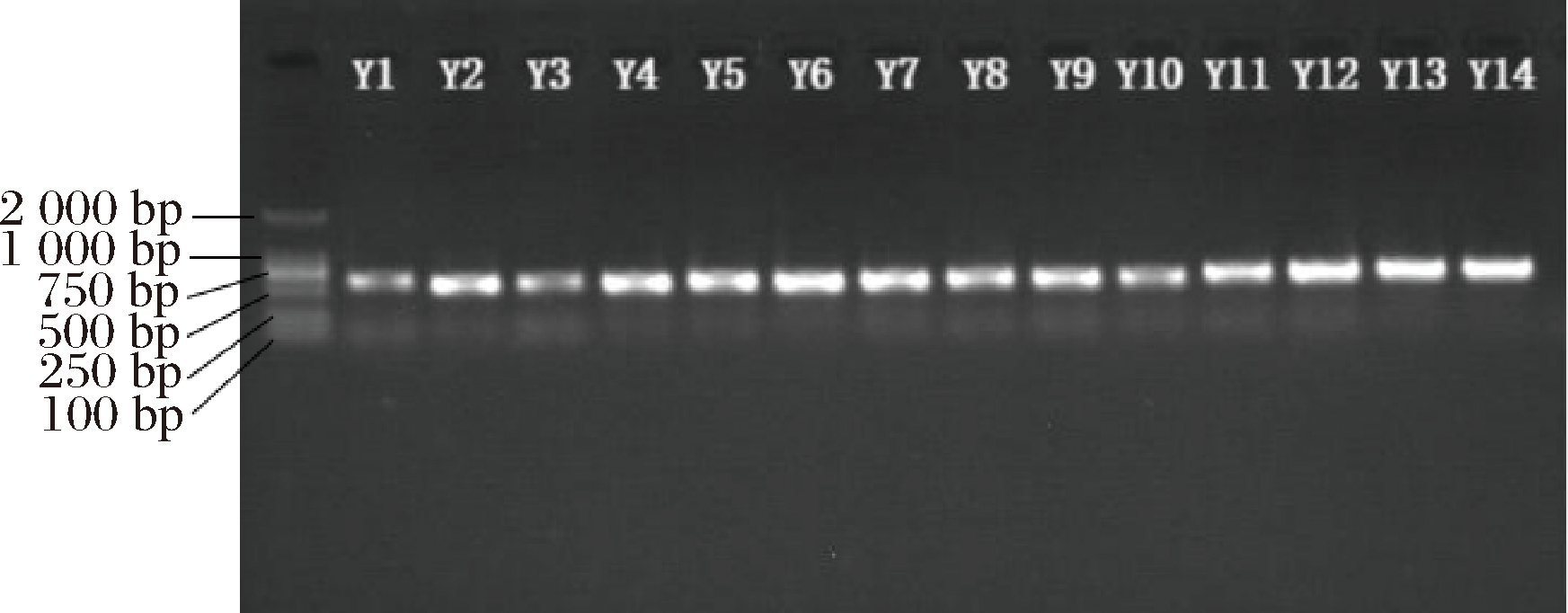
图2 不同菌株26S rDNA PCR扩增结果
Fig.2 PCR amplification results of 26S rDNA of different strains
将PCR产物送生工生物工程(上海)股份有限公司进行测序,所得序列在NCBI数据库中进行BLAST同源性比对,比对结果如表2。鉴定结果表明,14株酵母菌株中有9株葡萄牙棒孢酵母,2株异常威克汉姆酵母和3株毕赤酵母。
表2 酵母菌株26S rDNA鉴定结果
Table 2 Identification of yeast strains by 26S rDNA
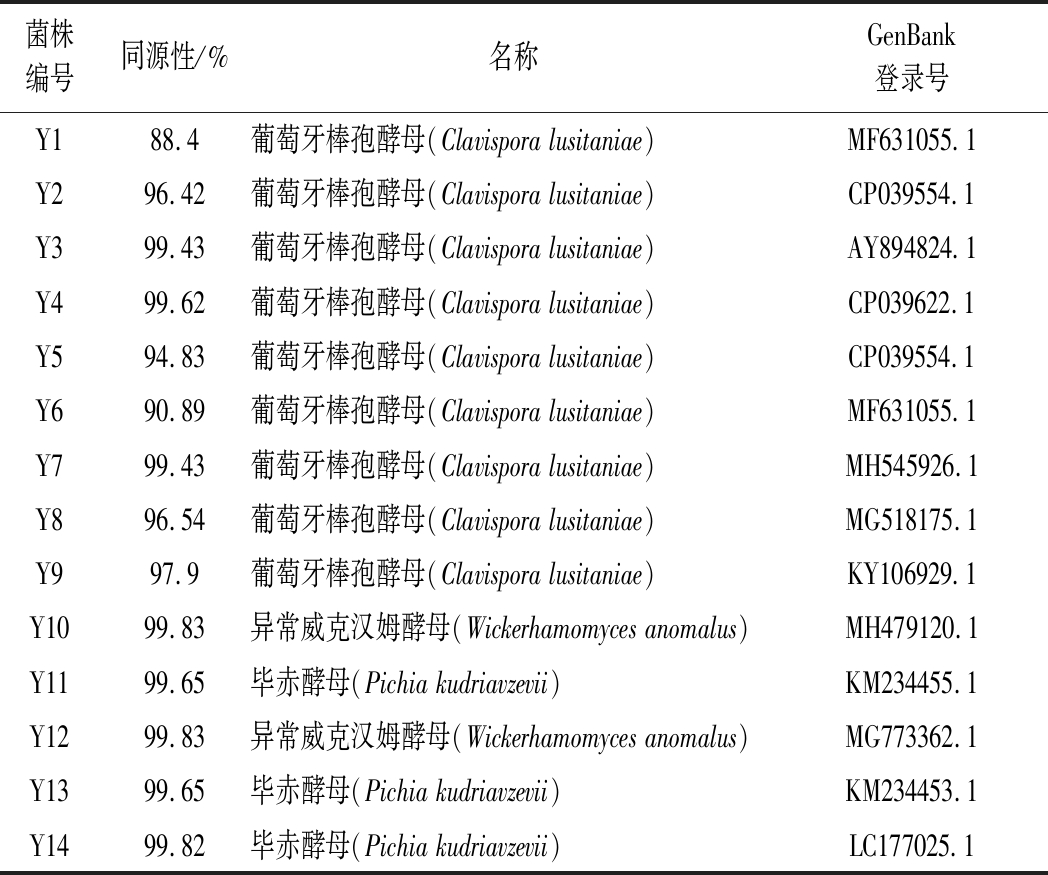
菌株编号同源性/%名称GenBank登录号Y188.4葡萄牙棒孢酵母(Clavispora lusitaniae)MF631055.1Y296.42葡萄牙棒孢酵母(Clavispora lusitaniae)CP039554.1Y399.43葡萄牙棒孢酵母(Clavispora lusitaniae)AY894824.1Y499.62葡萄牙棒孢酵母(Clavispora lusitaniae)CP039622.1Y594.83葡萄牙棒孢酵母(Clavispora lusitaniae)CP039554.1Y690.89葡萄牙棒孢酵母(Clavispora lusitaniae)MF631055.1Y799.43葡萄牙棒孢酵母(Clavispora lusitaniae)MH545926.1Y896.54葡萄牙棒孢酵母(Clavispora lusitaniae)MG518175.1Y997.9葡萄牙棒孢酵母(Clavispora lusitaniae)KY106929.1Y1099.83异常威克汉姆酵母(Wickerhamomyces anomalus)MH479120.1Y1199.65毕赤酵母(Pichia kudriavzevii)KM234455.1Y1299.83异常威克汉姆酵母(Wickerhamomyces anomalus)MG773362.1Y1399.65毕赤酵母(Pichia kudriavzevii)KM234453.1Y1499.82毕赤酵母(Pichia kudriavzevii)LC177025.1
2.2 酵母菌株产乙酸乙酯能力测定
利用高粱汁作为发酵培养基,对筛选得到的14株酵母菌株进行产乙酸乙酯能力的测定,检测结果见表3。14株酵母菌株产乙酸乙酯的能力具有显著差异。其中菌株Y10和Y12表现出较强的产乙酸乙酯能力,乙酸乙酯含量分别达到了6.68和4.73 g/L。其他菌株虽有产乙酸乙酯的能力,但均弱于Y10和Y12。因此,选用Y10和Y12这2株菌进行后续的发酵性能测试。
表3 不同菌株产乙酸乙酯情况
Table 3 Ethyl acetate production by different strains
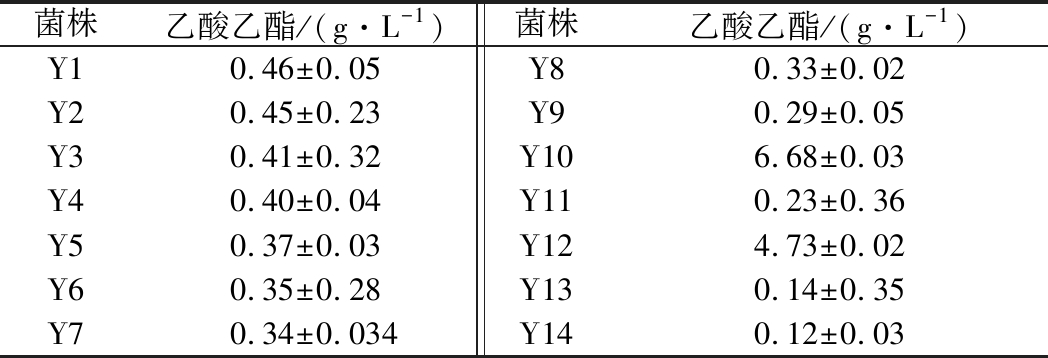
菌株乙酸乙酯/(g·L-1)菌株乙酸乙酯/(g·L-1)Y10.46±0.05Y80.33±0.02Y20.45±0.23Y90.29±0.05Y30.41±0.32Y106.68±0.03Y40.40±0.04Y110.23±0.36Y50.37±0.03Y124.73±0.02Y60.35±0.28Y130.14±0.35Y70.34±0.034Y140.12±0.03
为探究菌株Y10和Y12产乙酸乙酯能力的稳定性,选用产酯培养基和不同成分高粱汁培养基进行复测(表4)。结果表明,菌株Y10和Y12在这2种培养基中也均表现出了较高的产乙酸乙酯能力,在添加少量乙醇、乙酸的高粱汁培养基中,2株菌的乙酸乙酯产量分别达到了9.01和7.05 g/L。在产酯培养基中,虽然乙酸乙酯产量较普通高粱汁培养基略有降低,但2株菌株依旧表现出了较高的产乙酸乙酯能力,并分别达到了4.56和3.51 g/L。且与对照菌株(市售某知名产酯酵母)相比较,这2株酵母产乙酸乙酯能力均具有相对优势。
表4 不同培养基菌株产乙酸乙酯情况 单位:g/L
Table 4 Ethyl acetate production by strains in different media

菌株7°Brix高粱汁7°Brix高粱汁(含乙醇+乙酸)产酯培养基Y106.68±0.0349.01±0.044.56±0.02Y124.73±0.027.05±0.033.51±0.025市售产酯酵母5.00±0.0256.26±0.0213.34±0.03
2.3 酵母菌株发酵相关特性研究
发酵过程中随着糖化的进行,发酵液的糖度也在不断升高,这使整个发酵环境的渗透压被改变,从而对菌株的正常生长代谢和繁殖造成影响。为此,研究中首先考察不同葡萄糖浓度对菌株生长的影响。结果如图3-a所示,当培养基中的葡萄糖含量不断增加时,菌株的活性在不断降低,当葡萄糖含量高于300 g/L时,酵母菌Y10、Y12以及对照菌株(市售某知名产酯酵母)的生长均受到了不同程度的抑制。其中,Y12表现出了最强的葡萄糖浓度耐受性,即在3株酵母中Y12具有最强的耐高渗能力。
乙醇是酵母菌发酵的产物,酵母菌可利用乙醇和乙酸在酶的作用下合成乙酸乙酯[28],发酵过程中不断累积的乙醇浓度会对酵母菌的生长产生抑制作用。菌株的乙醇耐受性检测结果如图3-b所示。当乙醇体积分数低于10%时,被测酵母菌株均生长良好,同时,Y10和Y12对乙醇的耐受性整体优于对照菌株。
在发酵过程中,乳酸菌和醋酸菌等代谢会产生一定的乳酸和醋酸,导致发酵体系的pH值降低。因此具有良好的酸耐受性也是优良酵母菌株应具备的生物学性质之一。在图3-c中可见,菌株Y10与Y12即使在pH为3~4时仍然生长良好,而且,Y12在pH为2.5时也表现出了较好的活性,其酸耐受性明显优于参考菌株,说明菌株具有良好的环境适应性。
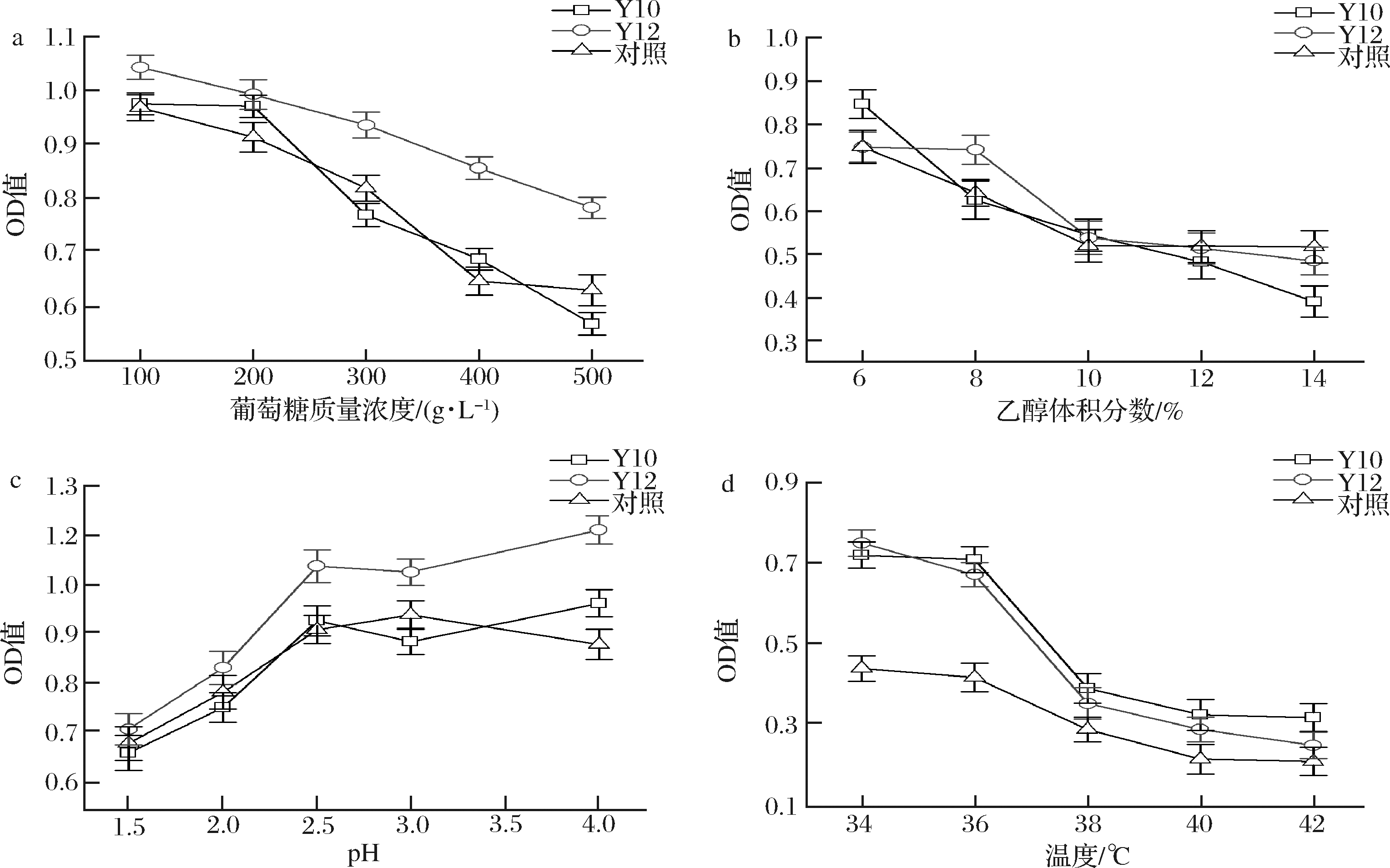
a-葡萄糖质量浓度;b-乙醇体积分数;c- pH;d-温度
图3 不同条件下酵母菌株的生长情况
Fig.3 Growth of yeasts strains at different conditions
除了以上3个条件外,温度也是影响微生物生长代谢的重要因素之一,过高的温度会影响微生物中酶的活性,从而减少代谢产物的生成。菌株的温度耐受性结果如图3-d所示,当温度逐渐升高时,菌株的活性在不断降低,菌株的生长受到了明显的抑制。当温度为36 ℃时,Y10和Y12尚能表现出较好的生存活力,表明两菌株对高温具有较好的耐受性。
2.4 单因素发酵条件对酵母菌株产乙酸乙酯能力的影响
在考察了菌株的基本发酵特性后,本研究从5个因素,包括葡萄糖浓度(6~12 °Brix)、温度(24~30 ℃)、pH值(2~6)、乙醇体积分数(0~8%)和发酵时间(3~7 d),对筛选到的2株高产乙酸乙酯菌株的发酵条件做了进一步研究,用以了解单因素发酵条件对菌株产酯能力的影响。如图4-a所示,当糖度为8°Brix时,菌株Y10和Y12的乙酸乙酯产量最高,分别达到2.47和1.62 g/L。研究中随着糖度的升高,发酵环境的渗透压也在逐渐增大,而较高的渗透压破坏了酵母菌的细胞形态,从而影响了菌株的生长代谢,并最终导致菌株产乙酸乙酯能力降低[29]。在考察温度对酵母菌产乙酸乙酯能力的影响时发现(图4-b),菌株Y10与Y12的乙酸乙酯产量随着温度升高也呈现明显的下降趋势,这可能是因为,过高的温度会引起菌株内相关酶活性的下降,并促进酵母体内合成较多的热激蛋白,而乙酸乙酯的产量也相对减少[30]。在24 ℃时产量最高,2株菌的产酯能力分别达到9.59和7.47 g/L。因此,过高的糖度和温度均可导致乙酸乙酯产量的下降。
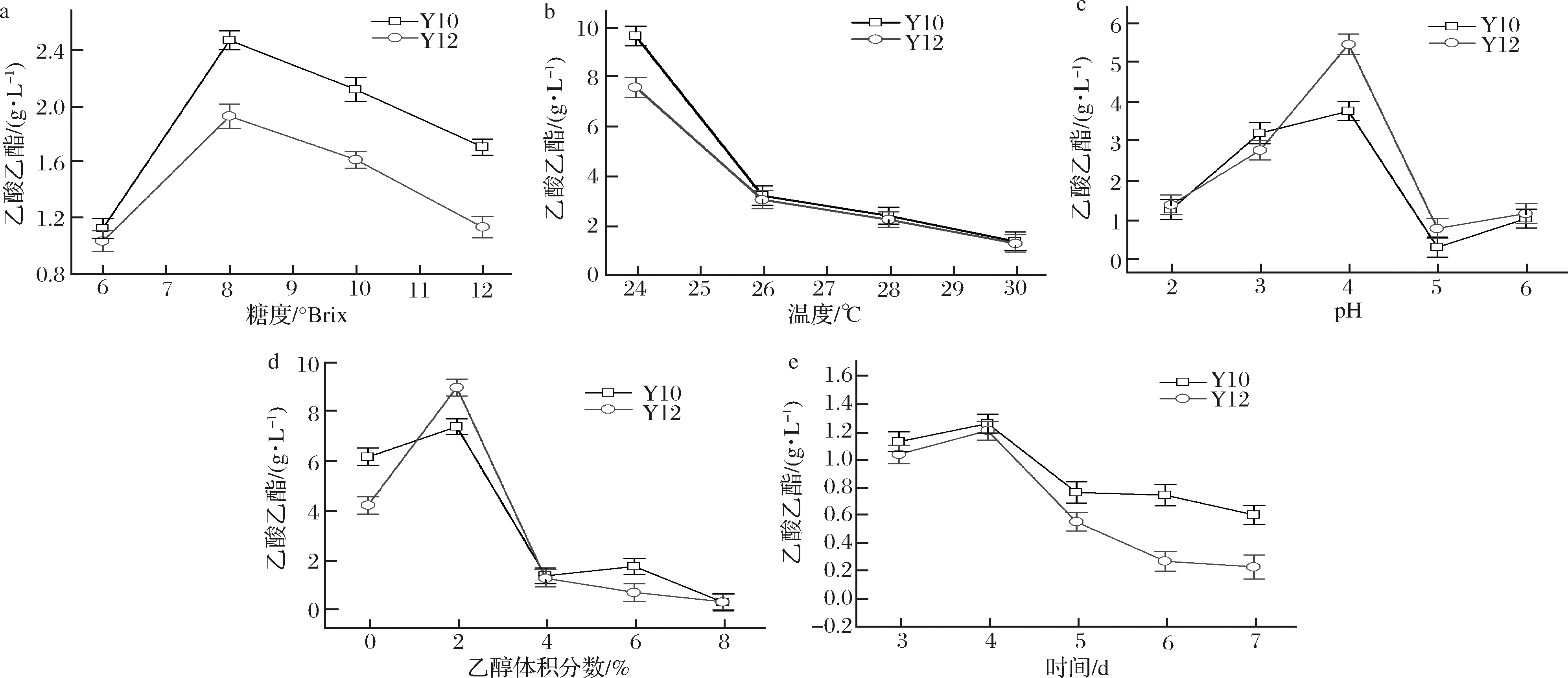
a-糖度;b-温度;c- pH;d-乙醇体积分数;e-发酵时间
图4 单因素发酵条件对酵母菌株乙酸乙酯产量的影响
Fig.4 Effect of different fermentation conditions on yield of ethyl acetate
pH值和乙醇含量也在不同程度上影响着酵母菌株的乙酸乙酯产量。如图4-c所示,当pH为4时,Y10和Y12的乙酸乙酯产量均达到最高值,分别为3.87和5.62 g/L。当pH值偏高或偏低时,对菌株的生长代谢均有明显的抑制。同样,在考察乙醇对菌株乙酸乙酯产量的影响时发现,乙醇体积分数为2%时Y10和Y12的乙酸乙酯产量分别达到了7.26和8.86 g/L(图4-d)。陈醋发酵过程中,乙醇量在发酵前期是逐渐积累和增加的。高浓度的乙醇会对酵母细胞产生一定的毒害效应[31],同时也会促进酵母细胞体内海藻糖代谢增加来提升其乙醇耐受性[32],从而可能减弱了酵母菌自身利用乙醇产乙酸乙酯的能力。
发酵时间也是控制酵母菌株乙酸乙酯产量的重要因素之一。图4-e表明,在发酵第4天,Y10和Y12两株菌株的乙酸乙酯产量均达到最高,分别为1.264和1.21 g/L。发酵时间过短会导致发酵不足,乙酸乙酯的产量降低;而发酵时间过长菌株活力有所下降,加之乙酸乙酯的挥发量的增加,都会导致乙酸乙酯的产量的减少[33]。
2.5 正交试验结果与分析
根据单因素试验结果并结合实际发酵情况,进一步对菌株产乙酸乙酯能力影响较大的3个主要因素,包括温度、pH、乙醇含量,进行正交试验,以确定菌株Y10和Y12产乙酸乙酯的最优生产条件。结果如表5、表6所示,在A(温度)、B(pH值)、C(乙醇浓度)3个影响因素中乙醇体积分数对乙酸乙酯的产量影响程度最大,3个因素的影响程度由高到低排序为C>A>B。根据试验结果综合分析,最优组合为A3B3C2,即在28 ℃、pH 6,乙醇体积分数为2%的条件下,菌株Y10和Y12的乙酸乙酯产量最高,分别能够达到13.18和12.92 g/L,相比于优化前分别显著提高了4.17和5.87 g/L。
表5 Y10产乙酸乙酯条件正交实验结果
Table 5 Orthogonal experiment results of Y10 for the production of ethyl acetate
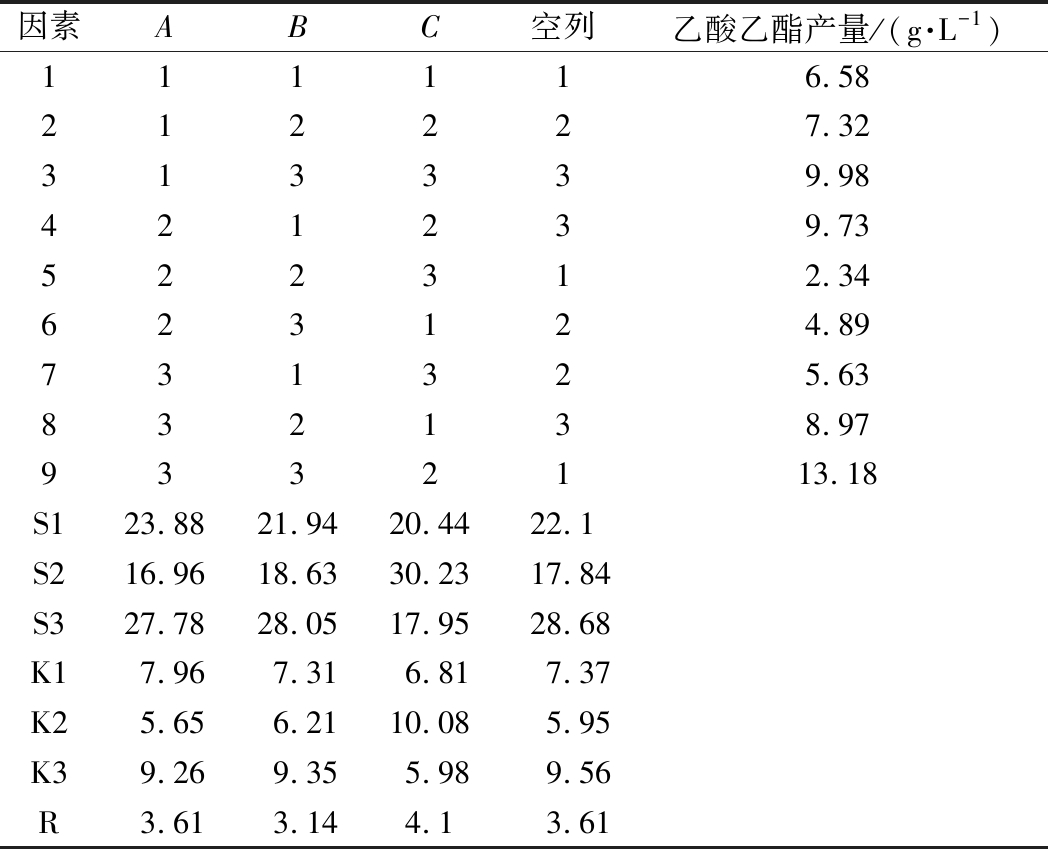
因素ABC空列乙酸乙酯产量/(g·L-1)111116.58212227.32313339.98421239.73522312.34623124.89731325.63832138.979332113.18S123.8821.9420.4422.1S216.9618.6330.2317.84S327.7828.0517.9528.68K17.967.316.817.37K25.656.2110.085.95K39.269.355.989.56R3.613.144.13.61
表6 Y12产乙酸乙酯条件正交实验结果
Table 6 Orthogonal experiment results of Y12 for the production of ethyl acetate
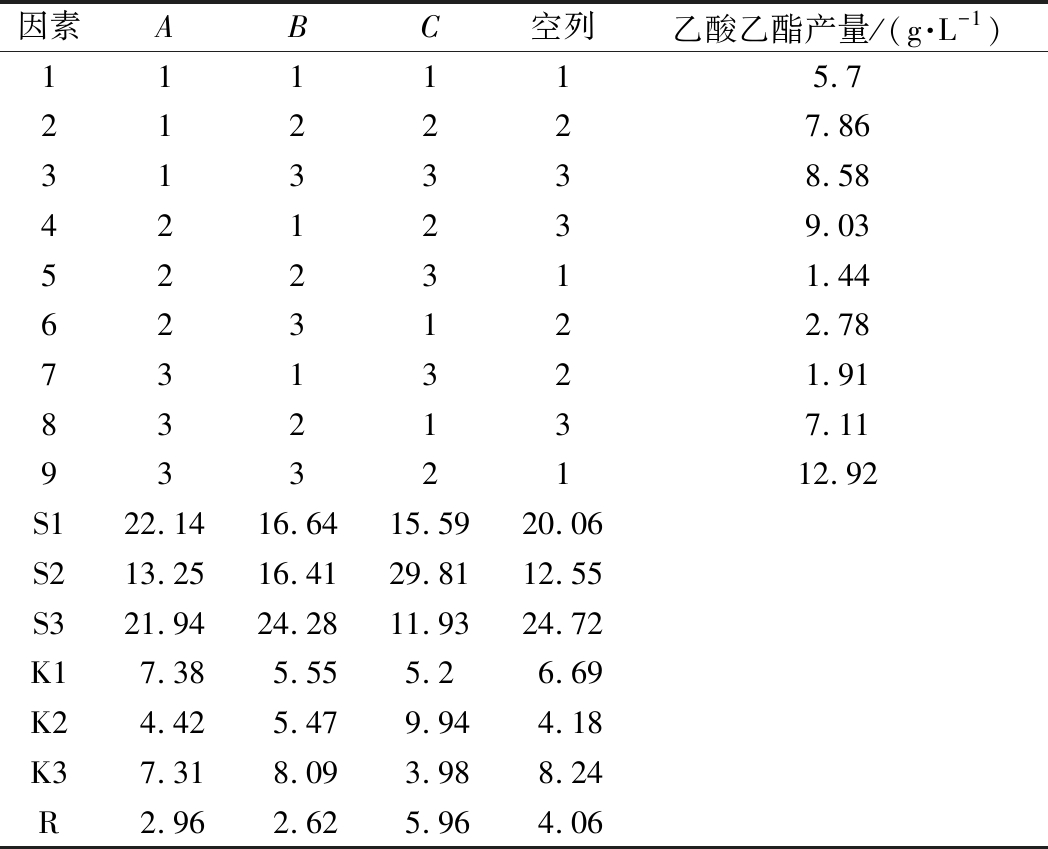
因素ABC空列乙酸乙酯产量/(g·L-1)111115.7212227.86313338.58421239.03522311.44623122.78731321.91832137.119332112.92S122.1416.6415.5920.06S213.2516.4129.8112.55S321.9424.2811.9324.72K17.385.555.26.69K24.425.479.944.18K37.318.093.988.24R2.962.625.964.06
3 结论
从工业化醋醅、酒醅样品中分离得到了14株酵母菌株,分别进行产乙酸乙酯能力的测定。其中2株酵母菌株Y10和Y12表现出了较高的产乙酸乙酯能力,产量分别达到了6.68和4.73 g/L,经鉴定2株酵母均为异常威克汉姆酵母(Wickerhamomyces anomalus)。结果表明,异常威克汉姆酵母Y10和Y12对发酵环境中的葡萄糖、酸、乙醇和温度的变化均具有良好的耐受性。当发酵条件为:pH 6、乙醇体积分数2%、温度28 ℃时,菌株Y10和Y12乙酸乙酯的产量最高,分别能够达到13.18和12.92 g/L。相比优化前,2株酵母的产酯能力分别显著提高了4.17和5.87 g/L。异常威克汉姆酵母Y10和Y12具有较高的产乙酸乙酯能力,具有较强的实际应用潜力。
[1] 张天震,孙晓琪,刘丹彤,等.山西老陈醋大曲细菌群落结构及多样性研究[J].中国食品学报,2021,21(5):323-330.
ZHANG T Z,SUN X Q,LIU D T,et al.Studies on bacterial community structure and diversity in Daqu from Shanxi aged vinegar[J].Journal of Chinese Institute of Food Science and Technology,2021,21(5):323-330.
[2] 刘丹彤,刘峰,康帅帅,等.传统山西老陈醋熏醅工艺过程风味物质及功能活性成分的变化[J].中国酿造,2021,40(2):163-169.
LIU D T,LIU F,KANG S S,et al.Changes of flavor substances and functional active components in fumigation process of traditional Shanxi aged vinegar[J].China Brewing,2021,40(2):163-169.
[3] WANG Z M,LU Z M,SHI J S,et al.Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J].Scientific Reports,2016,6:26818.
[4] 范梦蝶,王天泽,杜文斌,等.山西老陈醋晾晒前、后挥发性香味物质比较分析[J].中国食品学报,2019,19(12):229-242.
FAN M D,WANG T Z,DU W B,et al.Comparison of volatile flavor compounds in Shanxi aged vinegar before and after aging[J].Journal of Chinese Institute of Food Science and Technology,2019,19(12):229-242.
[5] CHEN J,XING X Y,FENG Z H,et al.Screening and aroma characteristics of ester-producing yeasts as starter cultures for Shanxi aged vinegar[J].Food Science,2019,40(16):144-151.
[6] ZHENG X W,YAN Z,NOUT M J R,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].International Journal of Food Microbiology,2014,182-183:57-62.
[7] 李婷,张磊,杨宇霞,等.山西老陈醋熏醅阶段风味物质的动态变化[J].中国调味品,2020,45(8):65-68.
LI T,ZHANG L,YANG Y X,et al.Dynamic changes of flavor substances of Shanxi aged vinegar during fumigation process[J].China Condiment,2020,45(8):65-68.
[8] 程伟,彭兵,汪焰胜,等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒,2018,45(5):43-47.
CHENG W,PENG B,WANG Y S,et al.Screening of one yeast strain with high-yield of ethyl acetate from Fen-flavor liquor fermenting-grains and analysis of its application performance[J].Liquor Making,2018,45(5):43-47.
[9] 陈嘉,冯志宏,施俊凤.传统山西老陈醋增香酵母菌的筛选及其特性研究[J].保鲜与加工,2020,20(1):120-126.
CHEN J,FENG Z H,SHI J F.Screening and characteristics study of flavoring yeast from traditional Shanxi aged vinegar[J].Storage and Process,2020,20(1):120-126.
[10] 董凯锋,安娜,李东乐,等.水塔老陈醋大曲酵母的分离鉴定及产乙醇和乙酸乙酯特性[J].食品工业科技,2016,37(10):213-216.
DONG K F,AN N,LI D L,et al.Isolation and identification of yeast in Daqu for aged vinegar production and their capacity for producing ethly alcohol and ethly acetate[J].Science and Technology of Food Industry,2016,37(10):213-216.
[11] 张杰,程伟,巩子路,等.一株高产乙酸乙酯酵母菌的筛选及其鉴定[J].酿酒,2018,45(6):59-62.
ZHANG J,CHENG W,GONG Z L,et al.Screening and identification of a strain with high yield of ethyl acetate yeast[J].Liquor Making,2018,45(6):59-62.
[12] 唐洁.清香型小曲酒微生物群落结构及功能的研究[D].江南大学,2012.
TANG J.Characterization of the structure and function of the microbial community in light aroma type liquor started by Xiaoqu[D].Wuxi:Jiangnan University,2012.
[13] 崔海灏.十里香酒产酯酵母的筛选及应用研究[D].保定:河北大学,2020.
CUI H H.A study on the screening and application of ester-producing yeast from Shilixiang[D].Baoding:Hebei University,2020.
[14] 王媛慧.山西老陈醋大曲中优良酵母菌的分离鉴定及发酵应用研究[D].太谷:山西农业大学,2014.
WANG Y H.Screening and identification of quality yeast strains in daqu of Shanxi-super vinegar and research on fermentation[D].Taigu:Shanxi Agricultural University,2014.
[15] 邢晓莹,刘毅,霍乃蕊,等.山西老陈醋中优良酵母菌株筛选及其在木枣果酒发酵中的应用[J].中国酿造,2021,40(3):64-72.
XING X Y,LIU Y,HUO N R,et al.Screening of excellent yeast strains in Shanxi-aged vinegar and their application in jujube wine fermentation[J].China Brewing,2021,40(3):64-72.
[16] 查枢屏,李兰,董琪,等.古井贡大曲中高产酯酵母的分离及分子学鉴定[J].酿酒,2017,44(4):45-48.
ZHA S P,LI L,DONG Q,et al,Isolation and molecular identification of high ester yeast Gujinggong Daqu[J].Liquor Making,2017,44(4):45-48.
[17] 王鹏昊,关统伟,张习超,等.小曲中优质产酯酵母分离鉴定及其产酯条件优化[J].食品与发酵工业,2018,44(2):62-67.
WANG P H,GUAN T W,ZHANG X C,et al.Isolation and identification of efficient ester-producing yeast in Xiaoqu and optimization of ester production conditions[J].Food and Fermentation Industries,2018,44(2):62-67.
[18] 李志辉,任蓓蕾,朱健辉,等.一株产乙酸乙酯酵母C42的分离与鉴定[J].食品工业科技,2014,35(8):188-191.
LI Z H,REN B L,ZHU J H,et al.Isolation and identification of an ethyl acetate producing yeast strain C-42[J].Science and Technology of Food Industry,2014,35(8):188-191.
[19] 王晓丹,韩超,印丽,等.白酒酿造过程中耐高糖酵母的筛选及发酵产多元醇分析[J].中国酿造,2020,39(8):54-58.
WANG X D,HAN C,YIN L,et al.Screening of high-sugar-tolerant yeast in Baijiu brewing and analysis of polyhydric alcohols production by fermentation[J].China Brewing,2020,39(8):54-58.
[20] 刘建学,刘金科,李璇,等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械,2020,36(6):42-49.
LIU J X,LIU J K,LI X,et al.Screening,identification and fermentation performance of a high-yield yeast from fermented grains of Dukang wine[J].Food&Machinery,2020,36(6):42-49.
[21] 史雁飞.高产乙酸乙酯且有耐受性酵母的选育及固定化研究[D].临汾:山西师范大学,2019.
SHI Y F.Breeding and immobilization of high-yield ethyl acetate and tolerant Saccharomyces cerevisiae[D].Linfen:Shanxi Normal University,2019.
[22] 刘兴艳,潘军,顾一洪,等.四株野生酵母菌株耐受性的研究[J].食品工业科技,2015,36(1):149-153;165.
LIU X Y,PAN J,GU Y H,et al.Stress tolerances of four wild yeast strains[J].Science and Technology of Food Industry,2015,36(1):149-153;165.
[23] 王朝阳.清香型大曲白酒产酯酵母的筛选及鉴定[D].太原:山西大学,2019.
WANG C Y.Screening and application of ester-producing yeast from Fen-flavor Chinese Baijiu[D].Taiyuan:Shanxi University,2019.
[24] 徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
XU L P.Screening and identification of ester-producing yeast in Luzhou Daqu and optimization of ester production conditions[J].China Brewing,2016,35(2):74-78.
[25] 刘源才,郭圣祥,李锐利,等.高产乙酸乙酯酵母的产酯条件研究[J].食品与发酵科技,2011,47(2):22-24.
LIU Y C,GUO S X,LI R L,et al.Researching the ester production conditions of the high production ethyl acetate yeast[J].Food and Fermentation Technology,2011,47(2):22-24.
[26] CHEN M B,LI R L,PENG N,et al.Screening of higher yield of ethyl acetate yeast and researching of ester-producing conditions[J].African Journal of Microbiology Research,2011,5(12):1 383-1 388.
[27] FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnology & Biotechnological Equipment,2018,32(5):1 218-1 227.
[28] 李锐利.高产乙酸乙酯酵母的选育及在清香型小曲酒中的应用研究[D].武汉:湖北工业大学,2011.
LI R L.Breeding of high-yield ethylacetate yeast and research of application in Fen-flavour Xiaoqu liquor[D].Wuhan:Hubei University of Technology,2011.
[29] 李梦琦,赵一凡,郑飞云,等.耐高糖产香酵母菌的分离鉴定及其应用[J].食品与发酵工业,2019,45(24):45-51.
LI M Q,ZHAO Y F,ZHENG F Y,et al.Isolation,identification and application of sugar-tolerant and aroma-producing yeast[J].Food and Fermentation Industries,2019,45(24):45-51.
[30] 陈雪,孟勤燕,齐欢,等.高产乙酸乙酯酵母菌株的筛选[J].酿酒科技,2020(1):96-102.
CHEN X,MENG Q Y,QI H,et al.Screening of yeast strains with high-yield of ethyl acetate[J].Liquor-Making Science & Technology,2020(1):96-102.
[31] 黄光建,徐学锋,郭梅君,等.豉香型白酒酒饼中高产乙酸乙酯酵母菌的分离鉴定及发酵性能研究[J].食品工业科技,2015,36(11):153-158.
HUANG G J,XU X F,GUO M J,et al.Isolation and identification of a high-yield ethyl acetate yeast from Xiaoqu of soybean-Flavor liquor and its fermentation characterization[J].Science and Technology of Food Industry,2015,36(11):153-158.
[32] 吴嘉.海藻糖对酿酒酵母1912菌株酒精耐受性及发酵影响的研究[D].昆明:云南大学,2012.
WU J.Effects of trehalose on ethanol tolerance and fermentation in Saccharomyces cerevisiae 1912[D].Kunming:Yunnan University,2012.
[33] 匡钰,廖留萍,沈福英,等.克鲁维毕赤酵母S23发酵产香条件优化及发酵液挥发性成分分析[J].食品科技,2019,44(11):23-29.
KUANG Y,LIAO L P,SHEN F Y,et al.Optimization of aroma-producing conditions and analysis of fermentation fluid volatile components of Pichia kluyveri S23[J].Food Science and Technology,2019,44(11):23-29.