我国传统的白酒酿造工艺中,酿酒微生物参与酒精及其香味物质的形成,赋予白酒特有的风味[1]。虽然白酒产量一直处于高速发展阶段,但名优白酒酿造受到严苛的酿造环境制约,优质酒的供需矛盾反而越来越尖锐。目前,提出了白酒生态发酵技术,通过重视微生态系统建立起完善的科学理论体系,进一步实现以质能提升代替量能提升[2]。
白酒中含有大量潜在的小分子生物活性物质,其中短链脂肪酸(short chain fatty acids,SCFAs)在白酒中含量较高,对发酵酒醅酸度的变化起主要贡献,乙酸、丙酸、丁酸等SCFAs与多种醇类形成的酯类是白酒典型风味形成的关键。同时,对肠道稳态对人体健康具有重要意义[3-5],与酒精性肝脏疾病进程联系密切。研究表明,SCFAs(乙酸、丙酸和丁酸)在低浓度时有一定的抗炎作用,揭示了酒类、醋类的保健作用[6-8]。因此研究SCFAs在清香型白酒中的含量变化本身具有意义。
清香型白酒地缸发酵过程中核心微生物菌群易受温度、酸度、原料等外界环境因素的影响,进而影响酒体的风味与品质[9]。每年9月初立醅,开始新一轮的生产,在实际生产中发现该时期出酒率正常,但原酒中存在总酸、总酯的含量较低等问题。夏季挑醅期气温升高,细菌生长旺盛,导致酒醅升酸高但出酒率低,酒体易出现酸高,乳酸乙酯与乙酸乙酯比例不协调现象。解决这一系列问题需要从不同产酸环境着手研究。近年来,对清香型白酒不同生产周期的研究开始有报道,如对汾酒立醅与圆排期酿酒过程微生物群落结构和风味物质的研究,结果表明耐酸乳杆菌的缺失是造成两时期发酵差异的主要因素[10]。从四季发酵过程微生物菌群与风味代谢差异中,找到关键驱动因素[11]。
但对于立醅与挑醅期的对比鲜见有相关研究。本文以解决生产中的实际问题为切入点,通过监测立醅及挑醅生产环境中的产酸微生物及与产酸直接相关的SCFAs动态变化,揭示两个时期发酵过程在产酸方面的显著性差异,对科学把控发酵进程和发酵工艺现代化升级改造具有重要意义。
1 材料与方法
1.1 样品采集
发酵过程酒醅样品取样于山西杏花村汾酒厂股份有限公司,采样时间点为大茬发酵0、7、15、28 d,选择全厂有代表行的4个车间的4个班组作为平行样品,每个酒醅样品300 g。样品挖取地缸表面中心向下30 cm处各3个,共120个样品。用无菌袋采样后迅速放置冰盒内,取样时间与样品处理时间隔不超过20 min。
酒体取样于对应4个车间的大茬蒸馏后的原酒,共8个。
1.2 主要试剂与仪器
MRS培养基,索莱宝;两性霉素,VWR Life Science;冰乙酸(≥98.0%)、乳酸(≥90.0%)、无水乙醇(≥99.5%),国药。
标准品:乙酸乙酯(GC-MS级),Merck;乙酸(≥99.5%)、异丁酸(>99.0%)、磷酸,国药;丙酸(>99.0%)、丁酸(>99.0%)、戊酸(>98.0%)、异戊酸(>99.0%),TCI;己酸(≥99.5%)、异己酸(98%),阿拉丁。
Agilent 7890A/5975C气-质联用仪、Agilent DB-WAX 毛细管柱30 m×0.25 mm ID×0.25 μm,安捷伦;WT3003N 电子天平,奥豪斯;QL-866涡旋仪,赛洛捷克;H1650-W冷冻离心机,湖南湘仪;LT-36VLC8人工气候生长培养箱,PERCIVAL;ZHJH-C1109C超净工作台,上海智诚;MAC-350P高压灭菌锅,日本SANYO;Milli Q Plus超级纯水仪,Bio-Rad;WP750中型机械微波炉,广东格兰仕;LQ-300DE超声波清洗机,昆山舒美。
1.4 酒醅产酸菌培养方法
1.4.1 培养基配制
MRS培养基+两性霉素(乳酸菌)[12]:胰蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,K2HPO4 2 g,柠檬酸二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温80 mL,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,蒸馏水1 L,调pH至6.2~6.4,121 ℃灭菌15 min。
1.4.2 酒醅样品产酸菌的分离培养及计数
取10 g酒醅样品溶于90 mL无菌水中,充分混匀,形成10-1的菌悬液,作为原液。依次10倍稀释,制成6个梯度的悬浊液,分别吸取100 μl涂布于相应培养基中,做3组平行。37 ℃培养箱培养。3 d后取出,计数统计。
每克样品中乳酸菌数=同一稀释度3个培养皿的菌落平均数×稀释倍数×10
1.5 短链脂肪酸检测
1.5.1 标准品配制
称量乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸标准品,用乙酸乙酯配制成0.1,0.5,1,5,10,20,50,100 μg/mL八个混合标准质量浓度梯度。取600 μL标准品,加入25 μL终浓度为500 μmol/mL的4-甲基戊酸作为内标,混匀加入进样瓶,进行GC-MS检测,进样量1 μL,分流比10∶1,分流进样。
1.5.2 代谢物提取
将样品冰上解冻,取 200 mg样品于2 mL玻璃离心管中。加入900 μL 0.5%的磷酸重悬,振荡混匀2 min;14 000×g离心10 min,取上清液800 μL,加入等量的乙酸乙酯提取,振荡混匀2 min,14 000×g离心10 min;取600 μL上层有机相,加入终浓度为500 μmol/L的4-甲基戊酸作为内标,混匀加入进样瓶,进行GC-MS检测,进样量1 μL,分流比10∶1,分流进样。
1.5.3 色谱-质谱分析
气相色谱条件:样品采用Agilent DB-WAX毛细管柱气相色谱系统进行分离。程序升温:初始温度90 ℃;以10 ℃/min升温至120 ℃;再以5 ℃/min升温至150 ℃;最后以25 ℃/min升温至250 ℃,并维持2 min。载气为氦气,载气流速1.0 mL/min。
质谱分析:采用Agilent 7890A/5975C气-质联用仪进行质谱分析。进样口温度250 ℃;离子源温度230 ℃;传输线温度250 ℃,四极杆温度150 ℃。电子轰击电离(EI)源,全扫及SIM扫描方式,电子能量70 eV。
1.5.4 数据处理
采用MSD ChemStation软件提取色谱峰面积及保留时间。绘制标曲曲线,计算样品中SCFAs的含量。
2 结果与分析
2.1 立醅与挑醅期发酵酒醅样品酸度变化
酸度检测采用碱式滴定法,结果如图1所示。从4个车间立醅、挑醅发酵过程均值水平酸度曲线图可知,挑醅期整个发酵期产酸高于立醅期,随发酵进程酸度递增;立醅期入缸后酸度更低,随发酵进行至7对(即7天,下同)时,两时期以相同的增长速度均呈上升趋势,而在7对时至发酵结束,挑醅期以更快的增长速度持续增长至最高,这与该时期产酸菌的迅速增长有关;立醅期则在7对时后缓慢上升至最高,两个时期在出缸时酸度相差最多为2.22。

图1 立醅(LP)与挑醅(TP)期发酵酒醅样品酸度变化
Fig.1 Changes of acidity of fermented grains in LP and TP
2.2 立醅与挑醅期大茬发酵过程微生物生物量的动态变化
两个时期酒醅发酵过程中产酸菌生物量的变化如图2所示。立醅大茬发酵期乳酸菌总数呈马鞍形,存在二次发酵现象,发酵4对时至15对时,环境产酸较弱,乳酸菌菌落数增减变化不大,而此后时期,耐酸乳杆菌是丰度最高优势菌[13-15],乳酸菌开始增长,推测延迟发酵期有助于酒醅酸度上升;挑醅大茬发酵期乳酸菌总数变化呈先增后减趋势,产酸菌生物量高于立醅期;大茬立醅发酵期入缸平板芽胞杆菌是优势菌,而大茬挑醅发酵期入缸平板先长乳酸菌3 d后才长芽胞杆菌,推测立醅期发酵材料中富集环境的乳酸菌较少或乳酸菌活力较弱,很难较快增长;挑醅期材料产酸高,发酵前期乳酸菌增长快,发酵后期,由于还原糖不足及环境酸度过高等特殊环境,乳酸菌生长受抑制而大幅下降至无。
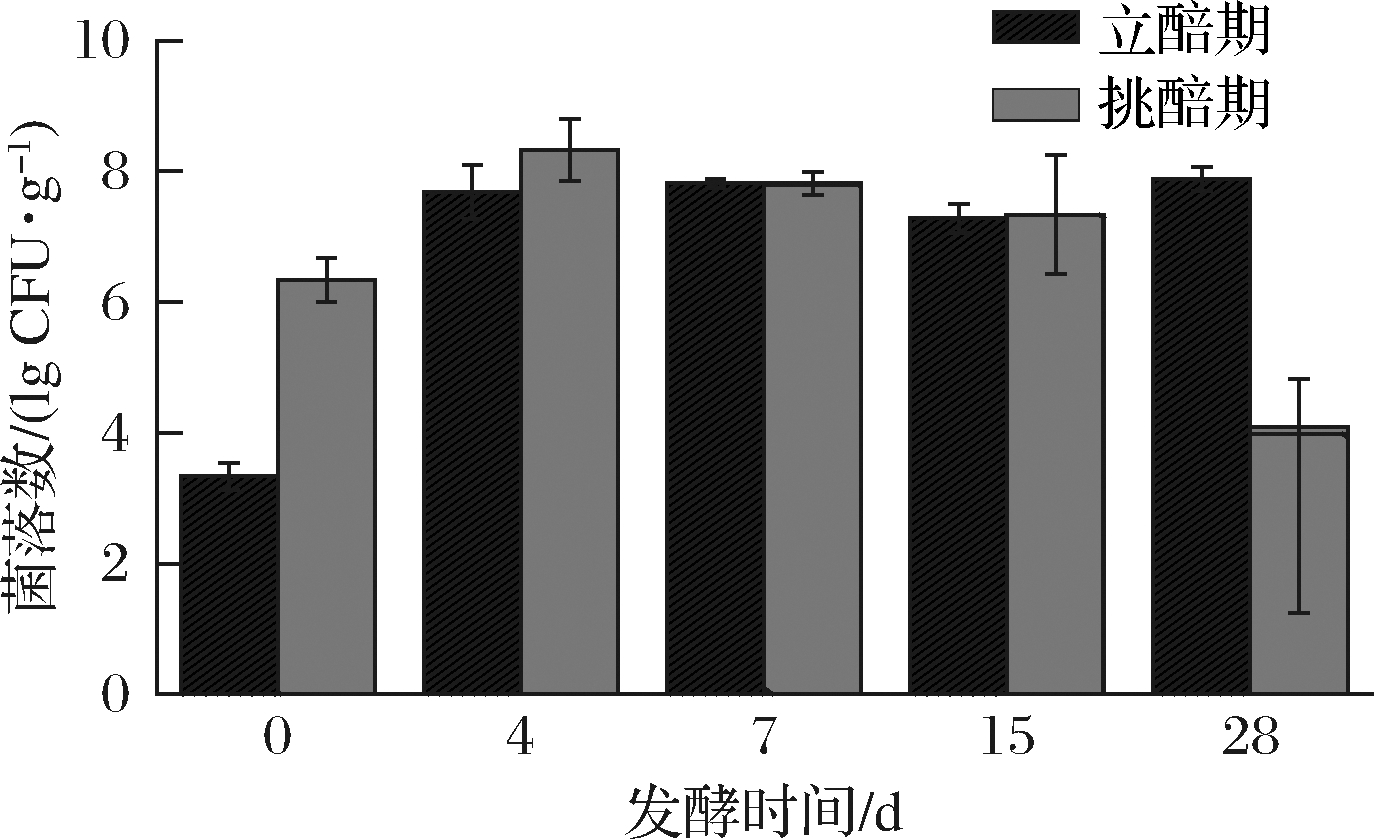
图2 立醅与挑醅期发酵过程中产酸菌的生物量变化
Fig.2 Viable lactic acid bacteria counts of fermented grains in LP and TP
2.3 立醅与挑醅期发酵酒醅样品及酒体SCFAs含量变化
标准品检测结果和标准曲线如表1所示。结果表明标准曲线质量较好可以用于定量分析(R2>0.99)。分别对两个时期的7种SCFAs含量变化做差异性对比,结果如图3所示。
表1 标准品信息和标准曲线
Table 1 Standard reference materials and standard curve
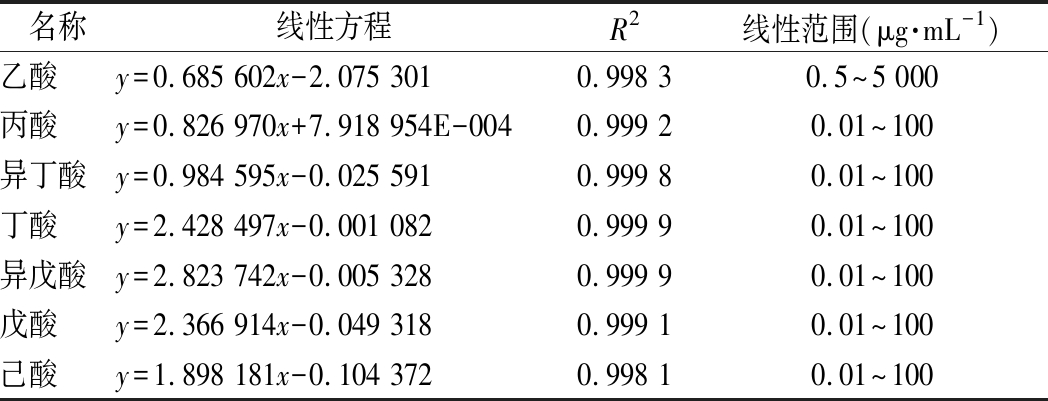
名称线性方程R2线性范围(μg·mL-1)乙酸y=0.685 602x-2.075 3010.998 30.5~5 000丙酸y=0.826 970x+7.918 954E-0040.999 20.01~100异丁酸y=0.984 595x-0.025 5910.999 80.01~100丁酸y=2.428 497x-0.001 0820.999 90.01~100异戊酸y=2.823 742x-0.005 3280.999 90.01~100戊酸y=2.366 914x-0.049 3180.999 10.01~100己酸y=1.898 181x-0.104 3720.998 10.01~100
由图3-a所示,立醅期入缸乙酸含量显著低于挑醅期,但在大茬发酵结束后达到同一水平。两个时期在0~7对时随发酵进行乙酸含量上升,7~15对时立醅期略有下降,挑醅期以更快的速度增长,而在15对时-出缸,立醅期乙酸迅速增长,挑醅期开始下降仍高于立醅期。立醅期较挑醅期发酵水平延滞,增加立醅期发酵对于乙酸水平的增加有正向作用。
由图3-b所示,立醅期丙酸含量显著低于挑醅期,起始含量相差12倍,为最大。产丙酸的菌群在立醅期最缺失,在环境中很难短期培养。丙酸菌在清香型白酒的中的研究极少。而丙酸菌对于酒体产香与增乙降乳都有一定的作用。
由图3-c所示,立醅期入缸异丁酸含量略低于挑醅期,但在大茬发酵结束后相差不多。两个时期在整个大茬发酵过程中异丁酸呈逐渐上升趋势,4~15对时增长缓慢,15对时至出缸发酵后期迅速增长至最高。
由图3-d所示,立醅期入缸丁酸含量显著低于挑醅期,在大茬发酵结束后相差最大。立醅整个发酵期呈递增趋势,挑醅呈先降后升趋势,入缸后至4对时稍有下降,4~14对时两个时期丁酸含量以同一水平保持不变,发酵后期,立醅期上升4倍至最高,挑醅期上升8倍增至最高。
由图3-e所示,立醅期异戊酸含量显著低于挑醅期,立醅期整个发酵过程变化不大,两个时期均呈缓慢的先增后降再迅速增长趋势,立醅期7对时开始下降,15对时上升至出缸;挑醅期4对时缓慢下降,7对时至出缸一直上升至最高,立醅较挑醅期在该指标上有延滞。
由图3-f所示,立醅期戊酸含量显著低于挑醅期,两个时期发酵变化趋势不同。挑醅期入缸与出缸时含量最高相差不多,4~15对时略微变化。立醅期在入缸至15对时基本保持不变,发酵后期开始上升,较挑醅期相差3.45倍。
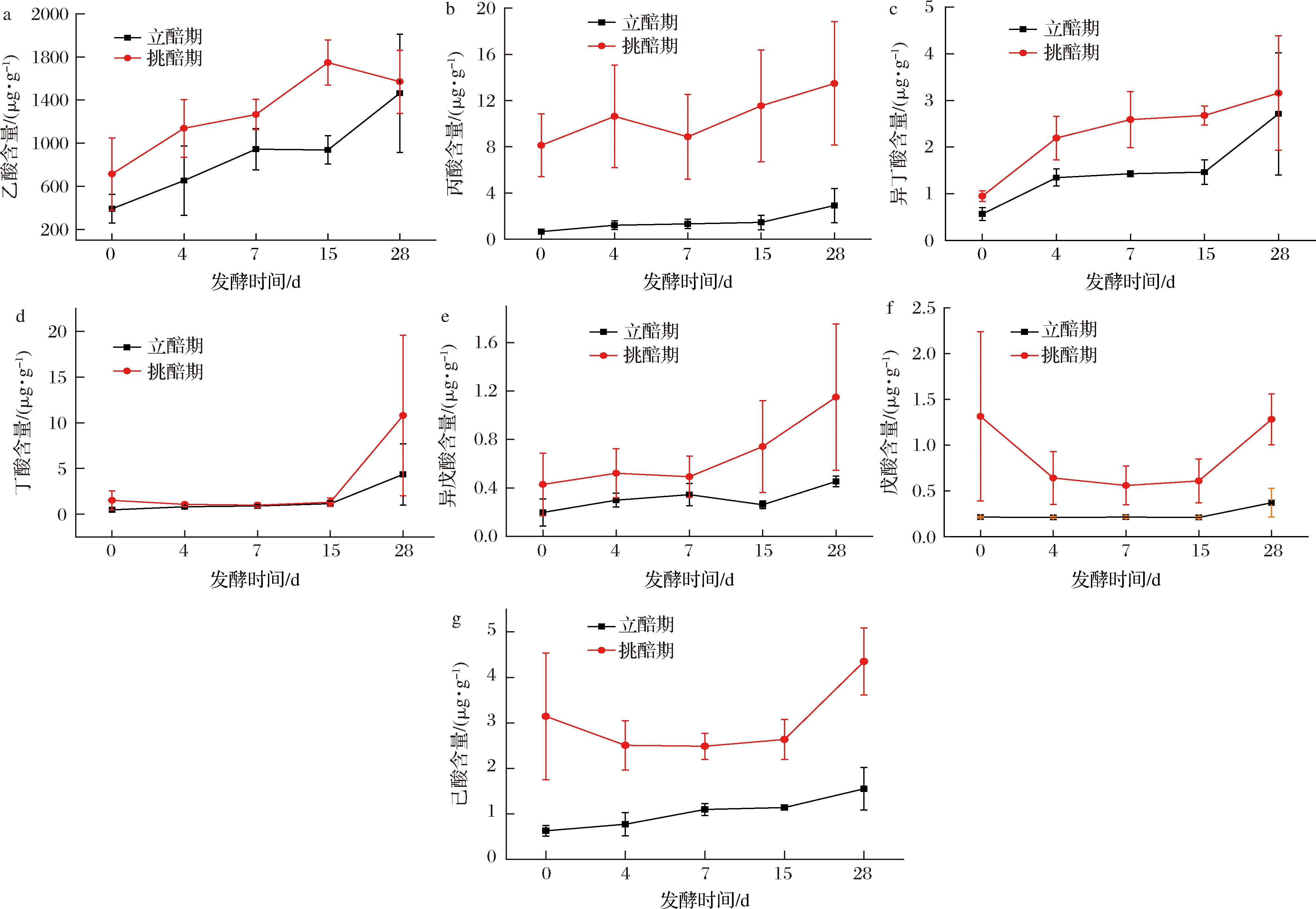
a-乙酸;b-丙酸;c-异丁酸;d-丁酸;e-异戊酸;f-戊酸;g-己酸
图3 立醅与挑醅期发酵过程中各短链脂肪酸变化
Fig.3 Comparison of SCFAs dynamics of fermented grains in LP and TP
如图3-g所示,立醅期己酸含量显著低于挑醅期,两个时期发酵变化趋势不同。但与戊酸的变化趋势一致。
由图4可知,整体来看,挑醅期的SCFAs含量均高于立醅各指标含量,且乙酸、异丁酸及异戊酸在两个时期随发酵进程呈递增趋势,而己酸、戊酸及丙酸在挑醅发酵起始含量较高,随发酵进行呈先减后增趋势,在整个发酵过程中挑醅期高表达,尤其是丙酸,两时期发酵末期差异倍数最高。立醅期除乙酸、异丁酸外其他几种酸在7对时开始增长直至最高。立醅期产酸最高水平只接近于挑醅期7对时,显然,热季发酵环境对产酸水平有很大影响。

图4 立醅与挑醅期发酵过程中各短链脂肪酸变化热图
Fig.4 Heatmap of SCFAs of fermented grains in LP and TP
立醅期、挑醅期一车间的酒体乙酸含量均是最高,与该车间特殊的微生态环境下的产酸菌有关;除己酸外,热季挑醅期的SCFAs含量均高于立醅期各指标含量。热季停排对立醅发酵产酸有直接影响。
立醅期4个车间除乙酸外其他SCFAs相差不多,其中立醅期7车间原酒丙酸含量最高,其他指标均是最少含量;汾一车间除丙酸外其他SCFAs含量在立醅期均是最高;挑醅期除乙酸、戊酸外其他均是汾九车间的最高;汾十二车间的各SCFAs均是最低。

图5 立醅与挑醅期酒体中各短链脂肪酸变化热图
Fig.5 Heatmap of SCFAs of Baijiu in LP and TP
3 结论与讨论
立醅与挑醅是清香型白酒新一轮发酵的始末两个时期,基于此特殊性,在大生产中最易出现质量不稳定,优质率下降的问题。本文针对这一现象,对两个时期发酵产酸情况进行对比分析,研究证实了发酵过程SCFAs的变化的差异性,与以往认知不同的是,无论在发酵过程还是原酒中,乙酸的差异倍数并不显著,需要关注的是除乙酸外的其他SCFAs的差异造成的影响,同时应关注这些SCFAs相应的合成微生物及参与的代谢途径,以实现精准调控微生物发酵及酒体质量稳定。现已对浓香型白酒酿造体系来源的SCFAs合成微生物种类、代谢途径及其与其品质的关系的研究[16-19]。
结合两时期的发酵情况来分析,挑醅期发酵环境最易产酸,发酵起始产酸菌已高度富集,酸度随发酵持续上升,致使酵母菌增长受限,还原糖利用率下降,酒醅酸败使发酵不完全,进一步影响出酒率,而蒸馏截酒在保证酒精度的前提下,酒尾中的SCFAs乙酸、乳酸等只有少量接出;立醅期发酵产酸全周期最低,菌群中产酸菌比例下降,酸度上升速度较缓慢,使酵母菌对还原糖利用率相对较高,发酵较完全,根据经验科学在实际蒸馏截酒时较挑醅期可适当拉长酒尾,将乙酸、乳酸等接入原酒,因此,两时期的发酵材料酸指标相差很大,酒体SCFAs差异倍数缩小,通过调整工艺范围参数可保证了两个时期酒体风格一致[20]。
[1] 徐岩.基于风味导向技术的中国白酒微生物及其代谢调控研究[J].酿酒科技,2015(2):1-11;16.
XU Y.Study on liquor-making microbes and the regulation & control of their metabolism based on flavor-oriented technology[J].Liquor-making Science & Technology,2015(2):1-11;16.
[2] 徐岩,吴群.基于风味导向的白酒生态发酵技术构建与发展趋势[C].第四届中国白酒学术研讨会论文集.淮安:中国轻工业出版社,2019,10-14.
XU Y,WU Q.Advances on flavor-oriented eco-fermentation for making Chinese liquor(Baijiu)[C].The 4th Baijiu Technology Symposium.Huaian:China Light Industry Press,2019.
[3] 汪诗欣,开朗,杨静怡,等.浓香型白酒中短链脂肪酸及其乙酯对人体的影响[J].食品与发酵工业,2020,46(16):257-263.
WANG S X,KAI L,YANG J Y,et al.Research progress on health effects of short-chain fatty acids and its ethyl esters in strong aroma-type Baijiu[J].Food and Fermentation Industries,2020,46(16):257-263.
[4] 王琳琳,王刚,张灏,等.具粘附特性的动物双歧杆菌对便秘模型小鼠血清中胃肠调节肽水平的影响[J].中国食品学报,2019,19(6):13-20.
WANG L L,WANG G,ZHANG H,et al.The Effect of bifidobacterium animalis with adhesive properties on the levels of gastrointestinal peptide neurotransmitter in serum of mice with constipation[J].Journal of Chinese Institute of Food Science and Technology,2019,19(6):13-20.
[5] BAJAJ J S,Alcohol,liver disease and the gut microbiota[J].Nature Reviews Gastroenterology & Hepatology,2019,16(4):235-246.
[6] 詹彦,支兴刚.短链脂肪酸的再认识[J].实用临床医学,2007,134-135.
ZHAN Y,ZHI X G.Re-understanding of short-chain fatty acids[J].Practical Clinical Medicine,2007,134-135.
[7] CUMMINGS J H,POMARE E W,BRANCH W J,et al.Short chain fatty acids in human large intestine,portal,hepatic and venous blood[J].Gut,1987,28(10):1 221-1 227.
[8] VINOLO M A R,RODRIGUES H G,HATANAKA E,et al.Short-chain fatty acids stimulate the migration of neutrophils to inflammatory sites[J].Clinical Science(London,England),2009,117(9):331-338.
[9] 余培斌,陈丙友,陈建新.白酒地缸发酵过程中酒醅温度及理化指标分析[J].食品与发酵工业,2019,45(10):48-53.
YU P B,CHEN B Y,CHEN J X.Changes in temperature and physiochemical indexes of fermenting grains during liquor fermentation in underground vats[J].Food and Fermentation Industries,2019,45(10):48-53.
[10] PANG X N,HAN B Z,HUANG X N,et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Scientific Reports,2018,8:3 396.
[11] WANG S L,XIONG W,WANG Y Q,et al.Temperature-induced annual variation in microbial community changes and resulting metabolome shifts in a controlled fermentation system[J].mSystems,2020,5(4):e00555-20.
[12] 关凯乐.清香型白酒汾酒汾发酵微生物群落结构与演替研究[D].北京:中国科学院大学,2019.
GUAN K L.Composition and dynamic succession of microbial communities during the fermentation of Fenjiu[D].Beijng: Chinese Academy of Sciences,2019.
[13] KATAKURA Y,SANO R,HASHIMOTO T,et al.Lactic acid bacteria display on the cell surface cytosolic proteins that recognize yeast mannan[J].Applied Microbiology and Biotechnology,2010,86(1):319-326.
[14] YANG X P,TENG K L,ZHANG J,et al.Transcriptome responses of Lactobacillus acetotolerans F28 to a short and long term ethanol stress[J].Scientific Reports,2017,7(1):2 650.
[15] LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].International Journal of Food Microbiology,2011,146(1):31-37.
[16] FANG C,DU H,JIA W,et al.Compositional differences and similarities between typical Chinese Baijiu and Western liquor as revealed by mass spectrometry-based Metabolomics[J].Metabolites,2018,9(1):2.
[17] 任聪,辜杨,杜海,等.基于新老窖泥的微生物菌群结构判定浓香型白酒生产中的主体己酸菌[J].食品与发酵工业,2018,44(12):8-14.
REN C,GU Y,DU H,et al.Predicting dominant caproate-producing microbes by comparing the microbiotas between new-and aged-pit muds[J].Food and Fermentation Industries,2018,44(12):8-14.
[18] CHAI L J,XU P X,QIAN W,et al.Profiling the Clostridia with butyrate-producing potential in the mud of Chinese liquor fermentation cellar[J].International Journal of Food Microbiology,2019,297:41-50.
[19] 杨娇.克氏梭菌己酸合成途径基因的鉴定及该菌遗传操作工具的构建[D].无锡:江南大学,2018.
YANG J.The identification of genes involved in hexanoate synthesis and the development of genetic manipulation tools for Clostridium kluyveri[D].Wuxi:Jiangnan University,2018.
[20] 刘坚,林汲,雷振河,等.汾酒酒醅有机酸的研究及酿造工艺的优化[J].食品与发酵工业,2012,38(1):83-87.
LIU J,LIN J,LEI Z H,et al.Study on organic Acid of fermented grains and optimization of the brewing process of Fen liquor[J].Food and Fermentation Industries,2012,38(1):83-87.