D-泛解酸内酯水解酶具有高度的立体选择性,可立体专一拆分DL-泛解酸内酯,生成D-泛解酸[1-2],是合成其他泛酸衍生物的重要中间体。泛酸,又称泛解酸、遍多酸、维生素B5,它是几乎每种天然食物来源中存在的必需微量营养素[3]。
生产D-泛酸的传统方法是采用Stiller法(异丁醛-甲醛-氰化钠法)或者乙醛酸-异丁醛法合成泛解酸内酯,再将β-丙氨酸钙与泛解酸内酯直接缩合即得到DL-泛酸钙。这种化学拆分的方法存在试剂贵、成本高、分离困难等缺点,此外还伴随严重的环境污染和毒性问题。与传统方法相比,直接发酵法是通过向能够自身合成泛酸的微生物中加入相应的前体物质,比如β-氨基丙酸、DL-泛解酸内酯等,使其直接合成D-泛酸,然而,由于该方法分离D-泛酸比较困难,产品收率低,未见工业化的报道。近些年来,微生物立体选择性拆分D-泛解酸内酯生成D-泛解酸的方法得到越来越多的关注。1994年SAKAMOTO等[4]利用特定菌株选择性水解DL-泛解酸内酯中的D-泛解酸内酯来生成D-泛解酸。2001年,江南大学利用镰孢霉菌(Fusarium)生产的水解酶对DL-泛解酸内酯进行拆分,1 L发酵液中有6~8 g干菌,酶活力达到0.52~0.74 U/100 mL[5],并实现了工业化生产;2016年,天津科技大学黎明课题组用离子交换树脂D380对该酶进行了固定化研究并取得良好效果[6]。在此基础上,伴随基因工程技术、固定化材料与方法的发展,这些技术手段也为D-泛酸类物质的高效生产提供了必要的技术条件。例如近些年来兴起的有机-无机杂化纳米化固定化酶,这种固定化方法已经应用于生物大分子如脂肪酶[7]、牛血清白蛋白[8]和脲酶[9]等,其活性和稳定性较游离酶均有提高;潘敬坤等[10]2018年发表的专利表明,利用硅藻土为载体得到固定化的D-泛解酸内酯水解酶细胞后,可使得固定化酶活力达到140 U/g;余继刚等[11]在2019年发表的专利中也显示,通过对赤霉菌进行诱变,可使得诱变菌株的发酵酶活力达4.09 U/100 mL。
本实验室前期通过分子生物学手段构建了1株高效表达串珠链孢霉菌属D-泛解酸内酯水解酶基因的重组乳酸克鲁维酵母(Kluyveromyces lactis GG799/pKLAC1-DL),其摇瓶酶活力为(2.83±0.12) U/mL。在本研究中,将在5 L发酵罐上通过探究不同的pH值、搅拌转速和接种量3种单因素条件,以及不同的补料策略来确定最佳的发酵条件,以期提高D-泛解酸内酯水解酶的酶活力,为进一步地扩大生产奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
本实验室保存的重组乳酸克鲁维酵母Kluyveromyces lactis GG799/pKLAC1-DL。
1.1.2 培养基
种子培养基(YPD)(g/L):葡萄糖20,酵母粉10,蛋白胨20。
发酵培养基(g/L):葡萄糖30,酵母粉15,蛋白胨20,NaCl 6,KCl 6,CaCl2 3,MgSO4 0.3。
补料培养基(g/L):葡萄糖500。
1.2 实验仪器
T&J Atype 5 L玻璃发酵罐,上海迪比尔生物工程有限公司;HC-2518高速离心机,安徽中科中佳科学仪器有限公司;MLS-3780高压蒸汽灭菌锅,三洋电机株式会社;V-1200可见分光光度计,上海美普达仪器公司;HYG-C组合式摇床,江苏太仓市强乐实验设备有限公司;101-1AB型电热鼓风干燥箱,天津市泰斯特仪器有限公司;Agilent 1260 System高效液相色谱,美国安捷伦科技公司;DRP-9082型电热恒温培养箱,上海森信实验仪器有限公司。
1.3 试验方法
1.3.1 种子活化
将保藏在-80 ℃冰箱的甘油管按2%的接种量接种于含有15 mL YPD培养基的50 mL三角瓶内进行活化,于30 ℃,200 r/min培养大约21 h;取菌液划线至YPD固体培养基平板,于30 ℃恒温培养箱内培养48 h;随后挑取单菌落在50 mL三角瓶进行活化作为一级种子液,再按2%的接种量接种于含有50 mL YPD培养基的250 mL三角瓶内,30 ℃,200 r/min培养菌体至对数期,作为上罐用的二级种子液。
1.3.2 发酵罐优化培养
以2%的接种量将种子液转接到5 L发酵罐中,装液量2.5 L,通气比为1 vvm,培养温度30 ℃,发酵时间96 h,使用10%(体积分数)硫酸和50%(体积分数)氨水调解pH。分别考察不同发酵pH(5.5、6.0、6.5、7.0、7.5)、搅拌转速(200、300、400、500、600 r/min)以及接种量(1.0%、1.6%、2.0%、3.0%)3种因素对产D-泛解酸内酯水解酶的影响。在分批发酵的基础上,发酵一定时间后流加质量浓度为500 g/L的葡萄糖作为补加的碳源。
1.3.3 粗酶液的收集
将发酵液于4 ℃,12 000 r/min离心20 min,获得的上清液即为粗酶液。
1.3.4 葡萄糖浓度的测定
参考文献[12], 使用DNS法测定。
1.3.5 泛解酸内酯和泛解酸的HPLC测定
参考文献[13]的方法测定。
1.3.6 酶活力测定
酶活力定义:在一定条件下,每分钟水解1 μmol D(-)-泛解酸内酯成1 μmol D-(+)泛解酸的酶量定义为1个酶活力单位(U)。
D-泛解酸内酯水解酶酶活力的测定方法:取离心的上清液0.5 mL、1 mL 4% D-泛解酸内酯水溶液、0.5 mL 2 mol/L Tris-HCl缓冲液,混匀并置于37 ℃摇床200 r/min反应10 min后立即放入沸水浴中加热15 min,随后将混合液于12 000 r/min离心20 min,以灭活酶作为对照,用HPLC分析泛解酸的生成量,计算每毫升发酵液的酶活力单位(U/mL)。
1.3.7 比速率的测定
参考文献[14]的方法测定。
2 结果与讨论
2.1 pH对分批发酵的影响
发酵过程中培养基的pH是微生物生长和合成产物的重要参数之一,也是反应微生物在一定环境条件下代谢活动的综合指标。因此,必须通过掌握发酵过程中发酵液的pH变化,使得微生物生长和产物合成处于最佳状态。由于在摇瓶发酵条件下很难对pH进行有效的控制,所以本实验在发酵罐中进行分批发酵,并在对pH进行调控,后选取了pH值为5.5、6.0、6.5、7.0时的发酵过程进行比较。
图1为控制不同pH条件下的发酵结果。酶活力的增加与菌体的生长呈现一定的正相关性,当发酵大约进行到第30 h时菌体进入生长平衡期,此时的酶活力增长缓慢。如表1所示,相较于其他3个pH条件,当pH控制在6.0时微生物产酶的效果最优,酶活力最高可达4.59 U/mL,比pH为5.5、6.5、7.0分别高了22%、13.5%和6%。在pH为6.5时,菌体量虽然增加较高,但是酶活力却低于pH控制在6.0时的效果。pH为5.5时的OD明显低于其他3种情况,可以看出低pH不利于菌体的生长和酶的产出。pH为7.0时的最高酶活力同pH为6.0相比相差不大,但是酶的产率较为缓慢,延长了生产时间。综合以上因素考虑选择pH控制策略为恒定6.0。
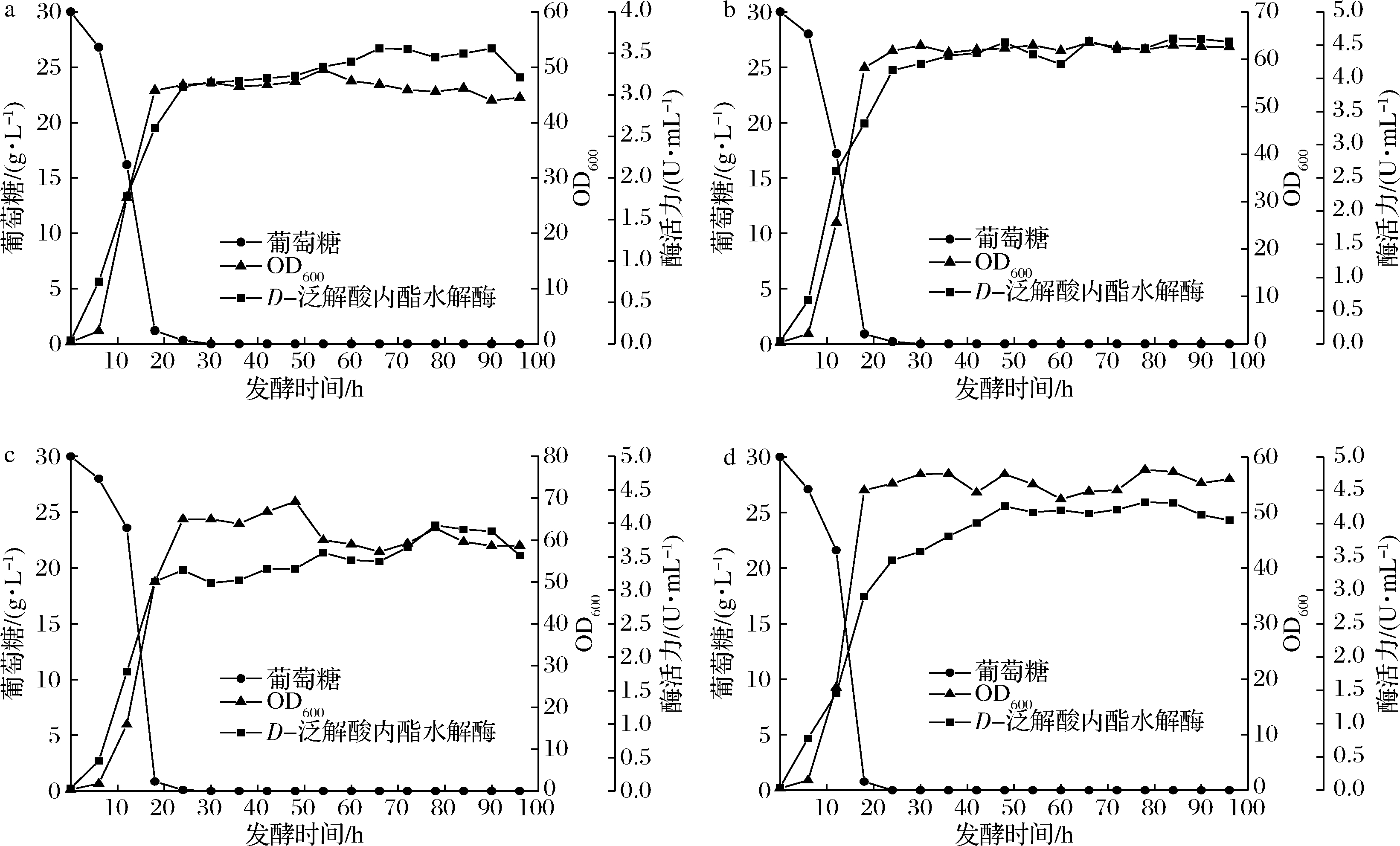
a-pH 5.5;b-pH 6.0;c-pH 6.5;d-pH 7.0
图1 pH值对分批发酵过程的影响
Fig.1 Effect of pH on batch fermentation
表1 不同pH值的分批发酵参数对比
Table 1 Comparison of parameters during batch fermentation under different pH
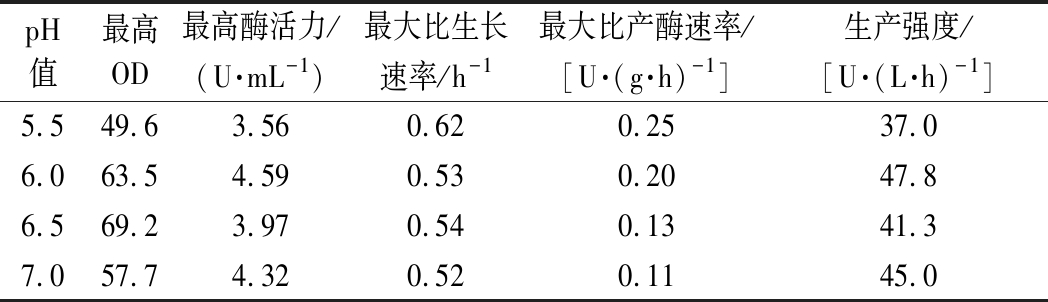
pH值最高OD最高酶活力/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]5.549.63.560.620.2537.06.063.54.590.530.2047.86.569.23.970.540.1341.37.057.74.320.520.1145.0
2.2 搅拌转速对分批发酵的影响
在发酵过程中,溶解氧是影响生物生长发酵的重要因素之一,它在细胞生长、产物形成和维持细胞的代谢中起着重要作用[15]。调节发酵罐搅拌转速是有效控制发酵液中溶氧状态的主要条件方式,但是过高的搅拌转速产生的剪切力也会对菌体的生长产生影响。
图2为控制不同搅拌转速(200、300、400、500、600 r/min)时的发酵结果,当搅拌转速为200 r/min时,菌体量及酶活力明显较其他4种搅拌转速低,OD和酶活力最高仅分别为36和3.15 U/mL,酶活力比300 r/min时低了38%。导致这种现象的原因是在低转速下溶氧传递效率差,从而在一定程度上抑制了菌体生长和产酶。当转速为400、500和600 r/min时,虽然OD和最大比产酶速率(表2)较300 r/min时高,但是高OD并不代表酶活力高,可能是由于高搅拌速率所导致的偏高溶氧量,过多的氧形成![]() 或·OH破坏许多细胞组分,进而对菌体的代谢产生严重影响[18],而且过大的转速产生的剪切力也会影响到细胞的生长[19]。在这5种搅拌转速中,转速为300 r/min时的最高酶活力比400 r/min时高10.4%,而且菌体生产强度比400 r/min时高(表2),基于以上结果,选定300 r/min为后期发酵过程的起始转速。在后续补料发酵过程中,当溶氧偏低时,除了提高转速外还可以考虑增大通气量来升高溶氧,这样可以避免高转速产生的剪切力对菌体自身的伤害。
或·OH破坏许多细胞组分,进而对菌体的代谢产生严重影响[18],而且过大的转速产生的剪切力也会影响到细胞的生长[19]。在这5种搅拌转速中,转速为300 r/min时的最高酶活力比400 r/min时高10.4%,而且菌体生产强度比400 r/min时高(表2),基于以上结果,选定300 r/min为后期发酵过程的起始转速。在后续补料发酵过程中,当溶氧偏低时,除了提高转速外还可以考虑增大通气量来升高溶氧,这样可以避免高转速产生的剪切力对菌体自身的伤害。
表2 不同搅拌转速的分批发酵参数对比
Table 2 Comparison of parameters during batch fermentation under different agitation speeds
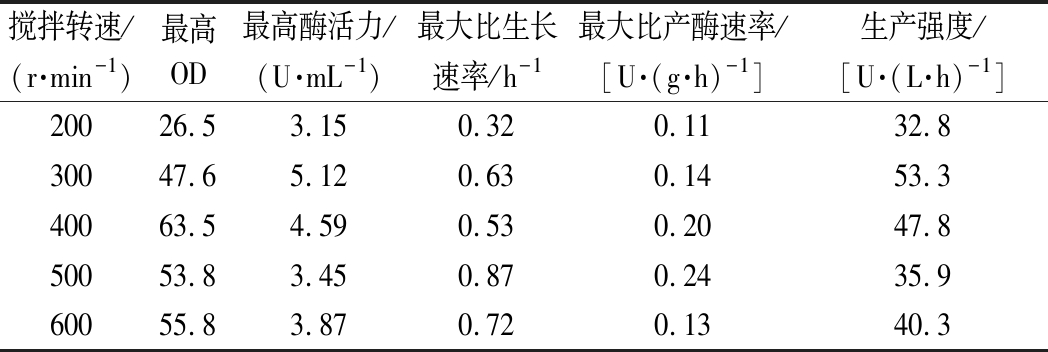
搅拌转速/(r·min-1)最高OD最高酶活力/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]20026.53.150.320.1132.830047.65.120.630.1453.340063.54.590.530.2047.850053.83.450.870.2435.960055.83.870.720.1340.3
2.3 接种量对分批发酵的影响
接种量是影响微生物生长及产物合成的另一个重要因素,接种量过小,菌体不足,延长期较长;接种量过大,菌体繁殖快,会造成培养基营养物质消耗过快,不利于微生物的持续生长,并进而影响产物的合成[20]。如图3所示,分别以4种不同的接种量进行分批发酵(1.0%、1.6%、2.0%和3.0%),接种量的多少直接影响糖的消耗速率,但这4种情况基本上在发酵第40 h时将糖耗完,之后OD和酶活力处于一种动态平衡状态。从图3曲线趋势和表3数据可知,不同接种量的最高酶活力和菌体生产强度的值相差不大,接种量对菌体的发酵产生的影响很小,只是延迟了菌体生长和产酶的时间。由于之前的接菌量一直是2%,所以后续还以2%的接种量进行发酵。

搅拌转速:a-200 r/min;b-300 r/min;c-400 r/min;d-500 r/min;e-600 r/min
图2 搅拌转速对分批发酵的影响
Fig.2 Effect of agitation speed on batch fermentation
接种量:a-1%;b-1.6%;c-2%;d-3%
图3 接种量对分批发酵的影响
Fig.3 Effect of inoculum volume on batch fermentation
表3 不同接种量的分批发酵参数对比
Table 3 Comparison of parameters during batch fermentation with different inoculum volume
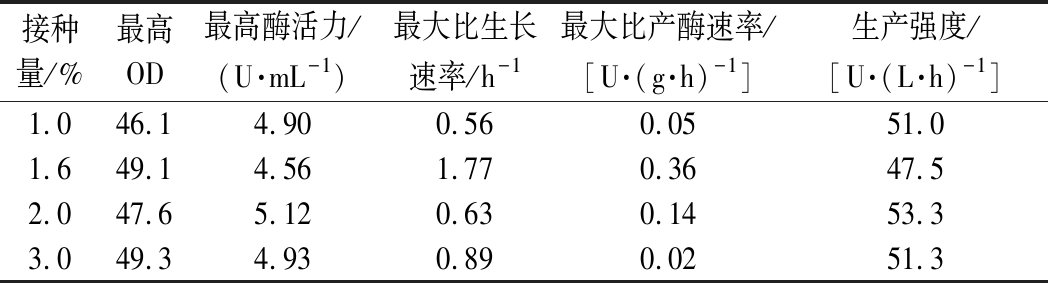
接种量/%最高OD最高酶活力/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]1.046.14.900.560.0551.01.649.14.561.770.3647.52.047.65.120.630.1453.33.049.34.930.890.0251.3
2.4 恒糖浓度对补料分批发酵的影响
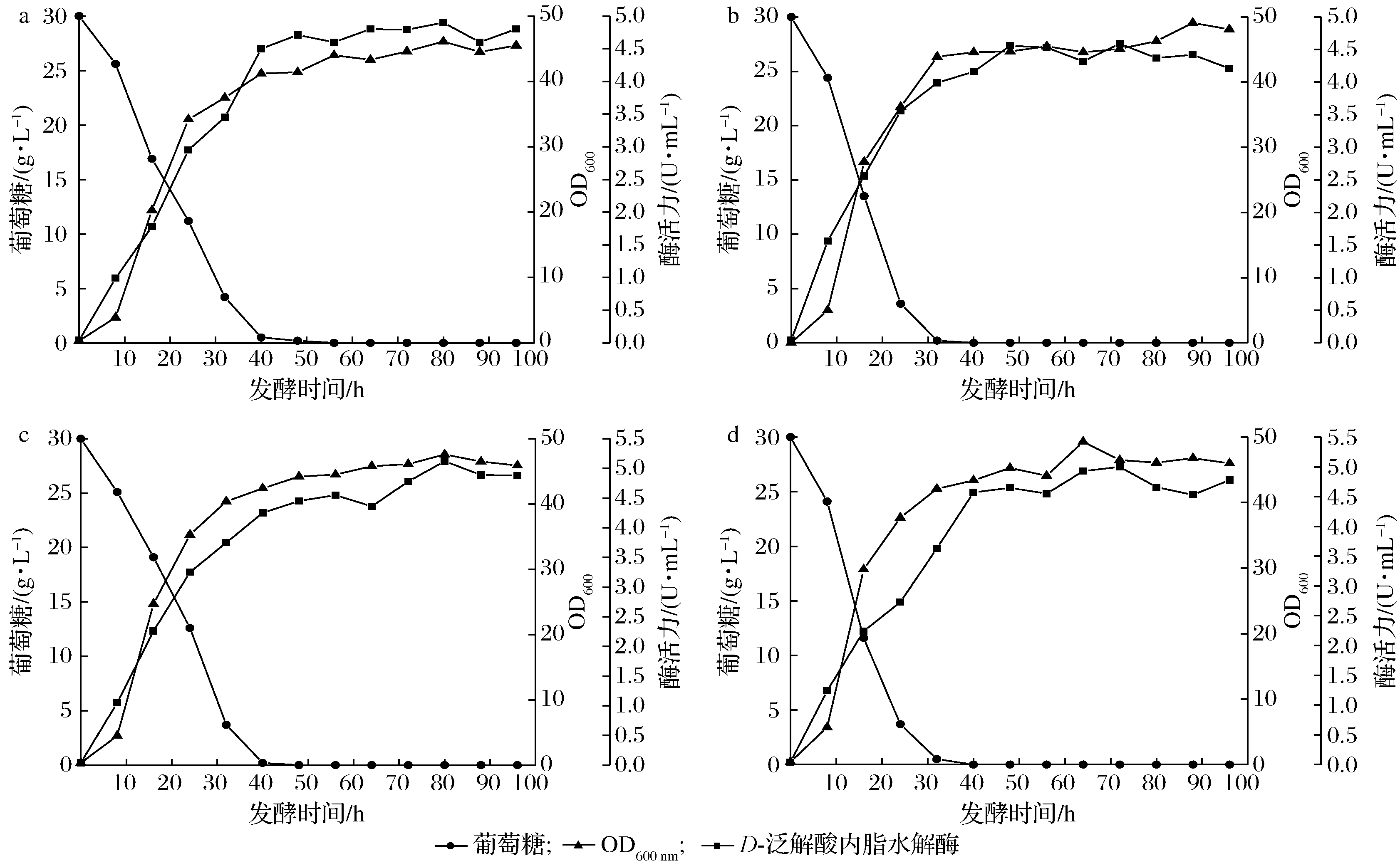
根据前期的单因素实验,当发酵pH为6.0,搅拌转速为300 r/min,接种量为2%时分批发酵效果最好。为了进一步探索补料对发酵过程中产D-泛解酸内酯水解酶的影响,以初始葡萄糖30 g/L,发酵液起始体积为2 L,发酵一段时间后,通过补加质量浓度为500 g/L的葡萄糖以维持发酵过程中的糖质量浓度(1、5、10 g/L)。图4为控制不同恒糖浓度的发酵结果,菌体的生长对数期是在发酵的0~30 h,在此期间,菌体生长旺盛且耗糖速率最快。当在补料发酵过程中维持葡萄糖质量浓度为5 g/L时,由表4数据可知,最高酶活力可达8.20 U/mL,与维持糖质量浓度1、10 g/L比分别高了61%和30%。导致这种现象的原因可能是由于过低或者过高的恒糖浓度均不利于D-泛解酸内酯水解酶的分泌。为证明发酵过程中的残糖累积是否影响了酶活力,使用恒速补料策略来验证。
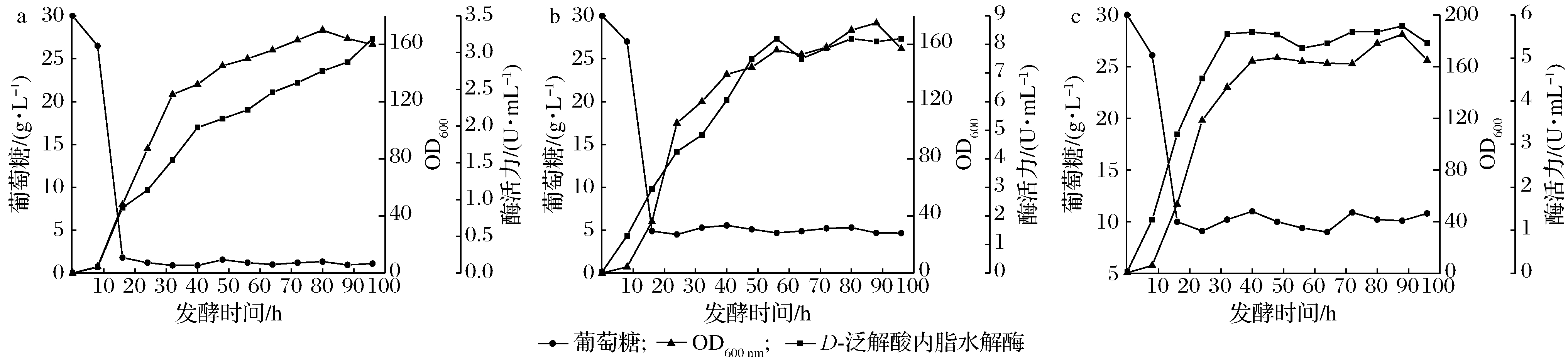
发酵过程中的含糖量:a-1 g/L;b-5 g/L;c-10 g/L
图4 恒糖质量浓度对补料分批发酵过程的影响
Fig.4 Eflect of different constant glucose concentration on fed-batch fermentation process
表4 不同恒糖浓度的补料分批发酵参数对比
Table 4 Comparison of parameters during fed-batch fermentation process with different constant glucose concentrations
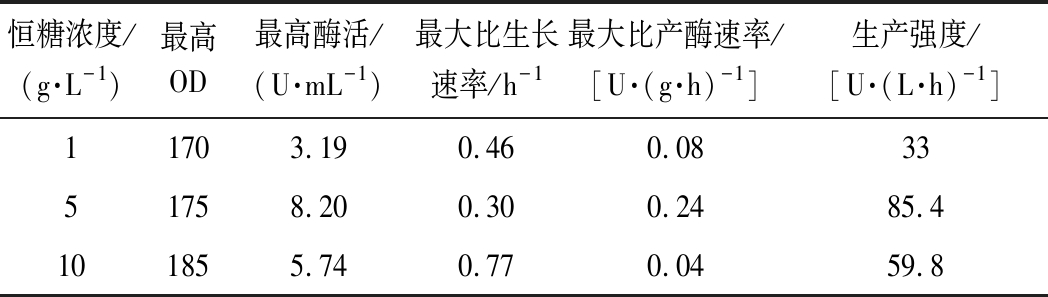
恒糖浓度/(g·L-1)最高OD最高酶活/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]11703.190.460.083351758.200.300.2485.4101855.740.770.0459.8
2.5 恒速补糖对补料分批发酵的影响
为了消除碳源浓度过高对产D-泛解酸内酯水解酶的影响,将恒糖补料方式改变为恒速流加葡萄糖。在分批发酵过程中,当发酵液中残糖浓度<1 g/L时,分别以5、10、15 g/h的速度流加浓度为500 g/L的葡萄糖溶液。由图5-a可看出,当补料速度为5 g/h时,所补加的葡萄糖可被耗尽,并使菌体保持较高的生长速率,在此条件下最高酶活力达到了10.70 U/mL(见表5)。
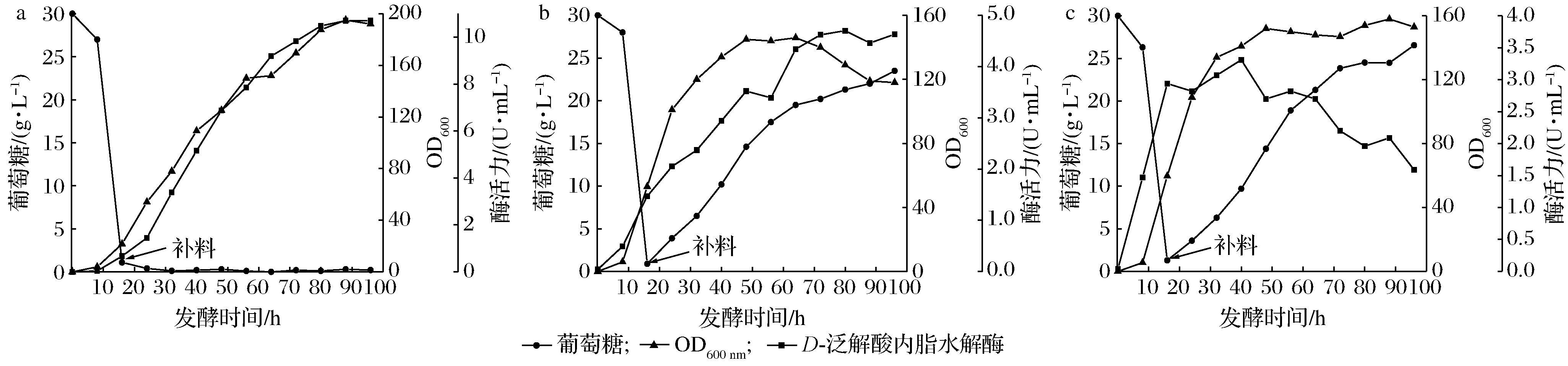
补糖速率:a-5 g/h;b-10 g/h;c-15 g/h
图5 恒速补料对补料分批发酵过程的影响
Fig.5 Eflect of constant feeding speed on fed-batch fermentation
当补料速度为10和15 g/h时,由于菌体无法消耗过多的碳源,导致发酵过程中葡萄糖浓度的积累,此时OD比补糖速度5 g/h时分别低了10.2%和25.6%,酶活力则分别低了56%和69%,可以看出高浓度的糖对菌体的生长和产酶都造成了一定的抑制。而且这种补料方法有一个缺陷,就是恒速补料流速的大小可能使得菌体在对数生长期缺糖或短时间内出现糖累积现象,为此又进行了指数补料实验。
表5 恒速补料的发酵参数对比
Table 5 Comparison of parameters during fed-batch fermentation with constant feeding speed
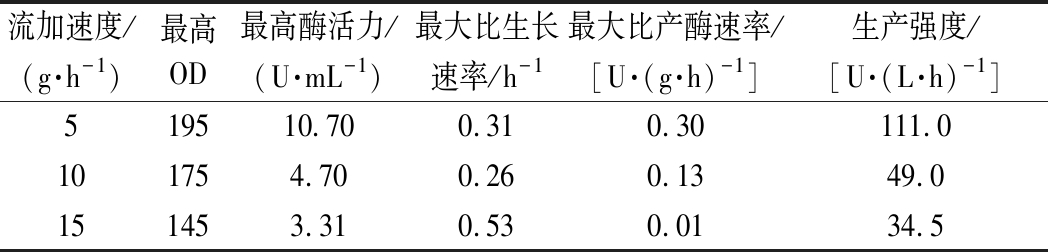
流加速度/(g·h-1)最高OD最高酶活力/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]519510.700.310.30111.0101754.700.260.1349.0151453.310.530.0134.5
2.6 指数补料对补料分批发酵的影响
YEE等[21]认为目前最成功的基因工程菌高密度培养方法是指数流加法。补料速度随着发酵时间的进行而呈指数增加,较好地避免了菌体在生长对数期因为缺糖导致的生长受到抑制或对产酶的影响。指数补料的流加速率如公式(1)所示。
(1)
式中:F,流加速度,L/h;μ,设定的比生长速率,h-1;XO和VO分别是流加初始时的细胞质量浓度(g/L)和培养基体积(L);t,指数流加后的发酵时间,h;Y,细胞对葡萄糖的得率系数(由分批发酵数据得到);SO,补料用的葡萄糖质量浓度,g/L。
设定的μ值需小于μmax(根据上述分批发酵结果求得),所以本文设定了μ值分别为0.15 h-1和0.20 h-1。当发酵液中残糖质量浓度<1 g/L时开始指数流加补料,根据上述补料结果得知发酵液中残糖质量浓度过高对菌体生长和酶活力有很大影响,所以当发酵液残糖质量浓度>10 g/L时逐渐降低降低补料流速,直到残糖质量浓度达到动态平衡。当设定μ=0.15 h-1时,由表6可知,此时最高OD为210,最高酶活力为4.50 U/mL,残糖最高累积到大约10 g/L。如图6-b所示,当设定μ=0.20 h-1时,指数补料的速度更快,发酵第30 h时流速为66 mL/h,残糖最高积累到大约25 g/L,最高OD为216同图6-a相比稍微有所增加,但是最高酶活力比图6-a下降了22.4%。虽然指数补料能获得更多的菌体,但发酵液中残糖越多酶活力却越低,就如同上述以恒速10和15 g/h补糖时,发酵液中的残糖抑制菌体产酶。这印证了上述结果的观点,即酶活力的增加与菌体生长呈现一定正相关性,但不意味着OD越高酶活力越高,且高浓度残糖的累积抑制了菌体产酶。

a-μ=0.15 h-1;b-μ=0.20 h-1
图6 指数补料对补料分批发酵过程的影响
Fig.6 Effect of exponentical feeding speed on fed-batch fermentation
表6 指数补料的发酵参数对比
Table 6 Comparison of parameters during fed-batch fermentation with exponentical feeding speed

μset/h-1最高OD最高酶活力/(U·mL-1)最大比生长速率/h-1最大比产酶速率/[U·(g·h)-1]生产强度/[U·(L·h)-1]0.152104.500.270.17540.202163.490.710.2342
3 结论
本研究在5 L玻璃发酵罐中探索了不同的pH、搅拌转速、接种量3种单因素以及3种不同的补料措施,分别以分批发酵及补料分批发酵方式,实现了D-泛解酸内酯水解酶在乳酸克鲁维酵母(K.lactis GG799/pKLAC1-DL)中的高效表达。单因素实验发现,当发酵pH为6.0时,搅拌转速为300 r/min时,接种量为2%时,分批发酵效果最好,酶活力最高为5.12 U/mL。与分批发酵相比,当维持补料发酵过程中恒糖浓度为5 g/L时,酶活力可达8.20 U/mL,比最优的分批发酵酶活力提高了60.1%;而当以5 g/h进行恒速补料时,此时流加的糖能够全部被耗尽,酶活力最高为10.70 U/mL,较分批发酵提高了98.6%,指数补料策略虽然保证了发酵过程菌体不会缺糖,但是残糖的累积对菌体的产酶有很大抑制作用,高OD并没有带来预想中的高酶活力,所以在发酵过程中不能有过多残糖的累积。与同类研究相比,本研究中所获得的发酵最高酶活力有了明显提高。例如,在2020年1月公布的专利中穆晓玲等使用1株串珠镰刀菌B5-1-7发酵,最高酶活力82.3 U/g干菌体[22],本研究的酶活力单位经过换算成干菌体酶活力得最高酶活力为153 U/g干菌体,与之相比酶活力提高了1.86倍;在另一份2020年5月公布的专利中,吴建中等使用1株串珠镰刀菌JHpharm 2-1,最高酶活力6.75 U/mL[23],本研究中的最高酶活力为10.70 U/mL,与之相比酶活力提高了1.58倍。以上结果为进一步扩大D-泛解酸内酯水解酶的生产规模与提高产酶效率提供了技术参考。
[1] TANG Y X, SUN Z H, HUA L, et al. Kinetic resolution of DL-pantolactone by immobilized Fusarium moniliforme SW-902[J]. Process Biochemistry, 2002, 38(4): 545-549.
[2] HUA L,SUN Z H,ZHENG P,et al.Biocatalytic resolution of DL-pantolactone by glutaraldehyde cross-linked cells of Fusarium moniliforme CGMCC 0536[J].Enzyme & Microbial Technology,2004,35(2-3):161-166.
[3] DE CORINTI D,MANNINA L,CHIAVARINO B,et al.IRMPD signature of protonated pantothenic acid,a ubiquitous nutrient[J].Chemical Physics Letters,2016,646:162-167.
[4] SAKAMOTO K,YAMADA H,SHIMIZU S.Process for the preparation of D-pantolactone:Japan,CA2037043A[P].1990-07-27.
[5] 汤一新,孙志浩,华蕾,等.微生物酶拆分方法生产D-泛酸的手性中间体D-泛解酸内酯[J].工业微生物,2001,31(3):1-5.
TANG Y X,SUN Z H,HUA L,et al.Optical resolution of racemic DL-pantolactone by a fungal enzyme,D-lactonohydrolase[J].Industrial Microbiology,2001,31(3):1-5.
[6] XUAN M J,ZHANG J Z,YUAN H Y,et al.Optimization of process for optical resolution of DL-pantolactone using immobilized D-lactonohydrolase[J].Advances in Applied Biotechnology,2017,444:459-467.
[7] HUA X F,XING Y,ZHANG X.Enhanced promiscuity of lipase-inorganic nanocrystal composites in the epoxidation of fatty acids in organic media[J].ACS Applied Materials & Interfaces,2016,8(25):16 257-16 261.
[8] ZHANG B L,LI P T,ZHANG H P,et al.Red-blood-cell-like BSA/Zn3(PO4)2 hybrid particles:Preparation and application to adsorption of heavy metal ions[J].Applied Surface Science,2016,366:328-338.
[9] SOMTURK B,YILMAZ I,ALTINKAYNAK C,et al.Synthesis of urease hybrid nanoflowers and their enhanced catalytic properties[J].Enzyme and Microbial Technology,2016,86:134-142.
[10] 潘敬坤,余海鹏.一种D-泛解酸内酯水解酶发酵及细胞固定化方法:中国,CN108192884A[P].2018-06-22.
PAN J K,YU H P.D-pantoate lactone hydrolase fermentation and cell immobilization method:China,CN108192884A[P].2018-06-22.
[11] 余继刚, 王保如,史实,等.一株产D泛解酸内酯水解酶的赤霉菌及应用、发酵方法:中国,CN201811595882.5[P].2019-10-22.
YU J G,WANG B R,SHI S,et al.Gibberella sp.producing D-pantolactone hydrolase and its application and fermentation method:China,CN201811595882.5[P].2019-10-22.
[12] YING G Q,SHI L E,YI Y,et al.Production,purification and characterization of nuclease p1 from Penicillium citrinum[J].Process Biochemistry,2006,41(6):1 276-1 281.
[13] 中国食品添加剂生产应用工业协会.食品添加剂分析检验手册[M].北京:中国轻工业出版社,1999.
China Food Additives Production and Application Industry Association.Handbook of food additives analysis[M].Beijing:China Light Industry Press,1999.
[14] 唐群芳,李江华,刘龙,等.耐有机溶剂α-葡萄糖苷酶的补料分批发酵研究[J].食品与生物技术学报,2016,35(1):12-18.
TANG Q F,LI J H,LIU L,et al.Enhanced production of solvent-stable alpha glycosidase from Bacillus licheniformis JXC-1 by an optimal feeding strategy[J].Journal of Food Science and Biotechnology,2016,35(1):12-18.
[15] 彭志坚,房峻,李江华,等.发酵法生产L-异亮氨酸的溶氧控制策略[J].工业微生物,2009,39(3):11-16.
PENG Z J,FANG J,LI J H,et al.Microbial production of L-isoleucine by dissolved oxygen control strategy[J].Industrial Microbiology,2009,39(3):11-16.
[16] 杨军,梁凌宇,高雪峰,等.基因工程菌发酵液中多种成分快速检测方法的建立[J].中国生物制品学杂志,2013,26(12):1 831-1 834.
YANG J,LIANG L Y,GAO X F,et al.Development of a method for rapid determination of several components in fermentation liquids of recombinant bacterial strains[J].Chinese Journal of Biologicals,2013,26(12):1 831-1 834.
[17] AMIRZADA M I,YU M L,GONG X H,et al.Cost-effective production of recombinant human interleukin 24 by lactose induction and a two-step denaturing and one-step refolding method[J].Journal of Industrial Microbiology & Biotechnology,2014,41(1):135-142.
[18] 高年发,张现青,吴迪.溶氧对丙酮酸发酵的影响[J].天津科技大学学报,2004,19(3):5-7;15.
GAO N F,ZHANG X Q,WU D.The effects of dissolve oxygen on pyruvate fermentation[J].Journal of Tianjin University of Science & Technology,2004,19(3):5-7;15.
[19] LI J W,LIU L,LI J H,et al.Strategy of two-stage agitation rate for citric acid production[J].Journal of Food Science and Biotechnology,2014,32(2):131-136.
[20] 朱明军,梁世中.装液量和接种量对红发夫酵母生长和虾青素积累的影响[J].氨基酸和生物资源,2002,24(4):28-31.
ZHU M J,LIANG S Z.Effects of liquid volume and inoculum concentration in flasks on growth and astaxanthin accumulation of Phaffia rhodozyma[J].Amino Acids and Biotic Resources,2002,24(4):28-31.
[21] YEE L,BLANCH H W.Recombinant trypsin production in high cell density fed-batch cultures in Escherichia coli[J].Biotechnology and Bioengineering,1993,41(8):781-790.
[22] 穆晓玲,杨金环,李海燕,等.一种高产D-泛解酸内酯水解酶的方法:中国,CN110656052A[P].2020-01-07.
MU X L,YANG J H,LI H Y,et al.A method for high-yield D-pantolactone hydrolase:China,CN110656052A[P].2020-01-07.
[23] 吴建中,丁叶.一种高产D-泛酸内酯水解酶的串珠镰刀菌JHpharm 2-1及其发酵方法:中国,CN201911391496.9[P].2020-05-08.
WU J Z,DING Y.A kind of high-yield D-pantolactone hydrolase Fusarium moniliforme JHpharm 2-1 and its fermentation method:China,CN201911391496.9[P].2020-05-08.