黄酮类化合物是普遍存在于各类蔬菜、水果、谷物和中草药中的主要活性成分,根据3-羟基取代类型和C-环结构差异,黄酮类化合物又可进一步分为黄酮类、黄酮醇类、黄烷酮类、查耳酮类、黄烷醇类和花青素类等,黄酮醇类是植物中最为普遍的一类黄酮类化合物[1]。研究表明,黄酮类化合物具有预防高血压、高血脂、炎症、心血管疾病和衰老等一系列慢性疾病发生和发展的能力[2],高的黄酮膳食摄入与糖尿病[3]、癌症[4]的发生率呈负相关。但黄酮类化合物的生物利用率和功能活性受其与其他生物大分子的相互作用的影响,如槲皮素、芦丁和儿茶素与血浆蛋白的相互作用会降低其抗氧化活性[5],但β-乳球蛋白-姜黄素的相互作用会提高姜黄素的抗氧化活性[6],牛奶蛋白和大豆蛋白与没食子酰儿茶素混合后会降低其生物利用率,但对非没食子酰儿茶素无影响[7]。阐明食品营养成分与生物大分子的相互作用是食品营养学和食品科学,尤其是食品营养成分递送领域的重要研究内容之一。
人血清蛋白(human serum albumin,HSA)是人血浆中含量最丰富的重要载体蛋白,由585个氨基酸组成,分子质量约为6.65 kDa。HSA的三维构象由区域I(1~195位氨基酸残基)、区域II(196~383位氨基酸残基)和区域III(384~585位氨基酸残基)这3个相似的螺旋亚基通过物理作用松散结合在一起组成,具有贮存与转运内源性代谢产物和外源性活性小分子到达靶组织的作用,是血液中活性小分子传送的重要运输载体蛋白[8]。营养活性成分与载体蛋白的结合能力决定其被吸收后在血液中的释放和活性浓度,并为功效保持提供保障,因此,活性分子与载体蛋白的相互作用对其在体内的转运、分布、降解、代谢和毒理特性有重要影响[9],是分析其生物活性的重要基础,也是阐明食品营养与功效作用的第一步。目前,已有许多学者研究天然活性小分子与血清蛋白相互作用,如槲皮素与HSA的相互作用[10]、鞣花酸和橄榄苦苷与HSA的相互作用[11],ANAS等[12]也研究发现迷迭香与HSA的相互作用会改变HSA的构象结构,降低HSA的糖基化反应活性。
槲皮素是最为常见的黄酮醇类化合物,主要以糖苷形式存在,如槲皮素-芸香糖苷、槲皮素-六碳糖苷、槲皮素-葡萄糖醛酸、槲皮素-鼠李糖苷、槲皮素-五碳糖苷等,具有抗炎、抗肿瘤、心血管保护和提高免疫力等保健作用[2-4]。目前已有许多关于黄酮的糖取代类型和位置对其功能活性的影响,但不同的糖取代对黄酮类化合物与血浆蛋白的结合和相互作用的影响还未见报道。因此,本文以槲皮素和4种常见的槲皮素糖苷(芦丁、异槲皮素、槲皮素-3-O-木糖苷、槲皮素-3-O-鼠李糖苷)为研究对象,采用荧光滴定、同步荧光和分子对接技术研究这5种黄酮与HSA的相互作用,通过Sterm-Volmer和Double logarithmic方程,结合同步荧光光谱变化,分析荧光淬灭类型、热力学参数、结合常数和结合位点数差异,并通过分子对接技术研究槲皮素及槲皮素糖苷与HSA结合区域与结合位点变化,最终阐述槲皮素上3-羟基的五碳糖、脱氧六碳糖、六碳糖和二糖取代对槲皮素与HSA相互作用的影响,为黄酮类化合物的功能活性分析提供理论基础。
1 实验方法
1.1 试剂和仪器
人血清白蛋白,美国sigma公司;槲皮素(quercetin,Que)、异槲皮素(quercetin-3-O-glucoside,Q3G)、芦丁(quercetin-3-O-rutinoside,Q3Ru)(纯度>95%),北京索莱宝科技有限公司;槲皮素-3-O-木糖苷(quercetin-3-O-xyloside,Q3X)(纯度98%),成都普瑞法科技开发有限公司;槲皮素-3-O-鼠李糖苷(quercetin-3-O-rhamnoside,Q3Rh)(纯度98%),深圳菲斯生物科技有限公司。
F-7000荧光光谱仪,日本Hatachi公司;BLD-FSN-ENT5高精度恒温循环水槽,昆山佰利达实验设备有限公司;FA1104 N型电子分析天平,上海丙林电子科技有限公司。
1.2 荧光滴定实验
采用荧光滴定的方法分别测定温度为298、304和310 K时,研究不同浓度的黄酮溶液对HSA在激发波长280 nm,发射波长为300~400 nm时的荧光发射光谱的影响。向3.0 mL 0.25 mg/mL的HSA溶液(50 mmol/L,pH 7.4磷酸盐缓冲盐水配制)中逐步滴加0.5 mmol/L的Que、Q3X、Q3Rh、Q3G和Q3Ru溶液,混匀后在对应测定温度条件下反应3 min,最后测HSA的荧光发射光谱,扫描电压为700 V,狭缝宽度为2.5 nm,扫描速度为1 200 nm/min。反应体系中黄酮溶液的浓度分别为0.0、0.83、1.66、2.47、3.29、4.10、4.91、5.70、6.49 μmol/L。
化合物淬灭HAS荧光的淬灭速率常数Kq可以通过Stern-Volmer方程根据公式(1)进行计算[11]:
![]() =1+KSVc=1+Kqτ0c
=1+KSVc=1+Kqτ0c
(1)
式中:F和F0分别为含和不含黄酮样品时HAS的荧光强度;c,黄酮的浓度;Ksv,Stern-Volmer淬灭常数;τ0,不存在淬灭剂时HAS的平均荧光寿命,10-8 s。
黄酮醇样品与HAS相互作用的结合常数(Ka)和结合位点数(n)可通过Double logarithmic方程根据公式(2)计算[12]:
(2)
式中:F0和F分别为不加和加抑制剂时HSA的荧光强度;c,反应体系中黄酮的浓度,mol/L。
1.3 同步荧光分析
采用F-7000荧光光谱仪测定不同浓度的黄酮溶液对HSA同步荧光光谱的影响[13]。发射波长(λEm)与激发波长(λEx)差值(Δλ)为60 nm时,激发光谱扫描范围为250~320 nm,荧光发射起始波长为310 nm;Δλ=15 nm时,荧光发射起始波长为280 nm,激发光谱扫描范围为265~350 nm。HSA质量浓度为0.50 mg/mL,测定温度为310 K,扫描速度为1 200 nm/min,扫描电压为700 V,狭缝宽度为2.5 nm,反应体系中黄酮溶液的浓度为0.0~12.99 μmol/L。
1.4 分子对接分析
采用AutoDockTools 1.5.6分别对HSA和Que、Q3X、Q3Rh、Q3G、Q3Ru的相互作用进行分析。HSA的三维结构(1H9Z)从Protein Data Bank上下载(https://www.rcsb.org/),然后依次用Pymol和AutoDockTools 1.5.6进行去水、加氢、计算电荷和合并非极性氢等处理,保存为pdbqt格式文件。Que、Q3X、Q3Rh、Q3G和Q3Ru的三维结构用ChemBio3D Ultra 14.0绘制,能量最优后保存为pdb文件,最后保存为pdbqt格式文件用于对接。对接盒子中心坐标为(20.853,9.572,-19.114),对接盒子XYZ各方向的格点数设为100×100×120,格点间距为0.375 Å[10-11],采用Lamarckkian GA遗传算法对接150次,其余参数采用默认值。对接结果采用AutoDockTools和Discovery Studio进行分析和处理。
1.5 数据分析
所有数据采用Excel软件进行处理,荧光扫描图谱用Origin 2019b绘制,分子对接图谱采用Discovery Studio 2017 R2 Client绘制。
2 结果与分析
2.1 内源荧光光谱分析
荧光光谱技术是研究小分子对蛋白构象结构的影响,以及小分子与蛋白质相互作用动力学的重要工具,目前已经广泛被用于研究药物与靶标蛋白[14]、活性功能因子与血浆蛋白[15]、活性小分子与食品蛋白[16]的相互作用。Que、Q3X、Q3Rh、Q3G和Q3Ru对HSA内源荧光光谱的影响如图1所示。当0.83、1.66、2.47、3.29、4.10、4.91、5.70、6.49 μmol/L黄酮醇添加到HSA溶液中后,HSA的内源荧光强度均显著下降,且其最大荧光发射波长也均出现了明显蓝移。当浓度为6.49 μmol/L时,HSA的内源荧光强度分别下降了57.70%、27.46%、30.18%、33.84%、25.90%,最大荧光发射波长分别减少了1.6、4.6、2.2、5.2、3.2 nm。说明Que、Q3X、Q3Rh、Q3G和Q3Ru均能导致HSA构象结构的展开,改变HSA的空间构象,且3-羟基糖取代会降低槲皮素对HSA的荧光淬灭效果,芸香糖和木糖取代的槲皮素糖苷的荧光淬灭效果最弱。另外,添加Q3G后,HSA的最大荧光发射波长偏移量最大,因此,葡萄糖取代增强槲皮素对HSA中荧光性氨基酸微环境的影响。
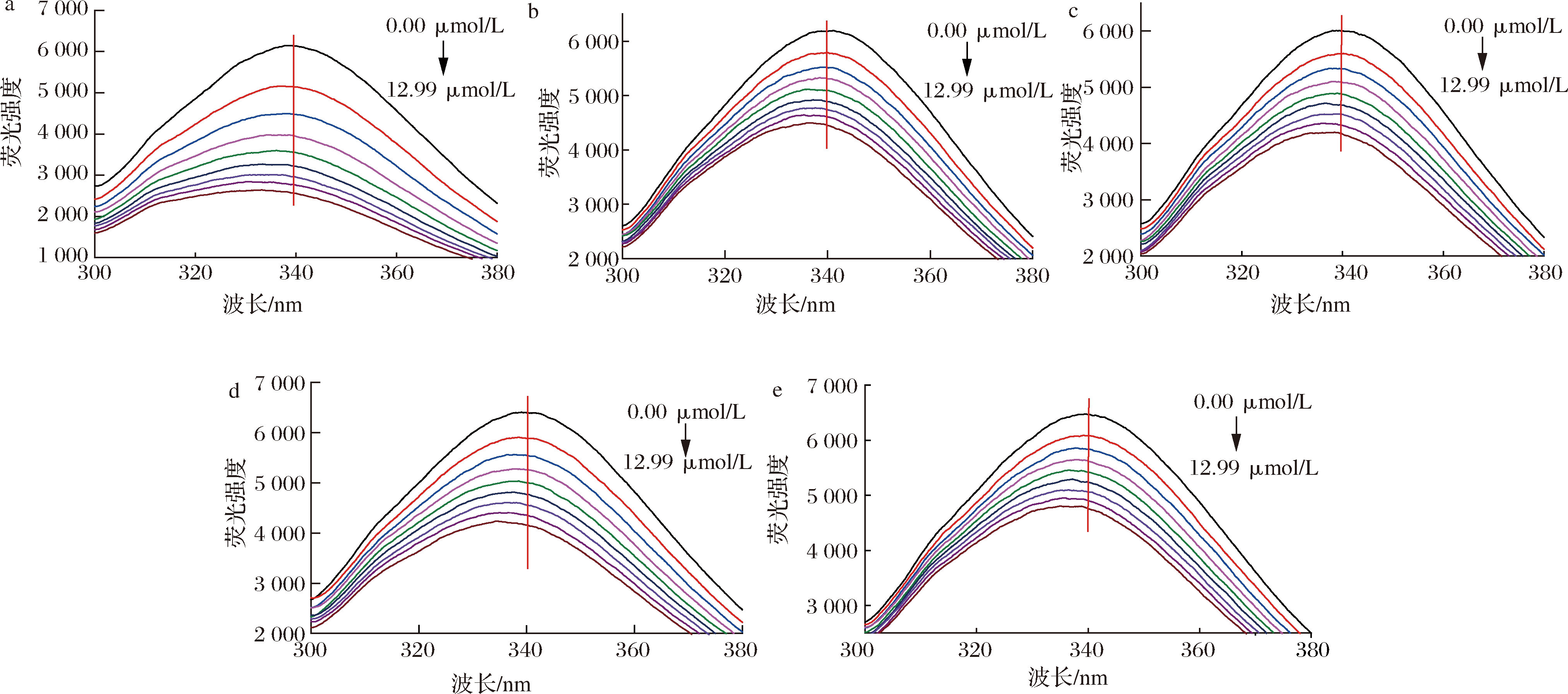
a-槲皮素;b-槲皮素-3-O-木糖苷;c-槲皮素-3-O-鼠李糖苷;d-异槲皮素;e-芦丁
图1 五种黄酮对HSA内源荧光光谱的影响
Fig.1 Effect of five flavonoids on the intrinsic fluorescence spectra of HAS
2.2 荧光淬灭机制分析
动态淬灭、静态淬灭和混合型淬灭是活性小分子淬灭蛋白荧光的作用机制,对于动态淬灭过程,其Kq值通常会随温度升高而增大;对于静态淬灭过程,荧光淬灭速率常数Kq会随反应温度的升高而减小,且其值大于最大扩散碰撞淬灭常数2.0×1010 L/(mol·s)[16]。但很多文献表明,Kq值随温度升高而增大,但其值远高于2.0×1010 L/(mol·s)时,也可认定淬灭机制为静态淬灭[13]。
在温度298、304、310 K的条件下,HSA与Que、Q3X、Q3Rh、Q3G和Q3Ru相互作用的Stern-Volmer图如图2所示,其Ksv和Kq值如表1所示。由图2可知,5种黄酮的Stern-Volmer图均呈很好的线性关系(R2>0.99)说明Que、Q3X、Q3Rh、Q3G和Q3Ru都是通过单一方式淬灭HSA的内源荧光[17]。由表1可知,Que、Q3X、Q3Rh、Q3G和Q3Ru对HSA的荧光淬灭速率常数Kq均随温度的升高逐渐下降,分别由298 K的28.63×1012、6.31×1012、7.62×1012、8.42×1012、5.82×1012 L/(mol·s),降低至310 K的21.04×1012、5.78×1012、6.39×1012、7.78×1012、5.15×1012 L/(mol·s),且值均大于2.0×1010 L/(mol·s),说明Que、Q3X、Q3Rh、Q3G和Q3Ru通过静态方式淬灭HSA的荧光。

a-槲皮素;b-槲皮素-3-O-木糖苷;c-槲皮素-3-O-鼠李糖苷;d-异槲皮素;e-芦丁
图2 五种黄酮淬灭HSA荧光的Stern-Volmer图
Fig.2 The Stern-Volmer plot of five flavonoids quenching HSA intrinsic fluorescence spectra
表1 五种黄酮与HSA在298、304和310 K条件下相互作用的结合常数和热力学参数
Table 1 The binding constants and thermodynamic parameters for the interaction of HSA with five flavonoids at 298,304 and 310 K
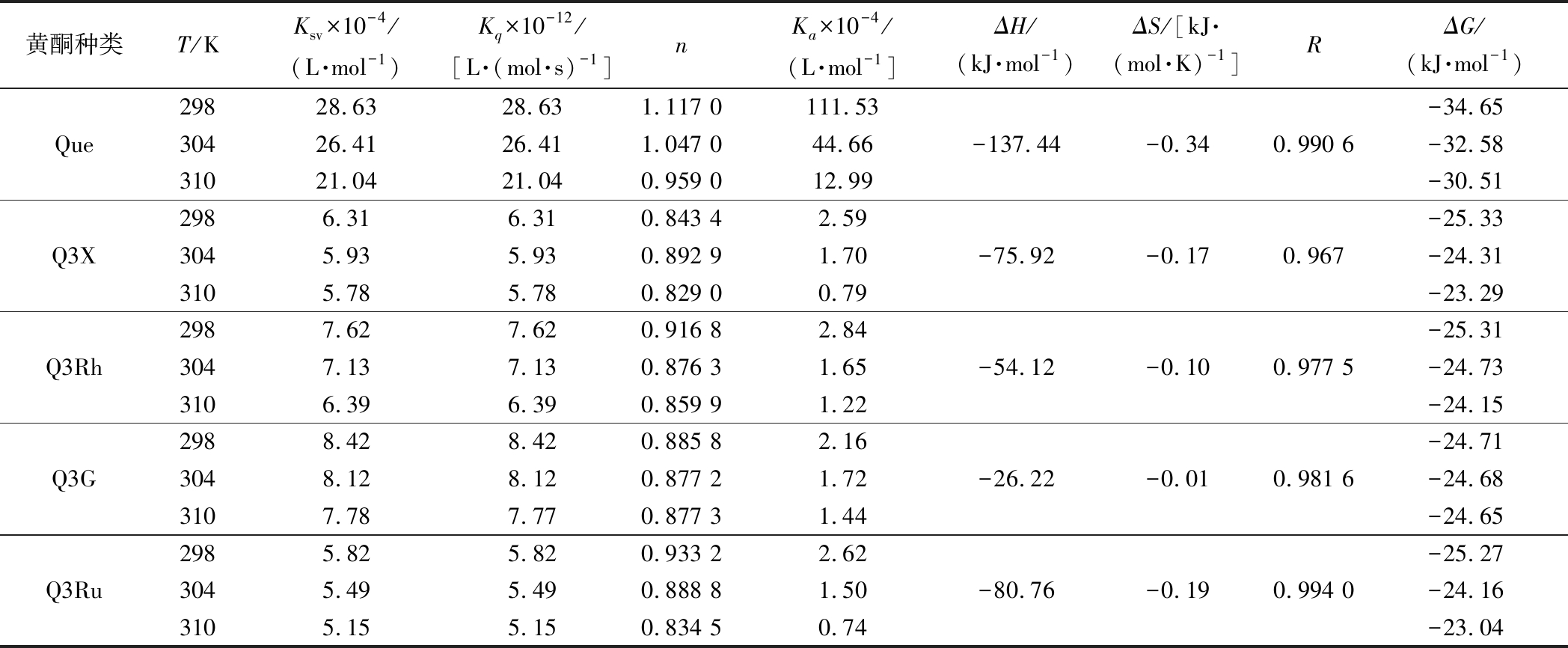
黄酮种类T/KKsv×10-4/(L·mol-1)Kq×10-12/[L·(mol·s)-1]nKa×10-4/(L·mol-1]ΔH/(kJ·mol-1)ΔS/[kJ·(mol·K)-1]RΔG/(kJ·mol-1)Que298 304 310 28.6326.4121.0428.6326.4121.041.117 01.047 00.959 0111.5344.6612.99-137.44-0.340.990 6-34.65-32.58-30.51Q3X298304 3106.315.935.786.315.935.780.843 40.892 90.829 02.591.700.79-75.92-0.170.967-25.33-24.31-23.29Q3Rh298304 310 7.627.136.397.627.136.390.916 80.876 30.859 92.841.651.22-54.12-0.100.977 5-25.31-24.73-24.15Q3G298 304 310 8.428.127.788.428.127.770.885 80.877 20.877 32.161.721.44-26.22-0.010.981 6-24.71-24.68-24.65Q3Ru298 304 310 5.825.495.155.825.495.150.933 20.888 80.834 52.621.500.74-80.76-0.190.994 0-25.27-24.16-23.04
2.3 结合常数和结合位点数分析
根据方程(2)的斜率和截距计算不同温度下黄酮样品与HSA相互作用的结合常数(Ka)和结合位点数(n),结果如表1所示。由表可知,Q3X、Que、Q3Ru、Q3G和Q3Rh与HSA结合的位点数n接近于1,且在温度为298 K时,5个黄酮与HSA相互作用的结合常数Ka值均大于2.16×104 L/mol,说明5个黄酮均是通过1∶1的摩尔比与HSA结合,形成稳定的复合物[17]。所有样品的Ka均随反应温度的增加呈下降趋势,说明Q3Ru-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Que-HSA复合物的稳定性均随着反应温度的增加而降低,这些复合物的形成均为放热过程[18]。另外,Que与HSA相互作用的Ka值最大,其次为Q3G,Q3Ru最小,说明Que与HSA的结合能力最强,3-羟基的木糖、鼠李糖、葡萄糖和芸香糖取代均会降低Que与HSA的结合能力以及形成的复合物的稳定性。
2.4 热力学参数分析
槲皮素和槲皮素糖苷与HSA相互作用的热力学参数焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)可通过用van’t Hoff方程计算[19],计算如公式(3)、公式(4)所示:
lnKa=-ΔH/RT+ΔS/R
(3)
ΔG=ΔH-TΔS
(4)
式中:R,气体常数8.314 J/(mol·K);T,反应绝对温度(298、304、310 K);Ka,对应温度条件下槲皮素、槲皮素糖苷与HSA的结合常数。
根据公式(3)计算出的ΔH、ΔS和ΔG如表1所示。活性小分子与蛋白质之间的作用力主要有氢键、疏水相互作用、范德华力和静电斥力,当ΔH<0,ΔS<0时,氢键和范德华力为小分子与蛋白质之间的主要作用力;ΔH>0,ΔS>0时,疏水相互作用为主要作用力;ΔH<0,ΔS>0时,静电相互作用为主要作用力[13]。
Que、Q3X、Q3Rh、Q3G、Q3Ru与HSA结合的ΔH分别为-137.44、-75.92、-54.12、-26.22、-80.76 kJ/mol,ΔS分别为-0.34、-0.17、-0.10、-0.01、-0.19 kJ/(mol·K),表明Que-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Q3Ru-HSA复合物形成的主要驱动力均为氢键和范德华力,不同糖取代不会影响槲皮素与HSA主要相互作用力类型的变化。另外,ΔG为负值,且其值随反应温度的增加而上升,说明复合物的稳定性均随着温度的升高而降低,进一步证明Que/Q3X/Q3Rh/Q3G/Q3Ru-HSA复合物形成的过程是一个自发的放热过程[20]。另外,相同温度条件下,Que-HSA复合物的稳定性最高,Q3G-HSA复合物的稳定性最差,表明糖取代降低复合物的稳定性。
2.5 同步荧光光谱分析
槲皮素及槲皮素糖苷对HSA同步荧光光谱的影响如图3所示,Δλ为15和60 nm时获得的荧光光谱分别反映的是酪氨酸和色氨酸微环境和极性的变化,激发波长向长波方向偏移,表明色氨酸/酪氨酸残基所处微环境的疏水性降低,极性增强;向短波方向偏移,则说明色氨酸/酪氨酸残基微环境的疏水性增强,极性降低[13,21]。
Δλ固定为15 nm时,HSA的最大激发波长为286.4,Que、Q3X、Q3Rh、Q3G和Q3Ru对HSA的最大激发波长影响较小,激发波长增量仅为0.2~0.6 nm;当Δλ为60 nm时,添加Q3X、Q3Rh、Q3G和Q3Ru使HSA的最大激发波长发生了明显红移,波长增量分别是1.4、2.0、2.4、1.6 nm,但Que对HSA的最大激发波长无显著影响。说明Q3X、Q3Rh、Q3G和Q3Ru可显著增加色氨酸微环境的极性,使色氨酸暴露在更加亲水的环境中,但对酪氨酸微环境极性的影响很小,Que不会诱导HSA中酪氨酸和色氨酸残基周围微环境极性的变化[22]。许多研究也发现,活性小分子可以诱导蛋白上色氨酸微环境极性的变化,但对色氨酸微环境极性变化影响较小,如LI等[16]发现,芹菜素、柚皮素、山奈酚和染料木素的添加促使β-乳球蛋白中色氨酸微环境的极性增加,但对酪氨酸的微环境的极性无显著影响。DAN等[13]研究表明川陈皮素可诱导β-乳球蛋白上色氨酸残基荧光发射波长的红移,但对酪氨酸残基的荧光发射波长无影响。综上可知,糖取代降低了槲皮素对HSA的荧光淬灭效果和构象的改变,但可增加Que对HSA上酪氨酸和色氨酸微环境极性的影响,其中葡萄糖的效果最强,木糖最小。
2.6 分子对接
分子对接是广泛用于分析小分子与蛋白质之间相互作用的一种计算机模拟技术,可以预测小分子配体与蛋白等大分子受体之间的作用力、结合区域和结合位点。如图4所示,Que、Q3X、Q3Rh、Q3G和Q3Ru分别结合在HSA上由13、14、18、14和20个氨基酸组成的疏水腔中,氢键、疏水相互作用和范德华力为Que-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Q3Ru-HSA复合物形成的主要作用力,形成的氢键数分别为4、6、4、2、4个。
Que上的3-羟基、7-羟基、4′-羟基和5′-羟基分别与HSA上的Leu154、Arg186、Leu135和Leu135形成了4个氢键。3-羟基被木糖取代后,木糖上的4″-和2″-羟基分别与Lys190、Leu185和Arg186结合形成氢键,苷元上的7-羟基和4′-羟基分别与Leu135和Arg117形成氢键;3-羟基被鼠李糖取代后,鼠李糖上的2″-羟基分别与Tyr161、Leu182和Arg117结合形成氢键,苷元上的7-羟基和4′-羟基分别与Leu135和Arg186形成氢键;3-羟基被葡萄糖取代后,葡萄糖上的5‴-羟基与Arg117结合形成氢键,苷元上的4′-羟基与Leu135形成氢键;3-羟基被芸香糖取代后,芸香糖上的3‴-羟基、4‴-羟基分别与Ala158和Leu135结合形成氢键,苷元上的4′-羟基和C![]() O上的氧分别与Tyr161和Leu135形成氢键。表明糖苷取代不仅会影响Que与HSA的结合,还会改变其具体的结合位点,但对复合物形成的主要作用力类型影响不大。
O上的氧分别与Tyr161和Leu135形成氢键。表明糖苷取代不仅会影响Que与HSA的结合,还会改变其具体的结合位点,但对复合物形成的主要作用力类型影响不大。

A,a-槲皮素;B,b-槲皮素-3-O-木糖苷;C,c-槲皮素-3-O-鼠李糖苷;D,d-异槲皮素;E,e-芦丁
图3 五种黄酮对HSA在Δλ为15 nm(A~E)和60 nm(a~e)时同步荧光光谱的影响
Fig.3 Effect of five flavonoids on the synchronous fluorescence spectra of HSA with Δλ at 15 nm(A-E) and 60 nm(a-e)
注:黄酮浓度分别为0.00、1.66、2.48、3.29、4.1、4.9、5.7、6.49、12.99 μmol/L
3 结论
通过比较研究Que、Q3X、Q3Rh、Q3G和Q3Ru与HSA之间的相互作用,结果发现:(1)Que、Q3X、Q3Rh、Q3G和Q3Ru与HSA的结合会改变HSA的构象结构,并通过静态方式淬灭HSA的内源荧光,3-羟基糖取代会降低Que对HSA的荧光淬灭效果;(2)Que、Q3X、Q3Rh、Q3G和Q3Ru与HSA按照1∶1的摩尔比通过自发的放热过程结合形成稳定的复合物,氢键、疏水相互作用和范德华力为稳定复合物的主要作用力。木糖、鼠李糖、葡萄糖和芸香糖取代均会降低其与HSA的结合能力,但对作用力类型无影响;(3)Que及其糖苷与HSA的结合使HSA上Tyr微环境的极性增加,但不会改变Trp残基微环境的极性。3-羟基糖取代增强Que对HSA上色氨酸微环境的影响,其中葡萄糖的效果最强,木糖最小;(4)Que、Q3X、Q3Rh、Q3G和Q3Ru均结合在HSA亚区域IB的疏水腔中,糖取代不会明显改变Que与HSA的结合区域和作用力类型,但会改变其相互作用氨基酸。

图4 五种黄酮与HSA分子对接的3D和2D图谱
Fig.4 The 3D and 2D diagrams of molecular docking of five flavonoids with HSA
以上结果可为深入了解糖取代对黄酮类化合物体内生物活性影响提供理论参考,对其在功能性食品中的应用奠定基础。
[1] YAO L H,JIANG Y M,SHI J,et al.Flavonoids in food and their health benefits[J].Plant Foods for Human Nutrition,2004,59(3):113-122.
[2] MUTHA R E,TATIYA A U,SURANA S J.Flavonoids as natural phenolic compounds and their role in therapeutics:An overview[J].Future Journal of Pharmaceutical Sciences,2021,7(1):1-13.
[3] ZHOU Y P,WANG T,SONG D Q,et al.Dietary intake of flavonoid subclasses and risk of type 2 diabetes in prospective cohort studies:A dose-response meta-analysis[J].Clinical Nutrition,2018,37(6):2 294-2 298.
[4] KOCIC B,KITIC D,BRANKOVIC S.Dietary flavonoid intake and colorectal cancer risk:Evidence from human population studies[J].Journal of B.U.ON.,2013,18(1):34-43.
[5] ARTS M J T J,HAENEN G R M M,VOSS H P,et al.Masking of antioxidant capacity by the interaction of flavonoids with protein[J].Food and Chemical Toxicology,2001,39(8):787-791.
[6] LI M,MA Y,NGADI M O.Binding of curcumin to β-lactoglobulin and its effect on antioxidant characteristics of curcumin[J].Food Chemistry,2013,141(2):1 504-1 511.
[7] EGERT S,TERESZCZUK J,WEIN S,et al.Simultaneous ingestion of dietary proteins reduces the bioavailability of galloylated catechins from green tea in humans[J].European Journal of Nutrition,2013,52(1):281-288.
[8] HE X M,CARTER D C.Atomic structure and chemistry of human serum albumin[J].Nature,1992,358(6 383):209-215.
[9] SCHMIDT S,GONZALEZ D,DERENDORF H.Significance of protein binding in pharmacokinetics and pharmacodynamics[J].Journal of Pharmaceutical Sciences,2010,99(3):1 107-1 122.
[10] SENGUPTA B,SENGUPTA P K.The interaction of quercetin with human serum albumin:A fluorescence spectroscopic study[J].Biochemical and Biophysical Research Communications,2002,299(3):400-403.
[11] HE J W,WANG Q,ZHANG L L,et al.Docking simulations and spectroscopy of the interactions of ellagic acid and oleuropein with human serum albumin[J].Journal of Luminescence,2014,154:578-583.
[12] SHAMSI A,AHMED A,KHAN M S,et al.Rosmarinic acid restrains protein glycation and aggregation in human serum albumin:Multi spectroscopic and microscopic insight-Possible Therapeutics Targeting Diseases[J].International Journal of Biological Macromolecules,2020,161:187-193.
[13] DAN Q Y,XIONG W F,LIANG H S,et al.Characteristic of interaction mechanism between β-lactoglobulin and nobiletin:A multi-spectroscopic,thermodynamics methods and docking study[J].Food Research International,2019,120:255-263.
[14] WEN Q H,WANG L H,ZENG X N,et al.Hydroxyl-related differences for three dietary flavonoids as inhibitors of human purine nucleoside phosphorylase[J].International Journal of Biological Macromolecules,2018,118:588-598.
[15] KHAN A Y,KUMAR G S.Probing the binding of anticancer drug topotecan with human hemoglobin:Structural and thermodynamic studies[J].Journal of Photochemistry and Photobiology B:Biology,2016,163:185-193.
[16] LI T,HU P,DAI T T,et al.Comparing the binding interaction between β-lactoglobulin and flavonoids with different structure by multi-spectroscopy analysis and molecular docking[J].Spectrochimica Acta.Part A,Molecular and Biomolecular Spectroscopy,2018,201:197-206.
[17] ZHU J X,SUN X W,WANG S H,et al.Formation of nanocomplexes comprising whey proteins and fucoxanthin:Characterization,spectroscopic analysis,and molecular docking[J].Food Hydrocolloids,2017,63:391-403.
[18] RABBANI G,BAIG M H,JAN A T,et al.Binding of erucic acid with human serum albumin using a spectroscopic and molecular docking study[J].International Journal of Biological Macromolecules,2017,105:1 572-1 580.
[19] JIA J J,GAO X,HAO M H,et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry,2017,228:143-151.
[20] RABBANI G,LEE E J,AHMAD K,et al.Binding of tolperisone hydrochloride with human serum albumin:Effects on the conformation,thermodynamics,and activity of HSA[J].Molecular Pharmaceutics,2018,15(4):1 445-1 456.
[21] ZHANG L,XU L,TU Z C,et al.Mechanisms of isoquercitrin attenuates ovalbumin glycation:Investigation by spectroscopy,spectrometry and molecular docking[J].Food Chemistry,2020,309:125 667.
[22] LU Y,WANG Y L,GAO S H,et al.Interaction of quercetin with ovalbumin:Spectroscopic and molecular modeling studies[J].Journal of Luminescence,2009,129(9):1 048-1 054.