在不断寻求安全有效的减肥措施过程中,某些益生菌或益生元得到了广泛关注。甘露低聚糖(mannooligosaccharides,MOS)作为一种益生元,在改善肥胖方面表现出良好的作用效果。研究发现MOS能够调节肠道菌群结构,增加短链脂肪酸(short-chain fatty acids,SCFAs)水平,改善高脂饮食诱导的肥胖[1]。临床研究也证明MOS能够降低人体血脂水平,减少人体腹部脂肪量,有效减轻体重[2-4]。此外,研究表明,部分益生菌,如双歧杆菌、植物乳杆菌等,能够降低体重、抑制脂质积累,具有良好的改善肥胖效果[5-7]。
合生元是益生菌与益生元的混合制剂,可通过合生元改变饮食结构,或对宿主脂代谢有积极作用,从而达到改善肥胖的效果。前人研究发现,乳杆菌联合MOS能够显著改善高脂饮食引起的肝损伤和肝脏脂肪细病变[8]。MOS也被证明能够促进肠道中乳酸菌和双歧杆菌等有益菌的生长,具有益生作用[9]。但其与益生菌联合作用对肥胖病症的改善作用研究的并不多且作用机制也不明确。尽管如此,合生元已成为膳食干预改善肥胖的新策略。
本研究以前期实验获得的具有良好减肥效果的植物乳杆菌(Lactobacillus plantarum)F3-2联合MOS干预高脂饮食诱导肥胖小鼠,对其作用效果进行评价,以进一步探究二者相互作用的潜在机制。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
L.plantarum F3-2,中国海洋大学功能性乳品与益生菌实验室保藏;6周龄SPF级雄性C57BL/6小鼠,山东济南朋悦实验动物繁育有限公司;低脂饲料(D12450B)、高脂饲料(D12492),北京维通利华实验动物技术有限公司;奥利司他,山东新时代药业有限公司;血清中甘油三酯(triglyceride,TG)、血清总胆固醇(serum total cholesterol,TC)检测试剂盒,南京建成生物工程研究所;Trizol裂解液,美国Invertrogen;逆转录试剂盒、Power SYBR Green PCR Master Mix,东洋纺生物科技有限公司;二乙基丁酸、乙酸标准品、丙酸标准品、丁酸标准品,德国Dr.Ehrenstorfer;MOS(93%),上海源叶科技生物科技有限公司。
1.1.2 仪器与设备
Multiskan FC酶标仪,北京普朗新技术有限公司;NIKON/Ni-E电动荧光显微镜,日本尼康公司;NanoDrop2000超微量分光光度计、LineGene9600实时荧光PCR仪,赛默飞世尔科技公司;TP600PCR扩增仪,宝日医生物技术有限公司;高温低速组织研磨仪,武汉赛维尔生物科技有限公司;GC6890气相色谱仪,安捷伦科技有限公司。
1.2 试验方法
1.2.1 菌株
将L.plantarum F3-2在MRS中37 ℃条件下培养24 h,于1 100×g,4 ℃条件下离心5 min收集菌体,用PBS洗3遍。将菌体重悬到PBS(pH 7.4)中,采用平板计数法[10]调整浓度到108CFU/mL。
1.2.2 小鼠饲养与分组
将24只6周龄雄性C57BL/6小鼠置于光照12 h、温度(20±2)℃、相对湿度(50±10)%条件下,适应性喂养1周,期间饮水自由。实验经中国海洋大学食品科学与工程学院实验动物伦理委员会批准,伦理审查号为SPXY20181118215。
适应性喂养1周后,小鼠被随机分为4组,每组6只。分别为低脂饲料对照组(normal control,NC)、高脂饲料对照组(high-fat diet,HFD)、MOS干预组(MOS)、L.plantarum F3-2联合MOS干预组(F3-2+MOS)。NC组喂低脂饲料,其余3组喂高脂饲料。从第7周开始,NC组和HFD组每天灌胃0.2 mL PBS;MOS组每天灌胃含有MOS(6 g/kg BW)的PBS;F3-2+MOS组每天灌胃0.2 mL含有MOS(6 g/kg BW)的菌悬液。实验共干预6周。每周测量1次小鼠体质量。
1.2.3 小鼠组织及血清
将小鼠麻醉后采用眼眶静脉丛取血法收集血液,并用颈椎脱位处死小鼠。将血液在3 000×g,4 ℃条件下离心20 min,收集上清液即为血清。切除脂肪组织及肝脏,称质量。血清、脂肪组织及肝脏被移至-80 ℃ 冻存,用于下一步分析,避免反复冻融[11]。
1.2.4 脂肪组织病理学分析
将小鼠附睾脂肪组织用生理盐水冲洗干净,置于脂肪专用固定液。用石蜡包埋,组织切片、苏木精-伊红(hematoxylin-eosin,HE)染色法。使用电动荧光显微镜对图像进行分析[12]。
1.2.5 血清脂质测定
血清中TG、TC的浓度按商业试剂盒的说明进行测定[11]。
1.2.6 逆转录聚合酶链反应分析脂代谢关键基因
根据先前实时荧光定量PCR方法[13],用Trizol试剂提取附睾脂肪组织中总RNA。使用逆转录试剂盒,利用PCR扩增仪将RNA反转录生成cDNA。采用Power SYBR Green PCR Master Mix通过实时逆转录聚合酶链反应对RNA表达水平进行定量分析。引物序列如表1所示。
表1 逆转录聚合酶链反应的引物序列
Table 1 Primer sequence of reverse transcription polymerase chain reaction

基因正向和反向引物(5′-3′)参考β-actinF:GGCTGTATTCCCCTCCATCG[14]R:CCAGTTGGTAACAATGCCATGTPPARγF:TTGATTTCTCCAGCATTTCT[15]R:TGTTGTAGAGCTGGGTCTTTC/EBPαF:AGCAACGAGTACCGGGTACG[15]R:TGTTTGGCTTTATCTCGGCTC
1.2.7 小鼠粪便中SCFAs测定
根据先前SCFAs测定方法[16]采用气相色谱法测定其SCFAs的浓度。将0.1 g的样品与1 200 μL的蒸馏水混匀后,与50 μL 50%浓硫酸混合进行酸化。室温下,每分钟涡旋1次,持续5 min。5 000×g离心10 min。取上清液500 μL,用0.22 μm滤器过滤,加入50 μL过膜的二乙基丁酸作为内标,加入500 μL无水乙醚,漩涡振荡30 s,5 000×g离心10 min。取上层乙醚150 μL,12 000×g离心10 min后将上清液转移至液相小瓶中。采用内标法利用气相色谱仪测定浓度,每次上样1 μL。
1.2.8 统计分析
实验重复3次。采用IBM SPSS 22.0软件进行统计学差异分析。所有结果均表示为平均值±标准差。不同字母表示差异显著(P<0.05)。#P<0.05 对照NC组,*P<0.05 对照HFD组。
2 结果与分析
2.1 L.plantarum F3-2联合MOS对小鼠体质量、脂肪组织质量的影响
如图1所示,各组小鼠经适应性饲养1周后,体质量没有显著差异。干预6周实验结束后,HFD组小鼠体质量与NC组相比体质量增加了40.39%(P<0.05)。而MOS减缓了小鼠体质量增长趋势,相比HFD组减少了14.16%(P<0.05)。当L.plantarum F3-2联合MOS干预时,相比HFD组,小鼠体质量减少了18.33%(P<0.05)。可以认为,MOS能有效减轻高脂饮食诱导肥胖小鼠体质量,联合L.plantarum F3-2在一定程度上加强MOS改善肥胖的作用效果。
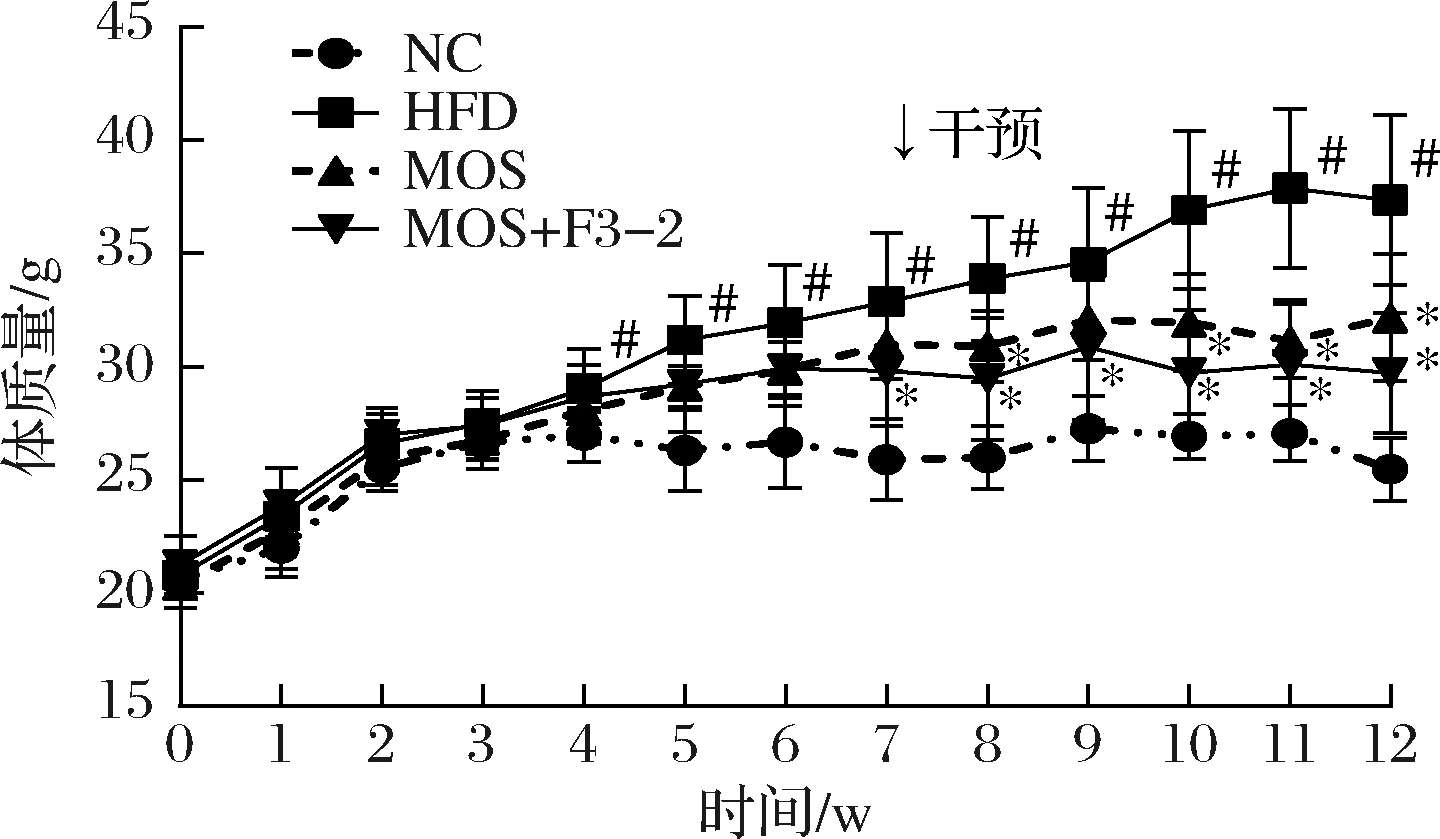
图1 L.plantarum F3-2联合MOS对小鼠体质量的影响
Fig.1 The effect of L.plantarum F3-2 combined with MOS on body weight
如表2所示,高脂饮食饲喂的小鼠各部分脂肪质量与NC组相比显著增加(P<0.05)。MOS干预后,各部分脂肪组织质量相比HFD组有下降的趋势,但差异并不显著。而与L.plantarum F3-2联合作用时各部分脂肪组织质量显著下降(P<0.05)。说明L.plantarum F3-2联合作用MOS能有效抑制脂肪组织扩张。
表2 L.plantarum F3-2联合MOS对小鼠脂肪组织质量的影响
Table 2 The effect of L.plantarum F3-2 combined with MOS on fat tissue weight of mice
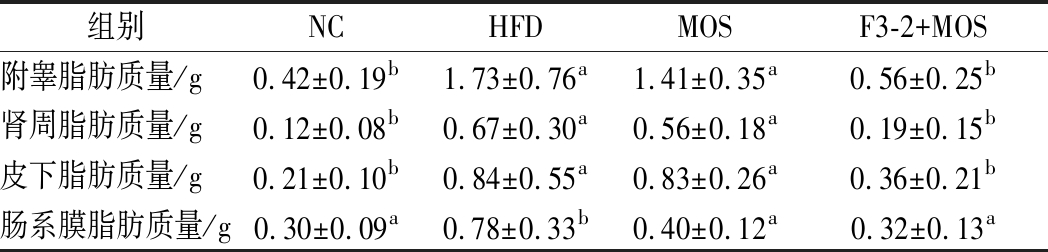
组别NCHFDMOSF3-2+MOS附睾脂肪质量/g0.42±0.19b1.73±0.76a1.41±0.35a0.56±0.25b肾周脂肪质量/g0.12±0.08b0.67±0.30a0.56±0.18a0.19±0.15b皮下脂肪质量/g0.21±0.10b0.84±0.55a0.83±0.26a0.36±0.21b肠系膜脂肪质量/g0.30±0.09a0.78±0.33b0.40±0.12a0.32±0.13a
2.2 L.plantarum F3-2联合MOS作用减下小鼠脂附睾脂肪细胞大小
为了进一步观察小鼠脂肪组织病变情况,对小鼠脂肪组织进行切片染色,分析各组处理对小鼠附睾脂肪细胞的大小的影响,结果见图2。对照NC组,高脂饮食显著增加了附睾脂肪细胞平均大小。MOS干预后细胞明显变小。L.plantarum F3-2联合MOS干预后,明显减小了脂肪细胞大小。通过软件分析附睾脂肪细胞平均面积,给予MOS的脂肪细胞平均面积明显减小,相比HFD组减小了31.99%(P<0.05),L.plantarum F3-2与MOS联合作用减小了63.49%(P<0.05)。进一步验证了L.plantarumF3-2联合MOS能够有效抑制脂肪组织扩张,减轻脂肪组织质量。
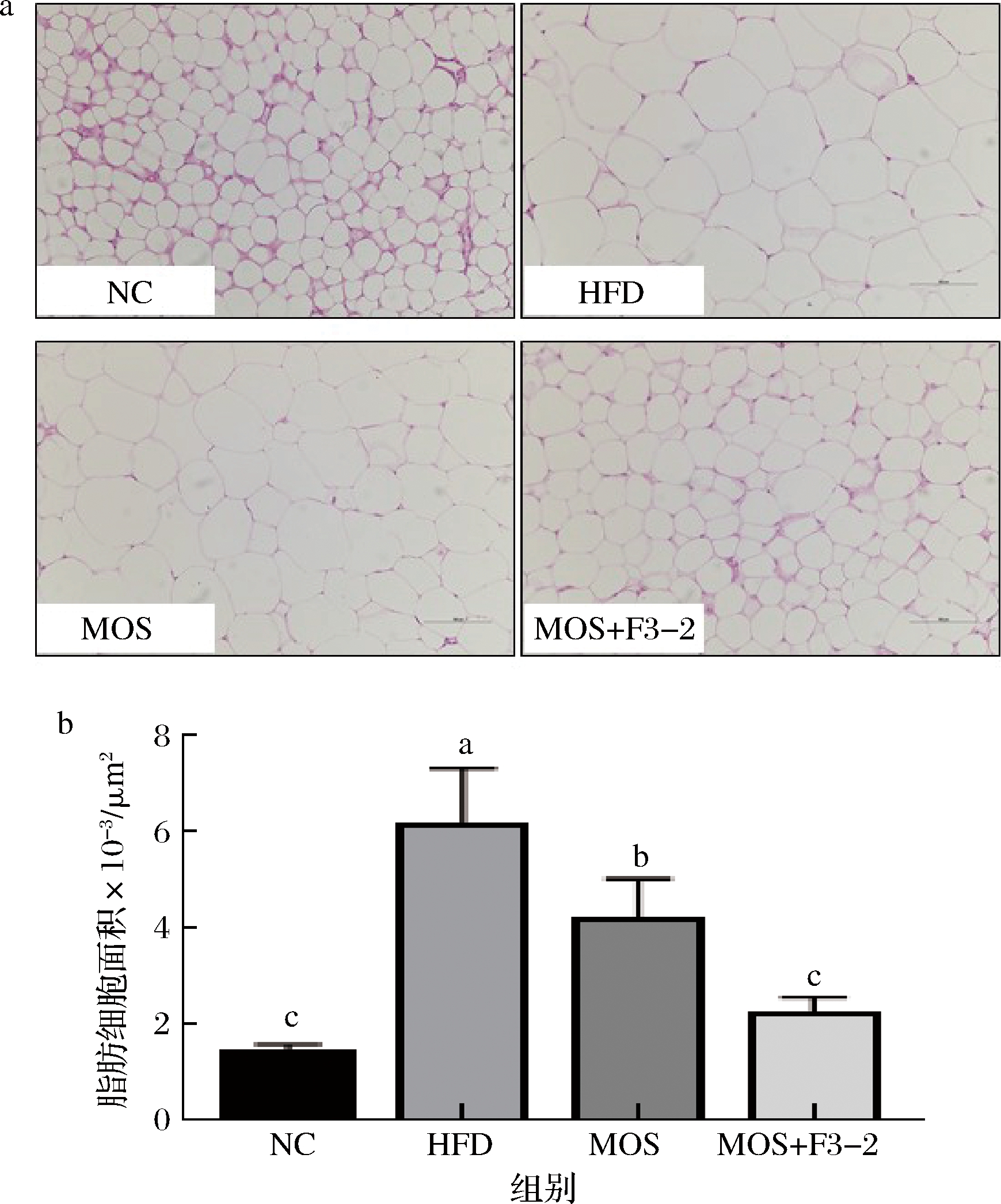
a-小鼠附睾脂肪组织病理切片(HE染色);b-脂肪细胞平均面积
图2 L.plantarum F3-2联合MOS干预对小鼠附睾脂肪细胞大小的影响
Fig.2 The effect of L.plantarum F3-2 combined with MOS intervention on the size of mouse epididymal adipocytes
2.3 L.plantarum F3-2联合MOS作用对血清TG、TC含量的影响
为了明确被干预后小鼠血脂水平变化情况,对各组小鼠血清中TG、TC含量进行分析,结果如表3所示。MOS能显著改善高脂饮食引起的血清TG含量的升高。当L.plantarum F3-2与MOS联合作用时,显著降低了血清中TG水平,相比HFD组下降了32.93%。各干预组对血清中TC含量均没有显著作用效果。说明MOS能通过降低血清中TG含量减少脂质堆积,L.plantarum F3-2联合作用加强了MOS的作用效果。
表3 L.plantarum F3-2联合MOS对血清TG、TC含量的影响 单位:mmol/L
Table 3 The effect of L.plantarum F3-2 combined with MOS on the TG and TC content in serum

组别TGTCNC0.49±0.74b3.19±0.50bHFD0.82±0.28a5.50±2.38abMOS0.56±0.92b5.99±1.48aF3-2+MOS0.55±0.10b4.56±1.48ab
2.4 L.plantarum F3-2联合MOS作用降低附睾脂肪组织中过氧化物酶体增殖物激活受体-γ和CCAAT/增强子结合蛋白-α基因表达
为了探究L.plantarum F3-2联合MOS有效改善肥胖的作用机制,对各组小鼠附睾脂肪组织中过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPARγ)及CCAAT/增强子结合蛋白-α(CCAAT/enhancer binding protein-α,C/EBPα)基因表达量进行分析,结果见图3。高脂饮食喂养小鼠附睾脂肪组织中PPARγ基因表达量显著升高,相比NC组增加了41.20%(P<0.05)。灌胃MOS后,附睾脂肪组织中PPARγ基因的表达量显著降低,减少了54.30%(P<0.05)。当L.plantarum F3-2和MOS同时作用时,PPARγ基因表达量显著低于MOS单独作用,相比HFD组减少了74.46%(P<0.05)。同样C/EBPα基因表达量变化趋势同PPARγ类似。
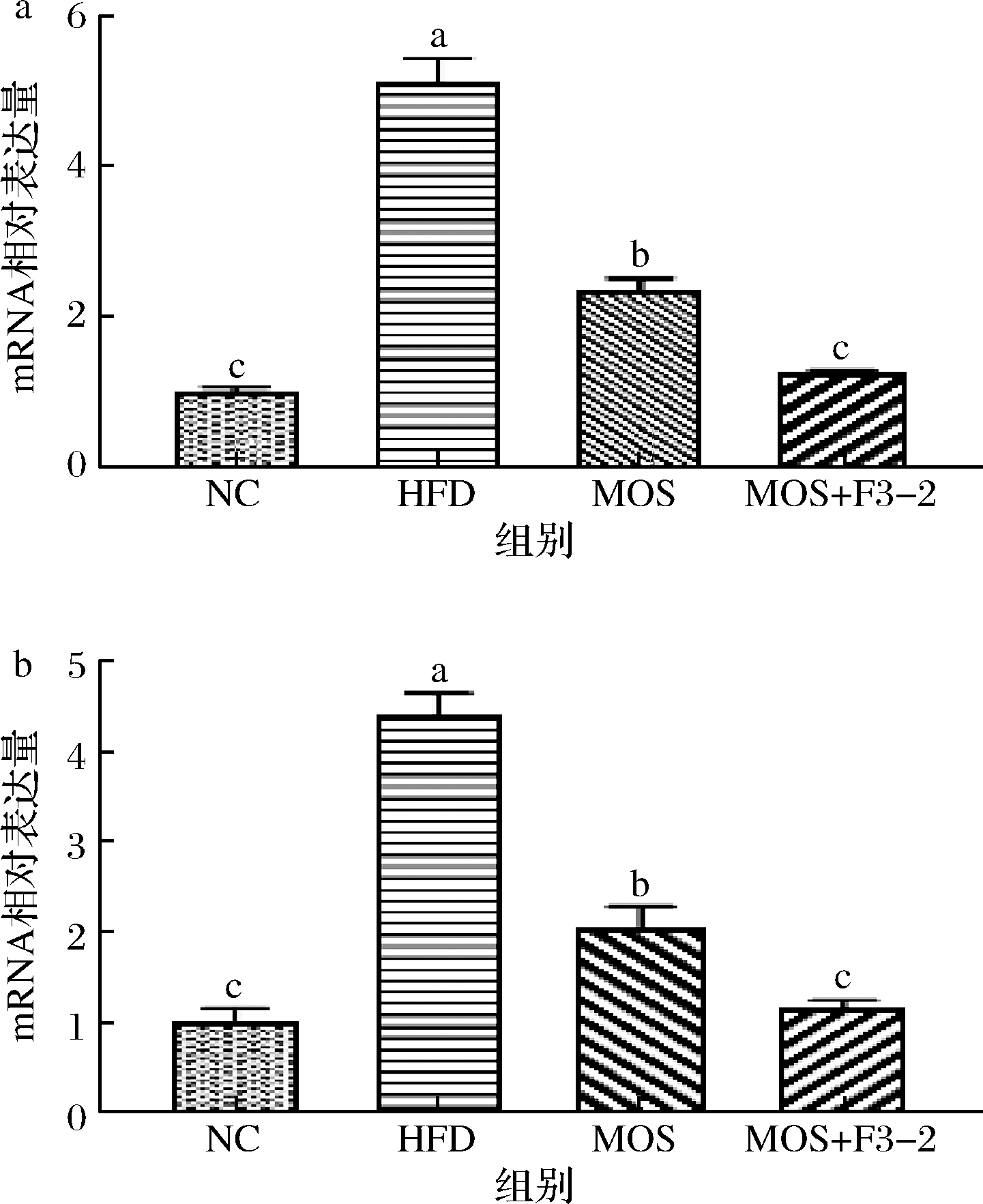
a-PPARγ表达量;b-C/EBPα表达量
图3 L.plantarum F3-2联合MOS对附睾脂肪组织中脂代谢关键基因表达量的影响
Fig.3 The effect of L.plantarum F3-2 combined with MOS on the expression of key genes of lipid metabolism in epididymal adipose tissue
2.5 L.plantarum F3-2联合MOS作用对SCFAs浓度的影响
为了进一步探究L.plantarum F3-2联合MOS抵抗高脂饮食诱导肥胖的作用机制,对各组小鼠粪便中SCFAs水平进行了分析,结果见图4。高脂饮食导致小鼠粪便中主要SCFAs浓度显著下降。MOS干预后,显著升高了乙酸、丙酸及丁酸浓度(P<0.05)。当L.plantarum F3-2联合MOS作用时,乙酸、丙酸、丁酸浓度被显著提升,特别是丁酸浓度,相比HFD组升高了109.89%(P<0.05)。发现甘露寡糖能有效提升高脂饮食诱导肥胖小鼠粪便中主要SCFAs的浓度,L.plantarum F3-2联合作用后能进一步提升粪便中丁酸的浓度。
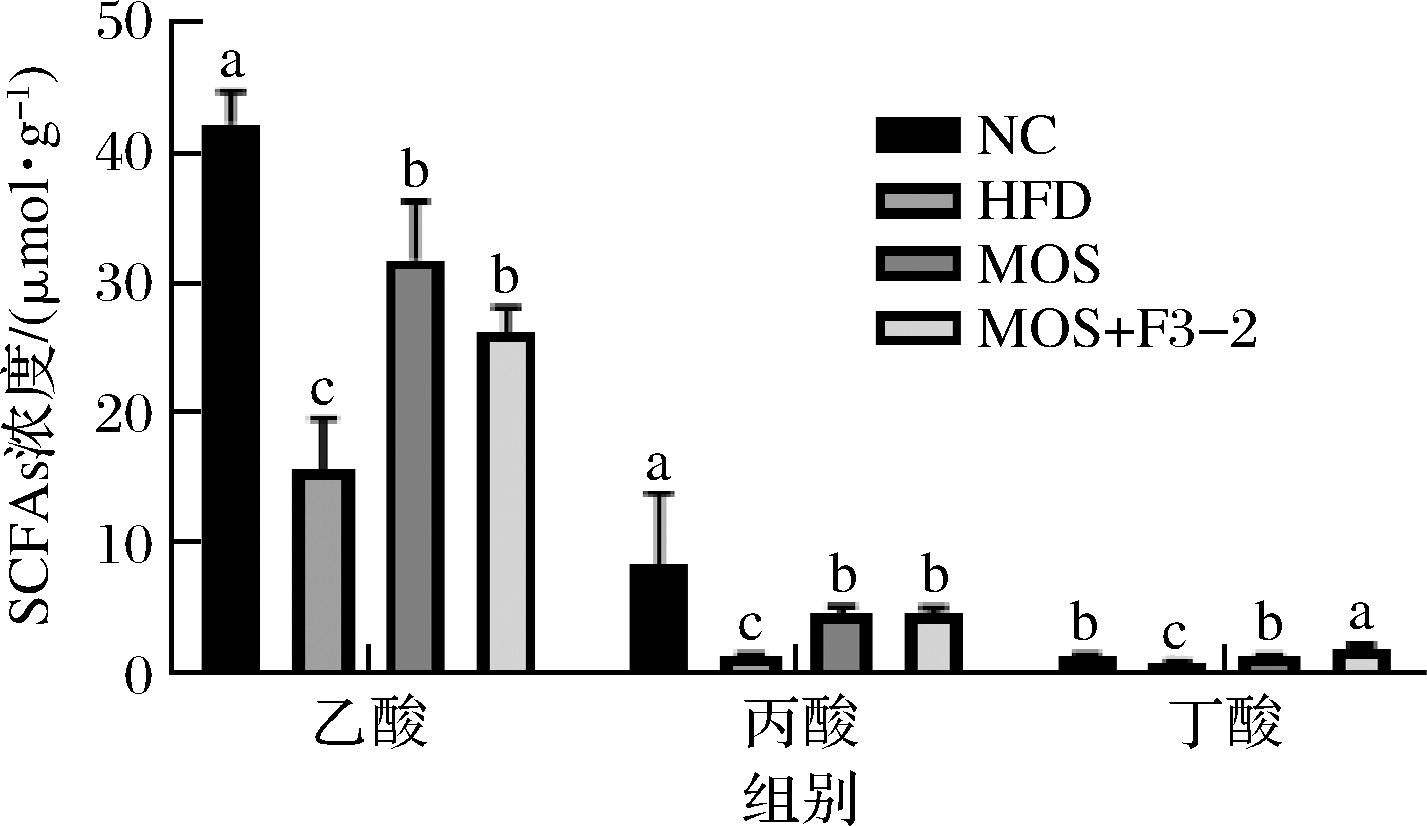
图4 L.plantarum F3-2联合MOS对干预对高脂饮食诱导肥胖小鼠粪便中主要SCFAs含量的影响
Fig.4 The effect of L.plantarum F3-2 combined with MOS on the main SCFAs content in the stool of obese mice induced by high-fat diet
3 结论与讨论
MOS在改善抗肥胖方面表现出极大的潜力,被证明能够促进有益菌生长,对宿主肠道健康产生积极影响[17-18]。反之,肠道菌及其益生菌对MOS的功能又会产生什么影响,是否能产生更有益的协调效果,是一个值得深入思考的问题。本文将前期实验获得的能改善肥胖的L.plantarum F3-2与MOS联合作用于高脂饮食诱导的肥胖小鼠,对其联合作用效果进行探究。发现L.plantarum F3-2与MOS联合作用时在抑制脂肪积累、减肥方面具有协同效果。
进一步探究L.plantarum F3-2加强MOS效果的作用机制。MOS不能被动物直接消化吸收,但能被嗜酸乳杆菌、双歧杆菌等代谢分解生成SCFAs[11,19],也有研究表明,益生菌干预能影响肠道菌群中主要产SCFAs相关菌群的丰度。例如Lactobacillus plantarum HAC01能提高小鼠肠道内Allobaculum的丰度,Allobaculum是产SCFAs的属之一,与体重增加呈负相关[11]。因此本研究对小鼠粪便中主要SCFAs浓度进行了分析,发现MOS能显著提升小鼠粪便中乙酸、丙酸、丁酸的浓度,这也与前人研究结果一致[20]。而L.plantarum F3-2联合作用后,3种主要SCFAs浓度均被提高,特别是丁酸的浓度。推测L.plantarum F3-2与MOS联合作用,能够通过提升粪便中主要SCFAs水平特别是丁酸水平来抵抗高脂饮食诱导肥胖。
前人研究表明,SCFAs通过抑制脂肪组织中PPARγ的表达来改善肥胖[21]。为进一步探究其机制,对小鼠脂肪组织中PPARγ和C/EBPα等基因表达量进行分析。发现L.plantarum F3-2联合MOS作用时,附睾脂肪中脂代谢关键基因PPARγ和C/EBPα等表达量被显著下调,L.plantarum F3-2加强了MOS对脂肪组织中脂代谢关键基因表达的抑制作用,而且各组之间的差异性与SCFAs趋势一致。因此推测,MOS能够通过增加SCFAs水平抑制脂肪组织中PPARγ等脂代谢关键基因的表达从而改善肥胖,而L.plantarum F3-2加强了MOS对肥胖的改善作用,但其如何影响SCFAs水平等作用机制作仍需进一步探究。
综上,本研究发现MOS能有效减轻小鼠体质量、脂肪组织质量、降低血清TG含量,证实了其在改善肥胖方面的良好作用效果。补充L.plantarum F3-2,可加强MOS的作用效果,其作用机制可能是增加SCFAs特别是丁酸的浓度,进一步下调脂肪组织中脂代谢关键基因PPARγ等的表达量,抑制脂肪组织扩张,改善肥胖病症。
[1] 王洪善,张晓娟,李恒,等.甘露寡糖对高脂饮食小鼠的益生作用[J].食品与发酵工业,2018,44(11):63-68.
WANG H S,ZHANG X J,LI H,et al.Prebiotic effects of mannan-oligosaccharide on high fat diet mice[J].Food and Fermentation Industries,2018,44(11):63-68.
[2] KUMAO T,FUJII S,OZAKI K,et al.Effect of diets with mannooligosaccharides from coffee mannan on fat in blood serum in healthy volunteers[J].Japan Journal of Food Engineering,2005,6(4):301-304.
[3] ST-ONGE M P,SALINARDI T,HERRON-RUBIN K,et al.A weight-loss diet including coffee-derived mannooligosaccharides enhances adipose tissue loss in overweight men but not women[J].Obesity,2012,20(2):343-348.
[4] ASANO I,FUJII S,OZAKI K,et al.Effects of “coffee beverage” containing mannooligosaccharides from coffee on human abdominal fat by long term ingestion[J].Japan Journal of Food Engineering,2005,6(2):133-141.
[5] AN H M,PARK S Y,LEE D K,et al.Antiobesity and lipid-lowering effects of Bifidobacterium spp.in high fat diet-induced obese rats[J].Lipids in Health and Disease,2011,10:116.
[6] WU C C,WENG W L,LAI W L,et al.Effect of Lactobacillus plantarum strain K21 on high-fat diet-fed obese mice[J].Evidence-Based Complementary and Alternative Medicine,2015,2015:391767.
[7] PARK J E,OH S H,CHA Y S.Lactobacillus plantarum LG42 isolated from gajami sik-hae decreases body and fat pad weights in diet-induced obese mice[J].Journal of Applied Microbiology,2014,116(1):145-156.
[8] 李亚男,马晓峰,王小英,等.乳杆菌联合甘露寡糖对非酒精性小鼠脂肪肝的影响[J].广东医学,2019,40(3):344-347.
LI Y N,MA X F,WANG X Y,et al.Effect of Lactobacillus and manna oligosaccharides on non-alcoholic fatty liver disease in mice[J].Guangdong Medical Journal,2019,40(3):344-347.
[9] POURABEDIN M,CHEN Q L,YANG M M,et al.Mannan-and xylooligosaccharides modulate caecal microbiota and expression of inflammatory-related cytokines and reduce caecal Salmonella Enteritidis colonisation in young chickens[J].FEMS Microbiology Ecology,2017,93(1):fiw226.
[10] LIANG X,LV Y,ZHANG Z,et al.Study on intestinal survival and cholesterol metabolism of probiotics[J].LWT,2020,124:109 132.
[11] PARK S,JI Y,JUNG H Y,et al.Lactobacillus plantarum HAC01 regulates gut microbiota and adipose tissue accumulation in a diet-induced obesity murine model[J].Applied Microbiology and Biotechnology,2017,101(4):1 605-1 614.
[12] SATO M,UZU K,YOSHIDA T,et al.Effects of milk fermented by Lactobacillus gasseri SBT2055 on adipocyte size in rats[J].The British Journal of Nutrition,2008,99(5):1 013-1 017.
[13] LIANG X,ZHANG Z,LV Y,et al.Reduction of intestinal trimethylamine by probiotics ameliorated lipid metabolic disorders associated with atherosclerosis[J].Nutrition,2020,79-80:110 941.
[14] ZHANG J,TANG H J,ZHANG Y Q,et al.Identification of suitable reference genes for quantitative RT-PCR during 3T3-L1 adipocyte differentiation[J].International Journal of Molecular Medicine,2014,33(5):1 209-1 218.
[15] PARK J E,OH S H,CHA Y S.Lactobacillus plantarum LG42 isolated from gajami sik-hae inhibits adipogenesis in 3T3-L1 adipocyte[J].BioMed Research International,2013,2013:460 927.
[16] WANG T,YAN H,LU Y Y,et al.Anti-obesity effect of Lactobacillus rhamnosus LS-8 and Lactobacillus crustorum MN047 on high-fat and high-fructose diet mice base on inflammatory response alleviation and gut microbiota regulation[J].European Journal of Nutrition,2020,59(6):2 709-2 728.
[17] CHAUHAN P S,SHARMA P,PURI N,et al.Purification and characterization of an alkali-thermostable β-mannanase from Bacillus nealsonii PN-11 and its application in mannooligosaccharides preparation having prebiotic potential[J].European Food Research and Technology,2014,238(6):927-936.
[18] GUO Y,HU Y,BAO W.Effects of konjac mannose-oligosaccharides in diets on immunity function and mecum microflora of three-yellow broilers’[J].Chinese Agricultural Science Bulletin,2011,27(17):58-61.
[19] DE VADDER F,KOVATCHEVA-DATCHARY P,GONCALVES D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell,2014,156(1-2):84-96.
[20] ASANO I,IKEDA Y,FUJII S,et al.Effects of mannooligosaccharides from coffee on microbiota and short chain fatty acids in rat cecum[J].Food Science and Technology Research,2004,10(3):273-277.
[21] DEN BESTEN G,BLEEKER A,GERDING A,et al.Short-chain fatty acids protect against high-fat diet-induced obesity via a PPARγ-dependent switch from lipogenesis to fat oxidation[J].Diabetes,2015,64(7):2 398-2 408.