粉红单端孢(Trichothecium roseum)是引起果蔬采后病害的重要病原物[1],它不仅能够侵染果蔬产品,造成严重的经济损失,而且产生的次级代谢产物单端孢霉烯毒素具有生物毒性[2]。目前,控制由T.roseum引起的果蔬采后病害主要依赖于化学合成的杀真菌剂[3],但是化学合成杀菌剂的长期使用,易引起药物残留,污染环境并影响人类健康,甚至增加病原体的抗药性[4]。因此,选择替代或减少化学合成杀菌剂,研究相应的抑菌物质具有重大意义[5]。
抗菌肽又名抗微生物肽[6],是一类小分子的多肽类物质,具有抗真菌的生物学特性且不易产生耐药性,有望成为化学药物替代品,应用潜力和价值巨大[7]。实验室前期从腐败的湿粉条中分离得到了1株对粉红单端孢具有拮抗作用的芽孢杆菌,经鉴定为短小芽孢杆菌(Bacillus pumilus) HN-10,利用B.pumilus HN-10发酵液开展了拮抗实验研究[8];严海娇等[9-10]通过硫酸铵沉淀、AB-8大孔吸附树脂、Sephadex G-100凝胶和半制备型反相高效液相色谱法对B.pumilus HN-10发酵液进行逐级分离纯化,获得了抗真菌肽P-1,并证实了B.pumilus HN-10抗菌肽P-1仅对粉红单端孢具有抑菌作用;明确了其氨基酸序列和分子质量,分别是GGSGGGSSGGSIGGR和1 149.14 Da;郭娟等[11]采用转录组学和蛋白组学初步分析了抗菌肽P-1对粉红单端孢胞内核酸,以及蛋白质的影响,但尚未明确其抑菌机理。
本试验以粉红单端孢为供试菌,基于平板培养和液态培养体系,采用碘化丙啶(propidiumiodide,PI)染色和透射电镜技术观察、结合系列生理生化指标测定,从细胞壁、膜结构变化、膜通透性以及膜脂过氧化等方面,探讨B.pumilus HN-10抗菌肽P-1处理对粉红单端孢细胞膜结构和活性氧(reactive oxygen species,ROS)代谢的影响,以期阐明抗菌肽P-1的抑制作用机理,为红粉病害控制及新型生防治剂的开发应用提供理论依据和支持。
试验材料:抗菌肽P-1,分离纯化于短小芽孢杆菌(Bacillus pumilus) HN-10。
试验菌株:粉红单端孢(Trichothecium roseum)CICC 2703,中国工业微生物菌种保藏中心。
1.2.1 B.pumilus HN-10抗菌肽P-1的粗提和分离纯化
参照严海娇等[9]的方法测定。
1.2.2 T.roseum孢子悬浮液制备
参照刘志恬等[12]的方法制备。
1.2.3 抗菌肽P-1抑菌效果的测定
采用牛津杯法进行抑菌实验。在PDA平板中央滴1滴(约2 μL),1×108 个/mL的T.roseum孢子悬浮液,然后在孢子悬浮液等距2 cm处放置4个牛津杯,吸取抗菌肽P-1 1 μL滴加于牛津杯中,等量无菌蒸馏水做为空白对照,置于28 ℃培养箱中培养7 d,采用十字交叉法测定抑菌直径。实验设3个重复。
1.2.4 抗菌肽P-1对T.roseum孢子细胞膜完整性和超微结构的影响
细胞膜完整性采用PI染色检测,具体参照WANG等[13]的方法测定,其超微结构变化参照HELAL等[14]的方法进行测定。
1.2.5 抗菌肽P-1对T.roseum菌体生长曲线的测定
在150 mL PDA 液体培养基中接种120 μL密度为1×108个/mL的孢子悬浮液和1 μg/mL的抗菌肽P-1,28 ℃,200 r/min 培养0、1、3、5、7 d,10 000 r/min离心20 min分别收集菌丝,80 ℃ 烘干至恒重,称量质量。每组重复3次。
1.2.6 抗菌肽P-1对T.roseum菌体细胞膜上麦角甾醇含量的影响
参考LIU等[15]的方法进行测定。
1.2.7 抗菌肽P-1对T.roseum 细胞膜通透性的影响
细胞外膜通透性参照付永岩等[16]的方法进行测定;电导率参照王雪燕等[17]的方法;脂质过氧化参照PUSHPANATHAN等[18]的方法;蛋白羰基化参照段丽菊等[19]的方法;丙二醛(malondialdehyole,MDA)含量参照王霆等[20]的方法。
1.2.8 抗菌肽P-1对T.roseum 菌体活性氧代谢的影响
![]() 超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、H2O2按照上海优选生物科技有限公司试剂盒的方法进行测定;过氧化物酶(peroxidase,POD)参照王新绘等[21]的方法。
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、H2O2按照上海优选生物科技有限公司试剂盒的方法进行测定;过氧化物酶(peroxidase,POD)参照王新绘等[21]的方法。
全部数据用Excel 2010计算平均值和标准偏差,使用Origin 9.0软件作图。用SPSS 19.0进行差异显著性分析及相关性分析(P<0.05)。
由表1可知,B.pumilus HN-10抗菌肽P-1经过硫酸铵沉淀、AB-8大孔吸附树脂、Sephadex G-100凝胶进行了分级纯化,最终得到了抗菌肽P-1。结果显示,经过逐级纯化的抗菌肽P-1对粉红单端孢具有明显的抑菌作用。
表1 不同纯化方式对粉红单端孢的抑菌活性
Table 1 Antifungal activity of different purification methods against T.roseum

抗菌肽P-1的纯化抑菌直径/mm硫酸铵沉淀9.73±0.10AB-8大孔吸附树脂10.45±0.10Sephadex G-100凝胶11.40±0.10
抗菌肽P-1对T.roseum的抑菌作用如图1,抗菌肽P-1对粉红单端孢菌体生长具有明显抑制作用,抑菌圈直径达到(12.1±0.10) mm。
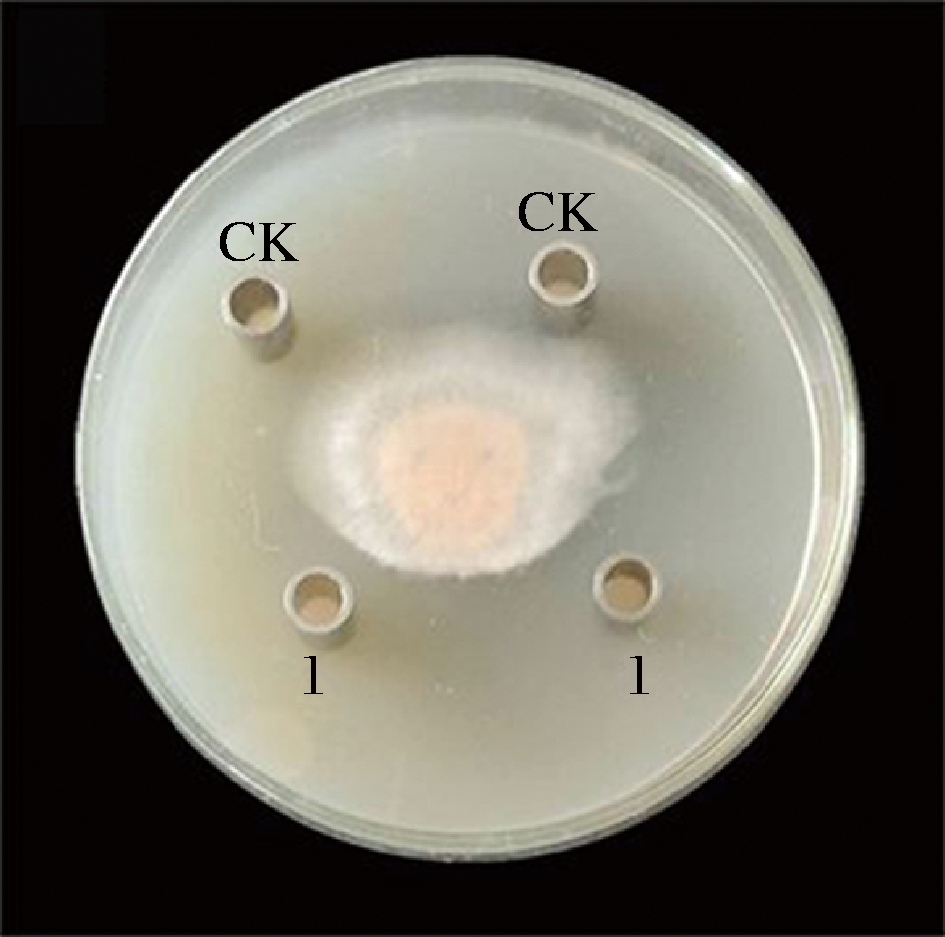
1-加入抗菌肽P-1;CK-对照
图1 抗菌肽P-1对T.roseum的抑制效果
Fig.1 Inhibitory effect of antifungal peptide P-1 on T.roseum
PI为非膜渗透性荧光染料,可以染色细胞核,质膜完整的细胞中,PI无法正常进入细胞,因而可以利用这一性质观察细胞核是否被染色,若能观察到荧光则证明质膜不完整。在荧光显微镜下观察,正常的细胞不能被染上红色,只有细胞膜被破坏的细胞才能发出红色荧光,并且早期凋亡的细胞红光比较微弱,晚期凋亡的细胞红光变强[22]。由图2可知,处理组中随着抗菌肽P-1时间的延长,被PI染色的孢子数逐渐增多(图2-d~图2-f),处理组可观察到明显荧光,而对照组(图2-a~图2-c)几乎无荧光。由此说明抗菌肽P-1破坏了T.roseum孢子的细胞膜完整性。
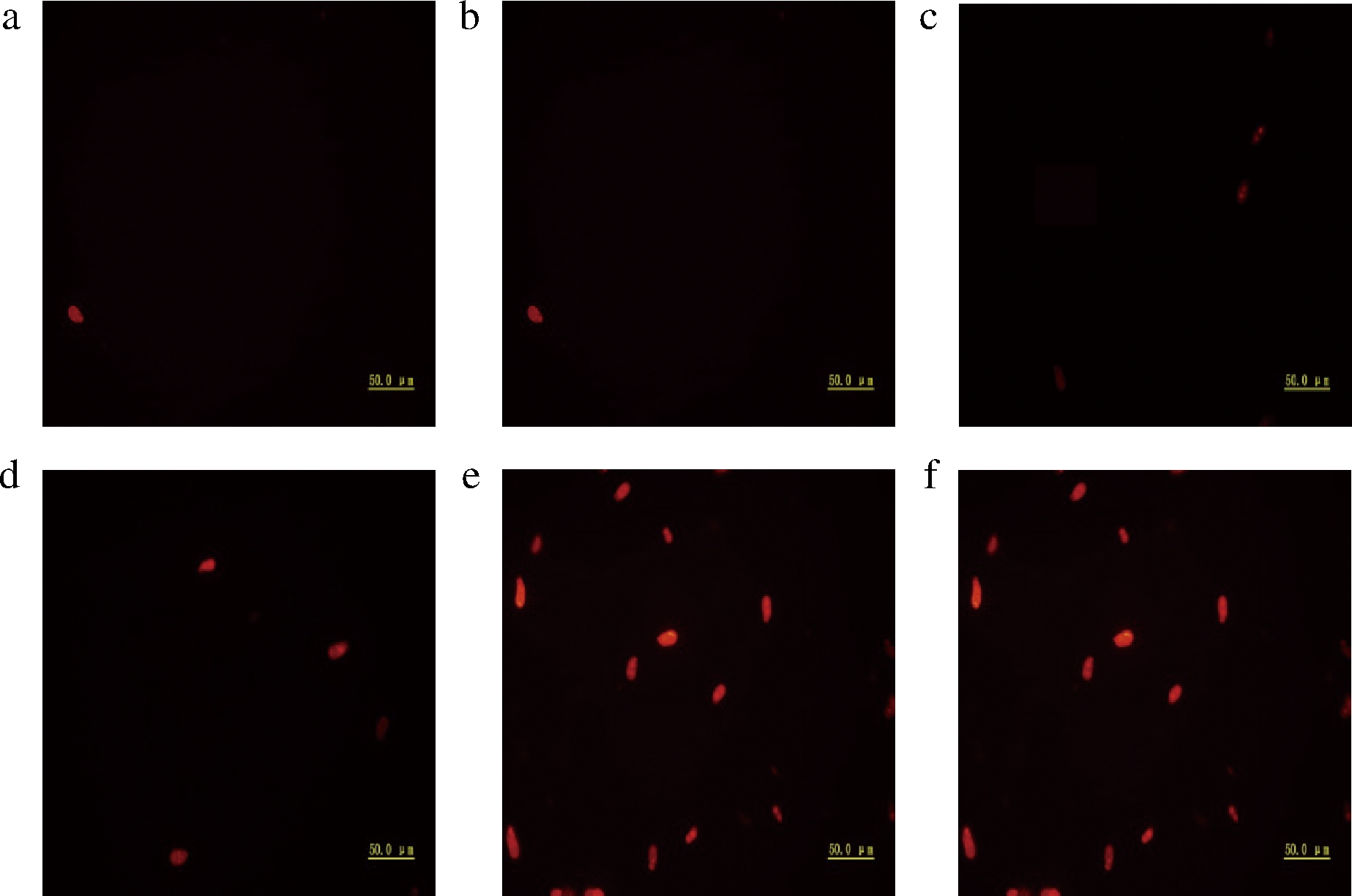
a-对照4 h;b-对照8 h;c-对照-12 h;d-处理4 h;e-处理8 h;f-处理12 h
图2 抗菌肽P-1对T.roseum孢子质膜完整性的影响
Fig.2 Effect of antifungal peptide P-1 on plasma membrane integrity of T.roseum spores
为了进一步验证抗菌肽P-1对T.roseum孢子的破坏作用,通过透射电镜观察正常菌体及被抗菌肽P-1处理的菌体细胞形态、细胞壁、膜及细胞器的变化情况,从细胞水平分析抗菌肽P-1对菌体的影响[23]。对照组孢子结构完整且紧密,壁、膜平滑完整,胞内横隔膜完整且细胞器分布均匀(图3-a)。抗菌肽P-1处理4 h后,有些菌体壁、膜边缘变得粗糙不平,甚至出现局部的破损缺口(图3-b)。处理8 h时,菌体内横隔膜内陷断裂细胞壁薄厚不均甚至残缺,细胞质外渗出现电子密度高的阴影,细胞器分布紊乱(图3-c)。延长处理时间至12 h时,观察到细胞器不规则且模糊,细胞质内含物大多消失,细胞质大量外渗,孢子变形(图3-d)。由此可知,抗菌肽P-1处理破坏了T.roseum菌体的超微结构,且处理时间越长,破坏越严重。
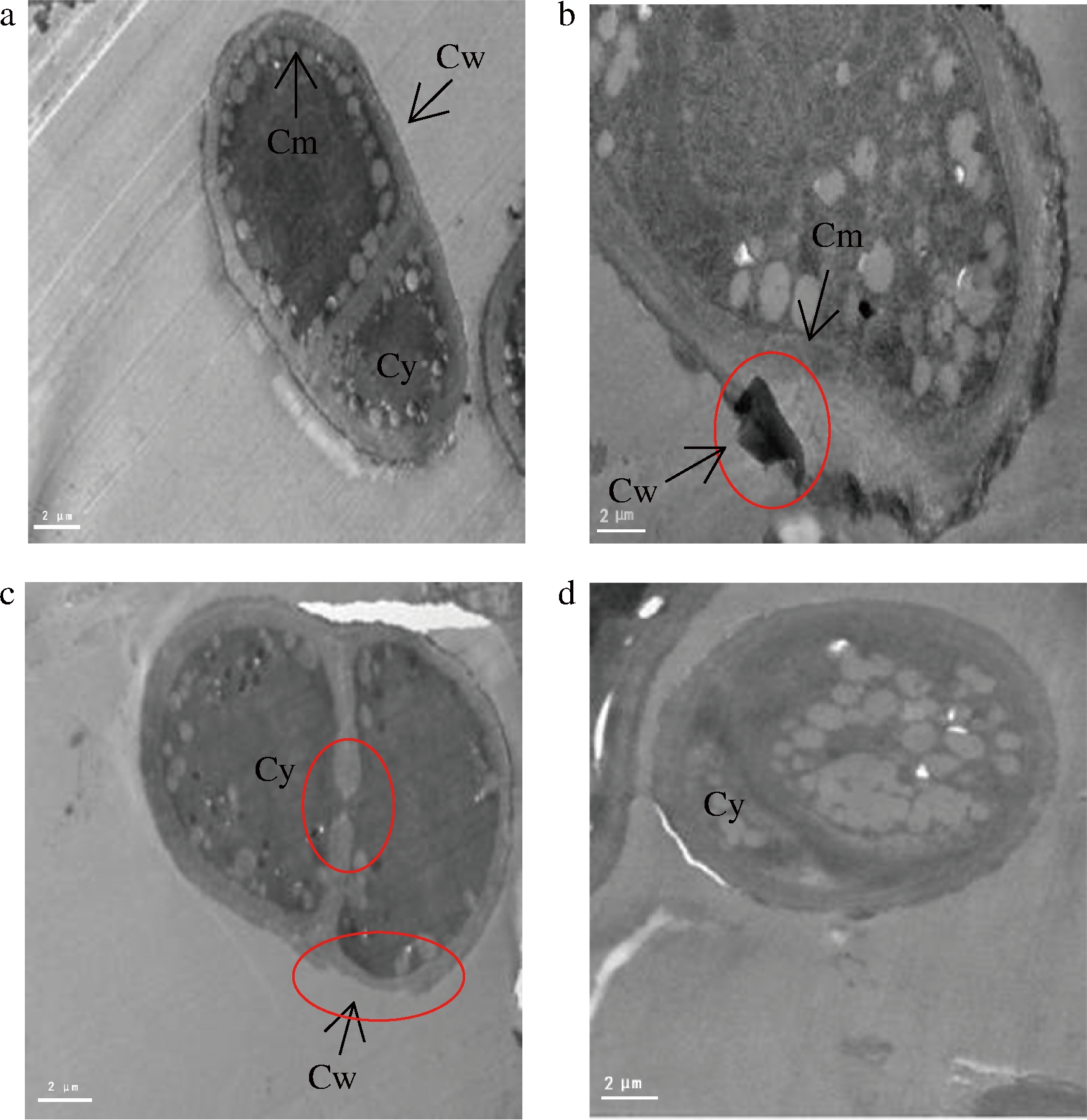
Cw-细胞壁;Cm-细胞膜;Cy-细胞质
a-对照0 h(×18 000);b-处理4 h(×25 000);
c-处理8 h(×21 000);d-处理12 h(×21 000)
图3 抗菌肽P-1对T.roseum孢子超微结构的影响
Fig.3 Effect of antifungal peptide P-1 on ultrastructure of T.roseum spores
注:a-×18 000;b-×25 000;c、d-×21 000
菌体生物量如图4-a,对照组的T.roseum生长良好,具有典型微生物的生长曲线特征,在第5天进入稳定期,第7天时达到最大生物量为0.171 g。而处理组生长曲线位于对照组下方,生长曲线呈现为平缓的下降趋势。结果说明抗菌肽P-1能够明显抑制T.roseum的生长繁殖。
麦角甾醇是真菌细胞膜的重要组分,主要以自由态的形式存在于磷脂双分子层中,在维持细胞膜流动性方面起着重要的作用[24]。麦角甾醇的缺失或降低,会导致真菌细胞膜结构破坏及功能的丧失[25]。因此,麦角甾醇含量的变化是衡量细胞膜受损的主要指标。由图4-b可知,随着时间的延长,麦角甾醇含量呈下降趋势,且在每个时段,处理组的麦角甾醇含量显著低于对照组(P<0.05),第7天时,相比对照组,减少了35%(P<0.05)。结果表明,抗菌肽P-1可以有效抑制T.roseum麦角甾醇的合成,引起细胞膜结构和功能受损,从而达到抑菌作用。
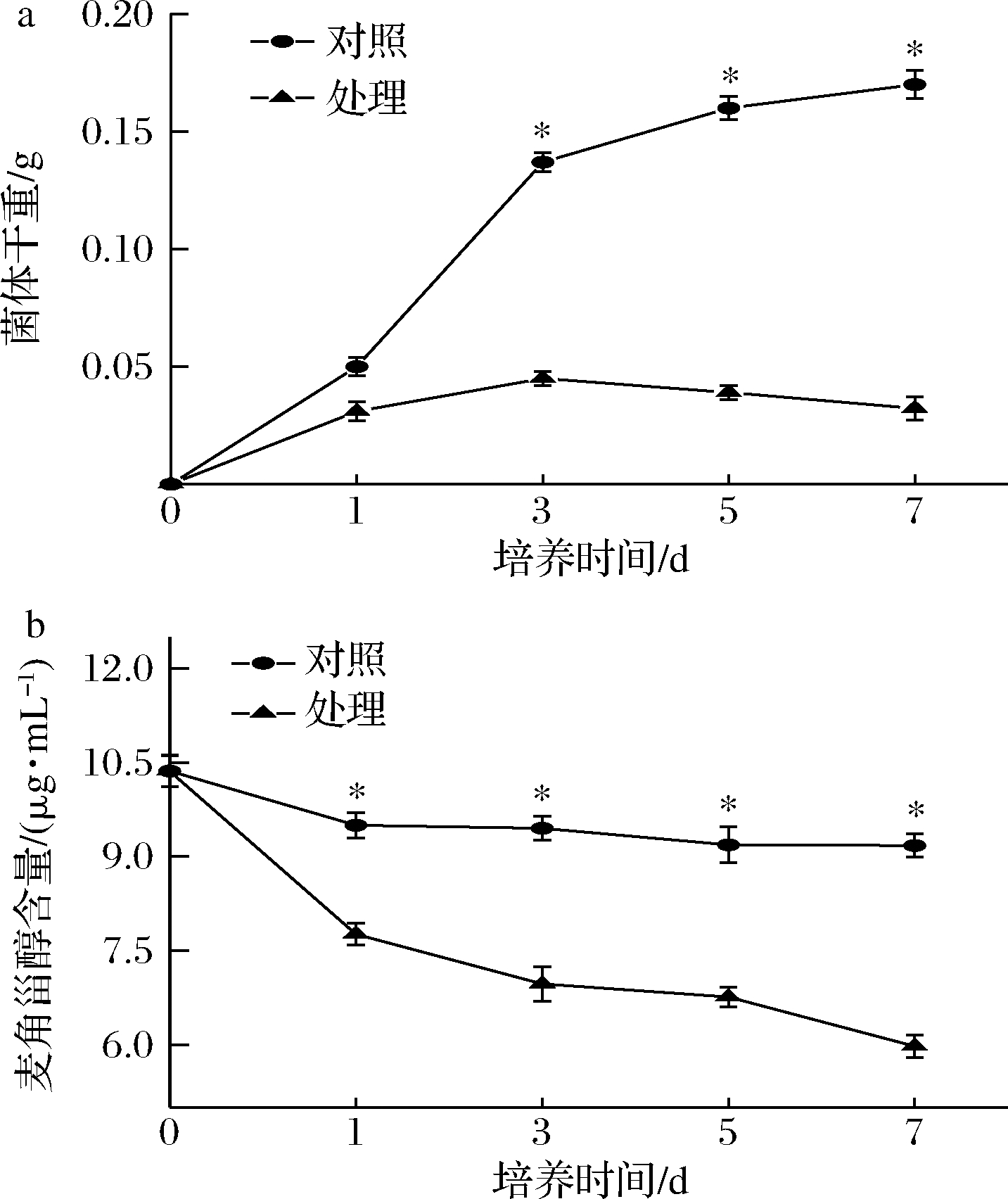
a-T.roseum菌体生物量;b-麦角甾醇含量
图4 抗菌肽P-1处理对T.roseum菌体生物量和麦角甾醇含量的影响
Fig.4 Effects of antifungal peptide P-1 treatment on T.roseum biomass and ergosterol content
注:竖线代表标准偏差(±SD),*代表组内差异显著(P<0.05)(下同)
2.6.1 荧光染料N-苯基-1-萘胺摄取率的测定结果
N-苯基-1-萘胺(N-phenyl-1-naphthylamine,NPN)是一种疏水荧光探针,在水环境中不会发出荧光,但在疏水环境中会发出强烈的荧光[26]。因此可以利用荧光染料NPN来评价抗菌肽P-1通过T.roseum细胞外膜的能力。图5反映了T.roseum胞内荧光NPN摄取率随培养时间的变化情况。结果显示,在整个培养过程中,随着时间的延长,NPN摄取率呈现增强趋势,且在每个时段,处理组的NPN摄取率显著高于对照组(P<0.05)。在第7天时,其高出对照组24%(P<0.05),说明抗菌肽P-1处理可造成T.roseum细胞外膜通透性增大,使NPN与膜上的磷脂分子中的疏水基结合,产生荧光。
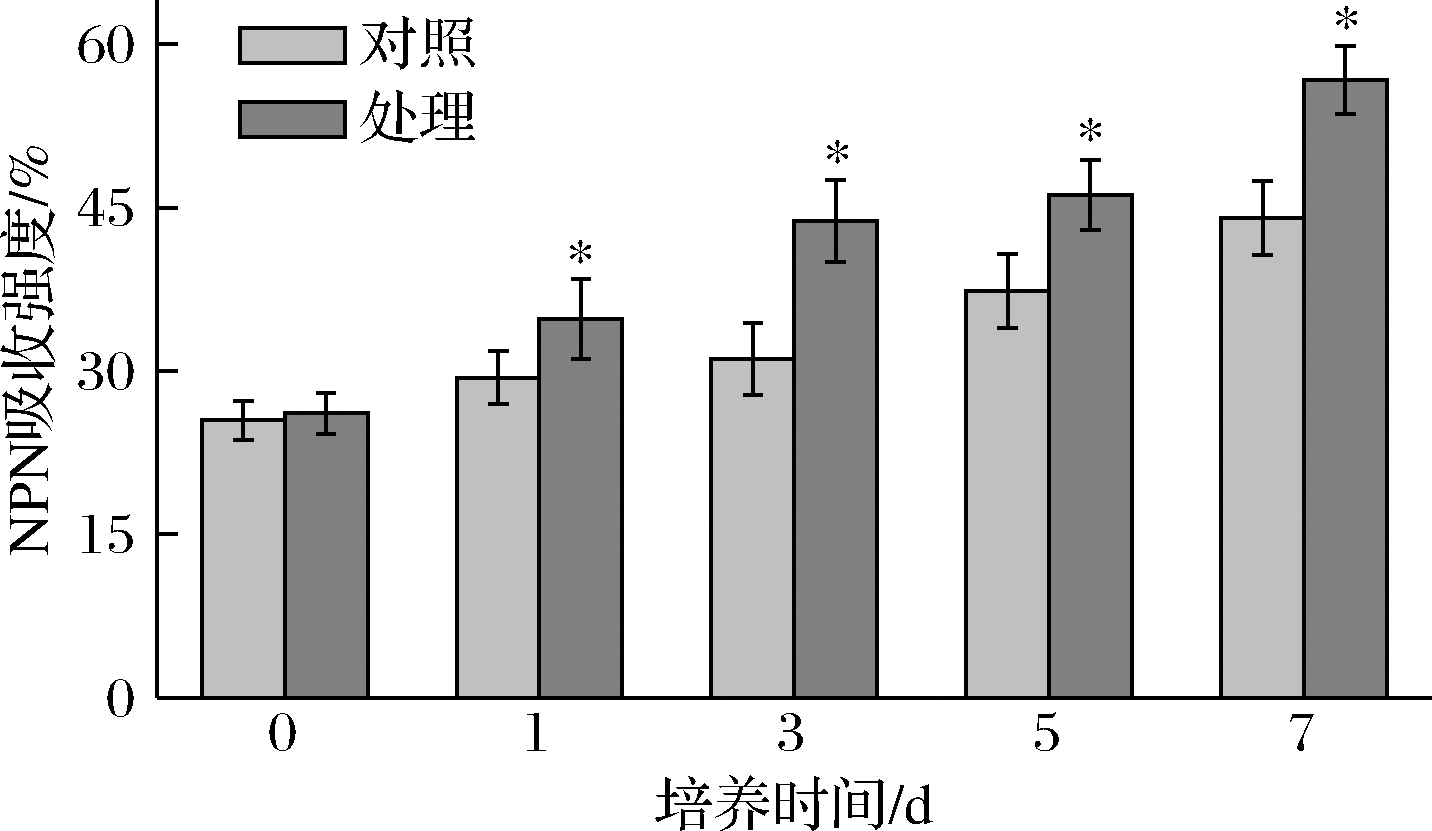
图5 抗菌肽P-1处理对T.roseum菌体NPN荧光吸收强度的影响
Fig.5 Effect of antifungal peptide P-1 treatment on NPN fluorescence absorption intensity of T.roseum cells
2.6.2 电导率测定结果
电导率的变化可反映细胞膜渗透性的改变[27]。图6显示,随着培养时间的增加,处理组菌体细胞相对电导率明显高于对照组,在第7天,比对照组高35%(P<0.05),表明抗菌肽P-1处理使T.roseum细胞膜的渗透性发生改变,导致细胞内外渗透压的调节能力下降,使细胞失水或胀破,从而起到抑菌作用。
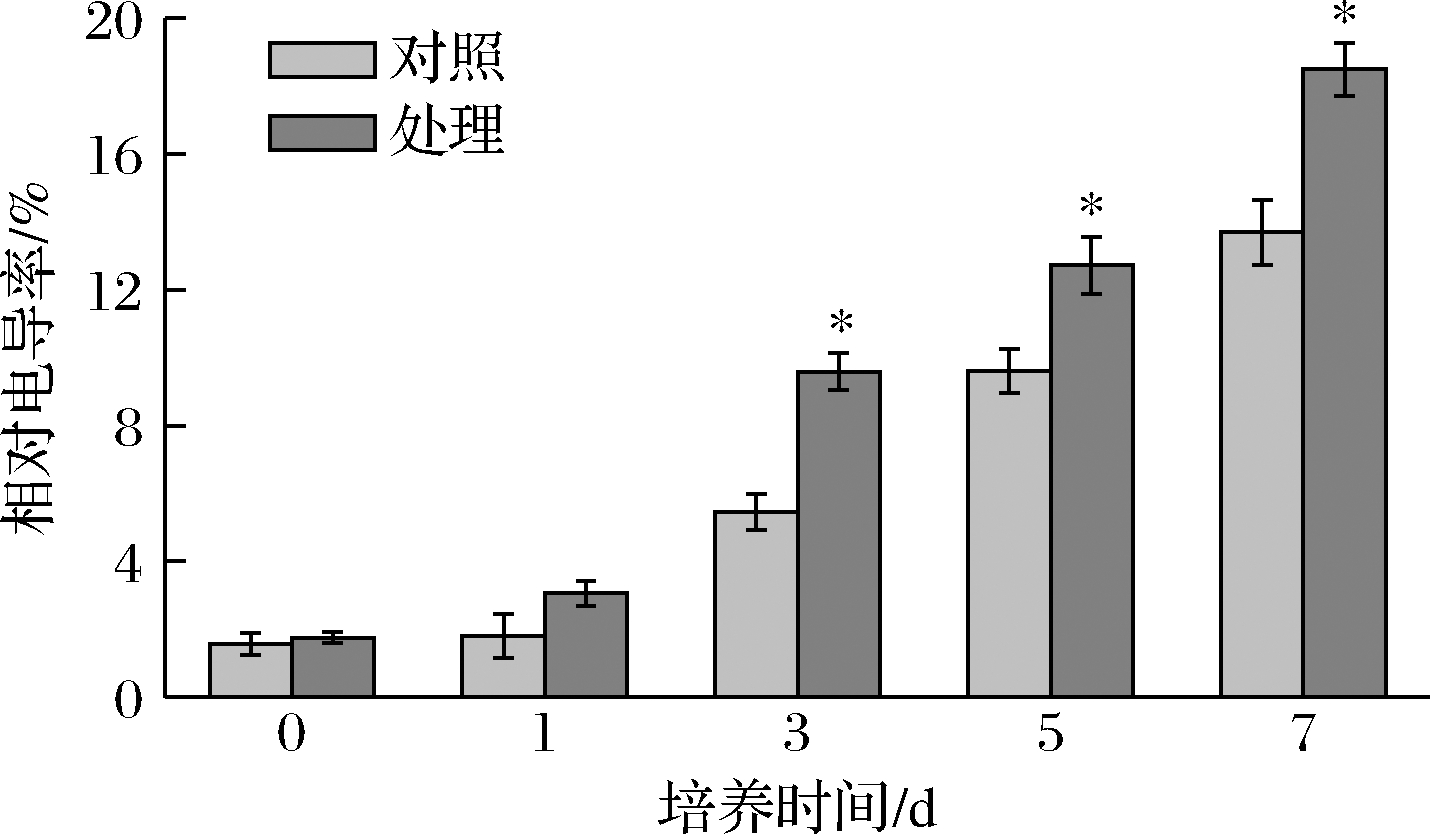
图6 抗菌肽P-1处理对T.roseum菌体相对电导率的影响
Fig.6 Effect of antifungal peptide P-1 treatment on relative conductivity of T.roseum cells
2.7.1 对菌体超氧阴离子自由基![]() 的影响
的影响
ROS是细胞内一类具有较高化学反应活性的氧代谢产物,具有多种存在形式,主要以氧化过程形成的![]() 存在。图7反映了
存在。图7反映了![]() 含量随培养时间的变化情况。结果显示,随着培养时间的延长,其含量呈现上升趋势。且每个时段,处理组的
含量随培养时间的变化情况。结果显示,随着培养时间的延长,其含量呈现上升趋势。且每个时段,处理组的![]() 含量显著高于对照组(P<0.05)。说明P-1处理诱导了胞内ROS的积累。
含量显著高于对照组(P<0.05)。说明P-1处理诱导了胞内ROS的积累。
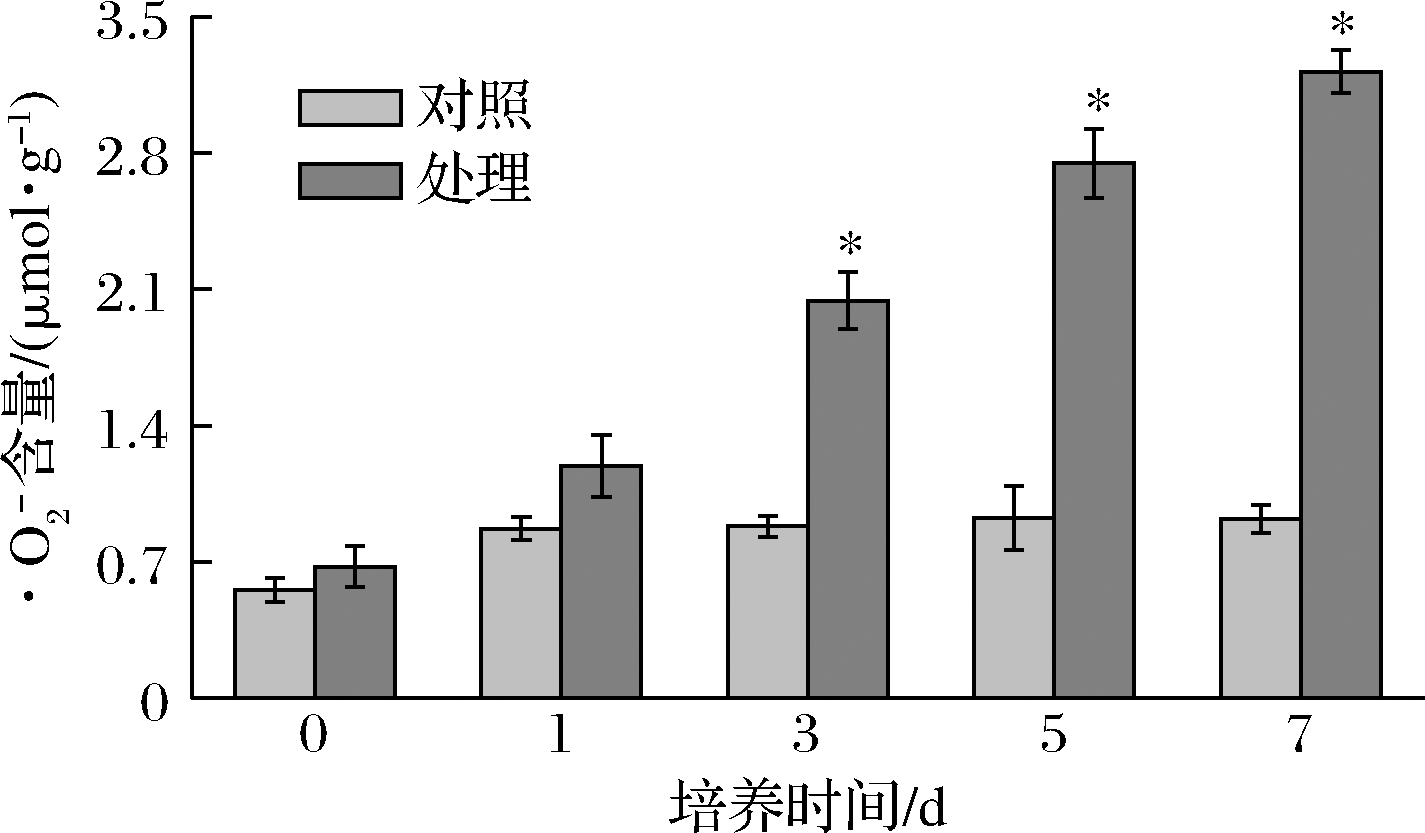
图7 P-1处理对T.roseum菌体![]() 的影响
的影响
Fig.7 Effect of P-1 treatment on superoxide anion of T.roseum
2.7.2 对抗氧化酶系(SOD、CAT、POD)和H2O2含量的影响
图8反映了P-1处理对参与ROS反应的相关抗氧化酶系活力和H2O2含量的影响。随着培养时间的延长,SOD活性呈现下降趋势,第1、3天,处理组的SOD活性都显著低于对照组(P<0.05)(图8-a);CAT活性呈先增大后减小的趋势,处理组的CAT活性显著高于对照(P<0.05)(图8-b);POD整体呈现增大的趋势,且处理组的POD活性显著高于对照组(P<0.05)(图8-c);H2O2含量呈现下降的趋势,且处理组的H2O2的含量显著低于对照组(P<0.05)(图8-d)。结果表明抗菌肽P-1处理加剧了T.roseum胞内的抗氧化程度。
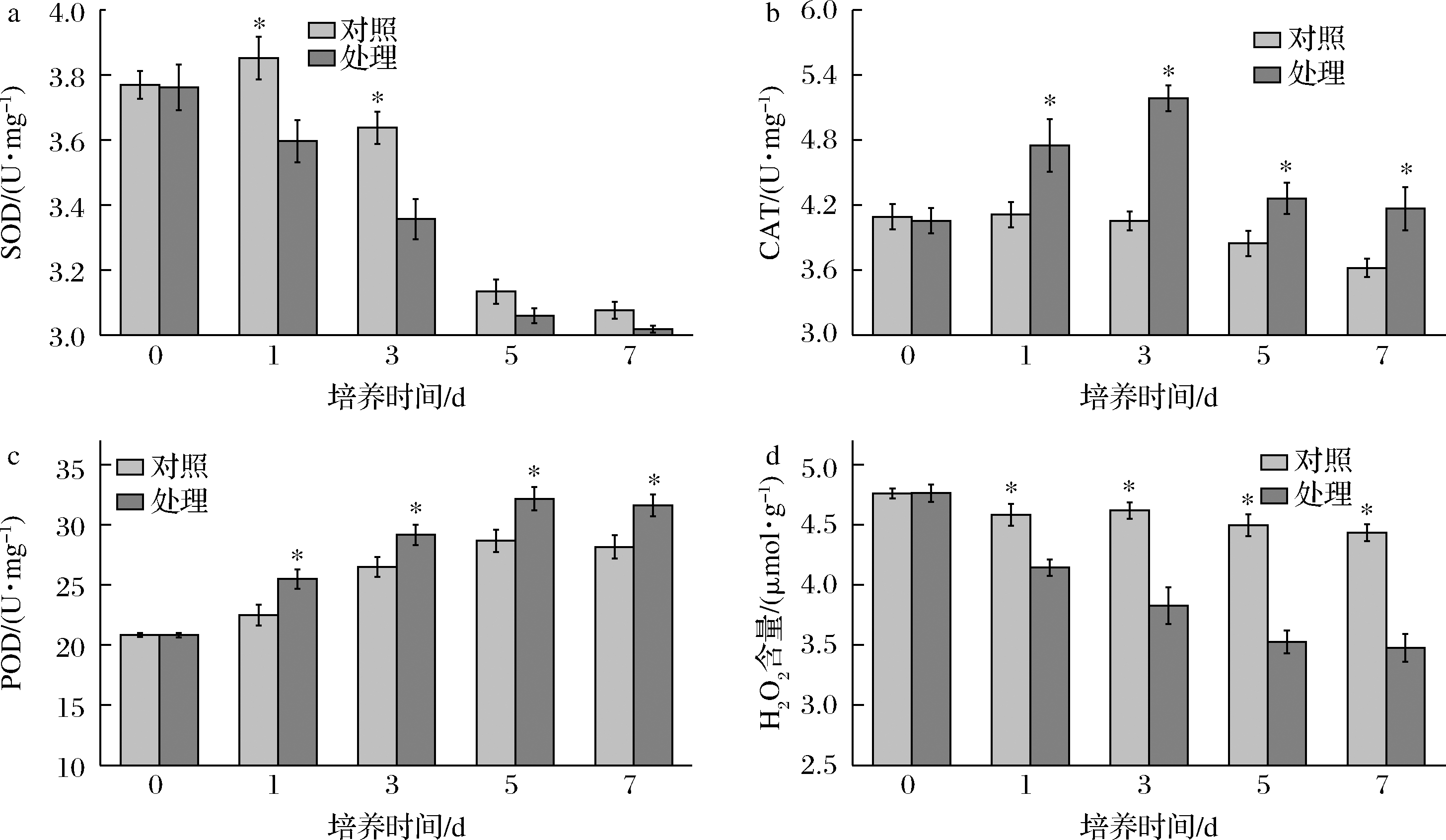
a-SOD活力;b-CAT活力;c-POD活力;d-H2O2含量
图8 抗菌肽P-1处理对T.roseum 菌体SOD活力、CAT活力、POD活力及H2O2含量的影响
Fig.8 Effect of antifungal peptide P-1 on SOD,CAT,POD activity and the content of H2O2 in T.roseum
2.7.3 对脂质过氧化、蛋白羰基化的影响
脂质和蛋白是细胞膜的主要组成部分,由ROS大量积累引起的脂质和蛋白的氧化损伤,可直接影响T.roseum的正常生理活动。由图9可知,随着培养时间的延长,处理组的脂质过氧化值(OD535)高于对照组,第7天时,OD535高于对照组55%(P<0.05)(图9-a);处理组蛋白羰基含量显著高于对照组。第7天时,羰基含量高于对照组71.96%(P<0.05)(图9-b)。上述结果表明抗菌肽P-1处理使T.roseum细胞膜氧化损伤引起的脂质过氧化和蛋白羰基化程度加深。
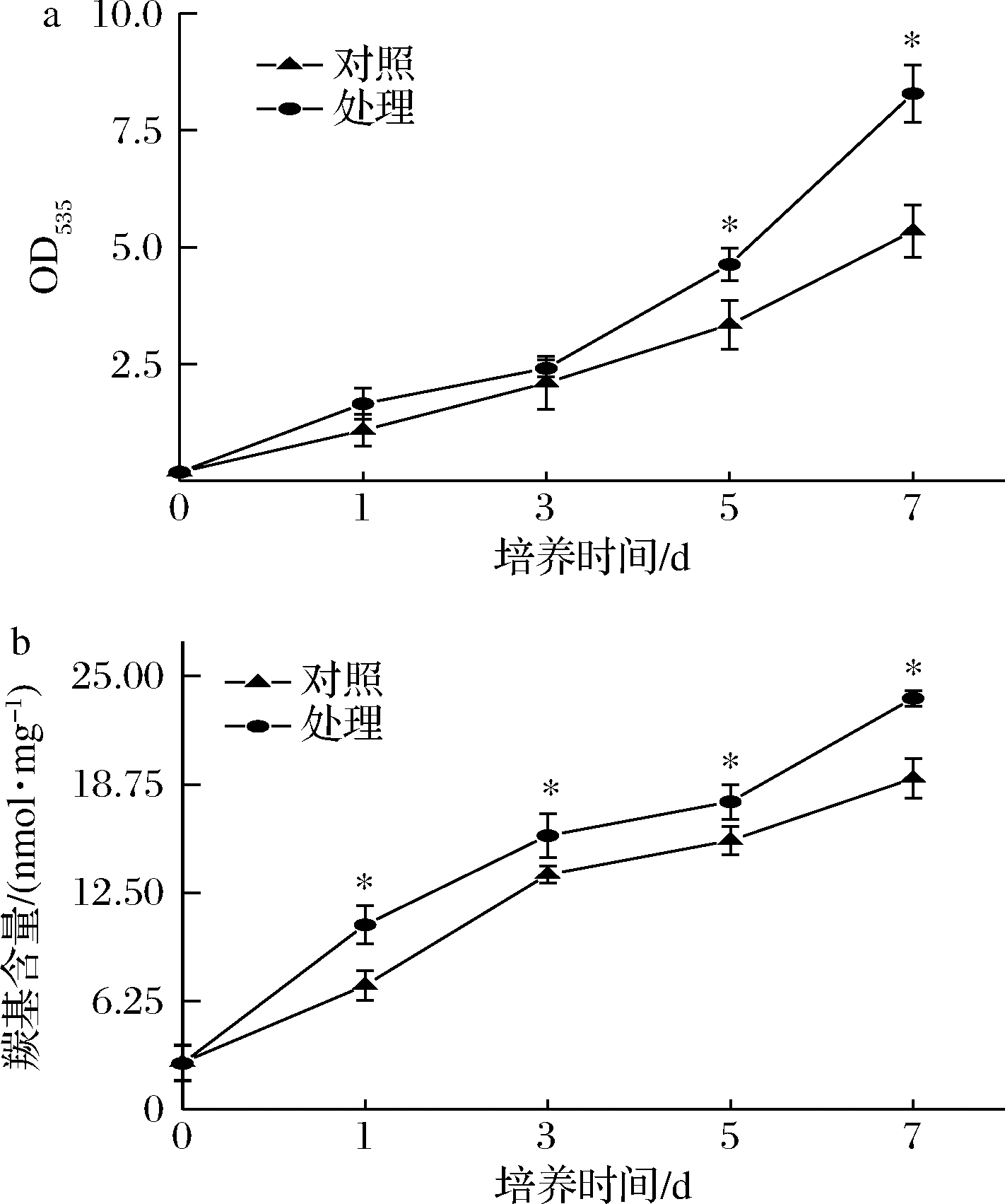
a-T.roseum菌体OD535;b-羰基含量
图9 抗菌肽P-1处理对T.roseum菌体OD535和羰基含量的影响
Fig.9 Effect of P-1 treatment on OD535 and carbonyl content of T.roseum
2.7.4 对MDA含量的影响
MDA是膜脂过氧化作用的主要产物之一,一般利用其含量作为膜脂过氧化的指标,反映细胞膜脂质过氧化的程度[28]。由图10可知,处理组MDA含量显著高于对照组,第7天时,MDA含量比对照组高67.6%(P<0.05)。表明抗菌肽P-1处理使菌体发生膜脂质过氧化反应,引起菌体MDA含量升高,最终导致细胞膜受损。
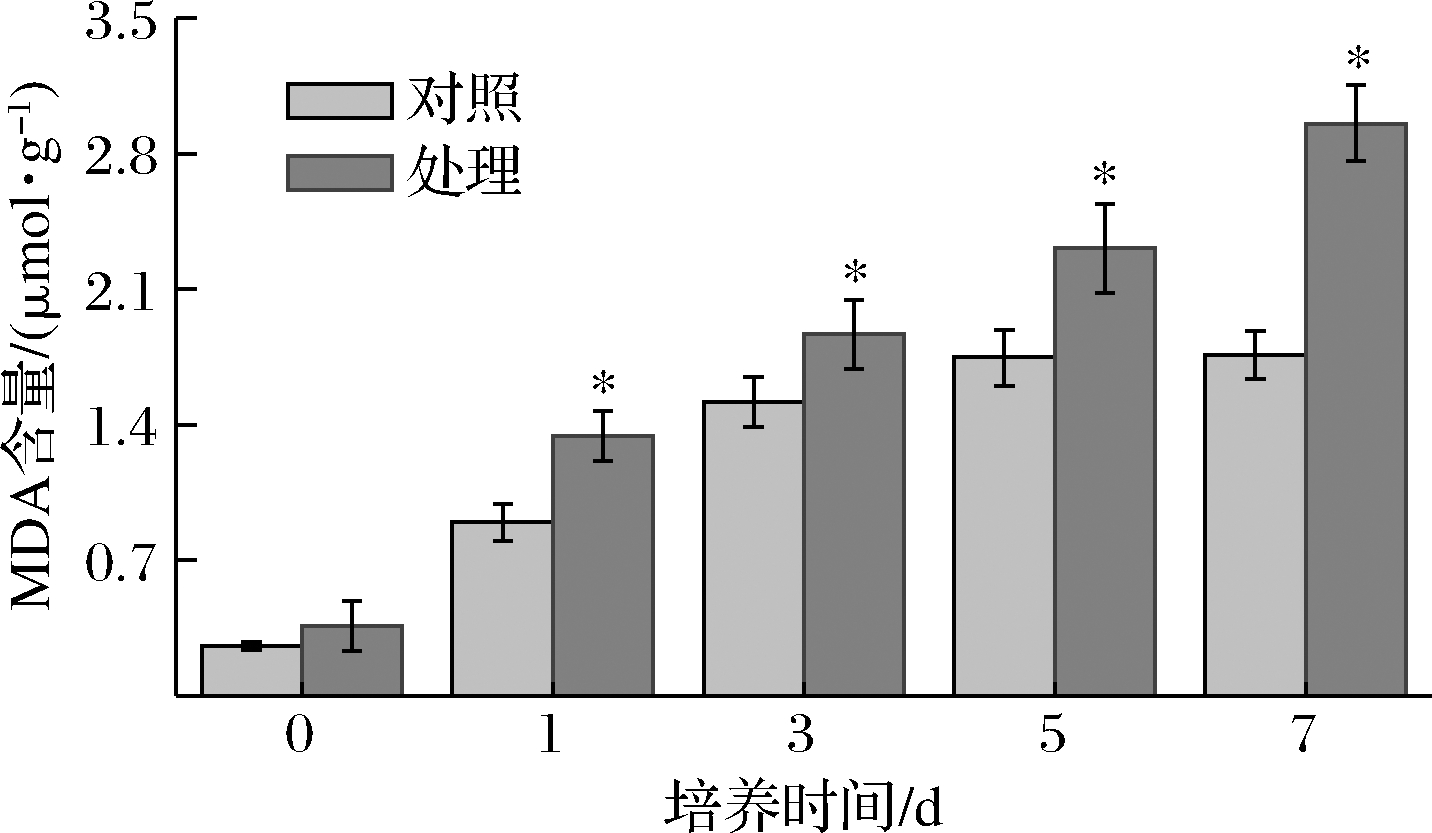
图10 抗菌肽P-1处理对T.roseum菌体MDA含量的影响
Fig.10 Effect of antifungal peptide P-1 treatment on MDA content of T.roseum
本试验从超微结构、细胞膜通透性及ROS代谢3个方面研究了抗菌肽P-1处理对T.roseum有抑菌作用。液体培养结果显示,抗菌肽P-1处理能够明显抑制T.roseum菌体生物量的增加,通过超微观察发现P-1破坏了T.roseum孢子的细胞壁膜、局部出现了缺口、细胞质大量流出,致使孢子的形态发生了剧烈的变化,胞质变得不均匀。这可能是抗菌肽P-1抑制T.roseum菌体生长的主要原因[29]。
细胞膜是主要由磷脂构成的富有弹性的半透性膜,麦角甾醇可以与磷脂结合形成稳定磷脂相,进而增加细胞膜的稳定性[30]。本研究结果显示,抗菌肽P-1处理使T.roseum细胞膜上麦角甾醇含量减少,可能是由于抗菌肽P-1抑制了麦角甾醇的生物合成途径,使膜的结构和完整性受到影响,使NPN这种对细胞外膜敏感性荧光染料透过了细胞外膜,与膜上的磷脂双分子层中的疏水基产生了结合;同时,抗菌肽P-1处理后T.roseum菌体细胞相对电导率的不断增大,进一步证明抗菌肽P-1处理破坏了细胞膜的结构,改变了膜的稳定性。
MDA是由高水平的ROS诱导的,过量的MDA通过与脂质、蛋白质交联而表现出膜损伤,最终导致细胞功能衰退或丧失[31]。本研究结果显示,抗菌肽P-1处理使T.roseum菌体脂质过氧化指标、蛋白羰基含量以及MDA含量增加。说明抗菌肽P-1使菌体发生了膜脂过氧化反应,并且产生了膜脂代谢产物MDA,导致机体内积累了ROS。该情况下机体会通过自身抗氧化酶系使其达到平衡,一旦平衡被破坏,可能导致菌体膜完整性的丧失。正常的细胞过程取决于ROS产生和清除之间的动态平衡,抗氧化酶可以减少ROS的积累。SOD可以将![]() 生成H2O2,CAT和POD降低H2O2含量,使其生成H2O。活性氧的过度产生或抗氧化酶的失效都会干扰这种平衡,导致氧化应激,这被描述为抗菌活性的重要机制[32]。
生成H2O2,CAT和POD降低H2O2含量,使其生成H2O。活性氧的过度产生或抗氧化酶的失效都会干扰这种平衡,导致氧化应激,这被描述为抗菌活性的重要机制[32]。
本研究通过测定抗菌肽P-1处理后T.roseum菌体胞内ROS的含量和抗氧化酶的活性,结果显示,抗菌肽P-1使T.roseum菌体SOD活性降低、CAT活性先增大后减小以及POD活性增大,胞内![]() 含量增加,H2O2含量降低。说明抗菌肽P-1处理使SOD的活性降低导致超氧自由基清除失败,同时,CAT和POD的活性被刺激降低了H2O2水平。尽管H2O2含量降低,但ROS的积累不受影响,因为
含量增加,H2O2含量降低。说明抗菌肽P-1处理使SOD的活性降低导致超氧自由基清除失败,同时,CAT和POD的活性被刺激降低了H2O2水平。尽管H2O2含量降低,但ROS的积累不受影响,因为![]() 是ROS的中心活性氧。因此,可以得出抗菌肽P-1处理使T.roseum菌体ROS过度产生以及抗氧化酶活性的不平衡变化,从而引起超氧自由基的积累,导致细胞膜完整性丧失,菌体生长受到抑制。
是ROS的中心活性氧。因此,可以得出抗菌肽P-1处理使T.roseum菌体ROS过度产生以及抗氧化酶活性的不平衡变化,从而引起超氧自由基的积累,导致细胞膜完整性丧失,菌体生长受到抑制。
本研究从超微结构、膜通透性以及ROS代谢的研究中推测出抗菌肽P-1对粉红单端孢的抑菌机理可能是通过破坏T.roseum菌体膜的完整性,改变膜的通透性,以及诱导ROS在胞内的积累,引起氧化胁迫反应,从而导致细胞膜完整性丧失,菌体生长受到抑制。
[1] 郑鄢燕,赵力卉,王宇滨,等.链格孢、粉红单端孢通过降解果皮细胞壁导致哈密瓜病害[J].食品与发酵工业,2020,46(10):124-131.
ZHENG Y Y,ZHAO L H,WANG Y B,et al.Alternaria alternata and Trichothecium roseum cause disease of Hami melon by degrading the cell wall in the pericarp[J].Food and Fermentation Industries,2020,46(10):124-131.
[2] TANG Y M,XUE H L,BI Y,et al.A method of analysis for T-2 toxin and neosolaniol by UPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J].Food Additives and Contaminants,2015,32(4):480-487.
[3] 赵冠华,牛黎莉,罗荣涛,等.3种抗氧化剂对硅酸钠胁迫下粉红单端孢(Trichothecium roseum)孢子生存能力的保护作用比较研究[J].食品科学,2015,36(17):191-195.
ZHAO G H,NIU L L LUO R T,et al.Comparison of protective effects of three antioxidants on spore viability of Trichothecium roseum under sodium silicate stress[J].Food science,2015,36(17):191-195.
[4] VALLEJO-REYNA M A,SANTAMAR A J M,RODR
A J M,RODR GUEZ-ZAPATA L C,et al.Identification of novel ERF transcription factor genes in papaya and analysis of their expression in different tissues and in response to the plant defense inducer benzothiadiazole(BTH)[J].Physiological & Molecular Plant Pathology,2015,91(1):141-151.
GUEZ-ZAPATA L C,et al.Identification of novel ERF transcription factor genes in papaya and analysis of their expression in different tissues and in response to the plant defense inducer benzothiadiazole(BTH)[J].Physiological & Molecular Plant Pathology,2015,91(1):141-151.
[5] 白小东,牛黎莉,毕阳,等.18种盐对苹果霉心病的控制及部分机理[J].食品工业科技,2015,36(10):335-338.
BAI X D,NIU L L,BI Y,et al.18 kinds of salt on apple of core rot control and part of the mechanism[J].Science and Technology of Food Industry,2015,36(10):335-338.
[6] 王为栋,孙海娟.抗菌肽生物活性及其作用机理研究进展[J].当代畜牧,2018(33):32-34.
WANG W D,SUN H J.Research progress on antimicrobial peptides bioactivity and its mechanism[J].Contemporary Animal Husbandry,2018(33):32-34.
[7] 王亚平,余维维,秦梦茹,等.抗菌肽的作用机理及应用[J].湖北农业科学,2018,57(5):9-13;70.
WANG Y P,YU W W,QIN M R,et al.Antibacterial mechanism and application of antimicrobial peptides[J].Hubei Agricultural Sciences,2018,57(5):9-13;70.
[8] 黄玉琴,贠建民,张紊玮,等.Bacillus pumilus HN-10对Trichothecium roseum的拮抗作用及菌体结构的影响[J].食品与生物技术学报,2019,38(6):25-33.
HUANG Y Q,YUN J M,ZHANG W W,et al.Effect of Bacillus pumilus HN-10 on antagonistic activity and cell structure of Trichothecium roseum[J].Journal of Food Science and Biotechnology,2019,38(6):25-33.
[9] 严海娇,贠建民,白杰,等.短小芽孢杆菌HN-10抗菌肽的分离纯化及其抗粉红单端孢活性[J].食品科学,2018,39(22):123-128.
YAN H J,YUN J M,BAI J,et al.Purification of an antimicrobial peptide from Bacillus pumilus HN-10 and its inhibitory activity against Trichothecium roseum[J].Food science,2018,39(22):123-128.
[10] YAN H J,YUN J M,AI D Y,et al.Two novel cationic antifungal peptides isolated from Bacillus pumilus HN-10 and their inhibitory activity against Trichothecium roseum[J].World Journal of Microbiology and Biotechnology,2018,34(2):1-10.
[11] 郭娟,贠建民,邓展瑞,等.Bacillus pumilus HN-10抗菌肽P-1对粉红单端孢的抑菌机理[J].食品科学,2019,40(19):17-22.
GUO J,YUN J M,DENG Z R,et al.Antimicrobial mechanism of antimicrobial peptide P-1 from Bacillus pumilus HN-10 against Trichothecium roseum[J].Food Science,2019,40(19):17-22.
[12] 刘志恬,董玉鹏,李永才,等.ε-聚赖氨酸对梨果实黑斑病菌Alternaria alternata的抑制作用及其机理[J].食品科学,2021,42(11):213-220.
LIU Z T,DONG Y P,LI Y C,et al.Antifungal effect of ε-polylysine on Alternaria alternata isolated from pears with black spot and its possible mechanism[J].Food Science,2021,42(11):213-220.
[13] WANG L T,WU H,QIN G Z,et al.Chitosan disrupts Penicillium expansum and controls postharvest blue mold of jujube fruit[J].Food Control,2014,41:56-62.
[14] HELAL G A,SARHAN M M,ABU SHAHLA A N K,et al.Effects of Cymbopogon citratus L.essential oil on the growth,morphogenesis and aflatoxin production of Aspergillus flavus ML2-strain[J].Journal of Basic Microbiology,2007,47(1):5-15.
[15] LIU Y,ZHU X Q,LI W D,et al.Enhancing production of ergosterol in Pichia pastoris GS115 by over-expression of 3-hydroxy-3-methylglutaryl CoA reductase from Glycyrrhiza uralensis[J].Acta Pharmaceutica Sinica B,2014,4(2):161-166.
[16] 付永岩,李盈盈,姜瞻梅,等.牛乳铁蛋白衍生肽FP-PF的安全性及其抑菌机理[J].中国食品学报,2020,20(8):92-99.
FU Y Y,LI Y Y,JIANG Z M,et al.Safety and antibacterial mechanism of bovine lactoferrin derived peptide FP-PF[J].Journal of Chinese Institute of Food Science and Technology,2020,20(8):92-99.
[17] 王雪燕,陈瑛,张嘉敏,等.草鱼鱼鳞抗菌肽与肉桂精油联合抑菌作用及机理[J].食品科学,2020,41(23):100-106.
WANG X Y,CHEN Y,ZHANG J M,et al.Combined antimicrobial effect and mechanism of antimicrobial peptide from grass carp scale and cinnamon essential oil[J].Food Science,2020,41(23):100-106.
[18] PUSHPANATHAN M,GUNASEKARAN P,RAJENDHRAN J.Mechanisms of the antifungal action of marine metagenome-derived peptide,MMGP1,against Candida albicans[J].PLoS One,2013,8(7):e69316.
[19] 段丽菊,刘英帅,朱燕,等.DNPH比色法:一种简单的蛋白质羰基含量测定方法[J].毒理学杂志,2005,19(4):320-322.
DUAN L J,LIU Y S,ZHU Y,et al.DNPH colorimetry:A simple method for the determination of protein carbonyl content[J].Journal of Toxicology,2005,19(4):320-322.
[20] 王霆,张雨,刘宏,等.臭氧熏蒸处理联合PE包装对金针菇采后贮藏品质及抗氧化能力的影响[J].中国农业科学,2020,53(4):823-835.
WANG T,ZHANG Y,LIU H,et al.Effects of ozone fumigation combined with PE packaging on postharvest storage quality and antioxidant capacity of Flammulina velutipes[J].Scientia Agricultura Sinica,2020,53(4):823-835.
[21] 王新绘,孙九丽,苟萍.灰葡萄孢菌AUR1基因内含子对肌醇磷脂酰神经酰胺合成酶表达的影响及致病性[J].微生物学报,2014,54(11):1 304-1 310.
WANG X H,SUN J L,GOU P.Effect of AUR1 gene intron on the expression of inositol phosphorylceramide synthase and pathogenicity in Botrytis cinerea[J].Acta Microbiologica Sinica,2014,54(11):1 304-1 310.
[22] 燕璐.体外条件下柠檬酸处理对T.roseum的抑制及部分机理[D].兰州:甘肃农业大学,2015.
YAN L.Citric acid inhibits against Trichothecium roseum in vitro and its partial mechanism[D].Lanzhou:Gansu Agricultural University,2015.
[23] 谢栋,彭憬,王津红,等.枯草芽孢杆菌抗菌蛋白X998-III的纯化与性质[J].微生物学报,1998,38(1):13-19.
XIE D,PENG J,WANG J H,et al.Purification and properties of antifungal protein X998-III from Bacillus subtilis[J].Acta Microbiologica Sinica,1998,38(1):13-19.
[24] ALIZADEH F,KHODAVANDI A,ZALAKIAN S.Quantitation of ergosterol content and gene expression profile of ERG11 gene in fluconazole-resistant Candida albicans[J].Current Medical Mycology,2017,3(1):13-19.
[25] HU C C,ZHOU M,WANG W Z,et al.Abnormal ergosterol biosynthesis activates transcriptional responses to antifungal azoles[J].Frontiers in Microbiology,2018,9:9.
[26] MA Q Q,DONG N,SHAN A S,et al.Biochemical property and membrane-peptide interactions of de novo antimicrobial peptides designed by helix-forming units[J].Amino Acids,2012,43(6):2 527-2 536.
[27] 陈惠,赵鑫荟,艾启俊.3种中草药对沙门氏菌的抑制机理初探[J].安徽农业科学,2013,41(25):10 275-10 277.
CHEN H,ZHAO X H,AI Q J.Study on inhibitory mechanism of three Chinese herbals against Salmonella[J].Journal of Anhui Agricultural Sciences,2013,41(25):10 275-10 277.
[28] TSIKAS D.Assessment of lipid peroxidation by measuring malondialdehyde(MDA) and relatives in biological samples:Analytical and biological challenges[J].Analytical Biochemistry,2017,524:13-30.
[29] SHREAZ S,WANI W A,BEHBEHANI J M,et al.Cinnamaldehyde and its derivatives,a novel class of antifungal agents[J].Fitoterapia,2016,112:116-131.
[30] LI Y,ZHANG W,NIU J F,et al.Mechanism of photogenerated reactive oxygen species and correlation with the antibacterial properties of engineered metal-oxide nanoparticles[J].ACS Nano,2012,6(6):5 164-5 173.
[31] YANG Q,WANG J,ZHANG P,et al.In vitro and in vivo antifungal activity and preliminary mechanism of cembratrien-diols against Botrytis cinerea[J].Industrial Crops and Products,2020,154:112745.
[32] SIMAS D L R,DE AMORIM S H B M,GOULART F R V,et al.Citrus species essential oils and their components can inhibit or stimulate fungal growth in fruit[J].Industrial Crops and Products,2017,98:108-115.