我国是“素中之荤”黑木耳的故乡,中华民族早在4 000多年前的神农氏时代便开始栽培并食用黑木耳,《礼记》中也有关于帝王宴会上食用黑木耳的记载。目前,我国黑木耳年产量占世界总产量的90%以上,以东北黑木耳尤为知名,仅黑龙江省东宁县黑木耳的产量就高达全国产量的20%[1]。黑木耳性平、味甘,可食、可药、可补,《本草纲目》中记载“益气不饥,轻身强志,断谷治痔”[2-3]。多糖是黑木耳子实体中重要的活性成分,具有抗氧化、抗凝血、免疫调节、抗疲劳、调节糖脂代谢等活性[4-6]。“小木耳,大产业”,陕西秦巴山区森林茂密、光照充足、气候湿润、夏秋昼夜温差大,也具有适合黑木耳生长的条件[7-8]。然而,关于西北秦巴山区黑木耳多糖资源的研究及其开发利用鲜有报道。
活性物质的结构决定其功能,不同的提取方法往往会影响天然多糖的产量、结构特性和生物活性[9-11]。水提法是提取多糖的最为传统的方法,成本低廉、操作简单,且可以保持多糖的完整结构,但提取过程繁琐耗时[12]。超声波可以破坏植物细胞壁的结构,加速多糖从细胞中溶出,但长时间可能导致多糖糖苷键断裂[13]。酶解提取法反应条件温和、杂质容易分离、得率高,但酶的活性受温度和pH的影响较大,且酶制剂成本较高,难以大规模应用[14]。LI等[15]发现酶法提取东北黑木耳多糖的得率显著大于水提和超声提取。BIAN等[16]以黑龙江伊春来源的黑木耳为研究材料,采用超声辅助提取出具有较好抗凝血活性的黑木耳酸性多糖,主要由甘露糖、葡萄糖醛酸、葡萄糖、半乳糖和木糖组成,摩尔比为80.63∶9.88∶2.25∶1∶31.13。另有研究表明,与低分子质量(<10 kDa)黑木耳多糖相比较,高分子质量(10~50 kDa 或>100 kDa)的黑木耳多糖具有更强的免疫刺激作用[17]。
基于此,本实验比较了西北秦巴山区及东北黑龙江黑木耳多糖的理化性质及抗氧化活性差异,并分别采用热水提取、酶法提取和超声提取3种方法从秦巴山区黑木耳中提取黑木耳粗多糖,考察不同提取方法对其糖含量、糖醛酸含量、分子质量、单糖组成等理化性质的影响,并通过检测Fe2+螯合能力、还原力和过氧化氢(hydrogen peroxide,H2O2)清除能力比较其体外抗氧化活性,以期为黑木耳多糖构效关系研究奠定理论基础,并为西北秦巴山区特色资源黑木耳的合理开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
西北黑木耳,陕西天美绿色产业有限公司,产地为西北秦巴山区;东北黑木耳,厦门绿帝生态股份有限公司,产地为黑龙江省牡丹江市。
纤维素酶、果胶酶、木瓜蛋白酶,美国Sigma-Aldrich公司;标准单糖及葡聚糖标准品,美国Fluka公司;无水乙醇、正丁醇、二氯甲烷、葡萄糖、苯酚、浓硫酸、鸡白蛋白、考马斯亮蓝G250、磷酸、糖醛酸、咔唑、冰醋酸、甲醇、乙酸酐、吡啶、三氟乙酸、硼氢化钠、碳酸钠、磷酸二氢钠、磷酸氢二钠、菲啰嗪、铁氰化钾、三氯化铁、30% H2O2溶液等,天津大茂有限公司。
1.2 主要设备
KQ-500DE型数字超声波清洗器,昆山市超声仪器有限公司;HC—2518型高速离心机,安徽中科中佳科学仪器有限公司;GL-21M型高速冷冻离心机,上海卢湘仪离心机仪器有限公司;UV-1000型紫外分光光度计,翱艺有限公司;GC-2010型气相色谱仪、LC-2010A高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 黑木耳多糖的提取
样品预处理:将不同产地黑木耳子实体分别用蒸馏水洗净,60 ℃烘箱风干,粉碎机碾碎,40目过筛,存储在4 ℃待用。
水溶性多糖的提取:分别称取30 g黑木耳粉状样品按照料液比(g∶mL)1∶50加入蒸馏水,一份用100 ℃水提取2次,每次2 h;一份浸泡30 min后,加入1.75%复合酶(果胶酶与纤维素酶质量比为1∶1于pH 5.0时50 ℃水浴80 min后加入2%木瓜蛋白酶,于pH 6.0时60 ℃水浴60 min;另一份在75 ℃水浴45 min后,于功率为100 W、温度为65 ℃的条件下超声15 min。将溶液于10 000 r/min下离心10 min,取上清液浓缩。浓缩后按1∶4体积比加入无水乙醇,醇沉12 h。
除蛋白、除小分子杂质:将醇沉12 h后的样品于10 000 r/min 离心10 min,去上清液,留取滤渣,溶于水中,待充分溶解后,用Sevage法除蛋白。配制V(二氯甲烷)∶V(正丁醇)=4∶1的混合溶液,加入Sevage试剂,搅拌20 min,使蛋白质充分反应变性后沉淀出来,10 000 r/min离心10 min。取上清液,弃去沉淀层和有机层,重复4~5次。采用分子截流量为3 000 Da的玻璃纸在流动的自来水中透析3 d,浓缩、冷冻干燥、最后称量装袋,获得黑木耳粗多糖样品。
1.3.2 黑木耳多糖理化性质测定
参照本课题组已有方法[18-19],采用苯酚-硫酸法测定样品中糖含量,考马斯亮蓝法测定蛋白含量,硫酸-咔唑法测定多糖样品中的糖醛酸含量。
采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)检测多糖样品平均分子质量[20]。用磷酸盐缓冲液(0.02 mol/L,pH 6.0)将多糖标准品(1、5、12、15、50、80、150、270 kDa)及黑木耳多糖样品均配制为质量浓度2.0 mg/mL的溶液。10 000 r/min 离心10 min除杂,取上清液待测。采用LC-2010A高效液相色谱仪,TSK-Gel G4000PWxL色谱柱,示差折光检测器,流速设定为0.3 mL/min,进样体积为20 μL。以出峰时间-分子质量的对数值绘制标准曲线,并通过标准曲线的回归方程计算多糖分子质量。
根据DENG等[20]的方法对黑木耳粗多糖样品进行单糖组成分析。将粗多糖样品经酸水解、还原乙酰化后得到糖醇乙酸酯衍生物,用气相色谱仪进行检测。Rtx-50毛细管柱(30.0 m×0.25 mm×0.25 μm),FID检测器,在压力为110 kPa条件下以N2和空气作为载气,流速为0.88 mL/min,分流比为19∶1。程序升温条件:180 ℃保持2 min后,依次以6 ℃/min的速率升温至210 ℃,0.3 ℃/min的速率升温至215 ℃,6 ℃/min的速率升温至240 ℃;当温度升至240 ℃后保持30 min。
1.3.3 黑木耳多糖体外抗氧化活性测定
将黑木耳多糖配制成不同浓度溶液,参照KIM等[21]、李有媛等[22]的方法,测定不同黑木耳多糖样品的还原力;参照李珊等[23]的方法,测定不同黑木耳多糖样品的Fe2+金属螯合力;参照DING等[24]的方法,测定不同黑木耳多糖样品对H2O2的清除能力。
1.3.4 数据处理与分析
所有实验结果均重复3次以上,且表示为平均值±标准差![]() 采用 SPSS 18.0统计学软件对数据进行单因素方差统计分析,不同字母标注表示具有显著差异(P<0.05)。
采用 SPSS 18.0统计学软件对数据进行单因素方差统计分析,不同字母标注表示具有显著差异(P<0.05)。
2 结果与分析
2.1 西北秦巴山区黑木耳多糖的提取及理化性质表征
经沸水提取、浓缩、醇沉、脱蛋白及透析冻干后得到西北秦巴山区黑木耳粗多糖样品和对照东北牡丹江黑木耳粗多糖样品,2组样品均为灰褐色蓬松絮状物。秦巴山区黑木耳粗多糖提取率为5.33%,牡丹江黑木耳粗多糖提取率为5.41%,无明显差异。
如表1所示,西北秦巴山区黑木耳粗多糖与对照组东北牡丹江黑龙江黑木耳粗多糖糖含量分别为(53.15±4.52)%、(60.98±3.25)%,无显著性差异(P>0.05)。秦巴山区黑木耳粗多糖糖醛酸含量为(11.04±0.59)%,东北黑木耳粗多糖糖醛酸含量为(10.54±0.68)%,无显著性差异(P>0.05);而秦巴山区黑木耳多糖中蛋白含量为(1.45±0.12)%,显著低于东北黑木耳多糖蛋白含量(P<0.05)。产地不同黑木耳多糖中结合蛋白含量有显著性差异,可能是由于地区温度、湿度等环境因素所致,东北地区属温带大陆季风气候,有着特殊的地貌及湿润的气候环境,适宜黑木耳生长和蛋白质的积累[25]。
表1 秦巴山区黑木耳多糖糖含量、蛋白含量及糖醛酸含量 单位:%
Table 1 Sugar protein and uronic acid content of Auricularia auricula polysaccharide from Qinba Mountain

含量秦巴山区对照(东北牡丹江)糖53.15±4.52a60.98±3.25a蛋白1.45±0.12b3.09±0.07a糖醛酸11.04±0.59a10.54±0.68a
由图1和表2可知,水提西北秦巴山区黑木耳粗多糖和水提东北牡丹江黑木耳粗多糖单糖组成基本相同,主要由甘露糖、葡萄糖醛酸、木糖和葡萄糖组成,且各组分比例相似,以甘露糖和葡萄糖醛酸含量较多,甘露糖含量约是葡萄糖醛酸含量的3倍。

单糖标准:1~9分别代表鼠李糖(Rha)、岩藻糖(Fuc)、阿拉伯糖(Ara)、
木糖(Xyl)、甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)、
葡萄糖醛酸(GlcA)和半乳糖醛酸(GalA)(下同)
图1 西北秦巴山区黑木耳多糖的单糖组成气相色谱图
Fig.1 Monosaccharide composition GC chromatogram of A.auricula polysaccharides from northwest Qinba mountain
表2 西北秦巴山区黑木耳多糖单糖组成相对摩尔百分比 单位:%
Table 2 Monosaccharide composition of the A.auricula polysaccharides from northwest Qinba Mountain
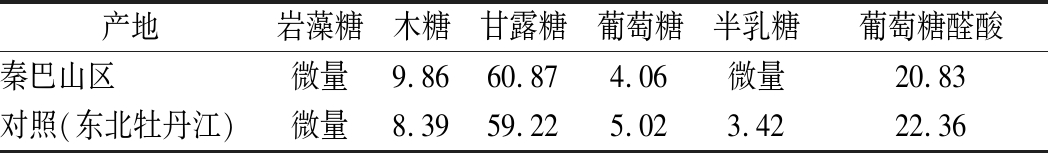
产地岩藻糖木糖甘露糖葡萄糖半乳糖葡萄糖醛酸秦巴山区微量9.8660.874.06微量20.83对照(东北牡丹江)微量8.3959.225.023.4222.36
2.2 秦巴山区黑木耳多糖体外抗氧化活性
样品的还原力大小即反映样品的总抗氧化能力的强弱。还原剂可以将铁氰化物中的三价铁离子还原成亚铁离子,反应混合物从黄色逐渐变为绿色和蓝色,吸光度越高表示还原能力越强。西北秦巴山区黑木耳多糖的还原能力如图2-a所示,在实验浓度范围内,西北秦巴山区黑木耳多糖和对照东北牡丹江黑木耳多糖均有较强的还原力,且呈剂量依赖关系。低浓度(0.625~1.25 mg/mL)时,西北黑木耳粗多糖反应混合物在700 nm时的吸光度显著高于东北黑木耳粗多糖(P<0.05);当浓度>2.5 mg/mL时,东北黑木耳粗多糖还原力与西北黑木耳粗多糖还原力无显著性差异(P>0.05)。
Fe2+极易催化脂质、蛋白质氧化,引起细胞损伤,因此金属螯合能力越强,抗氧化能力越好。Fe2+与菲啰嗪形成有色化合物,该化合物在562 nm处有最大光吸收。样品溶液与Fe2+螯合后,其吸光度降低越多,表明它的抗氧化活性越高。由图2-b可知,在实验浓度范围内,不同产地黑木耳多糖均有良好的Fe2+金属螯合能力。低浓度(0.3125~0.625 mg/mL)时,西北秦巴山区黑木耳多糖螯合能力为4.42%~4.43%,显著强于东北黑木耳多糖螯合能力(2.75%~3.14%)(P<0.05);当质量浓度为1.25~5 mg/mL时,西北秦巴山区黑木耳多糖和东北牡丹江黑木耳多糖螯合能力无显著性差异(P>0.05);在质量浓度为10 mg/mL时,对照东北黑木耳表现出比西北秦巴山区黑木耳更强的金属螯合能力(P<0.05),两者分别为58.14%和39.53%。
生物体处于氧化和抗氧化应激平衡中,过多的自由基会攻击蛋白质、脂质、DNA等生物大分子,与阿尔兹海默病、糖尿病、心血管疾病等的发生和发展密切相关[26-27]。如图2-c所示,西北秦巴山区黑木耳多糖和对照东北黑木耳多糖在实验浓度范围内均可以显著清除H2O2,且呈现浓度依赖性。在低浓度范围内(≤1 mg/mL)时,西北秦巴山区黑木耳多糖和东北黑木耳多糖的清除能力无显著性差异(P>0.05)。当浓度≥1.25 mg/mL时,东北黑木耳多糖清除H2O2能力显著强于西北秦巴山区黑木耳多糖(P<0.05)。
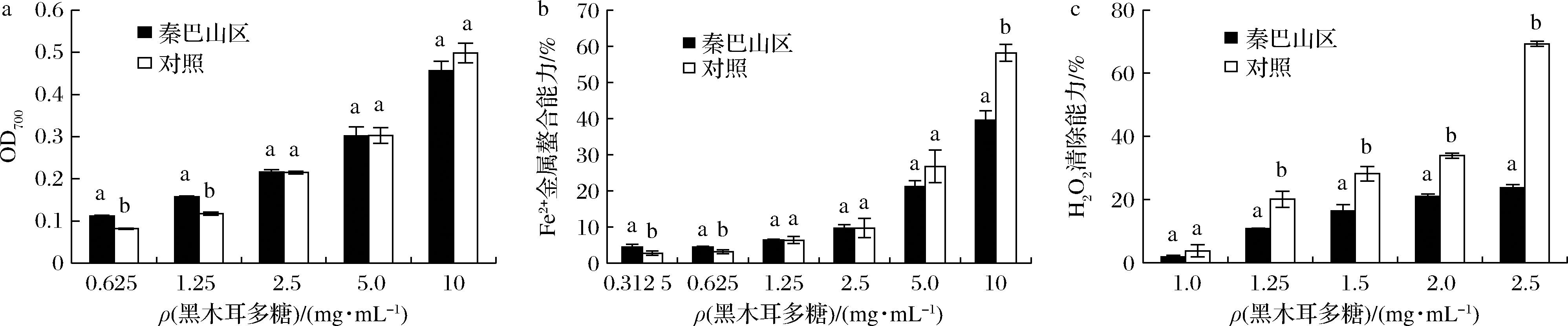
a-还原力;b-Fe2+金属螯合能力;c-H2O2清除能力
图2 秦巴山区黑木耳多糖体外抗氧化活性
Fig.2 Antioxidant activities of A.auricula polysaccharides from northwest Qinba Mountain
活性物质的结构决定其功能,在较高浓度时,东北黑木耳多糖的抗氧化能力强于西北黑木耳多糖,可能是由于东北黑木耳多糖具有较高的结合蛋白和半乳糖能力;两产地黑木耳多糖结构解析及构效关系尚有待进一步分析研究。
2.3 不同提取方式对西北秦巴山区黑木耳多糖理化性质的影响
采用不同方法提取得到的植物多糖混合物可能具有不同组分并具有不同生物活性。西北秦巴山区黑木耳分别经热水提取、酶法提取、超声提取,冻干所得黑木耳多糖均呈灰褐色絮状,得率分别为5.40%、3.73%和3.00%。
不同提取方式对秦巴山区黑木耳多糖糖含量、蛋白含量及糖醛酸含量的影响如表3所示。酶法提取与超声提取得到的黑木耳粗多糖的总糖含量分别为(64.50±4.52)%、(66.18±2.62)%,两者间无明显差异,且均显著高于热水提取法(P<0.05)。与总糖含量结果类似,热水提取法制得的黑木耳粗多糖蛋白含量最低,酶法提取与超声提取得到的黑木耳粗多糖的蛋白含量分别为热水提取法的3.02倍、2.98倍。
表3 不同提取方式对秦巴山区黑木耳多糖糖含量、蛋白含量及糖醛酸含量的影响 单位:%
Table 3 Sugar protein and uronic acid content of Qinba Mountain A.auricula polysaccharides extracted by different methods

含量热水提取酶法提取超声提取糖60.33±4.35a64.50±4.52b66.18±2.62b蛋白1.43±0.12a4.33±0.19b4.27±0.03b糖醛酸11.16±0.59a8.33±0.24b9.46±0.58c
3种方法所得黑木耳粗多糖糖醛酸含量均具有显著性差异(P<0.05),糖醛酸含量排序依次为:热水提取>超声提取>酶法提取。
由图3可知,3种方法制得的黑木耳粗多糖的HPGPC图谱峰形无对称性,即制得的黑木耳粗多糖均为非均一性多糖,且分子质量均>270 kDa,其中超声提取制得的多糖组分分子质量段范围更窄,热水提取的多糖组分有3个显著的峰。
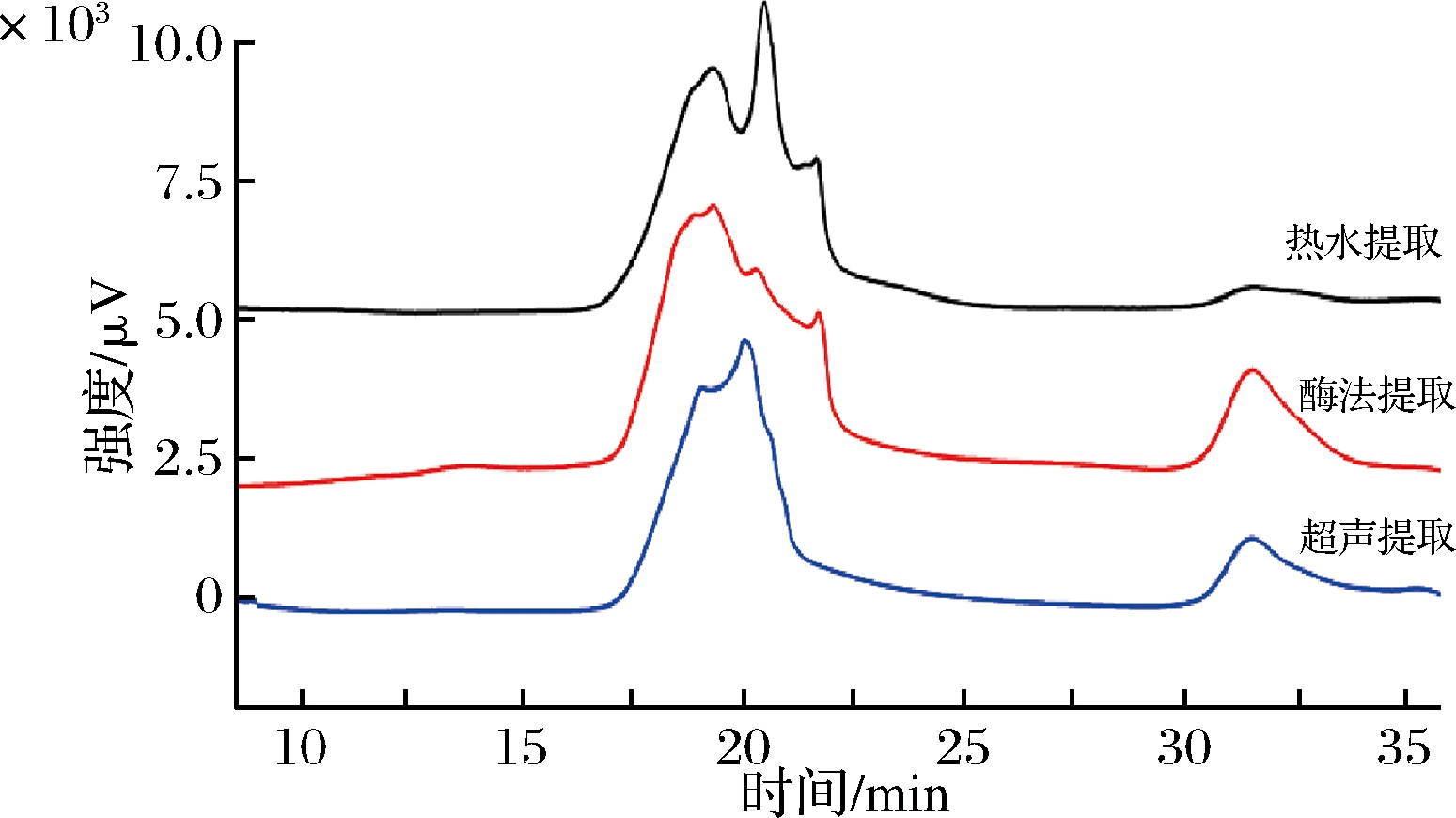
图3 不同提取方式制备秦巴山区黑木耳多糖的HPGPC色谱图
Fig.3 HPGPC chromatogram of Qinba Mountain A.auricula polysaccharides extracted by different methods
由图4和表4所示,3种方法提取的秦巴山区黑木耳粗多糖均含岩藻糖、木糖、甘露糖、葡萄糖、半乳糖和葡萄糖醛酸6种单糖,以甘露糖为主要成分。

图4 不同提取方式制得秦巴山区黑木耳多糖的单糖组成气相色谱图
Fig.4 Monosaccharide composition GC chromatogram of Qinba Mountain A.auricula polysaccharides extracted by different methods
表4 不同提取方式制得秦巴山区黑木耳多糖的单糖组成相对摩尔百分比 单位:%
Table 4 Monosaccharide composition of the Qinba Mountain A.auricula polysaccharides extracted by different methods
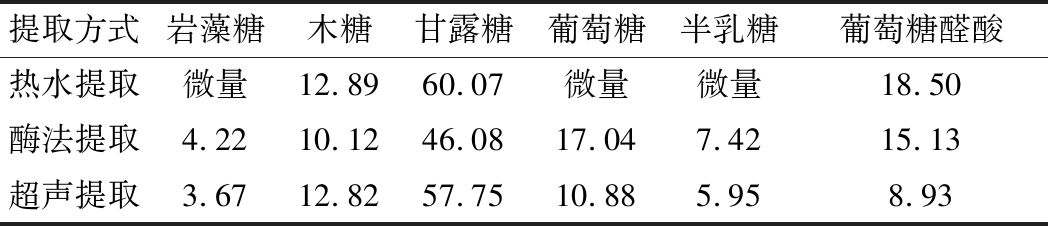
提取方式岩藻糖木糖甘露糖葡萄糖半乳糖葡萄糖醛酸热水提取微量12.8960.07微量微量18.50酶法提取4.2210.1246.0817.047.4215.13超声提取3.6712.8257.7510.885.958.93
热水提取制得的黑木耳粗多糖甘露糖、葡萄糖醛酸含量最高,岩藻糖含量最低。与热水提取和超声提取相比,酶法提取甘露糖含量较低,而葡萄糖、半乳糖含量较高。
2.4 不同提取方式对西北秦巴山区黑木耳多糖体外抗氧化活性的影响
如图5-a所示,在实验浓度范围内(0.625~10 mg/mL)3种方法提取得到的黑木耳粗多糖均有一定还原能力,且还原力大小与秦巴山区黑木耳粗多糖的浓度呈正相关的关系。在低浓度(≤1.25 mg/mL)时,3种黑木耳粗多糖的还原力有显著性差异(P<0.05),顺序为:超声提取>酶法提取>热水提取。在高浓度(≥2.5 mg/mL)时,超声提取黑木耳粗多糖和酶法提取黑木耳粗多糖的还原力无显著性差异,但均显著性高于热水提取黑木耳粗多糖的还原力(P<0.05)。
如图5-b所示,3种不同方法提取的秦巴山区黑木耳多糖均能够不同程度地螯合Fe2+,在实验浓度范围内(0.312 5~10 mg/mL),Fe2+螯合率与黑木耳粗多糖的浓度呈正相关关系。在低浓度(≤1.25 mg/mL)时,超声提取黑木耳粗多糖和酶法提取黑木耳粗多糖的Fe2+螯合率无显著性差异(P>0.05),但均显著性高于热水提取黑木耳粗多糖的Fe2+螯合率(P<0.05)。在高浓度(≥2.5 mg/mL)时,3种方法所提黑木耳粗多糖的Fe2+螯合率有显著性差异(P<0.05),顺序为:超声提取>酶法提取>热水提取。在质量浓度为10 mg/mL时,热水提取黑木耳粗多糖、酶法提取黑木耳粗多糖及超声提取黑木耳粗多糖的Fe2+螯合率分别为35.88%,52.90%,82.07%。
从图5-c可知,3种方法制得的秦巴山区黑木耳粗多糖均有较好的H2O2清除能力。在实验浓度范围内,H2O2清除能力与黑木耳粗多糖浓度呈正相关关系。在低浓度(≤2 mg/mL)时,超声提取黑木耳粗多糖和酶法提取黑木耳粗多糖的H2O2清除率无显著性差异,但均显著性高于热水提取(P<0.05)。在高浓度(2.5 mg/mL)时,3种方法所提黑木耳粗多糖的H2O2清除率有显著性差异(P<0.05):超声提取>酶法提取>热水提取。在实验浓度2.5 mg/mL时,酶法提取黑木耳粗多糖、超声提取黑木耳粗多糖的H2O2清除率分别为热水提取制得黑木耳粗多糖的3.3倍和4.2倍。
单糖组成的不同可能是导致多糖间活性差异的原因之一。除此之外,多糖的抗氧化生物活性与其分子质量大小、官能团数量、糖苷键连接方式等密切相关[28]。高分子质量有利于空间结构的稳定,但分子质量过大的多糖难以跨越多重细胞膜障碍而进入生物体内发挥生物学活性[29]。螺旋构象的多糖活性较高,而呈无规则链状构象的多糖活性一般较低。王荣琨等[30]推测超声波辅助提取法可能破坏了多糖与蛋白等杂质的连接键,从而使多糖结构中更多的活性基团暴露出来,从而提升了粗多糖的纯度和抗氧化能力。
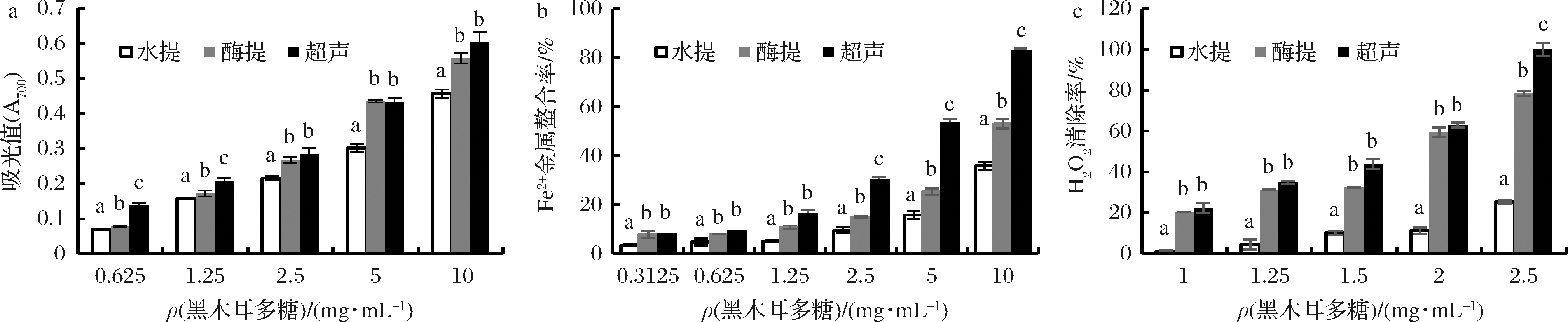
a-还原力;b-Fe2+金属螯合能力;c-H2O2清除能力
图5 不同提取方式制得秦巴山区黑木耳多糖的抗氧化活性
Fig.5 Antioxidant activities of Qinba Mountain A.auricula polysaccharides extracted by different methods
3 结论
采用热水浸提法提取西北秦巴山区黑木耳多糖,发现其主要由甘露糖、葡萄糖醛酸、木糖组成,相对摩尔百分比为60.87∶20.83∶9.86,其多糖结合蛋白含量及半乳糖比例显著低于东北黑木耳多糖。秦巴山区黑木耳多糖具有较好的H2O2清除能力、金属螯合能力和还原力。低浓度范围内,西北黑木耳多糖的抗氧化能力显著强于东北黑木耳多糖,而在较高浓度范围时,东北黑木耳多糖的抗氧化能力强于西北黑木耳多糖。不同提取方法制得的秦巴山区黑木耳多糖均具有较好的抗氧化活性,活性强弱依次为:超声提取>酶法提取>热水提取。超声提取制得的黑木耳多糖糖含量、蛋白含量显著高于热水提取;热水提取制得的黑木耳粗多糖甘露糖、葡萄糖醛酸含量最高,岩藻糖含量最低。
[1] 刘雅芳,胡妮娜.黑龙江省黑木耳产品研发策略探讨[J].中国中医药科技,2018,25(1):1-3.
LIU Y F,HU N N.Research and development strategy of Auricularia auricula product in Heilongjiang province[J].Chinese Journal of Traditional Medical Science and Technology,2018,25(1):1-3.
[2] 杨波,杨浪,周建波.黑木耳的生理活性及加工产品的研究进展[J].现代食品,2020(8):78-81.
YANG B,YANG L,ZHOU J B.Research progress on physiological activity and processing products of Auricularia Auricula[J].Modern Food,2020(8):78-81.
[3] BANDARA A R,RAPIOR S,MORTIMER P E,et al.A review of the polysaccharide,protein and selected nutrient content of Auricularia,and their potential pharmacological value[J].Mycosphere,2019,10(1):579-607.
[4] 张赫,杨柠,李家富,等.黑木耳多糖对非酒精性脂肪肝大鼠脂代谢的影响[J].吉林医药学院学报,2020,41(4):259-262.
ZHANG H,YANG N,LI J F,et al.Effects of Auricularia auricula polysaccharide on lipid metabolism in rats with non-alcoholic fatty liver[J].Journal of Jilin Medical University,2020,41(4):259-262.
[5] CHEN N N,ZHANG H,ZONG X,et al.Polysaccharides from Auricularia auricula:Preparation,structural features and biological activities[J].Carbohydrate Polymers,2020,247:116750.
[6] MIAO J N,REGENSTEIN J M,QIU J Q,et al.Isolation,structural characterization and bioactivities of polysaccharides and its derivatives from Auricularia-A review[J].International Journal of Biological Macromolecules,2020,150:102-113.
[7] 钱雪婷, 陈文强,邓百万,等.基于ITS序列分析秦巴山区黑木耳菌株的遗传多样性[J].北方园艺,2016(12):147-151.
QIAN X T,CHEN W Q,DENG B W,et al.Analysis of the genetic diversity of Auricularia auricular strains from Qinba Mountains based on ITS sequence[J].Northern Horticulture,2016(12):147-151.
[8] 谢海彬,王帮庆,解修超,等.秦巴山区黑木耳新菌株森盛1号选育研究[J].中国食用菌,2018,37(5):7-10.
XIE H B,WANG B Q,XIE X C,et al.Study on breeding of a new Auricularia auricular strains Sensheng 1 in Qinba mountain area[J].Edible Fungi of China,2018,37(5):7-10.
[9] MOZAMMIL HASNAIN S M,HASNAIN M S,NAYAK AK.Natural polysaccharides[M]//Natural Polysaccharides in Drug Delivery and Biomedical Applications.Amsterdam:Elsevier,2019:1-14.
[10] ZHU J X,CHEN Z Y,ZHOU H,et al.Effects of extraction methods on physicochemical properties and hypoglycemic activities of polysaccharides from coarse green tea[J].Glycoconjugate Journal,2020,37(2):241-250.
[11] HAO W,WANG S F,ZHAO J,et al.Effects of extraction methods on immunology activity and chemical profiles of Lycium barbarum polysaccharides[J].Journal of Pharmaceutical and Biomedical Analysis,2020,185:113219.
[12] 吴梦琪,夏玮,徐志珍,等.植物多糖的分离纯化、结构解析及生物活性研究进展[J].化学世界,2019,60(11):737-747.
WU M Q,XIA W,XU Z Z,et al.Review on isolation and purification,structural elucidation and biological activity of botanical polysaccharides[J].Chemical World,2019,60(11):737-747.
[13] NIE X R,FU Y,WU D T,et al.Ultrasonic-assisted extraction,structural characterization,chain conformation,and biological activities of a pectic-polysaccharide from okra(Abelmoschus esculentus)[J].Molecules,2020,25(5):1155.
[14] GUO Y,SHANG H M,ZHAO J C,et al.Enzyme-assisted extraction of a cup plant(Silphium perfoliatum L.) polysaccharide and its antioxidant and hypoglycemic activities[J].Process Biochemistry,2020,92:17-28.
[15] LI L,YANG X Y,PAN L,et al.Comparing three methods of extraction of Auricularia auricula polysaccharides[J].Current Topics in Nutraceutical Research,2017,17(2):7-10.
[16] BIAN C,WANG Z Y,SHI J.Extraction optimization,structural characterization,and anticoagulant activity of acidic polysaccharides from Auricularia auricula-judae[J].Molecules,2020,25(3):710.
[17] CHUNG H C,YU Z R,WANG B J,et al.Auricularia auricula-judae hot water extracts activate macrophages toward M1 phenotype[J].Taiwanese Journal of Agricultural Chemistry and Food Science,2019,57(5):220-232.
[18] GONG G P,DANG T T,FANG J,et al.Preparation,structural characterization,and bioactivity of PHPD-IV-4 derived from Porphyra haitanensis[J].Food Chemistry,2020,329:127042.
[19] CHEN X Y,TANG R,LIU T T,et al.Physicochemical properties,antioxidant activity and immunological effects in vitro of polysaccharides from Schisandra sphenanthera and Schisandra chinensis[J].International Journal of Biological Macromolecules,2019,131:744-751.
[20] DENG Y N,LIU Q,DANG T T,et al.Preparation,structural characterization and bioactivity of 4-O-Methylglucuronoxylan from Artemisia sphaerocephala Krasch[J].Carbohydrate Polymers,2019,222:115009.
[21] KIM H M,SONG Y X,HYUN G H,et al.Characterization and antioxidant activity determination of neutral and acidic polysaccharides from Panax ginseng C.A. Meyer[J].Molecules,2020,25(4):791.
[22] 李有媛,赵愉涵,陈庆敏,等.四种芹菜不同部位营养成分和抗氧化能力的分析比较[J].食品与发酵工业,2021,47(14):76-81.
LI Y Y,ZHAO Y H,CHEN Q M,et al.Analysis and comparison of nutritional components and antioxidant capacity in different parts of four kinds of celery[J].Food and Fermentation Industries.,2021,47(14):76-81.
[23] 李珊,刘哲,赵永珍,等.青藏高原狭果茶藨子黄酮纯化工艺及抗氧化活性研究[J].食品科技,2021,46(1):212-219.
LI S,LIU Z,ZHAO Y Z,et al.Purification process and antioxidant activity of flavonoids from Ribes stenocarpum Maxim in Qinghai-Tibet plateau[J].Food Science and Technology,2021,46(1):212-219.
[24] DING X A,TANG J,CAO M,et al.Structure elucidation and antioxidant activity of a novel polysaccharide isolated from Tricholoma matsutake[J].International Journal of Biological Macromolecules,2010,47(2):271-275.
[25] 杨林,钟锋,刘浩,等.东北黑木耳产业发展研究[J].食品安全导刊,2015,34:70-71.
YANG L,ZHONG F,LIU H,et al.Research on the development of black fungus industry in northeast China[J].China Food Safety Magazine,2015,34:70-71.
[26] BUTTERFIELD D A,HALLIWELL B.Oxidative stress,dysfunctional glucose metabolism and Alzheimer disease[J].Nature Reviews Neuroscience,2019,20(3):148-160.
[27] ORE A,AKINLOYE O A.Oxidative stress and antioxidant biomarkers in clinical and experimental models of non-alcoholic fatty liver disease[J].Medicina-Lithuania,2019,55(2):26.
[28] LI Z M,NIE K Y,WANG Z J,et al.Quantitative structure activity relationship models for the antioxidant activity of polysaccharides[J].PLoS One,2016,11(9):e0163536.
[29] QU J L,HUANG P,ZHANG L,et al.Hepatoprotective effect of plant polysaccharides from natural resources:A review of the mechanisms and structure-activity relationship[J].International Journal of Biological Macromolecules,2020,161:24-34.
[30] 王荣琨,王钦,罗欣,等.不同提取方法对竹荪多糖提取率及抗氧化性影响[J].中国食用菌,2020,39(3):24-28.
WANG R K,WANG Q,LUO X,et al.Effects of different extraction methods on the extraction rate and antioxidant properties of Dictyophora indusiata polysaccharide[J].Edible Fungi of China,2020,39(3):24-28.