尿苷二磷酸(uridine diphosphate,UDP)-葡萄糖在糖生物学研究中具有重要的地位,它是核苷酸依赖性糖基转移酶(“Leloir” glycosyltransferases,GTs,EC 2.4)合成糖苷的重要糖供体。一直以来,人们认为这些GTs是具有“革命性”的糖基化催化剂,具有大规模高精度生产糖苷的潜力[1-2]。但是,核苷二磷酸糖供体(NDP-糖)的高成本是GTs工业应用的主要限制[3-4],阻碍了寡糖、多糖的大规模合成[5]。此外,UDP-葡萄糖还可以为UDP-半乳糖、UDP-葡萄糖醛酸、UDP-木糖、UDP-阿拉伯糖等核苷酸糖的合成提供前体[6-8]。近2年研究还发现,UDP-葡萄糖还可以阻止肺癌转移,对医学研究具有重要意义[9]。
核苷二磷酸糖的合成有化学合成法、单酶法和多酶法[4, 10-11]。其中,由于蔗糖合酶(sucrose synthase,SuSy,EC 2.4.1.13)可以在几乎不耗能的前提下,利用廉价的蔗糖一步反应生成昂贵的核苷二磷酸糖,这有希望成为最经济高效的核苷二磷酸糖合成途径[11-12]。为了实现GTs应用价值的最大化,人们开展了对SuSy的相关研究。近年来,研究者们通过建立SuSy-GTs的级联反应实现了糖苷的高效合成[13-14],此外,采用酶固定化技术也可实现糖苷的高效合成[15-16]。还有学者通过大肠杆菌异源表达嗜酸杆菌中的SuSy基因,利用纯化得到的SuSy,实现了UDP-葡萄糖的高效生产[17]。
SuSy的早期研究主要在植物体内展开,其功能鉴定引起了大部分研究者的关注[18],还有一些研究者对其进行了异源表达及性状表征[19-20]。目前细菌来源的SuSy因其具有较高的热稳定特性逐渐被研究者所关注,越来越多的证据表明细菌来源的SuSy将会有更广阔的应用前景[21]。本文通过对来自氨氧化亚硝化螺菌的蔗糖合酶(Nitrosospira multiformis,NmSuSy)的研究,实现了UDP-葡萄糖的大量合成,为后续进一步实现UDP-葡萄糖的高效合成奠定了基础,为将来利用SuSy实现UDP-葡萄糖的工业化生产提供了理论支持。
1 材料与方法
1.1 实验材料
1.1.1 菌种、质粒和培养基
大肠杆菌BL21(DE3)、大肠杆菌质粒pET-28a(+)由中国高校工业微生物资源和信息中心保藏;氨氧化亚硝化螺菌蔗糖合酶基因的表达质粒pET-28a-NmSuSy由苏州金维智科技有限公司合成。
LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,氯化钠10.0,固体培养基另加琼脂粉20.0 g/L。抗性筛选时添加终质量浓度为100 mg/L的氨苄青霉素。
1.1.2 试剂与仪器
氨苄青霉素,Thermo Fisher Scientific公司;尿苷-5′-二磷酸二钠盐(uridine 5′-diphosphate disodium salt,5′-UDP-Na2),上海源叶生物科技有限公司;其他主要试剂均购于北京索莱宝科技有限公司。
酶标仪,TECAN公司;AKTA AVANT蛋白纯化仪,美国通用电气有限公司;pH计,梅特勒-托利多仪器公司;Sonic VCX-750型超声波细胞破碎仪,南京新辰生物科技有限公司。
1.2 实验方法
1.2.1 重组质粒的构建与表达
NCBI数据库中查询得到氨氧化亚硝化螺菌蔗糖合酶基因序列(GeneID:41370990),基于大肠杆菌偏好性完成密码子优化,由苏州金维智科技有限公司合成得到表达质粒pET-28a-NmSuSy。将质粒pET-28a-NmSuSy转化到大肠杆菌DE3中,通过菌落PCR验证、测序验证得到重组菌BL21/pET-28a-NmSuSy。
1.2.2 蔗糖合酶的诱导表达和分离纯化
将重组菌BL21 (DE3)/pET-28a-NmSuSy接种于含氨苄青霉素的LB平板,37 ℃培养12 h后接种至LB液体中过夜培养。然后按2%接种量进一步扩大培养(37 ℃)至OD600约为0.6后,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷诱导蛋白表达(16 ℃,24 h)。最后将发酵液冷冻离心(4 ℃,12 000 r/min,10 min)弃上清液,收集沉淀,用20 mmol/L PB缓冲液(pH 7.4)重悬菌体。采用超声波破碎法破碎细胞,冷冻离心后所得上清液即为粗蛋白液。
用1 mL镍离子柱对粗蛋白液进行纯化。用体积分数为85%的A液(20 mmol/L PB、500 mmol/L NaCl、20 mmol/L咪唑,pH 7.4)和体积分数15%的B液(20 mmol/L PB、500 mmol/L NaCl、500 mmol/L咪唑,pH 7.4)洗脱杂蛋白,最后以体积分数63%的A液和体积分数37%的B液洗脱目的蛋白,收集蛋白峰洗脱液,最后将粗蛋白液和纯酶液进行SDS-PAGE分析。另将得到的上述NmSuSy洗脱液用超滤管交换浓缩到25 mmol/L 4-羟乙基哌嗪乙磺酸{2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES}缓冲液(pH 7.4)中保存,便于后期酶学性质的研究。
1.2.3 蔗糖合酶酶活力测定
采用BCA(bicinchoninic acid)法[22]测果糖生成量来计算酶活力,酶活力测定体系[23]:在含有100 mmol/L蔗糖、10 mmol/L UDP总体积为100 μL的50 mmol/L PB溶液(pH 6.5)中50 ℃孵育5 min。酶活力定义:1 min内生成1 μmol果糖所需的酶量为1个酶活力单位(U)。
1.2.4 蔗糖合酶酶学性质研究
(1)最适反应pH和pH稳定性:将纯酶分别在pH 5.0~10.0的缓冲液中测定酶活力,以酶活力的最高值为100%。继续将纯酶在pH 5.0~7.5的缓冲液中4 ℃保存,每隔一段时间测定剩余酶活力,探究酶的pH稳定性。
(2)最适反应温度和热稳定性:将纯酶分别在30~80 ℃的条件下测定酶活力,以酶活力的最高值为100%。继续将纯酶在不同温度下保存,每隔一段时间测定剩余酶活力,探究酶的热稳定性。
(3)金属离子和抑制剂对酶活力的影响:向反应体系中添加不同的金属离子和抑制剂,终浓度为0.1、0.5 、1.0 mmol/L,测定酶活力,以未经处理的酶活力为100%。
(4)有机试剂对酶活力的影响:向反应体系中加入不同有机试剂,终体积分数为1%、5%和10%,测定酶活力,以未经处理的酶活力为100%。
(5)表面活性剂对酶活力的影响:向反应体系中加入不同表面活性剂至终体积分数为0.1%、0.5%、1%,测定酶活力,以未经处理的酶活力为100%。
(6)动力学常数测定:选择不同浓度的UDP为底物(0.5~8 mmol/L),在测酶活力的条件下测定重组酶活力。使用Lineweaver-Burk双倒数法[24]对NmSuSy的Km值以及kcat/Km值进行计算。
1.2.5 重组酶催化UDP-葡萄糖的高效合成
(1)底物抑制对蔗糖合酶初始反应速率的影响:用50 mmol/L PB缓冲液配制500 mmol/L蔗糖及不同浓度UDP的反应体系、400 mmol/L UDP及不同浓度蔗糖的反应体系,在pH 6.5、40 ℃条件下反应4 min,通过BCA法检测果糖的生成。
(2)pH和温度对蔗糖合酶反应的平衡常数的影响:用50 mmol/L PB缓冲液配制含有1 mol/L蔗糖、100 mmol/L UDP,pH分别调整为6.0、6.5、7.0、7.5。在酶终质量浓度为100 mg/L、30 ℃下反应,还有2个pH 6.0的反应体系分别在35、40 ℃下反应。反应过程中通过手动添加4 mol/L盐酸维持pH稳定,通过BCA法检测果糖的生成。
2 结果与分析
2.1 重组菌的获得与验证
如图1所示,PCR产物在2 394 bp左右有明显条带,这与NmSuSy基因大小相一致,测序结果与GenBank报告的基因完全一致,表明获得了正确的NmSuSy基因序列。
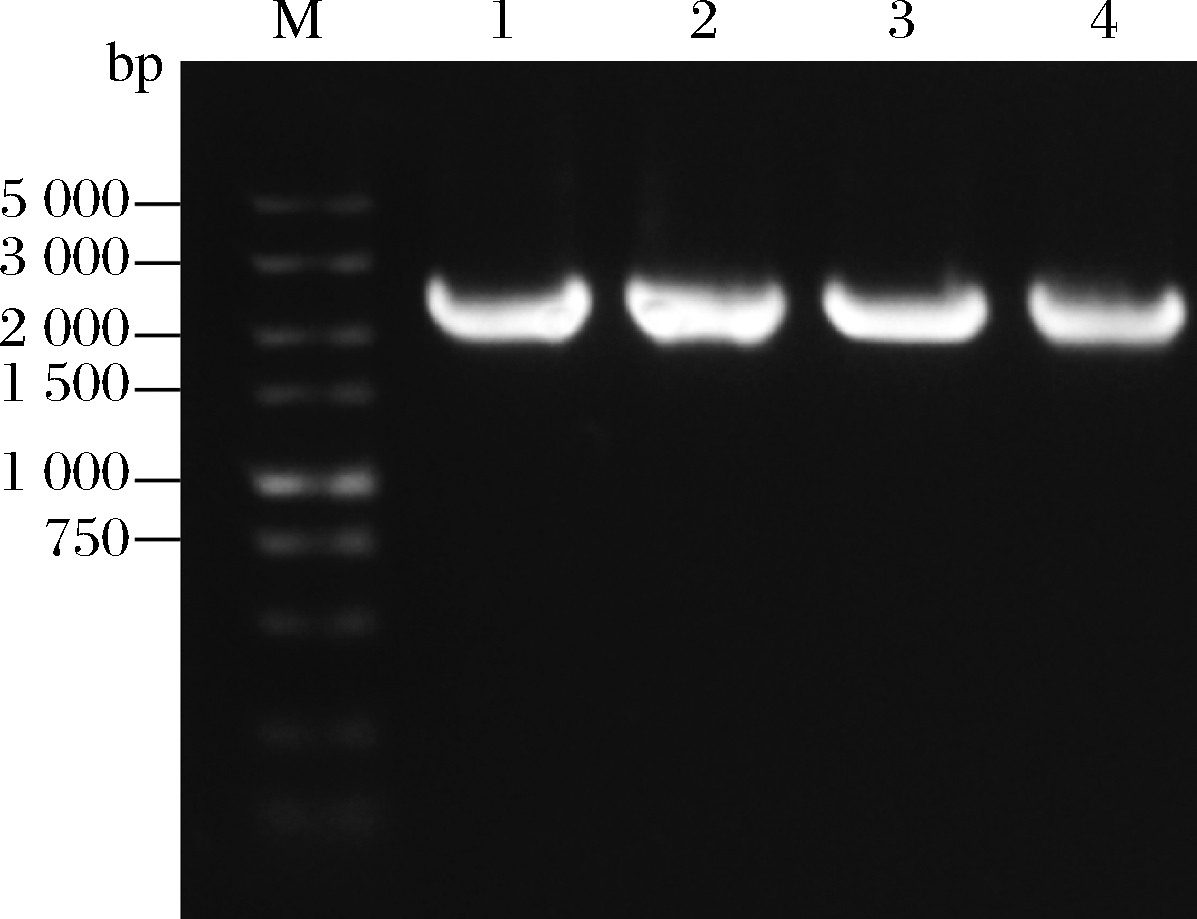
M-DNA Marker;1~4-重组菌BL21/pET-28a-NmSuSy菌落PCR产物
图1 重组菌菌落PCR鉴定电泳结果
Fig.1 Electrophoresis results of recombinant bacterial colony PCR identification
2.2 重组蔗糖合酶的诱导表达、酶活力检测及纯化
细胞破碎液上清液和纯化后的酶液SDS-PAGE鉴定结果如图2所示,重组蛋白在89 kDa左右出现明显条带,空载的破碎液上清液中,无法检测到相应大小的蛋白条带。粗酶液经镍离子柱亲和层析纯化后在SDS-PAGE中显示出单一的清晰条带。经超滤管超滤浓缩后可得到质量浓度为21.39 mg/mL的纯酶液。纯酶液按1.2.3的酶活力测定方法,测得比酶活力为14.4 U/mg。
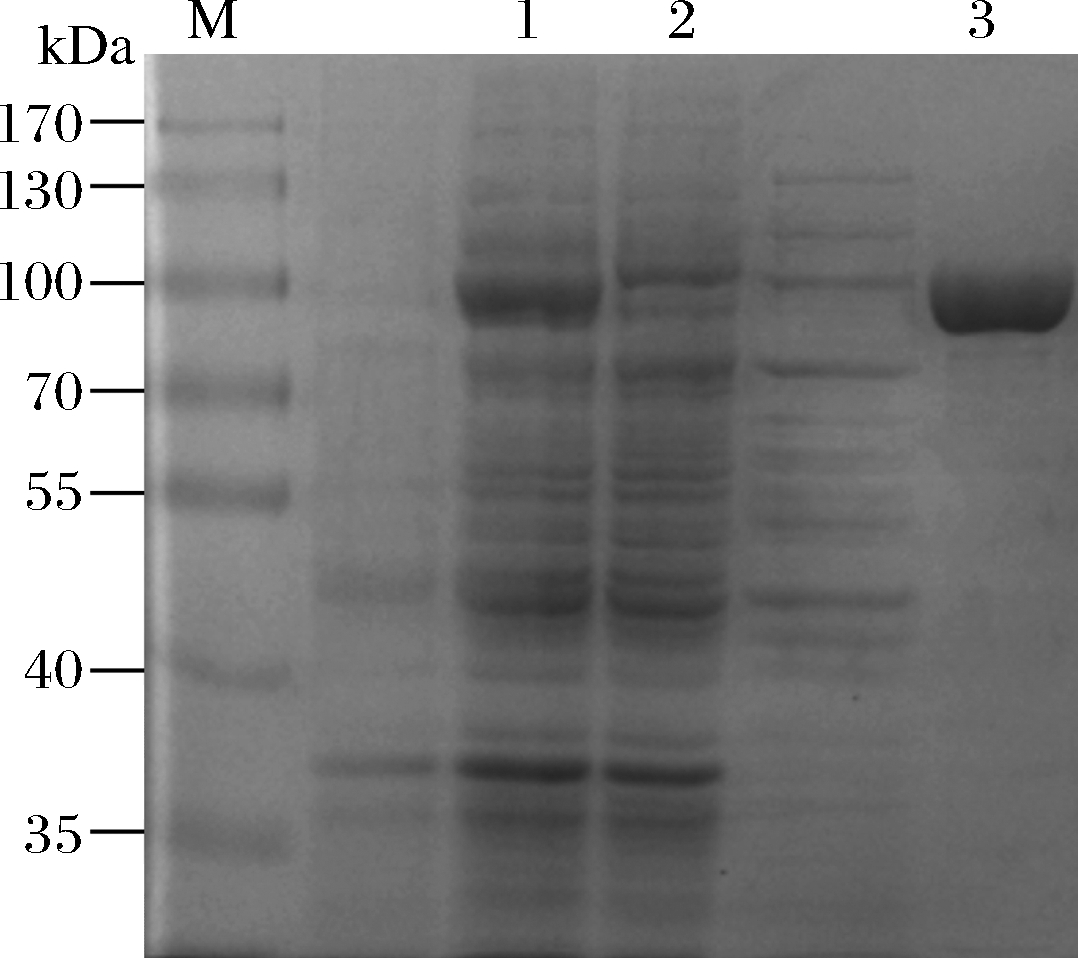
M-标准蛋白 Marker;1-重组菌BL21/pET-28a-NmSuSy粗酶液;
2-空载破碎后上清液;3-重组菌BL21/pET-28a-NmSuSy纯酶液
图2 重组酶的SDS-PAGE图
Fig.2 SDS-PAGE results of recombination enzymes
2.3 酶学性质分析
在探究酶学性质时,均使用纯化后的酶液,在每100 μL反应体系中加入1 μL纯酶液(2.14 μg)进行测定。
2.3.1 最适反应pH和pH稳定性
由于pH>7.5时蔗糖合酶催化的可逆反应向着UDP合成的方向进行[25],因此本文重点研究了pH<7.5时,NmSuSy的催化活力变化情况。如图3所示,重组酶最适反应pH为6.5,当pH<6.5时相对酶活力随着pH的下降快速下降,当pH为5.5时相对酶活力仅有23%。pH稳定性研究结果显示,当pH为6.0~7.5时NmSuSy稳定性较好,半衰期均在40 h以上。
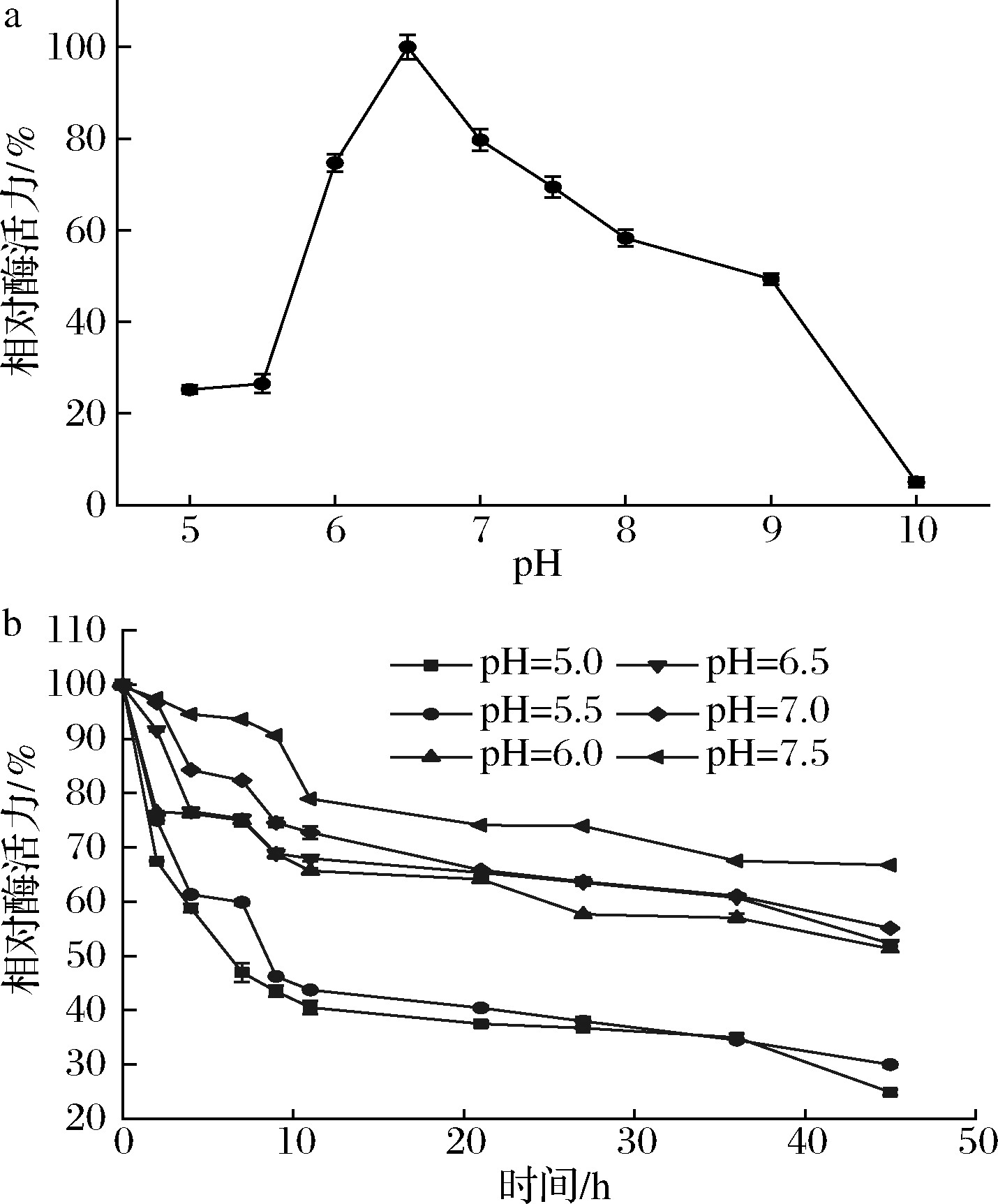
a-NmSuSy的最适pH;b-NmSuSy的pH稳定性
图3 pH对酶活力及其稳定性的影响
Fig.3 Effects of pH on activities and stabilities of recombination enzymes
2.3.2 最适反应温度和温度稳定性
NmSuSy热稳定性及最适反应温度如图4所示。NmSuSy的最适反应温度为55 ℃,且该酶不适合在60 ℃以上反应,60 ℃以上酶会迅速失活。温度<35 ℃时,酶稳定性很好,半衰期在35 h以上。据报道,绝大部分植物来源蔗糖合酶在高于30 ℃的温度下,酶会快速失活[21]。相比之下,NmSuSy具有相对较好的热稳定性。
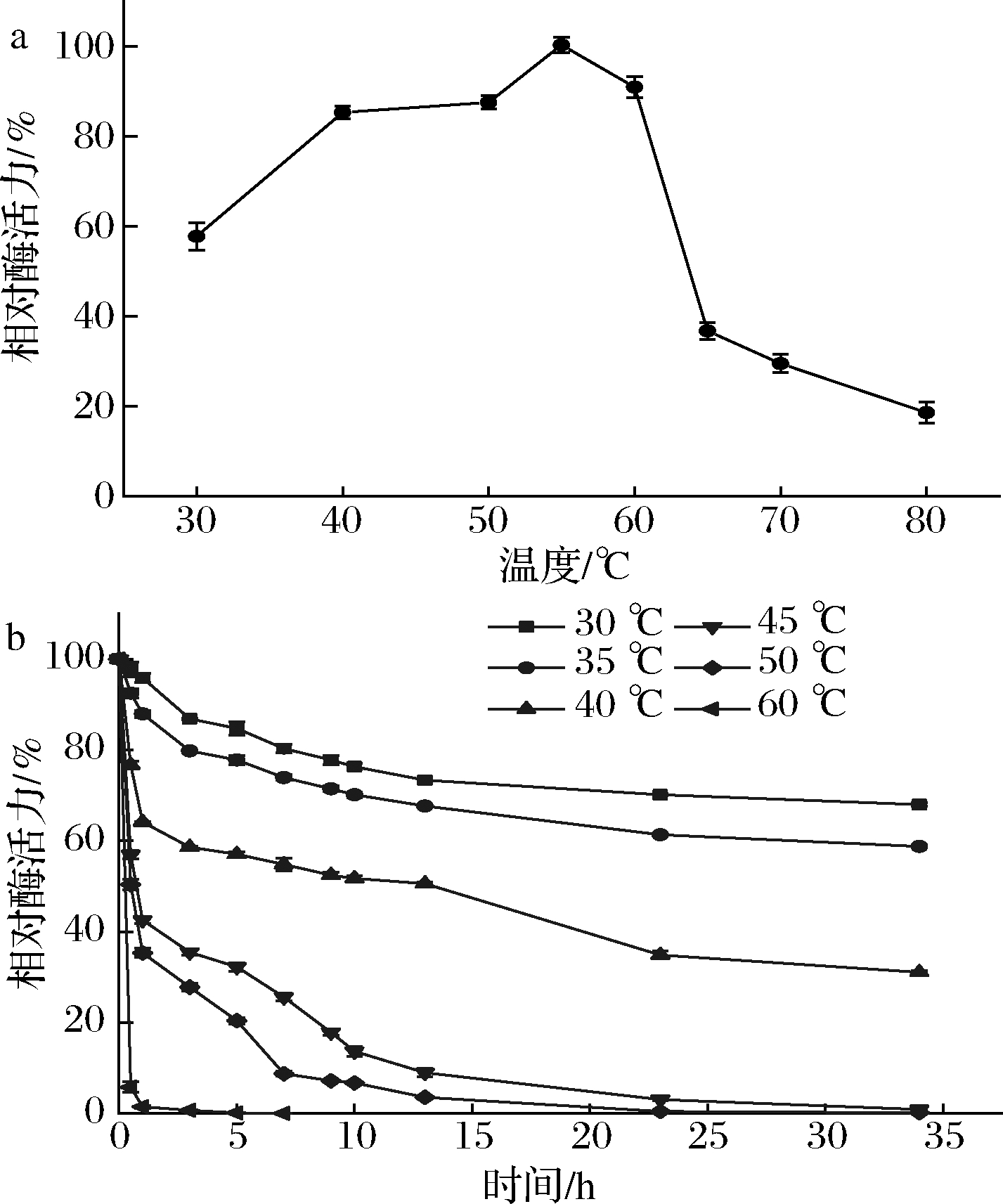
a-NmSuSy的最适温度;b-NmSuSy的温度稳定性
图4 温度对酶活力及其稳定性的影响
Fig.4 Effects of temperature on activities and stabilities of the enzyme
2.3.3 金属离子和有机溶剂对酶活力的影响
金属离子对不同蔗糖合酶的作用效果各不相同。如图5所示,Mg2+、Mn2+、Fe2+均可提高NmSuSy酶活力而Cu2+对酶活力抑制作用明显。此外,Ni2+、Co2+、Fe3+、Al3+、Na+、K+这些金属离子在低浓度时会提高酶活力,高浓度时则会抑制酶活力。
如图5所示,当测定酶活力体系中加入10%的甘油、丙酮、乙醇、甲醇时,酶活力降低了40%~50%,当加入体积分数10%的乙腈、异丙醇、正丙醇时,相对酶活力仅有10%左右。这说明NmSuSy对高浓度有机试剂耐受性不强。
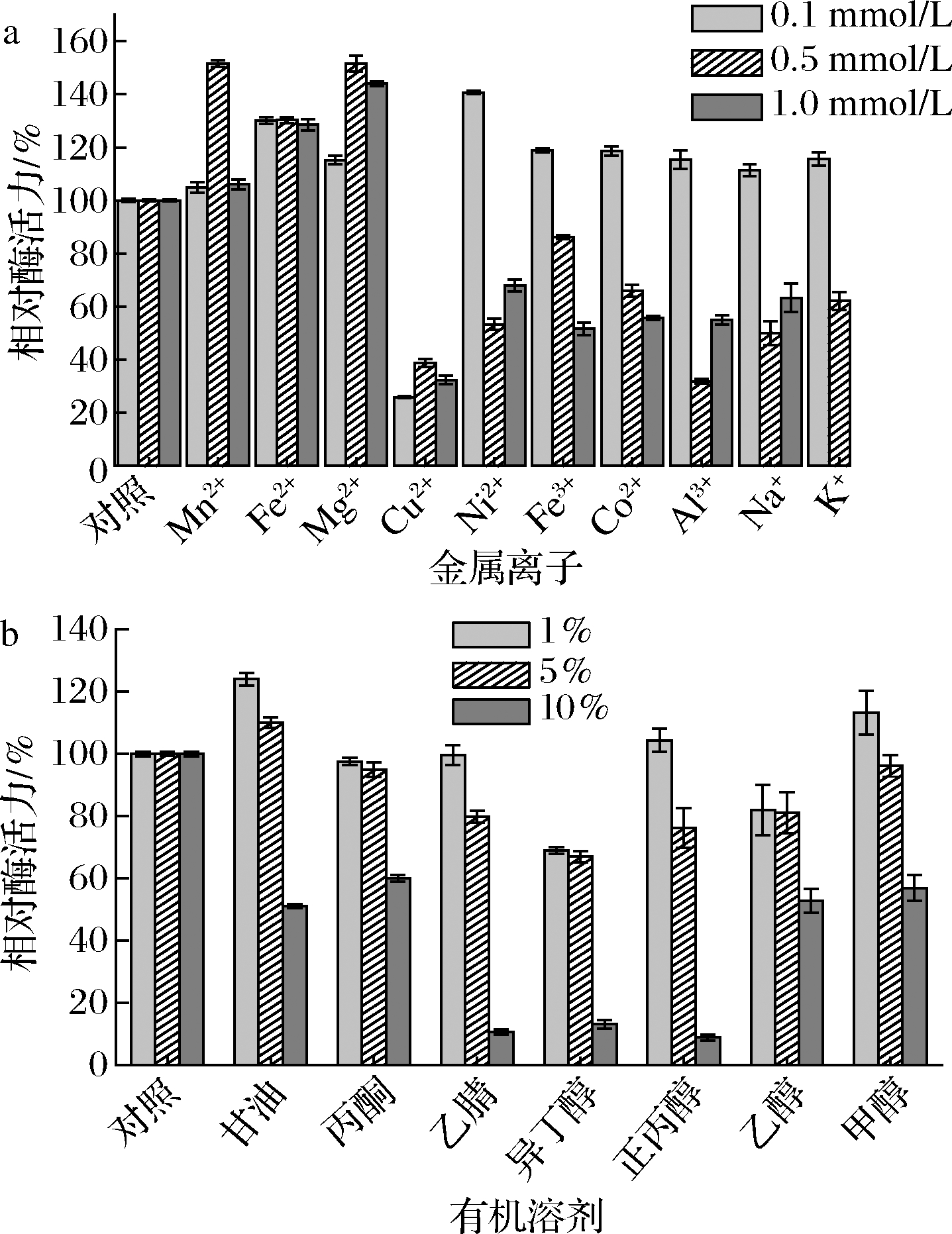
a-金属离子对酶活性的影响;b-有机溶剂对酶活性的影响
图5 金属离子和有机试剂对酶活性的影响
Fig.5 Effects of metal ions and organic reagents on activities of the enzyme
2.3.4 抑制剂和表面活性剂对酶活力的影响
在测定酶活力过程中EDTA、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、二硫苏糖醇(dithiothreitol,DTT)均对NmSuSy有轻微抑制作用,如图6所示,随着浓度的升高,NmSuSy相对酶活力也逐渐降低,但抑制作用不是很显著。
表面活性剂对酶活力的影响如图6所示,当吐温-20及吐温-80的添加量(体积分数)为0.1%、0.5%时,可促进NmSuSy的酶活力,当添加1%的吐温-20和吐温-80时NmSuSy活力却受到轻微的抑制。但SDS和曲拉通对NmSuSy活力有显著的抑制作用,当添加1%的SDS时,NmSuSy相对酶活力仅有13.74%。
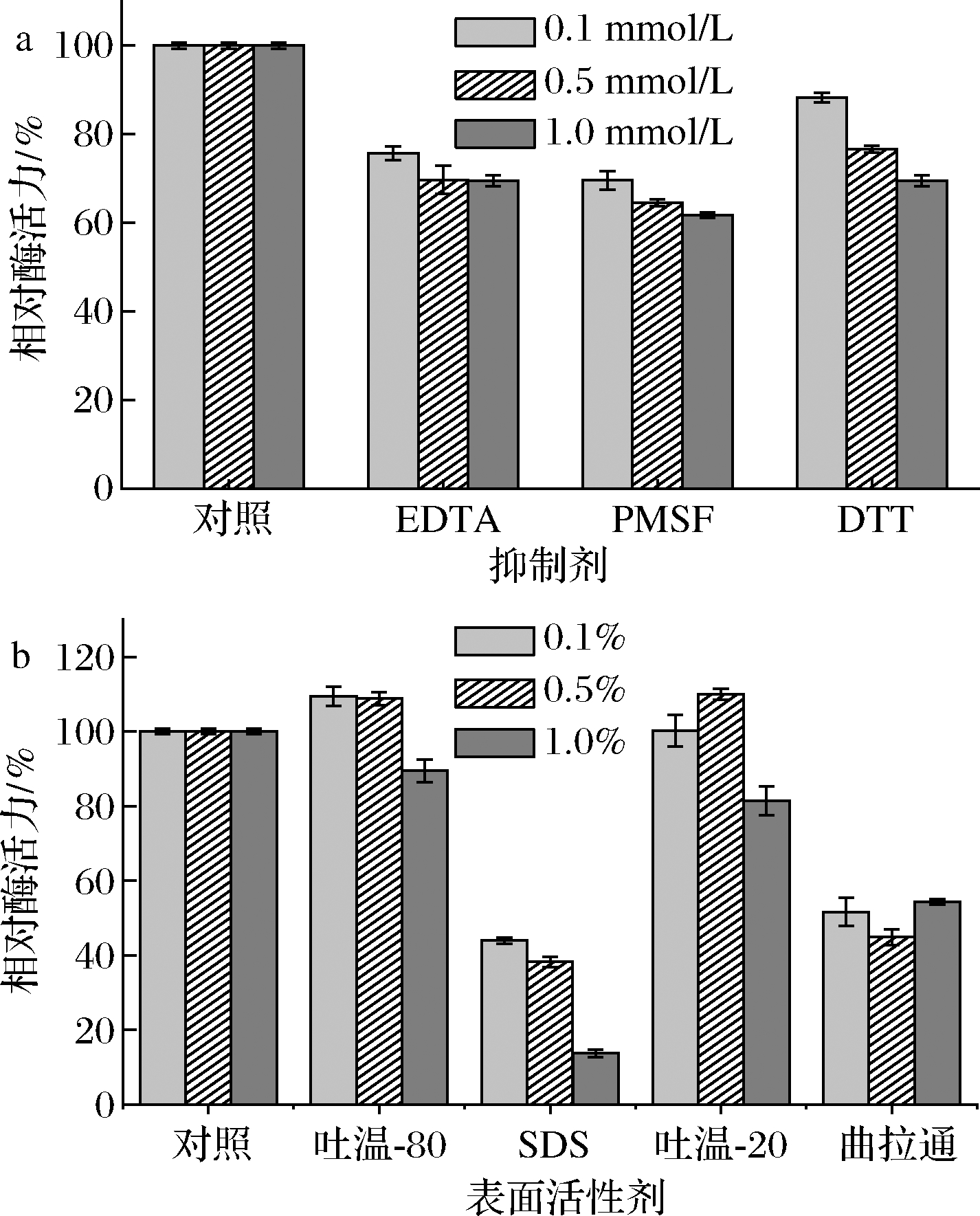
a-抑制剂对酶活性的影响;b-表面活性剂对酶活性的影响
图6 抑制剂和表面活性剂对酶活性的影响
Fig.6 Effects of inhibitors and surfactants on activities of the enzyme
2.3.5 重组蔗糖合酶的底物动力学研究
采用Linewaeaver-Burk双倒数进行作图,通过计算得到NmSuSy的米氏常数Km为6.6 mmol/L,反应最大速率Vmax为1 360 μmol/(L·min),催化常数kcat为23.81 s-1,催化效率指数kcat/Km为3.61 L/(mmol·s)。部分其他蔗糖合酶动力学参数见表1,对比发现,NmSuSy等细菌来源的蔗糖合酶普遍比植物来源的蔗糖合酶对UDP的亲和性低。虽然植物来源蔗糖合酶具有比NmSuSy更低的Km值,但低Km值往往会引起强烈的底物抑制作用,而为了高效合成UDP-葡萄糖,基于弱的底物抑制作用来选择蔗糖合酶则更为关键。而细菌来源的蔗糖合酶具有较高Km值,表现出更高的底物抑制浓度[17]。
表1 不同来源蔗糖合酶动力学参数
Table 1 Kinetic parameters of SuSy from different sources

来源名称底物条件Km/(mmol·L-1)kcat/s-1植物Arabidopsis thaliana (SUS1)[26]UDP37 ℃,pH 7.00.39907Arabidopsis thaliana (SUS3)[26]UDP37 ℃,pH 7.00.251 470Glycine max[21]UDP30 ℃,pH 7.50.00520.0Hordeum vulgare[26]UDP37 ℃,pH 7.00.22435Helianthus tuberosus[21]UDP30 ℃,pH 8.30.32n.a.Ipomoea batatas[21]UDP37 ℃,pH 6.00.13n.a.Lycopersicon chmielewskii[21]UDP25 ℃,pH 6.50.02n.a.Manihot utilissima[21]UDP37 ℃,pH 7.56.6n.a.Oryza sativa[21]UDP37 ℃,pH 6.00.11n.a.Phaseolus aureus[21]UDP25 ℃,pH 7.50.19n.a.Zea mays[21]UDP30 ℃,pH 6.50.14n.a.Vicia faba[21]UDP25 ℃,pH 7.00.213.1Vigna radiata[21]UDP25 ℃,pH 7.30.19n.a.Solanum tuberosum[21]UDP37 ℃,pH 6.00.14n.a.Pyrus pyrifolia (SUS1)[21]UDP30 ℃,pH 7.00.035.4Prunus persica[21]UDP25 ℃,pH 7.00.08n.a.Pisum sativum (SUS1)[21]UDP30 ℃,pH 7.50.082n.a.微生物Acidithiobacillus caldus[25]UDP60 ℃,pH 7.07.882Nitrosomonas europaea[27]UDP60 ℃,pH 7.00.69103.8Thermosynechoccus elongatus[28]UDP37 ℃,pH 7.01.33.5
注:“n.a.”表示未检出
2.4 UDP-葡萄糖的高效合成
2.4.1 UDP-葡萄糖高效合成的动力学限制研究
研究发现,NmSuSy催化UDP-葡萄糖合成的最大初始速率为32 μmol/(min·mg)(图7),比文献中报道的植物来源蔗糖合酶[17]催化UDP-葡萄糖合成的最大初始速率[14 μmol/(min·mg)]提高了近2.28倍。NmSuSy在较高的UDP浓度下,仍保持较为理想的催化能力。此外,研究还发现蔗糖对可逆反应没有底物抑制现象。因此,选择细菌来源的蔗糖合酶来催化可逆反应,可在较高UDP浓度下合成UDP-葡萄糖,从而促进UDP的充分利用。

a-UDP浓度对初始反应速率的影响;b-蔗糖浓度对初始反应速率的影响
图7 UDP和蔗糖浓度对合成UDP-葡萄糖初始反应速率的影响
Fig.7 The influence of the UDP concentration and sucrose concentration on the initial rates of UDP-glucose formation
2.4.2 UDP-葡萄糖高效合成的热力学限制
有研究表明pH会影响酶促转化的平衡常数[29]。GUTMANN等[17] 研究进一步证实pH会影响UDP的质子化程度进而影响反应平衡常数。因此在整个反应过程中控制反应体系pH保持恒定极其重要。当pH为5.5时,相对酶活力仅有23%,且NmSuSy在该条件下稳定性差;pH>7.5时,可逆反应向着UDP合成的方向进行。因此本研究在pH 6.0~7.5展开pH对平衡常数影响的研究。如图8-a所示,pH从7.5降低到6.0,反应达到平衡时的UDP转化率从30.5%提高到了41.5%。此外,本文还探究了温度对可逆反应的速率和平衡常数的影响,如图8-b所示,温度对可逆反应平衡常数没有影响,温度只能影响可逆反应到达平衡状态的时间。温度为40 ℃时,反应速度最快,在此温度下,仅需1 h即可获得35.8 mmol/L(20.2 g/L)的UDP-葡萄糖。由于温度高于40 ℃时酶稳定性差,因此并没有进行研究。
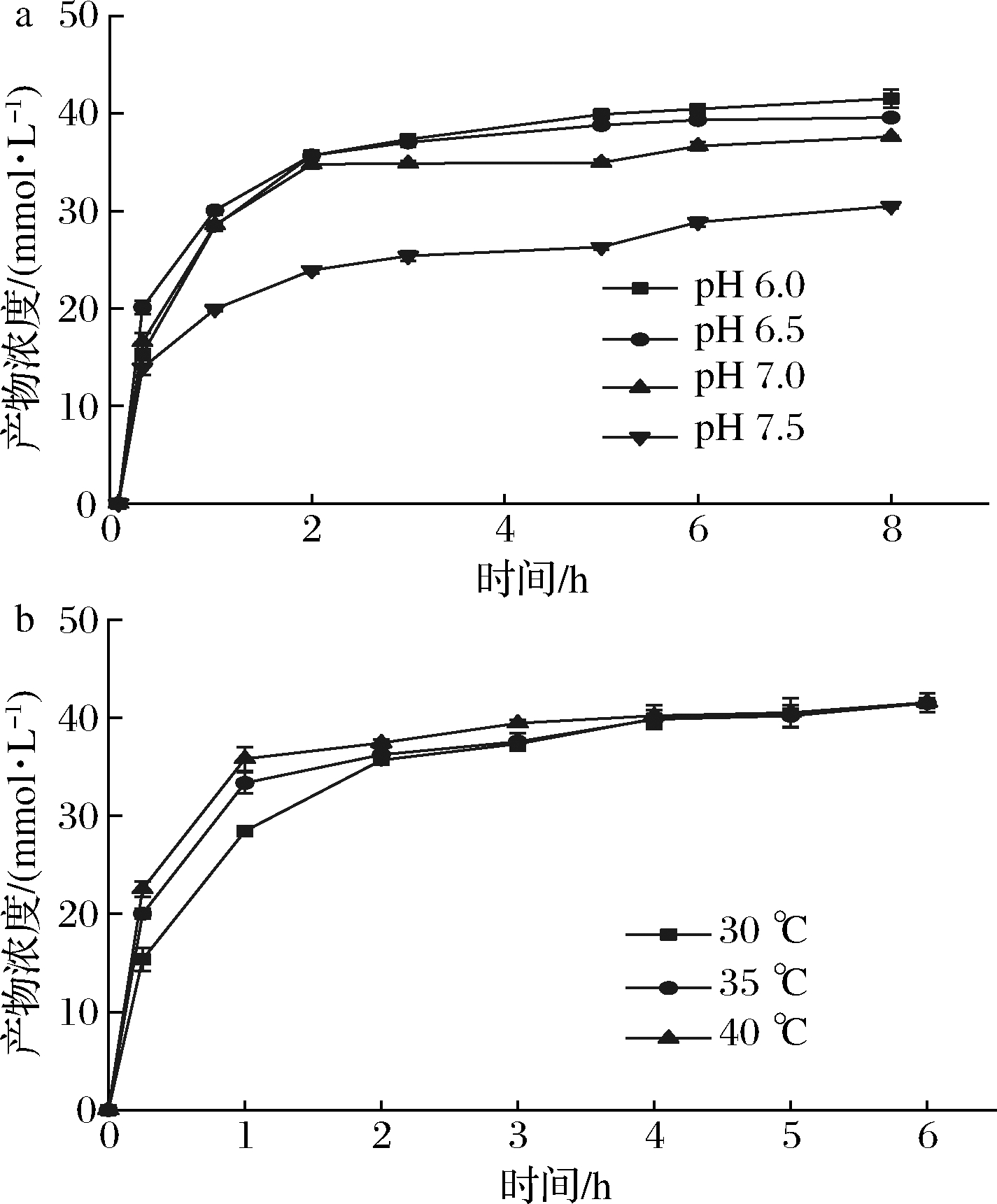
a-pH对可逆反应平衡常数的影响;b-温度对可逆反应平衡常数的影响
图8 pH和温度对可逆反应平衡常数的影响
Fig.8 The effect of pH and temperature on the equilibrium constant of the reversible reaction
3 结论与讨论
本文研究了氨氧化亚硝化螺菌来源的蔗糖合酶在大肠杆菌中的异源表达、纯化及酶学性质分析。此外,还利用纯化得到NmSuSy实现了UDP-葡萄糖的大量合成,为糖生物学的研究提供了更为经济的供体底物原料。在确定的最佳反应条件下(pH 6.0、40 ℃),100 mg/L的NmSuSy催化反应1 h可生成35.8 mmol/L(20.2 g/L)的UDP-葡萄糖,反应6 h可达到平衡状态,生成41.5 mmol/L(23.5 g/L)的UDP-葡萄糖。此研究成果为后续进一步实现UDP-葡萄糖的高效合成奠定了基础,如通过流加底物来提高反应速率,提高UDP利用率;也可通过酶的固定化,提高酶的耐酸性、耐高温性从而获得更高的反应平衡常数和更快的反应速度。本研究也为蔗糖合酶走向工业化应用,提供了重要的理论支持。
[1] KRASNOVA L, WONG C H.Understanding the chemistry and biology of glycosylation with glycan synthesis[J] Annual Review of Biochemistry, 2016, 85:599-630.
[2] NEUFELD E F, HASSID W Z.Biosynthesis of saccharides from glycopyranosyl esters of nucleotides ("sugar nucleotides")[J].Advances in Carbohydrate Chemistry, 1963, 18:309-356.
[3] DESMET T, SOETAERT W, BOJAROV P, et al.Enzymatic glycosylation of small molecules:Challenging substrates require tailored catalysts[J].Chemistry A European Journal, 2012, 18(35):10 786-10 801.
P, et al.Enzymatic glycosylation of small molecules:Challenging substrates require tailored catalysts[J].Chemistry A European Journal, 2012, 18(35):10 786-10 801.
[4] GANTT R W, PELTIER-PAIN P, THORSON J S.Enzymatic methods for glyco(diversification/randomization) of drugs and small molecules[J].Natural Product Reports, 2011, 28(11):1 811-1 853.
[5] ZHAO L T, MA Z B, YIN J, et al.Biological strategies for oligo/polysaccharide synthesis:Biocatalyst and microbial cell factory[J].Carbohydrate Polymers, 2021, 258:117695.
[6] EIXELSBERGER T, NIDETZKY B.Enzymatic redox cascade for one-pot synthesis of uridine 5′-diphosphate xylose from uridine 5′-diphosphate glucose[J].Advanced Synthesis & Catalysis, 2014, 356(17):3 575-3 584.
[7] MENG D H, DU R R, CHEN L Z, et al.Cascade synthesis of uridine-5′-diphosphate glucuronic acid by coupling multiple whole cells expressing hyperthermophilic enzymes[J].Microbial Cell Factories, 2019, 18(1):118.
[8] PEI J J, CHEN A N, SUN Q, et al.Construction of a novel UDP-rhamnose regeneration system by a two-enzyme reaction system and application in glycosylation of flavonoid[J].Biochemical Engineering Journal, 2018, 139:33-42.
[9] WANG X J, LIU R L, ZHU W C, et al.UDP-glucose accelerates SNAI1 mRNA decay and impairs lung cancer metastasis[J].Nature, 2019, 571(7 763):127-131.
[10] CAI L.Recent progress in enzymatic synthesis of sugar nucleotides[J].Journal of Carbohydrate Chemistry, 2012, 31(7):535-552.
[11] DE BRUYN F, MAERTENS J, BEAUPREZ J, et al.Biotechnological advances in UDP-sugar based glycosylation of small molecules[J].Biotechnology Advances, 2015, 33(2):288-302.
[12] DAUDÉ D, REMAUD-SIMÉON M, ANDRÉ I.Sucrose analogs:An attractive (bio)source for glycodiversification[J].Natural Product Reports, 2012, 29(9):945-960.
[13] CHU J L, YUE J H, QIN S, et al.Biocatalysis for rare ginsenoside Rh2 production in high level with co-immobilized UDP-glycosyltransferase Bs-YjiC Mutant and sucrose synthase AtSuSy[J].Catalysts, 2021, 11(1):132.
[14] PEI J J, SUN Q, GU N, et al.Production of isoorientin and isovitexin from luteolin and apigenin using coupled catalysis of glycosyltransferase and sucrose synthase[J].Applied Biochemistry and Biotechnology, 2020, 190(2):601-615.
[15] TROBO-MASEDA L, ORREGO A H, GUISAN J M, et al.Coimmobilization and colocalization of a glycosyltransferase and a sucrose synthase greatly improves the recycling of UDP-glucose:Glycosylation of resveratrol 3-O-β-D-glucoside[J].International Journal of Biological Macromolecules, 2020, 157:510-521.
[16] ORREGO A H, TROBO-MASEDA L, ROCHA-MARTIN J, et al.Immobilization-stabilization of a complex multimeric sucrose synthase from Nitrosomonas europaea synthesis of UDP-glucose[J].Enzyme and Microbial Technology, 2017, 105:51-58.
[17] GUTMANN A, NIDETZKY B.Unlocking the potential of leloir glycosyltransferases for applied biocatalysis:Efficient synthesis of uridine 5′-diphosphate-glucose by sucrose synthase[J].Advanced Synthesis & Catalysis, 2016, 358(22):3 600-3 609.
[18] 魏清江, 马张正, 勒思, 等.柑橘磷酸蔗糖合酶基因CsSPS的鉴定和表达[J].园艺学报, 2020, 47(2):334-344.
WEI Q J, MA Z Z, LE S, et al.Identification and expression analysis of sucrose-phosphate synthase(SPS) genes in Citrus[J].Acta Horticulturae Sinica, 2020, 47(2):334-344.
[19] 李慧婧, 魏玉梅, 吴慧昊.苦荞蔗糖合酶SuSy基因在大肠杆菌中的表达及其纯化[J].甘肃农业大学学报, 2020, 55(3):71-77.
LI H J, WEI Y M, WU H H.Expression of sucrose synthase gene from buckwheat(Fagopyrum tataricum)in Escherichia coli and its purification[J].Journal of Gansu Agricultural University, 2020, 55(3):71-77.
[20] BUNGARUANG L, GUTMANN A, NIDETZKY B.Leloir glycosyltransferases and natural product glycosylation:Biocatalytic synthesis of the C-glucoside nothofagin, a major antioxidant of redbush herbal tea[J].Advanced Synthesis & Catalysis, 2013, 355(14-15):2 757-2 763.
[21] SCHMÖLZER K, GUTMANN A, DIRICKS M, et al.Sucrose synthase:A unique glycosyltransferase for biocatalytic glycosylation process development[J].Biotechnology Advances, 2016, 34(2):88-111.
[22] WAFFENSCHMIDT S, JAENICKE L.Assay of reducing sugars in the nanomole range with 2, 2′-bicinchoninate[J].Analytical Biochemistry, 1987, 165(2):337-340.
[23] ZHANG L, GAO Y N, LIU X F, et al.Mining of sucrose synthases from Glycyrrhiza uralensis and their application in the construction of an efficient UDP-recycling system[J].Journal of Agricultural and Food Chemistry, 2019, 67(42):11 694-11 702.
[24] 马俊, 安启坤, 唐文竹.菊粉外切酶的异源表达、纯化及酶学性质[J].食品与发酵工业, 2019, 45(4):25-30.
MA J, AN Q K, TANG W Z.Heterelogous expression, purification and characterization of an exo-inulinase from Paenibacillus sp.Lfos 16[J].Food and Fermentation Industries, 2019, 45(4):25-30.
[25] ALMAGRO G, BAROJA-FERN NDEZ E, MU
NDEZ E, MU OZ F J, et al.No evidence for the occurrence of substrate inhibition of Arabidopsis thaliana sucrose synthase-1 (AtSUS1) by fructose and UDP-glucose[J].Plant Signaling & Behavior, 2012, 7(7):799-802.
OZ F J, et al.No evidence for the occurrence of substrate inhibition of Arabidopsis thaliana sucrose synthase-1 (AtSUS1) by fructose and UDP-glucose[J].Plant Signaling & Behavior, 2012, 7(7):799-802.
[26] BAROJA-FERN NDEZ E, JOSE MU
NDEZ E, JOSE MU OZ F J, LI J, et al.Sucrose synthase activity in the sus1/sus2/sus3/sus4 arabidopsis mutant is sufficient to support normal cellulose and starch production[J].Proceedings of the National Academy of Sciences, 2012, 109(1):321-326.
OZ F J, LI J, et al.Sucrose synthase activity in the sus1/sus2/sus3/sus4 arabidopsis mutant is sufficient to support normal cellulose and starch production[J].Proceedings of the National Academy of Sciences, 2012, 109(1):321-326.
[27] DIRICKS M, DE BRUYN F, VAN DAELE P, et al.Identification of sucrose synthase in nonphotosynthetic bacteria and characterization of the recombinant enzymes[J].Applied Microbiology and Biotechnology, 2015, 99(20):8 465-8 474.
[28] FIGUEROA C M, ASENCI N DIEZ M D, KUHN M L, et al.The unique nucleotide specificity of the sucrose synthase from Thermosynechococcus elongatus[J].FEBS Letters, 2013, 587(2):165-169.
N DIEZ M D, KUHN M L, et al.The unique nucleotide specificity of the sucrose synthase from Thermosynechococcus elongatus[J].FEBS Letters, 2013, 587(2):165-169.
[29] ALBERTY R A.Effect of pH and metal ion concentration on the equilibrium hydrolysis of adenosine triphosphate to adenosine diphosphate[J].Journal of Biological Chemistry, 1968, 243(7):1 337-1 343.