酱香风味是经微生物发酵产生,由酸类、醇类、醛类、酮类、酚类、吡嗪类等多种风味物质共同发挥作用形成的一种复合香味[1]。研究人员对比各种香型白酒的风味物质发现,吡嗪类化合物在酱香型白酒中种类多且含量丰富[2],其中以四甲基吡嗪(tetramethylpyrazine,TTMP)和2,5-二甲基吡嗪(2,5-dimethylpyrazine,2,5-DMP)较突出。TTMP呈泡豆子水气味[3],其46%酒精水溶液具有甜香、水果香、花香[4],在微生物发酵体系中,由乙偶姻和氨基酸脱下的氨作用生成[5];2,5-DMP呈炒花生的烘焙香味和巧克力、奶油的气味[6],在46%酒精水溶液中呈青草、炒豆香[2],在微生物发酵过程中,由L-苏氨酸脱氢酶(L-threonine dehydrogenase,L-TDH)以L-苏氨酸为底物生成[7-9]。据报道,吡嗪类物质减少,酱香风味会消失[10],表明该物质在白酒风味中对其他香味物质有重要的衬托、叠加作用,可使白酒香气更加丰厚、饱满[11-13]。
枯草芽孢杆菌(Bacillus subtilis)是重要的工业发酵生产菌种[14-15],针对B. subtilis现主要通过CRISPR/Cas9系统[16]、Cre-LoxP定点重组系统和重叠延伸PCR技术相结合[17]实现对B. subtilis的基因敲除,但国内外大多数研究人员仍采用传统的同源重组敲除技术。
本实验室在前期对酱香风味的研究工作中发现,在酱香风味更加浓郁、突出的发酵物中2,5-DMP相对含量较高,TTMP相对含量较低,而在酱香味不突出的发酵物中则相反。由此推测,2,5-DMP可能是对酱香风味起主要烘托作用的吡嗪类物质。因此,本研究以可使发酵物产生浓郁、纯正酱香风味的B.subtilis E20为原始菌株,使用同源重组技术敲除tdh基因,然后进行产酱香模拟发酵,对发酵物进行闻香评价、风味物质检测及特征香气成分评价,以期了解2,5-DMP在酱香风味呈味中的重要性,有助于了解固态发酵中酱香风味的形成。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
枯草芽孢杆菌B. subtilis E20、枯草芽孢杆菌B. subtilis 1S101由贵州大学微生物学实验室分离并保存;埃希氏大肠杆菌E.coli DH5α、质粒pUC18购自TakaRa公司;质粒pUC18-CAT、pUC18-HR-CAT、pUC18-HL-CAT-HR,本研究构建。
1.1.2 引物
实验所用引物如表1所示。
表1 实验所用引物
Table 1 Primers used in the experiment

引物序列(5'→3')和酶切位点CAT-FCGCGGATCCTCATGTTTGACAGCTTATCAT(BamHⅠ)CAT-RCGGGGTACCGCTCTCCCTTATGCGACTCCT(KpnⅠ)HL-FCCGGAATTCAGCGGAGTTGTGATTGAC(EcoRⅠ)HL-RGCCGGTACCAATGGGAACTTCAGTCAGC(KpnⅠ)HR-FCGCGGATCCTTCCGTTAGAGGAGTTTG(BamHⅠ)HR-RCCCAAGCTTATTCCGTCAATAATAGAGGC(HindⅢ)TEST-FAAACAAATAAAGCATTCTCAACTEST-RGTCAATAATAGAGGCATGGTTCRV-M-FGAGCGGATAACAATTTCACACAGGM13-47-RCGCCAGGGTTTTCCCAGTCACGAC
1.1.3 试剂与仪器
氯霉素,北京索莱宝科技有限公司;Green Taq Mix、基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒,南京诺唯赞生物科技有限公司;DNA Marker、限制性内切酶、T4 DNA Ligase,TakaRa公司;其他试剂,国产或进口分析纯。
T100TM PCR仪、GDXR+凝胶成像仪,美国Bio-Rad公司;DYY-4C核酸电泳仪,北京六一仪器厂;ZWYR-D2403真彩触摸屏三单元叠加振荡器,上海智城分析仪器制造有限公司;HP-5MS色谱柱、HP6890/5975C GC-MS,美国安捷伦公司;2 cm-50/30 μm DVB/CAR/PDMS StableFlex萃取纤维,美国Supelco公司。
1.1.4 培养基
牛肉膏蛋白胨固体培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,琼脂20,pH 7.0~7.2,121 ℃灭菌20 min。
牛肉膏蛋白胨液体培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,pH 7.0~7.2,121 ℃灭菌20 min。
LB液体培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 10,pH 7.0,121 ℃灭菌20 min。
LB固体培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 10,琼脂粉20,pH 7.0,121 ℃灭菌20 min。
黄豆发酵培养基:选用市售优质黄豆,用自来水浸泡24 h,按每瓶50 g分装于250 mL三角瓶中,棉塞密封,121 ℃灭菌30 min,冷却至室温待用。
1.2 实验方法
1.2.1 敲除载体的构建
以含氯霉素乙酰转移酶(chloramphenicol acetyltransferase,CAT)基因(cat)的B.subtilis 1S101基因组DNA为模板,用引物CAT-F/R进行PCR扩增获得cat基因序列;以野生菌株B.subtilis E20基因组DNA为模板,使用tdh基因同源左臂引物HL-F/R、同源右臂引物HR-F/R扩增基因序列,将上述片段连入pUC18,并转化到E.coli DH5α感受态细胞中,构建敲除载体pUC18-HL-CAT-HR。
1.2.2 基因敲除菌株的构建
将构建成功的敲除载体pUC18-HL-CAT-HR转化至E20感受态细胞中,E20感受态细胞的制备及转化按照文献描述的方法[18]。将转化产物涂布于含有5 μg/mL氯霉素的LB固体平板上,37 ℃培养过夜。使用验证引物TEST-F/R对挑取的阳性转化子进行菌落PCR、基因组DNA PCR和测序鉴定,将鉴定为重组型的菌株命名为E20-Δtdh。
1.2.3 产酱香模拟发酵方法
从牛肉膏蛋白胨固体平板上挑取野生菌株E20、突变菌株单菌落接种于牛肉膏蛋白胨液体培养基中,150 r/min、37 ℃振荡培养24 h。用移液枪吸取1 mL种子菌液接种于黄豆发酵培养基中,振荡均匀后置于恒温培养箱中,模拟产酱香升温发酵,温度控制方法依次为30、35、40、45、50、55 ℃各24 h。
1.2.4 挥发性风味物质的检测
运用顶空固相微萃取装置联合GC-MS对野生菌株、突变菌株的黄豆发酵物进行检测分析。取捣碎后混匀样品3 g,置于25 mL固相微萃取仪采样瓶中,插入装有2 cm-50/30 μm DVB/CAR/PDMS StableFlex纤维头的手动进样器,在65 ℃的平板加热条件下顶空萃取60 min,移出萃取头并立即插入GC进样口(250 ℃)中,热解析进样。GC条件:色谱柱为HP-5MS(60 m×0.25 mm,0.25 μm)弹性石英毛细管柱,初始温度 40 ℃(保留2 min),以3.5 ℃/min升温至180 ℃;以10 ℃/min升温至260 ℃,运行时间:50 min;汽化室温度250 ℃;载气为高纯He(99.999%);柱前压15.85 psi,载气流量1.0 mL/min,分流10∶1,溶剂延迟时间:3 min。MS条件:EI离子源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 847 V;接口温度280 ℃;质量范围29~500 amu。对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist 17和Wiley 275标准质谱图,用峰面积归一化法测定各化学成分的相对质量分数。
1.2.5 特征香气成分评价方法
目前许多学者主要参考刘登勇等[19]的气味活度值(odor activity value,OAV)法评价各挥发性成分对样品总体香气的贡献。为筛选出所检出风味物质中OAV最高的若干种挥发性风味化合物,可用这些化合物的相对百分含量(C)进行分析[20]。因此,参考解春芝[20]的方法采用相对风味活度值(relative OAV,ROAV)定义对样品风味贡献最大的组分:ROAVmax=100。其他风味成分ROAV计算如公式(1)所示:
(1)
式中:Ci、Ti分别为各挥发性物质的相对百分含量和相对应的感觉阈值,Cmax、Tmax分别为对样品总体风味贡献最大组分的相对百分含量和相对应的感觉阈值。
所有组分均满足0
2 结果与分析
2.1 敲除载体的构建
分别以1S101和E20的基因组DNA为模板,PCR扩增获得CAT、tdh基因同源左臂(HL)和同源右臂(HR)片段,3个片段的大小分别为1 539、892、511 bp。将CAT、HL、HR目的片段采用双酶切、酶连接的方法分步接入pUC18,转化至E.coli DH5α中;从氯霉素(25 μg/mL)LB固体平板上挑选单菌落进行PCR及质粒双酶切(EcoR I、Kpn I)鉴定,结果显示2条明显的与预期相符的条带(4 736、892 bp)(图1);同时测序结果显示,构建的敲除质粒序列同预期一致,表明pUC18-HL-CAT-HR载体构建成功,构建流程如图2所示。
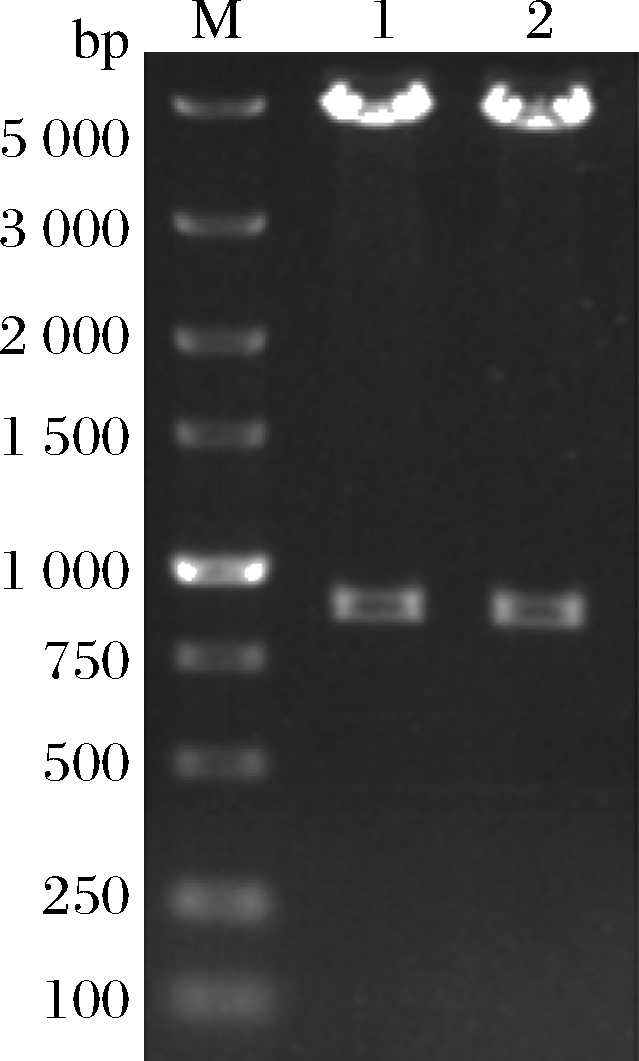
M-DL 5 000 marker;1~2-pUC18-HL-CAT-HR质粒平行样
图1 pUC18-HL-CAT-HR质粒双酶切
Fig.1 pUC18-HL-CAT-HR plasmid double enzyme digestion
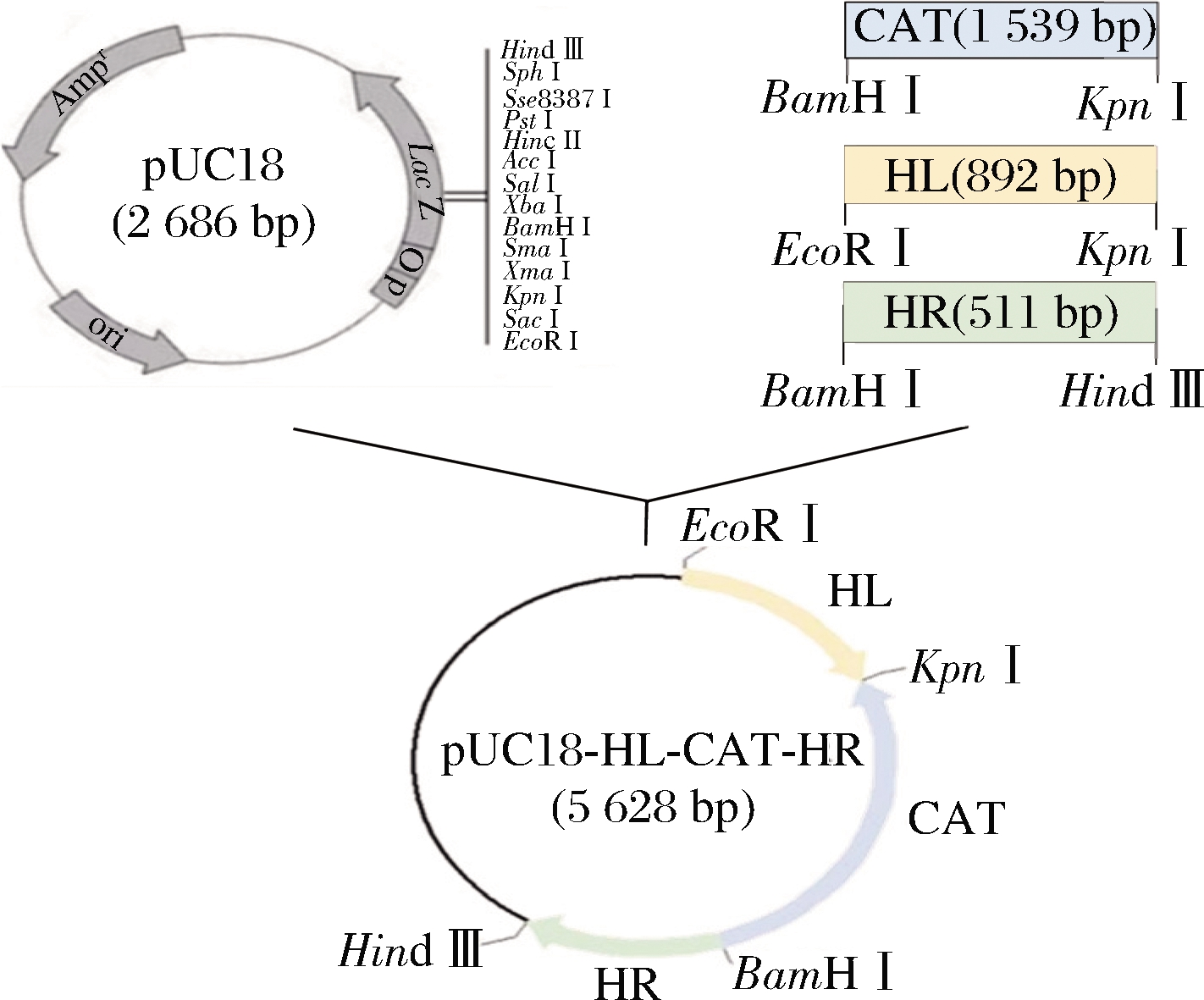
图2 敲除质粒pUC18-HL-CAT-HR构建流程
Fig.2 Knockout plasmid pUC18-HL-CAT-HR construction process
2.2 基因敲除菌株的获得及验证
检测引物TEST-F/R(表1)位于tdh基因同源左臂上游、同源右臂下游。使用引物TEST进行PCR验证原始菌株和敲除菌株,片段大小为2 760、3 407 bp。挑取经菌落PCR验证为阳性交换的突变菌株进行基因组DNA PCR,获得条带单一、明亮且片段大小为3 407 bp左右的目的条带(图3),且测序结果表明,突变菌株中的tdh基因已成功被敲除载体上的cat基因替换,表明突变菌株E20-Δtdh构建成功。
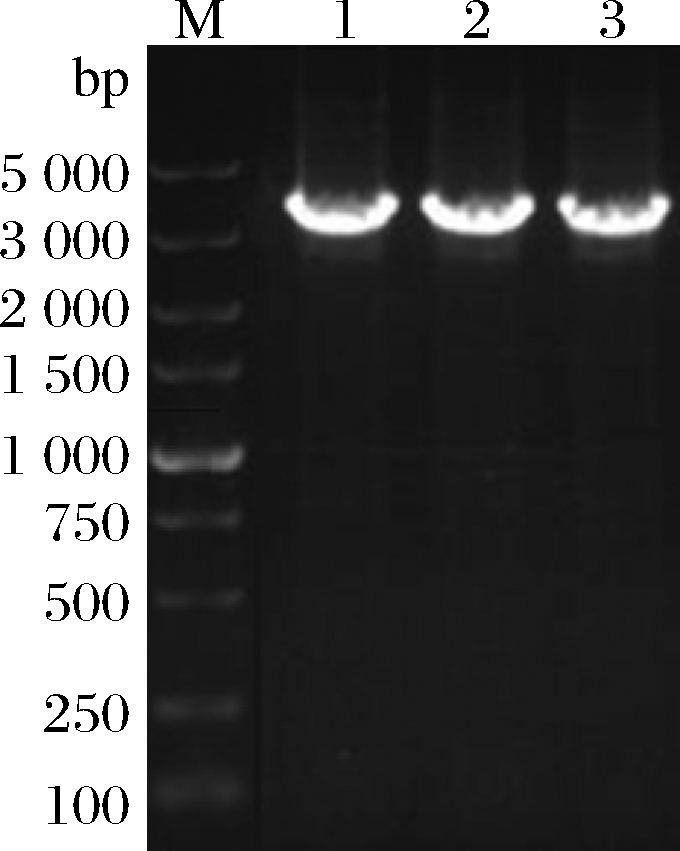
M-DL 5 000 marker;1~3-E20-Δtdh基因组DNA平行样
图3 E20-Δtdh基因组DNA PCR
Fig.3 E20-Δtdh genomic DNA PCR
为确保突变菌株E20-Δtdh具有遗传稳定性,使用抗性平板进行划线传代培养(传至12代),提取基因组进行PCR验证,均获得了大小为3 407 bp左右的片段(图4),表明突变菌株E20-Δtdh遗传性稳定。
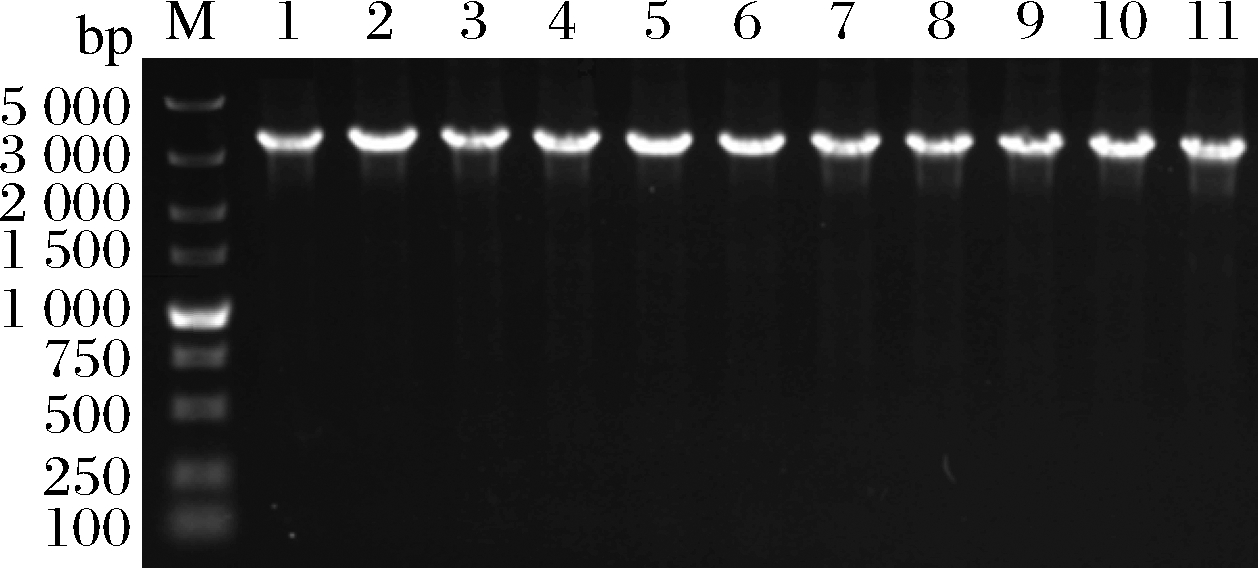
M-DL 5 000 marker;1~11-2~12代E20-Δtdh菌株基因组
图4 E20-Δtdh基因组PCR
Fig.4 E20-Δtdh genomic PCR
2.3 酱香模拟发酵物感官评价
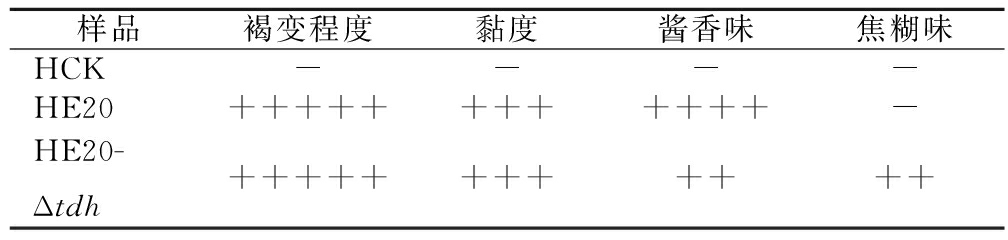
使用野生菌株E20、突变菌株E20-Δtdh分别对黄豆发酵培养基进行产酱香模拟发酵,以加入等量无菌水的黄豆发酵培养基为空白对照,发酵结束后对发酵物进行感官评价(表2、图5)。添加无菌水的空白对照样品(HCK)主要呈黄豆的甜香味;经野生菌株E20发酵的黄豆发酵培养基(HE20)褐变极为明显,最终呈棕褐色或黑褐色,有浓郁、纯正的酱香风味,有大量的黏液产生;由突变菌株E20-Δtdh发酵的黄豆发酵培养基(HE20-Δtdh)褐变程度与HE20一致,同样有大量黏液产生,但酱香味比HE20略淡,有焦糊味产生。

图5 酱香模拟发酵后的黄豆发酵培养基
Fig.5 Soybean fermentation medium after Maotai flavor simulated fermentation
表2 酱香模拟物发酵感官评价
Table 2 Sensory evaluation on fermentation of Maotai flavor simulants
样品褐变程度黏度酱香味焦糊味HCK----HE20++++++++++++-HE20-Δtdh++++++++++++
注:“-”表示无;“+”表示有且数量表示强度
2.4 挥发性风味物质的检测与分析
黄豆发酵物HCK、HE20、HE20-Δtdh的总离子流色谱图如图6所示。
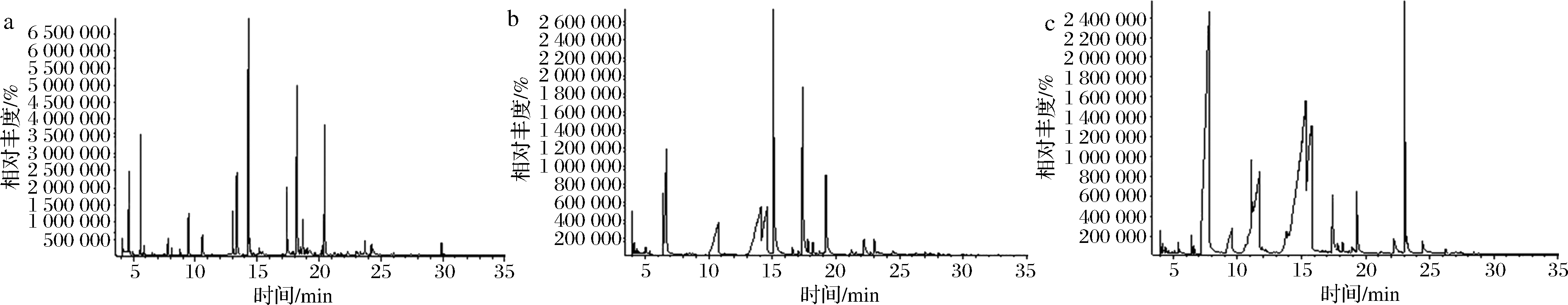
a-HCK;b-HE20;c-HE20-Δtdh
图6 黄豆发酵物风味物质的GC-MS总离子流色谱图
Fig.6 GC-MS total ion flow chromatography of flavor compounds in soybean fermentation products
由表3可知,使用微生物和不使用微生物进行发酵,主体风味成分有较大的差异。在HCK、HE20和HE20-Δtdh中分别检测出了61、38、34种挥发性风味成分。HCK的吡嗪类物质相对含量与HE20相差19.481%,差异显著,与HE20-Δtdh相差3.392%,差异不显著。与HCK相比,HE20和HE20-Δtdh中的烷烃类、烯类、醇类、呋喃类、苯类、酚类、醚类、其他类物质的总量都较低,但酸类物质总量有所增加,在HE20-Δtdh中,酸类物质含量高达86.474%。
表3 HCK、HE20、HE20-Δtdh中的挥发性成分
Table 3 Relative content of volatile components in HCK, HE20 and HE20-Δtdh

序号化合物名称HCKHE20HE20-Δtdh1正己烷4.572±0.987--2辛烷0.060±0.008--3庚烷0.254±0.052--4烷烃类十二烷0.069±0.014b0.337±0.039a0.071±0.018b5十三烷0.059±0.011--63-甲基十三烷0.071±0.012--7十四烷0.160±0.065a0.099±0.018ab0.032±0.008b共计 5.245±1.137a0.436±0.049b0.102±0.024b8乙醛0.302±0.011b0.396±0.043a0.172±0.031c9十二醛0.247±0.079--102-甲基丙醛-0.218±0.044a0.032±0.019b113-甲基丁醛0.215±0.016b1.816±0.331a0.245±0.035b122-甲基丁醛0.215±0.016b4.961±0.852a0.132±0.025b13戊醛0.148±0.018--14醛类 己醛0.847±0.048--15(E)-2-己烯醛0.193±0.018--16苯甲醛6.694±1.683b10.534±2.594a1.867±0.340c
续表3

序号化合物名称HCKHE20HE20-Δtdh17苯乙醛-0.591±0.181a0.084±0.015b18甲硫基丙醛-0.061±0.011-19辛醛0.456±0.199--20壬醛1.433±0.211--21癸醛0.192±0.033--共计 10.942±2.195b18.576±4.007a2.531±0.452c22苯乙烯16.871±2.949--23烯烃类柠檬烯9.910±2.029a0.095±0.015b0.040±0.006b24(E)-4,8-二甲基壬-1,3,7-三烯0.981±0.169--共计 27.762±4.890a0.095±0.015b0.040±0.006b25酮类 丙酮0.187±0.013a0.066±0.008b0.035±0.015c262,3-丁二酮0.291±0.015a0.111±0.028c0.16±0.025b273-辛酮0.817±0.204a0.064±0.014b0.026±0.007b28苯乙酮0.201±0.012c2.029±0.229a0.577±0.121b29(E,E)-3,5-辛二烯-2-酮0.546±0.168--306-甲基-2-庚酮-0.301±0.103-31苄基甲基酮-0.127±0.019-323,5-辛二烯-2-酮0.726±0.213--共计 2.768±0.585a2.698±0.388a0.798±0.167b33乙酸甲酯0.273±0.024--34乙酸乙酯0.580±0.021--35丁酸甲酯0.566±0.044--36丁酸乙酯1.607±0.116--37乙酸丁酯0.089±0.007--38酯类 2-丙烯酸丁酯0.672±0.164--39三硫化二甲酯0.530±0.162b0.899±0.177a0.169±0.025c40己酸乙酯0.613±0.165--41苯乙酸甲酯-0.391±0.082a0.086±0.02b422-甲基丙酸戊酯--0.214±0.01543乙酸己酯0.265±0.103--共计 5.194±0.683a1.290±0.259b0.469±0.054b44乙醇0.566±0.038a0.214±0.086b0.152±0.026c45(Z)-3-己烯-1-醇0.255±0.021--461-辛烯-3-醇19.388±3.835a0.804±0.101b0.228±0.02b47醇类 3-甲基-1-丁醇-0.100±0.022-48苯甲醇-0.074±0.007-49苯乙醇-0.780±0.174a0.608±0.166a502,3-丁二醇--1.113±0.090513-辛醇0.418±0.205a0.075±0.016b0.265±0.068ab共计 20.627±3.968a2.048±0.394b2.366±0.363b52甲基吡嗪0.120±0.016--532,5-DMP1.054±0.311b15.129±3.49a-54吡嗪类三甲基吡嗪0.920±0.162b5.426±1.351a1.48±0.267b55TTMP0.452±0.080b1.232±0.165b4.274±1.003a563-乙基-2,5-DMP-0.240±0.054a0.045±0.007b572,3,5-三甲基-6-乙基吡嗪--0.139±0.022共计 2.546±0.556b22.027±4.442a5.938±0.993b58呋喃2-乙基呋喃0.101±0.009--592-戊基呋喃3.114±0.320a0.193±0.014b0.052±0.014b共计 3.215±0.329a0.193±0.014b0.052±0.014b60苯酚-0.087±0.014-61酚类2-甲氧基苯酚-0.404±0.081b0.52±0.007a62麦芽酚1.701±0.428--共计 1.701±0.428a0.491±0.095b0.520±0.007b63甲苯2.857±0.238--64乙苯3.288±0.724--65对二甲苯7.665±1.084--66芳香族邻二甲苯1.288±0.357--672-丙烯基苯0.074±0.019--68丙苯0.154±0.027--
续表3
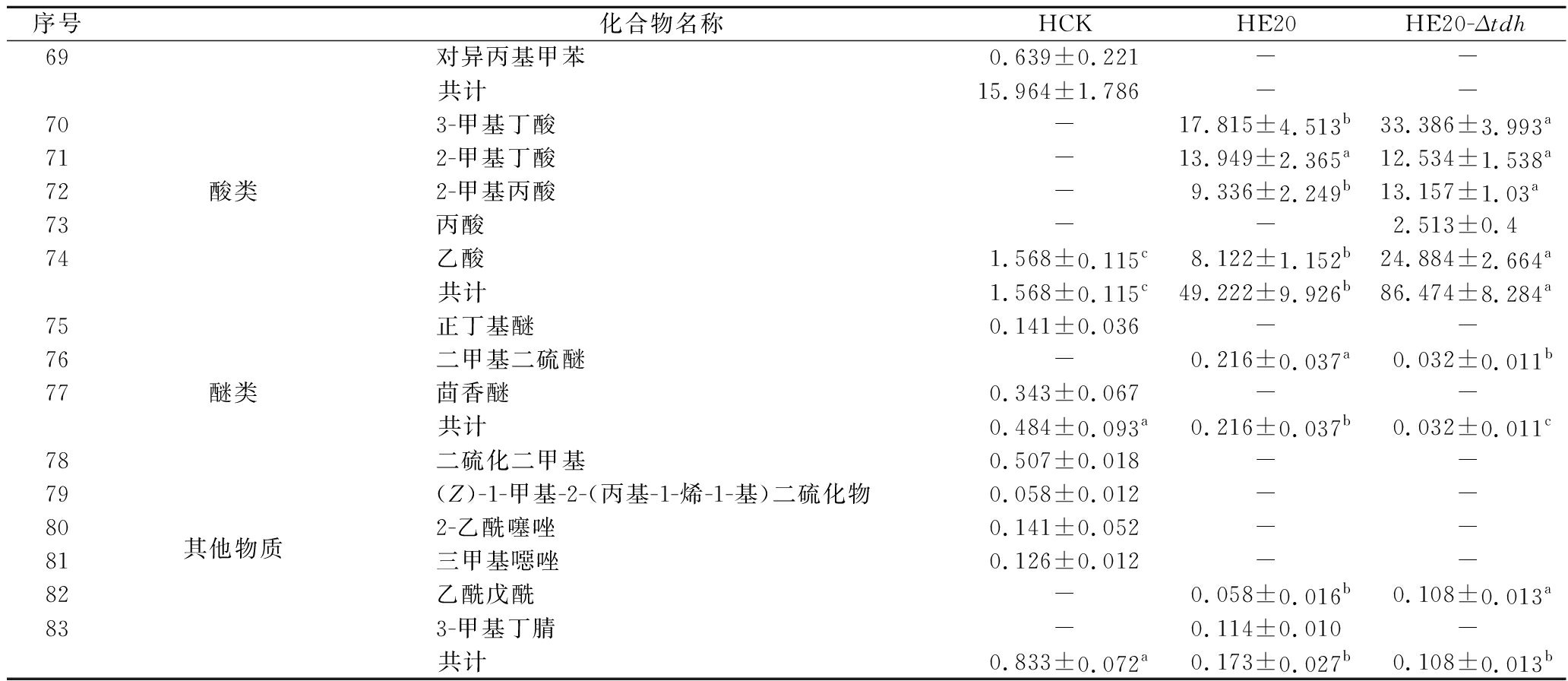
序号化合物名称HCKHE20HE20-Δtdh69对异丙基甲苯0.639±0.221--共计 15.964±1.786--703-甲基丁酸-17.815±4.513b33.386±3.993a712-甲基丁酸-13.949±2.365a12.534±1.538a72酸类2-甲基丙酸-9.336±2.249b13.157±1.03a73丙酸--2.513±0.474乙酸1.568±0.115c8.122±1.152b24.884±2.664a共计 1.568±0.115c49.222±9.926b86.474±8.284a75正丁基醚0.141±0.036--76二甲基二硫醚-0.216±0.037a0.032±0.011b77醚类茴香醚0.343±0.067--共计 0.484±0.093a0.216±0.037b0.032±0.011c78二硫化二甲基0.507±0.018--79(Z)-1-甲基-2-(丙基-1-烯-1-基)二硫化物0.058±0.012--80其他物质2-乙酰噻唑0.141±0.052--81三甲基噁唑0.126±0.012--82乙酰戊酰-0.058±0.016b0.108±0.013a833-甲基丁腈-0.114±0.010-共计 0.833±0.072a0.173±0.027b0.108±0.013b
注:同行数字后不同小写字母代表差异显著(P<0.05);“-”表示未检测到该物质(下同)
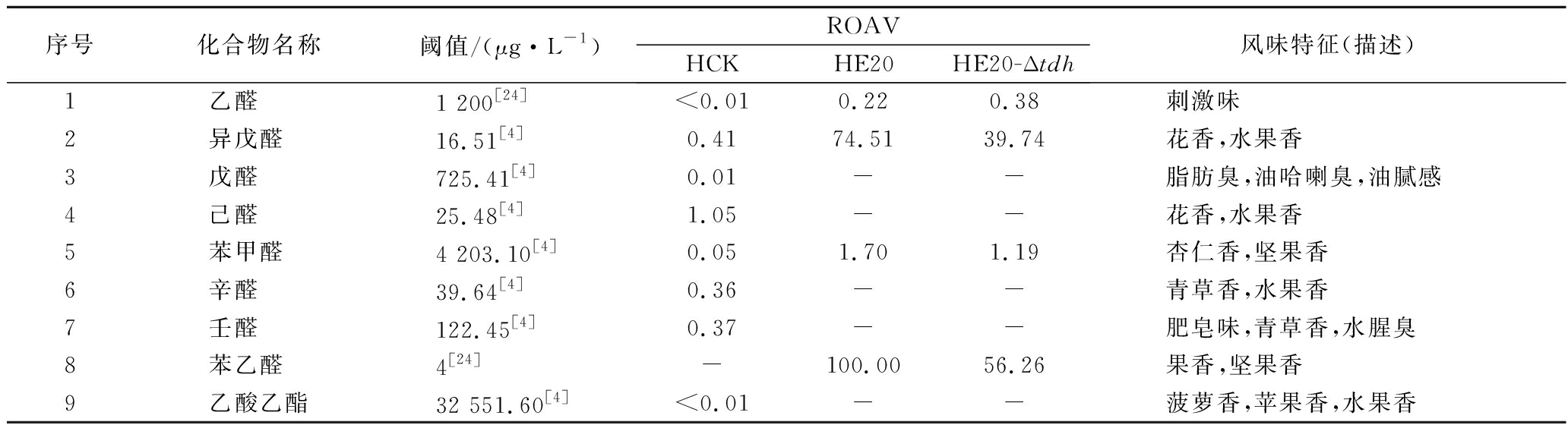
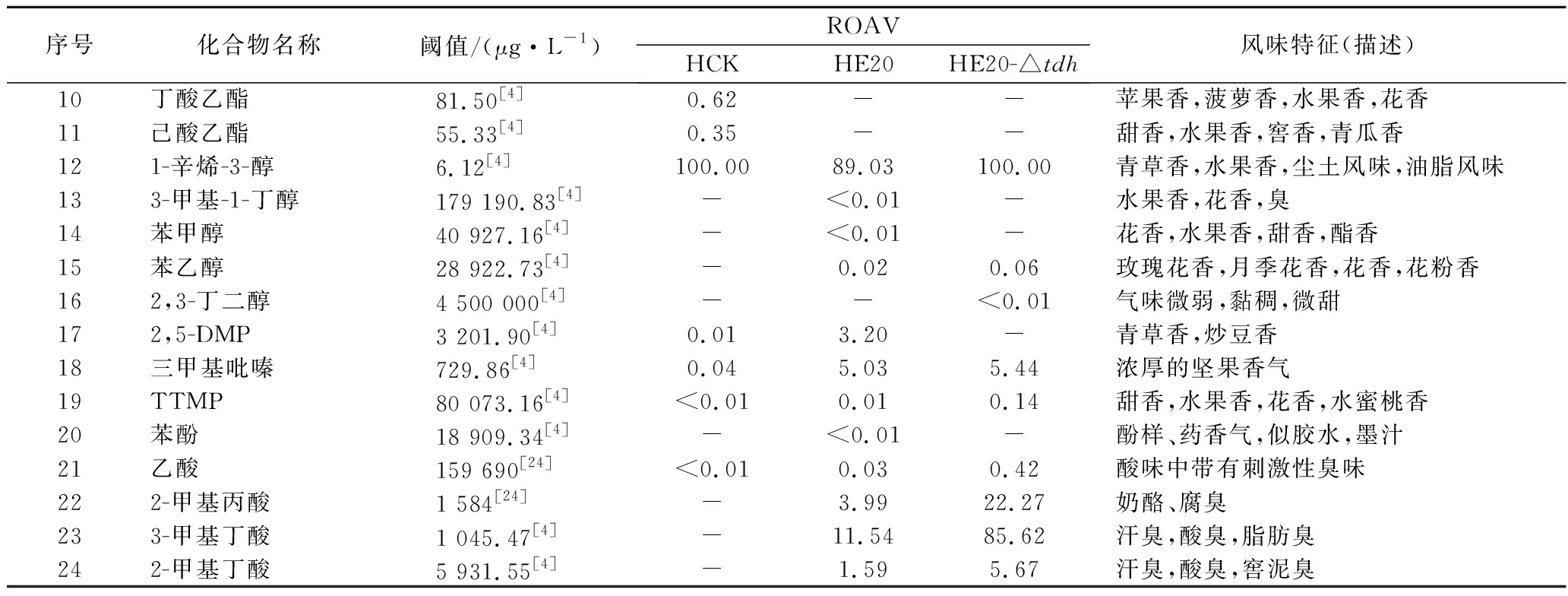
风味物质对总体风味的贡献不仅取决于其含量,还取决于其气味阈值。通过查询,共找到24种挥发性风味化合物气味阈值;进行ROAV分析,结果如表4所示,HCK中ROAV>1的物质有1-辛烯-3-醇和己醛,是HCK中的关键风味化合物,1-辛烯-3-醇呈青草香、水果香、蘑菇香,己醛具有花香、水果香;对总体风味有修饰作用的物质有异戊醛、辛醛、壬醛、丁酸乙酯和己酸乙酯(0.1≤ROAV<1),它们均具有花香、水果香、甜香味,与嗅闻到的黄豆甜香味相符。
表4 HCK、HE20、HE20-Δtdh中挥发性物质的阈值及ROAV
Table 4 Threshold and ROAV of volatile substances in HCK, HE20, HE20-Δtdh
序号化合物名称阈值/(μg·L-1)ROAVHCKHE20HE20-Δtdh风味特征(描述)1乙醛 1 200[24]<0.010.220.38刺激味2异戊醛 16.51[4]0.4174.5139.74花香,水果香3戊醛 725.41[4]0.01--脂肪臭,油哈喇臭,油腻感4己醛 25.48[4]1.05--花香,水果香5苯甲醛 4 203.10[4]0.051.701.19杏仁香,坚果香6辛醛 39.64[4]0.36--青草香,水果香7壬醛 122.45[4]0.37--肥皂味,青草香,水腥臭8苯乙醛 4[24]-100.0056.26果香,坚果香9乙酸乙酯32 551.60[4]<0.01--菠萝香,苹果香,水果香
续表4
序号化合物名称阈值/(μg·L-1)ROAVHCKHE20HE20-△tdh风味特征(描述)10丁酸乙酯81.50[4]0.62--苹果香,菠萝香,水果香,花香11己酸乙酯55.33[4]0.35--甜香,水果香,窖香,青瓜香121-辛烯-3-醇6.12[4]100.0089.03100.00青草香,水果香,尘土风味,油脂风味133-甲基-1-丁醇179 190.83[4]-<0.01-水果香,花香,臭14苯甲醇40 927.16[4]-<0.01-花香,水果香,甜香,酯香15苯乙醇28 922.73[4]-0.020.06玫瑰花香,月季花香,花香,花粉香162,3-丁二醇4 500 000[4]--<0.01气味微弱,黏稠,微甜172,5-DMP3 201.90[4]0.013.20-青草香,炒豆香18三甲基吡嗪729.86[4]0.045.035.44浓厚的坚果香气19TTMP80 073.16[4]<0.010.010.14甜香,水果香,花香,水蜜桃香20苯酚18 909.34[4]-<0.01-酚样、药香气,似胶水,墨汁21乙酸159 690[24]<0.010.030.42酸味中带有刺激性臭味222-甲基丙酸1 584[24]-3.99 22.27奶酪、腐臭233-甲基丁酸1 045.47[4]-11.54 85.62汗臭,酸臭,脂肪臭242-甲基丁酸5 931.55[4]-1.59 5.67汗臭,酸臭,窖泥臭
在酱香味纯正、浓郁的HE20中,关键风味化合物(ROAV>1)有苯乙醛、1-辛烯-3-醇、异戊醛、3-甲基丁酸、三甲基吡嗪、2-甲基丙酸、2,5-DMP、苯甲醛、2-甲基丁酸;ROAV在0.1~1的仅有乙醛,有一定的刺激味。酱香味较淡的HE20-Δtdh除缺少了2,5-DMP呈香外,其余关键风味化合物同HE20一致,但ROAV有差异;HE20的异戊醛、苯乙醛、苯甲醛的ROAV分别是HE20-Δtdh的1.9、1.8、1.4倍;HE20-Δtdh的1-辛烯-3-醇、乙酸、2-甲基丙酸、3-甲基丁酸、2-甲基丁酸分别是HE20的1.1、14、5.6、7.4、3.6倍,虽然两者的乙酸ROAV相差倍数最大,但乙酸对总体风味无直接影响。
在HE20、HE20-Δtdh的关键风味化合物中,苯乙醛、异戊醛、苯甲醛主要呈果香、坚果香、花香,关键的酸类风味化合物3-甲基丁酸、2-甲基丙酸、2-甲基丁酸主要呈现酸、汗味等,与在酱香型白酒中检测到的主要酸类化合物相吻合[23-24],三甲基吡嗪、2,5-DMP主要呈浓厚的坚果香气、青草香、炒豆香;结合感官评价(表2),HE20-Δtdh缺少了2,5-DMP,酱香风味不突出,表明该物质在发酵物形成酱香风味中具有十分重要的作用。
吡嗪类化合物对酱香风味的形成具有重要作用。对HE20、HE20-Δtdh中的吡嗪类物质进行T检验(表5),HE20-Δtdh中的三甲基吡嗪和3-乙基-2,5-DMP呈减少趋势,且差异显著;在HE20-Δtdh中检测到少量的2,3,5-三甲基-6-乙基吡嗪(0.139%),在HE20中未检测出。在HE20中检测出大量的2,5-DMP(15.129%)而在HE20-Δtdh中未检测到,表明tdh基因的缺失影响了2,5-DMP的生成;在HE20中检测到的TTMP相对含量并不高,HE20-Δtdh中TTMP相对含量比HE20多出了3.042%,两者差异显著。另一方面,据ROAV分析(表4),2,5-DMP、三甲基吡嗪对发酵物的总体风味有直接影响,TTMP在HE20中对总体风味无显著影响(ROAV<0.1),在HE20-Δtdh对总体风味起修饰作用(0.1≤ROAV<1)。因此推测,在对酱香风味起烘托作用的吡嗪类物质中,2,5-DMP的贡献可能比TTMP的贡献大。
表5 HE20、HE20-Δtdh发酵物中吡嗪类物质相对含量独立样本T检验
Table 5 Independent sample T test for the relative content of pyrazines in HE20 and HE20-Δtdh fermentation
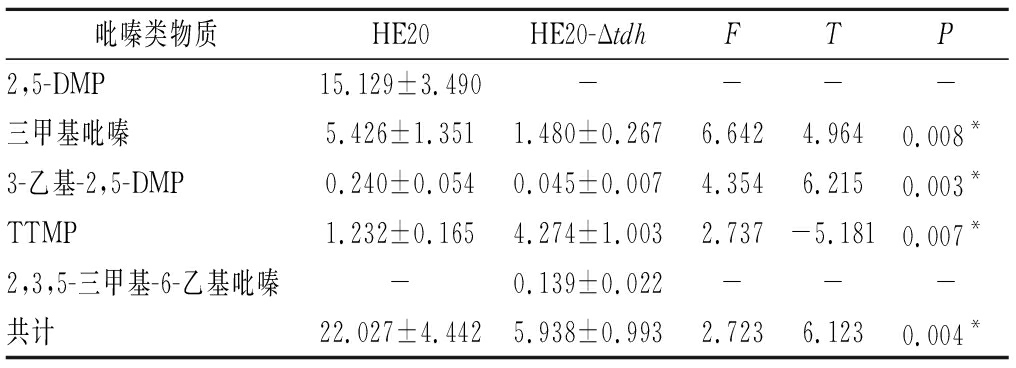
吡嗪类物质HE20HE20-ΔtdhFTP2,5-DMP15.129±3.490----三甲基吡嗪5.426±1.3511.480±0.2676.6424.9640.008*3-乙基-2,5-DMP0.240±0.0540.045±0.0074.3546.2150.003*TTMP1.232±0.1654.274±1.0032.737-5.1810.007*2,3,5-三甲基-6-乙基吡嗪-0.139±0.022---共计22.027±4.4425.938±0.9932.7236.1230.004*
注:*表示差异显著(P<0.05)
3 结论
本研究通过同源重组对1株可使发酵物产生浓郁酱香味的B.subtilis E20菌株的tdh基因进行了基因敲除。将突变菌株与野生菌株接种至黄豆发酵培养基中进行模拟产酱香升温发酵。通过感官评价和顶空固相微萃取联合GC-MS技术分析了发酵物风味的变化,结合ROAV分析发现,野生菌株E20可使黄豆发酵产生浓郁的酱香风味,苯乙醛、1-辛烯-3-醇、异戊醛、3-甲基丁酸、2-甲基丙酸、三甲基吡嗪、2,5-DMP、苯甲醛、2-甲基丁酸为关键挥发性风味化合物。tdh基因敲除后黄豆发酵物酱香味不突出,该基因对黄豆发酵物中的酸类、醛类、吡嗪类挥发性风味物质的相对含量影响较大,未检测到2,5-DMP。通过ROAV分析发现,tdh基因敲除后黄豆发酵物的关键挥发性风味化合物除无2,5-DMP外,其余与野生菌株E20黄豆发酵物的一致。在酱香风味的特征成分——吡嗪类物质中,2,5-DMP、三甲基吡嗪对总体风味有直接影响,TTMP在HE20中对总体风味无显著影响,在HE20-Δtdh对总体风味有修饰作用,表明在对酱香风味起烘托作用的吡嗪类物质中,起主要贡献作用的是2,5-DMP,TTMP对总体风味的修饰作用不大。tdh基因与2,5-DMP的生成密切相关且与酱香风味的形成呈正相关关系,这对进一步研究酱香风味的形成机制有重要意义。
[1] 吴拥军. 酱(豉)香风味的研究进展[J].山地农业生物学报, 2018, 37(6):1-9.
WU Y J.Research porgress of Maotai flavor[J].Journal of Mountain Agriculture and Biology, 2018, 37(6):1-9.
[2] 耿平兰, 孙棣, 寻思颖.酒中吡嗪类物质的检测技术研究进展[J].酿酒科技, 2013(9):90-92.
GENG P L, SUN D, XUN S Y.Progress in the detection of pyrazines in liquor/wine[J].Liquor-Making Science & Technology, 2013(9):90-92.
[3] 杨久玲, 谢和, 杜超峰.一种酱香风味红茶的研制[J].山地农业生物学报, 2017, 36(6):90-94.
YANG J L, XIE H, DU C F.Researching and developmenting a kind of Maotai-flavor black tea[J].Journal of Mountain Agriculture and Biology, 2017, 36(6):90-94.
[4] 范文来, 徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒, 2011, 38(4):80-84.
FAN W L, XU Y.Determination of odor thresholds of volatile aroma compounds in Baijiu by a forced-choice ascending concentration series method of limits[J].Liquor Making, 2011, 38(4):80-84.
[5] 吴建峰. 白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学, 2013.
WU J F.Study on the biosynthesis mechanism of tetramethylpyrazine during the Chinese liquor brewing[D].Wuxi:Jiangnan University, 2013.
[6] 孙宝国, 陈海涛.食用调香术[M].北京:化学工业出版社, 2015.
SYB B G, CHEN H T.The Technology of Food Flavoring[M].Beijing:Chemical Industry Press, 2015.
[7] ITO T, SUGAWARA E, MIYANOHARA J I, et al.Effect of amino acids as nitrogen sources on microbiological formation of pyrazines[J].Nippon Shokuhin Kogyo Gakkaishi, 1989, 36(9):762-764.
[8] LARROCHE C, BESSON I, GROS J B.High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J].Process Biochemistry, 1999, 34(6-7):667-674.
[9] ZHANG L J, CAO Y L, TONG J N, et al.An alkylpyrazine synthesis mechanism involving L-threonine-3-dehydrogenase describes the production of 2,5-dimethylpyrazine and 2,3,5-trimethylpyrazine by Bacillus subtilis[J].Applied and Environmental Microbiology, 2019, 85(24).DOI:10.1128/aem.01807-19.
[10] 郑磊. CotA、alsS基因与酱香相关性研究[D].贵阳:贵州大学, 2014.
ZHENG L.Study on the correlation between CotA, alsS genes and Maotai flavor[D].Guiyang:Guizhou University, 2014.
[11] 徐岩. 基于风味导向技术的中国白酒微生物及其代谢调控研究[J].酿酒科技, 2015(2):1-11;16.
XU Y.Study on liquor-making microbes and the regulation & control of their metabolism based on flavor-oriented technology[J].Liquor-Making Science & Technology, 2015(2):1-11;16.
[12] ZHANG C L, AO Z H, CHUI W Q, et al.Characterization of volatile compounds from Daqu-a traditional Chinese liquor fermentation starter[J].International Journal of Food Science & Technology, 2011, 46(8):1 591-1 599.
[13] 杨久玲. 一种酱香风味红茶制品的研发[D].贵阳:贵州大学, 2018.
YANG J L.Researching and developmenting a kind of Maotai flavor black tea products[D].Guiyang:Guizhou University, 2018.
[14] VAN DIJL J M, HECKER M.Bacillus subtilis:From soil bacterium to super-secreting cell factory[J].Microbial Cell Factories, 2013, 12(1).DOI:10.1186/1475-2859-12-3.
[15] SCHALLMEY M, SINGH A, WARD O P.Developments in the use of Bacillus species for industrial production[J].Canadian Journal of Microbiology, 2004, 50(1):1-17.
[16] ZHANG K, DUAN X G, WU J.Multigene disruption in undomesticated Bacillus subtilis ATCC 6051a using the CRISPR/Cas9 system[J].Scientific Reports, 2016, 6:27943.
[17] 闫新. 枯草杆菌基因一步敲除法的建立和MPH在芽孢杆菌中表达的研究[D].南京:南京农业大学, 2008.
YAN X.Establishment of one-step gene knockout method in Bacillus subtili and studies on MPH expression in Bacillus[D].Nanjing:Nanjing Agricultural University, 2008.
[18] 钟杰. 枯草芽孢杆菌酱(豉)香风味基因的筛选及功能研究[D].贵阳:贵州大学, 2019.
ZHONG J.Screening and functional research on the flavor genes about lobster or soya sauce of Bacillus subtilis[D].Guiyang:Guizhou University, 2019.
[19] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学, 2008, 29(7):370-374.
LIU D Y, ZHOU G H, XU X L."ROAV" method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[20] 解春芝. 基于氨基酸代谢的腐乳酱风味促熟及机理研究[D].贵阳:贵州大学, 2019.
XIE C Z.Study on sufu paste flavor ripening and mechanism based on amino acid metabolism[D].Guiyang:Guizhou University, 2019.
[21] 王丹, 丹彤, 孙天松, 等.SPME-GC-MS结合ROAV分析单菌及复配发酵牛乳中关键性风味物质[J].食品科学, 2017, 38(8):145-152.
WANG D, DAN T, SUN T S, et al.Analysis of key volatile compounds in fermented cow milk produced by pure and mixed cultures by SPME-GC-MS combined with ROAV[J].Food Science, 2017, 38(8):145-152.
[22] 明庭红, 苏秀榕, 周君, 等.基于2种培养基生长的植物乳杆菌发酵草鱼的关键风味比较[J].食品科学, 2016, 37(16):179-186.
MING T H, SU X R, ZHOU J, et al.Comparison of key flavor substances of fermented grass carp with Lactobacillus plantarum based on two growth media[J].Food Science, 2016, 37(16):179-186.
[23] 汪玲玲. 酱香型白酒微量成分及大曲香气物质研究[D].无锡:江南大学, 2013.
WANG L L.Studies on aroma compounds of the Chinese soy sauce liquor and Daqu[D].Wuxi:Jiangnan University, 2013.
[24] 马宇. 基于风味组学策略研究酱香型白酒关键成分及其呈香呈味特性[D].贵阳:贵州大学, 2019.
MA Y.Research on key components of Maotai flavor liquor based on flavoromics strategy and its aroma and taste characteristics[D].Guiyang:Guizhou University, 2019.