多糖是组成细胞的重要成分之一,是除核酸、蛋白质等生物大分子以外组成生命体的主要高分子有机化合物[1-2]。就生产成本而言,对多糖的研究主要来源于藻类微生物,且微生物胞外多糖因其天然来源、稳定性好、可降解性好、毒性低等特点而受到业界的青睐[3-5]。微生物的胞外多糖是菌株在生长代谢调控过程中为适应培养环境而产生的一种糖类聚合物,其在细胞内是由糖基单体通过多种代谢途径,最终在转移酶的作用下形成了胶囊型多糖(荚膜多糖)和松散型多糖(黏液多糖)[6]。
近年来随着糖生物学的发展,微生物胞外多糖因其在产物结构,生产成本,生产周期以及独特性能等方面所体现的优势而得到广泛的研究与开发[7]。不同的胞外多糖具有不同的空间结构和理化性质,这些结构的多样性对胞外多糖的发展应用起到至关重要的作用。目前仅有少数的细菌胞外多糖进行工业化生产,如由土壤杆菌(Agrobacterium sp.)产生热凝胶,鞘氨醇单胞菌(Sphingomonas sp.)产生威兰胶以及野油菜黄单胞杆菌(Xanthomonas Campestris)产生黄原胶[8]。据报道,微生物胞外多糖在不同的行业都有广泛的应用[9],包括食品、制药和化工,可以作为增稠剂、稳定剂、乳化剂、黏合剂、成膜剂、胶凝剂和悬浮剂等。ZHONG等[10]、OERLEMANS等[11]研究表明,细菌来源的胞外多糖可以调节人体胃肠道微生物菌群,调节与宿主的相互作用,降低体内胆固醇水平,进而改善人体的免疫力。RAMAMOORTHY等[12]研究表明,海洋细菌苏云金芽孢杆菌RSK CAS4胞外多糖具有良好的抗氧化性能以及潜在的抗癌性能。
当前广泛利用液态发酵法生产微生物胞外多糖以提高胞外多糖的产量,张红艳等[13]研究发现胞外多糖的产量随介质成分的不同而变化,包括碳、氮、无机盐离子和培养环境因素。该研究从发酵食品纳豆中筛选出1株胞外多糖产量相对较高的菌株,发现该多糖溶液具有纳豆激酶的活性,高泽鑫等[14]阐明纳豆激酶可以溶解血栓,减缓血栓的形成,是一种天然产物,具有副作用小,安全性高的特点,因此有望成为抗血栓药物的成分。由此借助优化培养基的组成和发酵培养条件以进一步提高胞外多糖的产量,为以后进一步探索该多糖的活性研究做准备。
1 材料与方法
1.1 材料
1.1.1 实验菌株
苏云金芽孢杆菌BT-IX17保藏于江南大学糖生物制造与生物反应器研究室。
1.1.2 实验试剂
葡萄糖、酵母提取物、胰蛋白胨、K2HPO4、KH2PO4、MgSO4,均为分析纯国药集团;黄豆饼粉,北京索莱宝科技有限公司;玉米浆,(上海)阿拉丁试剂有限公司。
1.1.3 培养基及测定指标
固体培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0,琼脂粉20,调节pH 7.0~7.2,121 ℃灭菌30 min。
活化培养基(g/L):干酪素5.0,葡萄糖1.0,酵母提取物1.0,K2HPO4 1.0,KH2PO4 0.5,MgSO4 0.1,琼脂粉20,调节pH 7.0~7.2,115 ℃灭菌30 min。
种子培养基(摇瓶)(g/L):葡萄糖10.0,酵母提取物8.0,玉米浆4.0,NaCl 3.0,调节pH 7.0~7.2,121 ℃灭菌30 min。
基础发酵培养基(摇瓶)(g/L):葡萄糖15.0,黄豆饼粉8.0,酵母提取物5.0,NaCl 3.0,调节pH 7.0~7.2,121 ℃ 灭菌30 min。
测定胞外多糖的方法如公式(1)所示,其中总糖含量采用苯酚-硫酸法[15]。
胞外杂多糖含量=发酵液中的总糖含量-培养基中残糖含量
(1)
1.2 实验方法
1.2.1 目的菌株筛选及确定
菌株活化培养:将从纳豆中筛选而来的菌株BT-IX17在活化培养基中培养24 h,之后用接种环将菌株转接到斜面固体培养基上,于恒温细菌培养箱37 ℃倒置培养约24 h,最后置于4 ℃保存备用。接着从保存的斜面上挑取1环菌苔,转接到固体培养基上。通过形态学分析,生理生化鉴定以及16S rDNA测序确定目的菌株类型。
1.2.2 发酵培养基成分的优化
以基础发酵培养基的成分和浓度为初始水平,选择不同碳源(麦芽糖,蔗糖,果糖,半乳糖,阿拉伯糖,鼠李糖),氮源(黄豆饼粉,玉米浆,酵母粉,大豆蛋白胨,鱼粉蛋白胨)和无机盐离子(KH2PO4,K2HPO4,MgSO4,CaCO3,CaCl2,FeCl3,MnCl2,NaCl,Na2HPO4,NaH2PO4),并确定最佳碳源质量浓度(10.0、15.0、20.0、25.0 g/L),氮源复配比(1∶1、2∶1、3∶1、3∶2、1∶2)(g∶g)和无机盐种类。起始pH定为7.0,使用500 mL的档口瓶装100 mL的培养基,接种量为3%,在30 ℃,200 r/min下培养3 d。
1.2.3 发酵培养条件的优化
采用上述优化好的最佳培养基成分进行发酵培养条件的优化,测定不同接种量(2%、4%、6%、8%、10%),pH(6.5、7.0、7.5、8.0),装液量(50、80、100、120 mL)及温度(25、28、30、34、37 ℃)对菌株BT-IX17胞外多糖产量及生长的影响。
1.2.4 Plackett-Burman实验设计优化胞外多糖产量
依据上述1.2.2和1.2.3的单因素试验结果,利用Plackett-Burman设计(N=9)方案[16],对培养基组分和发酵培养条件9种不同因素的重要性给予考察分析,以EPS产量(g/L)为响应值,各因素水平别分设高低2个水平。
1.2.5 采用Box-Benhnken实验设计优化
使用Design-Expert 8.0.6软件进行Box-Behnken中心组合设计试验,采用响应面法在3因素3水平上对EPS产量进行优化,设置EPS产量(g/L)为响应值。
1.2.6 数据统计分析
上述实验每组重复3次,以“平均值±标准差”形式表示结果。在单因素试验中,使用Origin 9.0软件作图。Box-Behnken试验设计均采用Design-Expert 8.0.6软件进行数据处理分析。
1.2.7 7 L发酵罐验证试验
根据上述优化的最佳培养基成分和发酵培养条件进行7 L发酵罐放大验证实验,依据Box-Benhnken实验中3个显著因素,将初始葡萄糖质量浓度调整为30.0 g/L,黄豆饼粉质量浓度调整为15.0 g/L,调控转速,其他参数设置同摇瓶优化结果,监测发酵过程中各参数的变化。
1.2.8 EPS活性的初步探索纳豆激酶活性研究
该菌株EPS经提取发现具有纳豆激酶活性,测定方法纤维蛋白降解法参考高泽鑫[17]的方法。
2 结果与分析
2.1 目的菌株的确定
经过筛选对比和分离纯化,获得目的菌株。通过菌落的形态学分析(图1),菌株呈乳白色,不透明,边缘呈不规则锯齿状,革兰氏阳性菌,有芽孢和伴孢晶体[18-19]。依据伯杰氏细菌鉴定手册[20]和常见细菌系统鉴定手册进行检测发现:接触酶实验、硝酸盐还原实验、酪蛋白分解实验、水解明胶实验、V-P实验、溶血实验均呈阳性;动力性实验、甘露醇产酸实验、根状生长实验、耐盐实验、柠檬酸盐利用实验均呈阴性。
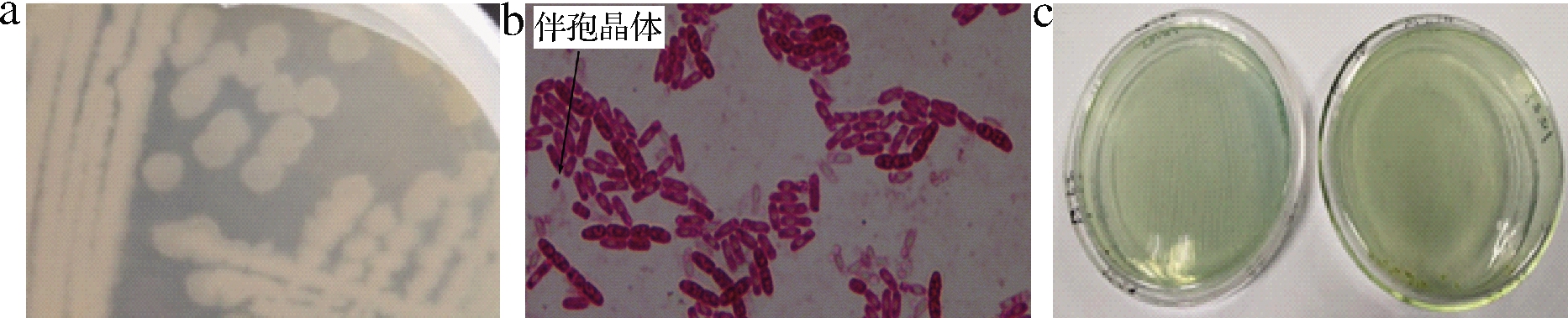
a-菌落形态;b-碱性复红染色伴孢晶体;c-柠檬酸盐利用实验
图1 菌株BT-IX17的生理生化鉴定
Fig.1 The physiological and biochemical identification of strain BT-IX17
由上海生工公司进行16S rDNA测序,并在NCBI数据库上对比序列并结合生理生化实验,确定该菌株为苏云金芽孢杆菌(Bacillus thuringiensis),并将其命名为BT-IX17菌株。利用MEGA 7.0.26软件绘制菌株的分支系统发育树[21](图2)。

图2 采用Neighbor-Joining构建菌株BT-IX17的系统发育树
Fig.2 Using Neighbor-Joining to construct a phylogenetic tree of strain BT-IX17
2.2 单因素实验结果
2.2.1 不同碳源及碳源浓度对菌株EPS产量及生长的影响
以基础发酵培养基中葡萄糖为对照,分别称取20.0 g/L的麦芽糖、蔗糖、果糖、半乳糖、阿拉伯糖、鼠李糖作为碳源,分析考察碳源种类对菌株BT-IX17生长及所产EPS产量的影响。由图3-a可知,麦芽糖作为碳源时,EPS的产量最高为1.62 g/L,但麦芽糖这种原料经济成本较高。而以葡萄糖为碳源时,菌株生物量[22]是最高的。以蔗糖为碳源时,菌株的代谢利用率很低,生长很慢。从菌株的生物量来看,菌株BT-IX17对果糖,半乳糖,阿拉伯糖,鼠李糖这几种碳源的利用率明显偏低,这可能是菌体内没有相应的酶来转化利用这些碳源,所以EPS产量和生物量都很低,综合以上考虑,故而选择葡萄糖为最佳碳源,此时EPS产量为1.26 g/L。
在确定葡萄糖为最佳碳源之后,对其浓度进一步优化。由图3-b可知,随着葡萄糖浓度的增加,EPS产量以及生物量都呈递增趋势。当葡萄糖质量浓度为25.0 g/L时,增加趋势有所减缓且与20.0 g/L时的结果相差不大,有可能是葡萄糖浓度过高,菌体细胞渗透压过大[23],致使菌体的生长减缓,故而选取质量浓度为20.0 g/L的葡萄糖作为最佳碳源浓度。
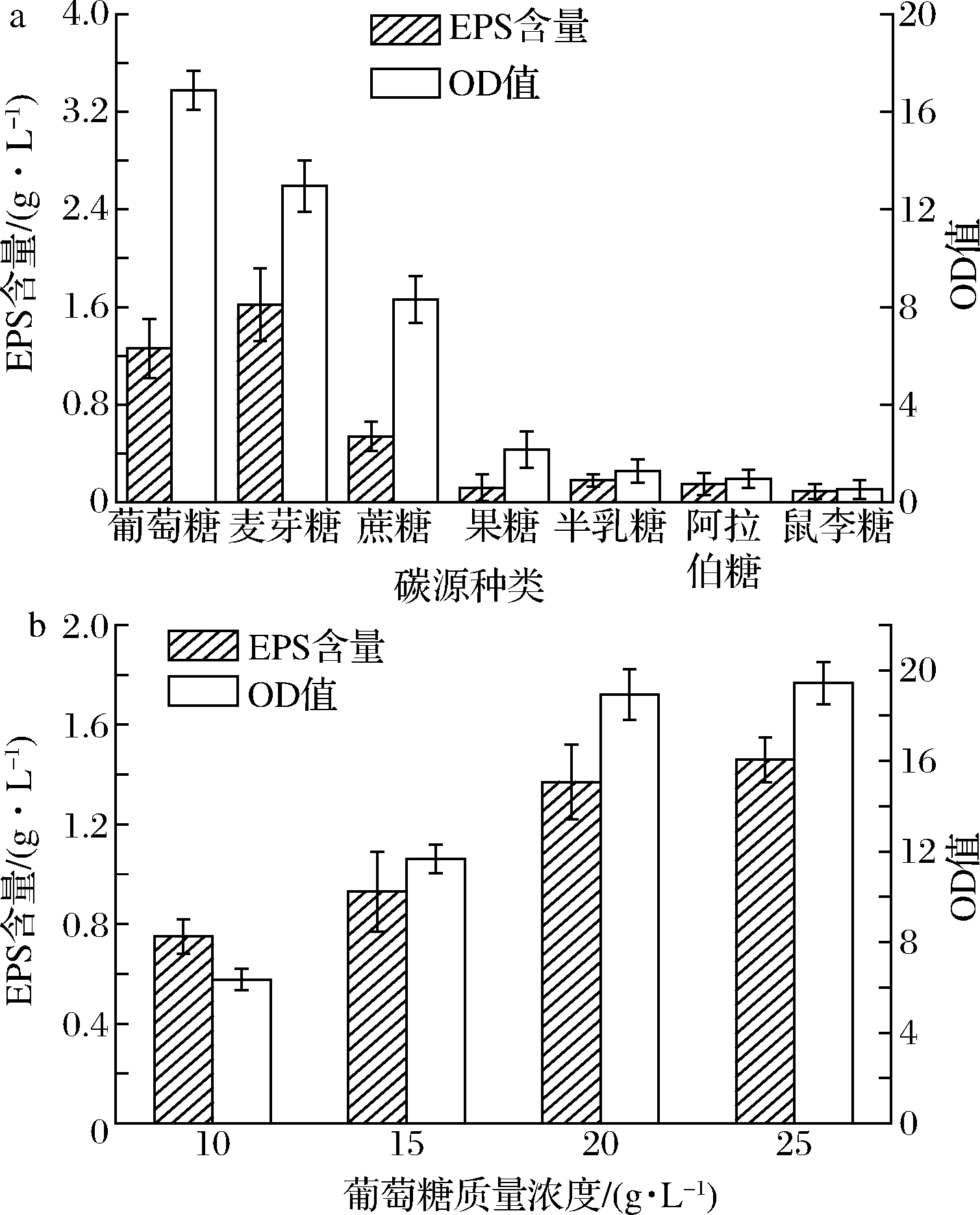
a-碳源种类;b-葡萄糖质量浓度
图3 碳源及其质量浓度对菌株EPS产量及生长的影响
Fig.3 The effect of carbon source and its mass concentration on the yield and growth of strain EPS
2.2.2 不同氮源及氮源浓度对菌株EPS产量及生长的影响
以质量浓度为20.0 g/L葡萄糖为碳源,依次称取质量浓度为10.0 g/L的黄豆饼粉、玉米浆、酵母粉、大豆蛋白胨、鱼粉蛋白胨作为氮源,分析考察氮源种类对菌株BT-IX17生长及所产EPS产量的影响。由图4-a可知,以玉米浆作为氮源时,菌株EPS的产量最高而生物量却不高,可能是玉米浆中的营养物质丰富,有利于EPS的产生,但是以黄豆饼粉作为氮源时,菌株生物量最高而EPS产量仅次于以玉米浆为氮源,综合考虑,故选取黄豆饼粉和玉米浆2种氮源作为最佳氮源。
在确定使用2种氮源作为培养基组分之后,对2种氮源的复配比例进一步优化。由图4-b可知,选取黄豆饼粉与玉米浆复配比例3∶1(g∶g),即黄豆饼粉9.0 g/L,玉米浆3.0 g/L作为最佳氮源质量浓度。
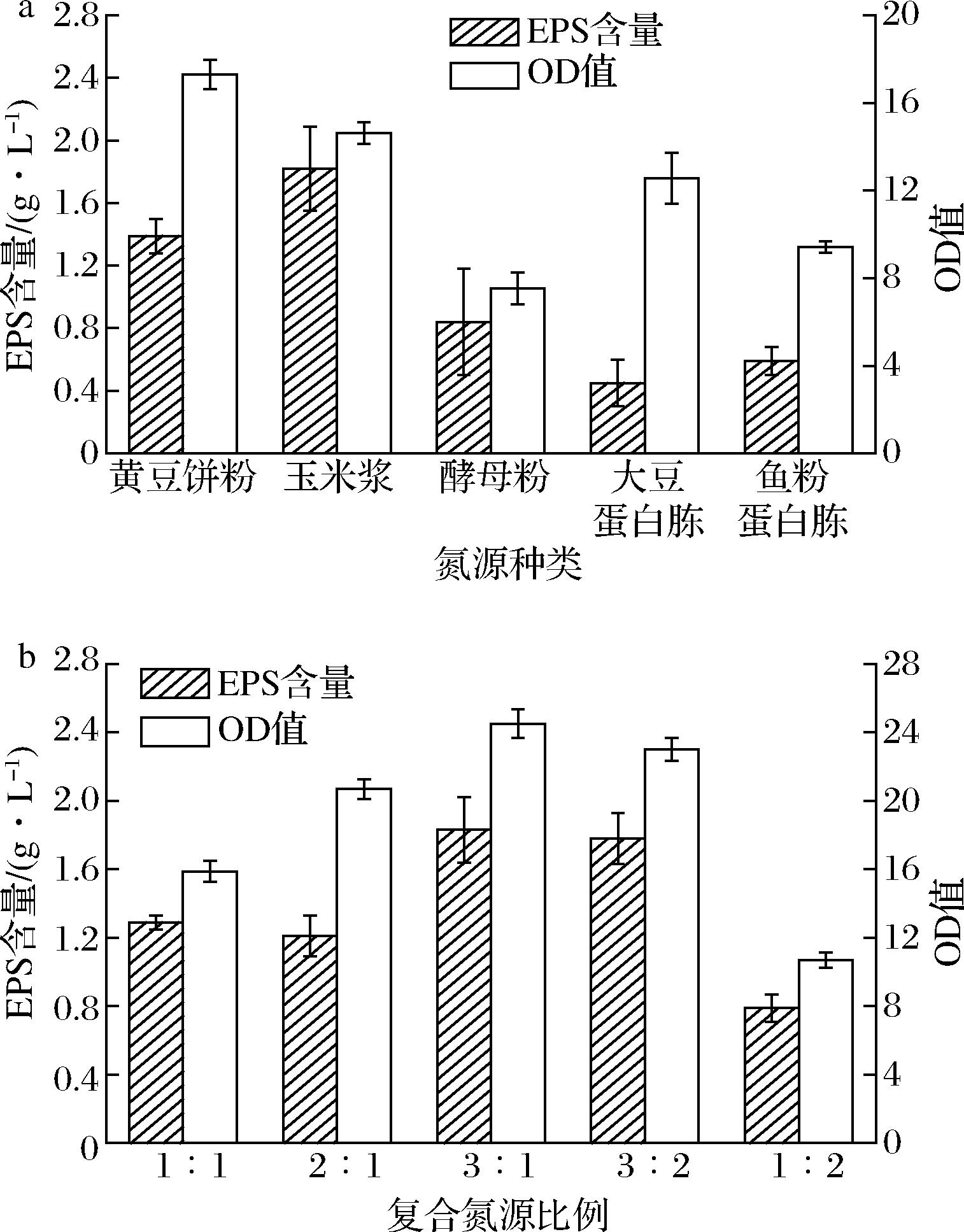
a-氮源种类;b-复合氮源比例
图4 氮源及其质量复合配比对菌株EPS产量及生长的影响
Fig.4 The effects of nitrogen source and its mass compound proportion on the yield and growth of strain EPS
2.2.3 不同无机盐种类对菌株EPS产量及生长的影响
将质量浓度为20.0 g/L的葡萄糖作为碳源,9.0 g/L黄豆饼粉和3.0 g/L玉米浆作为复合氮源,基础发酵培养基中的NaCl作为对照,分别称取质量浓度为0.50 g/L的KH2PO4、K2HPO4、MgSO4、CaCO3、CaCl2、NaCl、Na2HPO4、NaH2PO4;0.05 g/L的FeCl3、MnCl2,分析考察无机盐种类对菌株BT-IX17生长及所产EPS产量的影响。由图5可知,NaH2PO4为无机盐时,EPS的产量最高;选取CaCl2为无机盐时,菌体的生物量最高;选取MnCl2作为培养基中微量元素的补充,有利于菌体生长代谢中相关酶的合成。综合以上考虑,选取K2HPO4、NaH2PO4、MgSO4和MnCl2作为最佳无机盐种类,由于液体发酵过程中会产生一些酸类物质使发酵液偏酸,进而影响菌体生长,所以K2HPO4-NaH2PO4可作为缓冲对在培养基中维持发酵液pH的稳定。
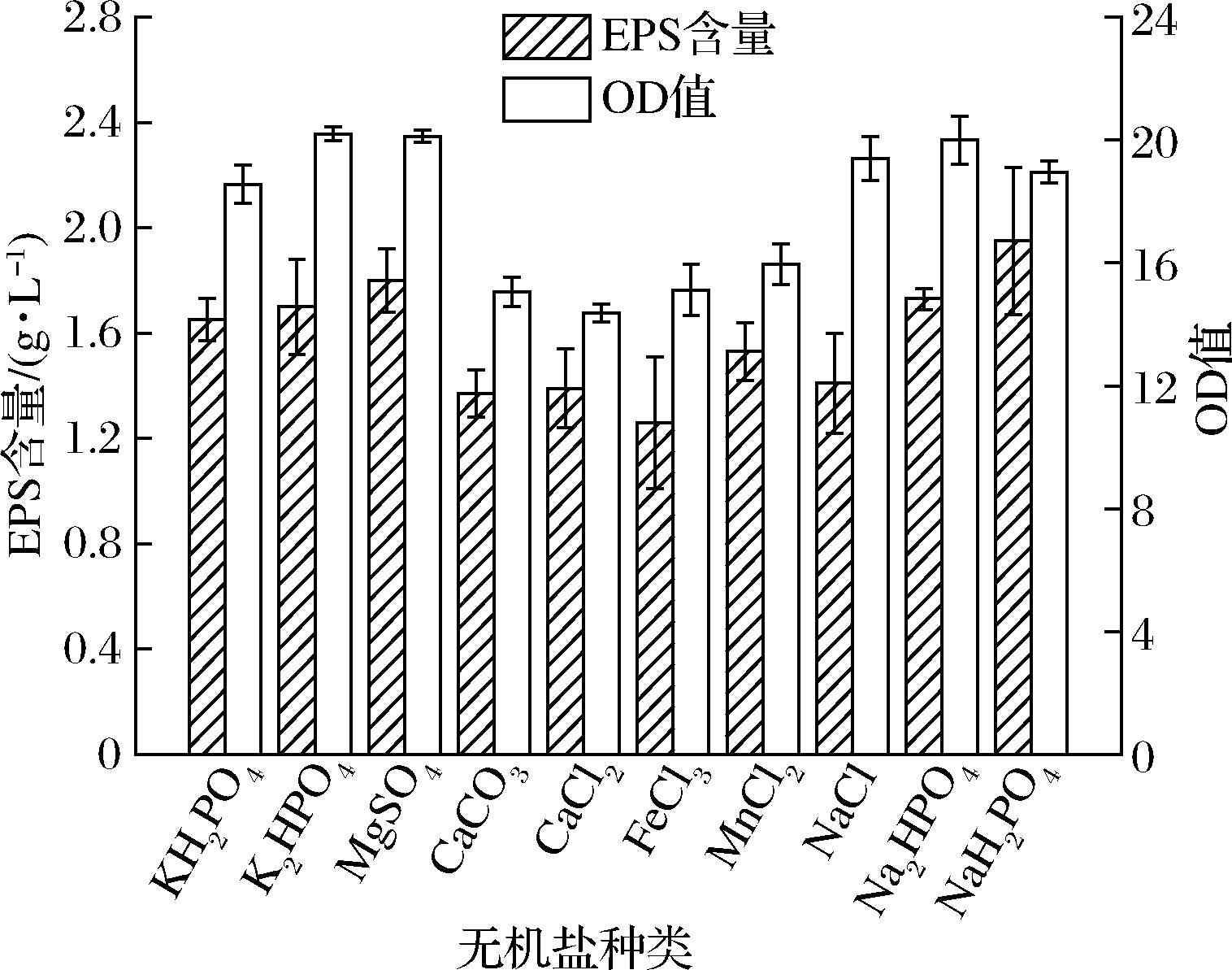
图5 不同无机盐种类对菌株EPS产量及生长的影响
Fig.5 The effects of different kinds of inorganic salts on the yield of exopolysaccharides and the growth of strain
2.2.4 不同发酵培养条件对菌株EPS产量及生长的影响
在上述确定好的培养基成分基础上,对发酵培养条件进行单因素优化,综合考虑EPS产量和菌株生物量。由图6可知,选取初始pH为7.5,温度为34 ℃,装液量80 mL,接种量为6%。

a-初始pH;b-发酵培养温度;c-装液量;d-接种量
图6 不同发酵培养条件对菌株EPS产量及生长的影响
Fig.6 The effects of different fermentation and culture conditions on the yield of exopolysaccharides and the growth of strain
2.3 利用Plackett-Burman实验设计优化胞外多糖产量
综合考虑以上各单因素结果,选取葡萄糖、黄豆饼粉、玉米浆、NaH2PO4、MgSO4、初始pH、发酵培养温度、装液量以及接种量为自变量,以EPS含量为响应值。每种实验条件重复3次取平均值,从中选出显著因素。借助Design-Expert 8.0.6试验设计,实验结果如表1所示。
表1 PB设计实验结果
Table 1 The results of PB design experiment
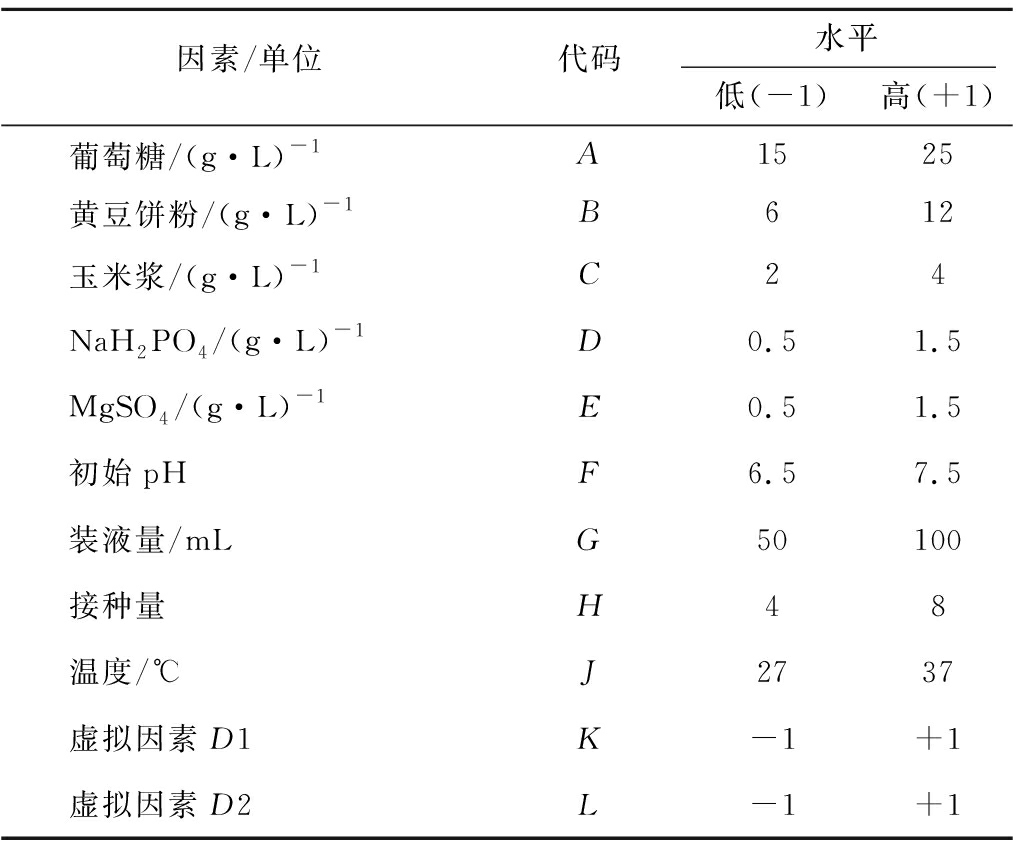
因素/单位代码水平低(-1)高(+1)葡萄糖/(g·L)-1A1525黄豆饼粉/(g·L)-1B612玉米浆/(g·L)-1C24NaH2PO4/(g·L)-1D0.51.5MgSO4/(g·L)-1E0.51.5初始pHF6.57.5装液量/mLG50100接种量H48温度/℃J2737虚拟因素D1K-1+1虚拟因素D2L-1+1
如表2所示,经PB设计分析,葡萄糖(A)、黄豆饼粉(B)和装液量(G)是影响EPS产量的主要因素,其重要性排序为A>B>G,而玉米浆、NaH2PO4、MgSO4、初始pH、接种量和温度对EPS产量影响不显著。对结果进行拟合得到回归方程:EPS含量=1.89+0.31A+0.21B-0.087G,R2=0.929 6,即该模型显著。
表2 PB设计实验结果回归分析
Table 2 Regression analysis of PB design experiment results
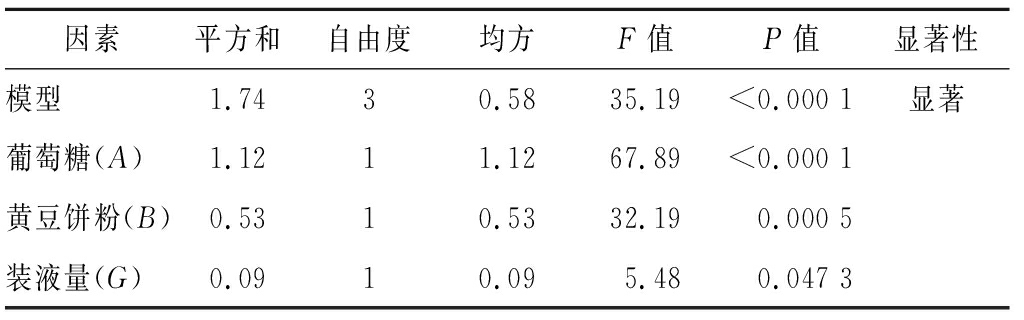
因素平方和自由度均方F值P值显著性模型1.7430.5835.19<0.000 1显著葡萄糖(A)1.1211.1267.89<0.000 1黄豆饼粉(B)0.5310.5332.190.000 5装液量(G)0.0910.095.480.047 3
2.4 采用Box-Behnken实验设计优化胞外多糖产量
综合考虑以上PB实验结果,选取葡萄糖(A)、黄豆饼粉(B)和装液量(C)为主要因素,采用3因素3水平Box-Behnken响应面优化法。结果见表3,方差分析结果见表4,分析考察各单因素之间的交互作用对菌株EPS产量的影响。该模型的相关系数R2=0.989 3,P<0.000 1,表明该模型极显著。由失拟值可知该模型没有失拟。经过拟合,该方程式为:EPS含量=2.76+0.49A+0.11B-0.08C-0.01AB-0.03AC-0.06BC-0.46A2-0.54B2-0.39C2。
表3 Box-Behnken响应面实验设计与结果
Table 3 Design and results of the Box-Behnken experiment
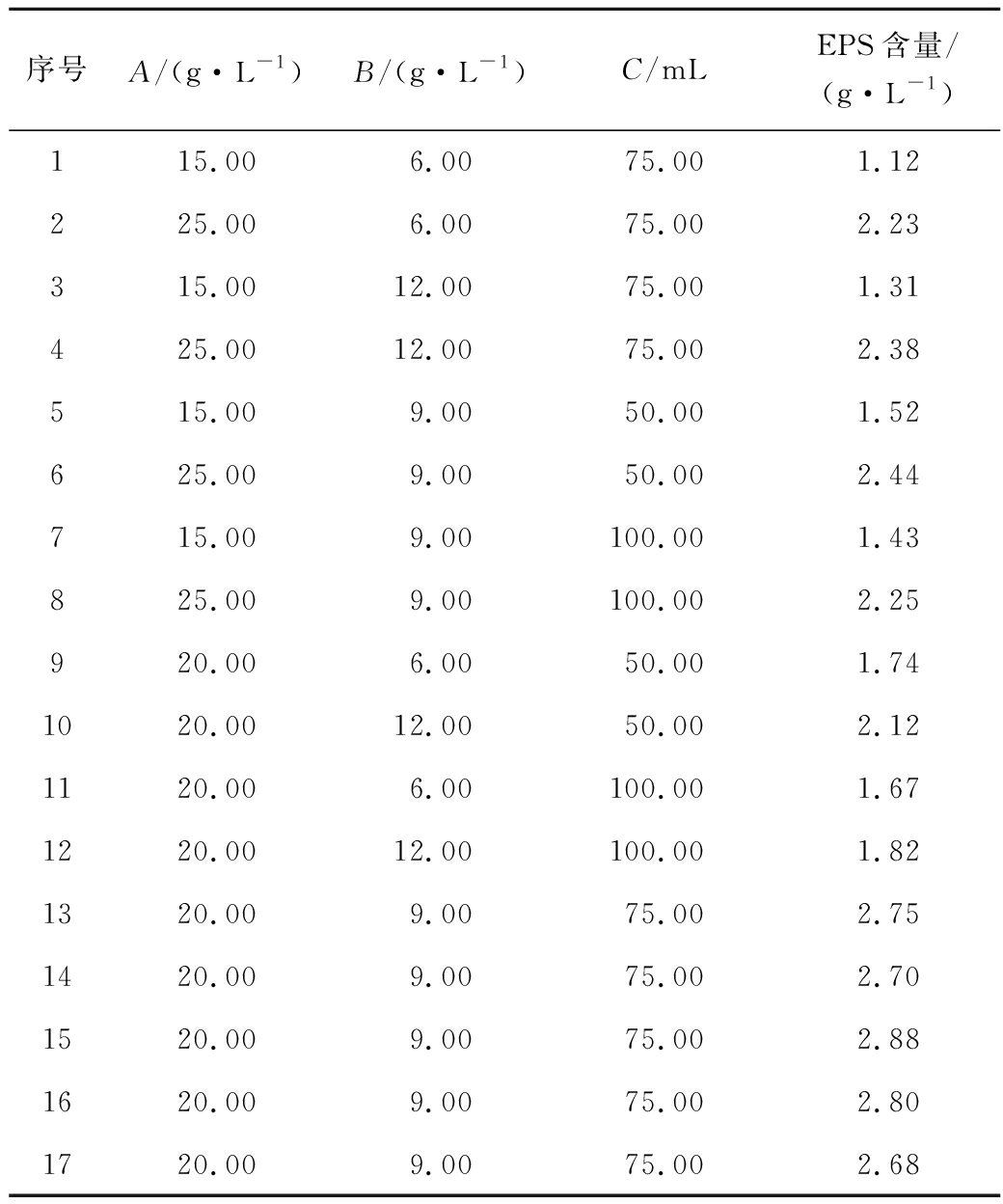
序号A/(g·L-1)B/(g·L-1)C/mLEPS含量/(g·L-1)115.006.0075.001.12225.006.0075.002.23315.0012.0075.001.31425.0012.0075.002.38515.009.0050.001.52625.009.0050.002.44715.009.00100.001.43825.009.00100.002.25920.006.0050.001.741020.0012.0050.002.121120.006.00100.001.671220.0012.00100.001.821320.009.0075.002.751420.009.0075.002.701520.009.0075.002.881620.009.0075.002.801720.009.0075.002.68
表4 EPS含量的方差分析表
Table 4 ANOVA for the yield of exopolysaccharides
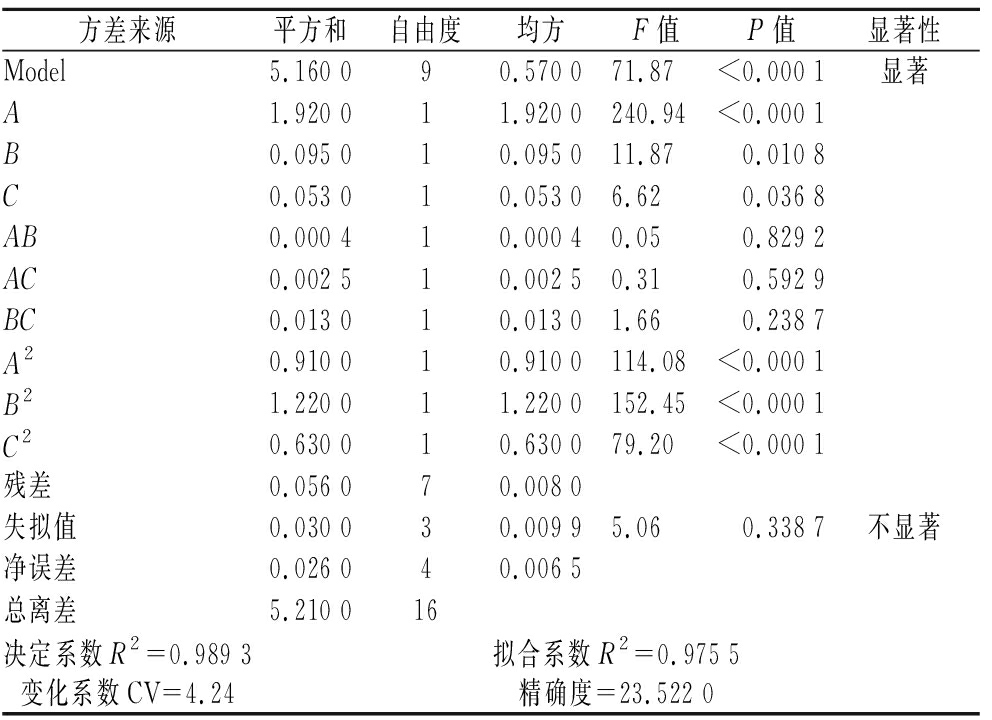
方差来源平方和自由度均方F值P值显著性Model5.160 090.570 071.87<0.000 1显著A1.920 011.920 0240.94<0.000 1B0.095 010.095 011.870.010 8C0.053 010.053 06.620.036 8AB0.000 410.000 40.050.829 2AC0.002 510.002 50.310.592 9BC0.013 010.013 01.660.238 7A20.910 010.910 0114.08<0.000 1B21.220 011.220 0152.45<0.000 1C20.630 010.630 079.20<0.000 1残差0.056 070.008 0失拟值0.030 030.009 95.060.338 7不显著净误差0.026 040.006 5总离差5.210 016决定系数R2=0.989 3拟合系数R2=0.975 5变化系数CV=4.24精确度=23.522 0
由响应面分析,图7表示当其中1种因素为0水平时,另外2个因素的交互作用对EPS产量的影响,可得BC>AC>AB。最终优化所得结果为葡萄糖22.63 g/L,黄豆饼粉9.33 g/L,装液量70.33 mL,当下EPS产量达到最大为2.90 g/L。为实际操作方便,对上述优化结果处理后优化实验得最佳发酵工艺为:葡萄糖22.6 g/L,黄豆饼粉9.3 g/L,玉米浆2.0 g/L,K2HPO4 0.5 g/L,NaH2PO4 1.5 g/L,MgSO4 1.5 g/L,MnCl2 0.05 g/L,初始pH 7.5,装液量70 mL,温度34 ℃,接种量6%。以此条件重复3次实验,得EPS产量为(2.94±0.11)g/L。同预测值相差不大,表明模型可靠,与优化前工艺相比,EPS的产量提高133.33%。

a-葡萄糖和黄豆饼粉之间交互作用3D图;b-黄豆饼粉和装液量之间交互作用3D图;c-黄豆饼粉和装液量之间交互作用3D图
图7 各因素的交互作用对EPS产量影响的响应曲面
Fig.7 The response surface of the interaction of various factors on the yield of exopolysaccharides
2.5 采用7 L发酵罐放大验证
将上述摇瓶优化的参数运用到7 L发酵罐中(pH自然),菌株的生长状况整体上分成3个阶段(图8),在0~16 h时处于菌株的适应期,此时菌体生长缓慢,无EPS产生,葡萄糖消耗也较少,此时转速为200 r/min,因为初期转速过快,搅拌桨会损伤菌体。在16~50 h时菌体处于急剧增长模式,葡萄糖含量也消耗结束,并开始了葡萄糖的匀速流加,此时EPS开始大量合成。在50~72 h时,菌体生长趋于稳定,56 h时菌株的生物量达到最大且葡萄糖含量也将近消耗完毕。由于此时发酵液呈黏稠流体状态,于是将搅拌转速升高至300 r/min,以保证发酵罐内的传质传氧稳定。可以看出,EPS产量跟菌株生物量呈正相关,与摇瓶水平相比,EPS产量提高了123.1%。
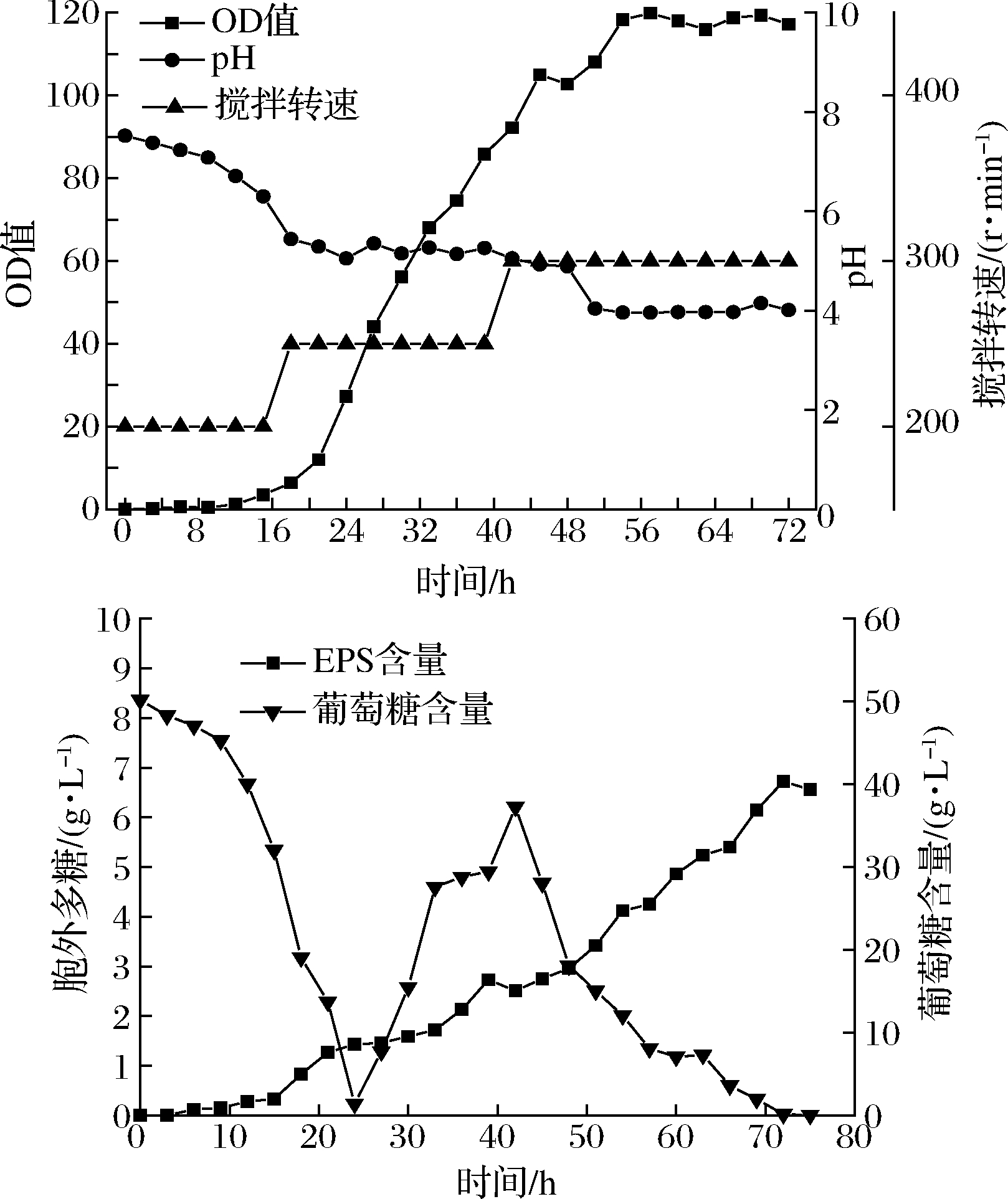
a-OD值;b-胞外多糖含量
图8 7 L发酵罐实验结果
Fig.8 The results of 7 L fermenter
2.6 EPS活性的初步探索
通过收集取样,该EPS经过初步纯化,具有一定的纳豆激酶活性,如图9所示,多糖溶液浓度跟纳豆激酶活性高低呈剂量效应。庞远祥等[24]通过优化纳豆激酶产生的培养条件使活性提高至204.52 U/mL,与初始相比提高了1.22倍。该文EPS的纳豆激酶活性相对较低,但明显可以看出,随着EPS浓度的提高,纳豆激酶活性也在提高,这为进一步探索EPS活性奠定基础。
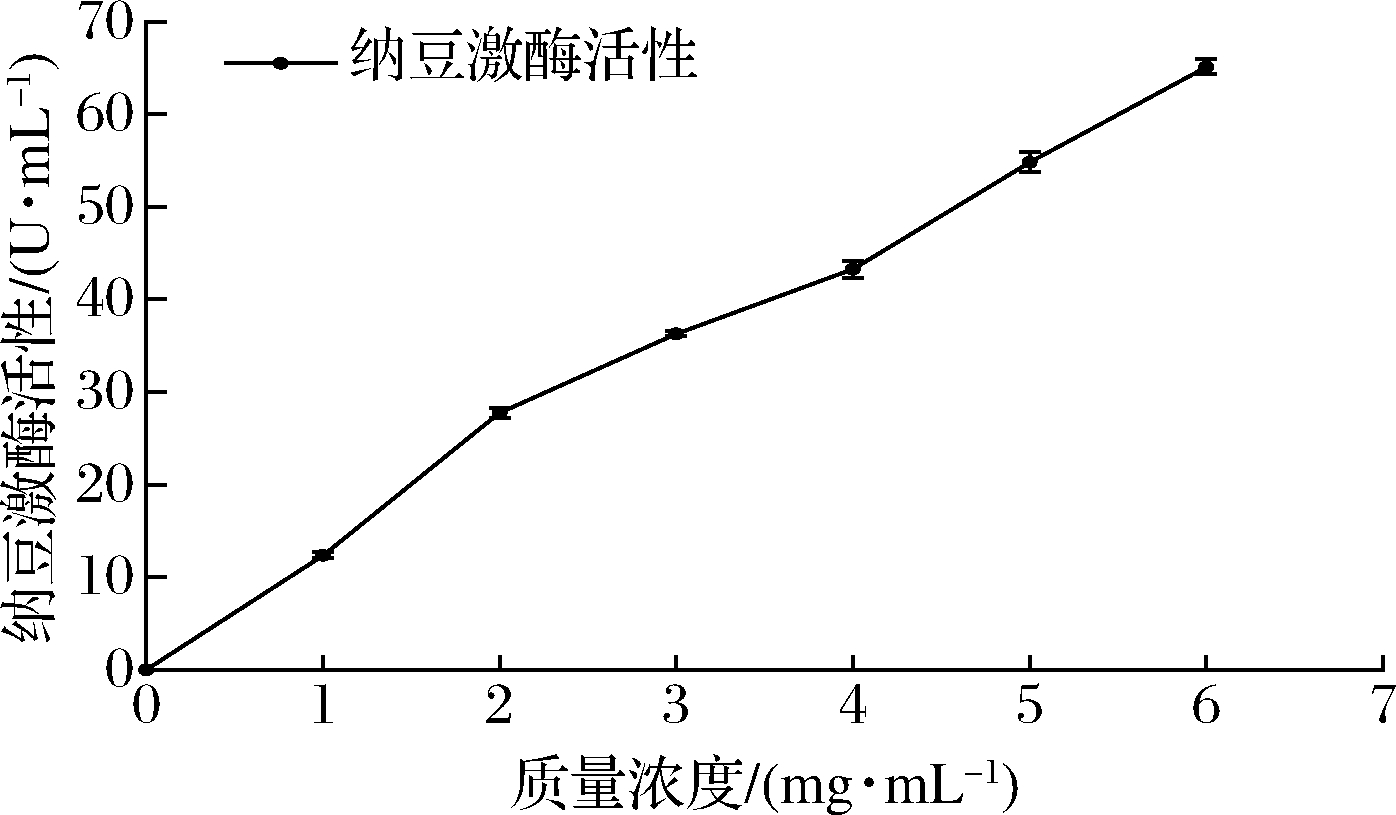
图9 EPS的纳豆激酶活性测定
Fig.9 The nattokinase activity of EPS
3 结论
该文通过在纳豆中筛选出1株产EPS较高的菌株BT-IX17,然后进一步确定该目标菌株为苏云金芽孢杆菌。为提高菌株的EPS产量,对液态发酵下的培养基成分和发酵培养条件进行单因素优化,使用PB设计分析得到影响EPS产量的显著因素,最后Box-Behnken优化设计的3因素3水平分析得到最佳发酵工艺。该优化方案与初期相比,EPS产量提高了133.33%。在7 L发酵罐放大水平,与摇瓶相比,EPS产量提高了123.1%。但是可以看出在发酵后期pH下降至4.00,葡萄糖消耗迅速,这2个主要问题,这种培养情况对于菌体和EPS的积累都是有影响的,接下来可以对上罐过程中的pH进行调控,优化补料方式来进一步提高EPS产量。目前经测定,该新型EPS具有一定纳豆激酶活性,有望成为未来治疗血栓的合成药物来源。由此该研究关于EPS产量的优化为将来进一步探索EPS活性应用提供更多便利和可能性。
4 讨论
当前对于微生物EPS的研究因其结构的复杂性而处于广泛探索阶段,如CAGRI-MEHMETOGLU等[25]研究Bacillus subtilis ATCC 6633菌株经优化培养基中乳糖和复合乳清粉等添加物后所产新型EPS含量为约0.77 g/L。ASGHER等[26]通过诱变和响应面法对Bacillus licheniformis MS3菌株进行产量优化,所产EPS提高到15.6 g/L,且发现该EPS具有良好的乳化活性。SUSAN等[27]研究Bacillus licheniformis SVD1的EPS经白介素和肿瘤坏死因子测定而具有免疫调节功能。这些微生物来源的天然EPS的发现将为发现具有工业应用潜力的新型生物大分子铺平道路,也将激励微生物多糖领域的生物技术开发。
[1] FREITAS F, TORRES C A V, REIS M A M.Engineering aspects of microbial exopolysaccharide production[J].Bioresource Technology, 2017, 245:1 674-1 683.
[2] WANG J, SALEM D R, SANI R K.Extremophilic exopolysaccharides:A review and new perspectives on engineering strategies and applications[J].Carbohydrate Polymers, 2019, 205:8-26.
[3] LIU J, WANG X C, PU H M, et al.Recent advances in endophytic exopolysaccharides:Production,structural characterization, physiological role and biological activity[J].Carbohydrate Polymers, 2017, 157(10):1 113-1 124.
[4] YILDIZ H, KARATAS N.Microbial exopolysaccharides:Resources and bioactive properties[J].Process Biochemistry, 2018, 72:41-46.
[5] SHUKLA A, MEHTA K, PARMAR J, et al.Depicting the exemplary knowledge of microbial exopolysaccharides in a nutshell[J].European Polymer Journal, 2019, 119:298-310.
[6] MALICK A, KHODAEI N, BENKERROUM N, et al.Production of exopolysaccharides by selected Bacillus strains:Optimization of media composition to maximize the yield and structural characterization[J].International Journal of Biological Macromolecules, 2017, 102:539-549.
[7] AMIRI S, REZAEI MOKARRAM R, SOWTI KHIABANI M, et al.Exopolysaccharides production by Lactobacillus acidophilus LA5 and Bifidobacterium animalis subsp.lactis BB12:Optimization of fermentation variables and characterization of structure and bioactivities[J].International Journal of Biological Macromolecules, 2019, 123(15):752-765.
[8] 李琪雯, 周嫄, 柯成竹, 等.微生物生产威兰胶的研究进展[J].食品工业科技, 2019, 40(23):337-342;348.
LI Q W, ZHOU Y, KE C Z, et al.Research progress in microbial production of welan gum[J].Science and Technology of Food Industry, 2019, 40(23):337-342;348.
[9] ZHOU Y, CUI Y H, QU X J.Exopolysaccharides of lactic acid bacteria:Structure, bioactivity and associations:A review[J].Carbohydrate Polymers, 2019, 207:317-332.
[10] ZHONG C Y, CAO G, RONG K, et al.Characterization of a microbial polysaccharide-based bioflocculant and its anti-inflammatory and pro-coagulant activity[J].Colloids and Surfaces B:Biointerfaces, 2018, 161(1):636-644.
[11] OERLEMANS M M P, AKKERMAN R, FERRARI M, et al.Benefits of bacteria-derived exopolysaccharides on gastrointestinal microbiota, immunity and health[J].Journal of Functional Foods, 2021, 76:104289.
[12] RAMAMOORTHY S, GNANAKAN A, S. LAKSHMANA S, et al.Structural characterization and anticancer activity of extracellular polysaccharides from ascidian symbiotic bacterium Bacillus thuringiensis[J].Carbohydrate Polymers, 2018, 190(15):113-120.
[13] 张红艳, 李忠玲, 张强, 等.地衣芽孢杆菌MYS68的鉴定及发酵培养基优化[J].粮食与饲料工业, 2018(2):50-53.
ZHANG H Y, LI Z L, ZHANG Q, et al.Identification and optimization of fermentation medium for Bacillus licheniformis MYS 68[J].Cereal & Feed Industry, 2018(2):50-53.
[14] 高泽鑫, 何腊平, 刘亚兵, 等.纳豆激酶的研究进展与展望[J].中国酿造, 2017, 36(8):11-15.
GAO Z X, HE L P, LIU Y B, et al.Research progress and prospect of nattokinase[J].China Brewing, 2017, 36(8):11-15.
[15] 刘卫宝, 余讯, 徐静静, 等.黄芪多糖的分离、结构表征及益生活性研究[J].食品与发酵工业, 2020, 46(7):50-56.
LIU W B, YU X, XU J J, et al.Isolation, structure characterization and prebiotic activity of polysaccharides from Astragalus membranaceus[J].Food and Fermentation Industries, 2020, 46(7):50-56.
[16] 陈博文, 李贞蓉, 常明昌, 等.香菇产α-半乳糖苷酶的液体发酵工艺优化[J].食用菌学报, 2018, 25(2):79-89.
CHEN B W, LI Z R, CHANG M C, et al.Optimization of fermention conditions for the production of α-galactosidase from Lentinula edodes[J].Acta Edulis Fungi, 2018, 25(2):79-89.
[17] 高泽鑫. 高产纳豆激酶菌株的筛选及其酶学稳定性的研究[D].贵阳:贵州大学, 2018.
GAO Z X.Screening of high-yield nattokinase strains and study of its enzymatic stability[D].Guiyang:Guizhou University, 2018.
[18] 李梅云, 高家合, 王革, 等.苏云金杆菌伴孢晶体形态特征观察[J].烟草科技, 2004, 208(11):43-45.
LI M Y, GAO J H, WANG G, et al.Morphologic characteristics of parasporal crystals of Bacillus thuringiensis[J].Tobacco Science & Techonlogy/Disease & Pest Control, 2004, 208(11):43-45.
[19] 杨树丽. 一株产胞外多糖芽孢杆菌的研究[D].上海:上海应用技术大学, 2016.
YANG S L.Study on Bacillus strains producing extracellular polysaccharide[D].Shanghai:Shanghai Institute of Technology, 2016.
[20] R.E.布坎南.伯杰氏细菌鉴定手册[M].第八版.北京:科学出版社, 1984:1 668.
R.E.BUCHANAN.Bergey′s Manual of Determinative Bacteriology[M].8th ed.Beijing:Science Press, 1984:1 668.
[21] ATTESON K.The performance of neighbor-joining methods of phylogenetic reconstruction[J].Algorithmica, 1999, 25(2-3):251-278.
[22] 张路路, 朱朝华, 郭刚.苏云金芽孢杆菌A322菌株发酵培养基和发酵条件的优化[J].热带生物学报, 2014, 5(3):253-259.
ZHANG L L, ZHU C H, GUO G.Optimization of Bacillus thuringiensis A322 strain fermentation medium and cultural conditions[J].Journal of Tropical Biology, 2014, 5(3):253-259.
[23] 胡红伟, 段明房, 闫凌鹏, 等.一株枯草芽孢杆菌的鉴定及液体发酵工艺优化[J].中国饲料, 2017(5):13-19.
HU H W, DUAN M F, YAN L P, et al.Identification of a Bacillus subtilis strain and optimization of its liquid fermentation process[J].China Feed, 2017(5):13-19.
[24] 庞远祥, 谢远红, 金君华, 等.低嘌呤、高纳豆激酶活性枯草芽孢杆菌SH21筛选及发酵条件优化[J].食品与发酵工业, 2021,47(11):194-199.
PANG Y X, XIE Y H, JIN J H, et al.Isolation and optimization of Bacillus subtilis SH21 for low purine and high nattokinase activity[J].Food and Fermentation Industries, 2021,47(11):194-199.
[25] CAGRI-MEHMETOGLU A, KUSAKLI S, VENTER V.Production of polysaccharide and surfactin by Bacillus subtilis ATCC 6633 using rehydrated whey powder as the fermentation medium[J].Journal of Dairy Science, 2012, 95(7):3 643-3 649.
[26] ASGHER M, UROOJ Y, QAMAR S A, et al.Improved exopolysaccharide production from Bacillus licheniformis MS3:Optimization and structural/functional characterization[J].International Journal of Biological Macromolecules, 2020, 151:984-992.
[27] SUSAN V D J, KEE N L A, FROST C L, et al.Extracellular polysaccharide production in Bacillus Licheniformis SVD 1 and its immunomodulatory effect[J].Bioresources, 2012, 7(4):4 976-4 993.