水苏糖是一种由半乳糖(α1→6)半乳糖(α1→6)葡萄糖(α1→2β)果糖组成的功能性低聚糖,具有促进肠道有益菌的增殖、润肠通便、保护肝脏等功能[1]。但由于人的小肠不能合成分解水苏糖所必需的α-半乳糖苷酶,因此水苏糖无法被小肠消化吸收,会直接进入大肠,从而被肠道细菌发酵[2]。
人体摄入过量水苏糖可能会导致胀气等不良反应,而这些负面影响是剂量依赖性的,中等剂量的水苏糖在肠内发酵有利于益生菌如双歧杆菌的代谢[3]。肠道内的益生菌通过利用水苏糖增殖,从而抑制腐败菌生长,起到调节肠道菌群、维持肠道微生态稳定等功能。
大量研究表明双歧杆菌和乳杆菌都可以利用水苏糖。早在1978年,YAZAWA等[4]曾报道,除两歧双歧杆菌外,所有人类来源的双歧杆菌都能利用水苏糖。HAYAKAWA等 [5]研究大豆低聚糖对人类粪便菌群的影响时发现,双歧杆菌属、乳杆菌属等7个属的58株菌能够利用水苏糖。PAN等[6]发现水苏糖通过诱导植物乳杆菌产生更多的α-半乳糖苷酶水解水苏糖,增加其糖代谢和细胞活性来高度促进自身增殖。但是目前对于双歧杆菌和乳杆菌利用水苏糖的相关研究大多集中在利用情况上,利用方式的研究相对较少。
本研究从人类粪便来源的32株双歧杆菌和乳杆菌中筛选出能够利用水苏糖的菌株,通过测定培养液上清液中糖的组成、α-半乳糖苷酶活力并结合基因组草图分析等方法,研究双歧杆菌、乳杆菌对水苏糖的利用特性,这对于水苏糖促进人体健康的研究具有一定的指导意义。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
水苏糖,上海源叶生物科技有限公司;棉籽糖,生工生物工程(上海)股份有限公司;酵母提取物、胰蛋白胨,英国Oxoid公司。
1.1.2 实验菌株
实验所用32株双歧杆菌和乳杆菌,由本实验室菌种保藏中心(Culture Collection of Food Microorganisms,CCFM)提供,具体信息如表1所示。
表1 实验菌株信息
Table 1 The information of the experimental strains
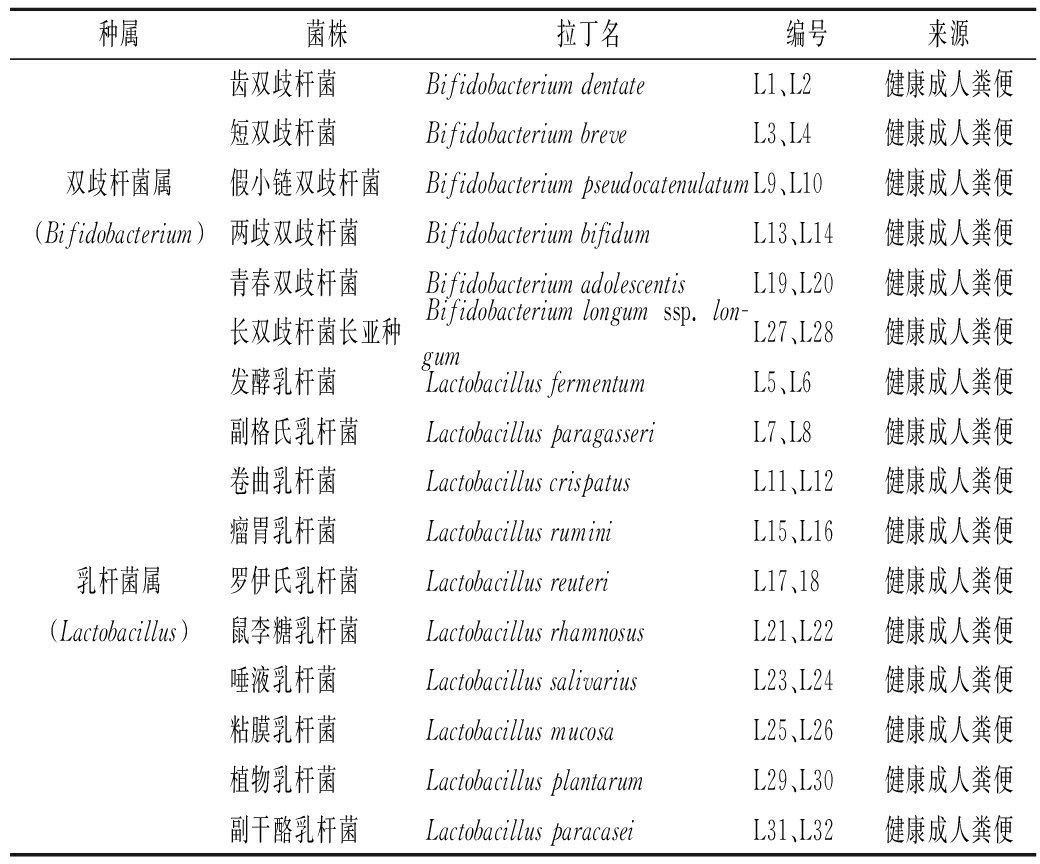
种属菌株拉丁名编号来源齿双歧杆菌Bifidobacterium dentateL1、L2健康成人粪便短双歧杆菌Bifidobacterium breveL3、L4健康成人粪便双歧杆菌属假小链双歧杆菌Bifidobacterium pseudocatenulatumL9、L10健康成人粪便(Bifidobacterium)两歧双歧杆菌Bifidobacterium bifidumL13、L14健康成人粪便青春双歧杆菌Bifidobacterium adolescentisL19、L20健康成人粪便长双歧杆菌长亚种Bifidobacterium longum ssp. lon-gumL27、L28健康成人粪便发酵乳杆菌Lactobacillus fermentumL5、L6健康成人粪便副格氏乳杆菌Lactobacillus paragasseriL7、L8健康成人粪便卷曲乳杆菌Lactobacillus crispatusL11、L12健康成人粪便瘤胃乳杆菌Lactobacillus ruminiL15、L16健康成人粪便乳杆菌属罗伊氏乳杆菌Lactobacillus reuteriL17、18健康成人粪便(Lactobacillus)鼠李糖乳杆菌Lactobacillus rhamnosusL21、L22健康成人粪便唾液乳杆菌Lactobacillus salivariusL23、L24健康成人粪便粘膜乳杆菌Lactobacillus mucosaL25、L26健康成人粪便植物乳杆菌Lactobacillus plantarumL29、L30健康成人粪便副干酪乳杆菌Lactobacillus paracaseiL31、L32健康成人粪便
1.2 实验方法
1.2.1 利用水苏糖的双歧杆菌和乳杆菌的确定
将菌株接种于以水苏糖作唯一碳源、并添加溴甲酚紫指示剂的肠道微生物培养基(GMM)平板上,置于厌氧工作站37 ℃培养24~48 h;挑取使培养基变黄的菌株,划线纯化2次后,转接到水苏糖GMM液体培养基中,置于厌氧工作站37 ℃培养24~48 h,通过HPLC分析上清液中水苏糖含量(方法见1.2.2),以未接种菌株的GMM液体培养基为空白对照,根据水苏糖消耗量确定能够利用水苏糖的菌株。
1.2.2 细菌培养上清液中水苏糖的HPLC分析
菌株在以水苏糖作唯一碳源的GMM培养基中37 ℃厌氧培养24 h,菌液以8 000 r/min离心5 min收集上清液,采用HPLC测定上清液中水苏糖的含量。色谱条件:采用SugarPak1糖柱(300 mm,id 3.5 μm),柱温85 ℃,流动相为纯水,流量为0.4 mL/min,使用外标法确定水苏糖的含量[7]。
1.2.3 细菌利用水苏糖生长的表征
将菌株活化后,接种于以水苏糖作唯一碳源的GMM培养基中37 ℃厌氧培养。自初始接种时起,每隔1 h取1 mL待测菌液于1.5 mL 离心管以8 000 r/min离心5 min,收集上清液和菌泥备用。同时,测定菌液的pH和600 nm处的吸光度(OD600)。待菌株生长进入稳定期后,停止实验。
1.2.4 α-半乳糖苷酶活力测定
α-半乳糖苷酶活力测定参照SCALABRINI等[8]和邬佳颖等[9]的方法:上述生长过程中得到的上清液和菌泥,其中菌泥用柠檬酸-柠檬酸钠缓冲液洗涤2次后重悬,加入100 μL氯仿,振荡30 s,制成粗酶液。将250 μL粗酶液或上清液与对硝基苯α-D-氨基半乳糖苷(p-nitrophenyl β-D-glucopyranoside,PNPG)混合,37 ℃反应30 min,加入500 μL 0.2 mol/L碳酸钠溶液终止反应,测定420 nm下的吸光值。菌泥测定结果对应胞内酶活力,上清液测定结果对应胞外酶活力。
酶活力定义:在测定条件下,1 min释放1 μmol的对硝基苯酚所消耗的酶量(mL)为1个酶活力单位。
1.2.5 基因组草图的测定
将菌株以4%的接种量接种至5 mL MRS液体培养基中进行活化,置于厌氧工作站37 ℃恒温培养24~48 h。活化2次的菌株以4%的接种量接种至装有100 mL MRS液体培养基的蓝盖瓶中,置于厌氧工作站培养24~48 h。菌液经8 000 r/min离心10 min得到菌泥,加入30%的甘油保存菌株,送至上海美吉生物医药科技有限公司完成基因组草图测序。
利用Illumina HiSeq 2000(Illumina Inc USA)测序平台对送测菌株进行双末端测序,获得原始数据,基因组覆盖度达到100倍[10]。使用短序列组装软件SOAPdenovo2进行从头组装,获得菌株基因组序列[11]。运用GeneMark1.1和Glimmer 3.02软件对组装结果进行基因de novo预测,获取开放阅读框(Open Reading Frame,,ORF)等相关信息[12-13]。在预测得到的编码基因基础上进行基因的功能注释,将草图基因的蛋白质序列与KEGG(Kyoto Encychopedia of Genes and Genomes)、蛋白相邻类的聚簇(Cluster of Orthologous Groups of proteins,COG)等数据库进行BLASTP对比,保留前5条相似性较高序列的结果,获得相应的功能注释信息,以此初步确定该蛋白序列与数据库中的蛋白质具备相似的功能。上述步骤均由上海美吉生物医药科技有限公司完成。
1.2.6 α-半乳糖苷酶的亚细胞定位分析
利用LOCTREE对菌株中的α-半乳糖苷酶进行亚细胞定位分析。在LOCTREE中输入该酶的氨基酸序列,选择物种细菌,系统将对该酶位置进行预测。
1.2.7 数据分析
实验中pH、 OD600、 糖含量以及酶活力的测定均为3次平行,结果以平均值±标准差表示。作图采用Origin 9.0,对数据进行分析与处理。
2 结果与分析
2.1 能够利用水苏糖的菌株确定
肠道细菌利用水苏糖生长后会产酸,使指示剂变色,即溴甲酚紫变黄。根据指示剂变色结果,初步筛选出能利用水苏糖的双歧杆菌和乳杆菌24株(表2)。
表2 能利用水苏糖细菌的初步筛选
Table 2 The primary screening of bacteria capable of using stachyose
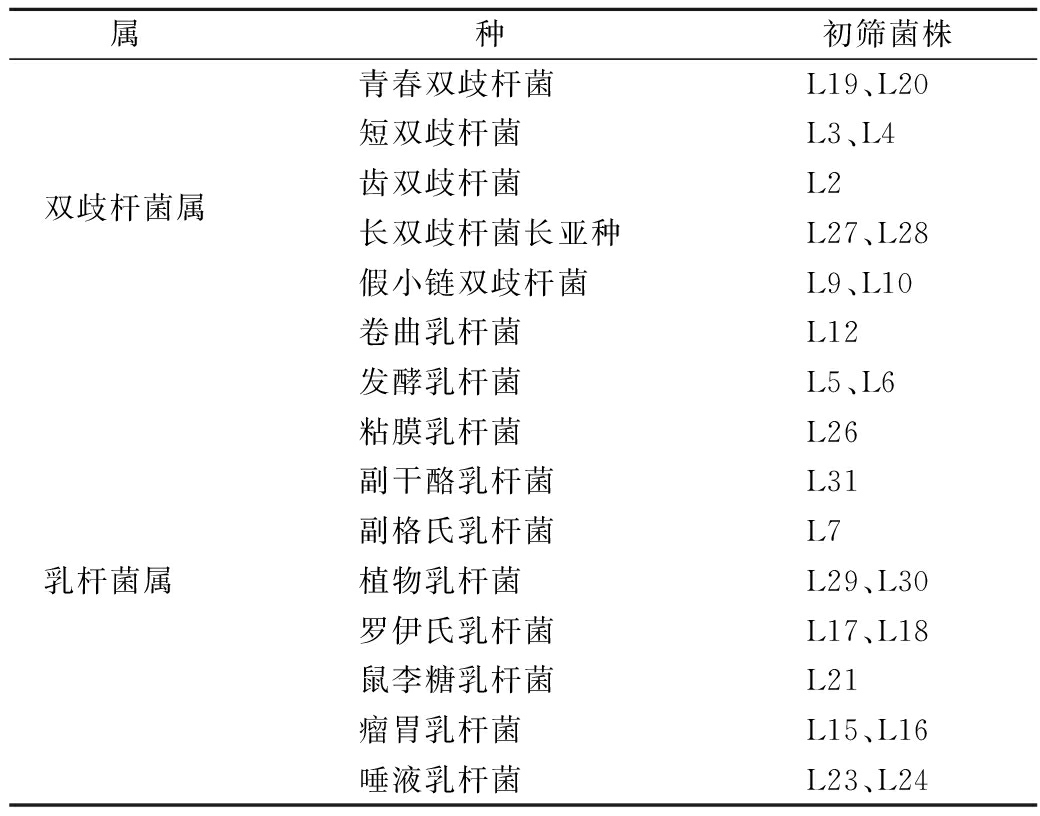
属种初筛菌株青春双歧杆菌 L19、L20短双歧杆菌 L3、L4双歧杆菌属齿双歧杆菌 L2长双歧杆菌长亚种L27、L28假小链双歧杆菌 L9、L10卷曲乳杆菌 L12发酵乳杆菌 L5、L6粘膜乳杆菌 L26副干酪乳杆菌 L31副格氏乳杆菌 L7乳杆菌属 植物乳杆菌 L29、L30罗伊氏乳杆菌 L17、L18鼠李糖乳杆菌 L21瘤胃乳杆菌 L15、L16唾液乳杆菌 L23、L24
HPLC法测定上述菌株上清液中水苏糖含量,与初始液体培养基中的水苏糖含量(8 g/L)进行比较,确定该菌株是否利用水苏糖。结果如表3所示,共有15株菌能够利用水苏糖,分别为短双歧杆菌、齿双歧杆菌、长双歧杆菌长亚种、假小链双歧杆菌、发酵乳杆菌、副格氏乳杆菌、罗伊氏乳杆菌、瘤胃乳杆菌以及唾液乳杆菌共9个种。
表3 细菌培养上清液中水苏糖含量的测定
Table 3 The determination of stachyose in the supernatant of bacterial culture
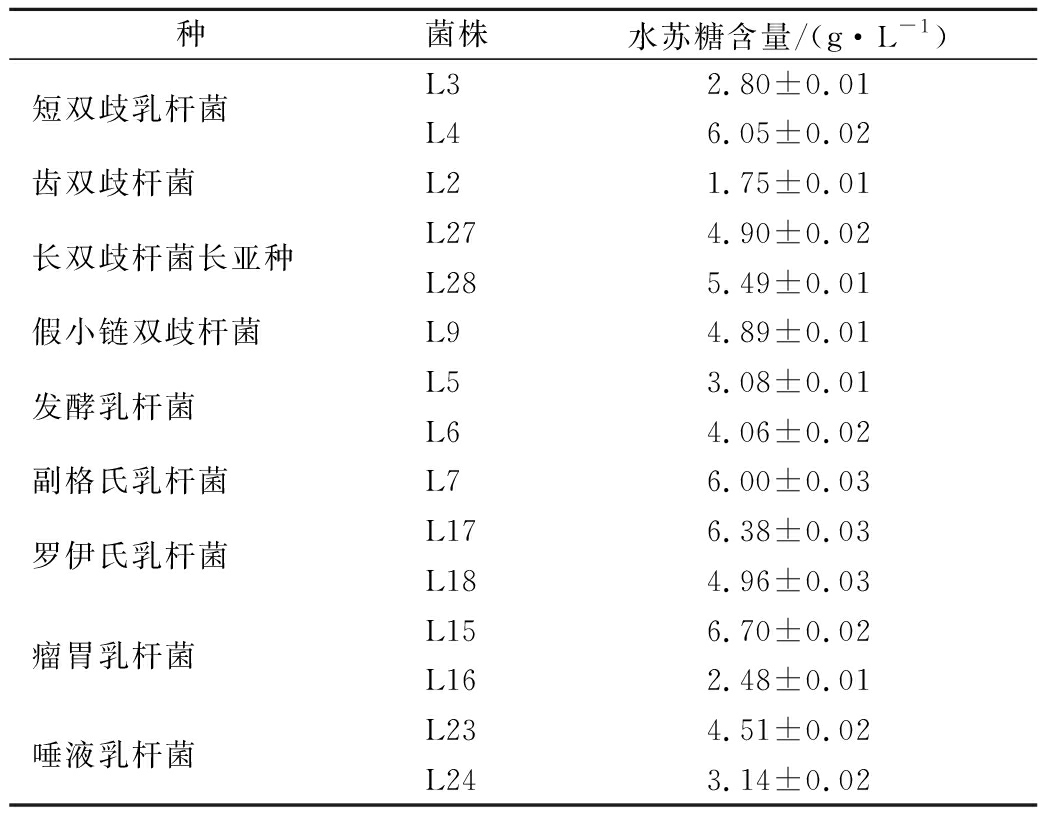
种菌株水苏糖含量/(g·L-1)短双歧乳杆菌L32.80±0.01L46.05±0.02齿双歧杆菌L21.75±0.01长双歧杆菌长亚种L274.90±0.02L285.49±0.01假小链双歧杆菌L94.89±0.01发酵乳杆菌L53.08±0.01L64.06±0.02副格氏乳杆菌L76.00±0.03罗伊氏乳杆菌L176.38±0.03L184.96±0.03瘤胃乳杆菌L156.70±0.02L162.48±0.01唾液乳杆菌L234.51±0.02L243.14±0.02
目前,有些菌株如短双歧杆菌、发酵乳杆菌、罗伊氏乳杆菌等已被报道能够利用水苏糖[5, 14-15]。有文献报道,副干酪乳杆菌、植物乳杆菌可以利用水苏糖[16],而本实验中所筛选的副干酪乳杆菌和植物乳杆菌几乎不能利用水苏糖生长,表明即使是同一个种,不同菌株之间也存在差异。
2.2 菌株生长曲线的测定
为研究筛选出来的肠道菌对水苏糖的利用情况,我们从14种菌中选择24 h内消耗水苏糖最多的菌株即短双歧杆菌L4、齿双歧杆菌L2、长双歧杆菌长亚种L28、假小链双歧杆菌L9、发酵乳杆菌L6、副格氏乳杆菌L7、罗伊氏乳杆菌L17、瘤胃乳杆菌L15以及唾液乳杆菌L23,测定其在以水苏糖作唯一碳源的GMM培养基中的生长曲线(图1)。
由图1可知,不同菌株在以水苏糖作唯一碳源的GMM液体培养基中的生长存在显著差异。菌株生长快慢与初始接种量有关,但更重要的是菌株自身的特性以及对水苏糖利用情况。大多数菌株在培养8 h左右进入稳定期,OD600值能够达到1.0以上,pH值下降至4.0左右。瘤胃乳杆菌L15在到达稳定期时,OD600值高达2.0,表明菌株对水苏糖利用情况较好;短双歧杆菌L4、副格氏乳杆菌L7菌株长势较好,OD600值在1.6左右;齿双歧杆菌L2、发酵乳杆菌L6生长较慢,其中发酵乳杆菌L6生长最慢,有大约8 h的延滞期,10 h之后,OD600值快速增长,一直到第18 h才进入稳定期。

a-短双歧杆菌L4;b-齿双歧杆菌L2;c-长双歧杆菌长亚种L28;d-假小链双歧杆菌L9;e-发酵乳杆菌L6;f-副格氏乳杆菌L7;g-罗伊氏乳杆菌L17;h-瘤胃乳杆菌L15;i-唾液乳杆菌L23
图1 菌株在以水苏糖作唯一碳源的 GMM 培养基中的生长曲线
Fig.1 The growth curves of the strains in GMM medium with stachyose as the sole carbon source
2.3 细菌培养上清液中糖组成分析
通过测定菌株生长过程中上清液中糖组成及含量变化,探究其对水苏糖的利用特性。随着时间的增长,菌株对水苏糖的消耗量增加(表4、表5)。
表4 不同时间菌株上清液中残留糖含量
Table 4 The content of residual stachyose in the supernatant of different strains at different times
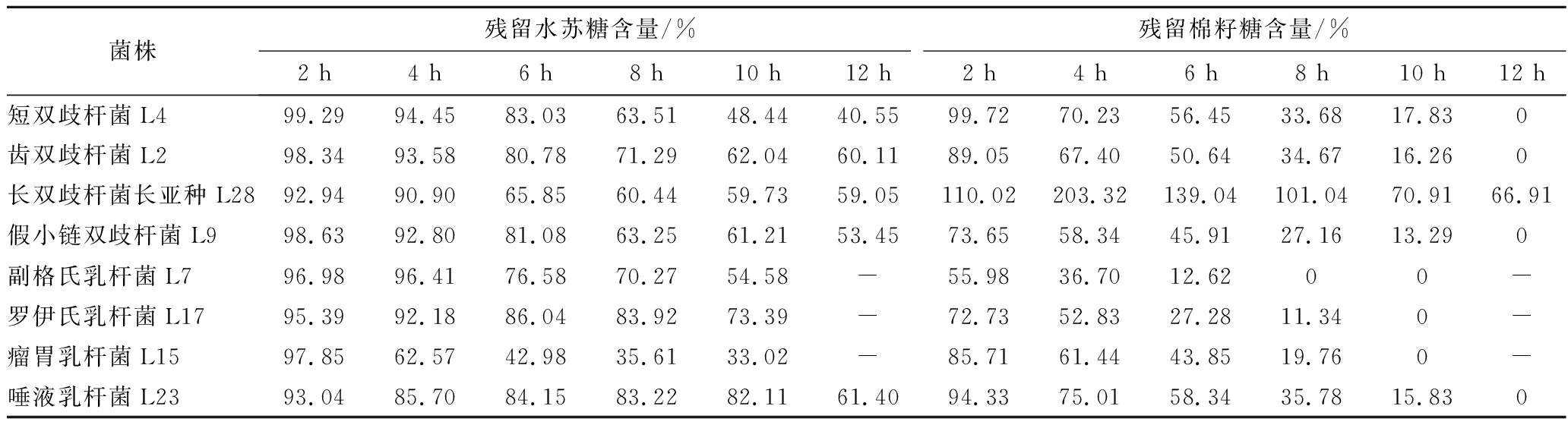
菌株残留水苏糖含量/%残留棉籽糖含量/%2 h4 h6 h8 h10 h12 h2 h4 h6 h8 h10 h12 h短双歧杆菌L499.2994.4583.0363.5148.4440.5599.7270.2356.4533.6817.830齿双歧杆菌L298.3493.5880.7871.2962.0460.1189.0567.4050.6434.6716.260长双歧杆菌长亚种L2892.9490.9065.8560.4459.7359.05110.02203.32139.04101.0470.9166.91假小链双歧杆菌L998.6392.8081.0863.2561.2153.4573.6558.3445.9127.1613.290副格氏乳杆菌L796.9896.4176.5870.2754.58-55.9836.7012.6200-罗伊氏乳杆菌L1795.3992.1886.0483.9273.39-72.7352.8327.2811.340-瘤胃乳杆菌L1597.8562.5742.9835.6133.02-85.7161.4443.8519.760-唾液乳杆菌L2393.0485.7084.1583.2282.1161.4094.3375.0158.3435.7815.830
注:残留水苏糖含量![]() 棉籽糖同理;“-”代表菌株生长已结束,未进行后续测定(下同)
棉籽糖同理;“-”代表菌株生长已结束,未进行后续测定(下同)
表5 不同时间发酵乳杆菌L6上清液中残留糖含量
Table 5 The content of residual stachyose in the supernatant of L.fermentum L6 at different times

菌株残留水苏糖糖含量/%残留棉籽糖含量/%8 h10 h12 h14 h16 h18 h20 h22 h24 h8 h10 h12 h14 h16 h18 h20 h发酵乳杆菌L697.2590.7286.7976.7470.4861.9652.7848.2044.9798.6386.7267.5851.2929.1113.170
由于实验所用的水苏糖中含有少量棉籽糖,因此,在HPLC测定细菌上清液时,会出现棉籽糖的峰[保留时间约为(7.8±0.1)min](图2-a)。实验结果表明,大多数菌株随着时间的增加,上清液中棉籽糖含量不断减少,至不再有棉籽糖检出。仅长双歧杆菌长亚种L28例外,其上清液中棉子糖含量呈现了先增加后减少的趋势,同时在4 h出现了半乳糖[保留时间约为(12.8±0.1)min](图2)。以上结果表明菌株对水苏糖的利用方式存在差异。
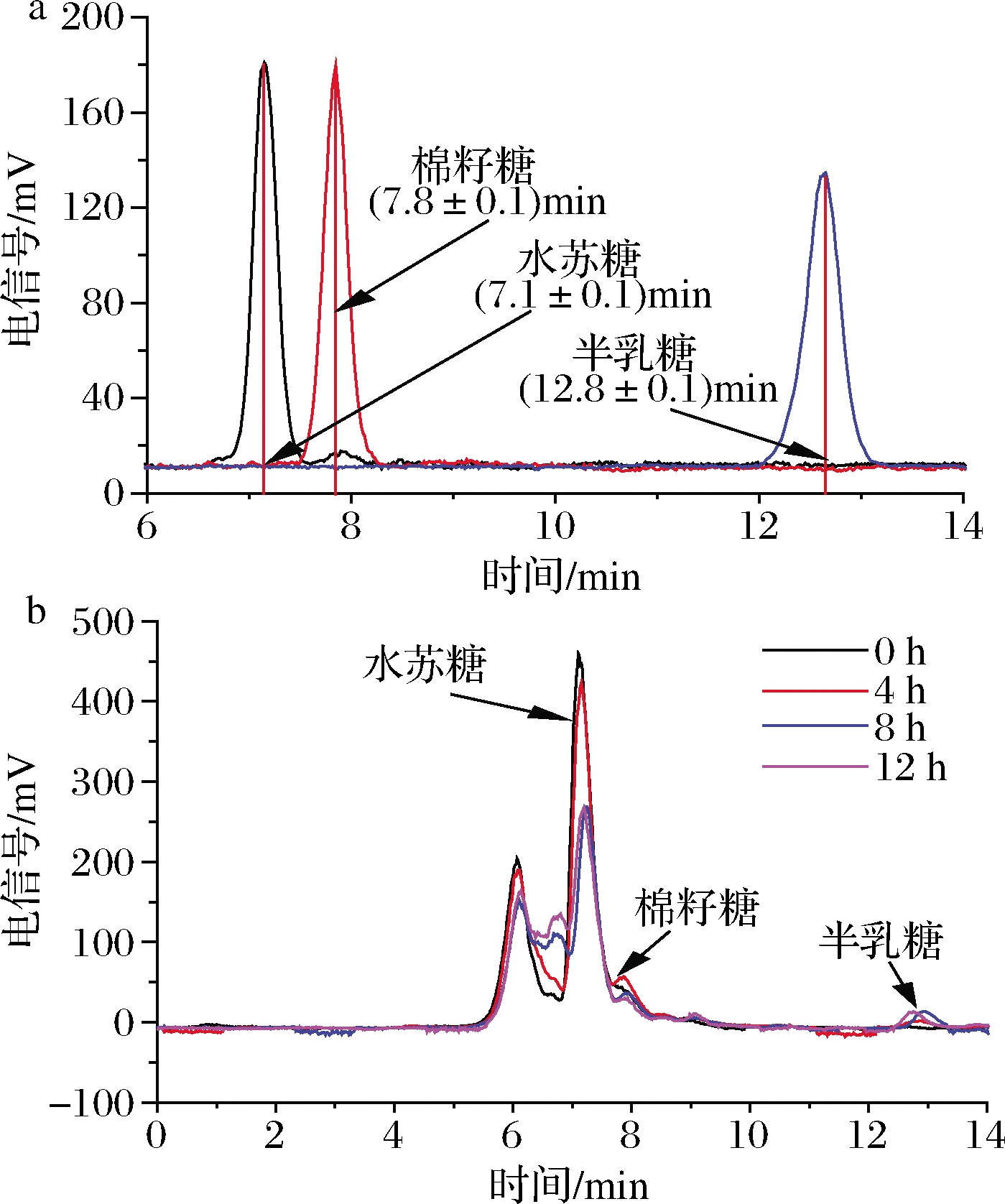
a-不同糖在HPLC中的出峰时间;b-不同时间长双歧杆菌长亚种L28上清液中糖含量变化
图2 长双歧杆菌长亚种L28培养上清液中糖组成的HPLC分析
Fig.2 The composition of sugars in the supernatant of B.longum spp.longum L28 by HPLC analysis
2.4 α-半乳糖苷酶酶活力的测定
肠道细菌水解水苏糖需要α-半乳糖苷酶,DONKOR等[17]测定了双歧杆菌、乳杆菌胞内α-半乳糖苷酶酶活力,发现乳酸双歧杆菌B94酶活力最高,水苏糖水解率也最高。实验中瘤胃乳杆菌L15的α-半乳糖苷酶活力最高,24 h内消耗的水苏糖也最多,约为67%。本实验通过比较胞内外酶活力,以确定酶所在位置,进一步探究其对水苏糖的利用特性。选择生长至稳定期的菌泥与上清液进行酶活力测定,由表6可知,实验菌株以胞内α-半乳糖苷酶为主。短双歧杆菌L4胞内、外酶活力相差最大,胞内约是胞外的2 973倍;齿双歧杆菌L2胞内、外酶活力相差最小,胞内约为胞外的8倍;长双歧杆菌长亚种L28、瘤胃乳杆菌L15、发酵乳杆菌L6、唾液乳杆菌L23胞内酶活力约为胞外的100~360倍。
表6 α-半乳糖苷酶酶活力的测定
Table 6 The determination of α-galactosidase enzyme activity
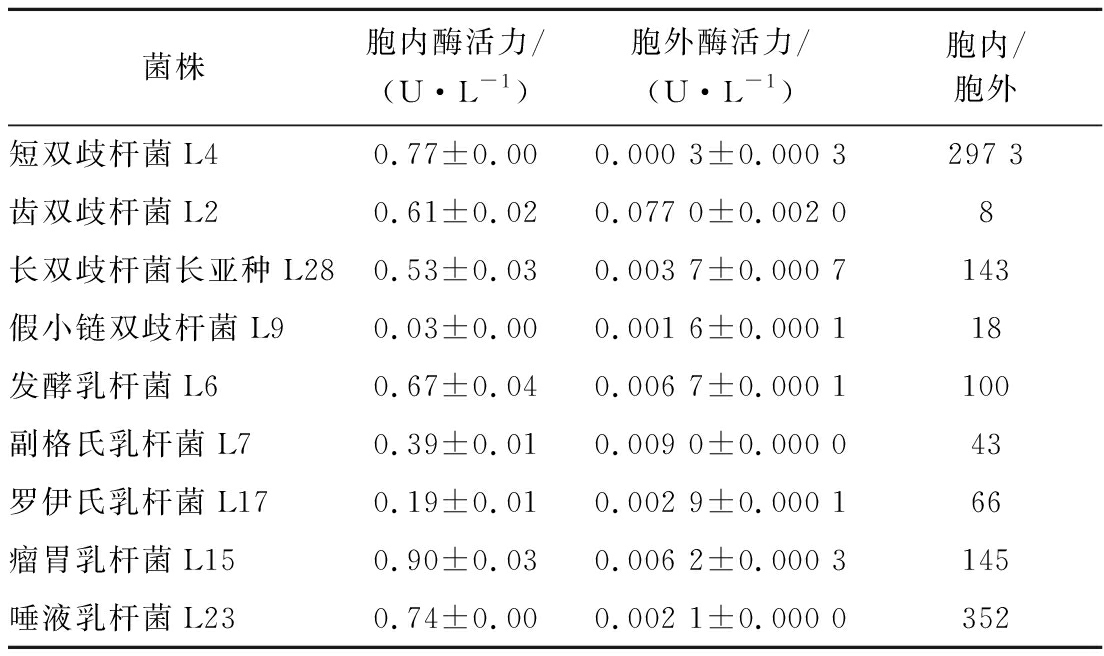
菌株胞内酶活力/(U·L-1)胞外酶活力/(U·L-1)胞内/胞外短双歧杆菌L40.77±0.000.000 3±0.000 3297 3齿双歧杆菌L20.61±0.020.077 0±0.002 08长双歧杆菌长亚种L280.53±0.030.003 7±0.000 7143假小链双歧杆菌L90.03±0.000.001 6±0.000 118发酵乳杆菌L60.67±0.040.006 7±0.000 1100副格氏乳杆菌L70.39±0.010.009 0±0.000 043罗伊氏乳杆菌L170.19±0.010.002 9±0.000 166瘤胃乳杆菌L150.90±0.030.006 2±0.000 3145唾液乳杆菌L230.74±0.000.002 1±0.000 0352
2.5 基因组草图分析
实验菌株均已完成基因组草图测序,由KEGG注释结果可知,水苏糖代谢属于半乳糖代谢路径,其代谢通路涉及了α-半乳糖苷酶(galA)、β-呋喃果糖苷酶(sacA)、α-葡萄糖苷酶(malZ)以及低聚-1,6-葡糖苷酶(malL)(图3)。我们从NCBI上下载了2株能够代谢水苏糖的双歧杆菌和乳杆菌的基因组信息,分别为动物双歧杆菌乳酸亚种ATCC SD5219和副格氏乳杆菌JCM5343,并与实验菌株进行比较。结果显示,所有菌株都具有α-半乳糖苷酶,但并不是所有菌株都含有β-呋喃果糖苷酶、α-葡萄糖苷酶以及低聚-1,6-葡糖苷酶,而且即使是同一种的菌株(副格氏乳杆菌JCM5343和副格氏乳杆菌L7)基因数量也有可能不同(表7)。因此,不同菌株对水苏糖的利用方式不同。
表7 菌株代谢水苏糖相关酶的基因信息
Table 7 The information on enzymes related to stachyose metabolism by strains
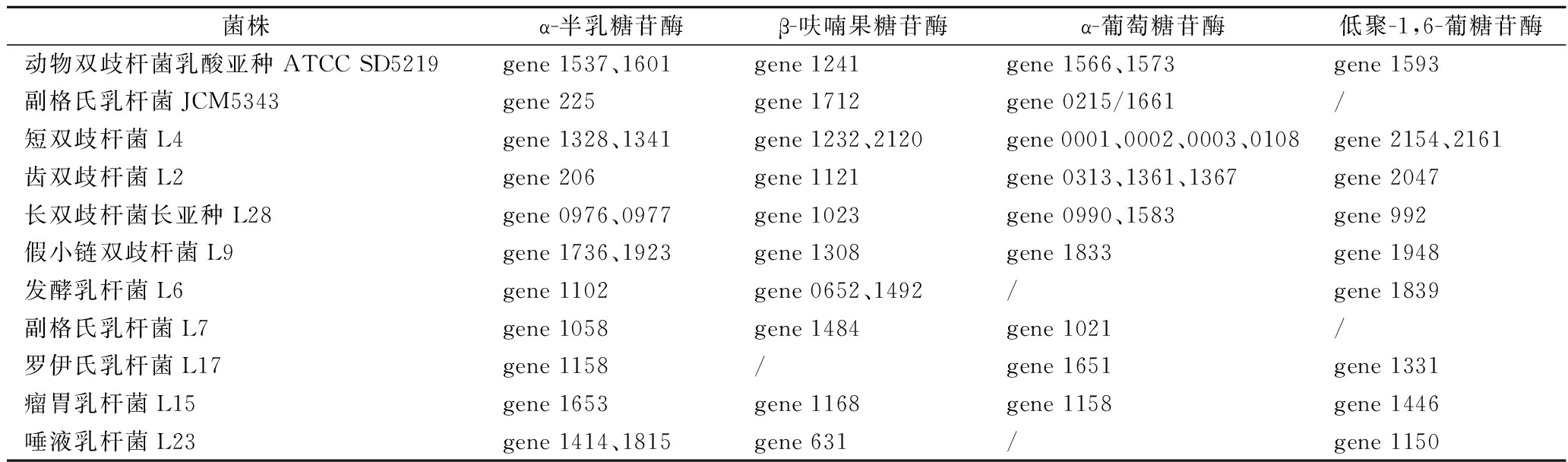
菌株α-半乳糖苷酶β-呋喃果糖苷酶α-葡萄糖苷酶低聚-1,6-葡糖苷酶动物双歧杆菌乳酸亚种ATCC SD5219gene 1537、1601gene 1241gene 1566、1573gene 1593副格氏乳杆菌JCM5343gene 225gene 1712gene 0215/1661/短双歧杆菌L4gene 1328、1341gene 1232、2120gene 0001、0002、0003、0108gene 2154、2161齿双歧杆菌L2gene 206gene 1121gene 0313、1361、1367gene 2047长双歧杆菌长亚种L28gene 0976、0977gene 1023gene 0990、1583gene 992假小链双歧杆菌L9gene 1736、1923gene 1308gene 1833gene 1948发酵乳杆菌L6gene 1102gene 0652、1492/gene 1839副格氏乳杆菌L7gene 1058gene 1484gene 1021/罗伊氏乳杆菌L17gene 1158/gene 1651gene 1331瘤胃乳杆菌L15gene 1653gene 1168gene 1158gene 1446唾液乳杆菌L23gene 1414、1815gene 631/gene 1150
注:“/”代表无相关基因
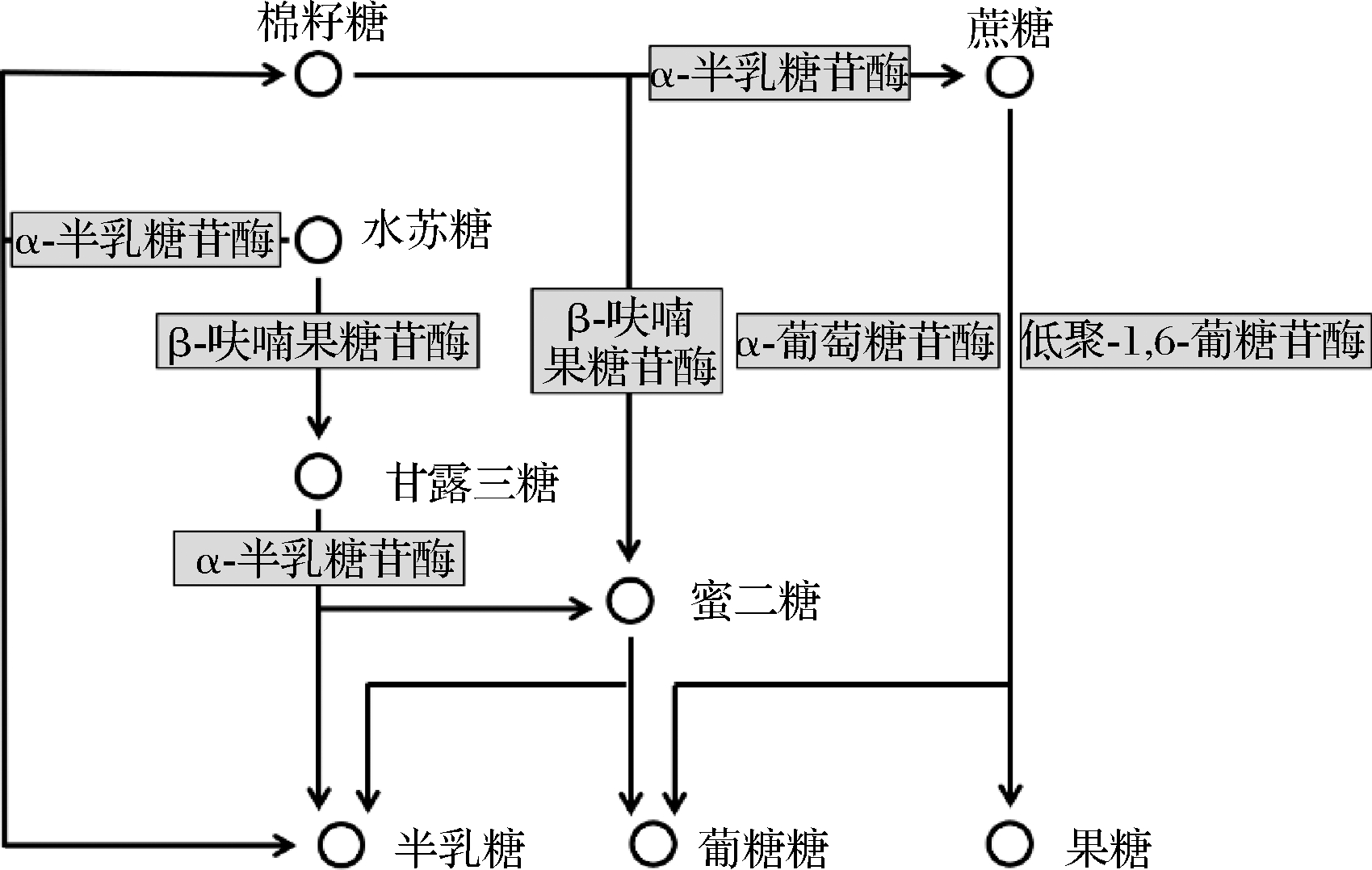
图3 水苏糖的代谢路径
Fig.3 The metabolic pathways of stachyose
我们利用LOCTREE对9株菌株的α-半乳糖苷酶进行亚细胞定位分析。除长双歧杆菌长亚种L28和罗伊氏乳杆菌L17外,大部分实验菌株的α-半乳糖苷酶均存在于细胞质,与酶活力测定结果基本一致(表8)。长双歧杆菌长亚种L28有2个α-半乳糖苷酶基因,根据LOCTREE预测结果显示,1个在细胞质中,1个存在于细胞外。酶活力结果显示长双歧杆菌长亚种L28的胞内酶活力是胞外的143倍,可能是胞内α-半乳糖苷酶的含量远高于胞外。罗伊氏乳杆菌L17仅有1个α-半乳糖苷酶基因,且系统预测该酶存在于细胞外,与酶活力测定结果不符,可能是因为酶活力测定时大量α-半乳糖苷酶尚未分泌到细胞外。
表8 α-半乳糖苷酶的亚细胞定位分析
Table 8 The subcellular localization analysis of α-galactosidase
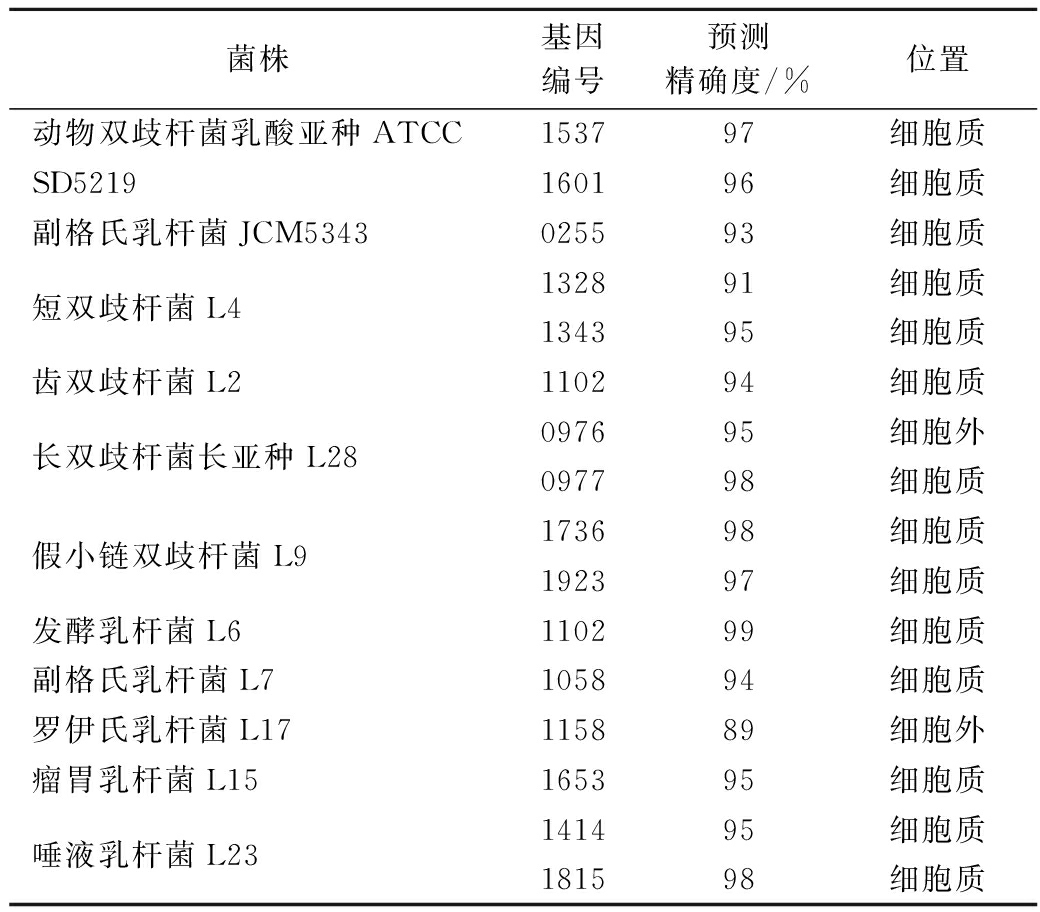
菌株基因编号预测精确度/%位置动物双歧杆菌乳酸亚种ATCC153797细胞质SD5219160196细胞质副格氏乳杆菌JCM5343025593细胞质短双歧杆菌L4132891细胞质134395细胞质齿双歧杆菌L2110294细胞质长双歧杆菌长亚种L28097695细胞外097798细胞质假小链双歧杆菌L9173698细胞质192397细胞质发酵乳杆菌L6110299细胞质副格氏乳杆菌L7105894细胞质罗伊氏乳杆菌L17115889细胞外瘤胃乳杆菌L15165395细胞质唾液乳杆菌L23141495细胞质181598细胞质
酶活力测定以及LOCTREE预测结果显示实验菌株均以胞内α-半乳糖苷酶为主,因此需要相关转运蛋白将水苏糖转运至胞内。已有研究表明,变形链球菌具有多糖代谢转运体,能够利用其转运水苏糖、棉籽糖、蜜二糖等。该转运体由底物结合蛋白(msmE)、2个膜蛋白(msmF,msmG)以及ATP-结合蛋白(msmK)构成[18-19]。之前的研究证明一些肠道菌(如屎肠球菌、粪肠球菌)中存在msmEFG基因,当缺失msmK基因时可能并不影响水苏糖的转运[9]。事实上,msmEFGK转运体属于ABC(ATP-binding cassette)家族的成员[19]。双歧杆菌属已被报道具有msmEFG转运体,并证明该转运体能够转运水苏糖等寡糖[20-22]。本实验研究的双歧杆菌中同样检测到了msmEFG基因,但乳杆菌中并不存在。
实验结果显示,双歧杆菌属在代谢水苏糖的基因方面比较相似,是由msmEFG转运体负责将水苏糖转运至细胞内,再由胞内的4种酶将水苏糖水解成单糖进行利用。其中,长双歧杆菌长亚种L28相对比较特殊。从表观现象来看,HPLC结果表明该菌株生长过程中胞外上清液棉籽糖含量呈现先增加后减少的趋势,同时出现了半乳糖。从基因方面来看,长双歧杆菌长亚种L28代谢水苏糖的相关基因片段更为复杂(图4),除重复出现galA和msmEFG基因之外,还有NagC转录调节因子和lacI转录调节因子,它们是否表达,是否对利用水苏糖有影响,目前尚不可知。根据现有结果,推测长双歧杆菌长亚种L28利用水苏糖的方式可能是:水苏糖在胞外被水解产生棉籽糖和半乳糖,导致其生长过程中出现了棉籽糖以及半乳糖含量的增加;而后期棉籽糖含量减少可能是被转运至细胞内利用,而不是继续在胞外水解,因为并未在上清液中检测到蜜二糖等物质。另外,在模式菌株动物双歧杆菌乳酸亚种ATCC SD5219中,galA基因附近除连续的msmEFG基因外,还出现了NagC转录调节因子,表明该基因可能参与调节水苏糖代谢。
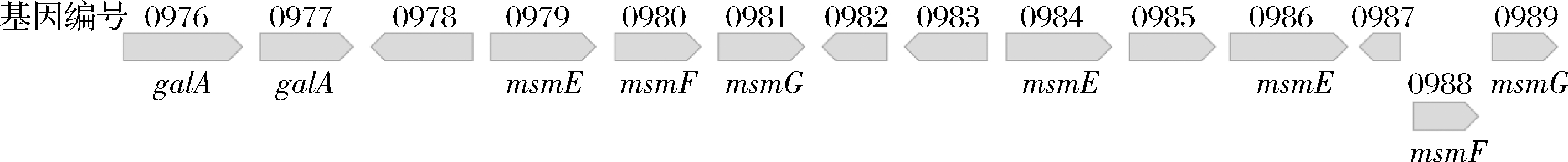
图4 长双歧杆菌长亚种L28中与水苏糖利用相关的基因簇
Fig.4 The gene clusters related to stachyose utilization in B.longum ssp. longum L28
在乳杆菌属5株菌的基因组草图注释结果中,并没有找到msmEFG基因,说明乳杆菌转运水苏糖的方式与双歧杆菌属不同。分析乳杆菌基因组草图,列出可能转运水苏糖的潜在基因(表9)。副格氏乳杆菌JCM5343和副格氏乳杆菌L7结果相似,拥有类似msmEFGK的体系,由3个假定蛋白组成:ABC.X4.S(ABC转运系统底物结合蛋白)、ABC.X4.P(ABC转运系统通透酶)、ABC.X4.A(ABC转运系统ATP结合蛋白),利用这3个基因指导合成的蛋白质转运水苏糖。发酵乳杆菌L6、瘤胃乳杆菌L15、唾液乳杆菌L23可能是通过lacS基因编码的通透酶将水苏糖运输至胞内利用。最初我们认为罗伊氏乳杆菌L17极有可能是利用yagU(假定通透酶)转运水苏糖,但是结合α-半乳糖苷酶的亚细胞定位分析,该基因所产生的通透酶可能是α-半乳糖苷酶分泌到细胞外的通道或载体;其后续利用可能也与其他菌株不同,因为罗伊氏乳杆菌L17并不存在β-呋喃果糖苷酶,可能是利用α-半乳糖苷酶水解成蔗糖,再由α-葡萄糖苷酶或低聚-1,6-葡糖苷酶进一步分解利用。
表9 乳酸菌中转运水苏糖的潜在基因
Table 9 The potential genes for stachyose transport in Lactobacillus

菌株基因编号功能ABC.X4.S0256假定ABC转运系统底物结合蛋白副格氏乳杆菌JCM5343ABC.X4.P0257假定ABC转运系统通透酶ABC.X4.A0258假定ABC转运系统ATP结合蛋白ABC.X4.S1059假定ABC转运系统底物结合蛋白副格氏乳杆菌L7ABC.X4.P1060假定ABC转运系统通透酶ABC.X4.A1061假定ABC转运系统ATP结合蛋白发酵乳杆菌L6lacS1103通透酶瘤胃乳杆菌L15lacS1653通透酶唾液乳杆菌L23lacS1409通透酶罗伊氏乳杆菌L17yagU1159假定通透酶
综上所述,双歧杆菌、乳杆菌大多通过转运蛋白将水苏糖转运至胞内水解利用,但是不同种属的菌株利用水苏糖的基因不同。双歧杆菌主要是通过msmEFG转运体转运水苏糖,再由胞内的多种酶将其水解;乳杆菌转运水苏糖可能是利用了ABC转运系统或其他通透酶。可能也存在一些特例,例如,长双歧杆菌长亚种L28可能是利用胞外α-半乳糖苷酶将水苏糖水解成棉籽糖和半乳糖,再通过msmEFG转运体棉籽糖转运至胞内利用。罗伊氏乳杆菌L17分泌胞外α-半乳糖苷酶将水苏糖水解成蔗糖,再利用α-葡萄糖苷酶或低聚-1,6-葡糖苷酶将其彻底分解利用。
3 结论
本研究分析了人类粪便来源的双歧杆菌、乳杆菌对水苏糖的利用情况及相关代谢基因,得到的实验结果表明,不同菌株对水苏糖的利用方式存在差异,产气机理也不同。双歧杆菌主要通过msmEFG转运体转运水苏糖至胞内,然后由α-半乳糖苷酶、β-呋喃果糖苷酶、α-葡萄糖苷酶或低聚-1,6-葡糖苷酶将其水解利用;乳杆菌主要是通过各种透性酶及其他转运蛋白转运水苏糖至胞内进行利用。此外,如长双歧杆菌长亚种和罗伊氏乳杆菌,这些菌株可能存在胞外α-半乳糖苷酶,可在细胞外将水苏糖初步水解以便进一步利用。研究肠道细菌对水苏糖的利用方式,筛选出能利用水苏糖但不产气的益生菌,可以指导可食用菌种与水苏糖进行合理搭配,为开发功能性产品提供思路。今后可以更深入地研究肠道细菌对水苏糖的利用机制,揭示摄入过量水苏糖引起人体不适的机理,进一步阐明水苏糖与人体健康的关系。
[1] REHMS H, BARZ W.Degradation of stachyose, raffinose, melibiose and sucrose by different tempe-producing Rhizopus fungi[J].Applied Microbiology & Biotechnology, 1995, 44(1-2):47-52.
[2] ZHANG Y J, LI S, GAN R Y, et al.Impacts of gut bacteria on human health and diseases[J].International Journal of Molecular Sciences, 2015, 16(4):7 493-7 519.
[3] OKU T, NAKAMURA S.Digestion, absorption, fermentation, and metabolism of functional sugar substitutes and their available energy[J].Pure & Applied Chemistry, 2002, 74(7):1 253-1 261.
[4] YAZAWA K, IMAI K, TAMURA Z.Oligosaccharides and polysaccharides specifically utilizable by bifidobacteria[J].Chemical & Pharmaceutical Bulletin, 1978, 26(11):3 306-3 311.
[5] HAYAKAWA K, MIZUTANI J, WADA K, et al.Effects of soybean oligosaccharides on human faecal flora[J].Microbial Ecology in Health and Disease, 1990, 3(6):293-303.
[6] PAN Q, ZENG X Q, PAN D D, et al.The proliferation mechanism of Lactobacillus plantarum RB1 stimulated by stachyose[J].Current Microbiology, 2017, 74(6):732-738.
[7] MAO B, LI D, ZHAO J, et al. In vitro fermentation of fructooligosaccharides with human gut bacteria[J].Food & Function, 2015, 6(3):947-954.
[8] SCALABRINI P, ROSSI M, SPETTOLI P, et al.Characterization of Bifidobacterium strains for use in soymilk fermentation[J].International Journal of Food Microbiology, 1998, 39(3):213-219.
[9] 邬佳颖, 毛丙永, 谷佳玉, 等.利用水苏糖的肠道细菌的分离鉴定及其利用特性研究[J].食品与发酵工业, 2020, 46(24):16-23.
WU J Y, MAO B Y, GU J Y, et al.Isolation and identification of the intestinal bacteria capable of utilizing stachyose and its utilization characteristics [J].Food and Fermentation Industries, 2020, 46(24):16-23.
[10] YU J, SONG Y Q, REN Y, et al.Genome-level comparisons provide insight into the phylogeny and metabolic diversity of species within the genus Lactococcus[J].BMC Microbiology, 2017, 17(1):213.
[11] LUO R, LIU B, XIE Y, et al.SOAPdenovo2:An empirically improved memory-efficient short-read de novo assembler[J].GigaScience,2012.DOI:10.1186/2047-217X-1-18.
[12] KURTZ S, PHILLIPPY A, DELCHER A L, et al.Versatile and open software for comparing large genomes[J].Genome Biology, 2004, 5(12):1-9.
[13] BORODOVSKY M, MILLS R, BESEME J, et al.Prokaryotic gene prediction using GeneMark and GeneMark.hmm[J].Current Protocols in Bioinformatics, 2003.DOI:10.1002/0471250953.bi0405s01.
[14] ZARTL B, SILBERBAUER K, LOEPPERT R, et al.Fermentation of non-digestible raffinose family oligosaccharides and galactomannans by probiotics[J].Food & Function, 2018, 9(3):1 638-1 646.
[15] ZHONG X F, ZHANG Y B, HUANG G D, et al.Proteomic analysis of stachyose contribution to the growth of Lactobacillus acidophilus CICC22162[J].Food & Function, 2018, 9(5):2 979-2 988.
[16] YOON M Y, HWANG H J.Reduction of soybean oligosaccharides and properties of α-d-galactosidase from Lactobacillus curvatus R08 and Leuconostoc mesenteriodes JK55[J].Food Microbiology, 2008, 25(6):815-823.
[17] DONKOR O N, HENRIKSSON A, VASILJEVIC T, et al.α-Galactosidase and proteolytic activities of selected probiotic and dairy cultures in fermented soymilk[J].Food Chemistry, 2007, 104(1):10-20.
[18] RUSSELL R R, ADUSE-OPOKU J, SUTCLIFFE I C, et al.A binding protein-dependent transport system in Streptococcus mutans responsible for multiple sugar metabolism[J].Journal of Biological Chemistry, 1992, 267(7):4 631-4 637.
[19] WEBB A J, HOMER K A, HOSIE A H F.Two closely related ABC transporters in Streptococcus mutans are involved in disaccharide and/or oligosaccharide uptake[J].Journal of Bacteriology, 2008, 190(1):168-178.
[20] 苏思韵, 杨思婷, 张宇博, 等.益生菌ABC转运体寡糖结合蛋白的结构学研究进展[J].食品工业科技, 2020, 41(17):327-334.
SU S Y, YANG S T, ZHANG Y B, et al.Research progress in the structure of oligosaccharide binding proteins of ABC transporter in probiotics[J].Science and Technology of Food Industry, 2020, 41(17):327-334.
[21] ANDERSEN J M, BARRANGOU R, ABOU HACHEM M, et al.Transcriptional analysis of oligosaccharide utilization by Bifidobacterium lactis Bl-04[J].BMC Genomics, 2013, 14:312-326.
[22] EJBY M, FREDSLUND F, ANDERSEN J M, et al.An ATP binding cassette transporter mediates the uptake of α-(1,6)-linked dietary oligosaccharides in Bifidobacterium and correlates with competitive growth on these substrates[J].Journal of Biological Chemistry, 2016, 291(38):20 220-20 231.