燃料乙醇是备受世界各国关注的清洁能源之一。以陈化粮为原料发酵法生产燃料乙醇时,蒸馏废液经固液分离、蒸发浓缩、干燥等工序联产酒糟蛋白饲料(distillers dried grains with solubles,DDGS),有效解决了高浓度蒸馏废液的污染难题。但DDGS生产过程中仍然会产生大量低化学需氧量(chemical oxyen demand,COD)浓度的蒸发冷凝水,直接排放会污染环境。目前,国内多数燃料乙醇生产企业采用好氧生化的处理方法,将蒸发冷凝水COD降解至0.5 g/L以下后进入城市污水管网,或进一步深度处理后达标排放。生化处理虽然解决了废水污染问题,但衍生了生化剩余污泥的二次污染问题[1-2],同时新鲜水资源浪费严重。
开发蒸发冷凝水资源化回用技术,实现蒸发冷凝水零排放,不仅能彻底消除蒸发冷凝水的污染问题,同时可以节约水资源,降低生产成本。蒸发凝结水直接回用拌料是最简单的回用方式,但实验证明蒸发冷凝水回用会降低乙醇发酵速率,有研究认为苯乙醇、糠醛是蒸发冷凝水中的主要抑制物[3-4]。
为了使蒸发冷凝水可以回用于乙醇发酵,研究者们尝试了离子交换、树脂吸附、反渗透以及它们两两组合的方法来处理蒸发冷凝水[5-7], 其中反渗透结合离子交换的处理方法,可以使蒸发冷凝水的回用率达到 87.5%[7]。但是反渗透存在膜污染、设备购置成本高以及需要消耗大量电力等问题。生物处理方法被广泛应用到燃料乙醇废水的处理上[8],然而蒸发冷凝水的有机物浓度低,其COD值仅为1.045 g/L,因此现有的生物处理方法如厌氧消化并不适合处理蒸发冷凝水。综上因素,研究者们正在探寻蒸发冷凝水再利用的新方法。
臭氧(O3)是一种强氧化剂,可以高效降解水体中的有机物[9-11],O3也会在水中自行降解[12],没有二次污染的问题,且O3不需要昂贵的设备,被认为是一种经济高效的有机物降解手段。ROZAS等 [13]进行的O3降解有机微污染物(organic micropollutants, OMPs)实验中,生长了24 h的水蚤在水体被氧化1 h后固定率降至20%。这表明O3对有机废水具有很好的解毒作用。
基于已有的研究成果,本文采用O3氧化的方法处理蒸发冷凝水,并将氧化后的蒸发冷凝水回用于乙醇发酵,检验O3氧化技术在蒸发冷凝水资源化全回用中的可行性。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
酵母菌种为实验室保藏;液体种子培养基(g/L):葡萄糖20,酵母粉8.5,NH4Cl 1.3,MgSO4·7H2O 0.1,CaCl2 0.06,115 ℃灭菌15 min。
1.1.2 实验材料
市售大米;蒸发冷凝水(pH 3.6~3.9,略微浑浊,淡黄色或米白色,有类似酒糟的特殊气味,COD值为1.045 g/L左右),蚌埠中粮生化燃料乙醇有限公司;耐高温α-淀粉酶(酶活力100 000 U/mL,最适作用温度95 ℃,最适作用pH 5.5)、糖化酶(酶活力100 000 U/mL,最适作用温度60 ℃,最适作用pH 5),无锡杰能科公司。
1.1.3 仪器与设备
BF-CS-310臭氧发生器,广州百丰环保科技有限公司;GCMS-QP2010 ULTRA气质联用仪,日本岛津公司;戴安U-3000液相色谱仪,美国戴安公司。
1.2 实验方法
1.2.1 蒸发冷凝水的氧化处理
取250 mL蒸发冷凝水于锥形瓶中,以10 g/h通入O3, 反应温度为25 ℃。
1.2.2 蒸发冷凝水的GC/MS分析
用浓H2SO4将蒸发冷凝水的pH调至与氧化后蒸发冷凝水相同,取样进行GC/MS分析。
1.2.3 苯乙醇、糠醛、有机酸检测
苯乙醇、糠醛[14-15]、有机酸[16]的检测方法参照文献。
1.2.4 乙醇发酵实验
乙醇发酵实验方法参照文献[17-18];乙醇含量的测定采用蒸酒法,酵母数采用血球计数板法计数,酵母活性检测参照文献[7]。
2 结果与分析
2.1 蒸发冷凝水全回用对乙醇发酵的影响
分别以自来水和蒸发冷凝水作为发酵工艺用水进行乙醇发酵,发酵30 h并定时取样测定发酵系统的失重以及乙醇和甘油的产量。结果如表1所示,发酵系统的失重源自于乙醇发酵途径产生的CO2的散失,单位时间内发酵系统的失重可以反映酵母的发酵速率。在发酵前12~30 h,蒸发冷凝水的发酵失重均低于自来水,表明蒸发冷凝水对乙醇发酵产生了明显的不利影响,降低了乙醇发酵的速率。由于乙醇的产生与CO2的产生相关联,因此发酵失重降低时乙醇的产量也相应的下降。其次,蒸发冷凝水作为工艺用水时,发酵副产物甘油的含量明显高于自来水对照组。酿酒酵母产生甘油的行为通常被认为是其面对环境胁迫的一种应对机制[19],因此进一步说明了蒸发冷凝水直接回用会对乙醇发酵产生抑制作用。
表1 蒸发冷凝水全回用对乙醇发酵的影响
Table 1 Effect of the total reutilization of condensate on the ethanol fermentation
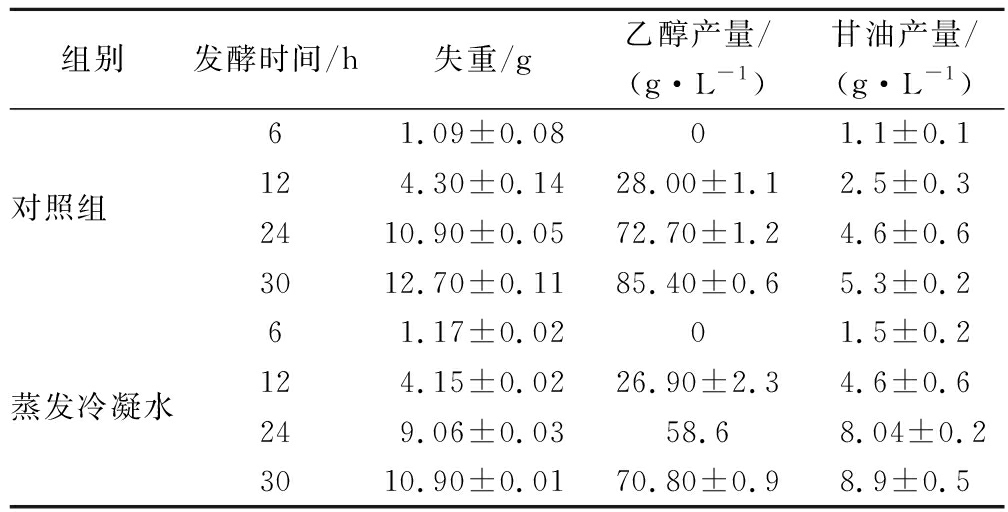
组别发酵时间/h失重/g乙醇产量/(g·L-1)甘油产量/(g·L-1)61.09±0.0801.1±0.1对照组 124.30±0.1428.00±1.12.5±0.32410.90±0.0572.70±1.24.6±0.63012.70±0.1185.40±0.65.3±0.261.17±0.0201.5±0.2蒸发冷凝水124.15±0.0226.90±2.34.6±0.6249.06±0.0358.68.04±0.23010.90±0.0170.80±0.98.9±0.5
2.2 O3氧化后蒸发冷凝水的组分分析
由于蒸发冷凝水对乙醇发酵具有抑制作用,本文尝试采用O3氧化的方法处理蒸发冷凝水以期消除其抑制性。氧化结束后首先采用GC/MS对蒸发冷凝水进行组分分析,如表2所示。
表2 O3氧化后蒸发冷凝水的GC/MS组分分析
Table 2 Analysis of the condensate treated by O3 oxidation using GC/MS

种类氧化前氧化后数目峰面积比/%数目峰面积比/%醇 28331218.1呋喃 1812.1114.1烯烃 334.9191.1烷烃 230.6120.18醛 120.3175.6酸 148.22017.3酯 3122.1276酮 368.9409.7其他 1829.914837.9总检出377100306100
由表2可以看出,氧化150 min后的蒸发冷凝水中醇类、呋喃类以及烯烃类化合物种类明显减少,这表明O3对蒸发冷凝水具有良好的氧化效果。氧化后蒸发冷凝水中总检出组分降低了18.8%,推断此现象为有机组分在O3作用下发生化学转化以及更进一步的无机化造成的。由于蒸发冷凝水组分复杂且归一化法无法衡量各组分的实际浓度,因此单纯的组分分析无法评估蒸发冷凝水的抑制性变化。所以还需进行乙醇发酵实验观察O3氧化后蒸发冷凝水的抑制性变化。图1为O3氧化前后蒸发冷凝水的GC/MS总离子流图。
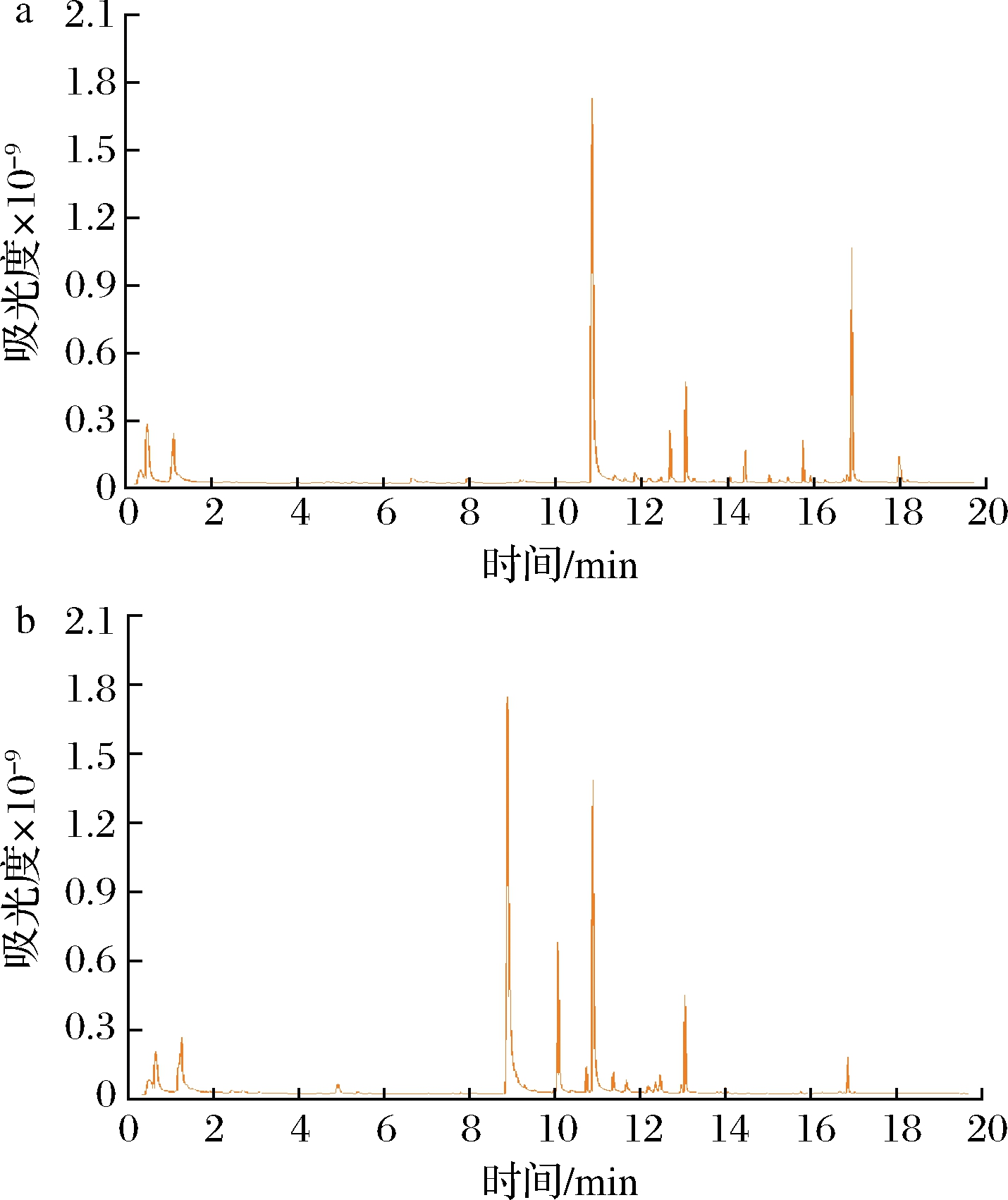
a-氧化前;b-氧化后
图1 O3氧化后蒸发冷凝水GC/MS总离子流色谱图
Fig.1 TIC chromatograms of the condensate treated by O3 oxidation using GC/MS
2.3 O3氧化后的蒸发冷凝水对乙醇发酵的影响
将氧化后的蒸发冷凝水回用于乙醇发酵实验,并在处于指数期的24 h时测定发酵系统的失重、乙醇以及甘油的产量。已有研究认为蒸发冷凝水中苯乙醇、糠醛是抑制乙醇发酵的物质[3-4],实验发现在O3作用下蒸发冷凝水中的苯乙醇、糠醛随氧化时间延长不断被降解,反应结束时苯乙醇、糠醛的降解率分别达到99.5%、100% (图2)。由于蒸发冷凝水中以苯乙醇、糠醛为代表的有机物不断被降解,发酵系统的发酵速率以及乙醇产量逐渐得到恢复,同时甘油的产量也相应降低(表3)。实验中我们注意到氧化处理150 min的蒸发冷凝水显著提高了乙醇发酵速率并将乙醇产量提高了8.3% (表3),这表明O3氧化处理不仅能解除蒸发冷凝水对乙醇发酵的抑制,而且对乙醇发酵具有促进作用。蒸发冷凝水的COD值并不高,仅有1.045 g/L,氧化结束后蒸发冷凝水的COD值仅降低了2.4%。由于O3氧化并不能将有机物完全无机化(表2,图2),所以推测O3氧化后蒸发冷凝水促进乙醇发酵的现象是O3氧化过程中产生的小分子物质作用的结果。
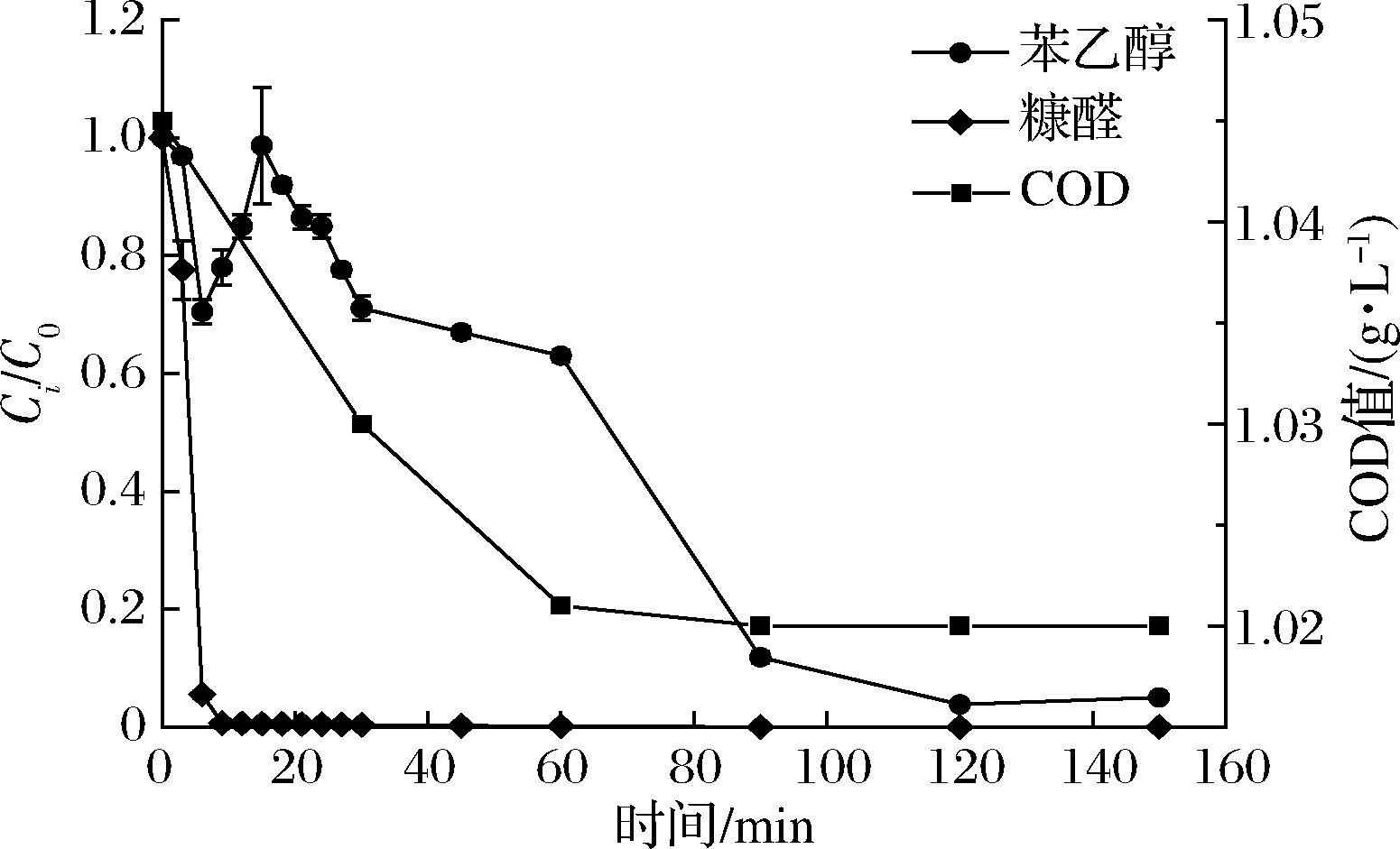
Ci-抑制物在i时刻的质量浓度;C0-抑制物初始质量浓度
图2 O3氧化过程中,蒸发冷凝水中苯乙醇、糠醛的浓度变化以及蒸发冷凝水COD值的变化
Fig.2 Temporal variation of COD value and concentrations of phenylethanol, furfural in the O3 oxidation of condensate
2.4 O3氧化后的蒸发冷凝水促进乙醇发酵原因的初步探究
羧酸会在O3氧化有机物的过程中累积[12, 20],通过对氧化后蒸发冷凝水中有机酸的监测发现氧化后蒸发冷凝水中乙酸、丙酸的含量明显增加。反应结束后乙酸、丙酸含量分别升高16.3%、22.4%(图3)。YANG等 [17]研究发现当乙酸质量浓度低于1.5 g/L时,乙酸最高可以增加3%的乙醇产量,ZHANG等[18]发现在丙酸质量浓度低于2.2 g/L时,丙酸最高可以增加7.6%的乙醇产量,所以推断乙酸、丙酸是氧化后蒸发冷凝水中促进乙醇发酵的物质。PAMPULHA等 [21]研究发现一定浓度的羧酸可以提高酵母的底物消耗速率,并降低菌体的得率系数,所以随着O3氧化的进行,由于乙酸、丙酸的积累发酵系统的酵母数出现了降低的现象(表4),但是氧化后的蒸发冷凝水对乙醇发酵却起到了促进的作用(表3),也说明酵母的数量与乙醇发酵的好坏并没有直接的关系。
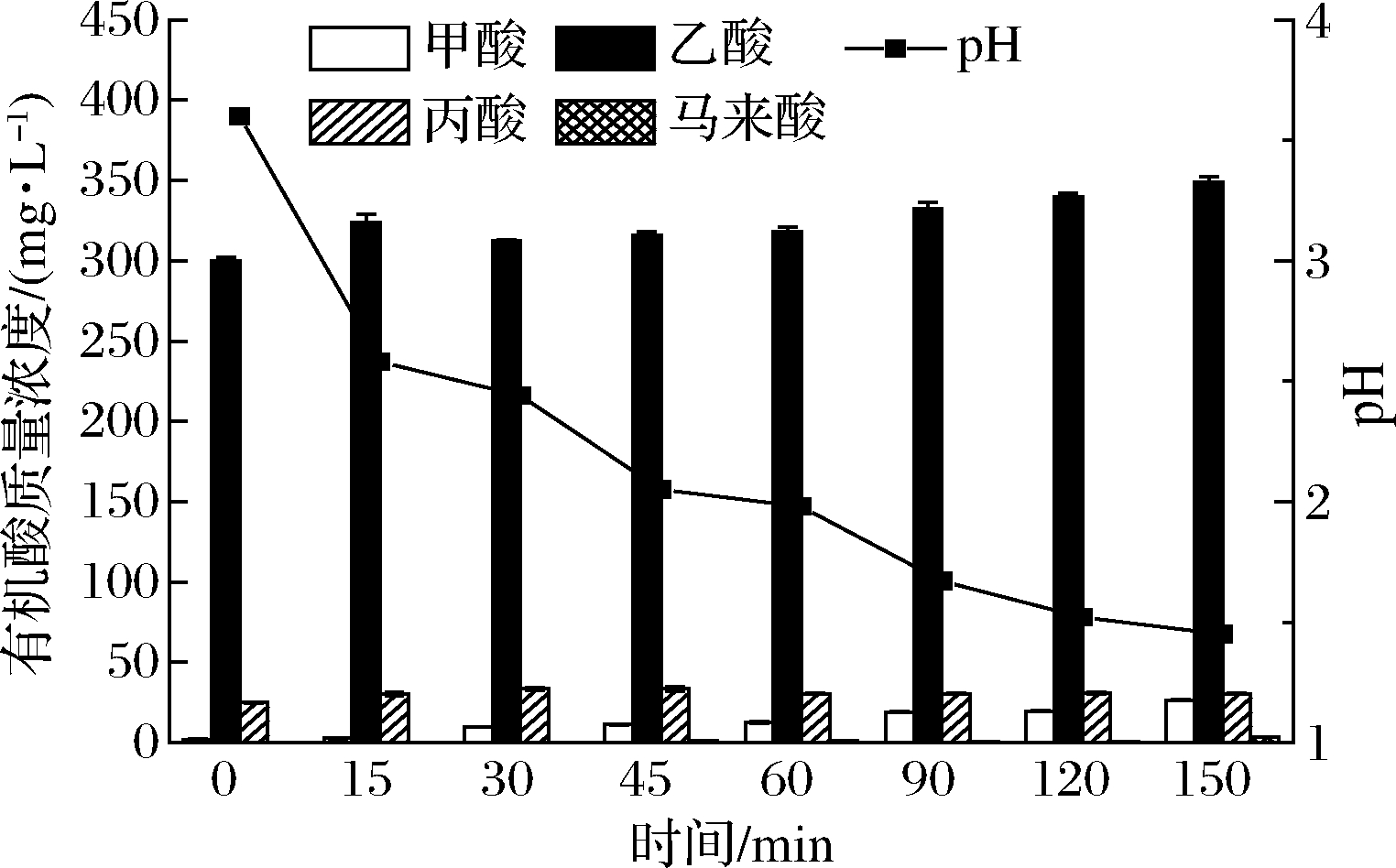
图3 O3氧化过程中蒸发冷凝水中有机酸的生成
Fig.3 Profile of organic acids concentrations in the condensate during O3 oxidation
表3 O3氧化蒸发冷凝水回用乙醇发酵结果分析
Table 3 Parameters of ethanol fermentation using condensate treated by O3 oxidation
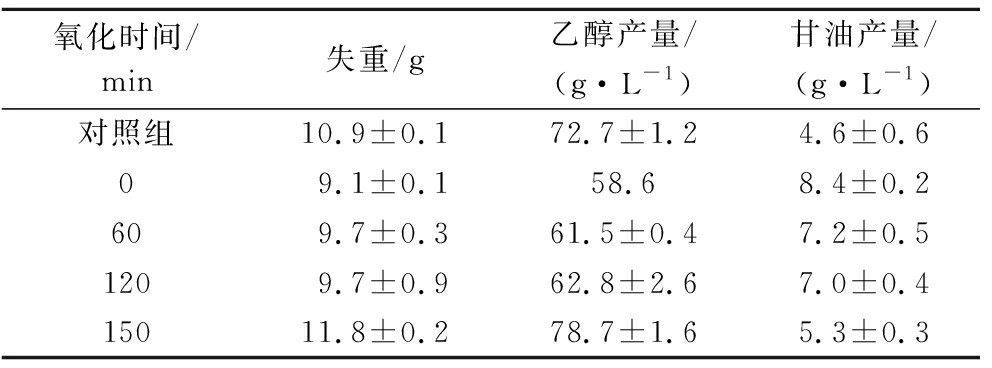
氧化时间/min失重/g乙醇产量/(g·L-1)甘油产量/(g·L-1)对照组10.9±0.172.7±1.24.6±0.609.1±0.158.68.4±0.2609.7±0.361.5±0.47.2±0.51209.7±0.962.8±2.67.0±0.415011.8±0.278.7±1.65.3±0.3
为了进一步探究氧化后蒸发冷凝水促进乙醇发酵的机理,实验中对酵母活性进行了鉴定。我们知道高活性酵母细胞处于旺盛生长状态,而低活性酵母细胞则处于衰老、休眠的状态。在乙醇发酵过程中酵母主要是在指数生长期快速转化还原糖并产生乙醇,这一阶段高活性酵母细胞比例最高,因此为了进一步观察O3氧化后的蒸发冷凝水对酵母细胞的影响,实验采用美蓝染色法来统计高活性酵母细胞的比例,由实验结果可以看出O3氧化150 min的蒸发冷凝水可以将指数生长期的高活性酵母细胞比例提高至95%,高于对照组的90%(表4)。
表4 O3氧化后蒸发冷凝水对酵母数以及酵母活性的影响
Table 4 Effect of the condensate treated by O3 oxidation on yeast number and yeast activity
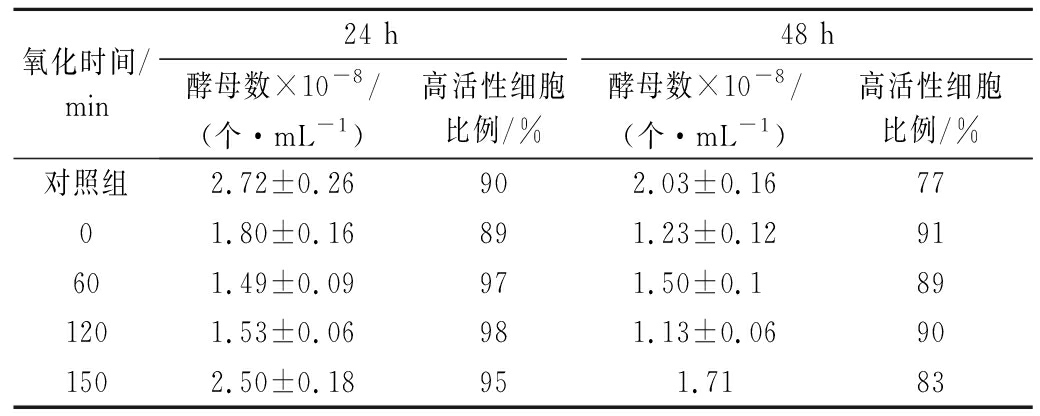
氧化时间/min24 h48 h酵母数×10-8/(个·mL-1)高活性细胞比例/%酵母数×10-8/(个·mL-1)高活性细胞比例/%对照组2.72±0.26902.03±0.167701.80±0.16891.23±0.1291601.49±0.09971.50±0.1 891201.53±0.06981.13±0.06901502.50±0.18951.7183
所以经过O3氧化的蒸发冷凝水中累积的乙酸、丙酸是O3氧化后的蒸发冷凝水促进乙醇发酵的诱因,即乙酸、丙酸的存在增强了乙醇发酵过程中酵母的活性,提高了还原糖的转化效率进而对乙醇发酵产生了促进作用。
值得注意的是当对照组酵母细胞进入到衰退期后,蒸发冷凝水组高活性酵母细胞的比例出现了升高的现象(表4),结合表1的实验结果得出结论,蒸发冷凝水对乙醇发酵的抑制作用主要表现为降低了酵母细胞的活性进而延长了乙醇发酵周期,当然这种低效的生产方式是不能被工厂所采用的。
3 结论与讨论
蒸发冷凝水直接回用会抑制乙醇发酵导致发酵速率降低,O3可以高效降解蒸发冷凝水中的抑制物苯乙醇、糠醛,进而减轻蒸发冷凝水对乙醇发酵的抑制性。蒸发冷凝水经O3 氧化后产生的乙酸、丙酸等有机酸可以提高高活性酵母细胞的比例,同时降低细胞密度,高活性的酵母细胞提高了乙醇的发酵速率进而提高了乙醇的产量。实验证明采用O3氧化的方法可以实现蒸发冷凝水的全部回用。
[1] 谭克林, 吴喜勇.城市污水厂污泥处理及处置现状分析[J].广东化工, 2017, 44(13):186-187.
TAN K L, WU X Y.Present situation and analysis of sludge treatment and disposal in city wastewater treatment plant [J].Guangdong Chemical Industry, 2017, 44 (13):186-187.
[2] LIANG Y, XU D H, FENG P, et al.Municipal sewage sludge incineration and its air pollution control[J].Journal of Cleaner Production, 2021, 295:126456.
[3] COUALLIER E M, PAYOT T, BERTIN A P, et al.Recycling of distillery effluents in alcoholic fermentation[J].Applied Biochemistry & Biotechnology, 2006, 133(3):217-237.
[4] 张春明. SPSC01废液全循环乙醇连续发酵及发酵副产物对酵母生长和乙醇发酵的影响研究[D].大连:大连理工大学, 2010.
ZHANG C M.Studies on continuous ethanol fermentation with recycling of distillage and impact of by-products on growth and ethanol fermentation of the self-flocculating yeast SPSC01 [D].Dalian:Dalian University of Technology,2010.
[5] MORIN-COUALLIER E, FARGUES C, LEWANDOWSKI R, et al.Reducing water consumption in beet distilleries by recycling the condensates to the fermentation phase[J].Journal of Cleaner Production, 2008, 16(5):655-663.
[6] FARGUES C, LEWANDOWSKI R, LAMELOISE M L.Evaluation of ion-exchange and adsorbent resins for the detoxification of beet distillery effluents[J].Industrial & Engineering Chemistry Research, 2010, 49(19):9 248-9 257.
[7] LAMELOISE M L, GAVACH M, BOUIX M, et al.Combining reverse osmosis and ion-exchange allows beet distillery condensates to be recycled as fermentable dilution water[J].Desalination, 2015, 363:75-81.
[8] 王柯, 张建华, 毛忠贵.生物质乙醇生产废水处理技术的研究进展[J].食品与生物技术学报, 2018, 37(3):225-231.
WANG K, ZHANG J H, MAO Z G.Research advances in bioethanol wastewater treatment technologies[J].Journal of Food Science and Biotechnology, 2018, 37 (3):225-231.
[9] 牟洁. 臭氧氧化技术在水处理中的应用研究[J].环境与发展, 2018, 30(1):81-82.
MOU J.Application of ozone oxidation technology in water treatment [J].Environment and Development, 2018, 30(1):81-82.
[10] 李杨, 朱夔, 李晶蕊, 等.采用臭氧催化氧化法深度处理石化污水[J].石化技术与应用, 2016, 34(5):410-413.
LI Y, ZHU K, LI J R, et al.Advanced treatment of petrochemical wastewater by ozone catalytic oxidation method[J].Petrochemical Technology and Application, 2016, 34 (5):410-413.
[11] SINGH S, SETH R, TABE S, et al.Oxidation of emerging contaminants during pilot-scale ozonation of secondary treated municipal effluent[J].Ozone:Science & Engineering, 2015, 37(4):323-329.
[12] WERT E C, ROSARIO-ORTIZ F L, DRURY D D, et al.Formation of oxidation byproducts from ozonation of wastewater[J].Water Research, 2007, 41(7):1 481-1 490.
[13] ROZAS O, BAEZA C, ![]() K,et al.Organic micropollutants (OMPs) oxidation by ozone:Effect of activated carbon on toxicity abatement[J].Science of the Total Environment, 2017, 590-591:430-439.
K,et al.Organic micropollutants (OMPs) oxidation by ozone:Effect of activated carbon on toxicity abatement[J].Science of the Total Environment, 2017, 590-591:430-439.
[14] 尤亮. 酿酒酵母2-苯乙醇耐受性高产突变株选育的研究[D].杭州:浙江工业大学, 2016.
YOU L.Study on screening the Saccharomyces cerevisiae mutant for 2-phenylethanol resistance and higher production [D].Hangzhou:Zhejiang University of Technology, 2016.
[15] 朱洋, 吴馨娜, 刘绿叶.高效液相色谱法同时测定土壤中的5-羟甲基糠醛和糠醛[J].广东化工, 2019, 46(17):164-165.
ZHU Y, WU X N, LIU L Y.Determination of 5-hydroxymethyl-2-furfural and 2-furaldehyde in soil by high performance liquid chromatography [J].Guangdong Chemical Industry, 2019, 46 (17):164-165.
[16] 周勇. 生产废水清液和二次凝水回用对燃料乙醇发酵的影响[J].广西科学, 2020, 27(2):188-194.
ZHOU Y.Effects of supernatant and secondary condensate from industrial waste water on fuel ethanol fermentation [J].Guangxi Sciences, 2020, 27(2):188-194.
[17] YANG X C, WANG K, ZHANG J H, et al.Effect of acetic acid in recycling water on ethanol production for cassava in an integrated ethanol-methane fermentation process[J].Water Science &Technology, 2016, 74(10):2 392-2 398.
[18] ZHANG C M, DU F G, WANG X, et al.Effect of propanoic acid on ethanol fermentation by Saccharomyces cerevisiae in an ethanol-methane coupled fermentation process[J].Chinese Journal of Chemical Engineering, 2012, 20(5):942-949.
[19] 时桂芹, 任菲, 谢冰宗, 等.高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J].食品工业科技, 2019, 40(20):94-100.
SHI G Q, REN F, XIE B Z, et al.Effect of high-glucose condition on antioxidant activity and metabolism of Saccharomyces cerevisiae [J].Science and Technology of Food Industry, 2019, 40 (20):94-100.
[20] 高俊贤, 阮智宇, 徐科威, 等.臭氧氧化工艺对污水处理厂二级出水的处理特性[J].环境工程, 2020, 38(7):88-92;18.
GAO J X, RUAN Z Y, XU K W, et al.Characteristics of ozone oxidation process on treatment of secondary effluent of wastewater treatment plant [J].Environmental Engineering, 2020, 38 (7):88-92;18.
[21] PAMPULHA M E, LOUREIRO-DIAS M C.Energetics of the effect of acetic acid on growth of Saccharomyces cerevisiae[J].FEMS Microbiology Letters, 2000, 184(1):69-72.