手掌参(Gymnadenia conopsea R.Br.)系兰科手掌参属多年生草本植物手参或粗脉手参的块茎,主要分布于西藏、四川、云南、甘肃、陕西、内蒙古及东北等地区[1]。常用于蒙、藏药中,具有止咳平喘、益肾健脾、理气和血、止痛、抗氧化、抗肿瘤等功效[2-4]。手掌参除具有很高的药用价值外,在西藏等地区手掌参常被作为泡酒、褒汤和烹煮的滋补食品使用,是一种药食同源植物。手掌参不但含有蛋白质、脂肪和维生素等营养成分,还含有皂苷、甾醇、酚酸、生物碱、多糖等活性成分[5-6]。
多糖广泛分布于植物物体内,具有提高机体免疫力、调节肠道菌群、抗氧化、抗肿瘤、抗炎、降血脂、降血糖等作用,已被作为药品、保健品和功能食品的添加剂使用[7-8]。研究发现,提取方法对多糖提取率和生物活性具有一定的影响作用,因此筛选高效的提取方法对研究多糖具有重要意义[9-10]。多糖是手掌参主要活性成分之一,目前国内外关于手掌参多糖研究报道较少,提取手掌参多糖的方法有热水提取法和超声辅助提取法2种方法[11-12],因此手掌参多糖具有很好的研究开发前景。自由基具有强氧化性,它能够使生物膜中多不饱和脂肪酸发生过氧化反应,导致蛋白质的交联物增多,失去细胞本身的作用,最终引起细胞功能积累性退化衰老,对机体造成不可逆损伤。研究表明,多糖具有很好的清除自由基作用,并且与合成的抗氧化剂相比,天然的多糖具有低毒、副作用小、来源广等特点。因此多糖的清除自由基能力常作为评价其抗氧化活性的重要指标[13-14]。本文采用不同提取方法获得手掌参多糖的提取物,并对多糖体外抗氧化活性进行比较,分析不同提取方法对手掌参多糖理化性质和抗氧化活性的影响,为手掌参多糖功能性食品开发提供依据,有助于提升其药食两用价值。
1 材料与方法
1.1 材料与试剂
手掌参,四川小金县,烘干、粉碎后备用;单糖标准品、纤维素酶(10 000 U/g)、间羟基联苯、DPPH、ABTS、1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP),上海源叶生物科技有限公司;其他试剂均为国产分析纯,上海国药集团化学试剂有限公司。
1.2 仪器与设备
WFZ UV-2100紫外可见分光光度计,尤尼柯(上海)仪器有限公司;RE-2000旋转蒸发器,上海亚荣生化仪器厂;XH-300UL电脑微波超声波紫外光组合催化合成仪,北京祥鹄科技发展有限公司;DK-S26电热恒温水浴锅,上海森信实验仪器有限公司;XO-SM50超声微波组合反应系统,南京先欧生物科技有限公司;Agilent-1260高效液相色谱仪,美国;LGJ-10真空冷冻干燥机,北京四环科学仪器厂;FTIR-8404傅里叶红外交换光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 材料预处理
手掌参粉末用石油醚回流脱脂,过滤,粉末挥干石油醚备用。
1.3.2 手掌参多糖的制备
称取2.0 g预处理的手掌参样品5份,分别按1∶30 (g∶mL)的料液比加入蒸馏水,90 ℃下提取3 h;磷酸盐缓冲液(pH 5.0)、10%纤维素酶(以手掌参质量计)、50 ℃下提取40 min,沸水浴灭酶活5 min;蒸馏水、超声功率280 W、50 ℃下提取40 min;磷酸盐缓冲液(pH 5.0)、10%纤维素酶(以手掌参质量计)、超声功率280 W、50 ℃下提取40 min,沸水浴灭酶活5 min;蒸馏水、微波频率450 W、50 ℃下提取15 min。提取结束后,5 000 r/min离心15 min,提取液浓缩至约30 mL,加入4倍体积95%(体积分数)乙醇沉淀24 h,5 000 r/min 离心15 min,沉淀经冷冻干燥后得到热水法提取手掌参多糖(Gymnadenia conopsea polysaccharides extracted by hot water,GCP-H)、酶辅助法提取手掌参多糖(Gymnadenia conopsea polysaccharides extracted by enzyme,GCP-E)、超声辅助法提取手掌参多糖(Gymnadenia conopsea polysaccharides extracted by ultrasonic,GCP-U)、超声-酶辅助法提取手掌参多糖(Gymnadenia conopsea polysaccharides extracted by ultrasonic-enzyme,GCP-UE)、微波辅助法提取手掌参多糖(Gymnadenia conopsea polysaccharides extracted by microwave,GCP-M)。
1.3.3 手掌参多糖提取率
分别将5种手掌参多糖样品用蒸馏水溶解后定容至100 mL,再稀释一定倍数,以葡萄糖为标准品绘制标准曲线,采用苯酚-硫酸法测定多糖浓度[15],按如下公式计算多糖提取率。
手掌参多糖提取率计算如公式(1)所示:
提取率![]()
(1)
式中:C为多糖质量浓度,mg/mL;V 为多糖溶液体积,mL;n 为稀释倍数;m 为称取的手掌参粉末质量,g。
1.3.4 手掌参多糖一般理化性质分析
采用苯酚-硫酸法测定中性糖含量、间羟基联苯法测定糖醛酸含量[16]、考马斯亮蓝法测定蛋白质含量[17]。
1.3.5 单糖组成分析[18-20]
1.3.5.1 多糖组分酸水解
分别称取10 mg 5种手掌参多糖置于密封的水解瓶中,加入4 mL 4 mol/L三氟乙酸,110 ℃水解5 h。加入适量无水乙醇,氮气吹干至无酸味。
1.3.5.2 PMP衍生
分别称取5 mg葡萄糖(glucose,Glc)、甘露糖(D-mannose,Man)、葡萄糖醛酸(D-glucuronic acid,GlcA)、鼠李糖(L-rhamnose monohydrate,Rha)、半乳糖醛酸(D-galacturonic acid,GalA)、木糖(xylose,Xyl)6种单糖标准品置于容器中,再分别向水解蒸干的样品和6种单糖标准品中加入200 μL 0.5 mol/L PMP溶液和200 μL 0.3 mol/L NaOH溶液,混匀,70 ℃水浴反应30 min。待冷却后,反应液用0.3 mol/L HCl溶液调至中性,加入2 mL蒸馏水和4 mL乙酸异戊酯,涡旋混匀后静置10 min,除去上层溶液,重复萃取2次。取下层溶液,加入4 mL氯仿,涡旋混匀后静置10 min,除去下层溶液,取上清液用蒸馏水定容至5 mL,过0.22 μm滤头后备用。
1.3.5.3 分析条件
Agilent 1260高效液相色谱仪,色谱柱为Eclipse Plus C18(4.6 mm×250 mm,5 μm),流动相为0.1 mol/L 乙酸胺-乙腈溶液[V(乙酸胺)∶V(乙腈)=83∶17],流速1.0 mL/min,紫外检测器,柱温30 ℃,检测波长250 nm,进样量20 μL。
1.3.6 红外光谱分析
将5种多糖样品与 KBr 压制成片,采用红外光谱仪在4 000~500 cm-1 波数范围测定光谱吸收值。
1.3.7 抗氧化性分析
将5种多糖样品和维生素C分别配制成0.25、0.5、1.0、2.0、4.0 mg/mL 5个浓度梯度溶液,备用。
1.3.7.1 对羟自由基的清除作用[21]
反应体系中加入2 mL 9 mmol/L FeSO4溶液、2 mL 9 mmol/L 水杨酸-乙醇溶液、2 mL待测多糖溶液、2 mL 10 mmol/L H2O2溶液,混匀,37 ℃水浴30 min,510 nm测吸光度值记为A样品。用蒸馏水代替水杨酸,按上述方法测定吸光度A对照。用蒸馏水代替多糖提取液, 按上述方法测定吸光度A空白,维生素C做阳性对照,羟自由基清除率计算如公式(2)所示:
羟自由基清除率![]()
(2)
1.3.7.2 对DPPH自由基的清除作用[22]
取2 mL多糖溶液,加入2 mL 0.05 mg/mL DPPH乙醇溶液,混匀,暗室反应30 min,517 nm测吸光度值记为A样品,用蒸馏水代替 DPPH溶液,按上述方法测定吸光度A对照。用无水乙醇代替多糖溶液按上述方法测定吸光度为A空白,维生素C做阳性对照,DPPH自由基清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
1.3.7.3 对ABTS阳离子自由基的清除作用[23]
取10 mL 7 mmol/L ABTS溶液和10 mL 4.9 mmol/L过硫酸钾溶液混匀,于室温、暗处反应16 h后用pH 7.4的磷酸盐缓冲液稀释使其在734 nm下吸光度值为0.7左右,得到ABTS工作液。取0.1 mL待测多糖溶液,加入3.9 mL ABTS工作液,混匀,静置6 min,734 nm测吸光度值记为A1。用蒸馏水代替多糖样品做空白对照记为A0,维生素C做阳性对照,按公式(4)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(4)
2 结果与分析
2.1 提取方法对手掌参多糖提取得率的影响
5种手掌参多糖提取率结果如图1所示。方差分析显示,5种不同提取方法得到的手掌参多糖提取率差异显著(P<0.05),多糖提取率由高到低依次为:GPS-E、GPS-UE、GPS-U、GPS-H、GPS-M。通过提取率的比较可知,采用酶辅助提取方法所得多糖的提取率最高,原因可能是手掌参中多糖部分与细胞壁的纤维素和半纤维素结合,纤维素酶能够水解和破坏纤维素空间结构,促进细胞内的多糖扩散到溶剂中,该结果与苏平等[24]研究结果一致。有研究表明超声功率和时间会对纤维素酶活力产生影响[25],本研究的超声条件可能导致了纤维素酶活力减弱,使得超声-酶辅助法的提取率低于酶辅助法。超声-酶辅助提取和超声辅助提取多糖得率高于热水提取法,同时超声辅助提取所用的时间比热水提取的短,超声波的空化效应对原料的组织和细胞壁产生了破坏作用,使原料和溶剂之间有更大的接触面积,多糖更易溶出,提高了提取效率。超声-酶辅助法提取率高于超声辅助法,可能是纤维素酶协助超声提取可以破坏植物组织的细胞壁,加速胞内多糖的溶出。微波辅助法手掌参多糖提取率最低,一方面原因可能是微波较高功率破坏了手掌参多糖的结构,另一方面原因可能是微波频率的振动增加了手掌参细胞内其他小分子物质的加剧溶出从而降低了手掌参多糖的提取率[26]。因此,采用微波辅助法提手掌参多糖时,需要将提取条件控制在相对较温和的条件下。
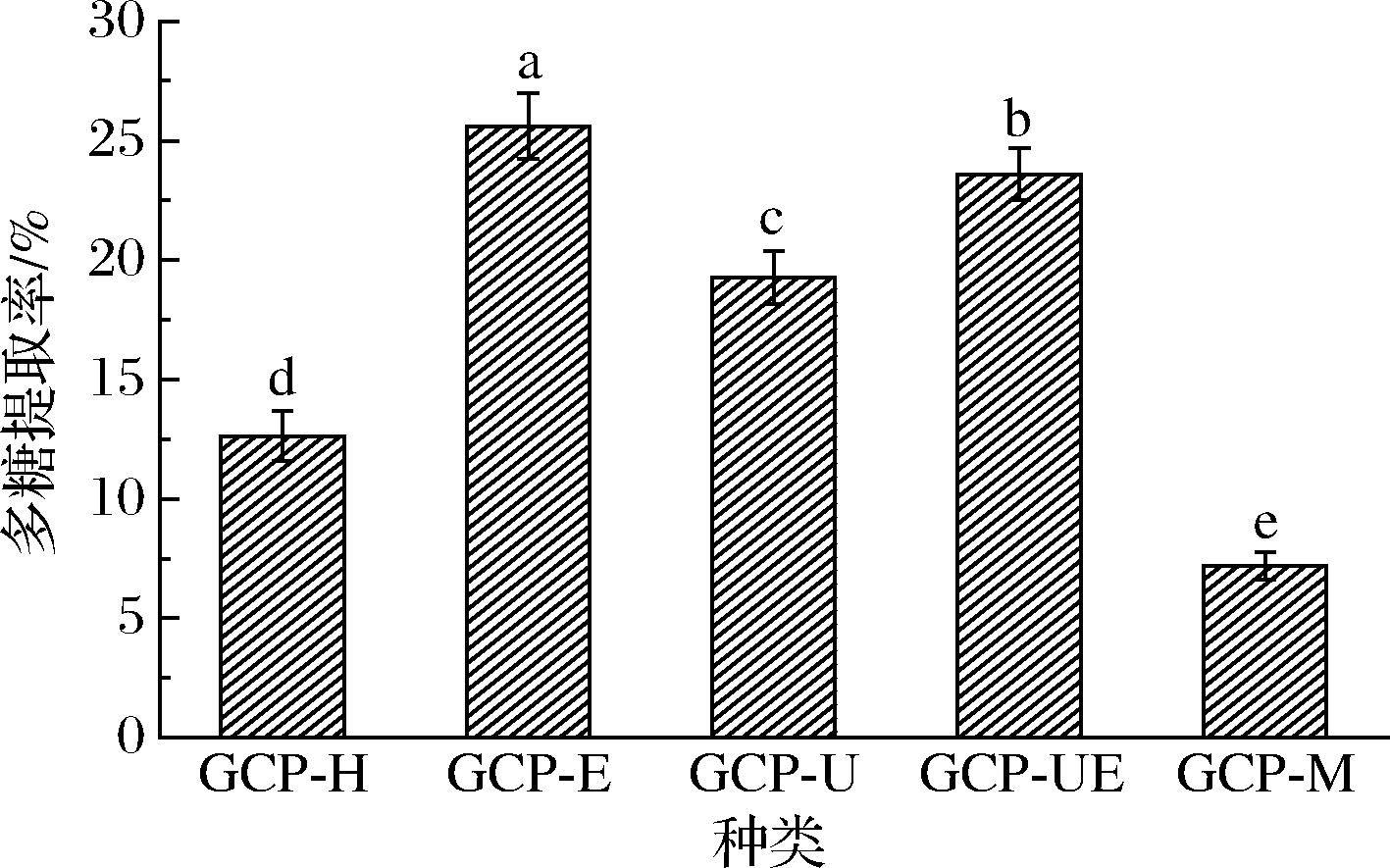
图1 提取方法对手掌参多糖提取率的影响
Fig.1 Effect of extraction methods on extraction yields of Gymnadenia conopsea polysaccharides
注:不同小写字母表示差异显著(下同)
2.2 提取方法对手掌参多糖理化性质的影响
如表1所示,5种方法制备的多糖中都含少量与糖类基团紧密相连的蛋白质类物质,其中超声辅助提取法中所含的蛋白质质量分数高于其他方法,可能是超声波对手掌参的细胞壁结构造成了更大的破坏,释放出了更多的非多糖成分。5种多糖中糖醛酸含量均较低,说明手掌参多糖为中性多糖。此结果与张晓红等[27]结果一致。
表1 手掌参多糖基本化学组成 单位:%
Table 1 The chemical compositions of Gymnadenia conopsea polysaccharides
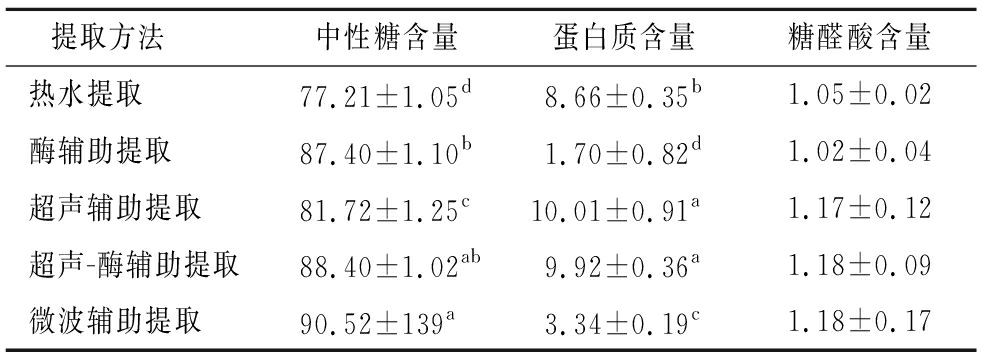
提取方法 中性糖含量蛋白质含量糖醛酸含量热水提取77.21±1.05d8.66±0.35b1.05±0.02酶辅助提取87.40±1.10b1.70±0.82d1.02±0.04超声辅助提取81.72±1.25c10.01±0.91a1.17±0.12超声-酶辅助提取88.40±1.02ab9.92±0.36a1.18±0.09微波辅助提取90.52±139a3.34±0.19c1.18±0.17
注:同一列不同小写字母表示差异显著(P<0.05)(下同)
2.3 单糖组成分析实验结果
采用PMP柱前衍生法检测手掌参多糖的单糖组成,通过比较图2标准品和图3样品衍生物的保留时间定性分析结果,5种手掌参多糖水解PMP衍生物中均含有Man和Glc两种单糖。结果表明手掌参中的多糖属于葡甘聚糖,这与张晓红等[28]研究结果一致。提取方法对手掌参多糖单糖组成种类没有影响,但是对2种单糖的含量会有影响。
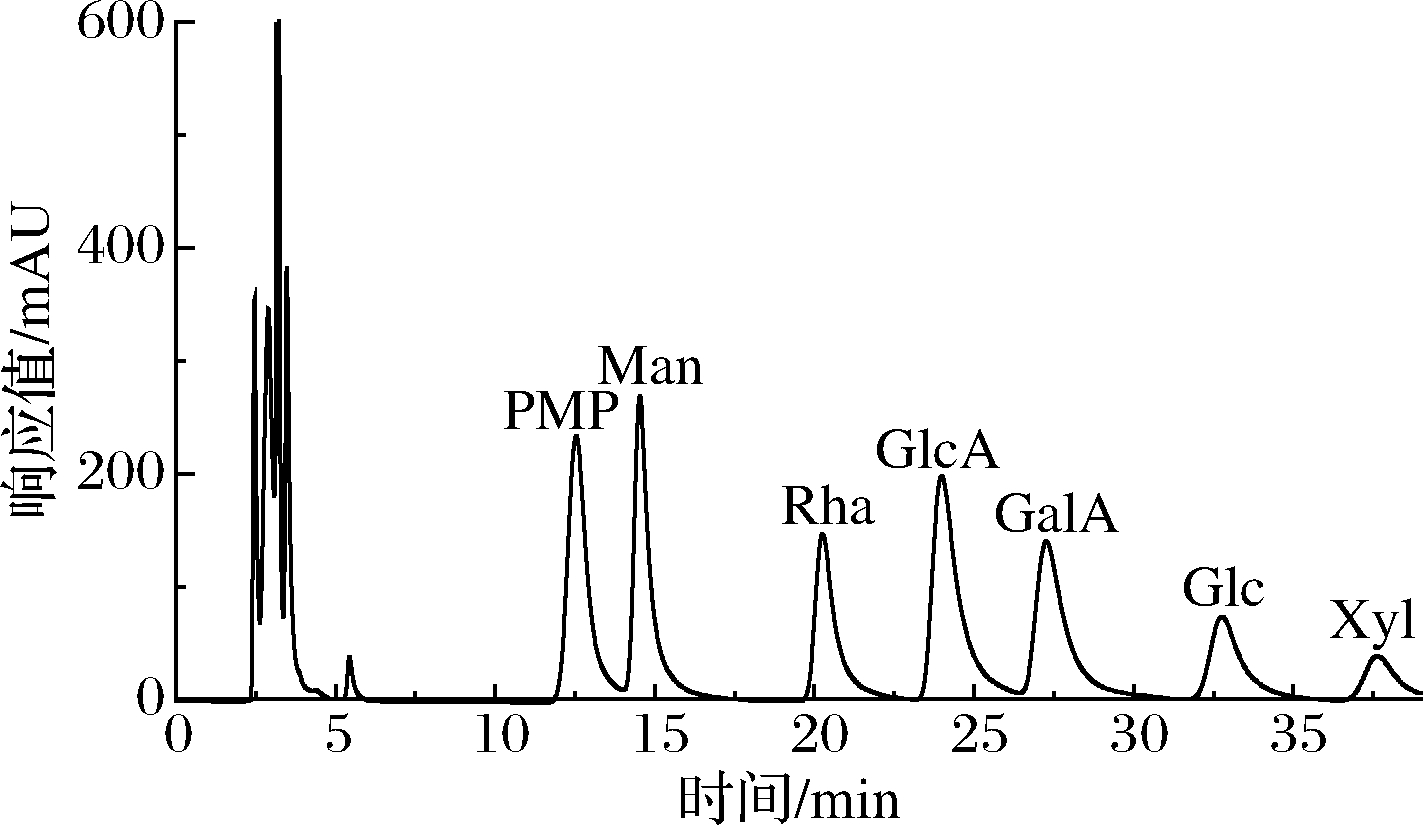
图2 单糖标准品PMP衍生物HPLC色谱图
Fig.2 HPLC spectra of PMP derivatives of the standard monosaccharides
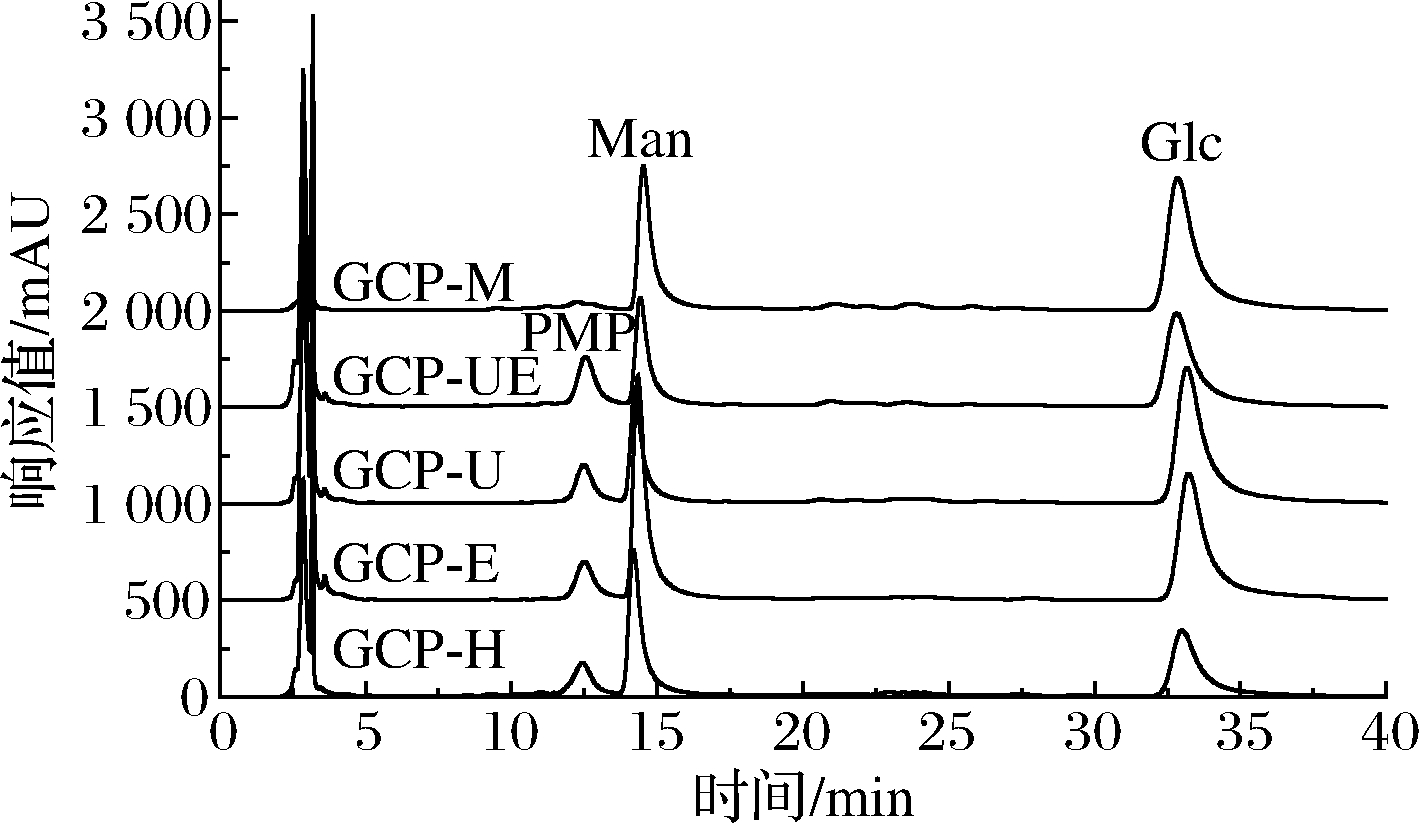
图3 手掌参多糖水解PMP衍生物HPLC色谱图
Fig.3 HPLC spectra of PMP derivatives of monosaccharides from Gymnadenia conopsea polysaccharides
2.4 红外光谱分析实验结果
利用红外光谱对几种不同提取方式提取的手掌参多糖结构进行初步分析,结果如图4 所示。5种多糖在4 000~500 cm-1均具有糖类物质特征基团吸收峰。3 365 cm-1处强而宽的吸收峰是多糖分子内和分子间O—H伸缩振动的结果。2 926 cm-1附近的吸收峰是CH2和CH3的C—H伸缩振动形成的。1 027 cm-1附近的拉伸峰是由糖环C—O—C或C—O—H的拉伸形成的,为吡喃环的特征吸收峰[29]。874、870 cm-1是β-糖苷键的特征吸收峰。从图4红外光谱可知,5种方法提取的手掌参多糖红外光谱图基本一致,只是指纹区略有差异,表明提取方法对手掌参多糖的化学结构不会产生影响,研究结果与刘江等[30]结果一致。
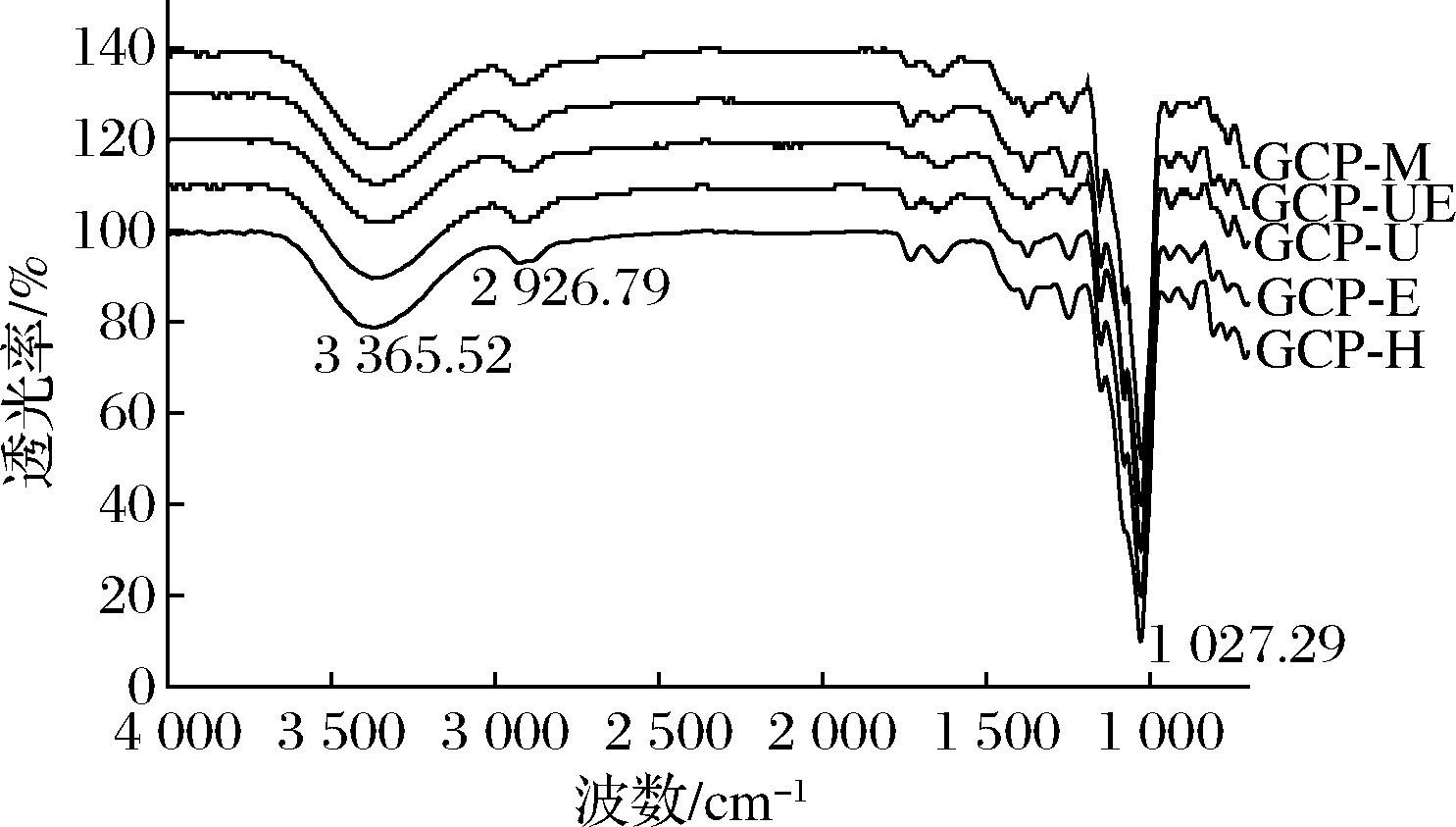
图4 手掌参多糖红外光谱图
Fig.4 Fourier transform infrared spectra of Gymnadenia conopsea polysaccharides
2.5 提取方法对手掌参多糖抗氧化活性的影响
2.5.1 对羟自由基的清除作用
羟自由基是一种反应性极强的化学分子,作为损伤作用最强的自由基,能够很容易穿过生物的细胞膜,与多种生物分子发生反应,导致组织损伤或细胞死亡,因此清除羟自由基对于维持生命系统的健康状态十分重要。由图5可以看出,5种方法提取的手掌参多糖对羟自由基都有一定的清除作用,其清除能力随多糖质量浓度的增大而增强。当多糖质量浓度达到4.0 mg/mL时,GCP-E的清除作用最强,其清除率达到61.33%。原因可能是在酶解条件下,多糖结构中更多的活性基团得以暴露,从而提升了多糖的抗氧化能力[31]。
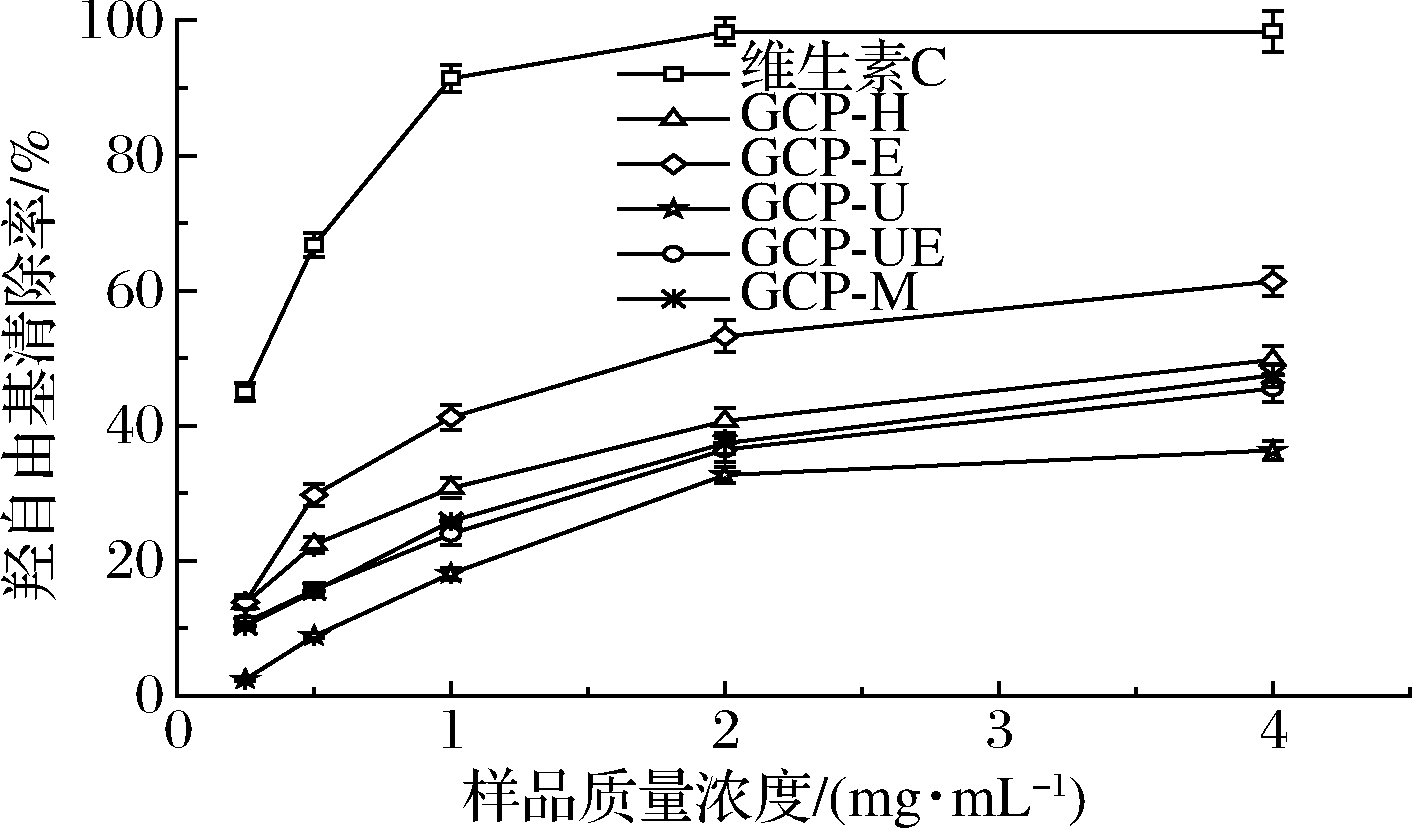
图5 手掌参多糖对羟自由基的清除作用
Fig.5 Scavenging effects of Gymnadenia conopsea polysaccharides on hydroxyl free radical
2.5.2 对DPPH自由基的清除作用
由图6可以看出,5种方法提取的手掌参多糖对DPPH自由基清除能力随多糖浓度的增大而增强。GCP-E清除DPPH自由基作用强于其他4种多糖,当多糖质量浓度为4.0 mg/mL时,其清除率达可到78.98%。有研究表明,多糖聚合度、单糖组成及糖苷键类型与DPPH自由基的清除能力有关[32]。
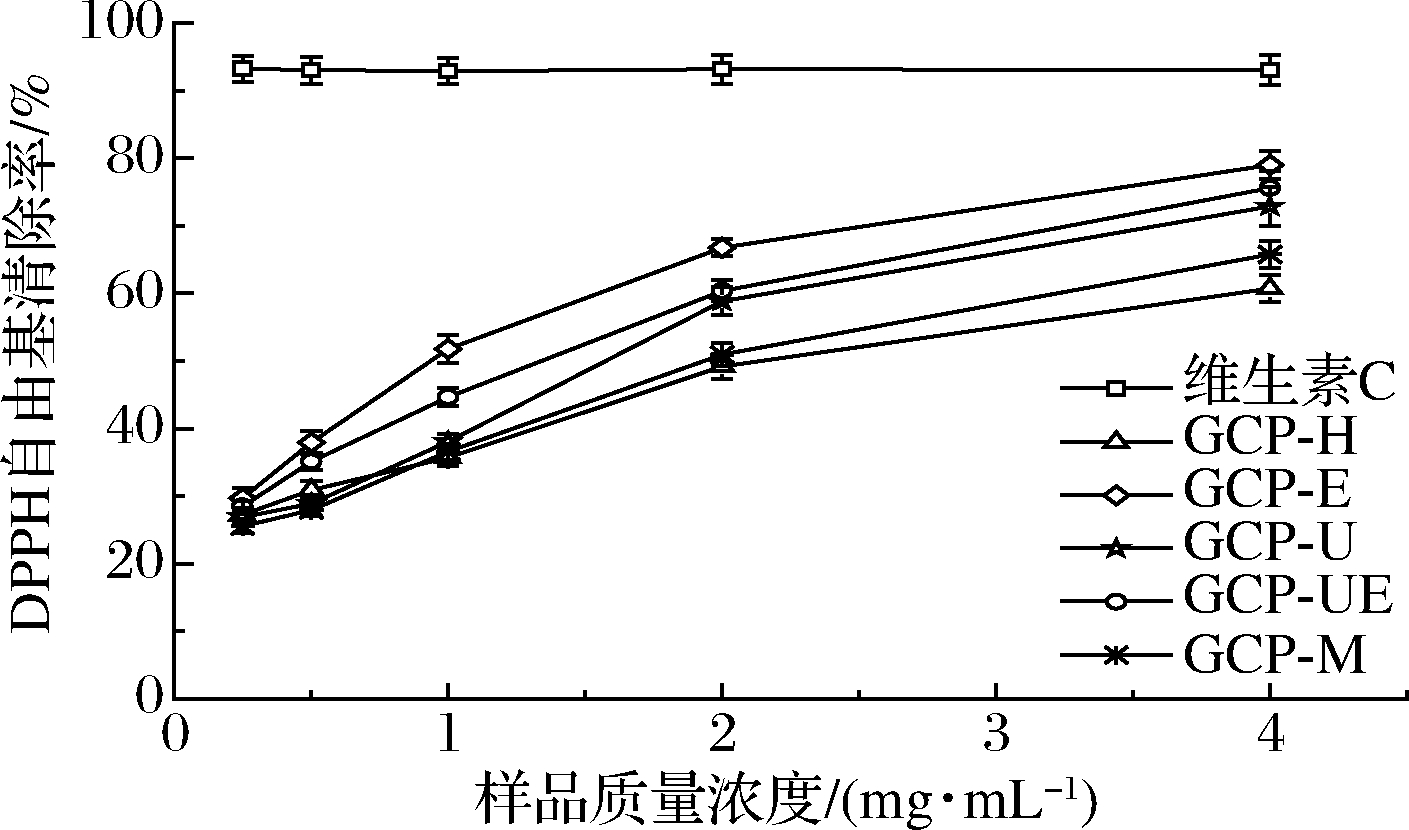
图6 手掌参多糖对DPPH自由基的清除作用
Fig.6 Scavenging effects of Gymnadenia conopsea polysaccharides on DPPH free radicals
2.5.3 对ABTS阳离子自由基的清除作用
由图7可以看出,手掌参多糖对ABTS阳离子自由基清除能力随多糖质量浓度的增大而增强,但对ABTS阳离子自由基的清除作用显著低于羟自由基和DPPH自由基。在质量浓度为4.0 mg/mL时,GCP-U对ABTS阳离子自由基发挥了较好的清除作用,其清除率为45.01%。GCP-M对ABTS阳离子自由基的清除能力低于其他4种多糖,这可能与微波处理改变了多糖构象影响了其对ABTS阳离子自由基的清除能力有关,此结果与黄玉龙等[33]研究结果一致。
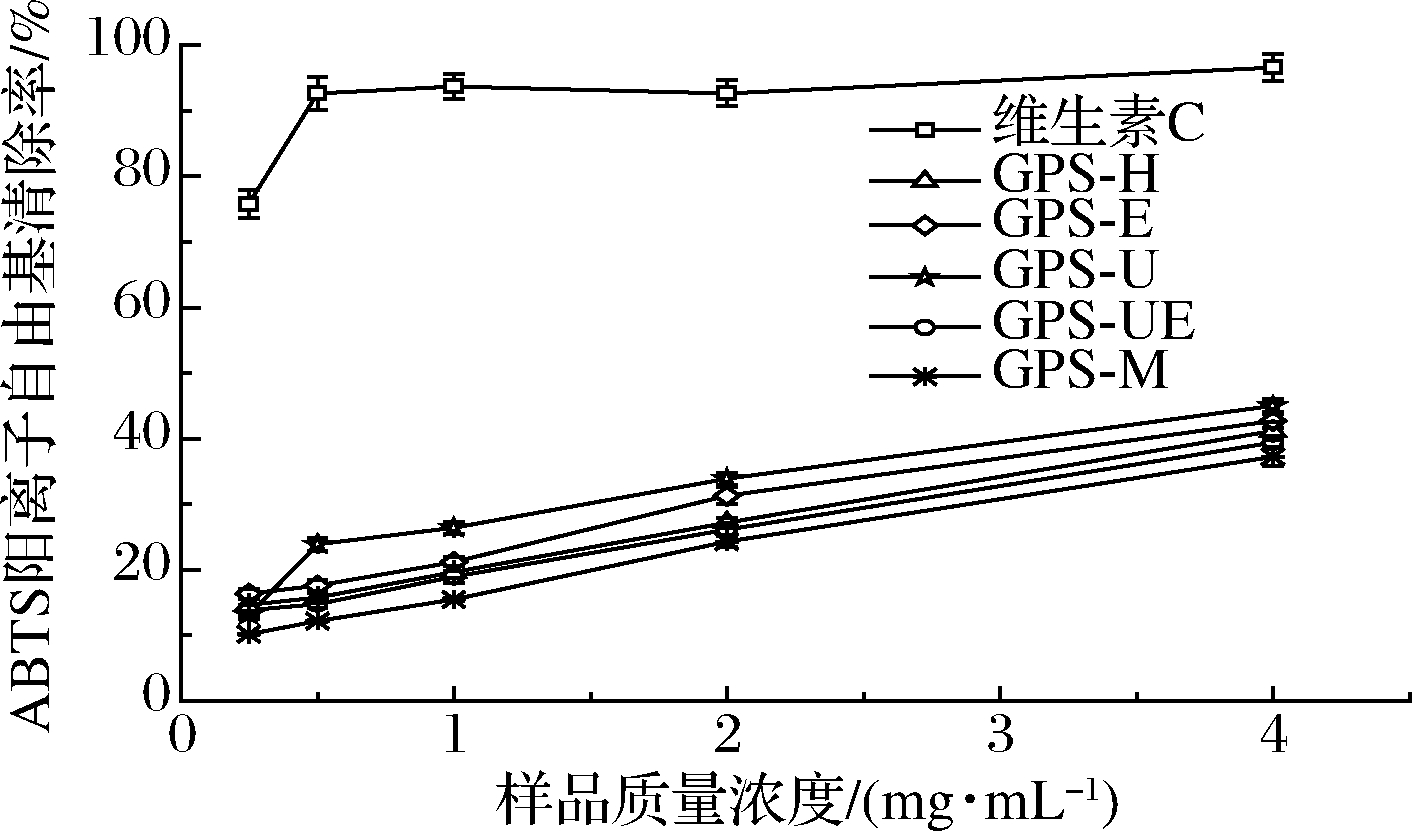
图7 手掌参多糖对ABTS阳离子自由基的清除作用
Fig.7 Scavenging effects of Gymnadenia conopsea polysaccharides on ABTS cationic free radicals
5种手掌参多糖对3种自由基的清除作用均低于阳性对照维生素C的活性,这可能与手掌参多糖的单糖组成、分子质量、连接方式等因素有关,其提供电子的基团种类和数量与维生素C相比有一定差异。研究表明,多糖中糖醛酸含量与抗氧化活性呈正相关[34],本研究发现5种方法制备的手掌参多糖均为中性多糖,这可能是其清除自由基活性低于维生素的原因之一。关于手掌参多糖的精制、结构与抗氧化活性的构效关系还有待于进一步深入研究。
3 结论
采用了5种提取方法:热水、酶辅助、超声辅助、超声-酶辅助、微波辅助法提取手掌参中的多糖,分别得到GCP-H、GCP-E、GCP-U、GCP-UE和GCP-M 5 种多糖。不同提取方法对手掌参多糖提取率有显著影响(P<0.05),其中酶法提取的得率最高,为25.6%。5种多糖都富含中性糖,含量均高于75%,且含有少量蛋白质。单糖组成结果表明,得到的5种多糖样品单糖组成成分相同,主要由甘露糖和葡萄糖组成,但不同样品的单糖比例有所不同。红外光谱显示,不同方法提取的多糖均具有多糖的特征官能团,说明提取方法不会对手掌参多糖结构产生影响。对5种手掌参多糖的羟自由基、DPPH自由基和ABTS阳离子自由基清除作用进行测定,发现5种方法制备的手掌参多糖具有不同程度的抗氧化活性,呈剂量依赖性。其中,酶和超声辅助提取的多糖在实验中表现出了较好的抗氧化活性,说明酶和超声辅助提取的方法可能对多糖的生物活性产生了有利的影响。绿色提取技术已成为提取研究热点和方向,酶和超声2种辅助提取法具有提取时间短、溶剂环保、产品回收率高、成本低的优点。因此,可将酶或超声辅助提取法作为提取功能性手掌参多糖的方法,实验结果可以为手掌参多糖的开发利用提供理论依据。
[1] LIN P C, YAO J, WU J, et al.A new ureido-substituted amino acid from the tubers of Gymnadenia conopsea[J].Chinese Chemical Letters, 2017,28(2):257-259.
[2] 岳正刚, 訾佳辰, 朱承根, 等.手掌参的化学成分[J].中国中药杂志, 2010, 35(21):2 852-2 861.
YUE Z G, ZI J C, ZHU C G, et al.Constituents of Gymnadenia conopsea[J].China Journal of Chinese Materia Medica, 2010, 35(21):2 852-2 861.
[3] LIN P C, WANG X, ZHONG X J, et al.Chemical characterization of a PD-1/PD-L1 inhibitory activity fraction of the ethanol extract from Gymnadenia conopsea[J].Journal of Asian Natural Products Research, 2021, 23(3):235-249.
[4] LIN P C, WU D T, XIE J, et al.Characterization and comparison of bioactive polysaccharides from the tubers of Gymnadenia conopsea[J].Food Hydrocolloids, 2015, 43:199-206.
[5] 杨帆, 刘岱琳, 邱峰, 等.手掌参块茎中水溶性化学成分的研究[J].食品研究与开发, 2009, 30(7):125-128.
YANG F, LIU D L, QIU F, et al.Study on the hydrosoluble constituents in the tuber of Gymnadenia conopsea R.Br.[J].Food Research and Development, 2009, 30(7):125-128.
[6] WANG X, ZHONG X J, ZHOU N, et al.Rapid characterizaiton of chemical constituents of the tubers of Gymnadenia conopsea by UPLC-orbitrap-MS/MS analysis[J].Molecules, 2020, 25(4):898.
[7] GOU Y R, SUN J, LIU J, et al.Structural characterization of a water-soluble purple sweet potato polysaccharide and its effect on intestinal inflammation in mice[J].Journal of Functional Foods, 2019(61):103502.
[8] XIE J H, WANG Z J, SHEN M Y, et al.Sulfated modification, characterization and antioxidant activities of polysaccharide from Cyclocarya paliurus[J].Food Hydrocolloids, 2016, 53:7-15.
[9] YAN Y J, LI X, WAN M J, et al.Effect of extraction methods on property and bioactivity of water-soluble polysaccharides from Amomum villosum[J].Carbohydrate Polymers, 2015,117:632-635.
[10] DONG H M, LIN S, ZHANG Q, et al.Effect of extraction methods on the properties and antioxidant activities of Chuanminshen violaceum polysaccharides[J].International Journal of Biological Macromolecules, 2016,93:179-185.
[11] 余培芝, 韩鸿萍, 尚军, 等.手掌参多糖延缓衰老作用的研究[J].西北药学杂志, 2018, 33(1):46-49.
YU P Z, HAN H P, SHANG J, et al.Study on the anti-aging effect of polysaccharides from Gymnadenia conopsea[J].Northwest Pharmaceutical Journal, 2018, 33(1):46-49.
[12] 孙平, 杨明明, 周清贞, 等.手掌参多糖的提取工艺研究[J].食品研究与开发, 2010, 31(3):76-79.
SUN P, YANG M M, ZHOU Q Z, et al.Study on the extraction of polyasccharides from Gymnadenia conopsea R.Br.[J].Food Research and Development, 2010, 31(3):76-79.
[13] 史晓宇, 高珍珍, 张超, 等.蓝刺头多糖提取工艺优化及其抗氧化活性[J].食品工业科技, 2020, 41(24):137-142.
SHI X Y, GAO Z Z, ZHANG C, et al.Optimization of extraction of Echinops lotifolis tausch polysaccharides and its antioxidant activity[J].Science and Technology of Food Industry, 2020, 41(24):137-142.
[14] ZHANG D Y, WAN Y, XU J Y, et al.Ultrasound extraction of polysaccharides from mulberry leaves and their effect on enhancing antioxidant activity[J].Carbohydrate Polymers, 2016, 137:473-479.
[15] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[16] ZOUAMBIA Y, YOUCEF ETTOUMI K, KREA M, et al.A new approach for pectin extraction:Electromagnetic induction heating[J].Arabian Journal of Chemistry, 2017, 10(4):480-487.
[17] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976,72(1-2):248-254.
[18] SU C H, LAI M N, NG L T.Effects of different extraction temperatures on the physicochemical properties of bioactive polysaccharides from Grifola frondosa[J].Food Chemistry, 2017,220:400-405.
[19] 金友权, 张四杰, 钱正, 等.木槿花多糖的组成分析及抗氧化活性研究[J].中国中药杂志, 2019, 44(9):1 822-1 828.
JIN Y Q, ZHANG S J, QIAN Z, et al.Composition analysis and antioxidant activity of polysaccharide from Hibiscus syriacus[J].China Journal of Chinese Materia Medica, 2019, 44(9):1 822-1 828.
[20] 王文霞, 张显斌, 张慧君, 等.不同提取方法对马铃薯果胶多糖组成特性的影响[J].食品与发酵工业, 2017, 43(12):150-156.
WANG W X, ZHANG X B, ZHANG H J, et al.Effect of different extraction methods on the compositions of potato pectin polysaccharides[J].Food and Fermentation Industries, 2017, 43(12):150-156.
[21] 苗永美, 孙佳琦, 徐荣华, 等.广东石豆兰多糖的提取工艺及其抗氧化活性[J].天然产物研究与开发, 2019, 31(5):779-785.
MIAO Y M, SUN J Q, XU R H, et al.Optimization of the extraction process of polysaccharide from Bublophyllum kwangtungense and its antioxidant activity[J].Natural Product Research and Development, 2019, 31(5):779-785.
[22] YAN J K, DING Z C, GAO X L, et al.Comparative study of physicochemical properties and bioactivity of Hericium erinaceus polysaccharides at different solvent extractions[J].Carbohydrate Polymers, 2018,193:373-382.
[23] CHEN S L, SHANG H M, YANG J Y, et al.Effects of different extraction techniques on physicochemical properties and activities of polysaccharides from comfrey (Symphytum officinale L.) root[J].Industrial Crops & Products, 2018,121:18-25.
[24] 苏平, 孙昕, 宋思圆, 等.提取方法对黄秋葵花多糖的结构组成及抗氧化活性的影响[J].食品科学, 2018, 39(15):93-100.
SU P, SUN X, SONG S Y, et al.Effect of extraction method on structure and antioxidant activity of polysaccharides from okra flowers[J].Food Science, 2018, 39(15):93-100.
[25] 王宝石, 谭凤玲, 李光耀, 等.超声波改性淀粉及其耦合酶解反应的生物学效应[J].食品与发酵工业, 2020, 46(23):81-85.
WANG B S, TAN F L, LI G Y, et al.Application of ultrasound treatment in starch modification and its biological effect on enzymatic hydrolysis[J].Food and Fermentation Industries, 2020, 46(23):81-85.
[26] 刘丹丹, 韩唯凡, 蒋建新, 等.无患子果皮多糖微波提取工艺及抗氧化活性研究[J].林产化学与工业, 2018, 38(4):109-116.
LIU D D, HAN W F, JIANG J X, et al.Technology of microwave-assisted extraction of Sapindus peel polysaccharide and its antioxidant activity[J].Chemistry and Industry of Forest Products, 2018, 38(4):109-116.
[27] 张晓红, 博·格日勒图.手掌参多糖的结构分析[J].内蒙古大学学报(自然科学版), 2005, 36(2):148-151.
ZHANG X H, GERELTU B.The structural analysis of Gymnadenia conopsea polysaccharide[J].Acta Scientiarum Naturalium Universitatis Neimongol, 2005, 36(2):148-151.
[28] 张晓红, 博· 格日勒图.手掌参多糖的分子量及组成的测定[J].内蒙古大学学报(自然科学版), 2005, 36(1):43-46.
ZHANG X H, GERELTU B.The structural analysis of Gymnadenia conopsea Polysaccharide[J].Acta Scientiarum Naturalium Universitatis Neimongol, 2005, 36(1):43-46.
[29] LI X Y, WANG L.Effect of extraction method on structure and antioxidant activity of Hohenbuehelia serotina polysaccharides[J].International Journal of Biological Macromolecules, 2016,83:270-276.
[30] 刘江, 雷激, 张俊, 等.不同提取方法对柠檬皮渣果胶特性的影响[J].食品与发酵工业, 2019, 45(23):199-206.
LIU J, LEI J, ZHANG J, et al.Effects of different extraction methods on properties of lemon pectin[J].Food and Fermentation Industries, 2019, 45(23):199-206.
[31] 王荣琨, 王钦, 罗欣, 等.不同提取方法对竹荪多糖提取率及抗氧化性影响[J].中国食用菌, 2020, 39(3):24-28.
WANG R K, WANG Q, LUO X, et al.Effects of different extraction methods on the extraction rate and antioxidant properties of Dictyophora indusiata polysaccharide[J].Edible Fungi of China, 2020, 39(3):24-28.
[32] CHEN S H, CHEN H X, TIAN J G, et al.Enzymolysis-ultrasonic assisted extraction, chemical characteristics and bioactivities of polysaccharides from corn silk[J].Carbohydrate Polymers, 2014,101:332-341.
[33] 黄玉龙, 高清雅, 全婷, 等.不同提取方法对兰州百合多糖结构及抗氧化活性的影响[J].现代食品科技, 2018, 34(11):126-131;94.
HUANG Y L, GAO Q Y, QUAN T, et al.Effects of different extraction methods on the composition and antioxidant activity of the polysaccharides in Lilium davidii var.unicolor salisb.[J].Modern Food Science and Technology, 2018, 34(11):126-131; 94.
[34] 马舒伟, 刘兴艳, 贾占东, 等.不同提取方法对玄参多糖单糖组分和抗氧化活性的影响[J].中华中医药学刊, 2020, 38(1):220-224;285.
MA S W, LIU X Y, JIA Z D, et al.Effect of different extraction methods on monosaccharide compositions and antioxidative activity of Scrophularia ningpoensis polysaccharide[J].Chinese Archives of Traditional Chinese Medicine, 2020, 38(1):220-224;285.