腌制是肉制品重要的加工环节,能使肉品呈现特有的色泽及风味,具有改善肉品品质的作用[1]。值得注意的是,不同腌制方式会造成腌肉制品中盐分、水分、保水性及嫩度等品质的变化,且腌制效率差异明显,间接导致肌原纤维蛋白结构及功能特性发生不同程度的变化,最终影响产品品质。传统腌制工艺存在盐分渗透速度慢、不均匀等现象[2],若腌制时间过长,还易引起微生物污染,无法适应大规模工业化生产需求。研究发现,真空滚揉、超声波辅助等腌制技术能有效提高腌料传质速率,诱导蛋白质特性改变,并改善肉的品质[2]。在真空滚揉腌制过程中,肌纤维的完整性不断降低,肌纤维间隙逐渐增大,钙激活酶被激活并促进肌原纤维蛋白的酶解。PATRASCU等[3]及谢媚等[4]认为真空滚揉处理产生的机械和盐溶作用不仅能促进腌制液的渗透,而且有利于肌球蛋白的提取,从而提高热处理后肉的黏附性。超声波产生的空化效应和机械效应会破坏肌原纤维结构,加速肌原纤维蛋白的降解,其促渗作用增加了肌球蛋白的溶解度[5]。KANG等[6]认为,超声波辅助腌制处理可以提高牛肉的肌原纤维碎片化指数,降解肌间线蛋白和肌钙蛋白-T,从而提高牛肉嫩度。
肌原纤维蛋白约占肌肉蛋白的55%~65%,是肌肉中含量最高的蛋白质,一定程度上直接影响肉品品质[4,6]。目前,有关肉制品腌制处理过程中蛋白质特性变化的研究侧重于和嫩度建立联系,鲜有不同腌制方式下肉制品肌原纤维蛋白特性及水分迁移规律的探究。本试验通过比较静置、真空滚揉及超声波辅助3种腌制方式处理牛肉肌原纤维蛋白氧化、结构特性与水分分布的变化规律,揭示不同腌制方式下牛肉肌原纤维蛋白特性与保水性的内在联系,以期为腌肉制品的质量控制提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
冷鲜西冷牛肉,购于扬州麦德龙超市;氯化钠、溴酚蓝、三氯乙酸、乙酸乙酯、盐酸胍、尿素、盐酸、氢氧化钠、β-巯基乙醇、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB]、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、三羟甲基氨基甲烷(Tris)、乙二醇-双-(2-氨基乙醚)四乙酸[glycol-bis-(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA],分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
HKS-30VT型真空滚揉机,无锡哈克逊工贸有限公司;UC-600E型超声波清洗器,上海精其仪器有限公司;FA1004(1/1000)型电子天平,浙江力辰仪器科技有限公司;H1850型台式高速离心机,湖南湘仪离心机有限公司;AccuFat-1050型低场核磁共振分析仪,江苏麦格迈有限公司;BIO-RAD型伯乐电泳仪,北京赛百奥科技有限公司;722 N型紫外分光光度计,上海菁华仪器有限公司;VORTEX 1型涡旋混匀仪,艾卡(广州)仪器设备有限公司;DXRxi型显微拉曼成像光谱仪,美国Thermofisher公司;BCD-346型海尔冰箱,青岛海尔有限公司。
1.2 实验方法
1.2.1 实验设计
腌制液:配制60 mg/mL NaCl溶液,置于0~4 ℃环境中冷藏备用。
样品处理:将冷鲜西冷牛肉去除可见筋膜,吸干样品表面血水,修整成规格约5 cm×5 cm×1.5 cm、质量为(40±2) g的样品,用保鲜膜包裹后置于4 ℃中平衡12 h后取出,浸渍于装有腌制液的自封袋中,料液比为1∶1(g∶mL),随机分为4组,每组6份进行不同腌制方式处理:(1)静置腌制:将样品置于0~4 ℃ 环境中分别腌制20、40 min,每个时间点随机抽取3份样品进行分析;(2)真空滚揉腌制:参考李鹏等[7]方法适当修改,真空度设置为0.08 MPa,温度0~4 ℃,转速10 r/min,样品进行单向连续真空滚揉处理,分别在滚揉腌制20、40 min 时随机取出3份进行分析;(3)超声波辅助腌制:于超声波清洗器(40 kHz,60 W,4 ℃)中放入样品,分别处理20、40 min后随机取出3份分析;空白对照:将生肉置于0~4 ℃环境中冷藏备用。
1.2.2 肌原纤维蛋白提取
参照WU等[8]方法略微修改。取不同腌制方式处理样品5 g,剪碎后加入4倍体积的磷酸盐缓冲溶液(0.1 mol/L NaCl,10 mmol/L Na3PO4·12H2O,10 mmol/L NaH2PO4·2H2O,10 mmol/L Na2HPO4·12H2O,2 mmol/L MgCl2·6H2O,1 mmol/L EGTA,pH 7.0),10 000 r/min均质60 s,挑去筋膜后,2 000×g离心15 min(4 ℃)后弃上清液,重复上述操作3次;取沉淀再用4倍体积0.1 mol/L NaCl溶液以10 000 r/min均质30 s,2 000×g离心15 min(4 ℃)后弃上清液,重复上述操作2次,所得沉淀即为肌原纤维蛋白,于0~4 ℃冰箱保存,48 h内使用完。
1.2.3 表面疏水性测定
参照CHELH等[9]方法测定。取1 mL 1 mg/mL悬浮液加入40 μL 1 mg/mL溴酚蓝溶液,空白对照为1 mL提取缓冲液(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0)加入40 μL 1 mg/mL溴酚蓝溶液,涡旋振荡混匀10 min后离心(4 ℃,4 000×g,15 min),取上清液稀释10倍后在595 nm处测定吸光值,表面疏水性计算如公式(1)所示:
表面疏水性![]()
(1)
式中:OD空白,空白样品的吸光度值;ODMP,样品的吸光度值。
1.2.4 总巯基含量测定
参照张海璐等[10]方法适当修改。取0.5 mL 5 mg/mL蛋白悬浮液,加入2.5 mL的Tris-Gly-8 mol/L 尿素缓冲液(pH 8.0),再加入0.02 mL 4 mg/mL DTNB溶液,振荡摇匀后25 ℃下反应30 min,然后于412 nm波长下测定吸光值(A412)。以不加DTNB的样品作为对照。总疏基含量计算如公式(2)所示:
总巯基含量![]()
(2)
式中:A412,412 nm下的吸光值;e,分子吸光系数,13 600 L/mol·cm;D,水浴前稀释倍数;c,蛋白浓度。
1.2.5 羰基含量测定
参照LEVINE等[11]方法适当修改。在1.5 mL的离心管中加入0.1 mL 5 mg/mL蛋白液与0.5 mL的2 mol/L HCl溶液(含0.02 mol/L DNPH),在25 ℃反应40 min,空白样品中加入0.5 mL不含DNPH的2 mol/L HCl溶液;在上述反应液中分别加入0.5 mL 20%(体积分数)的三氯乙酸,振荡后离心(4 ℃,11 000×g,5 min)弃去上清液;用1 mL乙醇-乙酸乙酯溶液(1∶1,体积比)洗涤蛋白质沉淀3次;将蛋白质沉淀悬浮于1 mL的 6 mol/L盐酸胍溶液中,在37 ℃ 条件下水浴30 min,在370 nm下测定吸光度值,利用摩尔吸光系数进行计算。
1.2.6 肌原纤维蛋白二级结构测定
参照曹锦轩等[12]方法适当修改。将不同腌制方式处理的牛肉肌原纤维蛋白质量浓度调整为20 mg/mL,真空冷冻干燥后磨碎,取适量样品平铺于玻璃载片上,进行拉曼光谱扫描。测定参数:激发波长532 nm,功率为100 mW,600 g/mm光栅,狭缝200 pum,3次扫描数据,获取光谱波数在400~3 600 cm-1。数据采用Peakfit 4.12软件对酰胺Ⅰ带(1 600~1 700 cm-1)处进行去卷曲、二阶求导及曲线拟合。
1.2.7 SDS-PAGE
采用丙烯酰胺质量分数为10%的分离胶和5%的浓缩胶。肌原纤维蛋白溶液质量浓度为4 mg/mL,加入 5×Loading buffer混合,100 ℃水浴10 min,上样前离心30 s,上样量为5 μL。浓缩胶中采用恒压80 V,进入分离胶后恒压110 V,直至电泳结束。电泳结束后进行染色、脱色处理。
1.2.8 水分分布测定
利用低场核磁共振分析仪(low-field nuclear magnetic resonance,LF-NMR)测定不同腌制方式处理牛肉中的水分分布。称取(20±1) g不同腌制方式处理牛肉样品,规格约为2.5 cm×5 cm×1.5 cm,将样品用保鲜膜均匀包裹后放入专用核磁管中,封口膜封口并放在射频管道中,测定每个样品的弛豫时间,采用CPMG脉冲序列测定样品横向弛豫时间T2。具体参数设置:接收增益为80,回波间隔为800 μs,采样点数为3 000,扫描次数为32,间隔时间为2 000 ms。每个样品重复测定3次,取平均值进行反演。
1.3 数据处理
实验至少重复3次,采用Excel 2010、Origin 2017及SPSS 22.0对测定结果进行统计分析,数据表示为平均值±标准差,差异显著水平α为0.05。
2 结果与分析
2.1 不同腌制方式对牛肉肌原纤维蛋白表面疏水性的影响
肌原纤维蛋白的表面疏水性与其氧化、结构的变化密切相关,因此表面疏水作用力对维持蛋白质的构象和功能特性至关重要[13]。肌原纤维蛋白表面疏水性越强,则说明其变性程度越大,相反亦是。由图1可知,不同腌制方式下牛肉肌原纤维蛋白表面疏水性差异显著(P<0.05),且均明显高于空白对照组(P<0.05),说明腌制处理改变了肌原纤维蛋白的空间结构,暴露了分子内部苯丙氨酸,色氨酸残基等疏水性的氨基酸残基,导致肌原纤维蛋白的表面疏水性增强[14]。静置腌制40 min牛肉肌原纤维蛋白表面疏水性显著高于静置腌制20 min处理组,可能是因为腌制液中NaCl逐渐渗入牛肉内部,使牛肉肌原纤维蛋白结构进一步展开,蛋白内部的疏水性基团充分暴露。胡远辉等[15]研究发现大黄鱼肌原纤维蛋白被0~0.4 mol/L NaCl处理时,表面疏水性逐渐增大可能是NaCl使蛋白分子外部亲水作用与内部疏水作用失衡所致。相反,在真空滚揉腌制及超声波辅助腌制处理组中,腌制40 min的牛肉肌原纤维蛋白表面疏水性均低于同一腌制方式下腌制20 min,可能是真空滚揉及超声波处理对肌原纤维蛋白空间构象破坏较为严重,暴露出更多疏水性基团,而腌制后期蛋白进一步氧化降解,出现较多的聚集交联所致[14]。由图1可见,超声波辅助腌制牛肉肌原纤维蛋白表面疏水性较其他腌制方式处理组降低,而蛋白表面疏水性一定程度上可以表征蛋白质水合能力的指标[16],其值越小蛋白质保水能力越强,结合水和不易流动水含量越多,因而推测超声波辅助腌制一定程度上可以增强牛肉的保水性。
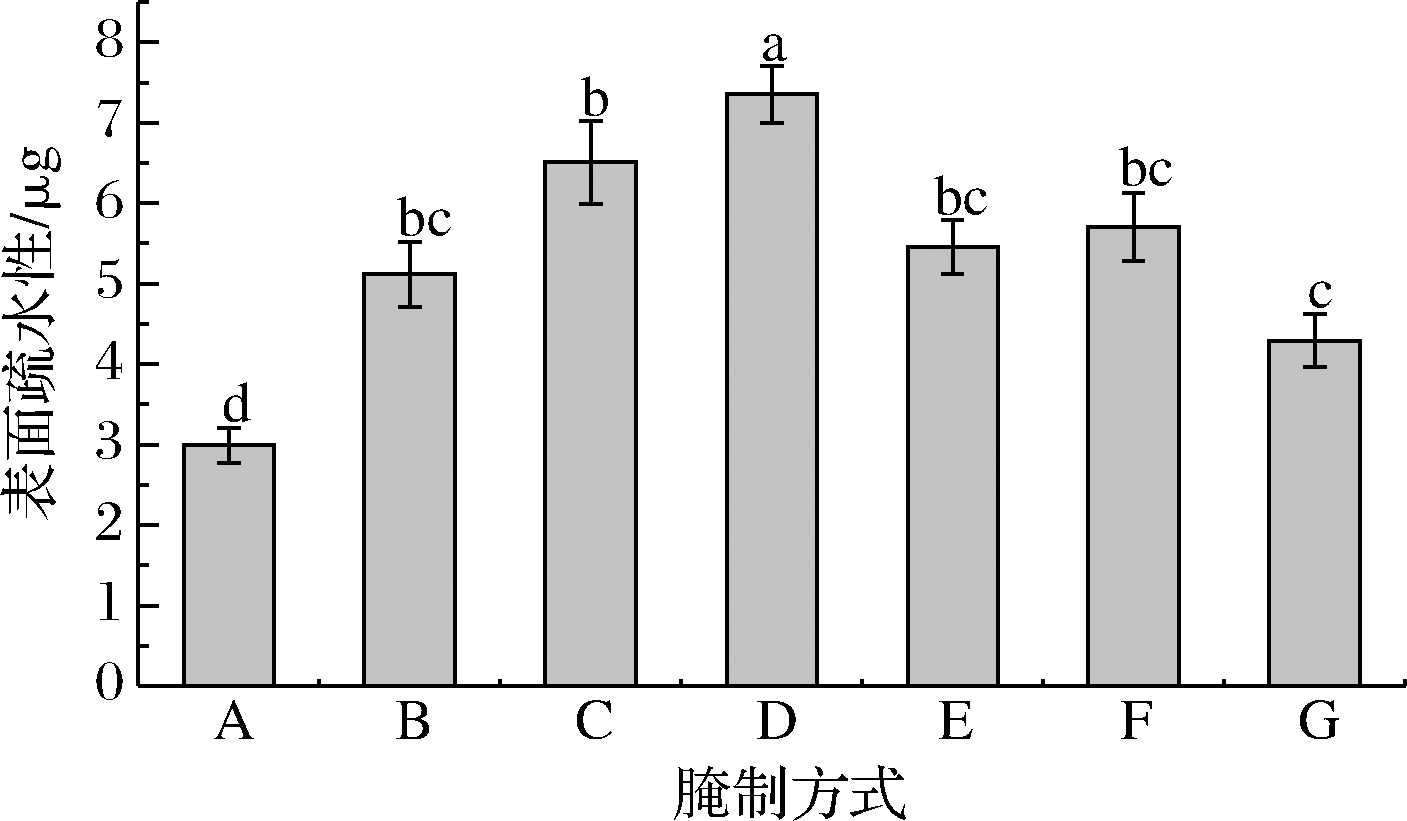
A-空白对照(生肉);B-静置腌制20 min;C-静置腌制40 min;D-真空滚揉腌制20 min;E-真空滚揉腌制40 min;F-超声波辅助腌制20 min;G-超声波辅助腌制40 min(下同)
图1 不同腌制方式对牛肉肌原纤维蛋白表面疏水性的影响
Fig.1 Effects of different curing processing on surface hydrophobicity of beef myofibrillar protein
注:字母不同表示该性质差异显著(P<0.05)(下同)
2.2 不同腌制方式对牛肉肌原纤维蛋白总巯基的影响
肌原纤维蛋白中的总巯基容易被氧化为二硫键,导致总巯基含量降低,因此总巯基含量是表征蛋白氧化程度的关键指标之一[17]。由图2可见,静置腌制20 min的牛肉肌原纤维蛋白总巯基含量与空白对照组无显著差别(P>0.05),当静置腌制时间延长至40 min时,牛肉肌原纤维蛋白总巯基含量开始下降,说明盐溶液会促进肌原纤维蛋白的氧化。真空滚揉腌制处理牛肉肌原纤维蛋白总巯基含量在各处理组中最低,可见真空滚揉腌制在一定程度上加速了牛肉肌原纤维蛋白的氧化降解,促进了蛋白结构的展开,使更多巯基转化为二硫键[18]。超声波辅助腌制20 min 时牛肉肌原纤维蛋白总巯基含量最高,达69.16 nmol/mg,可能是短时间内超声波辅助腌制处理导致牛肉盐溶性蛋白溶出,结合了牛肉中的结合水,在牛肉表面形成一层阻断氧气的保护膜,抑制了肌原纤维蛋白氧化所致[19]。当超声波辅助腌制40 min时,由于腌制时间延长使NaCl充分渗入牛肉中以及超声波的空化作用促进了肌原纤维蛋白分子的伸展,加速了蛋白的氧化降解,进而导致总巯基含量有所下降。
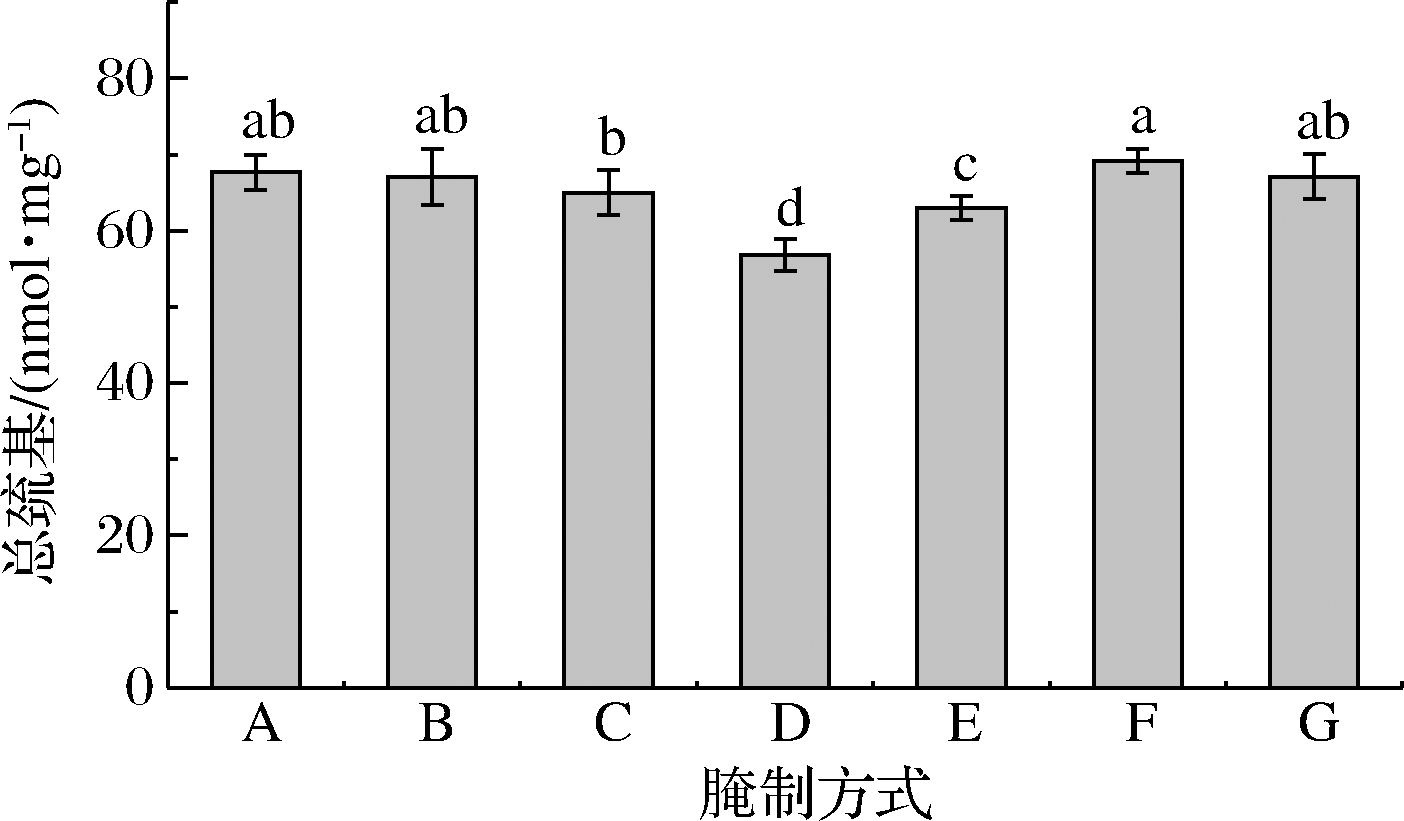
图2 不同腌制方式对牛肉肌原纤维蛋白总巯基的影响
Fig.2 Effects of different curing processing on total sulfhydryl groups of beef myofibrillar protein
2.3 不同腌制方式对牛肉肌原纤维蛋白羰基的影响
羰基是判断肌原纤维蛋白氧化程度的主要指标之一,肌原纤维蛋白的侧链或肽键受到羟基攻击时通常会造成羰基含量增加,且在氧化过程中蛋白空间构象也可能发生改变[6]。由图3可见,静置腌制牛肉肌原纤维蛋白羰基含量与空白对照组无显著差异(P>0.05),但真空滚揉腌制牛肉肌原纤维蛋白中羰基含量显著高于其他处理组(P<0.05),且真空滚揉腌制时间越长,羰基含量越高,说明肌原纤维蛋白在真空滚揉腌制的过程中被氧化,处理时间越长,蛋白氧化程度越严重,同时也反映出真空滚揉处理较大程度地改变了牛肉肌原纤维蛋白的空间构象。超声波辅助腌制组牛肉肌原纤维蛋白羰基含量也显著高于空白对照组及静置腌制组(P<0.05),且羰基含量随腌制时间的延长而增大。王安然[20]和XIONG等[21]研究认为脂质氧化产物可以与肌原纤维蛋白产生共价结合使蛋白羰基值增加,因而推测牛肉中少量脂肪在超声波的作用下发生氧化反过来促进了肌原纤维蛋白的氧化,导致牛肉肌原纤维蛋白中羰基含量升高。
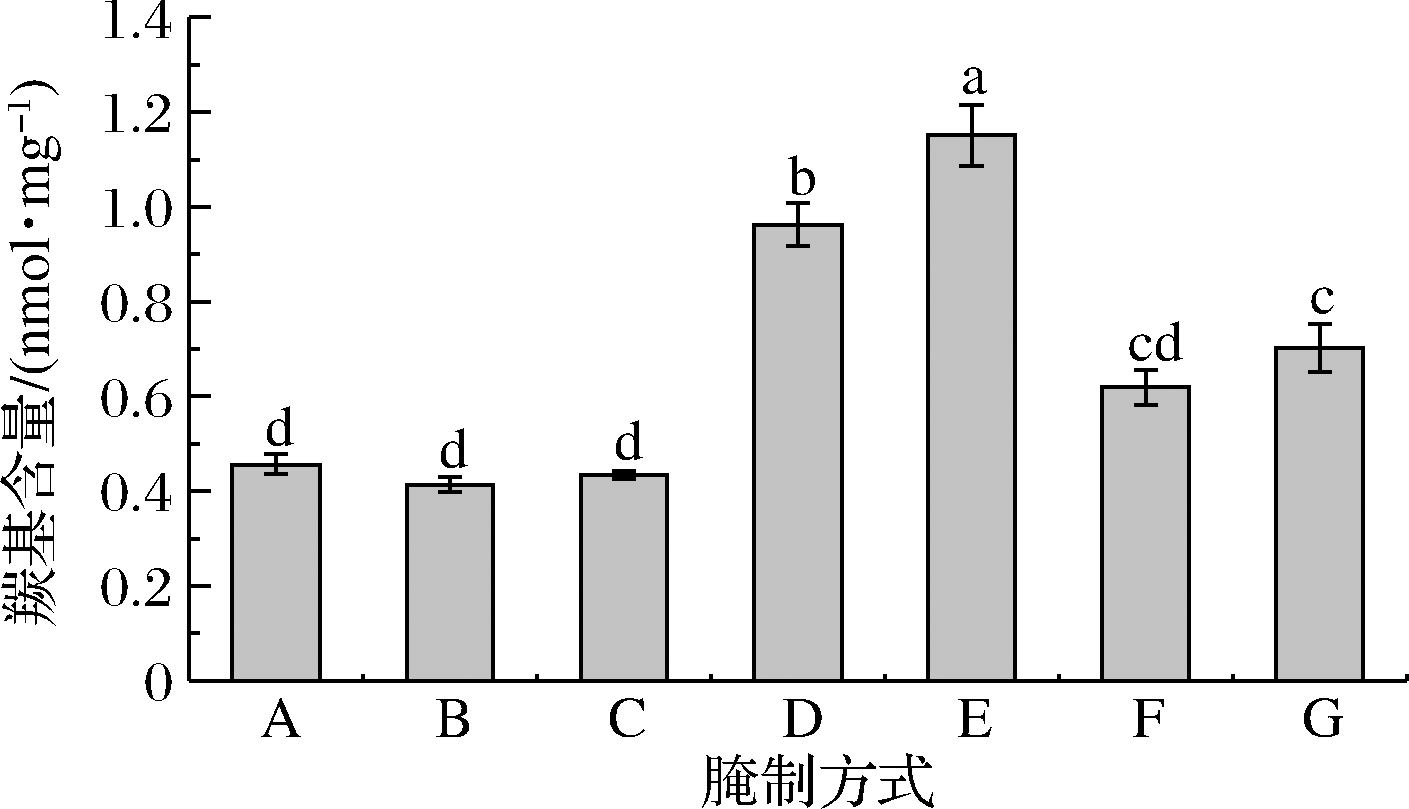
图3 不同腌制方式对牛肉肌原纤维蛋白羰基的影响
Fig.3 Effects of different curing processing on carbonyl groups of beef myofibrillar protein
2.4 不同腌制方式对牛肉肌原纤维蛋白二级结构的影响
酰胺Ⅰ带(1 600~1 700 cm-1)是由C![]() O的伸缩振动、C—N的伸缩振动、Cα—C—N的弯曲振动和N—N的面内弯曲振动共同引起的,是反映蛋白质二级结构的主要谱带[22]。一般情况下,波数范围在1 615~1 637 cm-1和1 682~1 700 cm-1的峰表示β-折叠,1 646~1 664 cm-1的峰表示α-螺旋,1 637~1 645 cm-1的峰表示无规则卷曲,1 664~1 681 cm-1的峰表示β-转角[16]。
O的伸缩振动、C—N的伸缩振动、Cα—C—N的弯曲振动和N—N的面内弯曲振动共同引起的,是反映蛋白质二级结构的主要谱带[22]。一般情况下,波数范围在1 615~1 637 cm-1和1 682~1 700 cm-1的峰表示β-折叠,1 646~1 664 cm-1的峰表示α-螺旋,1 637~1 645 cm-1的峰表示无规则卷曲,1 664~1 681 cm-1的峰表示β-转角[16]。
通过去卷积、二阶求导和曲线拟合的方式对拉曼光谱峰进行分峰处理,结果见图4;不同腌制方式下牛肉肌原纤维蛋白二级结构含量变化见图5。如图4所示,不同腌制方式处理牛肉肌原纤维蛋白结构有显著区别(P<0.05),空白对照组样品的酰胺Ⅰ带最大峰位置出现在1 661 cm-1处,而经不同腌制方式处理后,样品的最大峰位置均偏移至1 655 cm-1附近,且同一腌制方式下样品腌制时间越长,最大峰偏移程度越大。同时,从图4中各处理组拉曼峰的相对强度来看,静置腌制组样品拉曼强度低于真空滚揉腌制组和超声波辅助腌制组,表明真空滚揉和超声波处理破坏了肌原纤维蛋白的二级结构,导致蛋白质聚集体的高级结构展开[16,22]。

图4 不同腌制方式处理牛肉肌原纤维蛋白的拉曼光谱拟合曲线图
Fig.4 Raman spectrum fitting curve of beef myofibrillar protein treated by different curing processing
α-螺旋是蛋白质分子内的有序排列,主要由多肽链上羰基和氨基之间的分子内氢键稳定,β-折叠是蛋白质分子间的有序排列,由分子间氢键维持[23]。由图5可见,不同腌制方式处理牛肉肌原纤维蛋白二级结构中含量最高的为α-螺旋结构,其次为β-折叠和β-转角结构,无规则卷曲含量最少。与另外2种腌制方式处理组相比,真空滚揉腌制牛肉肌原纤维蛋白中α-螺旋结构含量明显减少(P<0.05),且β-折叠结构含量显著增加(P<0.05),原因可能是真空滚揉处理破坏了维持α-螺旋结构稳定的氢键,并转变为其他构象。BEATTIE等[24]研究发现,嫩度较差的肌肉二级结构中β-折叠结构含量显著多于嫩度较好的肌肉。由图5可知,经超声波辅助腌制的牛肉肌原纤维蛋白β-折叠结构含量显著减少(P<0.05),且超声波辅助腌制40 min时牛肉肌原纤维蛋白β-折叠结构含量最低,仅为15.47%,说明较长时间的超声波辅助腌制在一定程度上可以改善牛肉嫩度,这也与KANG等[6]研究结果相一致。随着腌制时间从20 min延长至40 min时,各腌制方式处理牛肉肌原纤维蛋白α-螺旋结构含量均呈上升趋势,β-折叠均呈下降趋势,可能与腌制过程中盐分逐渐渗透使肌原纤维蛋白变性或聚集程度增加有关[7]。相比于空白对照组,3种腌制方式对样品无规则卷曲含量影响并不明显(P>0.05),但β-转角结构含量显著增加(P<0.05)。

图5 不同腌制方式处理牛肉肌原纤维蛋白二级结构相对含量变化
Fig.5 Changes of relative content of secondary structure of myofibrillar protein in beef treated with different curing processing
2.5 不同腌制方式对牛肉肌原纤维蛋白SDS-PAGE的影响
由SDS-PAGE凝胶电泳图(图6)可知,在不同腌制方式处理牛肉肌原纤维蛋白泳道上存在多条共同条带,主要包括肌球蛋白重链、α-肌动素、肌动蛋白、原肌球蛋白、肌球蛋白轻链1、肌钙蛋白Ⅰ亚基、肌球蛋白轻链2和肌球蛋白轻链3等。图6中,肌球蛋白重链和肌动蛋白的谱带最为明显,验证了肌球蛋白和肌动蛋白是肌原纤维蛋白主要组成的观点[14]。一般情况下,蛋白质分子发生降解主要表现为分子质量较高处的条带出现模糊、弱化和扩展,较低分子质量区域则呈现出新的条带或条带颜色加深[25]。与空白对照组及静置腌制组相比,真空滚揉和超声波辅助腌制牛肉肌原纤维蛋白在10~26 kDa处条带呈现加深,43~95 kDa处条带呈现模糊及肌球蛋白重链处有轻微扩散现象,说明真空滚揉及超声波辅助腌制处理一定程度上加速了牛肉肌原纤维蛋白的降解,可能是因为牛肉肌细胞中的一些内源性蛋白酶在滚揉及超声波等外力的影响下释放,从而使肌原纤维蛋白的溶出及降解。这也与胡鹏等[19]认为滚揉处理会加快成熟早期羊肉肌原纤维蛋白降解的结论相印证。但在同一腌制方式下不同腌制时间处理的牛肉肌原纤维蛋白条带差异并不显著(P>0.05)。

图6 不同腌制方式处理牛肉肌原纤维蛋白的SDS-PAGE图谱
Fig.6 SDS-PAGE map of beef myofibrillar protein treated by different curing processing
2.6 不同腌制方式对牛肉水分分布的影响
2.6.1 不同腌制方式对牛肉横向弛豫时间T2的影响
LF-NMR主要通过横向弛豫时间来反映肉制品中不同状态水分的迁移规律[16,20]。图7及表1显示了经不同腌制方式处理后牛肉中水分状态的变化,由图7可见,在1~1 000 ms的弛豫时间内有3个峰,其横向弛豫时间分别为T2b(1~10 ms)、T21(10~100 ms)、T22(100~1 000 ms),分别代表结合水、不易流动水及自由水[20],这与康大成[26]研究超声波辅助腌制对牛肉水分分布的结果基本一致。
相关研究表明,弛豫时间T2越短,水与底物结合越紧密,保水性越好;T2越长,水与底物的结合越松散,水分越自由,保水性也越差[27]。由图7、表1可知,静置腌制组牛肉的弛豫时间T22显著高于其他处理组(P<0.05),不易流动水向自由水方向迁移,可能是因为静置腌制时盐分效应显著,较高浓度的盐溶液加速牛肉肌原纤维断裂及蛋白质溶解,加快了牛肉的水分流失。同时说明经真空滚揉和超声波处理后的牛肉肌原纤维蛋白构象在外力的作用下发生变化,并一定程度上减缓盐分效应,进而增强了牛肉的保水性。真空滚揉腌制组牛肉的T21显著低于静置腌制及超声波辅助腌制组(P<0.05),且滚揉时间越长,T21越短,表明较长时间真空滚揉处理可以降低牛肉中水分自由度,增强结合水和不易流动水与蛋白质的结合能力[28]。超声波辅助腌制组牛肉的T2b较其他处理组明显缩短(P<0.05),可能是超声波产生的空化效应较大程度地破坏了牛肉蛋白质高级结构,致使牛肉中结合水向不易流动水和自由水转变,这与超声波辅助腌制处理能够明显改变牛肉肌原纤维蛋白二级结构的结果相互印证。
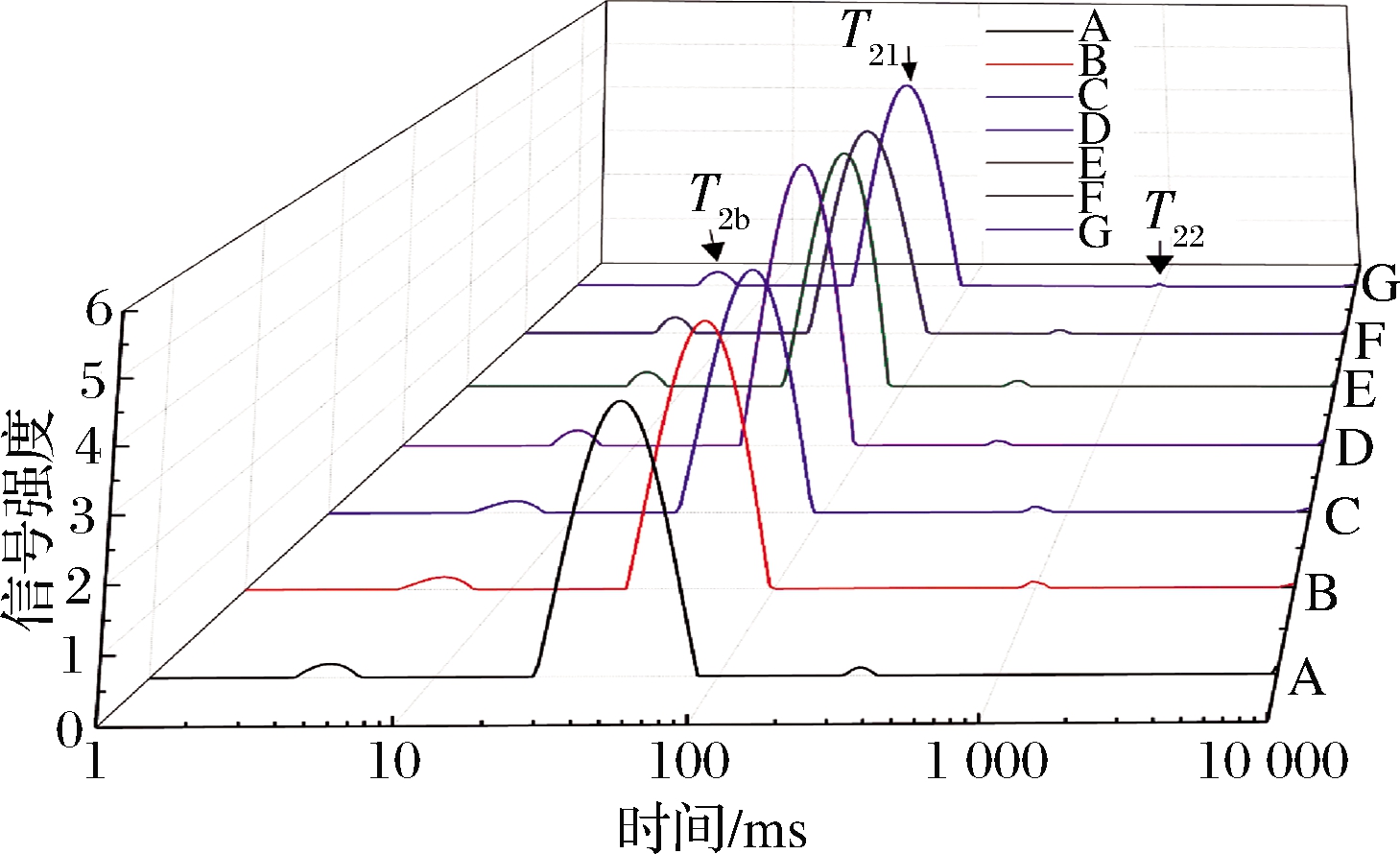
图7 不同腌制方式处理牛肉的弛豫时间T2图谱
Fig.7 Relaxation time T2 map of beef treated with different curing processing
表1 腌制方式对牛肉中不同状态水分的弛豫时间T2的影响
Table 1 Effect of curing processing on relaxation time T2 of water in different states in beef
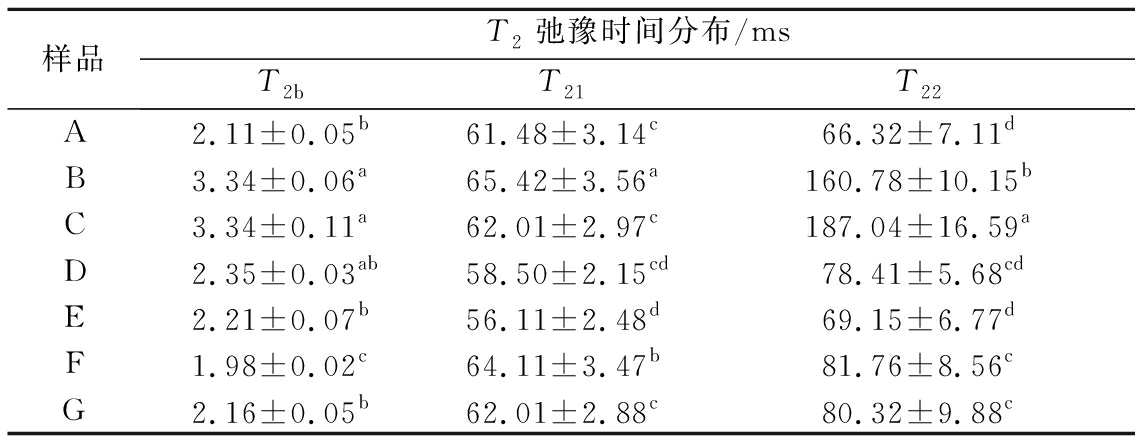
样品T2弛豫时间分布/msT2bT21T22A2.11±0.05b61.48±3.14c66.32±7.11dB3.34±0.06a65.42±3.56a160.78±10.15bC3.34±0.11a62.01±2.97c187.04±16.59aD2.35±0.03ab58.50±2.15cd78.41±5.68cdE2.21±0.07b56.11±2.48d69.15±6.77dF1.98±0.02c64.11±3.47b81.76±8.56cG2.16±0.05b62.01±2.88c80.32±9.88c
注:同列字母不同表示该性质差异显著(P<0.05)(下同)
2.6.2 不同腌制方式对牛肉横向弛豫时间T2峰面积的影响
不同腌制方式对牛肉弛豫时间T2所对应峰面积P2的影响结果如表2所示,其中P2b、P21、P22分别表示T2b、T21、T22的弛豫峰面积相对比例,通过相对比例的变化可以直观看出样品中各状态水分的相对含量,进而反映各组样品保水性的变化[29]。同时由图7可见,主峰为T21所对应的峰,其信号幅度高于总信号的90%,表明不同腌制方式下不易流动水是牛肉中水分的主要存在形态,不易流动水的相对含量与牛肉的保水性高度相关[29-30]。由图7及表2可知,经真空滚揉腌制和超声波辅助腌制处理的牛肉P2b、P21明显高于未腌制及静置腌制牛肉(P<0.05),且随着超声波腌制时间的延长,牛肉P22显著降低(P<0.05)。主要是因为真空滚揉和超声波的空化作用均能够加速牛肉肌原纤维溶胀及盐溶性蛋白的溶出,增强牛肉吸水能力,增加肌细胞内水分含量,进而提高牛肉的保水性。这与ZHENG等[30]认为P2b和P21与肌肉保水性呈正相关,P22与保水性呈负相关的观点相互印证。相反,静置腌制20 min和40 min的牛肉P21均显著小于其他处理组(P<0.05),P22均显著大于其他处理组(P<0.05),表明静置腌制牛肉保水性最低。李鹏等[7]和李侠等[16]研究也认为提高肌肉不易流动水横向弛豫时间对应的峰面积,能够提高肉制品保水性,改善产品品质。因此,超声波辅助腌制和真空滚揉腌制对提高牛肉保水性具有积极作用。
表2 腌制方式对牛肉中不同水分弛豫时间T2峰面积的影响
Table 2 Effect of curing processing on T2 peak area of beef with different water relaxation time
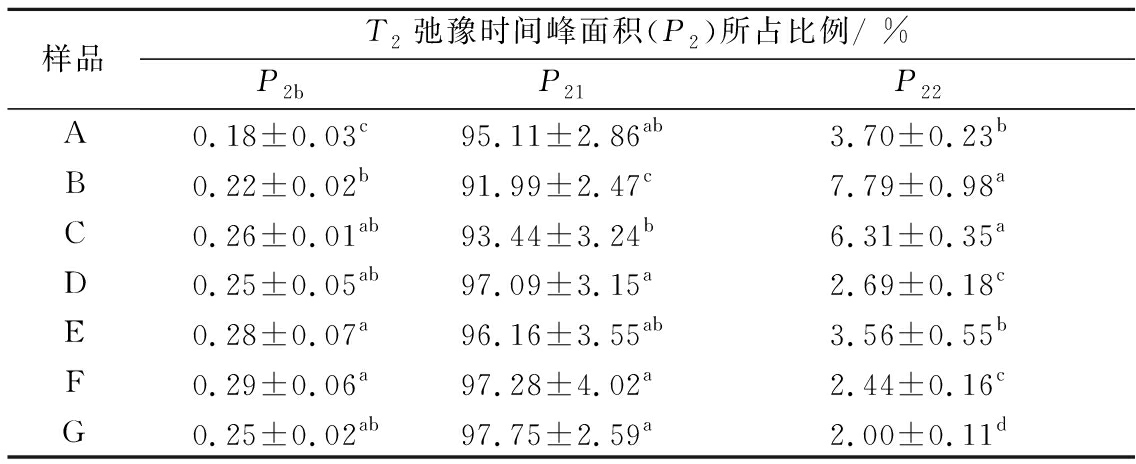
样品T2弛豫时间峰面积(P2)所占比例/ %P2bP21P22A0.18±0.03c 95.11±2.86ab3.70±0.23bB0.22±0.02b 91.99±2.47c7.79±0.98aC0.26±0.01ab93.44±3.24b6.31±0.35aD0.25±0.05ab97.09±3.15a2.69±0.18cE0.28±0.07a96.16±3.55ab3.56±0.55bF0.29±0.06a97.28±4.02a2.44±0.16cG0.25±0.02ab97.75±2.59a2.00±0.11d
3 结论
试验以未腌制牛肉为对照,探究了牛肉在不同腌制方式下水分分布及肌原纤维蛋白的氧化和结构特性。相比空白对照组,3种腌制方式处理组的肌原纤维蛋白表面疏水性显著增强(P<0.05),其中超声波辅助腌制组表面疏水性相对较低。真空滚揉腌制处理牛肉肌原纤维蛋白总巯基含量最低,羰基含量最高,表明蛋白氧化程度最大。真空滚揉处理较大程度地破坏了维持α-螺旋结构稳定的氢键,α-螺旋结构被破坏后向β-折叠结构转变。与对照组相比,超声波辅助腌制组肌原纤维蛋白β-折叠结构含量减少,牛肉嫩度得到改善。真空滚揉和超声波辅助腌制牛肉肌原纤维蛋白在低分子质量条带呈现加深,高分子质量条带呈现模糊及肌球蛋白重链处有轻微扩散现象,表明蛋白结构发生降解。真空滚揉腌制组牛肉的T21显著低于其他2种腌制方式处理组(P<0.05),且滚揉时间越长,T21越短。真空滚揉腌制和超声波辅助腌制牛肉P2b、P21明显高于未腌制及静置腌制牛肉(P<0.05)。综上,相比于静置腌制,在腌制过程中,真空滚揉和超声波会加速牛肉肌原纤维蛋白的氧化,促进蛋白结构的降解,其中超声波辅助腌制更有利于提高牛肉保水性,改善牛肉嫩度,对提升产品品质具有重要作用。
[1] AKKÖSE A, AKTA N.Curing and diffusion coefficient study in pastirma, a Turkish traditional meat product[J].Meat Science, 2014, 96(1):311-314.
N.Curing and diffusion coefficient study in pastirma, a Turkish traditional meat product[J].Meat Science, 2014, 96(1):311-314.
[2] 詹文圆. 肉制品加工中变压滚揉腌制技术研究[D].无锡:江南大学, 2008.
ZHAN W Y.Study on pressure-transform tumble curing technology in meat processing [D].Wuxi:Jiangnan University, 2008.
[3] PATRASCU L, IANITCHI D, DOBRE I, et al.Effect of tumbling time and injection rate on the processing characteristics, tenderness and color of pork biceps femoris muscle[J].The Annals of the University Dunarea de Jos of Galati, 2011, 35(1):9-18.
[4] 谢媚, 曹锦轩, 潘道东, 等.滚揉对成熟过程中鹅肉品质及其蛋白质结构的影响[J].现代食品科技, 2014, 30(10):205-211.
XIE M, CAO J X, PAN D D, et al.Influence of different tumbling methods on meat quality and protein structure of goose muscle during postmortem aging [J].Modern Food Science and Technology, 2014,30 (10):205-211.
[5] 史培磊, 闵辉辉, 李春保, 等.滚揉腌制前后鹅肉品质的变化[J].食品科学, 2011, 32(11):88-92.
SHI P L, MIN H H, LI C B,et al. Changes in meat quality characteristics of goose breast muscle after tumbling [J].Food Science, 2011,32 (11):88-92.
[6] KANG D C, ZOU Y H, CHENG Y P, et al.Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33:47-53.
[7] 李鹏, 孙京新, 冯婷,等.不同滚揉腌制对鸭肉蛋白及水分分布的影响[J].中国食品学报, 2019, 19(10):157-164.
LI P, SUN J X, FENG T, et al.Effects of pressure-transform tumbling curing assisted by ultrasound on the protein and water distribution of duck muscle[J].Journal of Chinese Institute of Food Science and Technology, 2019,19 (10):157-164.
[8] WU M G, XIONG Y L, CHEN J.Rheology and microstructure of myofibrillar protein-plant lipid composite gels:Effect of emulsion droplet size and membrane type[J].Journal of Food Engineering, 2011, 106(4):318-324.
[9] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[10] 张海璐, 黄翔, 杨燃, 等.氧化对羊肉肌原纤维蛋白分子与理化特性的影响[J].食品科学, 2020, 41(23):8-14.
ZHANG H L, HUANG X, YANG R, et al.Effect of oxidation on molecular and physicochemical properties of mutton myofibrillar protein [J].Food Science, 2020, 41 (23):8-14.
[11] LEVINE R L, WILLIAMS J A.STADTMAN E R, et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods in Enzymology, 1994, 233:346-357.
[12] 曹锦轩, 张玉林, 韩敏义, 等.腊肉加工过程中肌原纤维蛋白结构的变化[J].中国农业科学, 2013, 46(18):3 871-3 877.
CAO J X, ZHANG Y L, HAN M Y, et al.Changes of the construction of myofibrillar proteins in Chinese traditional bacon during processing[J].Scientia Agricultura Sinica, 2013, 46 (18):3 871-3 877.
[13] LI C Q, XIONG Y L, CHEN J.Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J].Journal of Agricultural and Food Chemistry, 2012, 60(32):8 020-8 027.
[14] 程述震, 王晓拓, 张洁, 等.电子束剂量率对牛肉蛋白结构和理化性质的影响[J].食品科学, 2018, 39(3):150-156.
CHENG S Z, WANG X T, ZHANG J, et al.Effect of electron beam dose rate on myofibrillar protein structure and physicochemical characteristics of chilled beef [J].Food Science, 2018,39(3):150-156.
[15] 胡远辉, 吕春霞, 廖慧琦, 等.NaCl处理对养殖大黄鱼肌原纤维蛋白风味吸附及结构的影响[J].食品与发酵工业, 2021,47(14):202-209.
HU Y H, LYU C X, LIAO H Q, et al.Effect of sodium chlorid treatment on flavor adsorption and structure of cultured large yellow croaker myofibrillar protein[J].Food and Fermentation Industries, 2021,47(14):202-209.
[16] 李侠, 孙圳, 杨方威, 等.适宜冻结温度保持牛肉蛋白稳定性抑制水分态变[J].农业工程学报, 2015, 31(23):238-245.
LI X, SUN Z, YANG F W, et al.Appropriate freezing temperature to maintain beef protein stability and inhibit myowater state changes[J].Transactions of the Chinese Society Agricultural Engineering, 2015, 31 (23):238-245.
[17] 孙克奎, 金声琅, 潘雅燕, 等.等离子体活性水腌制对猪肉肌原纤维蛋白氧化及结构的影响[J].食品科学, 2020, 41(14):36-41.
SUN K K, JIN S L, PAN Y Y, et al.Effects of plasma-activated water curing on oxidation and structure of pork myofibrillar protein [J].Food Science, 2020, 41 (14):36-41.
[18] ESTÉVEZ M, VENTANAS S, HEINONEN M.Formation of Strecker aldehydes between protein carbonyls-α-aminoadipic and γ-glutamic semialdehydes-and leucine and isoleucine[J].Food Chemistry, 2011, 128(4):1 051-1 057.
[19] 胡鹏, 汝医, 王维婷, 等.滚揉对成熟过程中羊肉肌原纤维蛋白降解及氧化程度的影响[J].黑龙江畜牧兽医, 2018(24):53-56.
HU P, RU Y, WANG W T, et al.The effect of tumbling treatment on the degradation and oxidation of mutton myofibrillar protein during ripening process[J].Heilongjiang Animal Science and Veterinary Medicine, 2018 (24):53-56.
[20] 王安然. 超声处理对牛肉品质的影响及机理研究[D].南京:南京农业大学, 2018.
WANG A R.Study on the effects and mechanism of ultrasonic treatment on beef quality[D].Nanjing:Nanjing Agricultural University, 2018.
[21] XIONG Y L, PARK D, OOIZUMI T.Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J].Journal of Agricultural and Food Chemistry, 2009, 57(1):153-159.
[22] ZHANG T, LI Z J, WANG Y M, et al.Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J].Food Research International, 2016, 83:152-161.
[23] 杨玉玲, 游远, 彭晓蓓, 等.加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响 [J].中国农业科学, 2014, 47(10):2 013-2 020.
YANG Y L, YOU Y, PENG X B, et al.Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle[J].Scientia Agricultura Sinica, 2014, 47 (10):2 013-2 020.
[24] BEATTIE J R, BELL S E J, BORGGAARD C, et al.Preliminary investigations on the effects of ageing and cooking on the Raman spectra of porcine longissimus dorsi [J].Meat Science, 2008, 80(4):1 205-1 211.
[25] CAI L Y, NIAN L Y, CAO A L, et al.Effect of carboxymethyl chitosan magnetic nanoparticles plus herring antifreeze protein on conformation and oxidation of myofibrillar protein from red sea bream (Pagrosomus major) after freeze-thaw treatment[J].Food and Bioprocess Technology, 2020, 13(2):355-366.
[26] 康大成. 超声波辅助腌制对牛肉品质的影响及其机理研究[D].南京:南京农业大学, 2017.
KANG D C.Effects and mechanism of ultrasound-assited curing on the quality of beef [D].Nanjing:Nanjing Agricultural University, 2017.
[27] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review[J].Meat Science, 2011, 89(2):111-124.
[28] WANG P, CHEN L, XU X L, et al.Effects of pre-slaughtering holding with water-misting sprays and forced ventilation on meat quality of broiler after summer transport[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(22):275-281.
[29] 李鹏, 王红提, 孙京新, 等.超声辅助变压滚揉对鸡肉蛋白质结构及含水量的影响[J].农业工程学报, 2017, 33(16):308-314.
LI P, WANG H T, SUN J X, et al.Effects of pressure-transform tumbling assisted by ultrasound on protein structure and water content of chicken [J].Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(16):308-314.
[30] ZHENG H B, HAN M Y, YANG H J, et al.The effect of pressure-assisted heating on the water holding capacity of chicken batters[J].Innovative Food Science & Emerging Technologies,2018, 45(2):280-286.