海洋微藻多糖具有抗氧化[1-2]、抗肿瘤[3-4]、抗病毒[5-6]、抑菌[7]、免疫调节[8]、防辐射[9]等多种生物活性。由于其天然无毒、结构特殊、生物活性强等特点具有很高的开发价值,成为生物多糖研究的热点。当前海洋微藻多糖的开发利用主要局限于微藻多糖产量低,所以,筛选高产多糖的藻种是微藻多糖资源开发利用的先决条件。
本文从广西北部湾分离筛选海洋微藻,对其进行鉴定,通过响应面法对其产糖培养基进行优化,以期得到高产多糖的微藻藻种,从而为海洋微藻多糖的进一步开发利用提供实验基础。
1 材料与方法
1.1 材料与仪器
藻种:从广西北部湾防城港红树林采样,分离筛选得到的微藻,编号为GF02;
培养基等试剂均为国产分析纯,天津市科密欧化学试剂有限公司;DPPH,Biotopped;羟自由基清除能力检测试剂盒,Solarbio;Plant Genomic DNA Kit,天根生化科技有限公司。
RTOP系列智能人工气候培养箱,浙江托普仪器有限公司;BX51TRF正立荧光显微镜,OLYMPUS;UV-1800型紫外可见分光光度计,上海美谱达仪器有限公司;Epoch酶标仪,Bio Tek Instruments; 冷冻干燥机,北京松源华兴科技发展有限公司;卢湘仪GL-21M离心机,上海泸湘仪离心机仪器有限公司;T100型PCR仪,广州市讯益生物技术有限公司。
1.2 微藻的分离纯化与筛选
1.2.1 采样
广西防城港七彩贝丘湾红树林保护区,海潮退后,在沿海红树林低洼蓄水处采取水样。
1.2.2 藻种分离
取200 μL采集到的水样于BG-11固体培养基上划线,置于(25±1)℃,光暗周期=12 h∶12 h,光照强度4 000 Lux的条件下培养。分离得到的藻株重复划线,直至得到纯化的藻种。
1.2.3 筛选
纯化好的藻种接种于BG-11液体培养基,培养至稳定期的藻液经离心得到的上清液用苯酚硫酸法检测胞外多糖含量,并选择1株产糖量最高的微藻进行后续的研究,编号为GF02。
1.3 生长曲线
GF02接种于BG-11液体培养基后,每隔24 h测定藻液680 nm处吸光值。以培养天数为横坐标,OD680为纵坐标绘制GF02生长曲线。
1.4 GF02鉴定
取20 μL藻液置于无菌载玻片,光学显微镜下观察GF02的形态特征。
按照试剂盒说明书,使用植物基因组试剂盒提取GF02基因组DNA,以其为模板,使用通用引物进行PCR扩增,获得其18S rDNA片段。PCR反应程序:95 ℃预变性2 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环,最后72 ℃终延伸2 min。
通用引物[10]为:1999F:WACCTGGTTGATCCTGCCAGT;1999R:GATCCTTCYGCAGGTTCACCTAC。
PCR产物经电泳验证后测序,序列在NCBI数据库中上进行BLAST比对,挑选同源性较近的序列用Clustal W软件进行多序列对齐,基于MEGA 7软件中的邻接法,1 000次重复计算的bootstrap,构建进化树。
1.5 胞外多糖含量的测定及初步表征
1.5.1 胞外多糖提取
培养至稳定期的微藻,取微藻悬液于8 000 r/min离心10 min,离心上清液经60 ℃旋蒸浓缩后用分子质量大小为3 000 Da的透析袋透析48 h,Sevage试剂[V(氯仿)∶V(正丁醇)=4∶1]∶多糖溶液=1∶5的体积比去除多糖溶液中蛋白,用4倍体积无水乙醇醇沉过夜,8 000 r/min离心10 min去上清液,白色沉淀经真空冷冻干燥得粗多糖。
1.5.2 标准曲线绘制
准确称取干燥至恒重的葡萄糖标准品配成1 mg/mL的葡萄糖标准液,用蒸馏水准确稀释至所需的浓度,取8个1.5 mL离心管按照表1进行加样操作,向每个试管中加入100 μL 5%(质量分数)的苯酚溶液,摇匀后加入500 μL浓H2SO4,摇匀后置于100 ℃水浴30 min。取出待冷却后在490 nm处检测吸光值。以标准葡萄糖浓度为横坐标,OD490为纵坐标绘制葡萄糖标准曲线(图1)。
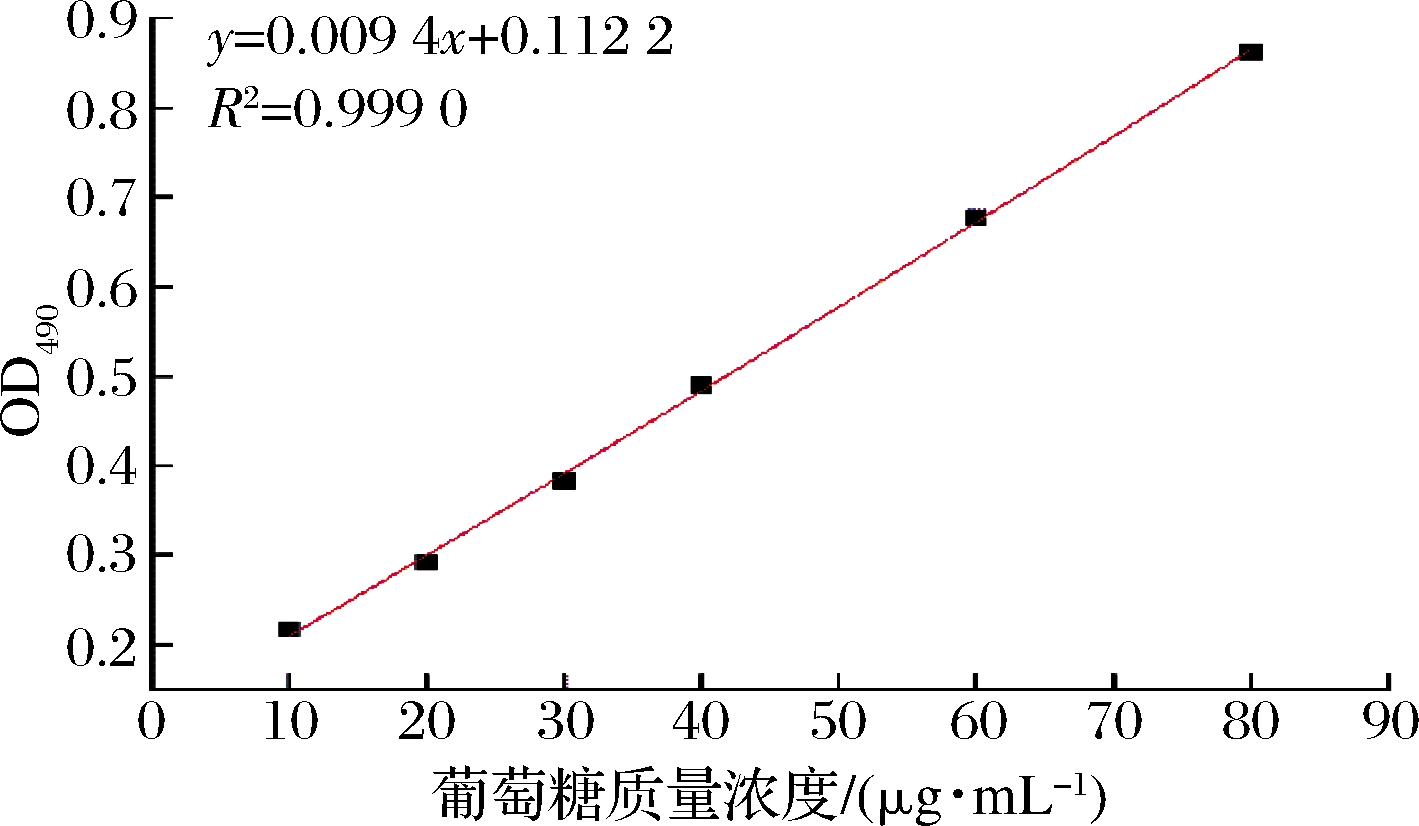
图1 葡萄糖标准曲线
Fig.1 Glucose standard curve graph
1.5.3 胞外多糖含量测定
GF02接种于BG-11液体培养基,间隔24 h取200 mL藻液提取多糖,所得胞外粗多糖用1 mL蒸馏水充分溶解,采用苯酚-硫酸法[11],检测上清液OD490,根据线性回归方程计算多糖含量。
1.5.4 胞外多糖紫外光谱表征
取2 mg胞外粗多糖用适量蒸馏水溶解,以蒸馏水为空白,用紫外分光光度计扫描400~200 nm的吸光值以检测胞外粗多糖是否有污染。
1.5.5 胞外多糖红外光谱表征
取2 mg胞外多糖加入干燥的KBr研磨混匀,用压片机压成薄片,在400~4 000 cm-1内进行红外光谱扫描。
1.6 单因素试验
为研究培养基中营养盐对GF02产胞外多糖的影响,通过调整培养基营养盐的浓度进行单因素试验,实验设计如表1,接种GF02,培养20 d至产糖稳定期,测定GF02产胞外多糖含量,方法同上,每个实验做3个平行样。
表1 单因素设计及水平
Table 1 Single factor design and level
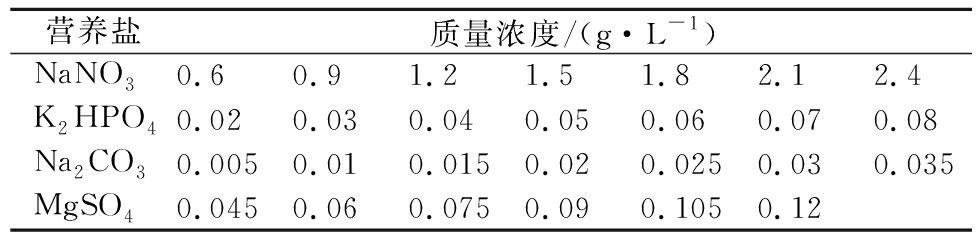
营养盐质量浓度/(g·L-1)NaNO30.60.91.21.51.82.12.4K2HPO40.020.030.040.050.060.070.08Na2CO30.0050.010.0150.020.0250.030.035MgSO40.0450.060.0750.090.1050.12
1.7 响应面分析
在单因素研究的基础上,采用响应面法优化培养基成分的最佳条件,利用Design expert 10软件进行Box-Behnken实验设计,实验因素及水平如表2所示,每个实验做3个平行样。
表2 Box-Behnken实验设计因素及水平
Table 2 Design factors and levels of Box-Behnken experiment
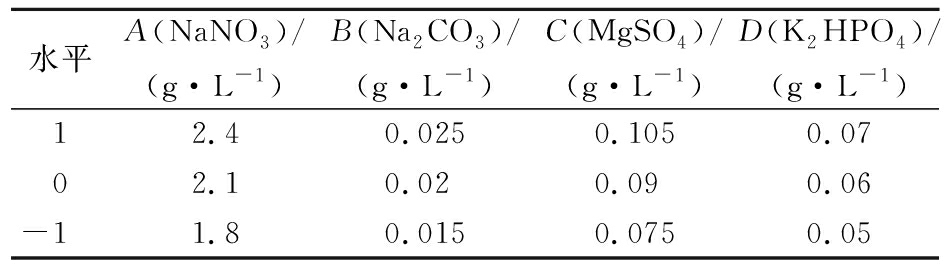
水平A(NaNO3)/(g·L-1)B(Na2CO3)/(g·L-1)C(MgSO4)/(g·L-1)D(K2HPO4)/(g·L-1)12.40.0250.1050.0702.10.020.090.06-11.80.0150.0750.05
1.8 抗氧化活性实验
1.8.1 DPPH自由基清除能力检测
配制多糖样品质量浓度为2、4、6、8、10、20 mg/mL,取2 mL各浓度样品溶液加入2 mL质量浓度为40 μg/mL DPPH溶液,摇匀黑暗条件放置30 min,517 nm 下测定吸光值,DPPH清除率计算如公式(1)所示:
DPPH清除率![]()
(1)
式中:A0,蒸馏水加DPPH吸光值;A1,样品待测液加DPPH吸光值。
1.8.2 羟自由基清除能力检测
配制质量浓度为5、10、15、20、30、40 mg/mL的多糖样品溶液,根据羟自由基清除能力检测试剂盒说明书测定各浓度样品的羟自由基清除能力,如公式(2)所示:
羟自由基清除率![]()
(2)
式中:B测,待测样品吸光值;B对,对照管吸光值;B空,空白管吸光值。
1.9 数据统计与分析
所有结果均重复检测3次,使用Origin 9.0软件对所得数据进行统计分析与作图,利用Design expert 10软件对响应面结果进行分析。
2 结果与分析
2.1 GF02的鉴定
2.1.1 形态学鉴定
在光学显微镜40倍镜下观察到的GF02呈球状,绿色无鞭毛,为单细胞微藻,初步鉴定可能为小球藻属(图2)。
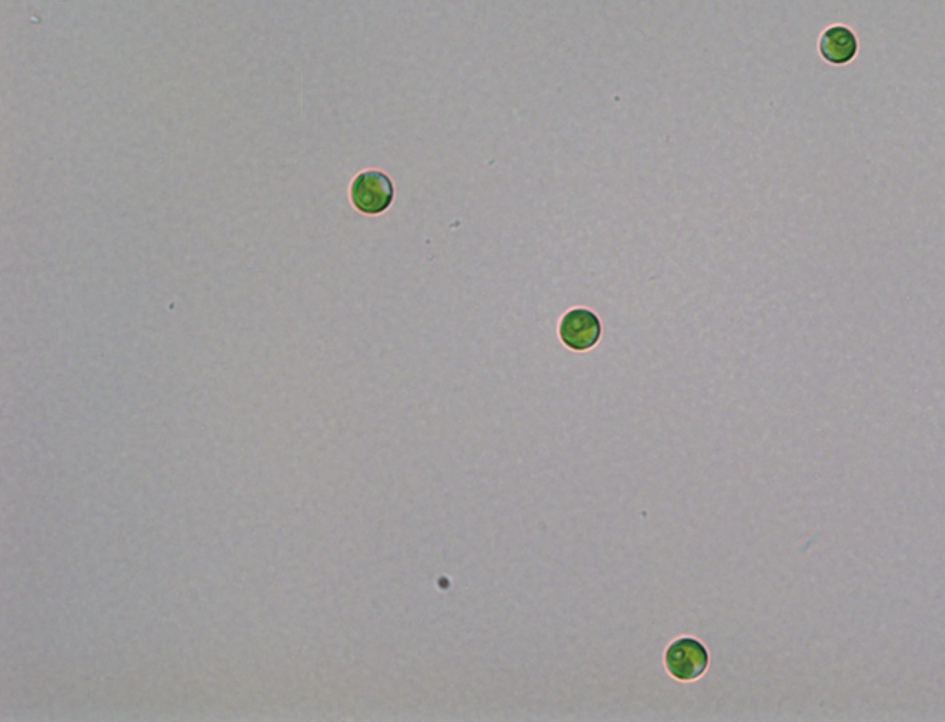
图2 GF02光学显微镜图(×40)
Fig.2 Optical microscope figure of GF02 (×40)
2.1.2 分子生物学鉴定
以GF02 DNA为模板,使用通用引物扩增18S rDNA,获得1.7 kb大小的条带,测序后构建系统发育树,结果如图3所示。GF02与数据库中的小球藻属Chlorella在同一分支上。测序结果经比对,发现GF02与C.Sorokiniana(GQ 122327.1)之间的亲缘关系最接近,序列相似度达到99.82%,结合形态学与分子生物学分析可以确定GF02属于C.Sorokiniana。
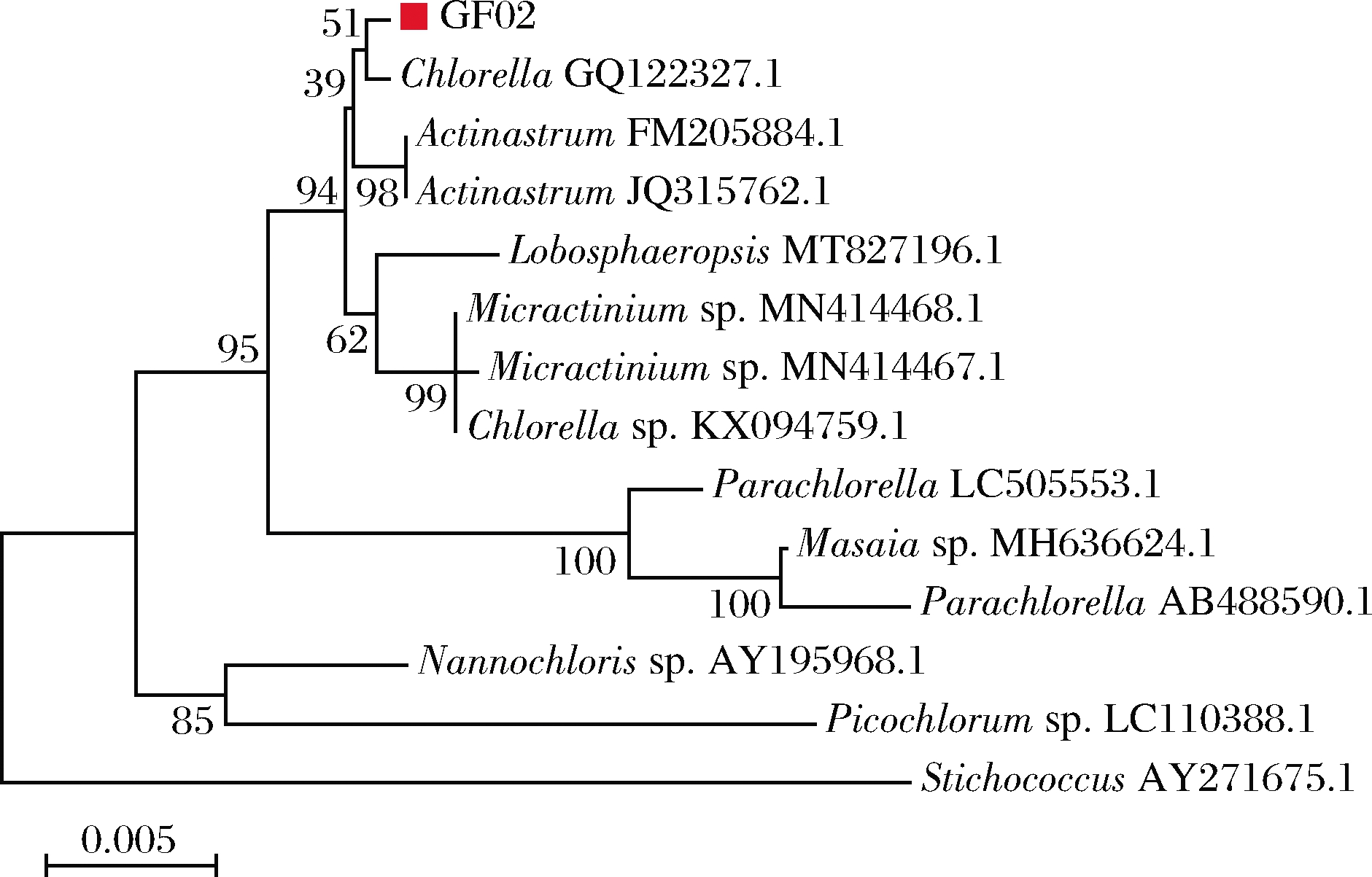
图3 微藻GF02 18S rDNA序列系统进化树
Fig.3 Phylogenetic tree of microalgae GF02 18S rDNA sequence
2.2 GF02生长曲线与胞外多糖含量测定
GF02生长曲线如图4-a所示,接种初期微藻生长速度较缓慢,1周之后生长速率变快,到第9天达到最高值,第10天之后达到稳定期。在稳定期前,GF02胞外多糖含量偏低且稳定,说明GF02在生长阶段很少分泌多糖(图4-b),到达稳定期后,多糖产量开始快速升高,说明GF02从这个阶段开始分泌并积累胞外多糖。浦寅芳等[12]的研究也证明,微藻在稳定期才开始大量积累多糖。GF02产糖量在培养20 d时达到高峰,其后糖含量开始有下降的趋势,这与吴琪璐等[13]的结果一致,可能是由于培养基养分过分消耗,GF02开始利用胞外产物作为养分来源。
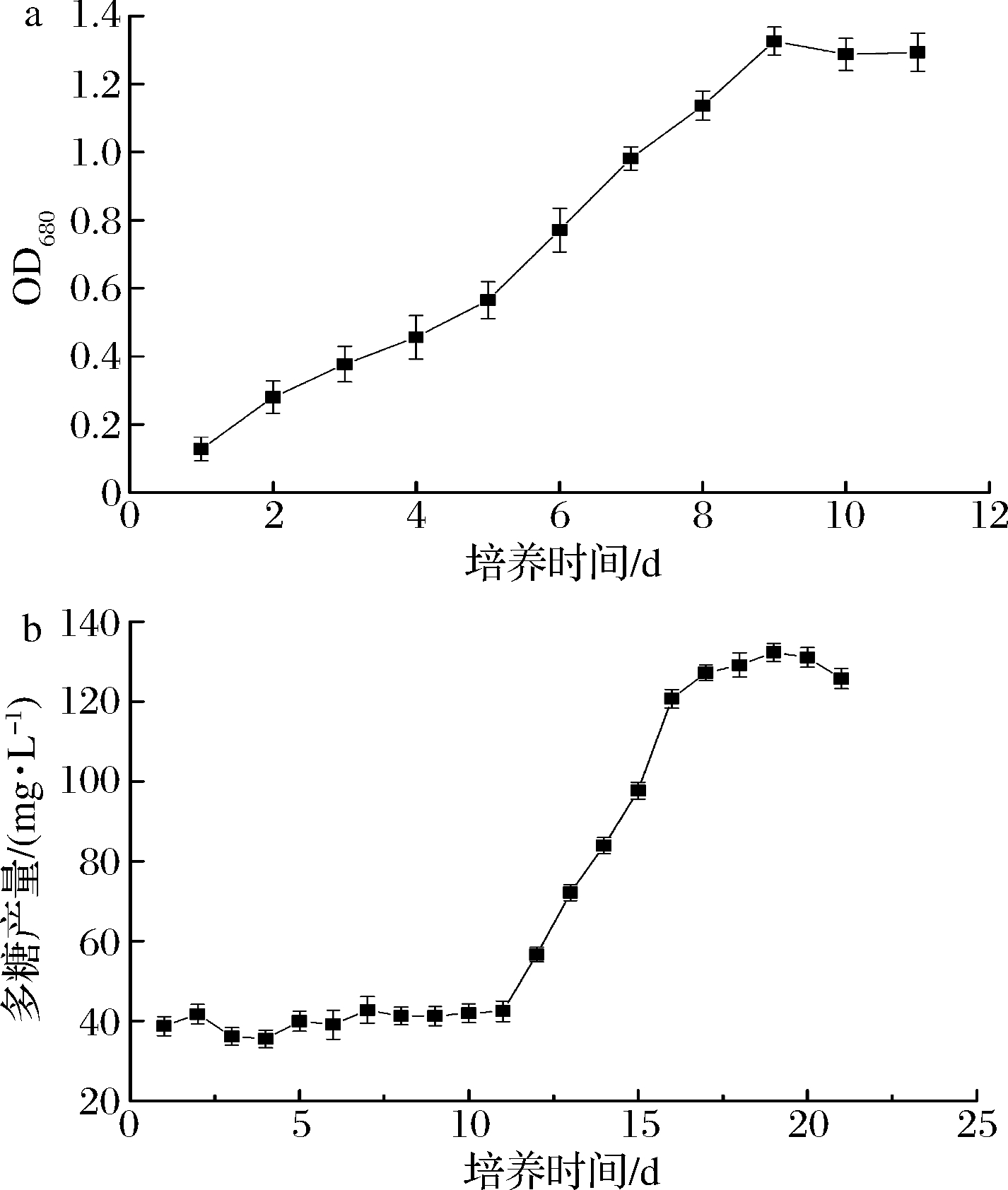
a-生长曲线;b-胞外多糖含量
图4 GF02生长曲线与胞外多糖含量
Fig.4 Growth curve and exopolysaccharides content of GF02
2.3 胞外多糖的初步表征
2.3.1 胞外多糖紫外光谱
由图5可知,GF02多糖在260、280 nm处没有明显的吸收峰出现,表明没有核酸和蛋白质的污染。
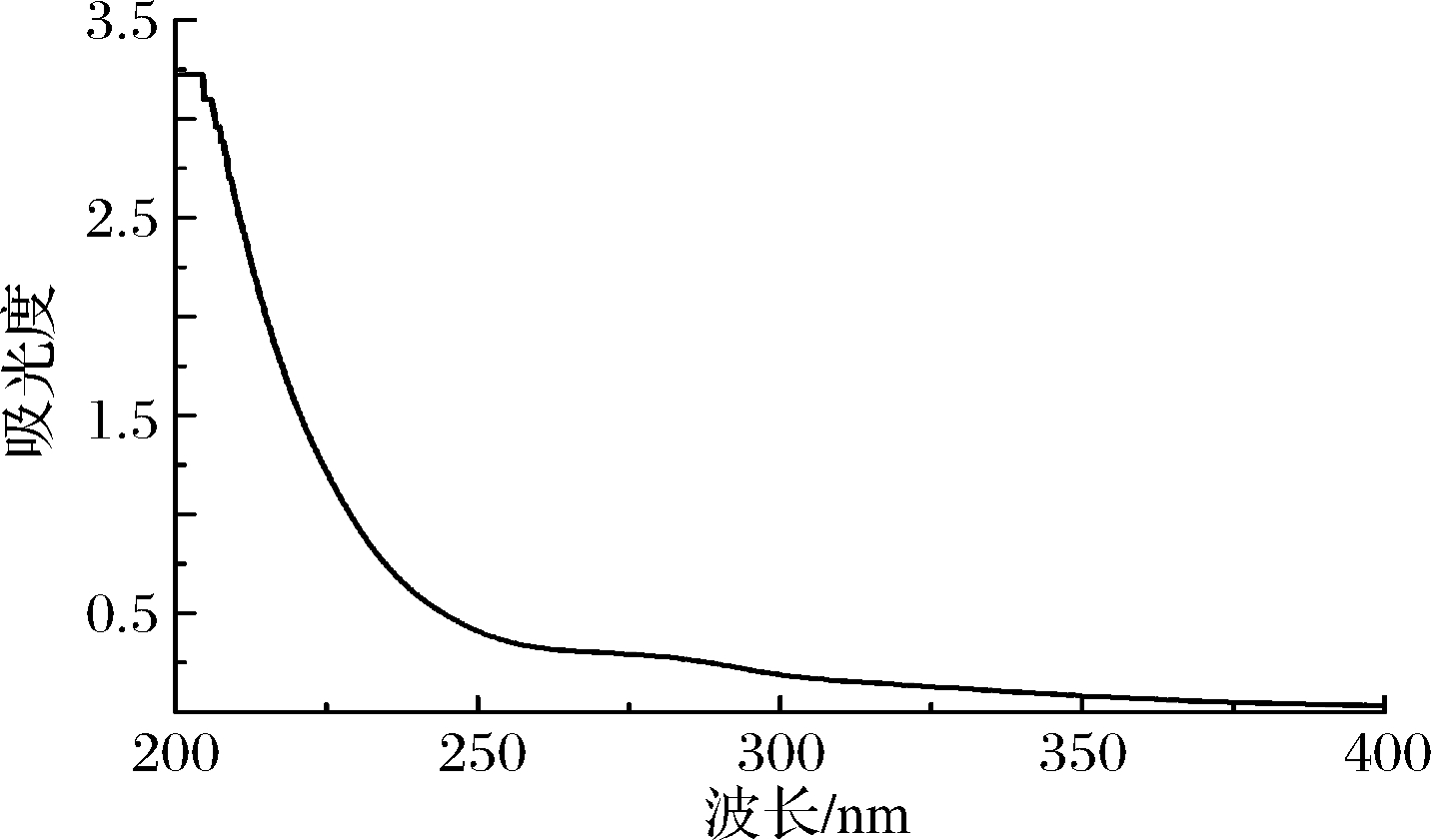
图5 胞外粗多糖紫外光谱
Fig.5 UV spectra of crude extracellular polysaccharides
2.3.2 胞外多糖红外光谱
图6为微藻GF02胞外粗多糖红外光谱图,在3 430 cm-1附近的强吸收峰对应的是—OH的伸缩振动吸收峰;2 935 cm-1的吸收信号为C—H伸缩振动吸收峰;1 635 cm-1处出现的吸收峰是糖醛酸羧酸盐的不对称伸缩振动引起的;波数1 400 cm-1 为C—H弯曲振动吸收峰;1 250 cm-1附近出现的吸收峰是C—O—S的弯曲振动吸收峰;在890~900 cm-1没有观察到吸收峰,说明此多糖含α-型糖苷键,不含β-型糖苷键;在770 cm-1处的伸缩振动是α-D-吡喃糖的特征吸收峰;表明GF02胞外粗多糖以α-型吡喃糖为主。
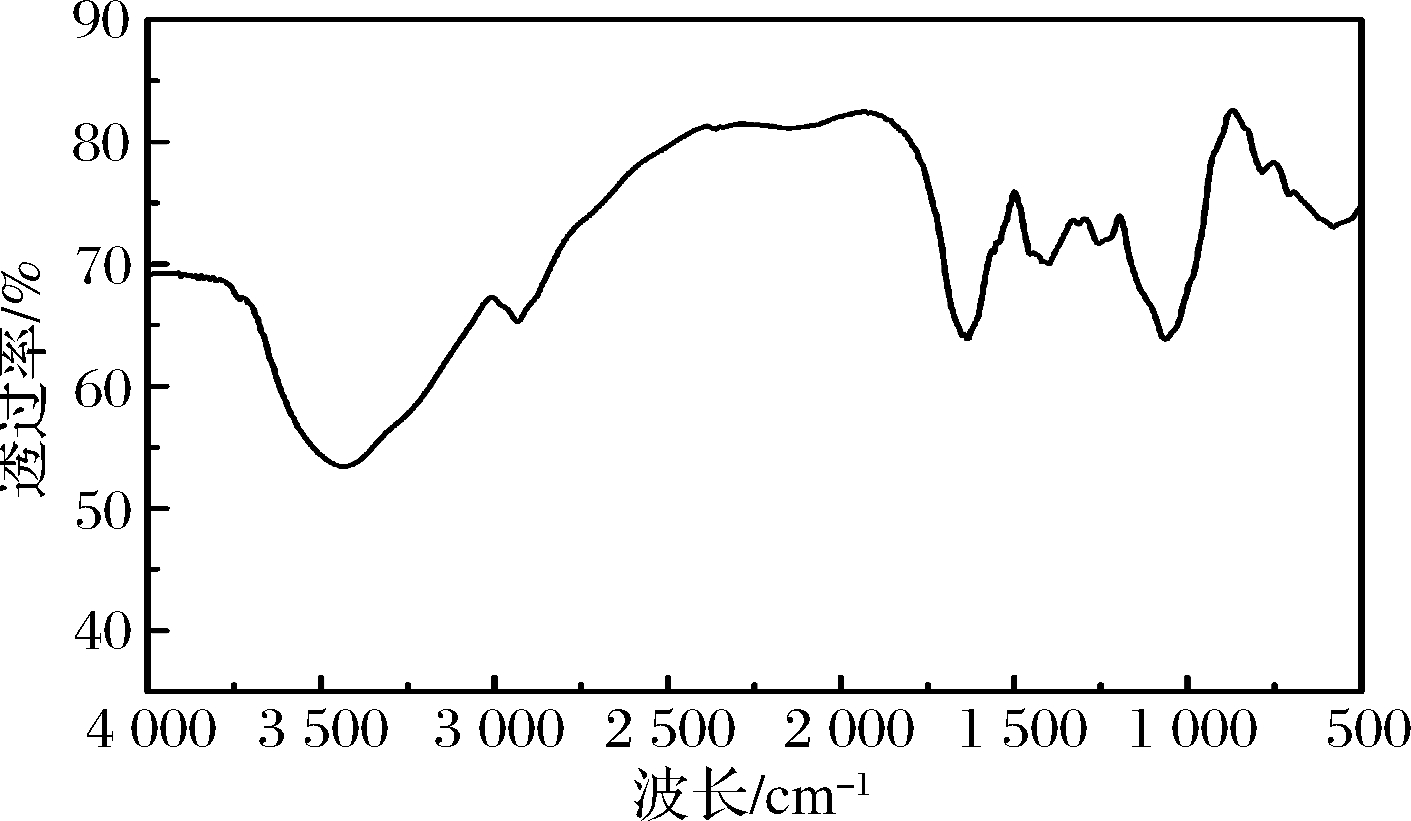
图6 胞外粗多糖红外光谱
Fig.6 Infrared spectra of crude extracellular polysaccharides
2.4 单因素试验结果
2.4.1 K2HPO4对GF02产胞外多糖的影响
随着K2HPO4浓度的增加,胞外多糖产量增加,当K2HPO4质量浓度达到0.06 g/L时,藻液中多糖含量最高,此时多糖质量浓度为142.513 mg/L,当磷酸盐浓度继续增加,多糖产量降低(图7-a)。
2.4.2 NaNO3对GF02产胞外多糖的影响
随着NaNO3浓度的增加,GF02产胞外多糖升高(图7-b),当NaNO3质量浓度达到2.4 g/L时,多糖产量达到最高值,这可能是NaNO3浓度提高导致藻细胞大量增殖从而提高了多糖的产量。氮源是微藻生长不可或缺的元素之一[11],NaNO3浓度过低时微藻生长缓慢或停止生长,随着氮源含量增加,微藻会加速生长,细胞密度持续升高;当NaNO3质量浓度超过2.4 g/L时,多糖含量降低,这可能是盐浓度过高产生胁迫作用所致。
2.4.3 Na2CO3对GF02产胞外多糖的影响
根据图7-c结果,胞外多糖含量随Na2CO3的浓度升高呈先上升后下降的趋势,当Na2CO3质量浓度为0.02 g/L时,多糖产量达最高值。说明低浓度的Na2CO3有利于GF02的生长产糖,而高浓度的Na2CO3则呈现明显的抑制作用,与曹科伟[14]在北极小球藻的研究结果一致。
2.4.4 MgSO4对GF02产胞外多糖的影响
MgSO4对GF02产胞外多糖的影响如图7-d所示,低浓度MgSO4对GF02产糖影响不大,当MgSO4质量浓度达到0.09 g/L时,多糖产量达到最高值;此后随MgSO4浓度升高,多糖产量呈下降趋势。Mg2+有利于微藻的生长发育,能够参与藻细胞的各种代谢过程[15],但过量的Mg2+会与培养基中K+、AI3+等产生拮抗作用从而抑制微藻生长[16]。

a-K2HPO4;b-NaNO3;c-Na2CO3;d-MgSO4
图7 四种营养盐对胞外多糖积累的影响
Fig.7 Effects of four nutrients on the accumulation of extracellular polysaccharide
2.5 响应面优化实验
2.5.1 实验方案设计与实验结果分析
根据单因素试验结果,利用Design expert 10软件的Box-Behnken法设计了29组实验,实验结果见表3。
表3 响应面设计与实验结果
Table 3 Response surface design and experimental results

序号因素水平ABCD多糖产量/(mg·L-1)1-1-100161.939±2.3521-100183.165±3.323-1100135.655±3.1441100175.234±2.98500-1-1184.621±2.646001-1137.264±3.10700-11183.280±3.0280011152.858±2.659-100-1166.690±2.7810100-1164.544±3.6111-1001134.774±2.45121001192.207±2.69130-1-10183.778±1.981401-10175.808±2.02150-110150.713±2.36160110149.793±3.0617-10-10164.008±2.571810-10166.498±2.8419-1010150.559±2.28201010172.207±3.48210-10-1146.460±2.3922010-1151.326±3.16230-101163.816±3.87240101171.326±3.67250000216.383±2.04260000202.667±1.77270000205.387±2.38280000210.138±1.87290000204.199±2.12
采用Design expert 10 对GF02胞外多糖产量的数据进行分析,得到各因素的回归拟合方程Y=207.75+11.65A-2.56B-12.05C+3.95D+4.59AB+4.79AC+14.89AD+1.76BC+0.66BD+4.23CD-21.21A2-23.52B2-20.73C2-23.50D2。
从方差分析结果可以看出(表4),校正系数R2=0.894 2,RAdj=0.788 4;模型(P<0.000 1)为极显著,失拟项(P>0.05)差异不显著,说明两次回归模型合理且模型拟合度较好,可以对GF02产胞外多糖的结果进行分析和预测。根据回归方程和方差分析结果可得,A(NaNO3)、C(MgSO4)、AD(NaNO3与K2HPO4的交互项)以及各个因素的2次项对多糖产量的结果有显著影响,各因素的显著性排序为C>A>D>B。
表4 方差分析表
Table 4 analysis of variance(ANOVA)
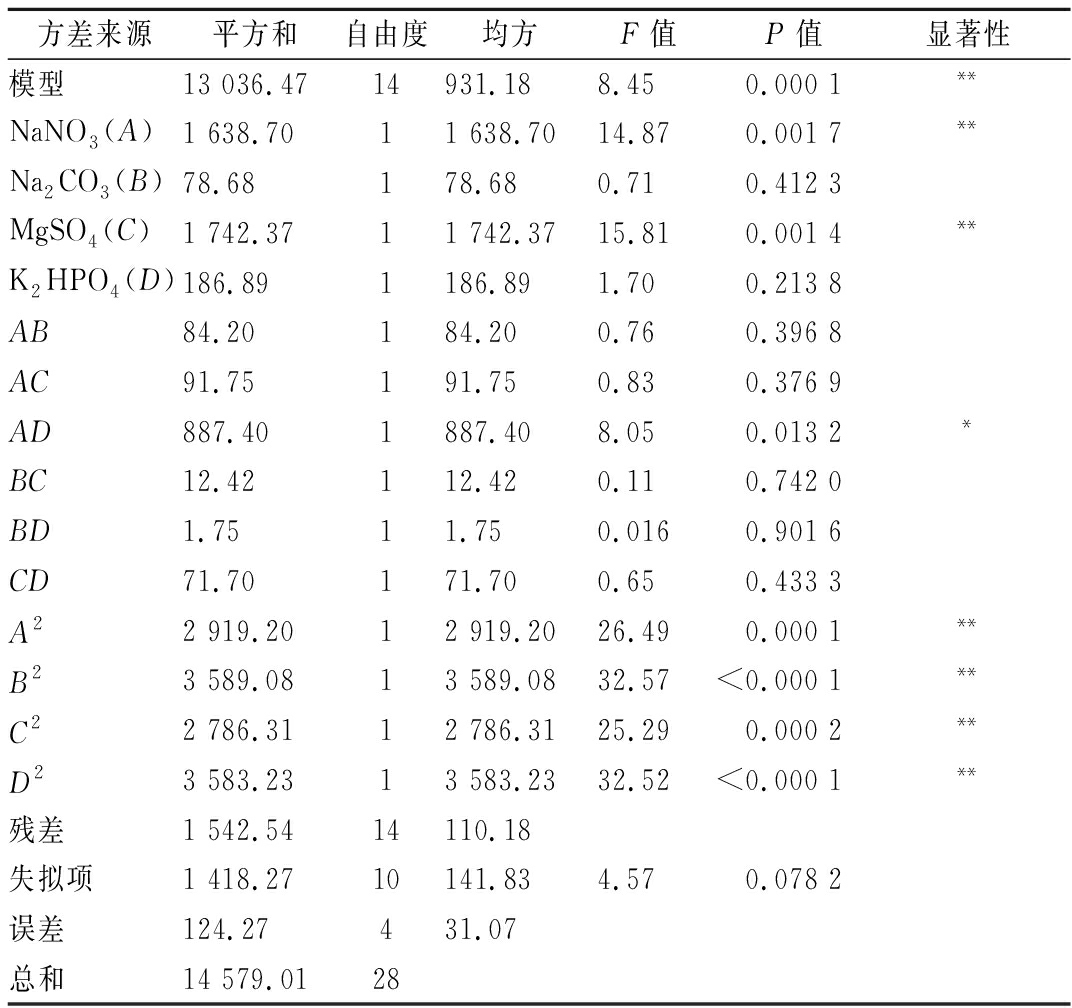
方差来源平方和自由度均方F值P值显著性模型13 036.4714931.188.450.000 1**NaNO3(A)1 638.7011 638.7014.870.001 7**Na2CO3(B)78.68178.680.710.412 3MgSO4(C)1 742.3711 742.3715.810.001 4**K2HPO4(D)186.891186.891.700.213 8AB84.20184.200.760.396 8AC91.75191.750.830.376 9AD887.401887.408.050.013 2*BC12.42112.420.110.742 0BD1.7511.750.0160.901 6CD71.70171.700.650.433 3A22 919.2012 919.2026.490.000 1**B23 589.0813 589.0832.57<0.000 1**C22 786.3112 786.3125.290.000 2**D23 583.2313 583.2332.52<0.000 1**残差1 542.5414110.18失拟项1 418.2710141.834.570.078 2误差124.27431.07总和14 579.0128
注:“*”表示差异在P<0.05水平上有统计学意义“**”表示差异在P<0.01水平上有统计学意义
响应面两两交互作用如图8所示,响应面图越陡峭,等高线图越接近椭圆,说明两变量之间的交互作用越显著,反之,响应面图越平缓,等高线图越接近圆形,说明两者之间的交互作用越弱[17]。因素AD响应面图最陡峭,其等高线图椭圆程度最明显,说明NaNO3(A)和K2HPO4(D)二者的交互作用对GF02产胞外多糖作用效果最明显,与方差分析的结果一致。

a-K2HPO4与NaNO3等高线图;b-Na2CO3与NaNO3等高线图;c-MgSO4与NaNO3等高线图;d-K2HPO4与NaNO3响应面图;e-Na2CO3与NaNO3响应面图;f-K2HPO4与Na2CO3响应面图
图8 各营养盐交互作用对胞外多糖含量的影响
Fig.8 Effect of the interaction between various nutrients on the content of extracellular polysaccharide
2.5.2 验证实验
Design expert 10预测出GF02产胞外多糖最优参数为NaNO3 2.1 g/L,Na2CO3 0.02 g/L,MgSO4 0.086 g/L,K2HPO4 0.06 g/L,此时的多糖产量为209.607 mg/L。根据预测出来的条件进行3次平行的验证实验,最终测得的胞外多糖质量浓度为(216.268±0.922)mg/L,与预测值相近,说明该模型可行,优化的最佳工艺参数结果可靠。
2.6 GF02多糖抗氧化活性
2.6.1 GF02胞外多糖对DPPH自由基清除效果
DPPH 被广泛用于评价物质的抗氧化能力。实验结果表明,GF02胞外多糖具有清除DPPH自由基的能力(图9),在实验浓度范围内,随着浓度的增加,DPPH清除效果越强,当多糖质量浓度为10 mg/mL时,DPPH清除率达到36.53%。多糖中存在的还原性末端可以直接作用于自由基,从而达到清除的效果[17]。AMNA[18]判断微藻多糖结构中的硫酸基团与其对DPPH自由基的清除能力有很大影响,不含硫酸基团的多糖,对DPPH自由基的清除能力低。部分原因是硫酸基团可以削弱多糖之间的氢键作用,硫酸多糖以经典的方式吸附自由基。GF02胞外多糖红外光谱表明,其结构中具有硫酸基团,可能与其具有DPPH的清除能力有关。

图9 不同浓度GF02粗多糖对DPPH自由基清除能力
Fig.9 DPPH radical scavenging ability of different concentrations of GF02 crude polysaccharide
2.6.2 GF02胞外多糖对羟自由基清除效果
羟自由基能作用于体内蛋白、核酸等生物分子,造成细胞结构功能的损伤,导致突变、致癌[19],从而引起机体代谢紊乱产生疾病,羟自由基清除能力也是样品抗氧化能力的重要指标之一。羟自由基清除结果表明,GF02胞外多糖具有明显的羟自由基清除能力,清除率最高达到67.33%(图10),其清除效果与Isochrysis galbana纯化多糖相当[20]。研究表明,多糖碳氢链上的氢原子可以与羟自由基结合,从而达到清除羟自由基的效果[21]。HROMADKOVA等[22]发现不含蛋白成分的多糖比富含蛋白质的多糖显示出更强的羟自由基清除能力。我们提取的GF02胞外多糖已去除了蛋白质,这可能对其具有强清除羟自由基能力有一定影响。
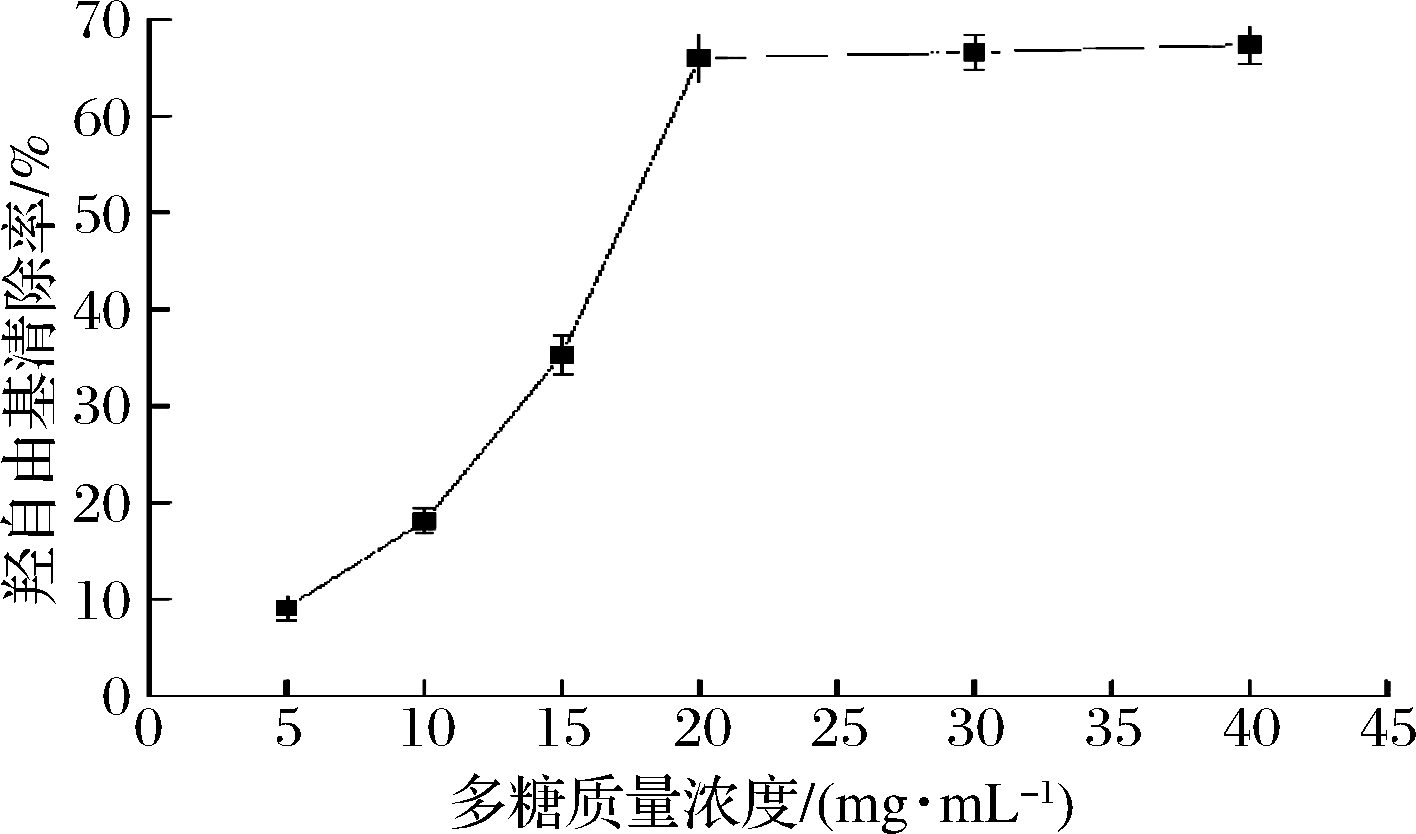
图10 不同浓度GF02粗多糖对羟自由基清除能力
Fig.10 hydroxyl radical scavenging ability of different concentrations of GF02 crude polysaccharide
3 结论
本研究从广西北部湾防城港红树林分离到1株高产多糖的微藻,编号为GF02,结合形态学与分子生物学鉴定此株藻为Chlorella Sorokiniana;红外光谱分析表明GF02胞外粗多糖以α-型吡喃糖为主;通过响应面法优化培养基中营养盐对GF02产胞外多糖的最佳条件为NaNO3 2.1 g/L,Na2CO3 0.02,MgSO4 0.086 g/L,K2HPO4 0.06 g/L,在最佳条件下,GF02产胞外多糖质量浓度为216.268 mg/L;体外抗氧化活性评价实验表明,提取到的GF02胞外粗多糖具有抗氧化活性。
4 展望
从广西北部湾防城港分离得到具有抗氧化活性多糖的微藻GF02,现阶段我们对GF02的产糖条件进行了优化,并对其胞外多糖进行初步的表征,但由于粗多糖成分复杂,在成分分析、结构解析等方面存在很多局限性。下一阶段,我们将对提取到的粗多糖进行分离纯化,再对纯化多糖的分子质量、单糖成分和结构进行表征,并对纯化多糖的生物活性进行研究,以探讨多糖结构与生物活性之间的构效关系。
[1] BURG A, OSHRAT L O.Salt effect on the antioxidant activity of red microalgal sulfated polysaccharides in soy-bean formula[J].Marine Drugs, 2015, 13(10):6 425-6 439.
[2] SONG H, HE M L, GU C K, et al.Extraction optimization, purification, antioxidant activity, and preliminary structural characterization of crude polysaccharide from an arctic Chlorella sp.[J].Polymers, 2018, 10(3):292.
[3] PARK G T, GO R E, LEE H M, et al.Potential anti-proliferative and immunomodulatory effects of marine microalgal exopolysaccharide on various human cancer cells and lymphocytes in vitro[J].Marine Biotechnology, 2017, 19(2):136-146.
[4] 钟闰, 吴思伟, 何秀苗, 等.杜氏盐藻藻胞外多糖抗肿瘤活性及其机制研究[J].食品工业科技, 2020, 41(22):126-133.
ZHONG R, WU S W, HE X M, et al.Antitumor activity and mechanism of exopolysaccharide from Dunaliella salina[J].Science and Technology of Food Industry, 2020, 41(22):126-133.
[5] KIM M, YIM J H, KIM S Y, et al.In vitro inhibition of influenza a virus infection by marine microalga-derived sulfated polysaccharide p-KG03[J].Antiviral Research, 2012, 93(2):253-259.
[6] HUHEIHEL M, ISHANU V, TAL J, et al.Activity of Porphyridium sp.polysaccharide against Herpes simplex viruses in vitro and in vivo[J].Journal of Biochemical and Biophysical Methods, 2002, 50(2-3):189-200.
[7] NAVARRO GALLON S M, ALPASLAN E, WANG M, et al.Characterization and study of the antibacterial mechanisms of silver nanoparticles prepared with microalgal exopolysaccharides[J].Materials Science and Engineering:C, 2019, 99:685-695.
[8] DAI B, WEI D, ZHENG N N, et al.Coccomyxa gloeobotrydiformis polysaccharide inhibits lipopolysaccharide-induced inflammation in RAW 264.7 macrophages[J].Cellular Physiology and Biochemistry, 2018, 51(6):2 523-2 535.
[9] 唐倩, 周楠, 唐东山, 等.具鞘微鞘藻胞外多糖抗紫外辐射活性研究[J].环保科技, 2015, 21(4):16-20.
TANG Q, ZHOU N, TANG D S, et al.Research on anti-ultraviolet radiation activity of extracellular polysaccharide from Microcoleus vaginatus Gom[J].Environmental Protection and Technology, 2015, 21(4):16-20.
[10] 潘艺华. 产EPA海洋微藻的分离筛选及培养条件优化[D].南宁:广西民族大学, 2015.
PAN Y H.Microalgae isolated and culture medium optimization for eicosapentaenoic acid (EPA) productivities[D].Nanning:Guangxi University for Nationalities, 2015.
[11] 李洁琼. 两种小球藻EC04和DC01所产多糖的初步研究[D].南宁:广西民族大学, 2016.
LI J Q.Research of polysaccharide produced by Chlorella EC04 and DC01[D].Nanning:Guangxi University for Nationalities, 2016.
[12] 浦寅芳, 孙颖颖, 严军威, 等.不同环境因子对球等鞭金藻胞内和胞外多糖合成的影响[J].淮海工学院学报(自然科学版), 2008, 17(4):61-64.
PU Y F, SUN Y Y, YAN J W, et al.Effect of environmental factors on the intracellular and extracellular polysaccharide production of Isochrysis galbana[J].Journal of Huaihai Institute of Technology (Natural Sciences Edition), 2008, 17(4):61-64.
[13] 吴琪璐, 崔文倩, 沈亮, 等.环境因子对微藻胞外多聚物主要组分的影响[J].厦门大学学报(自然科学版), 2018, 57(3):346-353.
WU Q L, CUI W Q, SHEN L, et al.The effect of environmental factors on the principal conponents of microalgal extracellular polymeric substances[J].Journal of Xiamen University (Natural Science), 2018, 57(3):346-353.
[14] 曹科伟. 一株北极小球藻的温度适应性及其优化培养的研究[D].南京:南京农业大学, 2015.
CAO K W.The adaptability of an arctic Chlorella sp.to temperatures and its optimized cultivation[D].Nanjing:Nanjing Agricultural University, 2015.
[15] 孙建瑞, 赵君峰, 符丹丹, 等.响应面法优化Chlorella vulgaris 224胞外多糖积累及其抑菌和抗氧化活性[J].天然产物研究与开发, 2020, 32(3):489-497.
SUN J R, ZHAO J F, FU D D, et al.Optimization of extracellular polysaccharide accumulation from Chlorella vulgaris 224 and its antibacterial and antioxidant activity[J].Natural Product Research and Development, 2020, 32(3):489-497.
[16] 张红兵, 刘荟, 史秀英, 等.产油微藻的选育及其培养条件优化[J].生物技术进展, 2020, 10(3):311-319.
ZHANG H B, LIU H, SHI X Y, et al.Microalgae breeding with high efficient of oil-producing and optimization of cultivation conditions[J].Current Biotechnology, 2020, 10(3):311-319.
[17] HUANG G L, MEI X Y, HU J C.The antioxidant activities of natural polysaccharides[J].Current Drug Targets, 2017, 18(11):1 296-1 300.
[18] AMNA KASHIF S, HWANG Y J, PARK J K.Potent biomedical applications of isolated polysaccharides from marine microalgae Tetraselmis species[J].Bioprocess and Biosystems Engineering, 2018, 41(11):1 611-1 620.
[19] GÜLCIN ![]() ELMASTA
ELMASTA M, ABOUL-ENEIN H Y.Determination of antioxidant and radical scavenging activity of Basil (Ocimum basilicum L.Family Lamiaceae) assayed by different methodologies[J].Phytotherapy Research, 2007, 21(4):354-361.
M, ABOUL-ENEIN H Y.Determination of antioxidant and radical scavenging activity of Basil (Ocimum basilicum L.Family Lamiaceae) assayed by different methodologies[J].Phytotherapy Research, 2007, 21(4):354-361.
[20] SUN Y Y, WANG H, GUO G L, et al.The isolation and antioxidant activity of polysaccharides from the marine microalgae Isochrysis galbana[J].Carbohydrate Polymers, 2014, 113:22-31.
[21] 吴雅清, 冷小鹏.多糖体外抗氧化作用及其影响因素[J].广州化工, 2018, 46(4):4-9;16.
WU Y Q, LENG X P.Antioxidant activity and influencing factors of polysaccharides in vitro[J].Guangzhou Chemical Industry, 2018, 46(4):4-9;16.
[22] HROM DKOV
DKOV Z, PAULSEN B S, POLOVKA M, et al.Structural features of two heteroxylan polysaccharide fractions from wheat bran with anti-complementary and antioxidant activities[J].Carbohydrate Polymers, 2013, 93(1):22-30.
Z, PAULSEN B S, POLOVKA M, et al.Structural features of two heteroxylan polysaccharide fractions from wheat bran with anti-complementary and antioxidant activities[J].Carbohydrate Polymers, 2013, 93(1):22-30.