近年来,植物基模拟肉的兴起使得热不可逆植物基凝胶性材料成为不可或缺的配料成分。大豆蛋白具有良好的营养价值、乳化性、填充性以及黏结性等功能[1],在植物基模拟肉中不仅作为组织化蛋白的原料,同时也作为填充和黏结料以及凝胶剂而存在[2-3],但是其热凝胶性相对于动物源凝胶蛋白如蛋清蛋白、肌纤维蛋白等,差距较大[4],也远不及碱性条件下魔芋胶或者可得然胶的热凝胶强度[5]。由于魔芋胶和可得然胶形成热不可逆凝胶需要较高碱性条件[6],严重影响口感[7],而现实应用中尚无其他天然蛋白或者天然多糖可以达成较好的热不可逆凝胶效果。因此改造大豆蛋白,提高其凝胶性,成为提高其应用价值的研究重点和热点之一。
目前,提高大豆蛋白的热不可逆凝胶性的主要方法有pH-shifting、热处理以及超声处理等[8]。LI等[9]通过预热诱导大豆分离蛋白(soybean protein isolation, SPI)变性,使SPI凝胶硬度、持水能力增加,减少凝胶形成时间。ZHENG等[10]发现较长时间的超声处理可以改变SPI二级和三级结构,减小颗粒直径,提高溶解度,提高不同团聚体的表面疏水性和凝胶性。杨昱等[11]研究发现极端酸碱处理通过诱导大豆蛋白高级结构的展开,改善其功能特性。也可基于与多糖的复合效应,提高大豆蛋白的凝胶性。WANG等[12]研究发现马尾豆多糖可显著提高葡萄糖内脂诱导的SPI凝胶的黏度、弹性、持水力和凝胶强度。XIAO等[13]发现小麦麸皮纤维素可以改善SPI凝胶的保水能力、凝胶强度和黏弹性。还有研究发现,转谷氨酰胺酶在一定条件下的预处理可以改善SPI乳液的凝胶性能,包括持水性[14]。
尽管关于大豆蛋白凝胶性的研究有了较好进展,同时有许多技术与方法已经商业化,但是迄今为止,商业SPI的热凝胶性尚无法达到魔芋胶或者可得然胶在碱性条件下所得的热凝胶强度。已有研究发现热处理、pH处理以及超声均有效果,然而这几种方法进行联用的研究较少。事实上,各类处理增强SPI凝胶性的原理略有不同,热处理和pH处理,均是基于形成一定的疏水聚集导致凝胶性提升,而超声则是基于控制疏水聚集导致凝胶性提升。因此,本研究拟联合使用热处理、pH处理以及超声处理,可能会产生对凝胶性更有意义的结果。基于此,本研究以提升SPI热不可逆凝胶性为目标,探讨热处理、pH处理以及超声的复合处理对于SPI凝胶性的影响,并重点分析处理过程SPI的粒径、分子质量分布、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylbenzene sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)、质构以及流变性质的改变,为改进大豆蛋白的性质、提升其应用提供基础。
1 材料与方法
1.1 材料与试剂
大豆(红丰16中粒),哈尔滨市弘杨农业开发有限公司;正己烷、无水乙醇、盐酸、氢氧化钠、硫酸钾、硫酸铜、硼酸、SDS、三羟甲基氨基甲烷、甘氨酸,国药集团化学试剂有限公司;聚丙烯酰胺凝胶(质量分数8%~16%)、考马斯亮蓝R250,碧云天生物技术有限公司。
1.2 仪器与设备
SevenEasy pH 计,瑞士梅特勒-托利多公司;SB-4200 DTD超声波清洗仪,宁波新芝生物科技股份有限公司;CU-420电热恒温水槽,江苏盛蓝仪器制造有限公司;GL-10MD大容量高速冷冻离心机,湘仪离心机仪器有限公司;Pilot 5-8E真空冷冻干燥机,北京博医康实验仪器有限公司;KDN-103F自动定氮仪,上海纤检仪器有限公司;Malvern Nano-ZS 型动态光散射仪,美国Malvern公司;Waters 1525-2489 Breeze高效液相色谱仪,美国Waters公司;Shodex Protein KW-804凝胶色谱柱(8.0 mm×300 mm, No.E801134),日本昭和电工株式会社;BIO-RAD 凝胶电泳仪,美国Bio-Rad公司;TA-XT Plus质构仪,英国Stable Micro System公司;MARS Ⅲ旋转流变仪,德国Thermo Scientific公司;Q2000差示扫描量热仪,美国TA公司。
1.3 实验方法
1.3.1 SPI的制备
大豆粉碎过100目筛,采用正己烷和乙醇体积比9∶1,以料液比为1∶3(g∶mL),3次脱脂,室温下搅拌2 h,真空抽滤后干燥得到脱脂豆粉。用pH 7.0~7.5去离子水(1 mol/L NaOH调节pH)在室温下搅拌提取,冷冻离心去上清液,用1 mol/L的HCl调节pH 4.5进行酸沉淀,30 min后再次离心,取沉淀,采用pH 7.2去离子水复溶沉淀后,再次pH 4.5酸沉淀,中和后,冷冻干燥,得到SPI,4 ℃冷藏备用。参照GB 5009.5—2016[15]中的凯氏定氮法测定上述SPI的总粗蛋白含量。
1.3.2 pH-超声复合处理及筛选SPI溶液
用去离子水将SPI溶液调节到0.08、0.10和0.12 g/mL。根据曾琪等[16]的报道,远离等电点pH值,蛋白质溶解度提高,pH值偏大时,蛋白质三维结构改变,黏弹性减弱,因此本研究选择极酸性条件对SPI进行改性,利用1 mol/L HCl溶液分别将上述3个质量浓度SPI调节pH至1.0、2.0和3.0。经预实验得知pH为1的条件下,大部分SPI溶液无法成胶,且该条件酸性过强不利于工业化生产,故排除。各取上述筛选所得6个条件处理的SPI溶液50 mL进行超声复合处理。参考胡昊等[17]的研究,设置超声功率为240 W,超声频率为40 kHz,将上述6种SPI溶液分别在20 ℃和40 ℃超声30 min,然后立即浸入冷水冷却。处理后的样品溶液分别记作S8+2+20、S8+2+40、S8+3+20、S8+3+40、S10+2+20、S10+2+40、S10+3+20、S10+3+40、S12+2+20、S12+2+40、S12+3+20、S12+3+40。对于0.08 g/mL SPI溶液,样品S8+2+20、S8+2+40和S8+3+20经95 ℃高温处理后无法形成稳定热凝胶,故排除,保留样品S8+3+40;对于0.10 g/mL SPI溶液和0.12 g/mL SPI溶液,考虑工业化生产能源消耗最小化因素,仅保留样品S10+2+20、S10+3+20、S12+2+20和S12+3+20。
将不做任何处理的3个浓度质量SPI,分别记作S8、S10和S12;单独进行pH处理的3个质量浓度SPI,分别记作S8+3、S10+2、S10+3、S12+2和S12+3;单独进行超声处理的3个浓质量度SPI,分别记作S8+超声、S10+超声和S12+超声。
1.3.3 粒径测定
用Malvern Nano-ZS型动态光散射仪测量蛋白粒径,选择蛋白水溶液模式,设定测量温度25 ℃,平行测量3次。测量时将样品液倒入测量池约2/3高度,每次测量结束后用去离子水清洗。
1.3.4 分子质量分布测定
将SPI溶液分散于去离子水中稀释成蛋白质量浓度为0.005 g/mL的溶液,过0.22 μm的水系微孔滤膜后进样分析。采用Waters 1525-2489 Breeze 高效液相色谱仪,色谱柱:Shodex protein KW-804 型(300 mm×8 mm);流动相:含 0.3 mol/L NaCl的50 mmol/L磷酸钠缓冲液(pH 7.0);紫外检测波长:280 nm;流速:1 mL/min;柱温:25 ℃。用于曲线校正的6种化学物质及其相对分子质量如下:甲状腺球蛋白,669 000;BSA,67 000;鸡蛋白,43 000;抑肽酶,6 500;维生素B12,1 350[18]。
1.3.5 SDS-PAGE分析
将处理前后的SPI溶液稀释至4 mg/mL,取蛋白样品溶液与上样缓冲液1∶1(体积比)混合,电泳前沸水浴煮沸5 min。上样量为15 μL。浓缩胶质量分数为4%,分离胶质量分数为8%~16%的梯度胶。电泳电压初始为40 V,待样品进入分离胶时,提高电压至80 V。采用考马斯亮蓝R250溶液染色,用去离子水脱色至条带清晰,采用BIO-RAD凝胶成像系统进行成像,用Image Lab软件进行条带分析。
1.3.6 流变性质测定
(1)频率扫描
为确定线性黏弹性范围,首先进行应变扫描,设置参数:温度20 ℃,设置应变范围为1%~100%,频率为1 Hz,记录弹性模量G′和黏性模量G″随应变范围的变化情况。结果表明,应变为0.5%,在线性黏弹性范围内,之后的频率扫描和温度扫描用该应变进行实验。
频率扫描参数设置:温度20 ℃,应变为0.5%,频率范围为0.1~10 Hz,记录G′和G″随频率的变化情况。每个样品做3次重复实验。
(2)温度扫描
利用HAKAA MARS III旋转流变仪的振荡模式测定SPI乳状液凝胶的流变性质,选择直径为35 mm的平板,间隙值为1 mm。参照XIAO等[13]的方法并作适当改动,将SPI乳状液上样,刮边除去多余的液体后在转子四周涂抹上硅油,防止高温下水分蒸发损失,随后立即进行动态流变测定。设置参数:应变0.5%(线性范围区内),频率1 Hz。温度循环:首先以5 ℃/min的速率从20 ℃升温至95 ℃,紧接着在95 ℃下保温30 min,然后再以5 ℃/min的降温速率从95 ℃降温至20 ℃。记录G′和G″随温度和时间的变化情况。每个样品做3次重复实验。
1.3.7 热不可逆凝胶的制备
将采用1.3.2中方法制得的处理后SPI溶液分别装于25 mL的烧杯中,盖上保鲜膜后将烧杯置于95 ℃的水浴锅中热处理20 min,冰水浴冷却至室温后在4 ℃的冰箱中待用,测试前0.5 h取出回复到室温后测试。
1.3.8 凝胶质构测定
在10 mL小烧杯中加蛋白样品10 mL,以保鲜膜封口后在95 ℃恒温水浴中加热30 min,冰水中快速冷却,于4 ℃冰箱中存放待用。
按1.3.7中方法于10 mL小烧杯中加10 mL样品成胶。利用TA-XT plus质构仪对样品进行全质构分析。条件设定:探头型号为P/50,测前速度为1.00 mm/s,测定速度为1.00 mm/s,测后速度为5.00 mm/s,测定压缩比为75%,探头2次测定间隔时间为5.00 s,触发类型为自动,触发力为5.0 g,数据获取速度为200.00 pps。每个样品进行3次重复实验。
1.3.9 表面疏水性的测定
利用苯胺基-8-萘磺酸(anilino-8-naphthalenesulfonic acid,ANS)荧光探针测定蛋白的表面疏水性,方法参考TANG等[19]的研究。SPI样品用0.01 mol/L PBS(pH 7.0)配成10 mg/mL溶液后离心(10 000 r/min,15 min,4 ℃),上清液再用相同缓冲液稀释至0.01~4.0 mg/mL。取2 mL不同浓度点的稀释样品与20 μL 8 mmol/L的ANS混合。设定激发波长390 nm、发射波长470 nm,狭缝校正均为5 nm,测定荧光强度值。以荧光强度对蛋白浓度作图,曲线斜率即为蛋白的表面疏水性指数。
1.3.10 色氨酸荧光分析
根据蒋将[20]的方法,将0.08、0.10、0.12 g/mL溶液稀释,终质量浓度调整为0.2 mg/mL,采用荧光分光光度计在激发波长280 nm(狭缝宽5 nm)条件下以25 nm/s的扫描速度得到300~400 nm的发射光谱(狭缝宽5 nm),以0.2 mg/mL的未处理SPI溶液作为空白对照。
1.3.11 数据统计
本实验中样品均进行3次重复,实验数据用平均值±标准偏差的表示。实验数据使用Statistix 9.0进行显著性差异分析。
2 结果与分析
2.1 粒径结果分析
由图1可以看出,经过pH-超声后的蛋白粒径较未处理后均向大粒径方向移动,分布变宽,在高粒径处分布更多,平均粒径显著增加。原因是热超声处理对蛋白聚集程度有影响。经过热处理后,蛋白质分子热运动加剧,蛋白质的多肽链伸展,胶粒间吸引力增大,发生一定程度的聚集[21]。另一方面,经过超声处理后,可能由于超声空穴、微流束等效应打破了大豆分离蛋白间的非共价相互作用[17],使超声后粒径分布更广。同时,pH也会通过影响蛋白的聚集程度而影响粒径大小,尤其是等电点附近蛋白质的表面电荷几乎为零,蛋白质会形成较大的聚集体[22]。
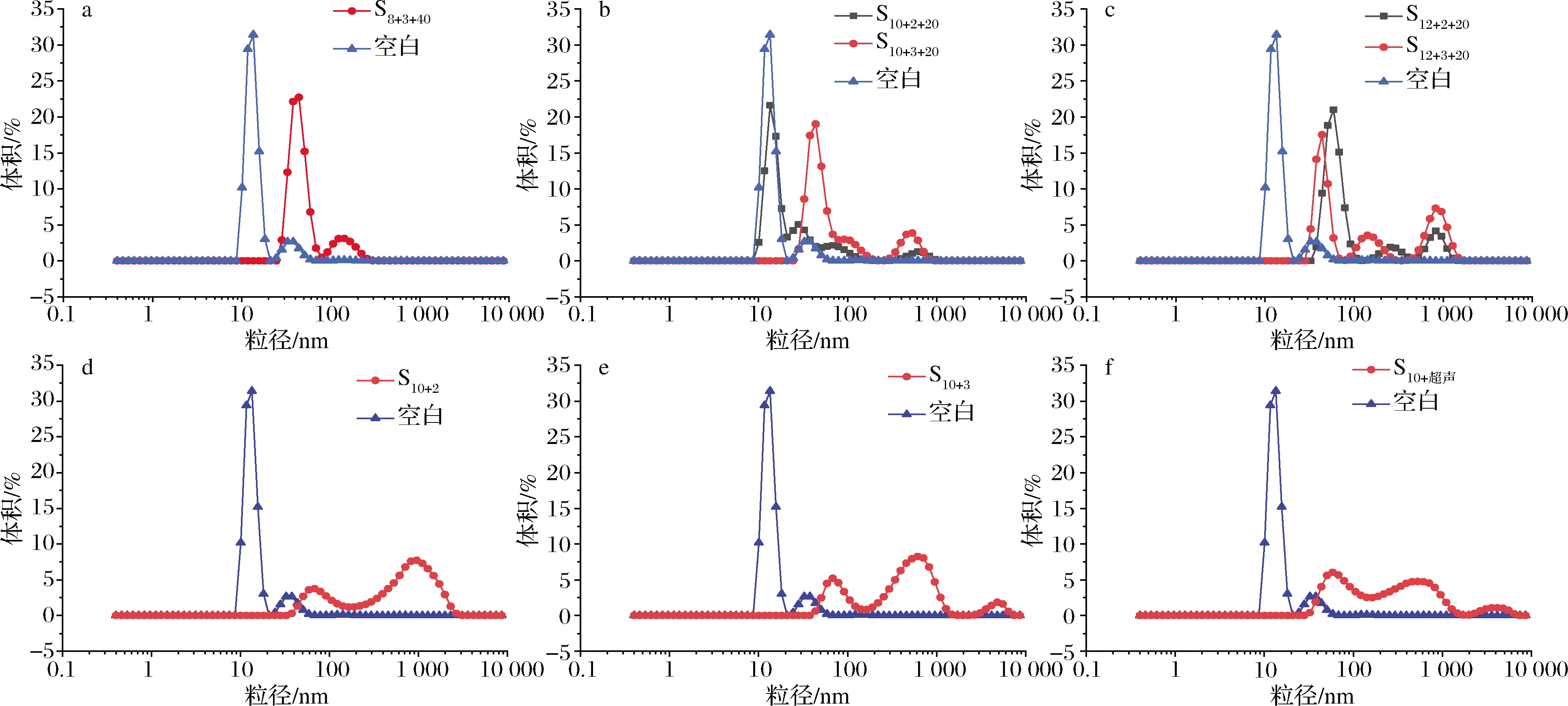
a-0.08 g/mL组别;b-0.10 g/mL组别;c-0.12 g/mL组别;d-0.10 g/mL单独pH 2处理;e-0.10 g/mL单独pH 3处理;f-0.10 g/mL单独热超声处理
图1 不同处理条件对蛋白质粒径分布的影响
Fig.1 Effects of different treatment conditions on soybean protein granulometric distribution
由表1可以看出,经过处理后的蛋白质分散指数(protein dispersibility index, PDI)值均高于空白样,佐证了样品中颗粒粒径分布范围增大。PDI值越小,分散体系中粒径分布范围越小,颗粒分散性较好[23]。在同一浓度下,pH 3.0处理下的样品分散均匀性相对高于pH 2.0处理下的样品,而此二者均比空白样小,说明超声pH复合处理致使蛋白分散体系胶体颗粒增多而分散性降低。同样,对比pH-超声复合处理和单独进行pH和热超声处理的S10+2、S10+3和S10+超声组别,可以得出,复合处理使蛋白颗粒分散均匀性明显提升,分布更加集中。相同超声-pH处理条件下,较高浓度蛋白与较低时相比,粒径分布增大,推测因为在复合处理下,蛋白浓度越高的样品分子间发生相互作用和聚集的可能性越大;相同浓度和超声处理下,pH 3.0大于pH 2.0处理下的蛋白溶液平均粒径,推测原因是pH值越接近SPI等电点,电荷的静电屏蔽作用越强,导致蛋白质分子的静电斥力减小[24],分子间的疏水作用增大,致使蛋白分子发生聚集,高晓莉等[25]的研究中也出现类似现象。
表1 不同处理条件对蛋白质分散系PDI值的影响
Table 1 Effects of different treatment conditions on PDI value of SPI dispersion
处理条件空白S8+3+40S10+2+20S10+3+20S12+2+20S12+3+20S10+2S10+3S10+超声PDI0.3330.3590.6650.6560.6180.4720.5340.4730.453
2.2 相对分子质量分布结果分析
SPI聚集体含量如图2所示,天然大豆蛋白和pH-超声复合处理大豆蛋白的分子质量分布如图3所示。天然大豆蛋白的相对分子质量分布呈现见图3-f,结合KW804蛋白柱标准曲线。天然大豆蛋白主要包括大豆β-伴球蛋白、大豆球蛋白以及15S(对应150 kDa峰),2S以及大豆β-伴球蛋白和球蛋白亚基(对应14.1 kDa峰),短肽(对应<2 kDa峰)[26]。如图3-e所示,本研究所提取大豆蛋白产生了一定程度的聚集,但相较于pH-超声复合处理后的大豆蛋白,聚集程度较小。
对照标准曲线可以得知,处理后的大豆蛋白,由于色谱柱排阻范围(≤6 600 kDa)所限[27],在保留时间5.8 min左右出现的一个峰,对应分子质量大于1 000 kDa。对比图2和图3可以得知,pH-超声复合处理使得大豆蛋白发生聚集,形成了相对分子质量大的可溶性聚集体,且各个浓度下,相较于pH 3条件,pH 2条件的解聚程度均较大,形成聚合物能力较强。
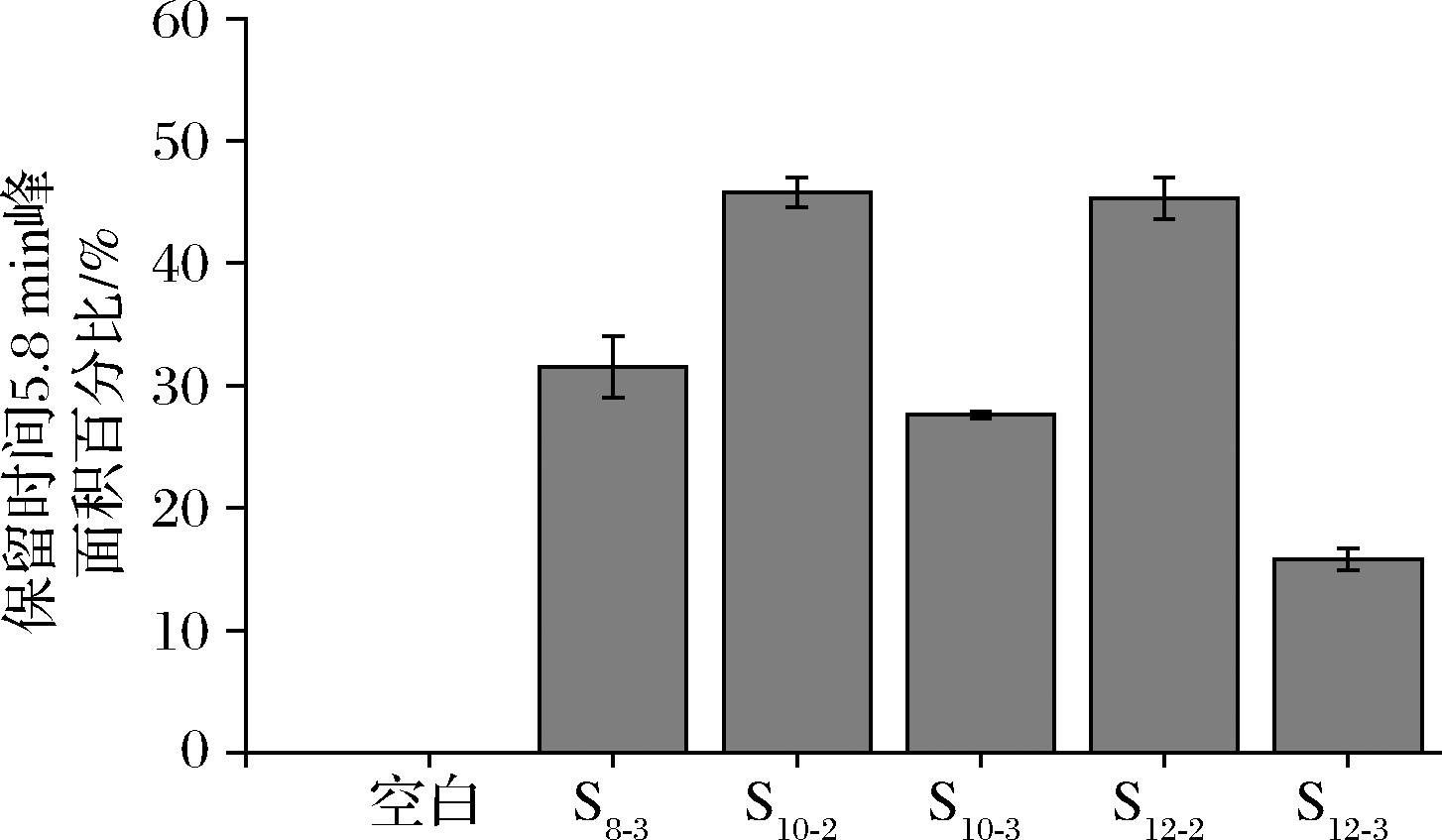
图2 不同处理条件对大豆蛋白聚集体含量的影响
Fig.2 Effects of different treatment conditions on soybean protein aggregates
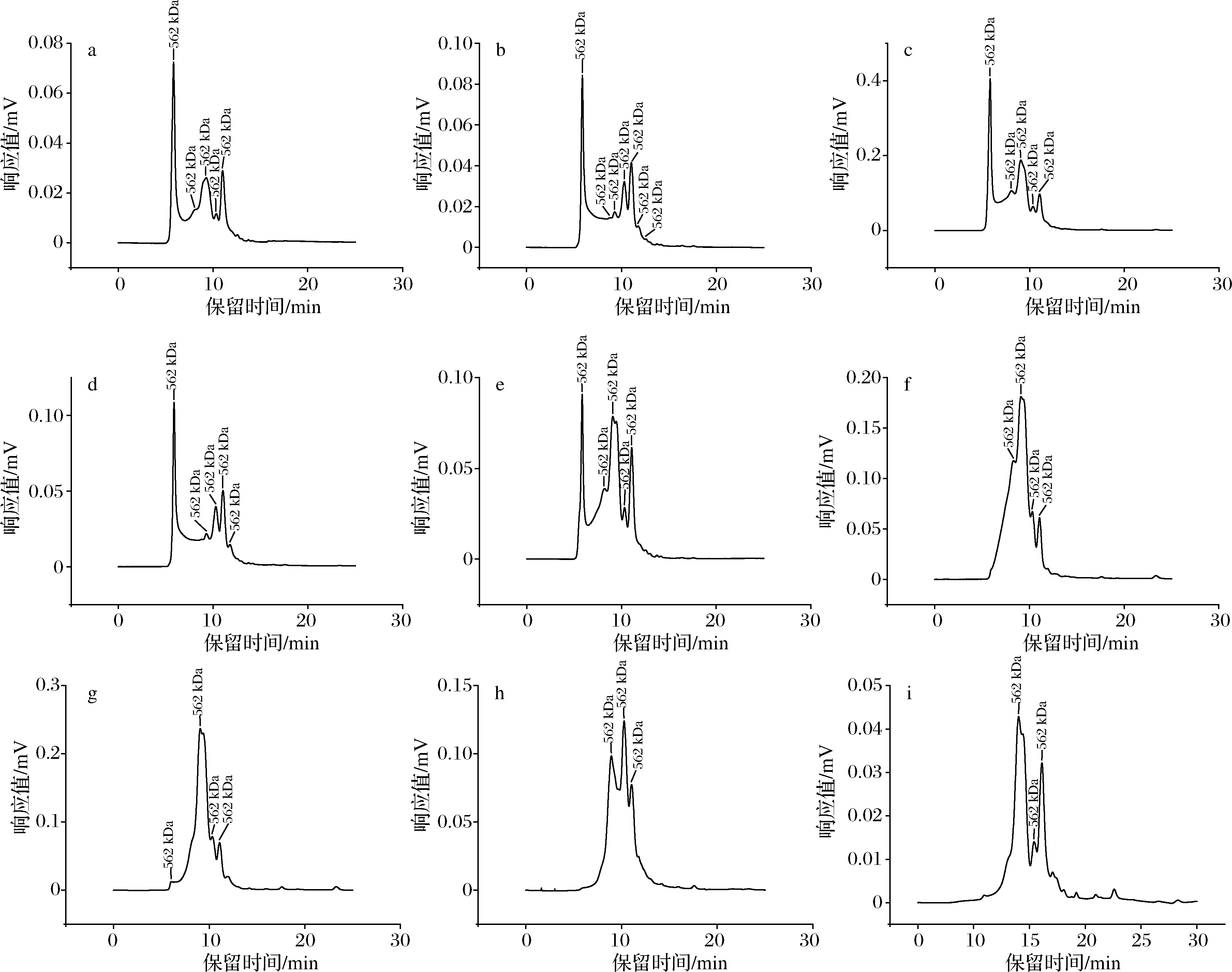
a~e-经0.08 g/mL-pH 2-40 ℃-30 min,0.10 g/mL-pH 2-20 ℃-30 min,0.10 g/mL-pH 3-20 ℃-30 min,0.12 g/mL-pH 2-20 ℃-30 min,0.12 g/mL-pH 3-20 ℃-30 min处理的SPI溶液;f-未经处理的SPI溶液,g~i-0.10 g/mL-超声,0.10 g/mL-pH 2,0.10 g/mL-pH 3
图3 天然大豆蛋白和pH-超声复合处理大豆蛋白的分子质量分布
Fig.3 Molecular weight distribution of natural soybean protein and pH-ultrasound combined treatment soybean protein
以0.10 g/mL为例,对比pH-超声复合处理,经pH 2 和pH 3单独处理的SPI均在9 min(720 kDa)左右处出峰,说明较天然SPI有所降解;经超声单独处理的样品在6 min处有一小峰,峰面积占比约为1%,说明在超声处理下,天然SPI产生一定程度的聚集,但未形成较大的蛋白聚集体,但经pH-超声复合处理下的SPI,却可聚合成大分子质量的可溶性聚集体。
推测出现该现象是由于pH处理时,在低酸性条件下蛋白质内部结构得以展开,并且不能回复,从而使内部疏水基团暴露到表面,导致蛋白质表面疏水性增强,随后在热超声处理下,由于疏水作用,蛋白质分子聚集,重新包埋疏水基团,达到疏水-亲水平衡的同时也形成了大分聚集体[28]。pH 2条件下聚合程度高于pH 3,推测原因可能是在pH 2低酸性条件下,SPI解离程度剧烈,蛋白的结构展开,可以使更多相互作用的基团暴露,在经过热超声处理后,SPI分子发生重新聚集且聚集程度普遍大于pH 3处理条件[29]。
2.3 SDS-PAGE结果分析
大豆蛋白的主要组分为7S球蛋白和11S球蛋白。7S球蛋白是由α、α′和β亚基构成,11S球蛋白是由酸性亚基和碱性亚基通过二硫键组成的六聚体[30]。如图4所示,与未处理样品的SDS-PAGE图谱相比,经pH-超声复合处理的SPI溶液的SDS-PAGE图谱未产生明显变化,说明大豆蛋白未发生热变性,蛋白质分子中不耐热化学键未断裂,溶液化学组成变化小,在含有的化学物质和化学键上相差极小。经pH或超声单独处理的SPI溶液的SDS-PAGE图谱与上述结果一致,未发生明显变化。

图4 SDS-PAGE图谱
Fig.4 SDS-PAGE analysis
注:图a、图c为还原性(加β-巯基乙醇)SDS-PAGE图,图b、图d为非还原性SDS-PAGE图;泳道1:标准分子质量蛋白;图a~b泳道3~7:分别为S8+3+40、S10+2+20、S10+3+20、S12+2+20和S12+3+20;泳道8:未经任何处理的SPI溶液(空白组);图c~d泳道2~4:分别为S10+超声、S10+2和S10+3
2.4 流变性质结果分析
2.4.1 频率扫描结果
频率扫描结果取0.1~2.1 Hz,作G′随频率变化曲线,如图5所示。SPI的G′按以下顺序排列[31]:S10+2>S12+2+20≥S10+2+20>S10+3+20>S8+3+40>S12+3+20>S10+3>S8>S10>S12>S10+超声。G′反映了SPI凝胶体系的黏弹性特性(图5),并与凝胶强度呈正相关[32]。故G′的排序亦可为凝胶强度的排序。凝胶强度排序结果显示pH 2>pH 3>空白,相对于空白样品,低酸性条件更有利于凝胶强度的提高,这与JACOBA[33]的结论一致,即将G′作为测量凝胶强度的标准时,G′随pH的减少而逐渐增加,故SPI于低pH下处理比高pH更硬。曾琪等[16]对比未处理过的样品,发现pH 2和pH 3处理可以改善G′和G″,且pH 3处理的G′高于pH 2。如图5所示,G′对扫描频率还具有一定的依赖性,pH处理后的样品G′值高于未经pH处理组,说明pH处理SPI可以在一定程度上促进形成均一、致密、高强度的蛋白质凝胶状网络结构。
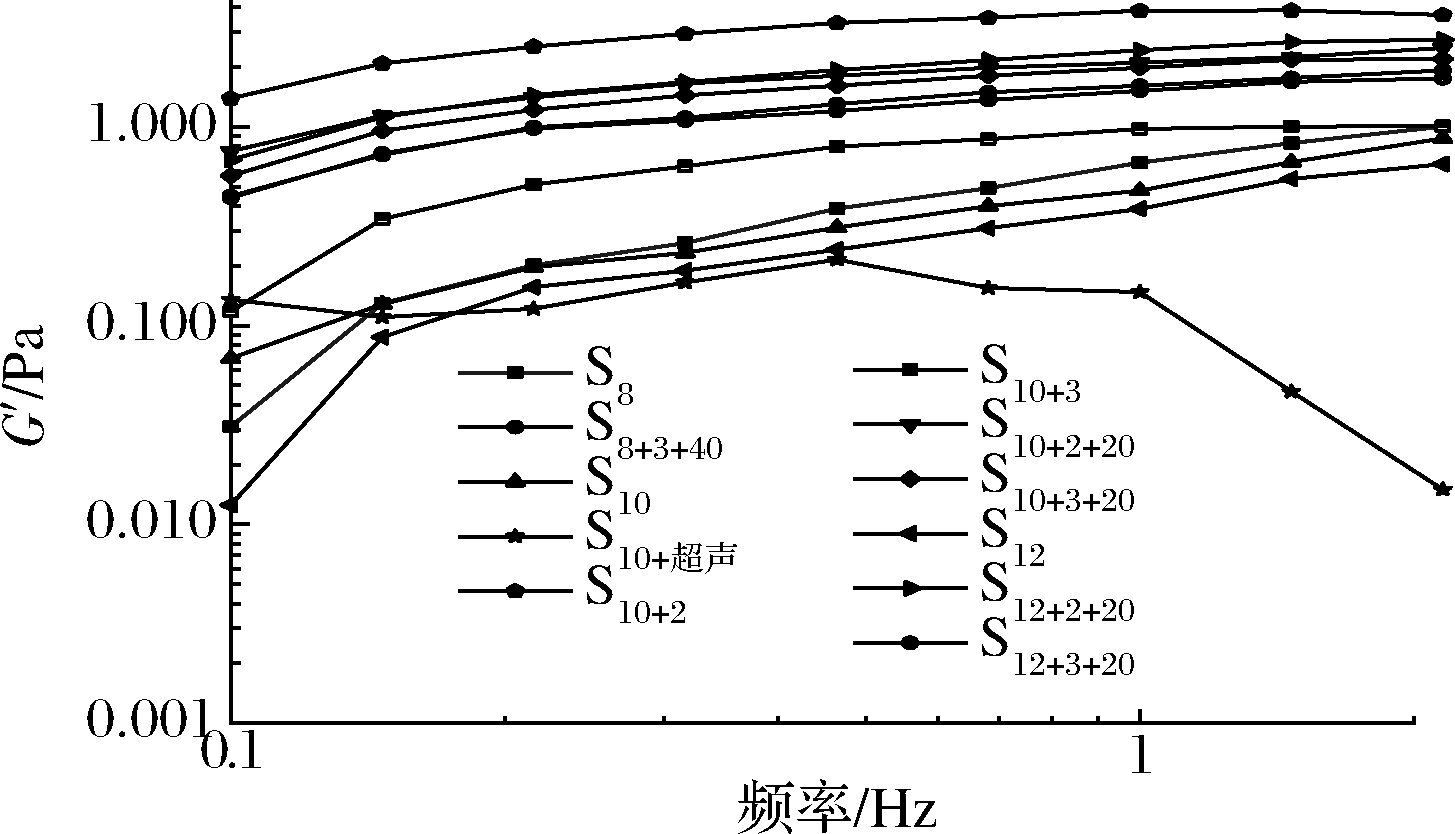
图5 G′随频率的变化情况
Fig.5 Variation of elastic modulus G′ with frequency
质量浓度为0.10 g/mL的排序结果显示:S10+2>S10+2+20>S10+3+20>S10+3>S10>S10+超声,对比S10,低酸性(S10+2和S10+3)可以显著提高凝胶强度;超声处理则可能会降低凝胶强度。同样的情况也出现在S10+2与S10+2+20这一组的对比上,相反超声可以明显提高pH 3条件下的凝胶强度:S10+3+20>S10+3。
2.4.2 温度扫描结果
图6显示,未复合处理过的空白对照样品G′随温度多变,变化规律不明显,而经过复合处理后趋势变化明显,图7中,将S10+2的凝胶点定为G′和G″交叉点[32],其他条件在整个升温阶段存在明显的G′突然增加的点,将凝胶点(凝胶开始的温度)定为G′突然增加[34](增长速率大于0.5 Pa/℃)时的温度值。如图8所示,对比每个浓度的空白样品,pH和热超声的复合处理使得凝胶点显著降低:S8+3+40可以降低20%,至75.91 ℃;S10+2+20可以降低28%,至68.34 ℃;S10+3+20可以降低24%,至72.20 ℃;S12+2+20可以降低33%,至60.96 ℃;S12+3+20可以降低21%,至72.23 ℃。而且复合处理条件比单独处理降低凝胶温度的幅度大。这可能是由于空化导致分子快速运动,超声空化产生的剪切力足以破坏弱的蛋白质结合从而断裂蛋白质链[11],导致SPI离解和部分展开,使疏水基团及二硫键等暴露,在不断升高的温度作用下,这些展开的蛋白质再次聚集成为新的蛋白质网络。另一方面,极端pH处理导致SPI中的亚基发生变性,巯基氧化形成二硫键,新的二硫键进一步加强了蛋白质分子间的共价作用,加固了蛋白的凝胶网络结构[31]。在温度、pH、超声三重影响下,就出现了升温过程中G′不断增强的现象。
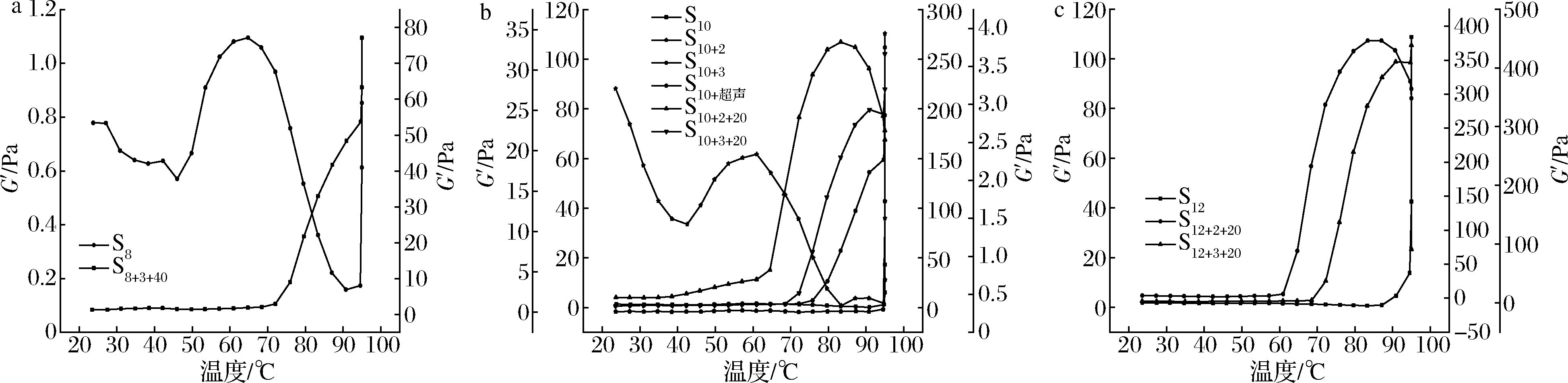
a-0.0 g/mL的SPI溶液;b-0.10 g/mL的SPI溶液;c-0.12 g/mL的SPI溶液
图6 温度扫描后G′随温度变化图
Fig.6 Change of storage modulus G′ with temperature after temperature scanning

图7 温度扫描后G′和G″随温度变化图(S10+2)
Fig.7 Change of storage modulus G′ and loss modulus G″ with temperature after temperature scanning(S10+2)
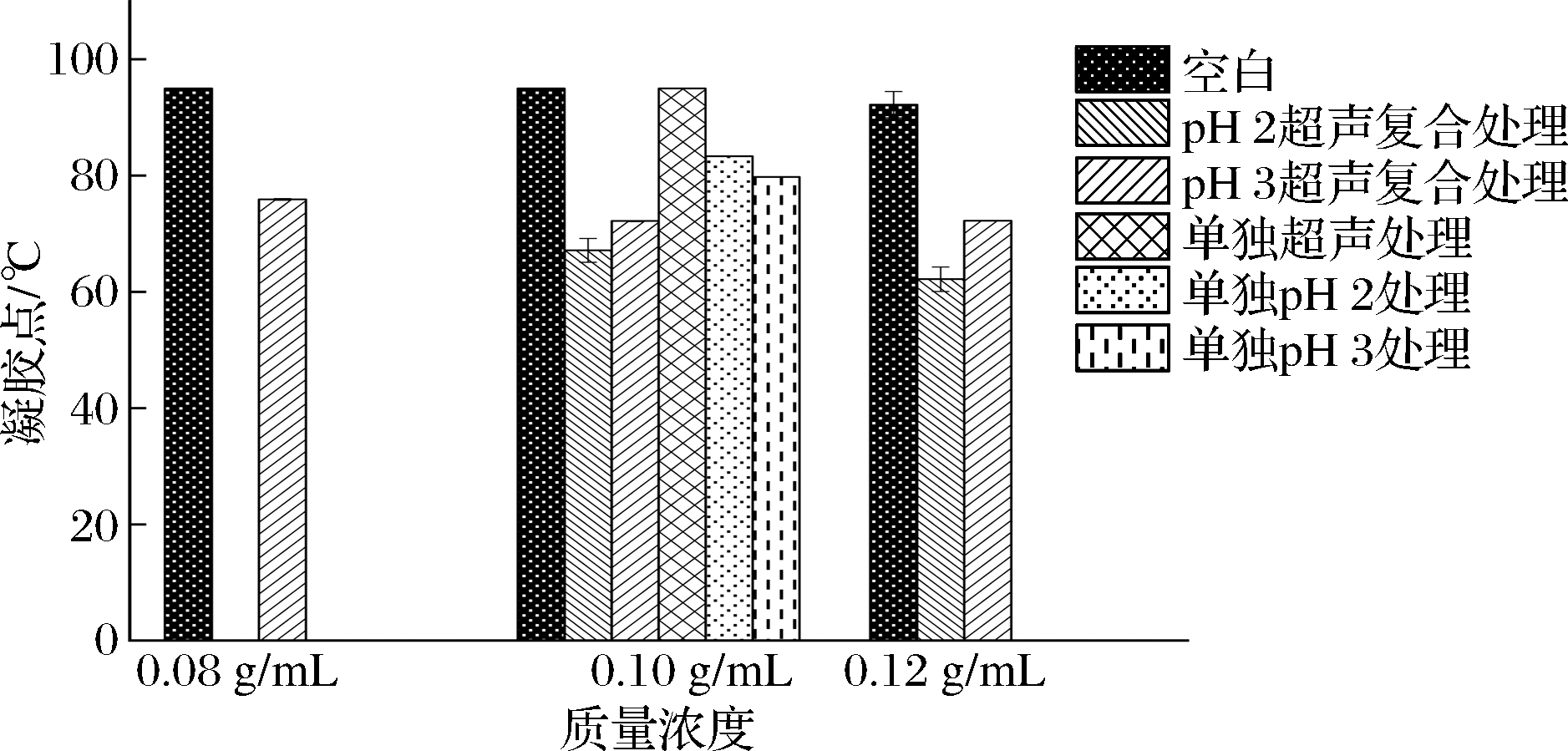
图8 各个组合的凝胶温度
Fig.8 Gel temperature of each combination
文献表明,如果G′≥10 Pa,则可以假设具有一定的凝胶稳定性[35]。在目前的研究中5种复合处理:S8+3+40,S10+2+20,S10+3+20,S12+2+20,S12+3+20的改性效果都比较显著,经过凝胶点之后的G′都大于10 Pa,证明凝胶具有一定的稳定性。其中S10+2+20的综合效果最优,S10+2+20的黏弹性最高,且在温度扫描过程中其G′和G″提升都比较高,凝胶点降低程度也较大。从整个过程来看,G′和G″随时间和温度的变化是不可逆的,即降温阶段并不会恢复原有状态,这个结论是可以预期的。
2.5 凝胶质构结果分析
图9为不同处理条件对SPI凝胶体硬度、强度、弹性和内聚性的影响。对于0.08 g/mL的样品,样品S8+3+40制得的大豆蛋白凝胶的弹性和内聚性均有增强,与对照组S8相比分别增强了36.8%和62.2%,而硬度和强度有所减弱,与S8+超声和S8+3相比则增强。对于0.10 g/mL的样品,样品S10+2+20制得的大豆蛋白凝胶,内聚性均有所增强,与对照组S10相比增强了4.4%,弹性相差较小,而硬度和强度均有减弱;样品S10+3+20制得的大豆蛋白凝胶的硬度、强度、弹性和内聚性均有增强,与对照组S10相比分别增强了16.0%、16.0%、28.4%和10.0%,强度增强至4.00×103 Pa,与对照组S10+超声相比硬度、强度、弹性和内聚性分别增强了52%、52%、41%和52%,与对照组S10+3相比硬度、强度、弹性和内聚性分别增强了89%、89%、182%和48%。对于0.12 g/mL的样品,样品S12+2+20的大豆蛋白凝胶的硬度、强度、弹性和内聚性,与对照组S12和S12+超声相比均有所减弱,但其弹性和内聚性较对照组S12+2高;样品S12+3+20大豆蛋白凝胶的硬度较对照组S12增强了32.2%,强度增强了32.2%,至4.86×103 Pa,而弹性和内聚性与对照组S12和S12+超声相比均有所减弱,而较对照组S12+3弹性则增强,内聚性减弱。
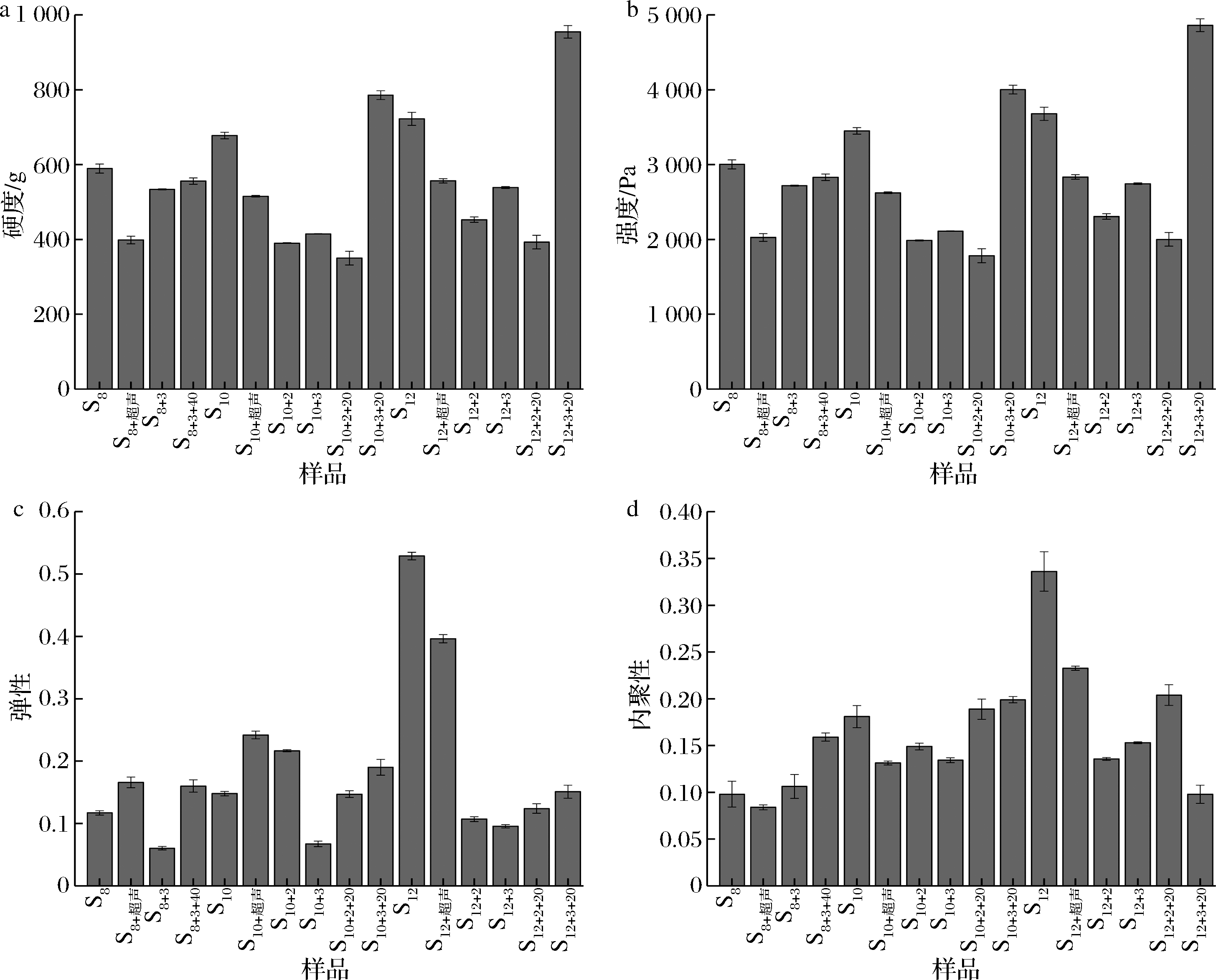
a-硬度;b-强度;c-弹性;d-内聚性
图9 不同处理条件下SPI凝胶体的全质构特性
Fig.9 Total texture properties of SPI gels under different treatment conditions
单独条件对照组相比空白对照组的硬度和强度均有减弱,结合相对分子质量分布结果推测,可能是因为经过较长时间的超声处理后,蛋白质的肽链发生解离,蛋白质逐渐展开,其分子间不容易发生交联,因此凝胶硬度和强度减弱[36];而在偏极端pH值下,内部结构展开,不能回复,使更多疏水基团暴露出来,改变了蛋白质紧密的三维结构,导致凝胶硬度和强度减弱[9]。但在pH-超声复合处理下,蛋白凝胶质构各方面性能均显著增强,可能是超声通过空泡内爆、微射流和微湍流的形成、高速粒子间碰撞和微孔粒子的微扰,加强了pH对巯基的氧化作用[36],使得二硫键显著增多,从而加强了蛋白质三维结构。
综上,样品S10+3+20在浓度0.10 g/mL、pH为3、处理温度为20 ℃及处理时间为30 min的条件下,与单独条件对照组相比,其大豆蛋白凝胶的硬度、强度、弹性和内聚性均有显著提升,且硬度、强度、弹性和内聚性较空白对照组S10分别提升了16.0%、16.0%、28.4%和10.0%,强度提升至4.0×103 Pa,该条件形成了良好的协同增效效果,实现了对于上述质构性能的提升。
2.6 复合处理对SPI结构的影响
2.6.1 表面疏水性分析
如图10所示,SPI经单一或复合处理后,其表面疏水性在pH 2条件下升高,说明该情况下SPI部分展开,疏水基团暴露,改变了蛋白质紧密的三维结构。而经pH 3处理的SPI疏水性远小于经pH 2处理后的SPI疏水性,可能是由于在低酸性条件下,蛋白质结构展开,其内部疏水基团暴露,导致表面疏水性增强,但当达到pH 3条件后,蛋白质的亚基聚集形成共价键及氢键等结构,重新包埋疏水基团,导致蛋白质疏水相互作用降低[28],进而使蛋白凝胶强度得到增强。
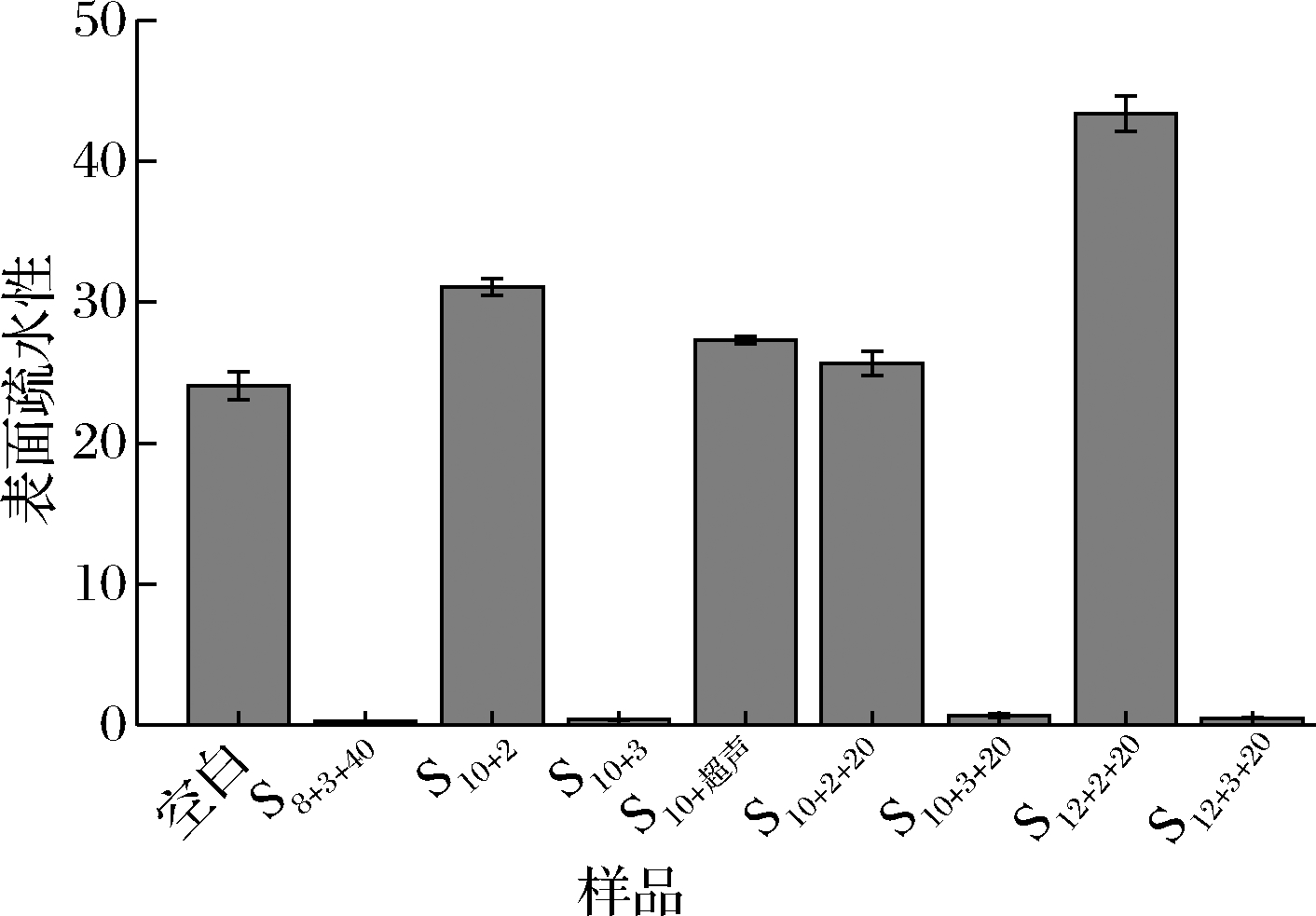
图10 不同条件处理下SPI的表面疏水性
Fig.10 Surface hydrophobicity of SPI under different treatment conditions
2.6.2 色氨酸荧光分析
侧链的变化可以反映大豆蛋白三级结构的变化[37]。经过pH-超声复合处理后,原先包裹在SPI内部的疏水侧链会暴露在分子表面的极性环境中,这种微环境的改变将导致色氨酸内源荧光光谱的改变。图11为经过pH-复合处理以及单变量处理后SPI的内源荧光光谱图。采用280 nm波长激发光针对激发色氨酸残基[38],可以发现处理前SPI的内源荧光最大吸收波长为331.5 nm,经处理后,最大吸收波长发生了一定的红移(从331.5 nm移至335.5 nm);荧光强度除S12+2+2组其余较未处理组均有较大提升(从682.6增至796.2)。同时,对比pH-超声复合处理组别和单变量组别,复合处理组的荧光强度增值和吸收波长偏移值均较大;单变量处理组的S10+超声组的荧光强度增值幅度较大,体现在内源荧光结构分析中,超声改性效果优于pH改性,复合处理整体优于单变量处理改性。这表明pH-超声复合处理增大了色氨酸暴露的程度,并且使蛋白质分子的三级结构变得更加疏散。
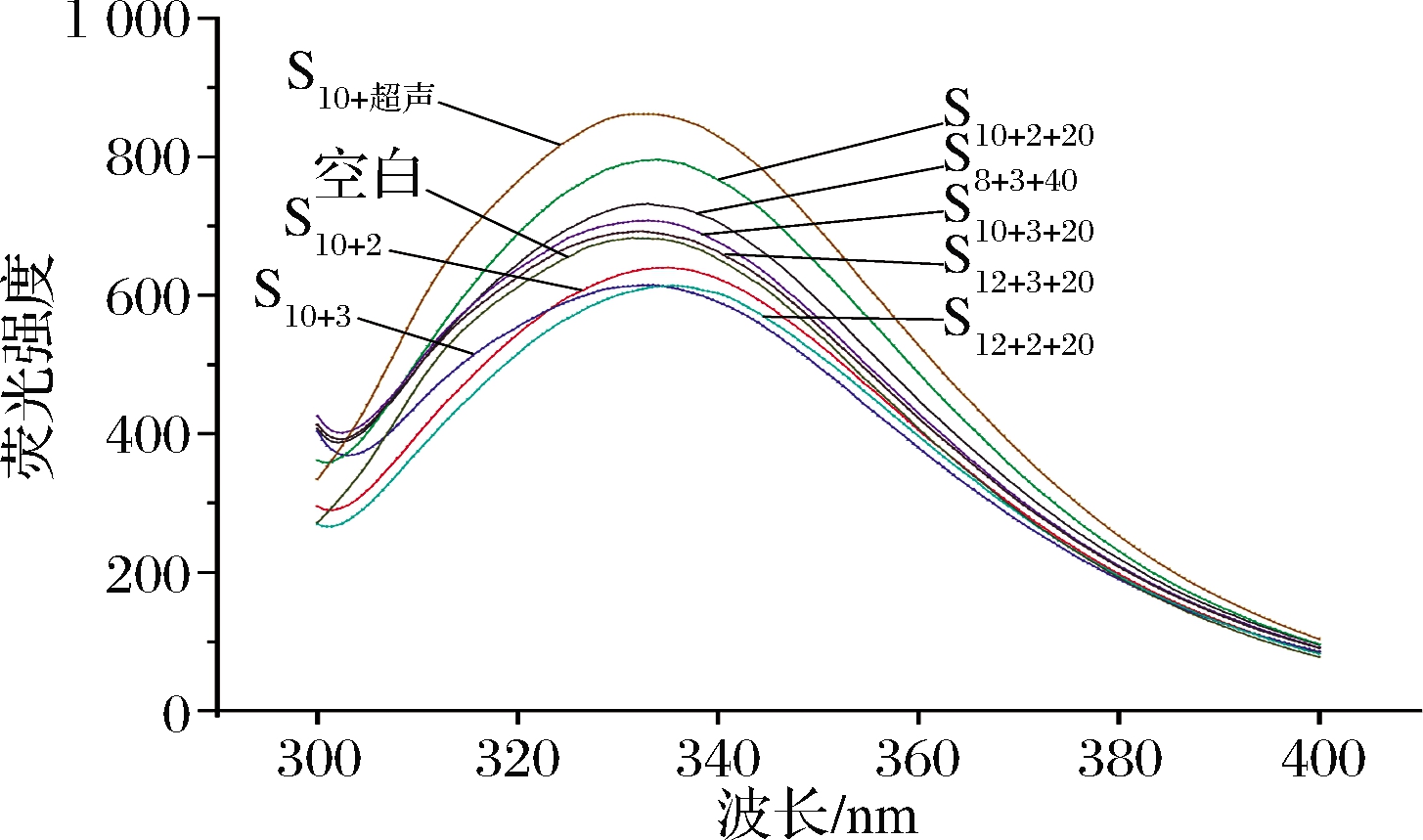
图11 不同处理条件下SPI的内源荧光光谱和最大吸收波长
Fig.11 Intrinsic fluorescence spectra and maximum absorption wavelength of SPI under different treatment conditions
3 结论
pH-超声复合处理可以有效改变SPI的凝胶性。粒径和相对分子质量测定结果表明,该方法在一定程度上可以促进SPI形成大分子聚集体,进而有利于形成凝胶。不同浓度、pH、温度和超声条件的复合处理具有不同的改性情况,且复合处理样品的凝胶性提升效果比单独pH或单独超声处理的效果显著。质构和流变性质分析证明,质量浓度为0.10 g/mL和 0.12 g/mL的SPI在pH 2和pH 3条件下,经过pH-超声复合处理后,相比于质量浓度为0.08 g/mL的SPI,具有更显著的变性效果,在凝胶温度、凝胶强度和凝胶性方面均有所改善。其中,质量浓度为0.10 g/mL的SPI溶液,在pH为3、处理温度20 ℃的条件下,经功率为240 W、频率为40 kHz的超声处理,相比空白样品,其凝胶温度可降低24%,同时可实现对于SPI凝胶硬度、强度、弹性和内聚性质构性能数据的提升,即凝胶硬度可提高16%,弹性可提高28.4%,凝胶强度可提高16%,具有协同增强效果。综上分析推测,该复合处理方法有利于使SPI具有较低的凝胶化温度及较高的凝胶强度,以及具有形成均匀致密凝胶网络的能力。本研究的pH-超声复合法可应用于提升SPI凝胶性,进而有利于改善SPI在植物肉领域的应用情况,为植物肉加工和食用方面提供探究思路。
[1] 丁玲, 张丽芬, 赖少娟, 等.植物蛋白在肉制品中的应用研究[J].食品研究与开发, 2021, 42(4):193-197.
DING L, ZHANG L F, LAI S J, et al.Application of plant protein in meat products[J].Food Research and Development, 2021,42(4):193-197.
[2] 徐莉莉, 姚静.大豆分离蛋白在加工肉制品中的综合应用[J].当代畜禽养殖业, 2016(8):3-4.
XU L L, YAO J.Comprehensive application of soybean protein isolate in processed meat products [J].Contemporary Livestock and Poultry Breeding industry, 2016(8):3-4.
[3] BANERJEE S, BHATTACHARYA S.Food gels:Gelling process and new applications[J] Critical Reviews in Food Science and Nutrition, 2012, 52(4/6):334-346.
[4] 杨娟, 罗玮倩, 何曼源.大豆蛋白/蛋清蛋白复合凝胶特性的研究[J].食品与发酵工业, 2021, 47(6):134-138.
YANG J, LUO W Q, HE M Y.Study on properties of soybean protein/egg white protein composite gel [J].Food and Fermentation Industries, 2021, 47(6):134-138.
[5] 张建友, 牛记者, 郐鹏,等.复合亲水胶体对带鱼鱼糜制品凝胶特性的影响[J].食品工业科技, 2012, 33(17):54-57.
ZHANG J Y, NIU J Z, KUAI P, et al.Effect of hydrophilic colloid on gel properties of surimi of hair [J].Science and Technology of Food Industry, 2012, 33(17):54-57.
[6] KANZAWA Y, HARADA T, KOREEDA A, et al.Curdlan gel formed by neutralizing its alkaline solution[J].Agricultural and Biological Chemistry, 1987, 51(7):1 839-1 843.
[7] ZHOU Y, JIANG R S, PERKINS W S, et al.Morphology evolution and gelation mechanism of alkali induced konjac glucomannan hydrogel[J].Food Chemistry, 2018, 269:80-88.
[8] 蔡燕萍, 游寅寅, 刘建华,等.大豆蛋白凝胶性及其改良方法的研究进展[J].食品与发酵工业, 2021, 47(15):298-306.
CAI Y P, YOU Y Y, LIU J H, et al.The research progress of soybean protein gel and its improved method[J].Food and Fermentation Industry, 2021, 47(15):298-306.
[9] LI X F, CHEN L Y, HUA Y F, et al.Effect of preheating-induced denaturation during protein production on the structure and gelling properties of soybean proteins[J].Food Hydrocolloids, 2020, 105:105846.
[10] ZHENG T, LI X H, TAHA A, et al.Effect of high intensity ultrasound on the structure and pH physicochemical properties of soy protein isolates produced by different denaturation methods[J].Food Hydrocolloids, 2019, 97:105216.
[11] 杨昱, 雷泽夏, 白靖文, 等.极端pH处理对大豆分离蛋白、β-伴大豆球蛋白、大豆球蛋白结构和功能特性的影响[J].中国食品学报, 2018, 18(7):306-313.
YANG Y, LEI Z X, BAI J W, et al.Effect of extreme pH treatment on the structure and functional properties of soybean protein, β-conglycinin and glycinin and glycinin[J].Journal of Chinese Institute of Food Science and Technology 2018, 18(7):306-313.
[12] WANG W J, SHEN M Y, JIANG L, et al.Influence of Mesona blumes polysaccharide on the gel properties and microstructure of acid-induced soy protein isolate gels[J].Food Chemistry, 2020, 313:126125.
[13] XIAO Y Q, LI J M, LIU Y N, et al.Gel properties and formation mechanism of soy protein isolate gels improved by wheat bran cellulose[J].Food Chemistry, 2020, 324:126876.
[14] LUO K Y, LIU S T, MIAO S, et al.Effects of transglutaminase pre-crosslinking on salt-induced gelation of soy protein isolate emulsion[J].Journal of Food Engineering, 2019, 263:280-287.
[15] 中华人民共和国农业部. GB 5009.5—2016 食品安全国家标准 食品中蛋白质的测定[S].北京: 中国标准出版社, 2017.
Ministry of Agriculture of the People′s Republic of China.GB 5009.5—2016 National Food Safety Standard Determination of protein in foods[S].Beijing: Standards Press of China, 2017.
[16] 曾琪, 胡淼, 王欢, 等.pH处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J].食品科学, 2020, 41(22):15-21.
ZENG Q, HU M, WANG H, et al.Effect of pH treatment on structure, rheological properties and emulsifying properties of black bean protein isolate[J].Food Science, 2020, 41(22):15-21.
[17] 胡昊. 利用高场强超声波增强大豆蛋白凝胶性及凝胶缓释效果[D].武汉:华中农业大学, 2014.
HU H.Using high intensity ultrasound to improve the gelation property of soy protein and the drug control release of soy protein hydrogel[D].Wuhan:Huazhong Agricultural University, 2014.
[18] 吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D].无锡:江南大学, 2010.
WU W.Effects of protein oxidation on structure and gel properties of soy protein[D].Wuxi:Jiangnan University, 2010.
[19] TANG C H, MA C Y.Effect of high pressure treatment on aggregation and structural properties of soy protein isolate[J].LWT-Food Science and Technology, 2009, 42(2):606-611.
[20] 蒋将. pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D].无锡:江南大学, 2011.
JIANG J.structural changes and functional properties improvement of molten ball soybean protein induced by pH migration treatment[D].Wuxi:Jiangnan University, 2011.
[21] 李云. 大豆蛋白聚集及共混凝胶性质研究[D].无锡:江南大学, 2007.
LI Y.The study on properties of aggregated soybean protein and mixed gelation with native soybean protein[D].Wuxi:Jiangnan University, 2007.
[22] TEO A, GOH K, WEN J, et al.Physicochemical properties of whey protein, lactoferrin and Tween20 stabilised nanoemulsions:Effect of temperature, pH and salt[J].Food Chemistry, 2016, 197:297-306.
[23] SARKAR A, KAMARUDDIN H, BENTLEY A, et al.Emulsion stabilization by tomato seed protein isolate:Influence of pH, ionic strength and thermal treatment[J].Food Hydrocolloids, 2016, 57:160-168.
[24] GULSEREN I, GUZEY D, BRUCE B D, et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry, 2007, 14(2):173-183.
[25] 高晓莉, 王丽丽, 刘丽娅, 等.pH值和温度对燕麦蛋白溶解与聚集特性的影响[J].核农学报, 2020, 34(11):2 492-2 498.
GAO X L, WANG L L, LIU L Y, et al.Effects of pH and temperature on the solubility and aggregation of oat protein[J].Journal of Nuclear Agricultural Science, 2020, 34(11):2 492-2 498.
[26] WOLF W J, NELSEN T C.Partial purification and characterization of the 15S globulin of soybeans, a dimer of glycinin[J].Journal of Agricultural and Food Chemistry, 1996, 44(3):785-791.
[27] 安然. 大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学, 2019.
AN R.Study on soluble thermal aggregates of soybean protein isolate and its ultrasonic regulation[D].Harbin:Northeast Agricultural University, 2019.
[28] 王中江, 江连洲, 魏冬旭, 等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品科学, 2012, 33(11):47-51.
WANG Z J, JIANG L Z, WEI D X, et al.Effect of pH on conformation and surface hydrophobicity of soybean protein isolate[J].Food Science, 2012, 33(11):47-51.
[29] 源博恩. 亚基解离与重聚集对大豆蛋白结构和功能特性的影响[D].广州:华南理工大学, 2012.
YUAN B E.Effect of subunits dissociation and aggregation on structure and functional properties of soy protein[D].Guangzhou:South China University of Technology, 2012.
[30] 于国萍, 岳崇慧, 陈媛, 等.转谷氨酰胺酶对大豆分离蛋白乳状液冻融稳定性的影响[J].食品科学, 2019, 40(6):22-27.
YU G P, YUE C H, CHEN Y, et al.Effect of transglutaminase on freeze-thaw stability of soybean protein isolate emulsion[J].Food Science, 2019, 40(6):22-27.
[31] LIN D Q, ZHANG L T, LI R J, et al.Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J].Food Hydrocolloids, 2019, 96:537-545.
[32] ZHOU Y Z, CHEN C G, CHEN X, et al.Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J].Journal of Agricultural and Food Chemistry, 2014, 62(12):2 655-2 662.
[33] JACOBA M S R, HARRY G, TON V V.Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J].Journal of agricultural and food chemistry, 2002, 50(21):6 064-6 071.
[34] ALAVI F, EMAM-DJOMEH Z, CHEN L Y.Acid-induced gelation of thermal co-aggregates from egg white and hempseed protein:Impact of microbial transglutaminase on mechanical and microstructural properties of gels[J].Food Hydrocolloids, 2020, 107:105960.
[35] JOEL M A, ADINARAYANA A, LIM D J, et al.Modulating the gelation properties of self-assembling peptide amphiphiles[J].ACS nano, 2009, 3(11):3 447-3 454.
[36] 赵飞. 物理预处理对大豆分离蛋白结构和理化性质的影响机制[D].泰安:山东农业大学, 2019.
ZHAO F.Mechanism of influence of physical pretreatment on structure and physicochemical properties of soybean protein isolate [D].Tai′an:Shandong Agricultural University, 2019.
[37] NATARAJAN S, XU C, BAE H, et al.Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J].Plant Physiology Biochemistry, 2007, 45 (6-7):436-444.
[38] VISEU M I, CARVALHO T I, COSTA S M B.Conformational transitions in β-lactoglobulin induced by cationic amphiphiles:equilibrium studies[J].Biophysical Journal, 2004, 86(4):2 392-2 402.