肠衣作为香肠产品的重要包材,其性能直接影响香肠的产品品质。肠衣分为由猪、牛、羊的大肠制成的天然肠衣和以胶原蛋白、纤维素等为原料制成的人造肠衣[1]。天然肠衣已无法满足人们的需求,可批量生产的人造肠衣逐渐成为市场主流。目前香肠肠衣每年的市场份额超过42亿,截至2018年,肠衣的年消费量高达600亿m[2]。随着香肠市场需求量的增加以及生产水平的提高,人造肠衣的市场份额还将持续增长。其中胶原肠衣具有和天然肠衣类似的性质,是较为常见的一种可食性肠衣。但胶原肠衣也具有生产工艺繁琐、价格较高、蒸煮后易破裂等缺陷,并且其存在致敏可能性,在清真食品的应用方面有所限制。成本的不断上升、消费者安全意识的提高以及对清真食品需求的增加等因素驱使着肠衣制造商开始寻找胶原蛋白肠衣的最佳替代品——植物肠衣。国内外已有研究尝试采用乳清蛋白、壳聚糖、果胶/明胶/海藻酸钠等原料制备新型肠衣[3-5],但这些肠衣采用的原辅料并不是严格意义上的来源于植物,仍然具有潜在的致敏性。目前国外已有研究进行海藻酸钠肠衣的研制,但在国内却鲜有报道[6]。
海藻酸钠是从天然褐藻中提取的一种无毒无害、价格低廉的阴离子多糖,其分子结构是由β-D-甘露醛酸(M)和α-L-古罗糖醛酸(G)通过1-4糖苷键连接而成的无支链线性二元共聚物,能与Ca2+离子发生交联反应形成不溶于水的海藻酸钙,其具有成膜性好、相容性好等优点,因此作为可食性膜材料日益成为研究热点[7]。此外,2019年全球素食香肠肠衣市场规模达到了7.9亿元,预计2026年将达到12亿元,因此海藻酸钠肠衣的研制,对可食性植物肠衣的发展具有重要意义。然而,海藻酸钠独立成膜,质脆且韧性差,使其应用受到限制,本文复配瓜尔胶将显著改善这一缺陷。瓜尔胶是一种天然的半乳甘露多聚糖,具有良好的生物相容性、成膜性且安全无毒、价格低廉,被用作稳定剂、增稠剂、黏结剂等广泛应用于食品加工、精细化工、化妆品等领域[8]。本研究拟采用流延法制备海藻酸钠/瓜尔胶肠衣膜,并用氯化钙溶液进行交联,以抗拉强度、断裂拉伸率、水蒸气透过系数等指标探讨不同因素对肠衣性能的影响,以期获得一种综合性能良好的可食性植物肠衣。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
海藻酸钠(食品级),青岛明月海藻有限公司;瓜尔胶(食品级),万利达生物科技有限公司;甘油(食品级),阳江市阳东食品香料公司;CaCl2(食品级),河南万邦实业有限公司;胶原肠衣,梧州神冠蛋白肠衣有限公司。
1.1.2 仪器与设备
C-MAG HS7型加热磁力搅拌器,德国IKA公司;TA.XT2i型物性分析仪,英国SMS公司;T25DS25型高速均质机,德国IKA公司;DZF-6210型真空干燥箱,上海一恒科学仪器有限公司;SU8100型冷场发射扫描电子显微镜,日本日立。
1.2 方法
1.2.1 制膜工艺流程
(1)原料溶解:15 g/L海藻酸钠恒温50 ℃溶解、15 g/L 瓜尔胶常温溶解;(2)均质:用均质机10 000 r/min分散10 min;(3)脱气:将膜液置于真空干燥箱中,常温、真空度0.08 MPa条件下抽真空2 h;(4)成膜:量取25 mL膜液倾倒于10 cm×10 cm的聚四氟乙烯板;(5)干燥:在鼓风干燥箱中50 ℃烘干4 h;(6)氯化钙交联:将干燥成型的肠衣膜浸泡在CaCl2溶液中,取出用清水洗净;(7)平衡:将自然干燥的肠衣膜放入恒温恒湿箱(25 ℃,50% 相对湿度)中平衡48 h待测。
1.2.2 单因素实验
(1)复配比对肠衣膜性能的影响:改变海藻酸钠/瓜尔胶的复配比例(质量比)为10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6,研究海藻酸钠/瓜尔胶复配比例对肠衣膜性能的影响。其他条件为:甘油添加量20%(占成膜基质的质量分数)、CaCl2质量浓度150 g/L、交联20 min;(2)甘油添加量对肠衣膜性能的影响:改变甘油添加量为0%、10%、20%、30%、40%、50%、60%、80%、100%,研究甘油添加量对肠衣膜性能的影响。其他条件为:海藻酸钠/瓜尔胶复配比为7∶3、CaCl2质量浓度150 g/L、交联20 min;(3)CaCl2质量浓度对肠衣膜性能的影响:改变CaCl2质量浓度为0、20、50、100、150、200、250、300 g/L,研究CaCl2质量浓度对肠衣膜性能的影响。其他条件为:海藻酸钠/瓜尔胶复配比为7∶3、甘油添加量20%、交联20 min;(4)交联时间对肠衣膜性能的影响:改变交联时间为0、0.5、2、5、10、20、30、40、50、60 min,研究交联时间对肠衣膜性能的影响。其他条件为:海藻酸钠/瓜尔胶复配比为7∶3、甘油添加量20%、CaCl2质量浓度为100 g/L。
1.2.3 正交试验
本试验需综合考虑多个指标来对肠衣膜的性能进行评价,故利用主成分分析和隶属度函数综合评价方法[9],优化出最佳工艺指标。其中,主成分分析用于各指标权重的确定,隶属度则根据公式(1)、公式(2)计算[10]:
![]() 正效应
正效应
(1)
![]() 负效应
负效应
(2)
式中:X(u),隶属度;Xi,指标值;Xmax,指标所在列的最大值;Xmin,指标所在列的最小值。
肠衣膜的综合得分按公式(3)计算
S=0.068X1+0.221X2+0.005X3+0.236X4+0.132X5+0.161X6+0.177X7
(3)
式中:S,肠衣膜的综合得分;X1,干态抗拉强度隶属度;X2,干态断裂拉伸率隶属度;X3,湿态抗拉强度隶属度;X4,湿态断裂拉伸率隶属度;X5,吸水率隶属度;X6,热溶率隶属度;X7,水蒸气透过系数(water vapor permeability,WVP),隶属度。
根据单因素试验结果,进一步采用L9(34)正交试验方案进行优化。以综合得分为指标,确定最佳工艺条件。
表1 正交因素水平
Table 1 Factors and levels of the orthogonal test

水平因素A(复配比)B(甘油添加量)/%C(CaCl2质量浓度)/(g·L-1)D(交联时间)/min18∶21050527∶3201001036∶43015015
1.3 指标测定
1.3.1 膜厚
用游标卡尺在被测膜上随机选择5点进行测定,取平均值。
1.3.2 含水量
参考GB 5009.3—2016进行测定。
1.3.3 干态、湿态机械性能
参考CHEN等[11]的方法,将肠衣样品裁剪成10 mm×50 mm的矩形,分别在干态、湿态(常温浸泡2 min)条件下采用物性分析仪测定其拉伸性能,分别按照公式(4)、公式(5)计算不同状态下的拉伸强度(tensile strength,TS)和断裂伸长率(elongation break,EB)。参数设定如下:夹具A-MTG,测前速率0.5 mm/s,测中速度0.5 mm/s,返回速率0.5 mm/s,触发力Auto-10 g,拉伸距离20 mm,每组样品重复测定5次。
(4)
(5)
式中:F,样品断裂时的最大拉力,N;A,样品的横截面积,m2;L0,样品的初始长度,mm;L,样品拉伸断裂时的长度,mm。
1.3.4 热溶率
参考WU等[12]的方法,将肠衣样品剪成1 cm ×5 cm的矩形,称取其质量(m1),在沸水中煮2 min 后取出,用滤纸轻轻吸去表面残留水分再次称重记为m2。计算过程如公式(6)所示:
热溶胀率![]()
(6)
1.3.5 吸水率
将肠衣样品剪成1 cm×5 cm 的长条状,称取其质量(m1),在常温水中浸泡24 h取出,用滤纸轻轻吸去表面残留水分再次称重记为m2。计算过程如公式(7)所示:
吸水率![]()
(7)
1.3.6 WVP
参考吴佳[13]的方法略作修改,称取5 g无水CaCl2装入40 mm×70 mm称量瓶中,用封口膜将肠衣膜密封于瓶口处,将整体称重后的称量瓶放入底部为水溶液(相对湿度100%、23 ℃)的干燥器中,使膜内外两侧保持一定的蒸汽压差,24 h内每隔2 h称重1次,作称量瓶增重-时间关系曲线,曲线的斜率为水蒸气通透速率,WVP按公式(8)计算:
(8)
式中:C,水蒸气透过速率,g/h;d,膜厚,mm;A,膜覆盖的有效面积,m2;Δp,膜内外两侧的蒸汽压差,kPa。
1.3.7 阻氧性
参考丛旭等[14]的方法略作修改,在40 mm×70 mm称量瓶中装入10 mL新鲜色拉油,用膜样品覆盖瓶口并密封,同时空白对照组不封膜,放入60 ℃的烘箱中加速氧化7 d,采用硫代硫酸钠滴定法测定大豆油的过氧化值(peroxide value,POV)。根据油脂POV的大小来评价可食用膜样品的阻氧性。
1.3.8 微观结构
将肠衣膜喷金后置于冷场发射扫描电子显微镜下观察表面和横断面的微观形态,样品扫描的加速电压为3 000 V。
2 结果与分析
2.1 单因素试验
2.1.1 复配比例对肠衣膜性能的影响
(1)不同复配比例肠衣膜的物理特性
由表2可知,复配比例对肠衣膜厚度影响不大,仅在质量比为8∶2、7∶3时厚度略有增加。当瓜尔胶添加比例超过7∶3时,水分含量出现下降,可能是因为海藻酸钠含量减少,与Ca2+的交联程度降低,被网合的水减少导致含水量下降。随着瓜尔胶添加量的增加,吸水率整体呈现上升趋势,热溶胀率不断增大,这是由于瓜尔胶的结构多羟基,添加瓜尔胶引入了较多的羟基,亲水性增强,溶胀过程吸收的水分也随之增加。
表2 不同复配比例肠衣膜的物理特性
Table 2 Physical properties of casings with different composite proportion
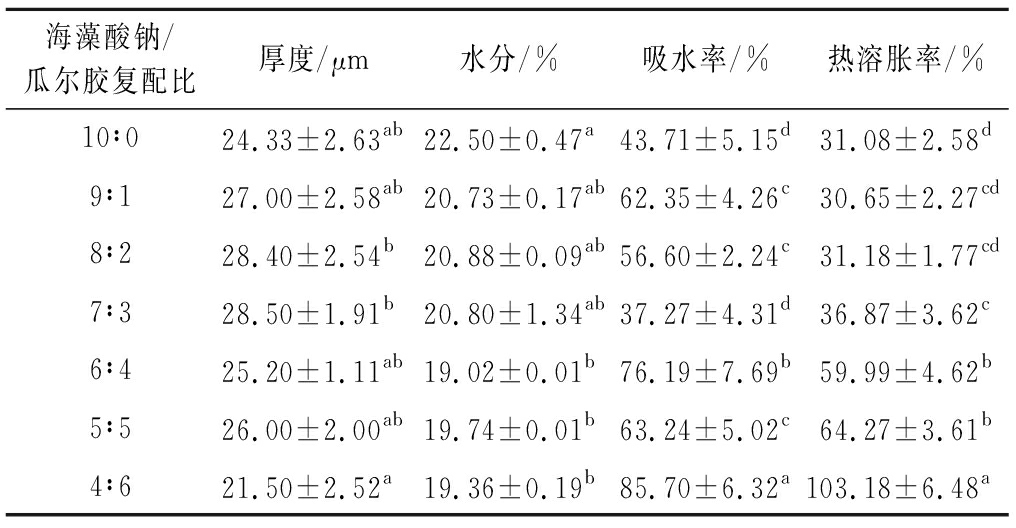
海藻酸钠/瓜尔胶复配比厚度/μm水分/%吸水率/%热溶胀率/%10∶024.33±2.63ab22.50±0.47a43.71±5.15d31.08±2.58d9∶127.00±2.58ab20.73±0.17ab62.35±4.26c30.65±2.27cd8∶228.40±2.54b20.88±0.09ab56.60±2.24c31.18±1.77cd7∶328.50±1.91b20.80±1.34ab37.27±4.31d36.87±3.62c6∶425.20±1.11ab19.02±0.01b76.19±7.69b59.99±4.62b5∶526.00±2.00ab19.74±0.01b63.24±5.02c64.27±3.61b4∶621.50±2.52a19.36±0.19b85.70±6.32a103.18±6.48a
注:同一列中的不同字母表示统计上具有显著差异(P<0.05)(下同)
(2)不同复配比例对肠衣膜的各状态下机械性能的影响
如图1所示,添加瓜尔胶后,肠衣膜的干态抗拉强度无显著变化,继续添加至60%时,抗拉强度较未添加时出现显著性下降,可能由于此时作为主要成膜基质的瓜尔胶阻碍了海藻酸钠和钙的共价键的形成以及分子间的相互作用,使得初始结合紧密的膜基质变疏松,进而导致肠衣膜干态强度的下降。
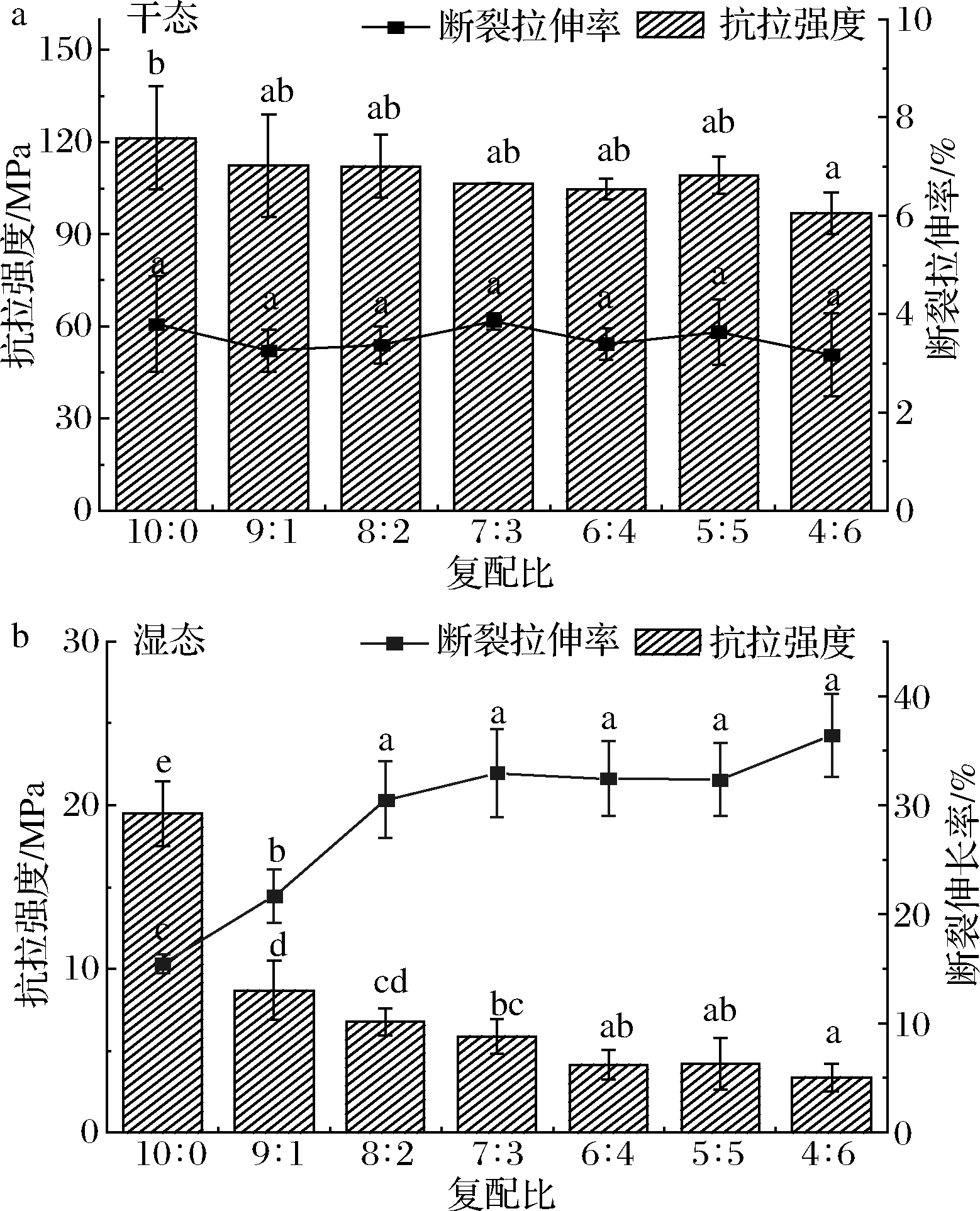
a-干态;b-湿态
图1 不同复配比例的肠衣膜的各状态下的机械性能
Fig.1 Mechanical properties of casings with different composite proportions at different conditions
注:不同小写字母表示差异显著(P<0.05)(下同)
湿态的抗拉强度远小于对应添加量的干态肠衣,这是由于水分的浸入破坏了维持其结构的大量氢键[11]。值得注意的是,灌肠过程中通常使用的是润湿状态的肠衣,此时肠衣必须具有较大的柔韧性,才能保证在快速填充肉料时肠衣不发生破裂且与馅料保持良好的相容性,因此肠衣的湿态拉伸率是衡量肠衣质量的重要指标[15]。随着瓜尔胶比例的增加,肠衣膜的抗拉强度逐渐下降,断裂拉伸率则呈现出逐渐增大的趋势,可能因为瓜尔胶的添加引入了较多羟基,水分子的润滑作用使得分子间的位移变得更为容易,因此断裂延伸率显著提高,强度相应地有所下降,但仍然满足灌肠的要求且改善了纯海藻酸钠膜质脆、韧性差的缺陷。
(3)不同复配比例对肠衣膜阻湿性、阻氧性的影响
如图2所示,相较于纯海藻酸钠膜,添加瓜尔胶的复合肠衣膜的阻氧型未发生显著性变化,而WVP则显著下降,复配比为7∶3时,WVP达最小值0.39 g·mm/(h·m2·kPa),这可能说明瓜尔胶与海藻酸钠膜之间能够形成致密的网状结构,阻碍水分子的进入,赋予肠衣膜具有较好的阻湿性能。

a-WVP;b-POV
图2 不同复配比例的肠衣膜的WVP、POV
Fig.2 WVP and POV of different proportions of casings
综合分析,过量添加瓜尔胶会导致机械性能、耐水性能变差。海藻酸钠与瓜尔胶的比例为7∶3时,肠衣膜的抗拉强度为5.89 MPa,断裂拉伸率32%,优于文献[3]报道的一种拉伸强度为5.4 MPa,断裂拉伸率为12.4%的乳清蛋白肠衣,该比例下的肠衣膜还具有最佳的阻湿性能和耐水性能,因此初步确定海藻酸钠与瓜尔胶的比例为7∶3。
2.1.2 甘油添加量对肠衣膜性能的影响
(1)不同甘油添加量的肠衣膜的物理特性
由表3可知,甘油添加量对肠衣膜的厚度和水分影响均无显著影响。当添加少量甘油(<50%)时,肠衣膜的吸水率无显著变化;添加量大于50%时,甘油中的亲水基团与水分子的结合能力变强,吸水率显著提高[16]。随着甘油添加量的增加,热溶胀率不断下降,可能是因为甘油作为增塑剂能够插入分子链间与羟基反应,破坏了海藻酸钠与瓜尔胶之间的部分氢键作用,加上高温破坏了膜的网状结构,空隙变大,从而宏观上表现为热溶胀率的下降。当甘油添加过量至100%时,大量水分子吸附在薄膜表面,溶胀率提高[17]。
表3 不同甘油添加量的肠衣膜的物理特性
Table 3 Physical properties of casings with different glycerol levels

甘油添加量/%厚度/μm水分/%吸水率/%热溶胀率/%032.80±3.63a19.69±1.53ab55.37±1.95c52.20±2.52b1030.40±2.58a18.74±1.15b54.33±0.84c42.36±3.26c2030.50±3.21a21.13±0.48ab62.74±2.75c34.03±2.13d3033.33±3.06a21.50±0.49ab53.83±5.96c33.24±0.94d4030.13±2.95a20.53±2.33ab62.32±5.47c31.08±1.85d5035.50±3.43a21.55±0.82ab71.64±7.02b43.25±2.41c6036.00±3.65a18.66±1.54b88.12±6.59a44.30±1.35c8036.00±1.63a22.88±1.38a87.12±7.57a46.83±1.35c10035.60±4.10a22.88±1.38ab82.81±1.2a57.72±4.06a
(2)不同甘油添加量对肠衣膜的各状态下机械性能的影响
如图3所示,甘油的添加量对肠衣膜的干态抗拉强度和断裂拉伸率几乎无显著影响,可能因为此时糖醛酸羧基与钙的配位作用起到主要的支撑作用,甘油的增塑效果较弱。随着甘油添加量的增加,肠衣膜的湿态抗拉强度逐渐下降,而断裂拉伸率呈现不断上升的趋势,这可能是由于水分子进入薄膜的网状结构中,激活了甘油分子及膜中的部分极性基团,甘油插入分子链间与复合膜内的其他大分子结合,有力地破坏分子链间的氢键作用及位阻作用,软化刚性结构,从而改善了膜的力学性质[18]。

a-干态;b-湿态
图3 不同甘油添加量的肠衣膜的各状态下的机械性能
Fig.3 The mechanical properties of casings with different glycerol additions at different conditions
(3)不同甘油添加量对肠衣膜阻湿性、阻氧性的影响
如图4所示,肠衣膜的WVP值随着甘油添加量的增加逐渐升高,阻湿能力有所下降。这可能是因为甘油中含有的亲水性基团使得膜与水分子的结合能力变强,增加了自由体积和链段运动,同时水蒸气在膜中的扩散能力变大,从而增大了膜的WVP[19]。TURHAN等[16]的研究也发现将聚乙二醇-400作为增塑剂掺入聚合物基质会导致WVP的增加。甘油添加量为0%~40%时,肠衣膜的透氧性变化不显著;继续添加甘油,增塑剂与膜内大分子结合,增大了大分子间的距离,削弱了分子间作用力,破坏了膜的网状结构,空隙变大,透过的氧气更多,阻氧性能有所下降。

a-WVP;b-POV
图4 不同甘油添加量的肠衣膜的WVP、POV
Fig.4 WVP and POV of casings with different glycerol contents
综合分析,甘油添加量大于50%时会显著提高膜的韧性,但也会造成阻湿性能、耐水性能大幅下降,不适于肠衣膜综合性能的提高。当添加量为20%~30%时,肠衣膜的韧性得到显著提高,且阻氧性、耐水性能依然良好,结合生产成本的因素确定甘油添加量为基质的20%。
2.1.3 CaCl2质量浓度对肠衣膜性能的影响
(1)不同CaCl2质量浓度交联的肠衣膜的物理特性
PAVLATH等[20]提出将膜浸入CaCl2溶液中时会发生2种竞争反应:藻酸盐在溶液中的溶解和膜表面的Ca2+与羧基交联而使膜不溶解的2种情况。当Ca2+的浓度过低,则第一个过程(即藻酸盐的溶解)将占主导地位,薄膜厚度减小;相反地Ca2+浓度的增加将通过交联作用抵消溶解。由表4可知,经CaCl2交联的肠衣膜的厚度先减小后增大,这可能因为CaCl2质量浓度低于200 g/L时,一方面海藻酸钠分子与Ca2+形成钙桥,海藻酸钠分子间的结合力度增强,复合膜分子间的斥力减小,另一方面肠衣膜的溶解速度占主导地位,因此厚度有所下降,这与卞紫秀等[21]制备的海藻酸钠-卡拉胶复合膜交联后厚度减小的结果一致。当CaCl2质量浓度达到200 g/L以上时,Ca2+的交联速度远大于海藻酸的溶出速度,且Ca2+浓度越高,交联的速度越快,在膜表面迅速形成致密的交联膜,抑制了海藻酸的溶出,进而导致了膜厚度的增加。这与已报道的研究结果相一致,郭锦棠等[22]制备抗菌性海藻酸钠膜时发现CaCl2质量浓度超过100 g/L时,薄膜的厚度较未交联时有所增加。此外交联的肠衣膜的水分较未交联膜有显著提高,这是因为交联过程膜吸水溶胀且交联形成的网状结构阻碍了水分的迁出,从而导致含水量有所增加。
表4 不同CaCl2质量浓度的肠衣膜的物理特性
Table 4 General physical properties of casings with different concentrations of CaCl2
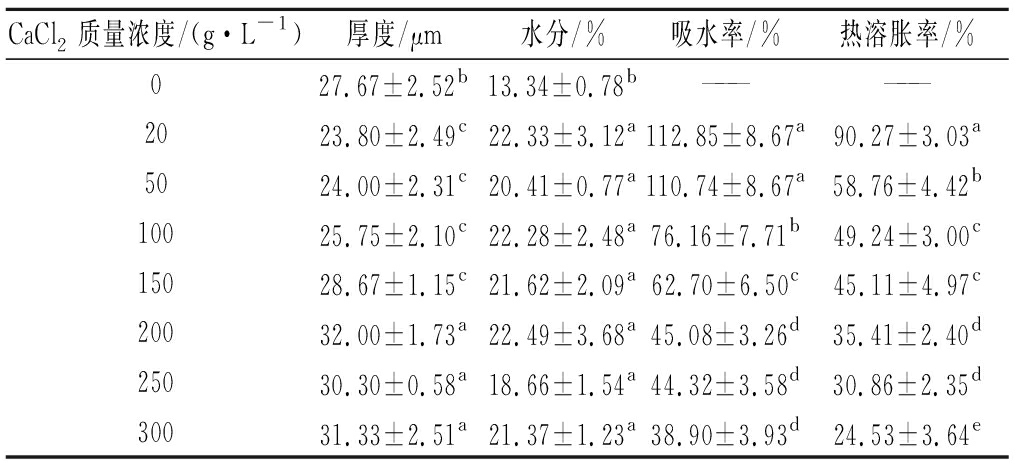
CaCl2质量浓度/(g·L-1)厚度/μm水分/%吸水率/%热溶胀率/%027.67±2.52b13.34±0.78b——————2023.80±2.49c22.33±3.12a112.85±8.67a90.27±3.03a5024.00±2.31c20.41±0.77a110.74±8.67a58.76±4.42b10025.75±2.10c22.28±2.48a76.16±7.71b49.24±3.00c15028.67±1.15c21.62±2.09a62.70±6.50c45.11±4.97c20032.00±1.73a22.49±3.68a45.08±3.26d35.41±2.40d25030.30±0.58a18.66±1.54a44.32±3.58d30.86±2.35d30031.33±2.51a21.37±1.23a38.90±3.93d24.53±3.64e
注:——表示未经交联的肠衣膜不耐水,故无法计算吸水率和热溶胀率(下同)
实验发现未交联膜水溶性为100%,即无耐水性。随着CaCl2质量浓度的增加,肠衣膜不溶于水且吸水率和溶胀率都呈现不断下降的趋势,说明CaCl2与海藻酸钠交联形成了致密的“蛋盒”结构,提高了肠衣膜的耐水能力以适应生产加工的要求。
(2)不同CaCl2质量浓度对肠衣膜的各状态下机械性能的影响
如图5所示,CaCl2的交联对肠衣膜的干态断裂拉伸率几乎无影响,但显著提高了肠衣膜的拉伸强度,当CaCl2质量浓度为100 g/L时,肠衣膜的抗拉强度达到最大值为117.4 MPa,远高于未交联膜(70.3 MPa)。RHIM[23]报道的海藻酸钠膜经交联后的拉伸强度由33.6 MPa上升至85.9 MPa,与本文的结果类似,说明Ca2+的交联显著改善了肠衣膜的力学性质且本文制备的肠衣膜力学性能更好。当CaCl2质量浓度为20~100 g/L,肠衣膜的湿态断裂拉伸率高达45%左右;CaCl2质量浓度高于150 g/L时,断裂拉伸率显著降低至35%以下,可能因为CaCl2质量浓度较大时,在膜的表面迅速形成的交联膜阻碍了Ca2+向膜内渗透,膜内部的交联度不均匀,从而影响其力学性能。另一方面致密的网状结构阻碍了水的进入,缺少增塑剂的作用,膜的柔韧性也有所下降[22,24]。

a-干态;b-湿态
图5 不同CaCl2质量浓度交联的肠衣膜各状态下的机械性能
Fig.5 Mechanical properties of casings with different concentrations of CaCl2at different conditions
(3)不同CaCl2质量浓度对肠衣膜阻湿性、阻氧性的影响
如图6所示,随着CaCl2质量浓度的增加,肠衣膜的透氧量显著降低,WVP则先减小后增大。交联浓度为50、100 g/L时,WVP最小为0.18 g·mm/(h·m2·kPa)左右,说明在该交联浓度下,肠衣膜形成的网状结构最为致密均匀,阻氧阻湿性能较好。

a-WVP;b-POV
图6 不同CaCl2质量浓度交联的肠衣膜的WVP、POV
Fig.6 WVP and POV of casings crosslinked with different CaCl2 concentrations
综合分析,CaCl2质量浓度过低时,肠衣膜的耐水性能较差;浓度过高时,肠衣膜结构被破坏机械性能减弱,最终确定CaCl2质量浓度为100 g/L,该条件下的肠衣膜综合性能最好。
2.1.4 交联时间对肠衣膜性能的影响
(1)不同交联时间的肠衣膜的物理特性
由表5可知,不同交联时间的肠衣膜的含水量较未交联膜有所升高,但对膜厚无明显影响。交联时间由30 s~40 min,肠衣膜的吸水率由91.17%不断下降至60.55%,继续延长浸泡时间,吸水率反而上升,这是因为交联形成的初期,藻酸盐链中存在的所有结合位点都是可接近的,因此Ca2+可以迅速与聚合物结合并将聚合物链连接在一起,剩余的Ca2+需通过已形成的部分网络结构扩散,这将导致一定的扩散阻力[24],因此40 min时交联才接近完全且交联时间越长,海藻酸钠与钙的交联程度越高,游离的亲水基团越少,吸水率越低;但交联时间过久,增塑剂等组分有可能溶出,原本稳定的膜结构紊乱,耐水性能有所减弱。热溶率也呈现出类似先下降后上升的趋势,在交联10~20 min左右时降至30%左右,说明此时的膜结构最为稳定,耐热耐水性能较好。
表5 不同交联时间的肠衣膜的物理特性
Table 5 Physical properties of casings with different cross-linking time

交联时间/min厚度/μm水分/%吸水率/%热溶胀率/%027.67±2.52a13.34±0.78b——————0.526.80±1.39a16.08±0.94a91.17±9.92a56.07±3.72a227.48±1.23a17.03±1.56a76.65±8.25b48.94±3.36b524.60±2.16a17.45±0.95a77.51±5.74b46.08±1.16bc1027.90±2.66a17.69±0.81a76.81±6.46b28.18±1.27d2026.70±2.47a17.33±0.70a72.42±4.72b30.16±1.56d3029.20±2.50a16.65±1.31a72.16±2.57b41.55±1.16c4030.40±1.39a18.84±0.37a60.55±4.41c44.17±2.49bc5027.20±1.39a18.20±1.25a82.29±7.74ab46.26±1.42bc6026.52±0.78a18.43±0.35a90.27±5.86a54.19±3.87a
(2)不同交联时间对肠衣膜各状态下机械性能的影响
如图7所示,交联时间为0.5~20 min时,干态抗拉强度均大于140 MPa,此时高聚物分子链结合牢固,形成的膜刚性较大;交联超过40 min时,部分组分溶出结构不稳定,膜的强度下降,断裂拉伸率略有上升。肠衣膜湿态条件下的抗拉强度和断裂拉伸率随交联时间的变化不显著,可能由于交联是快速发生的,其时间长短对肠衣膜湿态的机械特性影响不大。

a-干态;b-湿态
图7 不同交联时间的肠衣膜各状态下的机械性能
Fig.7 Mechanical properties of casing films with different crosslinking time at different conditions
(3)不同交联时间对肠衣膜阻湿性、阻氧性的影响
如图8所示,肠衣膜的阻氧性能较未交联膜显著下降,但受时间的影响不大,而肠衣膜的WVP则先减小后增大并最终趋于稳定。交联时间较短时,肠衣膜形成稳定的网状结构,具有较好的阻湿阻氧性;交联时间过长可能会导致结构紊乱,分子间空隙变大,阻氧阻湿性能有所下降。
综合分析,交联10 min的肠衣膜具有最低的热溶率,此时膜结构最为稳定,耐热耐水性能较好,因而确定交联时间为10 min。

a-WVP;b-POV
图8 不同交联时间的肠衣膜的WVP、POV
Fig.8 WVP and POV of casings with different crosslinking time
2.2 正交试验与验证
基于单因素试验,进行正交试验,结果如表6所示。极差分析表明影响对肠衣膜的性能程度的影响次序为复配比>甘油添加量>交联时间>CaCl2质量浓度,最佳组合为A1B2D1C2。利用上述最佳工艺进行肠衣的制作,各项性能综合得分为0.66,同时与市售的胶原肠衣性能进行比较。结果如表7所示,植物肠衣膜的湿态断裂拉伸率达到26.43%,显著改善了纯海藻酸钠膜质脆、韧性差的缺陷,优于文献[2]报道的壳聚糖肠衣(16.4%),和市售胶原蛋白肠衣(23.83%),说明其具有灌肠的应用可能性。该植物肠衣的溶胀性、WVP均低于胶原蛋白肠衣,说明其耐水性能、阻湿性能更好,在后续加工和贮存过程中具有保护香肠免受水分和质量损失的潜力。此外植物肠衣在600 nm波长下透光率为75%,高于胶原蛋白肠衣(34%),说明其透明度更高,这在肉类加工方面将是一大优势。因此本文制备的植物肠衣具有替代胶原蛋白肠衣的可能性且因成膜基质均是植物来源、无致敏性,故应用前景更广。
表6 正交试验结果
Table 6 The results of orthogonal test
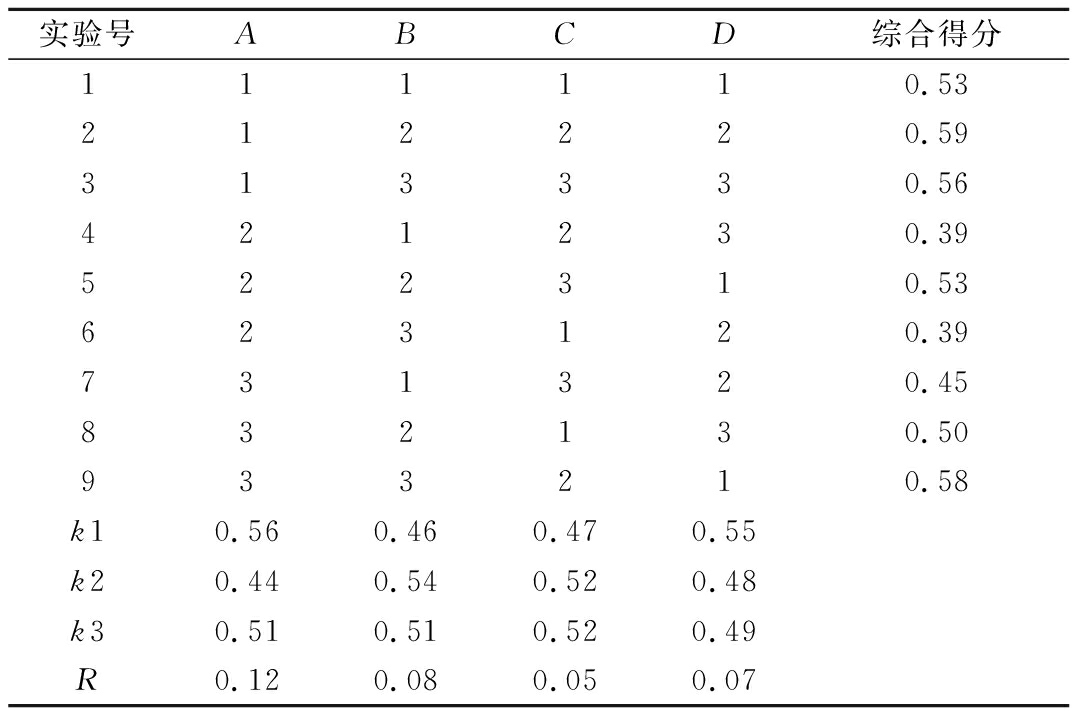
实验号ABCD综合得分111110.53212220.59313330.56421230.39522310.53623120.39731320.45832130.50933210.58k10.560.460.470.55k20.440.540.520.48k30.510.510.520.49R0.120.080.050.07
表7 植物肠衣与市售胶原肠衣的性能对比
Table 7 Comparison of properties between vegetarian casings and commercial collagen casings

各项性能 状态植物肠衣胶原肠衣吸水率/% -66.20±3.52a62.34±4.60a热溶率/% -60.00±4.80a124.84±9.24bWVP/[g·mm·(h·m2·kPa)-1]0.29±0.01a0.42±0.01b抗拉强度/MPa干态106.50±4.62a 80.15±6.51a湿态5.82±0.41a12.84±1.44b断裂拉伸率/%干态3.86±0.08a22.53±1.00b湿态26.43±2.12a23.83±1.65b
注:-表示无
由图9可以看出,单一的海藻酸钠膜表面平整、有略微的结晶现象,与瓜尔胶共混后的肠衣膜表面光滑平整,不存在裂隙或小孔,而交联后的肠衣膜有细微的褶皱,具有良好的致密性。截面图显示,纯海藻酸钠膜的截面光滑平整,添加瓜尔胶的肠衣膜影响了原本均一的体系,断面有些粗糙,但不存在明显的相分离现象,说明海藻酸钠与瓜尔胶具有良好的相容性。加入CaCl2后,其与海藻酸钠上的糖醛酸羧基形成蛋盒结构,造成膜的褶曲,此外膜交联点分布较均匀,内部趋于形成更加稳定的致密结构,这与前文中CaCl2交联有助于提高肠衣膜的机械性能、耐水性能等理论存在一致性,由此进一步证明最佳工艺下制备的肠衣膜具备良好的性能。

a-海藻酸钠膜表面;b-未交联肠衣膜表面;c-交联肠衣膜表面;d-海藻酸钠膜截面;e-未交联肠衣膜截面;f-交联肠衣膜截面
图9 海藻酸钠膜、海藻酸钠-瓜尔胶肠衣膜的扫描电镜图
Fig.9 Scanning electron micrographs of sodium alginate film and sodium alginate-guar gum casings
3 结论
先利用单因素试验测试植物肠衣膜的机械、阻隔、耐水等性能,确定复配比、甘油添加量、CaCl2质量浓度、交联时间,再通过4因素3水平正交试验对工艺进行最终优化验证,得到最佳制备工艺为:海藻酸钠与瓜尔胶复配比(质量比)8∶2,甘油添加量为20%,CaCl2溶液质量浓度为100 g/L,交联时间为5 min,该条件下所得肠衣膜的湿态韧性显著提高,具有灌肠的应用可能性,此外植物肠衣较胶原蛋白肠衣具有更好的阻湿阻氧性,更有利于保持香肠品质。本研究提出了一种替代胶原蛋白肠衣的方案,为合理使用海藻酸钠、瓜尔胶制备植物肠衣提供理论和应用指导。
[1] SUURS P, BARBUT S.Collagen use for co-extruded sausage casings-A review[J].Trends in Food Science & Technology, 2020, 102:91-101.
[2] ADZALY N Z, JACKSON A, KANG I, et al.Performance of a novel casing made of chitosan under traditional sausage manufacturing conditions[J].Meat Science, 2016, 113:116-123.
[3] CAGRI A, USTUNOL Z, OSBURN W, et al.Inhibition of Listeria monocytogenes on hot dogs using antimicrobial whey protein-based edible casings[J].2003, 68(1):291-299.
[4] ADZALY N Z, JACKSON A, LOBOS-CARVAJAL R V, et al.Development of a novel sausage casing[J].Journal of Food Engineering, 2015, 152:24-31.
[5] LIU L, KERRY J F, KERRY J P.Application and assessment of extruded edible casings manufactured from pectin and gelatin/sodium alginate blends for use with breakfast pork sausage[J].Meat Science, 2007, 75(2):196-202.
[6] SENTURK PARREIDT T, MULLER K, SCHMID M.Alginate-based edible films and coatings for food packaging-applications[J].Foods, 2018, 7(10):170-207.
[7] TAVASSOLI-KAFRANI E, SHEKARCHIZADEH H, MASOUDPOUR-BEHABADI M.Development of edible films and coatings from alginates and carrageenans[J].Carbohydrate Polymers, 2016, 137:360-374.
[8] LIU F, CHANG W, CHEN M S, et al.Film-forming properties of guar gum, tara gum and locust bean gum[J].Food Hydrocolloids, 2020, 98:1-8.
[9] 陈珊珊. 葵花籽壳纳米纤维素的制备及其在大豆分离蛋白基可食膜中的应用[D].长春:吉林大学, 2016.
CHEN S S.Preparation of sunflower seed hull nanocrystalline celluslose and its appliction in soy-isolated protein-based edible film [D].Changchun:Jilin University, 2016.
[10] 刘魁英. 食品研究与数据分析[M].第3版.北京:中国轻工业出版社, 2009.
LIU K Y.Food Research and Data Analysis [M].3rd Edition.Beijing:China Light Industry Press, 2009.
[11] CHEN C, LIU F, YU Z, et al.Improvement in physicochemical properties of collagen casings by glutaraldehyde cross-linking and drying temperature regulating[J].Food Chemistry, 2020, 318:126404.
[12] WU J M, LIU F, YU Z, et al.Facile preparation of collagen fiber-glycerol-carboxymethyl cellulose composite film by immersing method[J].Carbohydr Polymers, 2020, 229:115429.
[13] 吴佳. 普鲁兰壳聚糖复合可食用膜的性质研究[D].无锡:江南大学, 2012.
WU J.Characterization of pullulan-chitosan blend film[D].Wuxi:Jiangnan University, 2012.
[14] 丛旭, 刘锐, 刘砚, 等.小麦面筋蛋白可食膜的制备及其在调料包中的应用[J].天津大学学报, 2018, 33(3):9-17.
CONG X, LIU R, LIU Y.et al.Preparation of edible wheat gluten film and its application to seasoning package[J].Journal of Tianjin University of Science & Technology, 2018, 33(3):9-17.
[15] 吴颖. 大豆分离蛋白可食性肠衣加工工艺研究[D].武汉:武汉轻工大学, 2013.
WU Y.The processing technology of soybean protein isolated edibility casing[D].Wuhan:Wuhan Polytechnic University, 2013.
[16] TURHAN K N, SAHBAZ F.Water vapor permeability, tensile properties and solubility of methylcellulose-based edible films[J].Journal of Food Engineering, 2004, 61(3):459-466.
[17] 包俊青. 基于明胶的人造肠衣制备与应用研究[D].无锡:江南大学, 2019.
BAO J Q.The preparation and application of artifical casing based on gelatin[D].Wuxi:Jiangnan University, 2019.
[18] GHASEMLOU M, KHODAIYAN F, OROMIEHIE A.Physical, mechanical, barrier, and thermal properties of polyol-plasticized biodegradable edible film made from kefiran[J].Carbohydrate Polymers, 2011, 84(1):4 77-4 483.
[19] AL-HASSAN A A, NORZIAH M H.Starch-gelatin edible films:Water vapor permeability and mechanical properties as affected by plasticizers[J].Food Hydrocolloids, 2012, 26(1):108-117.
[20] PAVLATH A E, VOISIN A, ROBERTSON G H.Pectin-based biodegradable water insoluble films[J].Macromolecular Symposia, 1999, 140:107-113.
[21] 卞紫秀, 董增, 张旭, 等.海藻酸钠与卡拉胶复合膜的制备及性能[J].塑料工业, 2018, 46(9):39-43.
BIAN Z S, DONG Z, ZHANG X.et al.Preparation and performances of sodium alginate/carrageenan composite packaging film[J].China Plastics Industry, 2018, 46(9):39-43.
[22] 郭锦棠, 张瑾, 殷俊威, 等.抗菌性海藻酸钠膜的制备及性能分析[J].天津大学学报, 2013, 7:653-658.
GUO J T, ZHANG J, YIN J W, et al.Preparation and performance analysis of edible antimicrobial films based on sodium alginate[J].Journal of Tianjin University, 2013, 7:653-658.
[23] RHIM J W.Physical and mechanical properties of water resistant sodium alginate films[J].LWT-Food Science and Technology, 2004, 37:323-330.
[24] ROGER S, TALBOT D, BEE A.Preparation and effect of Ca2+ on water solubility, particle release and swelling properties of magnetic alginate films[J].Journal of Magnetism and Magnetic Materials, 2006, 305(1):221-227.