孔雀石绿(malachite green,MG)和结晶紫(crystal violet,CV)均属于三苯甲烷类染料,最先应用在纺织工业上[1],但同时因具有广谱抗菌、便宜及药效显著等特点,曾被广泛应用于水产品的养殖和运输过程中,预防和治疗水产品细菌性感染疾病[2]。水产品的组织中能够富集此类药物,且当药物进入生物体内会通过生物转化而产生毒性更强的隐性孔雀石绿 (leucomalachite green,LMG)和隐性结晶紫(leucocrystal violet,LCV)[3],其在水产品体内的代谢速率较为缓慢,残留时间较长,难以消除,研究表明,长期食用此类水产品,很容易引起人体部分脏器和组织中毒,产生“三致”等副作用,严重威胁人体健康[4]。
为此,美国、欧盟、日本等多国已禁止MG、CV在水产品的养殖及运输过程中使用[5],我国也将其列为禁用药物,要求在动物性食品中不得检出[6]。但因治疗效果显著,价格低,使得其在水产品养殖、运输等途径中屡禁不止。目前水产品中孔雀石绿和结晶紫的分析方法主要包括:高效液相色谱法[7]、液相色谱-串联质谱法[8]、酶联免疫法[9]、毛细管电泳法[10]、电化学法[11]等,其中液相色谱法与液相色谱-质谱联用法的应用最为普遍。目前检测该药物的国标方法有GB/T 20361—2006《水产品中孔雀石绿和结晶紫残留量的测定 高效液相色谱荧光检测法》[12]和GB/T 19857—2005《水产品中孔雀石绿和结晶紫残留量的测定》[13]。液相色谱法一般将MG用硼氢化钾还原为LMG,利用其具有荧光性而使用荧光检测器进行分析[14];或将LMG通过二氧化铅进行柱后衍生氧化为MG,使用紫外或二极管阵列检测器检测[15]。与液相色谱-串联质谱法相比,高效液相色谱法的检出限相对较高,当目标物在样品中的含量较低时,仅仅依靠保留时间进行定性的局限性很大,而串联质谱法的灵敏度和专属性较高、简便快速、干扰少、可避免假阳性等优点,成为众多研究者首选的测定方法[16]。
目前,针对水产品中药物残留检测的样品前处理方法主要有固相萃取法[17]、还原法[13]、柱后衍生法[15]、液液萃取法[18]、AlphaLISA检测方法[19]、QuEChERS法[20]等,快速滤过型净化柱(multi-plug filtration cleanup,m-PFC)在传统 QuEChERS 方法之上进行优化[21],简化前处理操作,利用新复合型纳米材料,更大比表面积,分散性好等优点,提高去除基质中色素、有机酸、部分糖类、脂类、甾醇类等干扰物,完成基质的净化。与传统方法相比,该方法不需要称量N-丙基乙二胺、C18 和无水硫酸镁等吸附剂,无需活化淋洗洗脱程序,可实现一步净化,从而大大缩短了净化时间,可大幅度提高前处理的总体速率。目前该方法已成功应用于人参[22]、生姜[23]、果蔬[24]、茶叶[25]等农药的多残留检测中,但尚未见用于水产品中药物残留的分析。本文采用m-PFC结合UPLC-MS/MS 检测技术,建立了水产品中MG及其代谢物MG、CV及其代谢物LCV同时检测的方法,旨在为简单、快速检测水产品中的药物多残留和药物风险评估提供思路。
1 材料与方法
1.1 仪器与试剂
UPLC-TQS超高效液相色谱-串联质谱仪(配电喷雾离子源),美国Waters公司;ME204E 分析天平,瑞士梅特勒-多利多仪器有限公司;涡轮振荡器,德国IKA 公司;Milli-QA10超纯水仪,美国Millipore公司;IKA T25高速组织匀浆机,飞利浦公司;高速冷冻离心机,日本HITACHI公司;超声波清洗器,瑞士BUCHI公司;移液器,Eppendorf 中国有限公司。
MG、LMG、CV、LCV、内标氘代孔雀石绿(D5-MG)、内标氘代隐性孔雀石绿(D6-LMG)(6种标准品的纯度大于98%),德国 Dr.Ehrenstorfer公司;乙腈、甲醇为色谱级,德国Merck公司;乙酸铵、甲酸为分析纯,上海阿拉丁生化科技股份有限公司;无水硫酸镁、氯化钠为分析纯,中国Macklin公司;m-PFC专用净化柱和陶瓷均质子,北京绿绵科技有限公司;0.22微孔滤膜,天津市津腾实验设备有限公司;实验用水为超纯水。
1.2 标准溶液的配制
单标储备液:分别精密称取MG、LMG、CV、LCV、D5-MG和D6-LMG标准品各10 mg于25 mL的棕色容量瓶中,用乙腈溶解定容配制成400 μg/mL的单标储备液,然后再用乙腈稀释配成10 μg/mL的单标中间液,于-20 ℃避光保存。
混合标准中间液:分别精密吸取MG、LMG、CV、LCV单标中间液1.00 mL于10 mL的棕色容量瓶中,用乙腈定容后配成1.00 μg/mL混合标准中间溶液,于-20 ℃避光保存。
混合内标中间液:分别精密吸取氘代孔雀石绿和内标氘代隐性孔雀石绿单标中间液1.00 mL于10 mL的棕色容量瓶中,用乙腈定容后配成1.00 μg/mL混合内标中间溶液,于-20 ℃避光保存。
混合标准工作溶液:根据需要,随用随配制,吸取一定量的混合标准储备液和混合内标标准溶液,用乙腈-5 mmol/L乙酸铵混合溶液(体积比1∶1)稀释配制0.100、0.200、1.00、4.00和6.00 ng/mL的混合标准工作液,其中混合标准工作溶液中内标的质量浓度为1 ng/mL,于-20 ℃避光保存。
1.3 样品前处理
样品制备:用均质器将500 g可食的鲜鱼肉均质后混匀,装入干净的容器中,用保鲜膜密封,保存于-20 ℃冰箱中冷冻备用。
样品的提取:将样品取出稍解冻,称取匀浆样品5.0 g(精确至0.01 g)于50 mL 具塞离心管中,加入100 μL的混合标准内标,依次加入 2.0 mL 超纯水和 10.0 mL乙腈(含体积分数为1%的甲酸),涡旋 1 min,再加入4.0 g MgSO4、1.0 g NaCl及1颗陶瓷均质子,涡旋1 min;以8 000 r/min离心5 min,将全部上清液转入空离心管中,冷冻除脂后,剩余提取液待净化。
样品的净化:准确移取上述提取液1 mL,从m-PFC净化柱顶部加入,柱底端连接0.22 μm有机滤膜,滤膜下方连接进样小瓶,然后缓慢推动注射杆,流速1~1.5 s/滴,弃去初滤液1~2滴,收集续滤液,即得待测液,待UPLC-MS/MS测定(图1)。
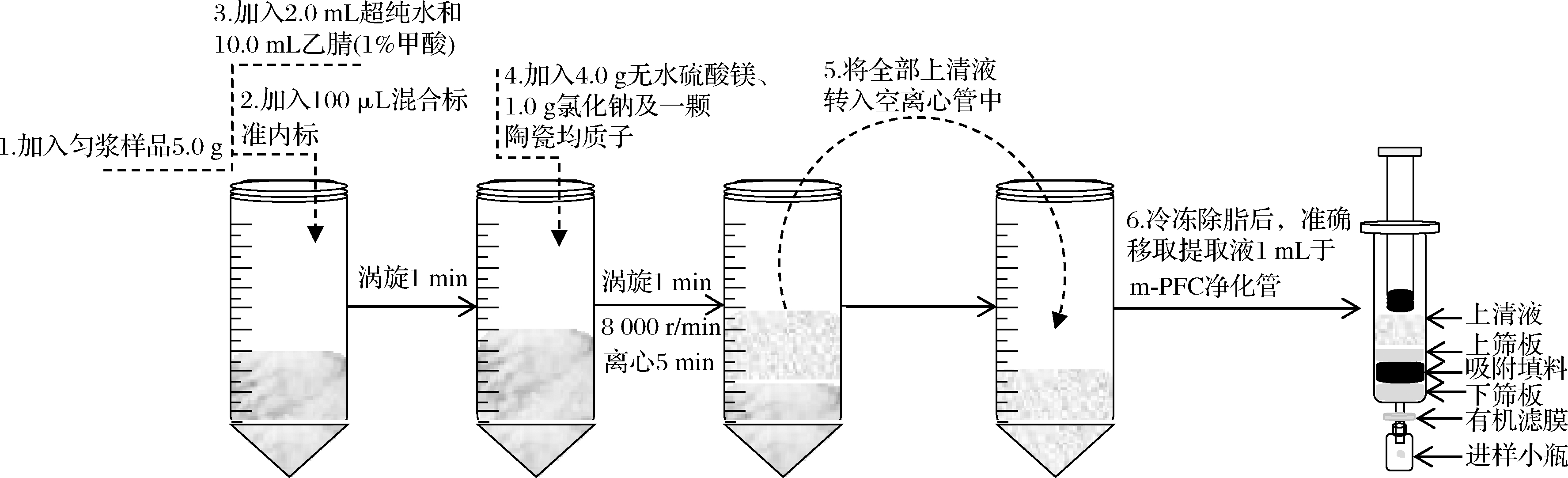
图1 样品前处理流程图
Fig.1 The flow chart of the sample pretreatment
1.4 液相色谱-质谱条件
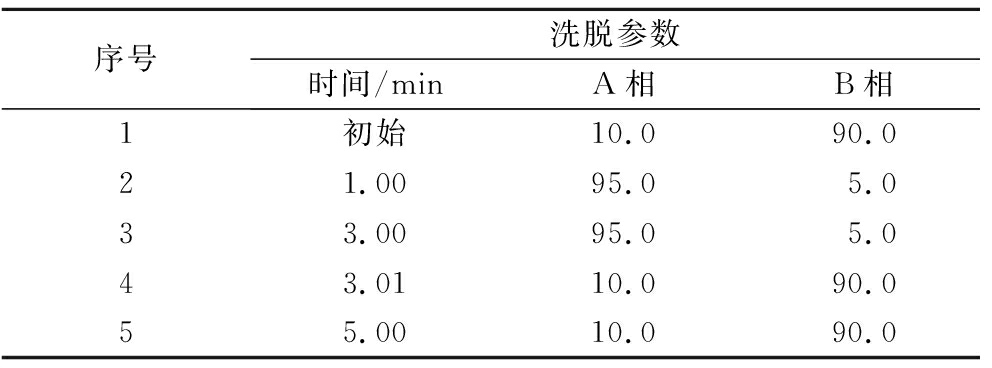
液相色谱条件:ACQUITY UPLC® BEH C18柱(2.1 mm×50 mm,1.7 μm),流动相A为甲醇,流动相B为5 mmol/L乙酸铵溶液(含体积分数为0.1%的甲酸),流速:0.3 mL/min,柱温:35 ℃,进样量:2 μL,梯度洗脱,具体流动相比例见表1。
表1 液相色谱梯度洗脱方法
Table 1 Gradient elution method of liquid chromatography
序号洗脱参数时间/minA相B相1初始10.090.021.0095.05.033.0095.05.043.0110.090.055.0010.090.0
质谱条件:电喷雾离子源正离子扫描(electrospray ion source positive ion,ESI+),雾化气温度:500 ℃,雾化气流速1 000 L/h,毛细管电压:0.4 kV,锥孔气流速:150 L/h,检测方式:多反应监测(multiple reaction monitoring,MRM)。
1.5 定量计算
采用内标法测定MG和CV的峰面积,MG和CV的内标物为氘代孔雀石绿,LMG和LCV的内标物为氘代隐性孔雀石绿。
本方法中MG的残留量是指MG和它的代谢物LMG残留量之和,以MG表示。
本方法中MG的残留量是指MG及其的代谢物LCV残留量之和,以CV表示。
2 结果与分析
2.1 液相色谱条件优化
与GB/T 19857—2005《水产品中孔雀石绿和结晶紫残留量的测定》的色谱条件对比,本文将乙腈更换为甲醇,因为实验过程中发现,乙腈的极性大于甲醇,在反相色谱柱中,化合物会延后出峰,并且碱性的4个MG类化合物都出现峰型变宽和拖尾的情况,因此,选择乙酸铵作为缓冲溶液,可以调节pH值并促进目标物生成正离子的情况下,加入甲酸,使pH<4,可以有效解决色谱柱游离硅羟基与碱性化合物的二级作用所造成的拖尾,从而获得峰型对称,灵敏度较高的峰(图2)。

图2 质量分数为0.5 μg/kg时4种标准品分别在优化液相方法和国标液相方法下的总离子流对比图
Fig.2 Comparison of total ion chromatograms of four standards under optimized liquid phase method and national standard liquid phase method at 0.5 μg/kg
将梯度洗脱流速设置为0.3 mL/min时,洗脱速度加快,3 min内可将目标物全部洗脱出来,分析时间短,有机试剂用量少,基线较稳定,干扰少,化合物能够有效分离,可以达到快速检测的目的。
2.2 质谱条件优化
三重四极杆质谱条件的优化主要包括离子模式、母离子、锥孔电压、子离子、碰撞能量等几个方面。本研究中的目标化合物均为氢键供体,易形成M+1型分子离子峰,因此采用ESI+模式。首先通过母离子扫描,在全扫描色谱图中选择信号强度高且质荷比较大的特征离子作为母离子,记录锥孔电压,得到 MG、LMG、D5-MG、D6-LMG、CV、LCV 的质荷比(m/z)分别为329.0、331.0、334.0、337.0、374.2、372.2,再通过子离子扫描得到离子碎片,选择最强丰度作为定量子离子,干扰较小离子作为定性子离子,确定MRM模式的离子对,最后在MRM模式下,优化所选子离子的最佳碰撞能量,优化结果见表2和图3。可以根据物质的定性离子质量数、定量离子质量数、保留时间、离子丰度比等信息对样品中的目标物进行准确定性。本实验使用的仪器带有QuanpediaTM可扩展且可搜索的数据库,采用以化合物为中心的数据库设计,集液相色谱、MS/MS采集和TargetLynxTM定量信息为一体,能够自动整合数据采集和数据处理方法(两者之间可以自动更新保留时间和离子比率),便于方法开发和定量计算。

图3 六种标准物MRM离子流图
Fig.3 Standard ion chromatograms for multi-reaction monitoring of six standards
表2 质谱参数表
Table 2 Mass spectrometric parameters
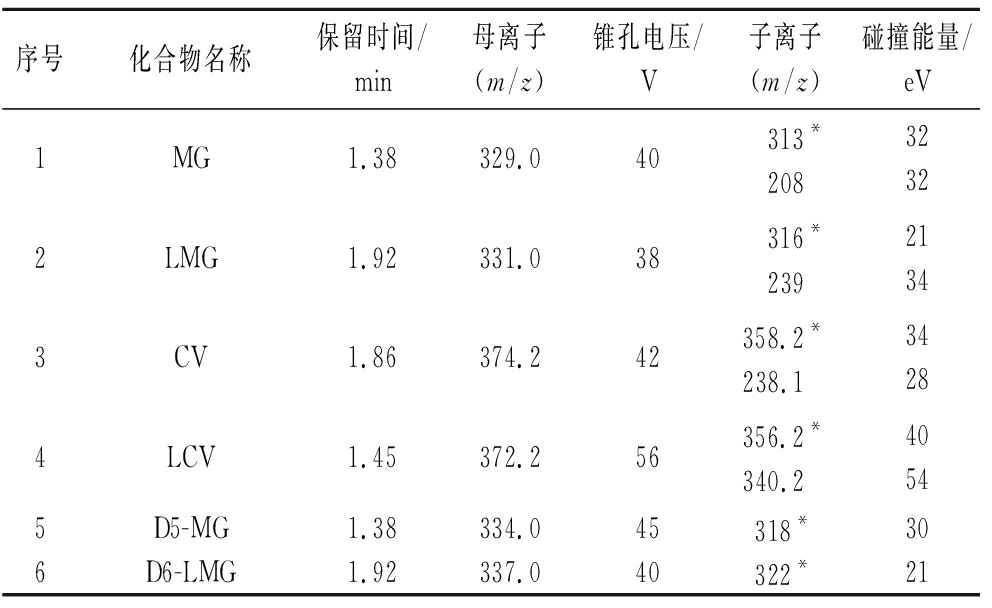
序号化合物名称保留时间/min母离子(m/z)锥孔电压/V子离子(m/z)碰撞能量/eV1MG1.38329.040 313*20832322LMG1.92331.038 316*23921343CV1.86374.242358.2*238.1 34284LCV1.45372.256356.2*340.2 40545D5-MG1.38334.045318*306D6-LMG1.92337.040322*21
注:*为定量离子
2.3 样品前处理条件优化
使用m-PFC法净化时,提取通常需要根据基质的差异,决定是否选择需要添加MgSO4进行脱水干燥以及使用氯化钠加速水相与有机相的分层,同时需要选择合适的m-PFC净化柱,以促进基质中多药物残留的充分溶出。本研究中,为了便于冷冻除脂,添加了无水硫酸镁和氯化钠,选择吸附填料为新复合型纳米材料的m-PFC小柱,对水产品的提取液进行净化,获得了理想的净化效果。
2.4 基质效应(matrix effect,ME)
ME普遍存在于药物残留分析中,是指基质中一种或者多种成分对目标物分析结果的影响。样品基质中的某些共提取物组分能明显降低或增强目标物离子的生成速率与强度,从而影响检测结果的准确性。尤其是在质谱检测中,基质效应很普遍。可以使用比值法来评价:ME=B/A,其中,A为纯溶剂中药物的响应值,B为空白样品基质中添加相同含量药物的响应值。若比值>1,则视为基质增强效应,比值<1,则为基质减弱效应,比值=1,说明基质对目标物质的测定没有影响。
本研究在同一质量浓度水平下,采用流动相和基质空白分别配制标准溶液,并通过对4种物质的响应比值来获得基质效应的大小。结果发现,空白基质对MG、CV、LMG的峰响应有较大抑制作用,基质效应的比值<1,而对LCV峰响应几乎无影响,基质效应的比值≈1(表3)。基质效应的产生原因复杂,难以根本清除。据报道,用来减少或补偿基质效应的方法有:基质净化法、同位素内标法、空白基质配制标准溶液等[25]。使用同位素内标,可以有效地校正基质效应,但如果内标含量和分析物含量不一致,基质效应会有差异[26-27]。本研究为了能较好地降低ME的影响,采用空白基质溶液配制标准曲线和同位素内标2种方式进行校正。
表3 四种标准物的ME对比
Table 3 Comparison of matrix effects of 4 standards
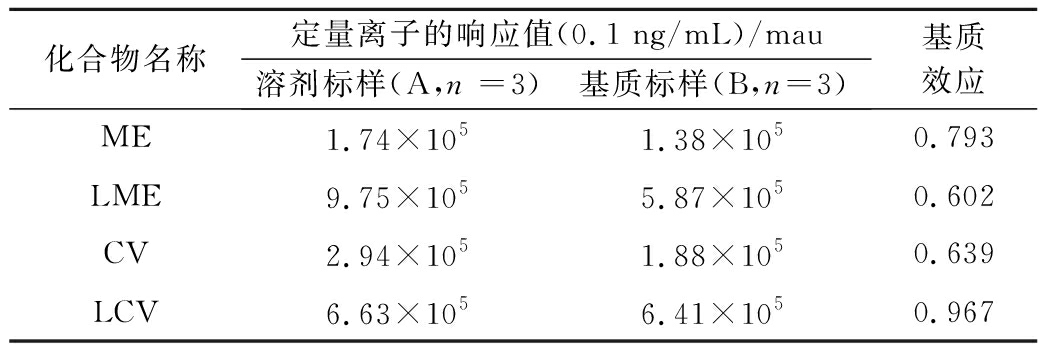
化合物名称定量离子的响应值(0.1 ng/mL)/mau溶剂标样(A,n =3)基质标样(B,n=3)基质效应ME1.74×1051.38×1050.793LME9.75×1055.87×1050.602CV2.94×1051.88×1050.639LCV6.63×1056.41×1050.967
2.5 方法的线性范围、检出限和定量限
4种药物在最佳条件下的总离子流图见图4。可见,在最佳条件下4种药物的分离度良好,在5 min内可完成4种药物的基线分离。
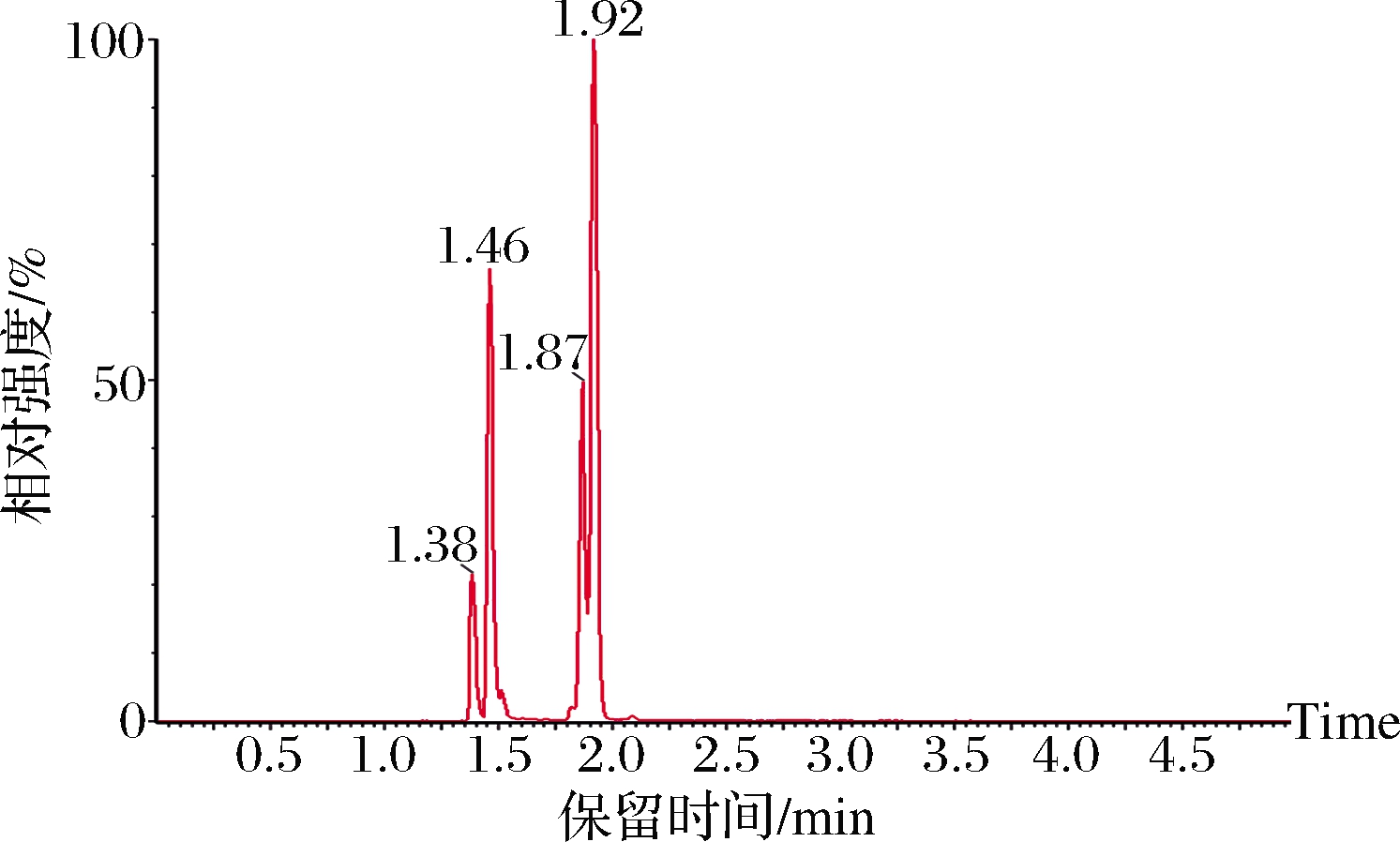
图4 四种标准物在1.00 ng/mL时的总离子流图
Fig.4 Total ion chromatogram of 4 standards at 1.00 ng/mL
由表4可知,4种药物的线性范围均在0.1~6.0 ng/mL,色谱峰面积与对应的质量浓度之间的线性关系良好,相关系数R2均大于0.99。本实验通过向草鱼空白基质中添加多个较低水平的药物混合标准溶液分别进行试验,所得溶液经UPLC-MS/MS 分析,取各药物的S/N=10时的质量浓度计算该药物的定量限,以S/N=3时相应浓度确定检出限。经计算,4种药物的检出限均为0.05 μg/kg,定量限均为0.2 μg/kg。比标准方法检出限(0.5 μg/kg)降低近10倍,说明本方法有较高的灵敏度。
表4 四种化合物的线性范围、检出限和定量限以及加标回收率和精密度
Table 4 Linear relationships, detection limits and quantitation limits, recoveries and RSD of 4 compounds
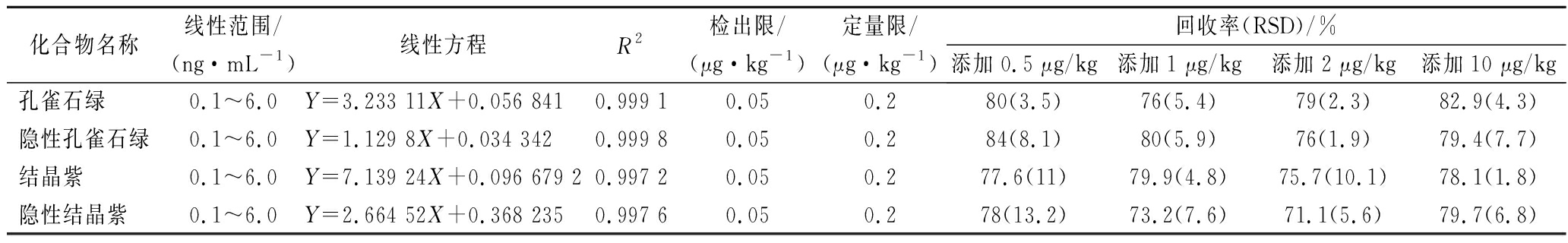
化合物名称线性范围/(ng·mL-1)线性方程R2检出限/(μg·kg-1)定量限/(μg·kg-1)回收率(RSD)/%添加0.5 μg/kg添加1 μg/kg添加2 μg/kg添加10 μg/kg孔雀石绿 0.1~6.0Y=3.233 11X+0.056 8410.999 10.050.280(3.5)76(5.4)79(2.3)82.9(4.3)隐性孔雀石绿0.1~6.0Y=1.129 8X+0.034 3420.999 80.050.284(8.1)80(5.9)76(1.9)79.4(7.7)结晶紫 0.1~6.0Y=7.139 24X+0.096 679 20.997 20.050.277.6(11)79.9(4.8)75.7(10.1)78.1(1.8)隐性结晶紫 0.1~6.0Y=2.664 52X+0.368 2350.997 60.050.278(13.2)73.2(7.6)71.1(5.6)79.7(6.8)
2.6 加标回收率和精密度
本文采用基质匹配标准溶液-内标法定量,对水产品罗非鱼、草鱼中空白样品进行添加回收试验,添加水平分别为0.5、1、2、10 μg/kg的混合标准溶液,每个水平重复6次,低速涡旋后加盖密封,冷藏过夜,第2天取出后置于通风橱避光放至常温,加入内标后静置2 h,之后按照本文样品的前处理方法进行提取净化。由表4可知,在不同的添加水平下,该方法的回收率为71.1%~84%,RSD为 9%~14%,表明该方法准确度较高,精密度良好,能够满足检测要求。
2.7 m-PFC方法与标准方法的比较
以水产品样品为例,当添加水平为2 μg/kg时,分别采用m-PFC方法和GB/T 19857—2005《水产品中孔雀石绿和结晶紫残留量的测定》对4种药物的回收率进行了检测。结果显示,采用m-PFC法,4种药物的回收率为71.5%~85%,RSD<11%;采用标准方法,4种药物的回收率为78%~104%,RSD<8%。2种方法相比,回收率相差较小,准确度也均符合要求,但是标准方法前处理过程包括液液分配至二氯甲烷层进行提取,中性氧化铝柱和阳离子固相柱的净化以及旋转蒸发浓缩等过程,步骤繁琐、费时费力,有毒试剂消耗量大等[28]。而本方法中样品直接用乙腈振荡提取,高速离心,冷冻除脂后,将上清液直接注入m-PFC小柱净化,净化一步完成,直接吸附杂质,无需活化淋洗洗脱,试剂用量少,无需浓缩,单个样品净化时间小于1 min。相比标准方法,具有步骤简单,省时省力、灵敏度高的优点,在保证实验结果准确度和精密度的前提下大大提升了检测效率,完全满足实验室检测的要求。
2.8 实际样品检测结果
以本研究所建立的m-PFC净化结合UPLC-MS/MS法,对市售的草鱼、罗非鱼、鲢鱼共3份水产品样品中的4种药物进行检测,结果均为未检出,与国标方法测定的结果一致。
3 结论
本研究采用m-PFC前处理净化技术,结合UPLC-MS/MS法,建立了水产品中MG及其代谢物LMG、CV及其代谢物LCV同时检测的分析方法。该方法单个样品净化时间<1 min,整个样品的前处理及分析时间能够在30 min内完成。4种药物的线性范围在0.1~6.0 ng/mL,检出限为0.05 μg/kg,定量限为0.2 μg/kg,其检出限较GB/T 19857—2005《水产品中孔雀石绿和结晶紫残留量的测定》的检出限值 (0.5 μg/kg) 降低近10倍。在 0.5、1、2、10 μg/kg 这4个添加水平下,方法平均回收率均在 71.1%~84%,RSD均小于14%,回收率较好且方法稳定。与传统前处理方法相比,所建立的方法具有操作简单、省时省力、灵敏度高,在保证实验结果准确度和精密度的前提下大大提升了检测效率,为孔雀石绿及其结晶紫在水产品中的残留测定提供了一种有效的技术支撑,同时为研发建立更快速、准确地检测水产品中药物残留的方法提供了新思路。
[1] MEYER F P, JORGENSON T A.Teratological and other effects of malachite green on development of rainbow trout and rabbits[J].Transactions of the American Fisheries Society, 1983, 112(6):818-824.
[2] DOERGE D R, CHANG H C, DIVI R L, et al.Mechanism for inhibition of thyroid peroxidase by leucomalachite green[J].Chemical Research in Toxicology, 1998, 11(9):1 098-1 104.
[3] CHA C J, DOERGE D R, CERNIGLIA C E.Biotransformation of malachite green by the Fungus Cunninghamella elegans[J].Applied and Environmental Microbiology, 2001, 67(9):4 358-4 360.
[4] 陈永平, 张素青, 李春青, 等.不同水产品中有色和无色孔雀石绿的降解动力学研究[J].食品安全质量检测学报, 2013, 4(1):183-188.
CHEN Y P, ZHANG S Q, LI C Q, et al.Studies on degradation kinetics of malachite green and leucomalachite green in different aquatic products[J].Journal of Food Safety and Quality, 2013, 4(1):183-188.
[5] 任维美. 孔雀石绿在美国禁用[J].国外水产, 1992 (3):45.
REN W M.Malachite green is banned in the United States[J].Fore Aqua Prod, 1992 (3):45.
[6] 中华人民共和国农业部. 农业部193号公告. 食品动物禁用的兽药及其化合物清单[EB/OL].(2002-4)[2021-01-19]. http://www.moa.gov.cn/.
Announcement No.193 of ministry of Agriculture of the People′s Republic of China. List of veterinary drugs and other compounds prohibited in animal foods[EB/OL].(2002-4)[2021-01-19].http://www.moa.gov.cn/.
[7] 施彩仙, 周亚莲, 马秋玲, 等.高效液相色谱法测定水产品中孔雀石绿及隐色孔雀石绿的残留[J].浙江农业科学, 2008, 49(6):774-776.
SHI C X, ZHOU Y L, MA Q L, et al.Rapid residue determination of malachite green and leucomalachite green in aquatic products by HPLC[J].Journal of Zhejiang Agricultural Sciences, 2008, 49(6):774-776.
[8] 王旭峰, 王强, 赵东豪, 等.超高效液相色谱-串联质谱法测定养殖水和沉积物中孔雀石绿、结晶紫及其代谢物残留[J].分析试验室, 2015, 34(6):702-706.
WANG X F, WANG Q, ZHAO D H, et al.Determination of malachite green,crystal violet and its metabolites residues in aquaculture water and sediment using ultra-high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2015, 34(6):702-706.
[9] 谢焕龙, 王宇, 徐振林, 等.基于混合抗体的酶联免疫分析方法同时检测孔雀石绿和隐孔雀石绿[J].现代食品科技, 2015, 31(12):325-330.
XIE H L, WANG Y, XU Z L, et al.Simultaneous detection of malachite green and leucomalachite green based on hybrid antibody ELISA analysis method[J].Modern Food Science and Technology, 2015, 31(12):325-330.
[10] 黄宝美, 姚程炜, 陈红.鱼类中孔雀石绿残留量的高效毛细管电泳检测[J].应用化学, 2007, 24(3):327-330.
HUANG B M, YAO C W, CHEN H.Determination of malachite green in fishes by capillary electrophoresis combined with conductive detection[J].Chinese Journal of Applied Chemistry, 2007, 24(3):327-330.
[11] GUO Z Y, GAI P P, HAO T T, et al.Determination of malachite green residues in fish using a highly sensitive electrochemiluminescence method combined with molecularly imprinted solid phase extraction[J].Journal of Agricultural and Food Chemistry, 2011, 59(10):5 257-5 262.
[12] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 20361—2006 水产品中孔雀石绿和结晶紫残留量的测定 高效液相色谱荧光检测法[S].北京:中国标准出版社, 2006.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Standardization administration of China.GB/T 20361—2006 Determination of malachite green and gentian violet residues in fishery products-High perfomance liquid chromatography with fluorescence detector[S].Beijing:China Standards Press, 2006.
[13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 19857—2005 水产品中孔雀石绿和结晶紫残留量的测定[S].北京:中国标准出版社, 2005.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Standardization administration of China.GB/T 19857—2005 Determination of malachite green and crystal violet residues in aquatic product[S].Beijing:China Standards Press, 2005.
[14] 王静, 杨洪生, 张美琴, 等.高效液相色谱-荧光检测法测定水产品中孔雀石绿代谢物残留量[J].理化检验-化学分册, 2010, 46(6):642-644;647.
WANG J, YANG H S, ZHANG M Q, et al.Determination of residual amounts of malachite green and its metabolite in aquatic products by high performance liquid chromatography with fluorescence detector[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2010, 46(6):642-644;647.
[15] 陈永平, 张素青, 李春青, 等.高效液相色谱法测定水产品中孔雀石绿残留量方法的改进[J].动物医学进展, 2011, 32(11):80-84.
CHEN Y P, ZHANG S Q, LI C Q, et al.Improving method of determination of residual amounts of malachite green in fishery products by high performance liquid chromatography[J].Progress in Veterinary Medicine, 2011, 32(11):80-84.
[16] 于宙, 谷小凤, 丁白瑜.液相色谱串联质谱法测定水产及其加工品中孔雀石绿[J].农产品加工, 2020 (2):53-56.
YU Z, GU X F, DING B Y.Determination of malachite green in aquatic products and their processed products by liquid chromatography-mass spectrometry[J].Farm Products Processing, 2020 (2):53-56.
[17] 梅光明, 郭远明, 陈雪昌, 等.超高效液相色谱-串联质谱法测定鱼粉中孔雀石绿[J].分析试验室, 2013, 32(8):73-76.
MEI G M, GUO Y M, CHEN X C, et al.Determination of malachite green residues in fish meal by UPLC-MS-MS[J].Chinese Journal of Analysis Laboratory, 2013, 32(8):73-76.
[18] 张艺蓓, 岳田利, 乔海鸥, 等.超高效液相色谱-串联质谱法检测鱼中孔雀石绿、结晶紫及其代谢物[J].食品科学, 2014, 35(10):179-184.
ZHANG Y B, YUE T L, QIAO H O, et al.Determination of malachite green, crystal violet and their metabolites in fishes by ultra performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2014, 35(10):179-184.
[19] 龚倩, 郗存显, 聂福平, 等.水产品中孔雀石绿AlphaLISA检测方法的建立[J].食品与发酵工业, 2017, 43(2):206-210.
GONG Q, XI C X, NIE F P, et al.Quantitative determination of malachite green in aquatic products using amplified luminescent proximity homogeneous assay[J].Food and Fermentation Industries, 2017, 43(2):206-210.
[20] 赵暮雨, 韩芳, 孙锦文, 等.多壁碳纳米管作为吸附剂的QuEChERS- 气相色谱-四极杆飞行时间质谱快速筛查淡水产品中145 种农药残留[J].分析测试学报, 2016, 35(12):1 513-1 520.
ZHAO M Y, HAN F, SUN J W, et al.Rapid screening of 145 pesticide residues in limnetic products by gas chromatography-quadrupole time of flight mass spectrometry and QuEChERS with multi-walled carbon nanotubes[J].Journal of Instrumental Analysis, 2016, 35(12):1 513-1 520.
[21] 潘灿平, 赵鹏跃.一种农药残留的净化方法及其专用净化器:中国, CN103055540B[P].2012-12-28.
PAN C P, ZHAO P Y.A Purification method for pesticide residues and its special purifier:China, CN103055540B [P].2012-12-28.
[22] 郝东宇, 席兴军, 初侨, 等.快速滤过型净化法结合高效液相色谱-串联质谱同时检测人参中的5种农药残留[J].农药学学报, 2019, 21(1):82-88.
HAO D Y, XI X J, CHU Q, et al.Simultaneous detection of five pesticide residues in ginseng by multi-plug filtration cleanup method combined with high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Pesticide Science, 2019, 21(1):82-88.
[23] 马立利, 贾丽, 周欣燃, 等.多壁碳纳米管滤过型净化柱净化-超高效液相色谱串联质谱法同时测定生姜中的涕灭威及其代谢物[J].色谱, 2014, 32(6):635-639.
MA L L, JIA L, ZHOU X R, et al.Analysis of aldicarb and its metabolites in ginger using ultra performance liquid chromatography-tandem mass spectrometry coupled with multiplug filtration clean upwith multiwalled carbon nanotubes[J].Chinese Journal of Chromatography, 2014, 32(6):635-639.
[24] 孟志娟, 黄云霞, 邸鹏月, 等.快速滤过型净化法结合气相色谱-四极杆-飞行时间质谱同时筛查果蔬中234种农药残留[J].食品科学, 2020, 41(16):272-285.
MENG Z J, HUANG Y X, DI P Y, et al.Rapid screening of 234 pesticide residues in vegetables and fruits by multi-plug filtration cleanup method combined with gas chromatography-quadrupole time of flight mass spectrometry[J].Food Science, 2020, 41(16):272-285.
[25] 黄云霞, 孟志娟, 赵丽敏, 等.快速滤过型净化结合气相色谱-串联质谱法同时检测茶叶中10种拟除虫菊酯农药残留[J].色谱, 2020, 38(7):798-804.
HUANG Y X, MENG Z J, ZHAO L M, et al.Determination of 10 pyrethroid pesticide residues in tea by gas chromatography-tandem mass spectrometry coupled with multi-plug filtration cleanup[J].Chinese Journal of Chromatography, 2020, 38(7):798-804.
[26] RAPOSO F, BARCEL D.Challenges and strategies of matrix effects using chromatography-mass spectrometry:An overview from research versus regulatory viewpoints[J].TrAC Trends in Analytical Chemistry, 2021, 134.DOI:10.1016/j.trac.2020.116068.
D.Challenges and strategies of matrix effects using chromatography-mass spectrometry:An overview from research versus regulatory viewpoints[J].TrAC Trends in Analytical Chemistry, 2021, 134.DOI:10.1016/j.trac.2020.116068.
[27] 马智玲, 赵 文, 李凌云, 等.气相色谱-三重四极杆串联质谱法快速测定蔬菜水果中129 种农药的残留量[J].色谱, 2013, 31(3):228-239.
MA Z L, ZHAO W, LI L Y, et al.Rapid determination of 129 pesticide residues in vegetables and fruits by gas chromatography-triple quadrupole mass spectrometry[J].Chinese Journal of Chromatography, 2013, 31(3):228-239.
[28] 王蓓蓓,李尔春,卫星华, 等.液质联用法测定水产品中孔雀石绿和隐色孔雀石绿残留量[J].食品安全质量检测学报, 2020, 11(6):1 827-1 832.
WANG B B, LI E C, WEI X H, et al.Determination of malachite green and leucomalachite green residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality, 2020, 11(6):1 827-1 832.