香辛料主要是指一类具有芳香、辛辣等典型风味的天然植物制品。在古时,人们就开始在饮食中使用一些具有刺激性的芳香植物,其精油含量较高,有强烈的呈味、呈香作用,不仅能促进食欲,改善食品风味,还具有抗氧化的作用。香辛味香料种类繁多,其中,有热感和辛辣感的香料主要包含辣椒、胡椒、花椒等。食用色素又称食品着色剂,消费者可适量食用,其在一定程度上能改变食品原有颜色的食品添加剂,分为天然着色剂和合成着色剂两大类[1]。合成着色剂由苯、甲苯和萘等化工产品经化学合成而制成[2],因其具有色泽鲜艳、着色力强、颜色多样、价格低廉等优点,在现代食品工业中应用广泛。然而,合成色素中含砷、铅、铜、苯酚、苯胺、乙醚、氯化物和硫酸盐,大量食用会对人体造成不同程度的危害,可能导致生育力下降,增加人体的致癌率,加重或恶化多动症症状。近年来,因非法添加合成色素而引发的食品安全事件屡见不鲜,如辣椒制品中的苏丹红、香辛料中的罗丹明B[3]、香肠中的胭脂红等。
目前,食品中非法使用合成色素的现象主要包括3种情况,即超标、超范围和非法使用添加物,为此,各国都建立了严格的法律法规加以规范。我国GB 2760—2014《食品安全国家标准 食品添加剂使用标准》对食品中允许使用的合成色素种类、使用范围和限量进行了详细的规定。食品中合成色素的检测技术多种多样,包括分光光度法 [4]、酶联免疫法 [5-6]、薄层色谱法[7]、拉曼光谱法 [8-9]、毛细管电泳法 [10-11]、示波极谱法 [12]、以及HPLC[13-14]。相较于其他方法,HPLC分离效果好、灵敏度高、应用范围广[15]、检测低限低。国内对柠檬黄、苋菜红、胭脂红、日落黄及诱惑红这5种色素主要依据标准GB/T 5009.35—2016、SN/T 1743—2016,采用HPLC法进行检测。香辛料产品基质复杂,油脂含量高,粉末细腻,常用的前处理方法为溶剂提取法[16-17]、聚酰胺吸附法[18-20]和固相萃取法[21-24]。溶剂提取法操作简单,但提取率低,对复杂基质的样品提取不完全;聚酰胺吸附法操作繁琐,含大量脂肪和大分子的物质还需要经葡聚糖凝胶色谱进一步净化。更为重要的是,这2种方法均不适用于香辛料类产品,因此,有必要建立一种简单、准确、有效的样品前处理方法对香辛料中合成色素进行检测。
本文结合样品基质特点,通过研究香辛料中柠檬黄、苋菜红、胭脂红、日落黄、诱惑红5种合成着色剂的前处理方法,建立了由正己烷脱脂,乙腈-水除杂,聚酰胺固相萃取柱净化富集,乙醇-氨水-水提取色素的前处理方法。本检测方法高效、准确、可操作性强,为今后复杂基质中多种合成着色剂的提取检测和标准制定提供了一定的理论依据。
1 材料与方法
1.1 标准品
柠檬黄、日落黄、胭脂红、诱惑红、亮蓝标准品,中国计量科学研究院,质量浓度均为1 000 μg/mL。
1.2 材料与仪器
实验材料:香辛料来源于市售,均质后室温贮藏;甲醇、乙腈(色谱纯),德国默克公司;乙酸铵(色谱纯)、聚酰胺粉小柱,美国Cleanert;所有实验室用水为一级水。
实验仪器:U3000高效液相色谱仪,Thermo Fisher公司;CT14RD高速冷冻离心机,TECHCOMP公司;氮吹仪,ANPEL公司。
1.3 仪器条件
高效液相色谱条件:色谱柱:Waters Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm),柱温:35 ℃;检测器:二极管阵列检测器,扫描范围:400~800 nm;流动相A为乙酸铵溶液(0.2 mol/L),流动相B为甲醇;流速:1.0 mL/min,进样量10 μL;采用的梯度洗脱程序见表1。
表1 液相色谱流动相梯度洗脱程序
Table 1 The gradient elution program of LC

时间/min流速/(mL·min-1)A/%B/% 0.01.09553.01.065357.01.0010010.01.0010010.11.095521.01.0955
1.4 样品提取
称取2.000 g样品置于50 mL刻度离心管中,加入20 mL正己烷,涡旋振荡5 min,4 000 r/min离心 5 min,弃去正己烷层,再用正己烷重复脱脂3次。脱脂后的样品置于70 ℃水浴挥干残留的正己烷。向样品中加入10 mL乙腈-水(体积比,9∶1)溶液,超声30 min,离心取上清液,用乙腈-水溶液重复提取2次,合并提取液,70 ℃水浴氮吹干;向上述样品中再加入10 mL水提取,重复提取直至提取液无色或近无色,将水层合并至氮吹干的乙腈提取液离心管中,涡旋混匀。将上述溶液全部置于聚酰胺固相萃取小柱净化,待试样全部流出后,依次用 6 mL 0.5%(体积分数)甲酸-甲醇溶液,6 mL水清洗,弃去全部流出液,抽干。用6 mL乙醇-氨水-水(体积比,7∶2∶1)洗脱,收集洗脱液,置80 ℃水浴氮吹至干,用1 mL水涡旋定容,经0.45 μm水相滤膜过滤后供液相色谱分析。
2 结果与分析
2.1 样品前处理方法优化
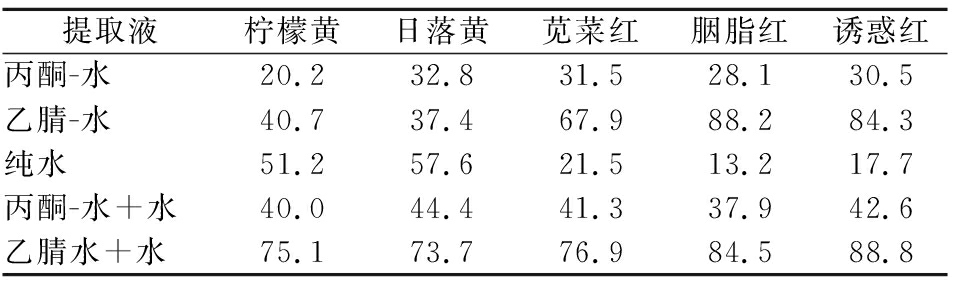
由于香辛料基质复杂,油脂含量大,粉末细腻,对后期聚酰胺小柱过柱效率影响极大,提取液的选择对5种色素的提取效率影响显著。本实验以花椒粉(n=30)为预实验对象,考察了:(1)丙酮-水(体积比,8∶2);(2)乙腈-水(体积比,9∶1);(3)纯水;(4)丙酮-水和水2次提取;(5)乙腈-水和水2次提取对加标回收样品的提取效果。5种提取方法对柠檬黄、日落黄、胭脂红、苋菜红、诱惑红的加标回收见表2。
表2 不同提取方法对5种合成色素的加标回收率 单位:%
Table 2 Recoveries of five synthetic pigments by different extraction methods
提取液柠檬黄日落黄苋菜红胭脂红诱惑红丙酮-水20.232.831.528.130.5乙腈-水40.737.467.988.284.3纯水51.257.621.513.217.7丙酮-水+水40.044.441.337.942.6乙腈水+水75.173.776.984.588.8
由表2可见,水对柠檬黄、日落黄的提取效果较好,乙腈水对苋菜红、胭脂红、诱惑红的提取效果最优,因此,选取乙腈水+水2次提取的方式进行优化研究。
2.2 检测波长的选择
使用二极管阵列检测器,被测物质的定性分析不仅可以通过保留时间进行确定,还可通过光谱吸收曲线的模式图形状、最大吸收波长、峰纯度分析等参数进行辅助定性分析,以提高高效液相色谱的定性分析能力,采用分段扫描的方式,使每一种合成色素出峰处都处于其最大吸收波长处。各组分的最大吸收波长如表3所示,液相色谱图如图1所示。
表3 五种合成色素的最大吸收波长
Table 3 The maximum absorbance wavelength of five synthetic pigments
色素种类柠檬黄日落黄苋菜红胭脂红诱惑红最大吸收波长/nm426.7486.2521.6509.4508.2
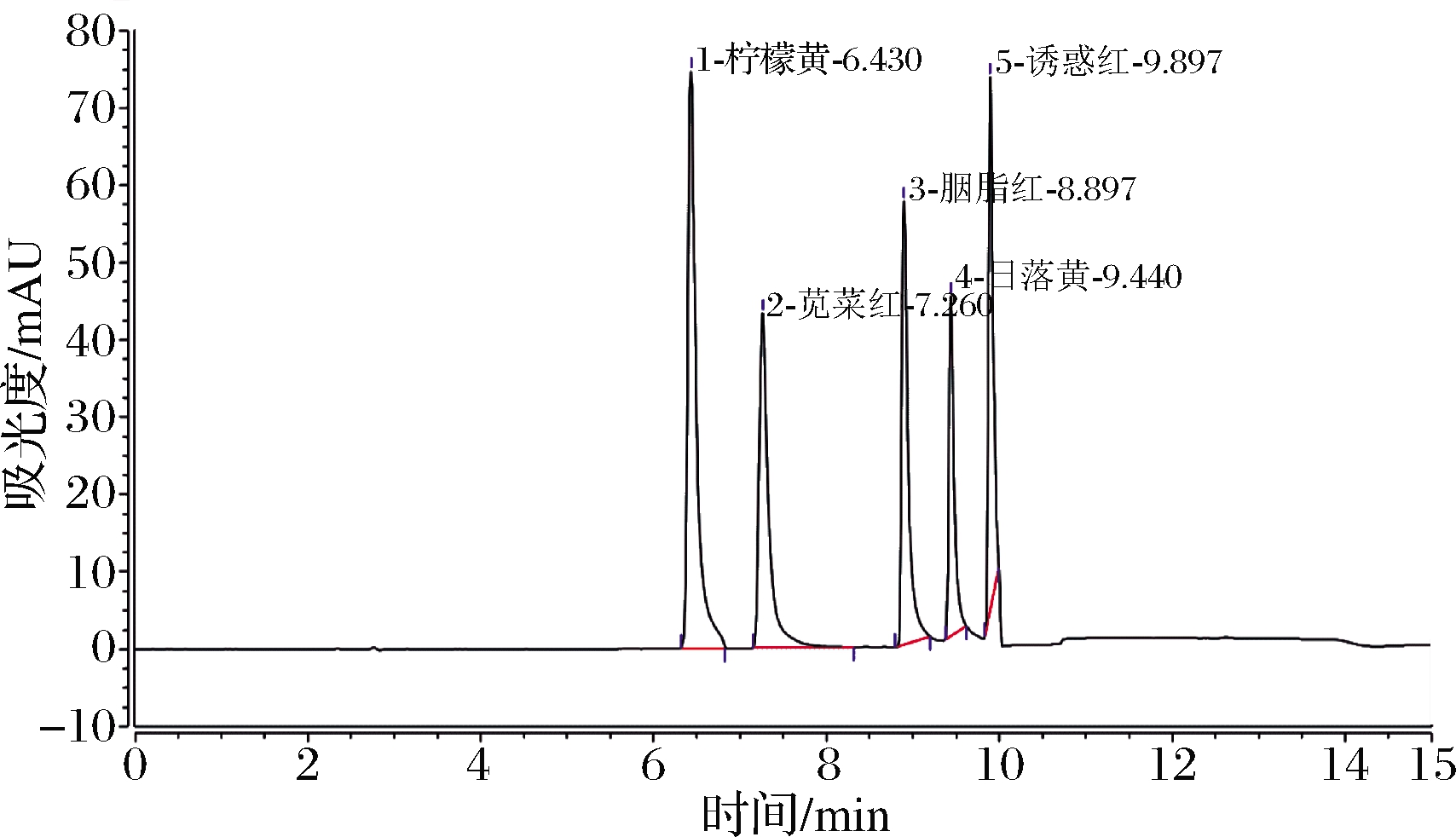
图1 五种合成色素的混合标准品色谱图(质量浓度为10 μg/mL)
Fig.1 HPLC chromatogram of mixed standard (10 μg/mL)
2.3 方法验证
采用空白基质(辣椒、花椒粉)加标回收的方式对上述样品前处理过程及液相条件进行方法验证。依照GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》[25]从检出限(limits of detection,LOD)、定量限(limit of quantitation,LOQ)、线性(r)、准确度(加标回收率)、精密度(重现性,RSD)对方法进行评估。其中,以定性离子通道信噪比(S/N)为3时样品溶液种目标化合物的质量浓度为LOD。
2.3.1 线性关系与检测低限
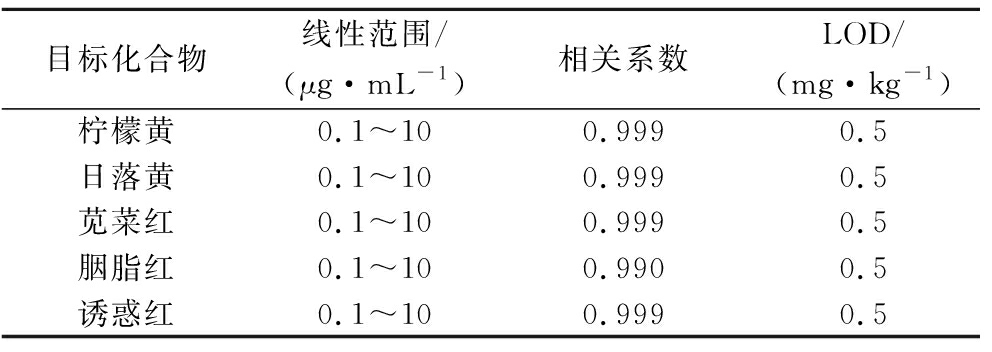
由于本研究方法为外标定量法,以峰面积为纵坐标,目标化合物浓度为横坐标进行线性回归,结果如表4所示,5种合成色素的相关性系数(r)均大于0.999,浓度范围内线性关系良好。表4中同样列出了方法的LOD。
表4 五种合成色素线性相关系数和检出限
Table 4 r values of the matrix-matched calibration curves, supplemented with limits of detection (LOD) for all analytes
目标化合物线性范围/(μg·mL-1)相关系数LOD/(mg·kg-1)柠檬黄0.1~100.9990.5日落黄0.1~100.9990.5苋菜红0.1~100.9990.5胭脂红0.1~100.9900.5诱惑红0.1~100.9990.5
2.3.2 回收率与精密度
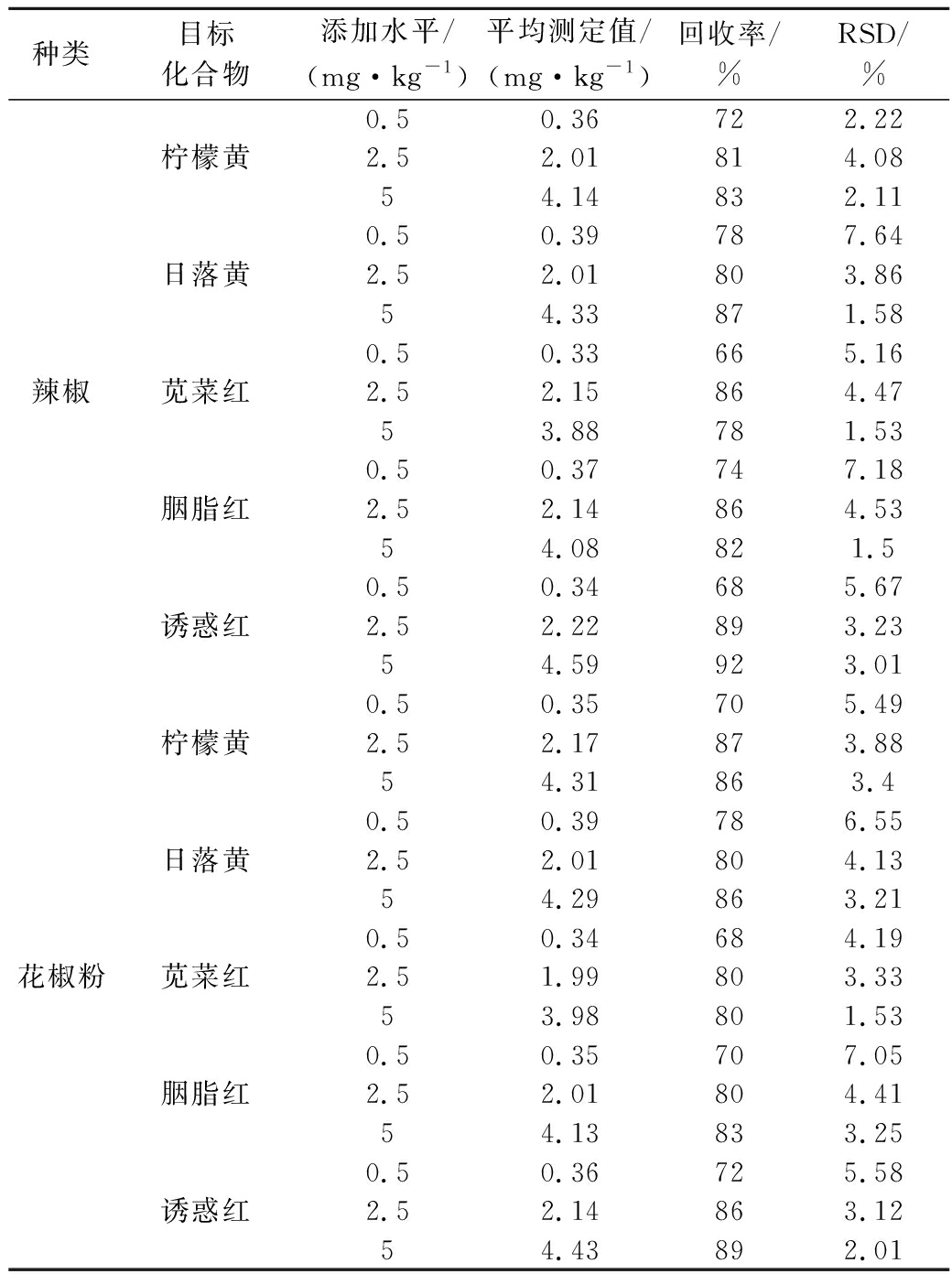
在空白辣椒、花椒粉样品中添加3个浓度水平的合成色素混合标准溶液,每个添加水平6个平行样品,计算回收率和精密度,结果见表5。辣椒样品中色素添加量为0.5~5 mg/kg时,回收率为66%~92%、相对偏差(RSD)为1.5%~7.7%,说明方法准确性、精密度良好。
表5 方法、回收率及精密度(n=6)
Table 5 Relative abundance ratio deviatio, recovery and precision of the method (n=6)
种类目标化合物添加水平/(mg·kg-1)平均测定值/(mg·kg-1)回收率/%RSD/%0.50.36722.22柠檬黄2.52.01814.0854.14832.110.50.39787.64日落黄2.52.01803.8654.33871.580.50.33665.16辣椒苋菜红2.52.15864.4753.88781.530.50.37747.18胭脂红2.52.14864.5354.08821.50.50.34685.67诱惑红2.52.22893.2354.59923.010.50.35705.49柠檬黄2.52.17873.8854.31863.40.50.39786.55日落黄2.52.01804.1354.29863.210.50.34684.19花椒粉苋菜红2.51.99803.3353.98801.530.50.35707.05胭脂红2.52.01804.4154.13833.250.50.36725.58诱惑红2.52.14863.1254.43892.01
2.4 市售香辛料中5种合成色素含量分析
在优化、验证了前处理方法和仪器条件后,对市售辣椒、花椒粉(n=70+35)进行了采样并处理分析。结果表明,柠檬黄、苋菜红、胭脂红、日落黄、诱惑红在105个样本中均未检出,暴露水平低。通过平行样品的测定发现,此方法重现性好、准确度高、灵敏度强,能满足日常对于香辛料中合成色素检测的需求。
2.5 本文方法与国标方法的差异性讨论
目前,对食品中合成色素的检测主要依据GB 5009.35—2016[26],但该法适用的食品种类不包含辣椒、花椒粉,故前处理过程无脱脂、去油的过程,仅使用温水溶解,采用聚酰胺粉吸附色素,最后用水定容。图2为空白辣椒样品(图2-a)、加标样品按国标法提取(图2-b)、相同加标量加标样品按本文前处理方法提取(图2-c)的液相色谱图。由图2可知,按照国标法处理辣椒样品,回收率仅有20%,对5种合成色素的提取率极低,同时杂质提取不完全也会对检测器和色谱柱产生较大的损伤;而使用本文的前处理方法则能很好地去除样品中的杂质,采用聚酰胺小柱替代聚酰胺粉,使实验过程更简单,避免了重复洗脱的过程,缩短了实验时长,同时大大提高了5种合成色素的回收率(70%~80%)。
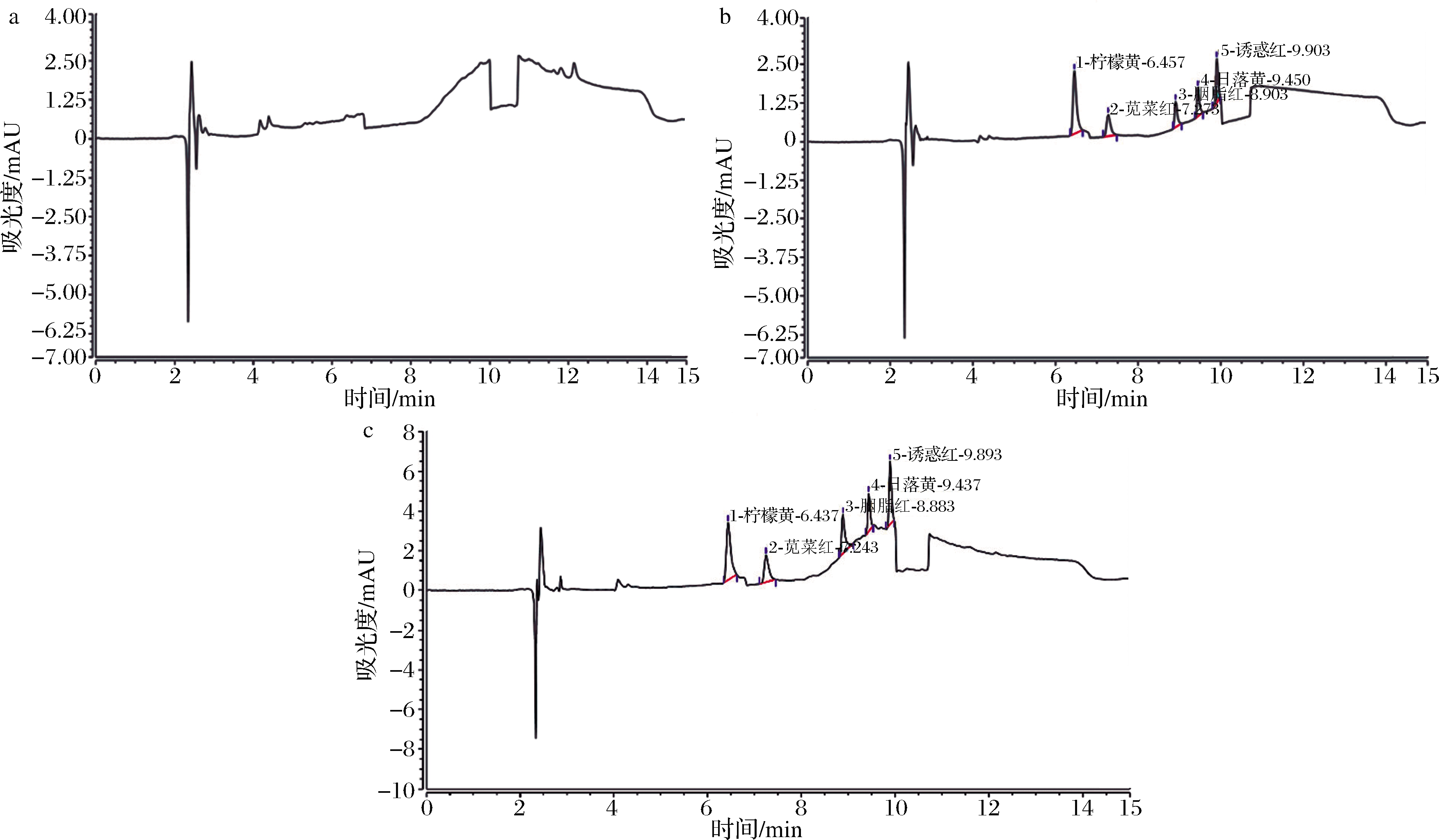
a-样品;b-国标法加标回收;c-本方法加标回收
图2 样品、国标法加标回收、本方法加标回收的HPLC色谱图
Fig.2 HPLC chromatogram of sample, extracted by GB 5009.35—2016, extracted by n-hexane, CN and water
3 结论
本研究采用HPLC法对国产市售辣椒、花椒粉中柠檬黄、苋菜红、胭脂红、日落黄、诱惑红5种合成色素进行了检测,使用正己烷脱脂的方法,降低油脂对小柱净化的影响,以乙腈-水和水2次提取合并提取液的方法,提高了提取效率,采用外标法定量,效果良好。本方法可以准确检测香辛料中合成色素的含量水平,方法检出限为0.5 mg/kg,满足国内外的检测要求,并可适用于其他复杂基质的多种合成色素的检测,为食品安全检测和风险监测工作提供技术支持。
[1] 赵飞.食用合成色素及其检测技术的研究进展[J].食品安全导刊,2012(Z1):32-33.
ZHAO F.Research progress of edible synthetic pigment and its detection technology [J].China Food Safety, 2012 (Z1):32-33.
[2] 李强,韩国善.食品检测中合成着色剂测定方法的探讨[J].中外食品工业,2014(2):30;32.
LI Q, HAN G S.Discussion on the measurement method of synthetic colorant in food test[J].Sino-Foreign Food Industry,2014(2):30;32.
[3] 葛宇.食品中人工合成色素使用法规及检测标准进展[J].质量与标准化,2011(9):31-35.
GE Y.The progress of artificial synthetic pigment usage regulations and testing standards in food [J].Quality and Standardization, 2011 (9):31-35.
[4] LAU O W, POON M M K, MOK S C, et al.Spectrophotometric determination of single synthetic food colour in soft drinks using ion-pair formation and extraction[J].International Journal of Food Science & Technology,1995,30(6):793-798.
[5] 任立松,卢士英,周玉,等.柠檬黄色素免疫学检测方法的研究[J].食品科学,2009,30(12):258-261.
REN L S, LU S Y, ZHOU Y, et al.Immunoassay determination of tartrazine[J].Food Science,2009,30(12):258-261.
[6] ZHANG B, DU D L, YIN Y M, et al.A direct enzyme immunoassay to detect erythrosine in foods[J].Food Analytical Methods,2014,7(9):1 798-1 803.
[7] ![]() P, et al.Development and validation of a TLC method for the analysis of synthetic food-stuff dyes[J].Journal of Liquid Chromatography & Related Technologies,2013,36(17):2 476-2 488.
P, et al.Development and validation of a TLC method for the analysis of synthetic food-stuff dyes[J].Journal of Liquid Chromatography & Related Technologies,2013,36(17):2 476-2 488.
[8] 逯美红,雷海英,王志军,等.几种人工合成色素的荧光光谱与拉曼光谱研究[J].量子电子学报,2014,31(1):12-17.
LU M H, LEI H Y, WANG Z J, et al.Fluorescence spectra and Raman spectra of several synthetic food colors[J].Chinese Journal of Quantum Electronics, 2014,31(1):12-17.
[9] KELLER S, LÖCHTE T, DIPPEL B, et al.Quality control of food with near-infrared-excited Raman spectroscopy[J].Fresenius′ Journal of Analytical Chemistry,1993,346(6-9):863-867.
[10] DEL GIOVINE L, PICCIOLI BOCCA A.Determination of synthetic dyes in ice-cream by capillary electrophoresis[J].Food Control,2003,14(3):131-135.
[11] LIU H W, ZHU T, ZHANG Y N, et al.Determination of synthetic colourant food additives by capillary zone electrophoresis[J].Journal of Chromatography A,1995,718(2):448-453.
[12] 宋新,纪双利,杨丽,等.示波极谱法在食品合成食用色素测定中的应用[J].中国食品卫生杂志,2009,21(5):422-423.
SONG X, JI S L, YANG L, et al.Application of oscillopolarography in synthetic food colorants determination[J].Chinese Journal of Food Hygiene, 2009, 21(5):422-423.
[13] 中华人民共和国国家卫生和计划生育委员会. GB 5009.35—2016食品安全国家标准 食品中合成着色剂的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of the PRC.GB 5009.35—2016 National Food Safety Standard Determination of synthetic colorants in food stuffs[S].Beijing:Standards Press of China,2016.
[14] 中华人民共和国国家质量监督检验检疫总局.SN/T1743—2006食品中诱惑红、酸性红、亮蓝、日落黄的含量检测高效液相色谱法 [S].北京:中国标准出版社,2006.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China.SN/T 1743—2006 Determination of allure red AC,carmosine,brillint blue FCF,sunset yellow FCF in food-high performance liquid chromatographic method [S].Beijing:Standards Press of China,2006.
[15] 宋丹萍,张宏,李琪.国内外食用色素标准的比较及检测方法的研究进展[J].食品科学,2014,35(3):295-300.
SONG D P, ZHANG H, LI Q.Comparison of national standards for edible pigments between China and foreign countries and progress on analytical techniques [J].Food Science,2014,35(3):295-300.
[16] 吴彦蕾,林晓洋,胡靖,等.高效液相色谱法快速检测食品中18种合成色素[J].食品工业科技,2013,34(24):49-52;56.
WU Y L, LIN X Y, HU J, et al.Fast determination of 18 synthetic colors in foods by high performance liquid chromatography[J].Science and Technology of Food Industry,2013,34(24):49-52;56.
[17] 霍艳敏,王骏,张卉,等.高效液相色谱法同时测定冰淇淋中的10种合成色素[J].分析测试学报,2011,30(6):670-673.
HUO Y M, WANG J, ZHANG H, et al.Simultaneous determination of ten synthetic colours in ice-cream by high performance liquid chromatography [J].Journal of Instrumental Analysis,2011,30(6):670-673.
[18] 孔聪,沈晓盛,于慧娟,等.富含蛋白食品中的8种合成色素的高效液相色谱测定方法[J].食品安全质量检测学报,2014, 5(12):4 085-4 091.
KONG C, SHEN X S, YU H J, et al.Determination of 8 synthetic food colorants in protein-rich samples with high performance liquid chromatography[J].Journal of Food Safety and Quality,2014, 5(12):4 085-4 091.
[19] 王涛,方猛,余成,等.高效液相色谱法测定冰淇淋中6种人工合成色素[J].中国科技财富,2011 (24):61-62.
WANG T, FANG M, YU C, et al.Simultaneous determination of six synthetic colors in ice-cream by high performance liquid chromatography[J].Fortune World,2011 (24):61-62.
[20] 黄建蓉,杨洋.雪糕中合成色素的测定[J].中国食品添加剂,2010(3):228-231.
HUANG J R, YANG Y.Determination of synthetic colorants in ice-cream bar[J].China Food Additives,2010(3):228-231.
[21] MAZDEH F Z, KHORRAMI A R, MORADI-KHATOONABADI Z, et al.Determination of 8 synthetic food dyes by solid phase extraction and reversed-phase high performance liquid chromatography [J].Tropical Journal of Pharmaceutical Research,2016,15(1):173-181.
[22] YANG Y, ZHANG J, SHAO B.Quantitative analysis of fourteen synthetic dyes in jelly and gummy candy by ultra performance liquid chromatography[J].Analytical Methods,2014,6(15):5 872-5 878.
[23] GONZ LEZ M, GALLEGO M, VALCáRCEL M.Liquid chromatographic determination of natural and synthetic colorants in lyophilized foods using an automatic solid-phase extraction system[J].Journal of Agricultural and Food Chemistry,2003,51(8):2 121-2 129.
LEZ M, GALLEGO M, VALCáRCEL M.Liquid chromatographic determination of natural and synthetic colorants in lyophilized foods using an automatic solid-phase extraction system[J].Journal of Agricultural and Food Chemistry,2003,51(8):2 121-2 129.
[24] 宗珊盈,张轩,李超,等.固相萃取-HPLC-MS/MS法同时测定食品中6种人工合成着色剂[J].中国食品添加剂,2016(5):152-156.
ZONG S Y, ZHANG X, LI C, et al.Simultaneous determination of 6 kinds of synthetic pigments in foods by using solid-phase extraction coupled with HPLC-MS/MS[J].China Food Additives, 2016(5):152-156.
[25] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 27417—2017 合格评定化学分析方法确认和验证指南[S].北京:中国标准出版社, 2017.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, Standardization administration of China.GB/T 27417—2017 Comformity assessment-Guidance on validation and verification of chemical analytical methods[S].Beijing:Standards Press of China,2017
[26] 中华人民共和国国家卫生和计划生育委员会.GB 5009.35—2016 食品安全国家标准 食品中合成着色剂的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.35—2016 National Food Safety Standard Determination of synthetic colorants in foodstuffs [S].Beijing:Standards Press of China,2016.