红糖又称“非分蜜糖”,是甘蔗的茎汁经浓缩而成的带蜜糖。与精制糖相比,红糖中含有较高含量的必需氨基酸、维生素和矿物营养元素,是一种高营养食品[1-3]。红糖还具有补血活血、抗龋齿、预防糖尿病和高血压等保健功效,这与红糖中参与代谢的微量元素相关[4]。由于受甘蔗品种、加工工艺、贮存方式等因素的影响,红糖中无机元素的含量存在一定差异。因此,建立准确快速的方法测定红糖中无机元素含量,对控制红糖的品质以及保障食用者的健康具有重要意义。
目前,食品中无机元素的测定方法主要有:原子荧光光谱法、原子吸收光谱法、电感耦合等离子体发射光谱法和电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)法[5-8],其中,ICP-MS法具有灵敏度高、检出限低、可进行多元素同时测定等优点,已列入GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》的第一法[9],尤其适合食品中微量和痕量元素的分析。采用光谱分析法或ICP-MS法测定食品中无机元素前,一般需要进行前处理,使固体样品转化为溶液引入仪器检测。目前,样品前处理所用方法以微波消解居多,GB 5009.268—2016和参考文献报道,微波消解使用浓硝酸或浓硝酸+过氧化氢体系对样品进行前处理[9-12],样品消解彻底,空白值低,但浓酸的使用增加了试剂用量、消解液酸残留和废弃酸的排放。稀酸微波消解法主要采用稀硝酸+过氧化氢体系对样品进行消解[13-15],与浓酸微波消解法相比,不仅样品消解彻底、空白值低,而且有效减少了试剂用量、消解液酸残留和废弃酸的排放。目前,使用稀酸微波消解处理红糖样品,ICP-MS检测其无机元素含量的方法鲜见报道。
本文拟采用稀硝酸和过氧化氢为消解体系对红糖样品进行前处理,通过优化硝酸浓度、过氧化氢体积和消解时间,并结合ICP-MS对其中Mn、Fe、Co、Cu、Zn和Sr 6种营养元素进行分析,以期建立一种红糖中营养元素简单、准确且环保的测试方法。
1 材料与方法
1.1 材料与试剂
多元素标准储备液(含Mn、Fe、Co、Cu、Zn和Sr,质量浓度均为100 μg/mL)、内标混合溶液(含Sc、Ge和Rh,质量浓度均为100 μg/mL),国家有色金属及电子材料分析测试中心,使用前用0.288 mol/L硝酸稀释至浓度均为1 μg/mL的内标使用液;调谐液(Ce、Co、Li、Mg、Tl和Y,质量浓度均为1 μg/L),美国安捷伦公司;30%过氧化氢(电子级),苏州晶瑞化学股份有限公司;65%浓硝酸(优级纯),德国Merck公司;试验用水均为超纯水(电阻率>18 MΩ·cm)。
1.2 仪器与设备
Agilent 7900型电感耦合等离子体质谱仪,美国安捷伦公司;ETHOS UP型微波消解仪,意大利Milestone公司;VB24 UP型智能样品处理器,北京Lab Tech公司;PURELAB Chorus1 Complete型超纯水仪,英国ELGA LabWater公司;ML204T/02型电子天平,瑞士Mettler Toledo公司。经优化的ICP-MS工作参数列于表1。
表1 ICP-MS工作参数
Table 1 The working parameters of ICP-MS

仪器参数设定值仪器参数设定值射频功率 1 550 W雾化室温度2 ℃雾化气流量 1.00 L/min氦气流量5.0 mL/min辅助气流量 0.90 L/min调谐模式氦气模式蠕动泵 0.10 r/min氧化物比率<2%等离子气流量15.0 L/min双电荷比率<3%
1.3 试验方法
1.3.1 标准溶液的配制
分别精密量取多元素标准储备液1.0和10.0 mL至100 mL容量瓶中,用0.288 mol/L硝酸定容,配制成Mn、Fe、Co、Cu、Zn、Sr质量浓度为1.0和10.0 μg/mL的标准中间液。再分别精密量取1.0和10.0 μg/mL标准中间液0.00、0.10、0.50、1.00、3.00、5.00 mL至100 mL容量瓶中,用0.288 mol/L硝酸稀分别释成Co、Cu、Sr质量浓度为0、1.0、5.0、10.0、30.0、50.0 μg/L和Mn、Fe、Zn质量浓度为0、10.0、50.0、100、300、500 μg/L的系列标准溶液。
1.3.2 稀酸微波消解法
称取0.25 g(精确至0.000 1 g)样品于80 mL聚四氟乙烯消解罐中,加入7 mL浓度分别为1.0、2.1、4.2和6.3 mol/L的硝酸溶液和不同体积的过氧化氢(0、0.5、1和2 mL),旋紧罐盖,放入消解仪,按照升温程序:5 min从室温升至120 ℃,保持2 min,然后10 min从120 ℃升至190 ℃,在190 ℃分别保持不同的反应时间(10、20和30 min)。消解完毕,待消解罐冷却,将消解液转移至50 mL容量瓶中,用少量超纯水冲洗消解罐3~4次,合并洗涤液于容量瓶中,加水定容至刻度。用相同的方法做空白试验。
1.3.3 浓酸微波消解法
参考GB 5009.268—2016中电感耦合等离子体质谱法,称取0.25 g(精确至0.000 1 g)红糖样品,使用微波消解法处理,ICP-MS测定各元素含量。
2 结果与分析
2.1 消解条件的选择
随机选取颜色较深的红糖(HT1)为试验样品。称取样品0.25 g(精确至0.000 1 g),设置微波消解最高温度为190 ℃[9,16-17],考察硝酸浓度、过氧化氢体积和消解时间对元素回收率的影响。回收率为不同消解条件下,测定的样品质量浓度与浓酸微波消解法测定的质量浓度的比值(用百分比表示)[17-18]。
2.1.1 硝酸浓度
采用1.0、2.1、4.2和6.3 mol/L硝酸溶液消解样品,考察硝酸浓度对各元素回收率的影响。图1显示,随着硝酸浓度的增加,各元素回收率无明显变化,总体回收率为93%~105%,相对标准偏差(relative standard deviation, RSD)≤3%。综合考虑消解效果和试剂用量,选择硝酸的浓度为1 mol/L。
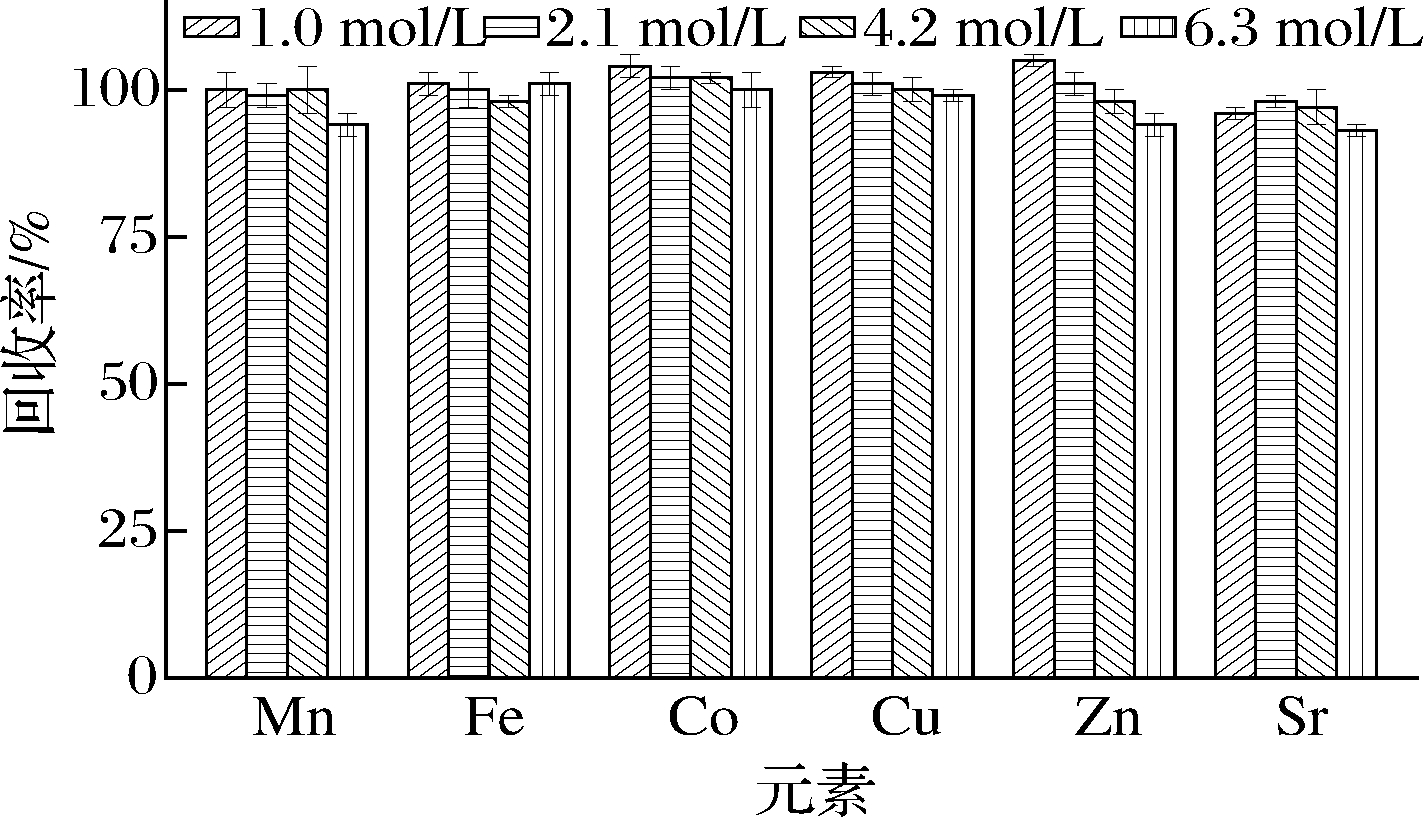
图1 硝酸浓度对元素回收率的影响(n=3)
Fig.1 Effect of HNO3 concentration on the recoveries of elements(n=3)
2.1.2 过氧化氢体积
采用0、0.5、1和2 mL过氧化氢消解样品,考察加入不同体积的过氧化氢对各元素回收率的影响。当加入过氧化氢0和0.5 mL时,消解液外观分别呈黄色和淡黄色,有较多悬浮物;当加入1 mL过氧化氢时,消解液呈无色透明,悬浮物基本消失,样品消解效果较好;当过氧化氢加入量增加至2 mL时,消解液的外观无明显变化。由图2可知,过氧化氢加入1 mL时,6种元素的回收率(95%~109%)最好,RSD≤5%。综上,选择过氧化氢的加入体积为1 mL。
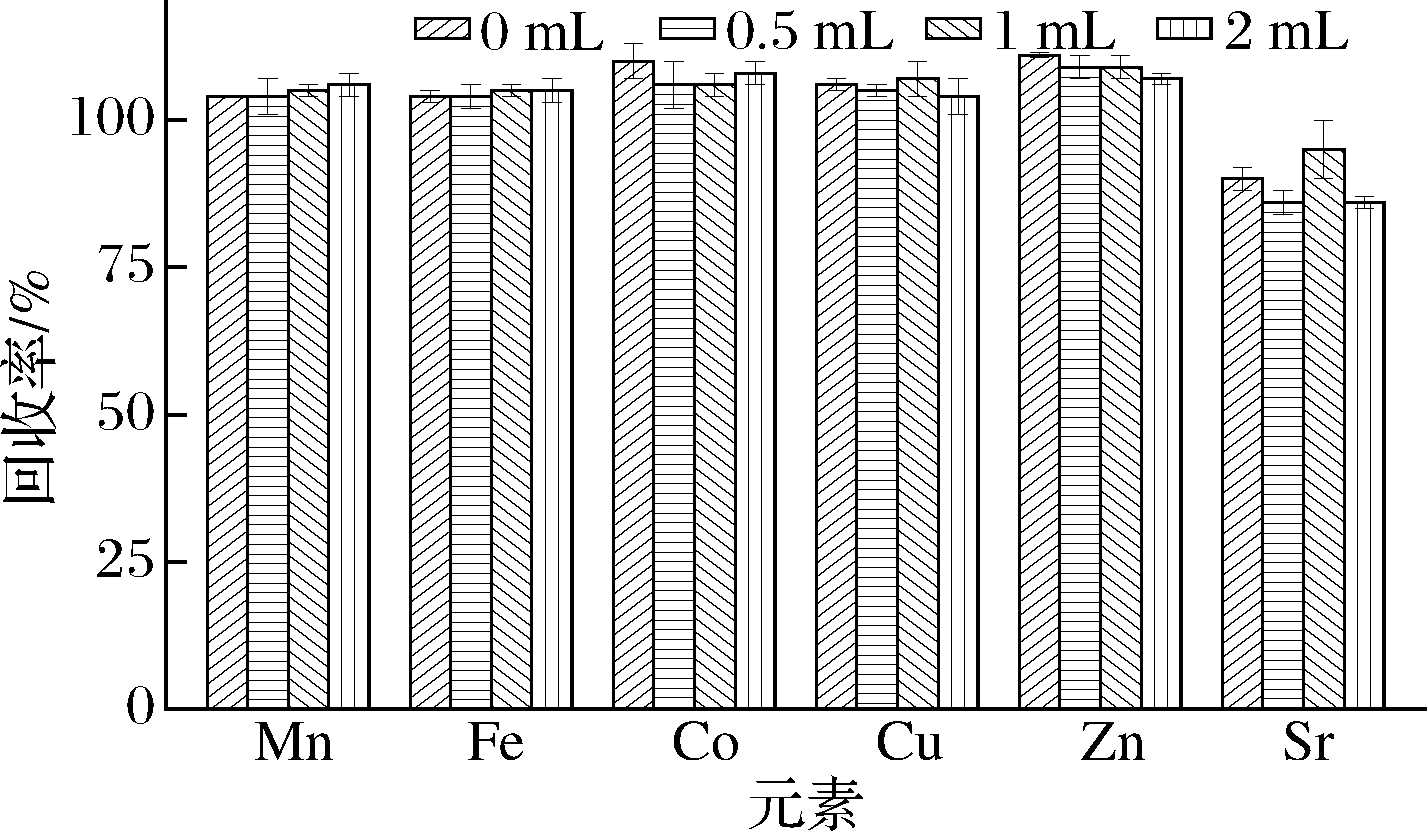
图2 过氧化氢加入量对元素回收率的影响(n=3)
Fig.2 Effect of H2O2 volume on the recoveries of elements(n=3)
2.1.3 消解时间
分别设置消解时间为27、37和47 min,考察不同消解时间对各元素回收率的影响。由图3可知,各元素回收率受消解时间的影响较小,总体回收率为94%~105%。其中消解时间为27 min时,各元素的回收率为95%~103%,RSD≤3%,回收率和稳定性最佳。因此,选择消解时间为27 min。
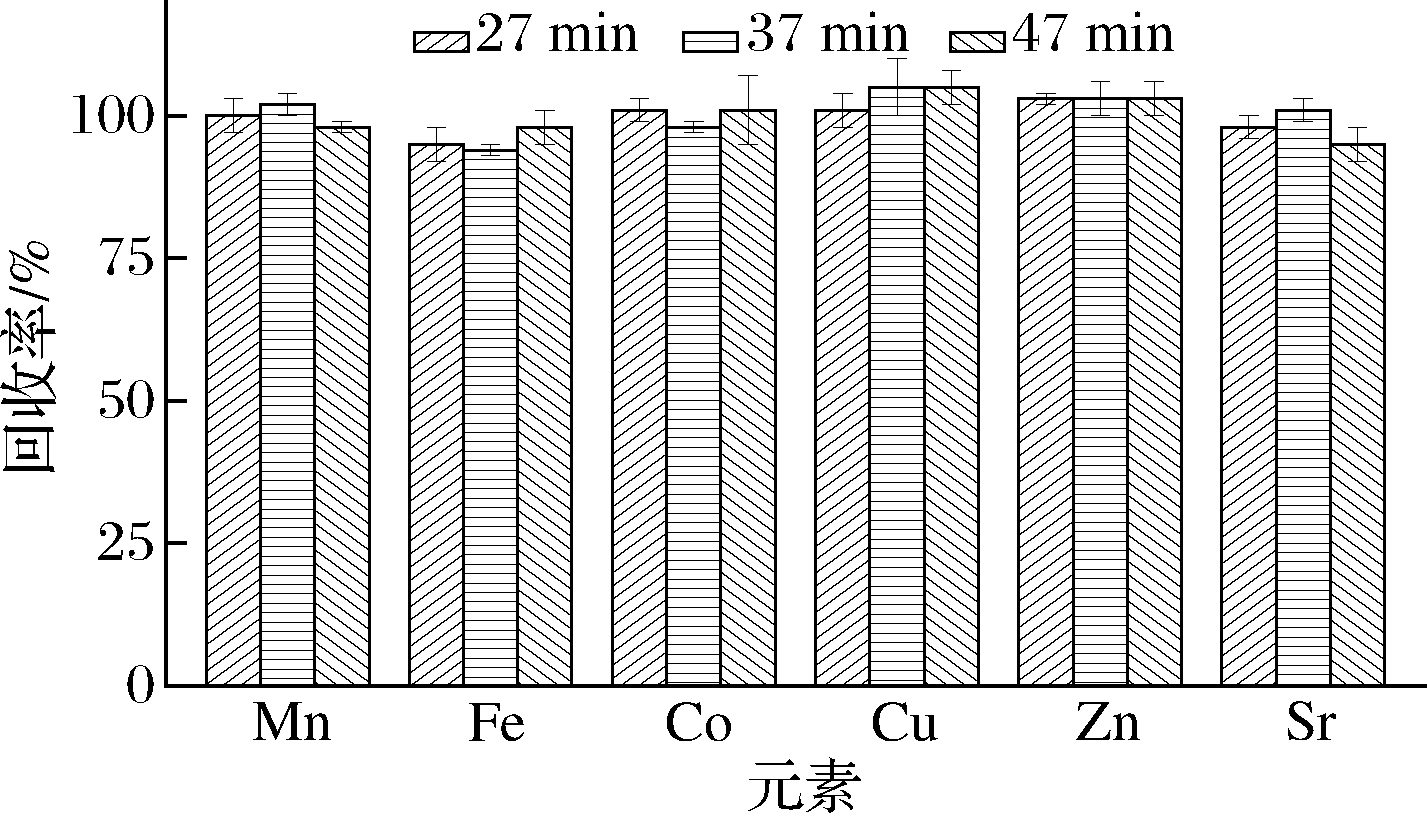
图3 消解时间对元素回收率的影响(n=3)
Fig.3 Effect of digestion time on the recoveries of elements(n=3)
2.2 ICP-MS干扰的排除
红糖中钾、钙、镁的含量较高[3],在测试过程中分析信号存在明显漂移现象,元素Mn、Fe、Co、Cu、Zn、Sr受到一定的基体干扰和质谱干扰。实验在配制标准溶液时,使标准溶液中硝酸的浓度和空白、样品溶液匹配,且对不同元素选用质量数接近、化学性质相似的内标元素:元素Mn、Fe选择45Sc为内标元素,Co、Cu、Zn选择72Ge为内标元素,Sr选择103Rh为内标元素,并通过蠕动泵和T型混合三通在线引入1 μg/mL的内标溶液较好地消除基体干扰,改善方法的精密度。通过优化仪器工作参数(表1),对不同元素选用丰度大、灵敏度高、干扰小的同位素(55Mn、56Fe、59Co、63Cu、66Zn和88Sr),采用八极杆氦气碰撞模式和四极杆质量分析器消除质谱干扰。
2.3 线性和检出限
取1.3.1节系列标准溶液进行检测,获得各元素标准曲线。取样品空白溶液,重复测定11次,计算各元素的检出限和定量限(表2)。所有工作曲线线性关系良好,相关系数大于0.999 5,各元素的检出限和定量限分别为0.001~0.05 mg/kg和0.004~0.2 mg/kg,满足检测要求。
表2 标准曲线方程、相关系数、检出限和定量限
Table 2 Regression equations, correlation coefficients, detection limits and quantification limits
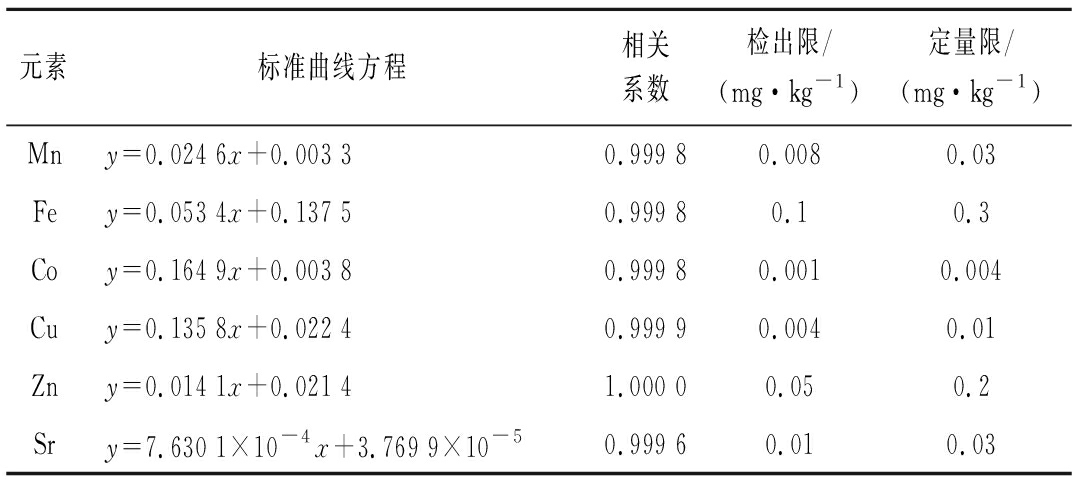
元素标准曲线方程相关系数检出限/(mg·kg-1)定量限/(mg·kg-1)Mny=0.024 6x+0.003 30.999 80.0080.03Fey=0.053 4x+0.137 50.999 80.10.3Coy=0.164 9x+0.003 80.999 80.0010.004Cuy=0.135 8x+0.022 40.999 90.0040.01Zny=0.014 1x+0.021 41.000 00.050.2Sry=7.630 1×10-4x+3.769 9×10-50.999 60.010.03
2.4 精密度和加标回收率
称取HT1样品6份,按优化后的条件测定,测定结果的相对标准偏差即为方法精密度,所测各元素的RSD值为1.52%~3.67%,说明方法精密度良好。另称取HT1样品24份,添加3个不同浓度的标准溶液,每个浓度做3个平行试验[19],6种元素的平均回收率为87.5%~110.2%,RSD值在0.24%~4.96%,表明方法的准确度较高,其结果见表3。
表3 方法精密度和加标回收率
Table 3 Precisions and recoveries of the method
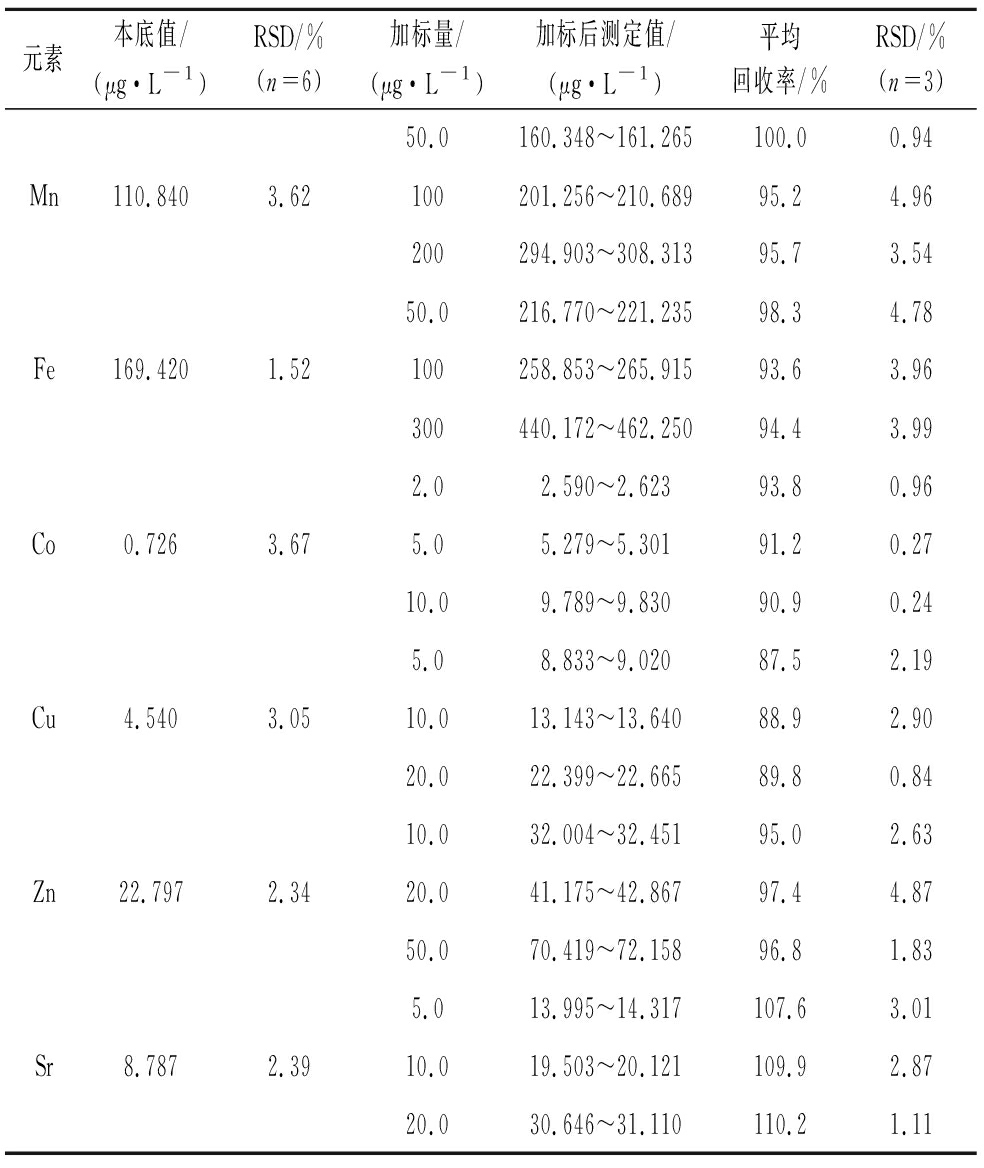
元素本底值/(μg·L-1)RSD/%(n=6)加标量/(μg·L-1)加标后测定值/(μg·L-1)平均回收率/%RSD/%(n=3)50.0160.348~161.265100.00.94Mn110.8403.62100201.256~210.68995.24.96200294.903~308.31395.73.5450.0216.770~221.23598.34.78Fe169.4201.52100258.853~265.91593.63.96300440.172~462.25094.43.992.02.590~2.62393.80.96Co0.7263.675.05.279~5.30191.20.2710.09.789~9.83090.90.245.08.833~9.02087.52.19Cu4.5403.0510.013.143~13.64088.92.9020.022.399~22.66589.80.8410.032.004~32.45195.02.63Zn22.7972.3420.041.175~42.86797.44.8750.070.419~72.15896.81.835.013.995~14.317107.63.01Sr8.7872.3910.019.503~20.121109.92.8720.030.646~31.110110.21.11
2.5 对比分析
采用稀酸微波消解法(A)和浓酸微波消解法(B),分别对3种不同红糖样品进行前处理后测定,测定结果见表4。基于t检验(取置信水平α=0.05),2种消解方法测定结果之间无显著性差异(P>0.05),说明稀酸微波消解法具有一定的可靠性。
表4 不同测定方法的实验结果(n=3) 单位:mg/kg
Table 4 Experiment results of different testing methods(n=3)
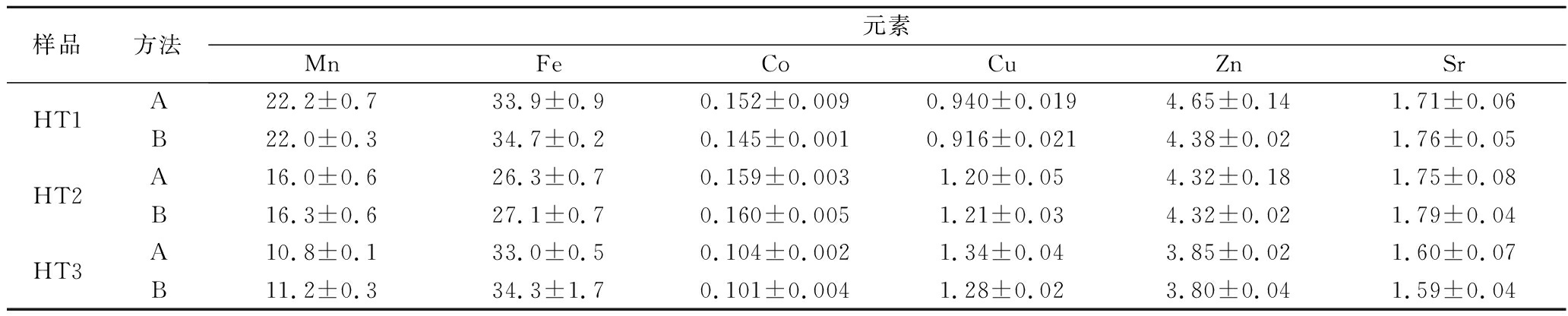
样品方法元素MnFeCoCuZnSrHT1A22.2±0.733.9±0.90.152±0.0090.940±0.0194.65±0.141.71±0.06B22.0±0.334.7±0.20.145±0.0010.916±0.0214.38±0.021.76±0.05HT2A16.0±0.626.3±0.70.159±0.0031.20±0.054.32±0.181.75±0.08B16.3±0.627.1±0.70.160±0.0051.21±0.034.32±0.021.79±0.04HT3A10.8±0.133.0±0.50.104±0.0021.34±0.043.85±0.021.60±0.07B11.2±0.334.3±1.70.101±0.0041.28±0.023.80±0.041.59±0.04
注:数据为“平均值±标准偏差”
3 结论
本研究建立了稀酸微波消解-ICP-MS法测定红糖中Mn、Fe、Co、Cu、Zn和Sr 6种营养元素的方法。通过优化硝酸浓度、过氧化氢体积和消解时间获得元素较好的消解效果。采取样品重复性测试和加标回收试验,分别验证方法的精密度和准确性,通过与国标法对比分析,验证了方法的可靠性。该法操作简单、灵敏度高、结果准确且适用于红糖中6种营养元素的检测。
[1] 徐灵均, 袁义明, 胡晓苹.红糖在我国的现状及其与精制砂糖的对比分析[J].食品研究与开发, 2017, 38(10):209-214.
XU L J, YUAN Y M, HU X P.Present situation and comparative analysis between refined sugar and brown sugar in China[J].Food Research and Development, 2017, 38(10):209-214.
[2] JAFFÉ W R.Nutritional and functional components of non centrifugal cane sugar:A compilation of the data from the analytical literature[J].Journal of Food Composition and Analysis, 2015, 43:194-202.
[3] 徐灵均, 袁义明, 冯爱国, 等.传统红糖与精制赤砂糖理化性质比较[J].食品科学, 2018, 39(7):125-129.
XU L J, YUAN Y M, FENG A G, et al.Comparative studies on physical and chemical properties of traditional brown sugar and refined brown granulated sugar[J].Food Science, 2018, 39(7):125-129.
[4] JAFFÉ W R.Health effects of non-centrifugal sugar(NCS):A review[J].Sugar Technology, 2012, 14(2):87-94.
[5] WANG M, ZHONG Y Z, QIN J P, et al.Determination of total selenium in food samples by d-CPE and HG-AFS[J].Food Chemistry, 2017, 227:329-334.
[6] SANTOS J M, QUINáIA S P, FELSNER M L.Fast and direct analysis of Cr, Cd and Pb in brown sugar by GF AAS[J].Food Chemistry, 2018, 260:19-26.
[7] OZDEMIR S, KILINC E, CELIK K S, et al.Simultaneous preconcentrations of Co2+, Cr6+, Hg2+ and Pb2+ ions by Bacillus altitudinis immobilized nanodiamond prior to their determinations in food samples by ICP-OES[J].Food Chemistry, 2017, 215:447-453.
[8] QIN J X, SU Z, MAO Y H, et al.Carboxyl-functionalized hollow polymer microspheres for detection of trace metal elements in complex food matrixes by ICP-MS assisted with solid-phase extraction[J].Ecotoxicology and Environmental Safety, 2021, 208:111729.
[9] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.268—2016 食品安全国家标准食品中多元素的测定[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China, China Food and Drug Administration.GB 5009.268—2016 National food safety standard Determination of multielements in food[S].Beijing:China Standards Press, 2017.
[10] MACHADO I, DOL I, RODRíGUEZ-ARCE E et al.Comparison of different sample treatments for the determination of As, Cd, Cu, Ni, Pb and Zn in globe artichoke (Cynara cardunculus L.subsp.Cardunculus)[J].Microchemical Journal, 2016, 128:128-133.
[11] DOHNALOVA L, BUCEK P, VOBORNIK P, et al.Determination of nickel in hydrogenated fats and selected chocolate bars in Czech Republic[J].Food Chemistry, 2017, 217:456-460.
[12]  EMEN S, MERCAN S, YAYLA M, et al.Elemental composition of green coffee and its contribution to dietary intake[J].Food Chemistry, 2017, 215:92-100.
EMEN S, MERCAN S, YAYLA M, et al.Elemental composition of green coffee and its contribution to dietary intake[J].Food Chemistry, 2017, 215:92-100.
[13] SIQUEIRA J S, PEREIRA J B, LEMOS M S, et al.Optimization of a digestion method using diluted acid in bee pollen samples for determination of Fe, Mn, and Zn by flame atomic absorption spectrometry[J].Food Analytical Methods, 2017, 10(3):759-763.
[14] SANTOS H M, COUTINHO J P, AMORIM F A C, et al.Microwave-assisted digestion using diluted HNO3 and H2O2 for macro and microelements determination in guarana samples by ICP OES[J].Food Chemistry, 2019, 273:159-165.
[15] DA SILVA I J S, LAVORANTE A F, PAIM A P S, et al.Microwave-assisted digestion employing diluted nitric acid for mineral determination in rice by ICP OES[J].Food Chemistry, 2020, 319:126435.
[16] MARTINS C A, CERVEIRA C, SCHEFFLER G L, et al.Metal determination in tea, wheat, and wheat flour using diluted nitric acid, high-efficiency nebulizer, and axially viewed ICP OES[J].Food Analytical Methods, 2015, 8(7):1 652-1 660.
[17] SANTOS W P C, SANTOS D C M B, FERNANDES A P, et al.Geographical characterization of beans based on trace elements after microwave-assisted digestion using diluted nitric acid[J].Food Analytical Methods, 2013, 6(4):1 133-1 143.
[18] SECO-GESTO E M, MOREDA-PI EIRO A, BERMEJO-BARRERA A, et al, Multi-element determination in raft mussels by fast microwave-assisted acid leaching and inductively coupled plasma-optical emission spectrometry[J].Talanta, 2007, 72(3):1 178-1 185.
EIRO A, BERMEJO-BARRERA A, et al, Multi-element determination in raft mussels by fast microwave-assisted acid leaching and inductively coupled plasma-optical emission spectrometry[J].Talanta, 2007, 72(3):1 178-1 185.
[19] 杨伟, 李蓉, 周美丽, 等.半消解-电感耦合等离子体质谱法测定分心木中锰、铜、锶和钡[J].质谱学报, 2020, 41(3):290-296.
YANG W, LI R, ZHOU M L, et al.Determination of Mn, Cu, Sr and Ba in Diaphragma Juglandis Fructus by semi-digestion-ICP-MS[J].Journal of Chinese Mass Spectrometry Society, 2020, 41(3):290-296.