铁元素是人体含量最高且必需的微量元素,是红细胞合成血红素必不可少的物质,在机体代谢中有着重要作用[1]。然而,据报道全球有20亿人因缺铁出现营养问题,缺铁性贫血可引起认知能力、成长发育和肠道免疫机制的功能障碍[2],已成为发展中国家和发达国家的主要公共卫生问题[3]。阿胶作为一种历史悠久的滋补良药和功能食品,两千多年来被广泛应用于早期造血和抗贫血治疗[4]。然而,因其成分的多样化和加工工艺的影响,对阿胶的补血活性物质及其化学成分与生物活性之间关系的研究比较有限。
近些年,有学者发现运用人工消化模型从阿胶的水解产物中获得分子质量小于5 000 Da的肽组分能够增加5-氟尿嘧啶引起的贫血小鼠的骨髓造血干/祖细胞集落数量,且补血效果明显,推断阿胶产生药效的物质基础是分子质量较小的组分[5-6]。体外消化模型的建立提供了一条研究阿胶活性成分的新途径。值得关注的是,阿胶通常会与一些富含铁的辅料(如核桃、芝麻、大枣等)加工为方便食用的阿胶糕。此外,阿胶的主要成分是蛋白质,进入消化道后被水解为肽。与氨基酸和蛋白质相比,肽具有许多优势,可以依赖于肠上皮细胞两侧的物质浓度和电化学势的差别通过细胞旁路途径转运到肠上皮细胞中且不需要消耗能量[7]。许多研究也表明,从食物蛋白水解物中获得的多肽可与金属离子结合形成多肽金属螯合物,这种螯合物的形式比游离金属离子更容易被机体吸收利用[8-10]。
因此,本研究假设在消化过程中形成的阿胶肽铁螯合物是阿胶的潜在补血活性成分,并研究了阿胶在体外对亚铁的螯合能力和促进铁吸收的作用,且进一步证明了阿胶肽与肽铁螯合的物理特性和结构特征。本研究可为对阿胶补血活性成分的理解提供实质性的补充,为促进传统阿胶产品的多样化及品质提升提供新的思路与方法。
1 材料与方法
1.1 材料与试剂
阿胶粉,市场购置;胃蛋白酶(≥ 2 500 U/mg),阿拉丁生物科技有限公司;胰蛋白酶(≥ 50 000 U/g)、邻菲罗啉、七水合硫酸亚铁(FeSO4·7H2O)、浓硝酸、无水乙醇、乙酸钠、乙酸铵、磷酸二氢钾、碳酸铵等试剂均为分析纯,国药化学试剂有限公司;琼脂糖凝胶6B,索莱宝生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、环氧氯丙烷(epichlorohydrin,ECH)、亚氨基二乙酸,麦克林生化科技有限公司;Krebs-Ringer缓冲液,飞净生物科技有限公司。
1.2 仪器与设备
Nexlon 350D电感耦合等离子体质谱仪,美国Perkin Elmer公司;微波消解系统,北京莱伯泰科仪器股份有限公司;THZ-C-L台式冷冻恒温振荡器,太仓市强乐实验设备有限公司;ST3100 pH计,常州奥豪斯仪器有限公司;冷冻干燥机,宁波新芝生物股份有限公司;Ussing chamber系统,美国 Physiologic Instruments公司;F98荧光分光光度计,上海棱光技术有限公司;傅立叶红外光谱仪,美国Nicolet公司;冷场发射扫描电子显微镜,日本株式会社日立高新技术公司。
1.3 实验方法
1.3.1 铁元素含量测定
分别称取0.20 g阿胶粉,用于阿胶中总铁含量和螯合铁含量的测定。用来测定总铁含量的样品不做前处理,测定螯合铁含量的样品需用无水乙醇溶液多次洗涤,并在6 000 r/min下离心15 min,取1 mL的上清液加入20 mg/mL的抗坏血酸溶液80 μL,5 mg/mL 的邻菲罗啉溶液160 μL显色,直至无明显橙红色出现,将乙醇洗涤后的阿胶样品置于40 ℃水浴锅中蒸干。做3组平行样品,得到待测样品。
将上述待测样品置于干燥的聚四氟乙烯消解罐中,加入10 mL浓硝酸,并做样品空白对照。设定消解程序为:0~120 ℃升温12 min,恒温5 min;120~160 ℃升温6 min,恒温10 min;160~180 ℃升温6 min,恒温15 min,微波消解仪功率为1 600 W。待消解完成后冷却至室温,将消解液转移至50 mL容量瓶中,用超纯水反复冲洗3次,合并消解液,用1%(体积分数)的稀硝酸定容至刻度,得供试样品溶液。各组微波消解后得到的溶液用电感耦合等离子体质谱仪测定铁元素的含量。
1.3.2 模拟消化液的配制
根据MINEKUS等[11]建立的食品通用标准化体外消化方法,稍作修改。口腔模拟消化液(simulated oral fluid,SOF)、胃液模拟消化液(simulated gastric fluid,SGF)和肠液模拟消化液(simulated intestinal fluid,SIF)由相应的电解质储备液配制而成。据中国居民膳食微量元素铁的参考摄入量,将FeSO4·7H2O溶解在SOF储备液中,制备成质量浓度为1.50 mg/mL的膳食Fe2+溶液。分别用SGF储备液溶解胃蛋白酶,配制酶活力为2 500 U/mg,质量浓度为10 mg/mL的胃蛋白酶溶液;用SIF储备液溶解胰蛋白酶,配制酶活为50 U/mg,质量浓度为16 mg/mL的胰蛋白酶溶液。模拟消化电解质储备液的配制见表1,并将配制好的电解质储备液定容至100 mL,于-20 ℃下保存。
表1 模拟消化电解质储备液的配制
Table 1 Preparation of electrolyte stock solutions of simulated digestion fluids
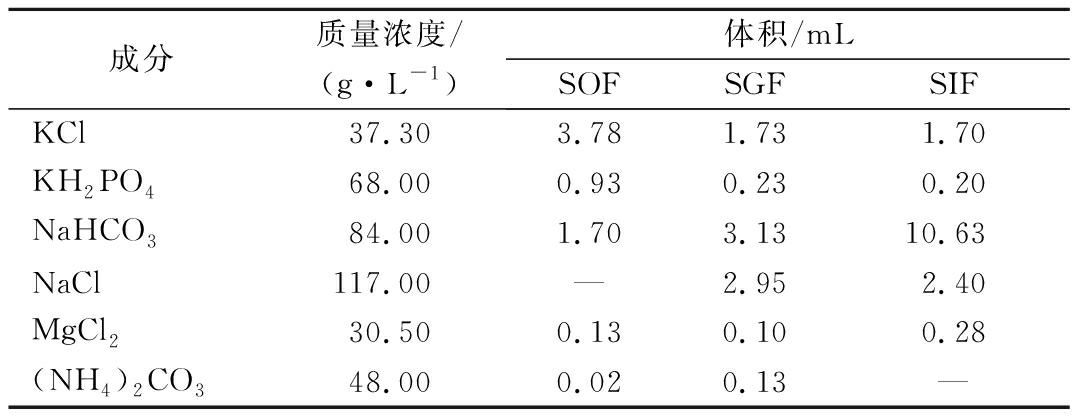
成分质量浓度/(g·L-1)体积/mL SOFSGFSIFKCl37.303.781.731.70KH2PO468.000.930.230.20NaHCO384.001.703.1310.63NaCl117.00—2.952.40MgCl230.500.130.100.28(NH4)2CO348.000.020.13—
注:-表示无
1.3.3 阿胶的体外模拟消化
(1)模拟口腔消化:称取5.00 g 阿胶与4 mL膳食Fe2+溶液混合,加入25 μL CaCl2溶液,超纯水定容至10 mL,37 ℃振荡消化2 min,得口腔消化产物。
(2)模拟胃液消化:将口腔消化产物与7.5 mL SGF储备液混合,加入5 μL CaCl2溶液,调节pH至3.0后加入1.6 mL胃蛋白酶液,超纯水定容至10 mL,37 ℃振荡消化120 min,得胃消化产物。
(3)模拟肠液消化:将胃液消化产物与11 mL SIF储备液混合,加入40 μL CaCl2溶液,调节pH至7.0后加入5.0 mL胰蛋白酶液,超纯水定容至20 mL,37 ℃振荡消化120 min,得肠消化产物。消化液在95 ℃水浴锅中加热10 min灭酶。
1.3.4 Ussing chamber吸收实验
1.3.4.1 吸收样品制备
将上述1.2.3所得的不同消化产物用无水乙醇多次洗涤,去除游离铁。以肠消化样品为标准,用Krebs-Ringer缓冲液稀释至Fe2+质量浓度为100.0 μg/mL,且3组消化样品稀释同等倍数。FeSO4·7H2O溶液作为对照组,Fe2+质量浓度为100.0 μg/mL。
1.3.4.2 吸收实验
健康的SD大鼠被禁食12 h后乙醚麻醉,立即分离出十二指肠,并将其剪成2.0 cm的小段,用镊子除去浆膜和部分肌肉层。将制备好的肠黏膜安装在灌流小室中,有效透过面积为0.5 cm2。向小室的两侧加入5 mL 37 ℃预热的缓冲液,持续通入体积分数95% O2和5% CO2混合气体,系统温度保持37 ℃,并平衡30 min,使肠黏膜达到稳定状态。将5.0 mL样品溶液加入黏膜侧,等体积的缓冲液加入浆膜侧。吸收实验开始后,分别在0、15、30、60、90、120 min收集1.0 mL浆膜样品以测定铁透过率,同时在每个取样点的浆膜侧加入等量的缓冲液。吸收结束后,收集粘膜侧的溶液,按上述1.2.1的方法测定累积铁吸收率[12]。根据SJÖGREN等[13]的方法计算铁向浆膜侧的累积透过率和表观渗透系数。
1.3.5 固定化金属亲和层析(immobilized metal affinity chromatography,IMAC)分离铁螯合肽
参考GUO等[14]的方法制备层析填料,并稍作修改。将除去乙醇的琼脂糖凝胶6B与60%(体积分数)的DMSO和40%(体积分数)的ECH混合,40 ℃活化3.5 h后与亚氨基二乙酸溶液(3∶10,g∶mL) 60 ℃下偶联10 h,结束后装于玻璃层析柱(30 mm×400 mm)中。用超纯水流洗3个柱体积后用0.2 mol/L的 Fe2+溶液流洗5个柱体积,使填料充分结合Fe2+,再用超纯水清洗至流出物中检测不到Fe2+,继续流洗平衡缓冲液A(0.05 mol/L的乙酸钠和0.10 mol/L的氯化钠,pH 5.5)去除非特异性结合的Fe2+,并平衡IMAC柱。将冻干的阿胶肠消化产物用缓冲液A溶解为20 mg/mL的溶液,装载到IMAC柱上。上样量为10 mL,流速1.0 mL/min,在220 nm处监测洗脱液的吸光度。用缓冲液A洗脱未结合的肽,直到基线稳定。然后用缓冲液B(0.02 mol/L磷酸氢二钠,0.10 mol/L氯化钠和0.01%乙酸铵,pH 8.4)洗脱出铁螯合肽。收集洗脱组分,于150 Da纳滤脱盐后冷冻干燥。
1.3.6 阿胶肽铁螯合物的制备
参照唐顺博[15]的方法,将铁螯合肽配制成质量浓度为40 g/L的溶液,调节pH至5.5,肽与Fe2+的质量比为4∶1,并在37 ℃下振荡螯合60 min。结束后冷却至室温,混合物在6 500 r/min下离心15 min,上清液冷冻干燥后获得阿胶肽铁螯合物。
1.3.7 分子质量分布及氨基酸组成分析
分子质量分布由HPLC测定,将铁螯合肽溶解在超纯水中配制成质量浓度为1 mg/mL的溶液,通过0.45 μm过滤器,上样量10 μL,流速0.5 mL/min加载到HPLC上。另称取0.12 g铁螯合肽经酸水解22 h后通过氨基酸分析仪测定,流速为1.0 mL/min。
1.3.8 质谱分析
铁螯合肽的氨基酸序列通过液相色谱串联质谱进行分析[16],样品流速为5 μL/min。质谱参数为:正电荷喷雾电压为2.0 kV,毛细管温度300 ℃,最大驻留时间为50 ms前驱体离子扫描范围350~1 550 m/z。
1.3.9 铁螯合肽和肽铁螯合物的结构表征
1.3.9.1 荧光光谱分析
铁螯合肽粉末溶解在超纯水中配制成0.1 mg/mL的溶液,加入不同浓度的FeSO4·7H2O(0、0.05、0.10、0.20、0.50和1.00 mmol/L),在335 nm的激发波长下进行荧光扫描,发射波长为365~500 nm。
1.3.9.2 傅里叶红外光谱分析
将铁螯合肽及其肽铁螯合物各2.0 mg放入玛瑙研钵中,加入200.0 mg干燥溴化钾混合并研磨均匀。将混合物压成透明的薄片,放入红外测定室,使用傅立叶变换光谱仪在4 000~400 cm -1处扫描[17]。
1.3.9.3 扫描电子显微镜分析(scanning electron microscope,SEM)
参考CHEN等[18]的方法,将适量的铁螯合肽和肽铁螯合物粉末均匀涂布在样品板的双面胶带上,经喷金后,在3.0 kV的加速电压下,用SEM观察样品的微观结构。
1.3.10 数据统计分析
采用SPSS 23.0软件进行数据统计分析,Graphpad Prism 7.0软件作图,实验数据至少重复3次,以平均值±标准差来表示,采用Duncan多重比较检验,以P<0.05表示为差异显著,P>0.05表示为无显著性差异。
2 结果与分析
2.1 阿胶在消化过程中铁螯合量的变化
经体外消化阿胶的铁螯合量发生了变化,如图1所示,经口腔消化后阿胶螯合铁量是未消化阿胶的12倍,这可能因为膳食Fe2+溶液的添加,增加了阿胶与Fe2+螯合的机会。与口腔消化相比,胃液消化后铁螯合量无明显变化(P>0.05),这可能与胃液中较低的pH值有关。在酸性条件下,溶液中的H+会与Fe2+竞争螯合基团,并抑制铁的螯合[19]。阿胶经肠消化后铁螯合能力显著提高(P<0.05)是未消化阿胶的16倍。通过消化,阿胶被胃蛋白酶和胰蛋白酶水解产生肽或氨基酸,暴露出更多的具有螯合能力的功能团和氨基酸残基,提高了其铁螯合能力。
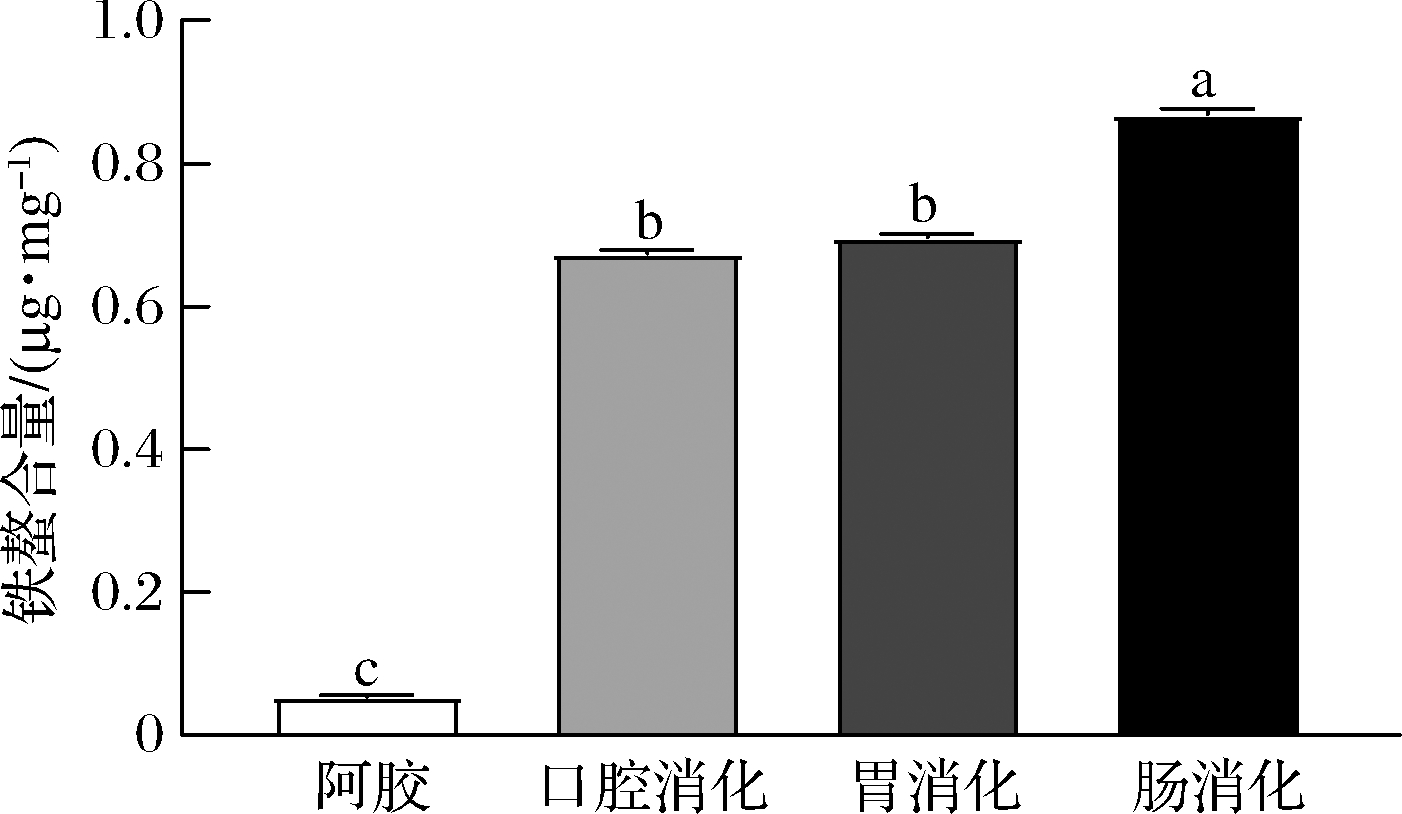
图1 模拟消化对阿胶铁螯合量的影响
Fig.1 The effects of simulated digestion on iron chelating capacity of Ejiao
注:不同小写字母表示差异显著(P<0.05),相同字母表示无显著性差异(P>0.05)(下同)
2.2 模拟消化对阿胶的促铁吸收能力的影响
采用Ussing chamber系统评价阿胶不同消化产物的促铁吸收能力。随着时间的延长,铁离子的透过率和吸收率均升高。如图2所示,肠消化后的累积铁离子透过率和吸收率均最高,然而,口腔和胃消化产物的铁离子透过率和吸收率低于FeSO4·7H2O组,这可能是因为在口腔和胃消化过程中,由于一些大分子蛋白质或肽的不完全消化以及溶液酸碱度的变化,导致铁离子不容易通过肠黏膜,降低了铁离子的吸收能力。表观渗透系数是表征化合物透过组织黏膜能力的重要指标[20]。经肠液消化后,铁离子的表观渗透系数显著高于其他组(P<0.05)。表明阿胶经肠液充分消化后能够螯合更多的铁,螯合物的形式能够增强铁离子的透膜能力,从而促进铁离子在肠道的吸收。许多研究也表明,蛋白水解物螯合亚铁离子的能力被认为是促进铁吸收的关键因素。铁螯合蛋白水解物是铁吸收的潜在促进剂,因为肽或氨基酸可以通过金属螯合增加金属的溶解度和生物利用度[21]。阿胶经口服后在胃肠道被消化成不同分子质量的肽段,一些具有螯合能力的肽与亚铁离子螯合,从而保持亚铁离子的溶解性并促进铁的吸收。
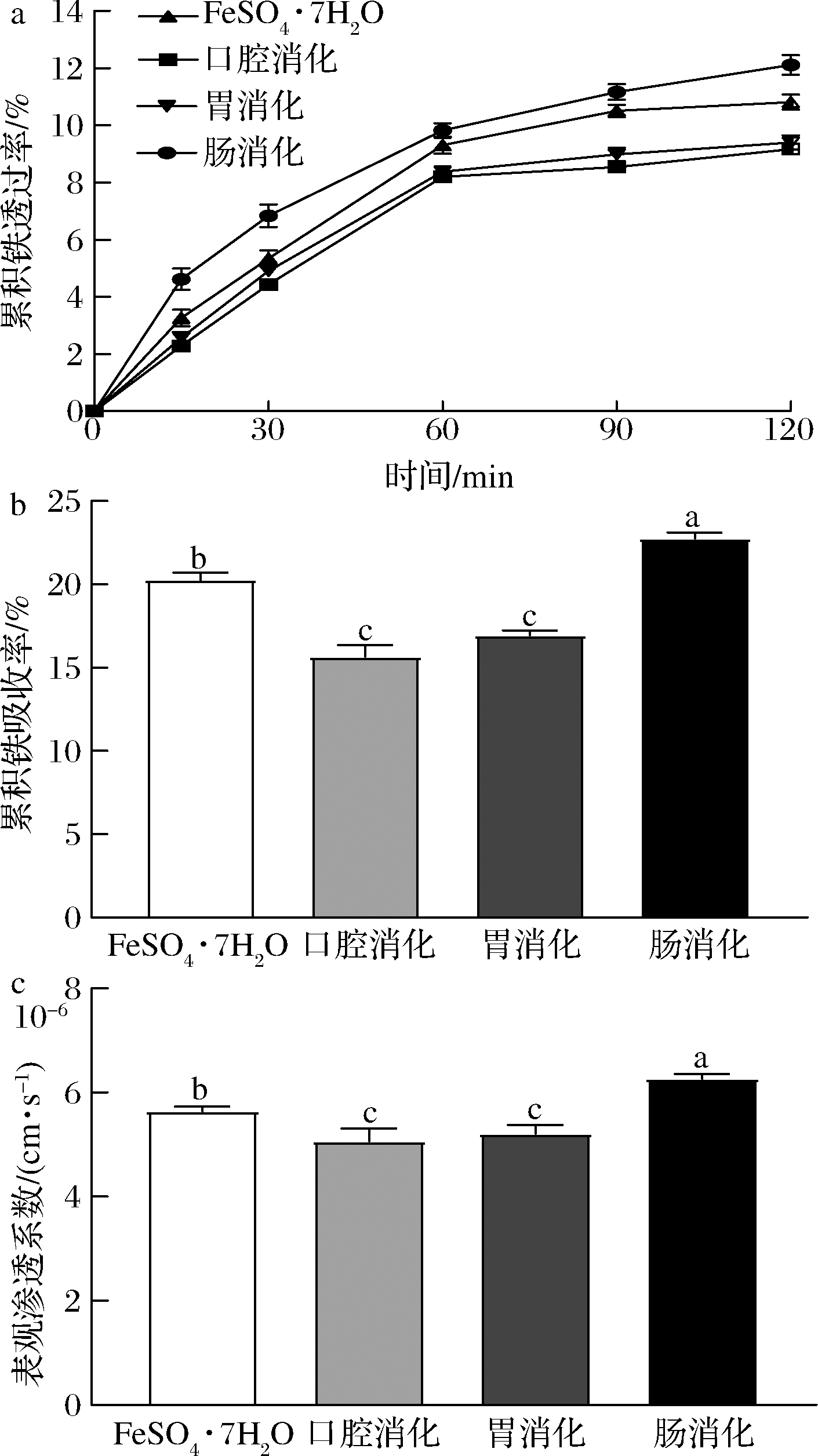
a-随时间变化的累计铁透过率;b-黏膜侧累积铁吸收量;c-表观渗透系数
图2 阿胶不同消化产物的铁吸收能力
Fig.2 Iron absorption capacity of different digested products of Ejiao
2.3 铁螯合肽的分离纯化
如图3所示,阿胶消化产物被IMAC-Fe2+分成F1和F2两个组分。组分F1是用pH为5.5的缓冲液A洗脱,在该pH下肽一般具有较高的铁螯合活性,所以被洗脱下来的为不能螯合或弱螯合能力的肽。组分F2是用pH为8.4的缓冲液B洗脱下来的铁螯合肽,其铁螯合能力为(23.58±0.7) μg/mg,较分离前提升了27.15倍。这是因为肽与固定化金属吸附剂的结合受溶液酸碱度的影响[22],洗脱pH接近Fe2+沉淀的pH,随着pH的升高,更多的OH-竞争结合Fe2+,铁螯合肽则易从固定配体上解离下来。
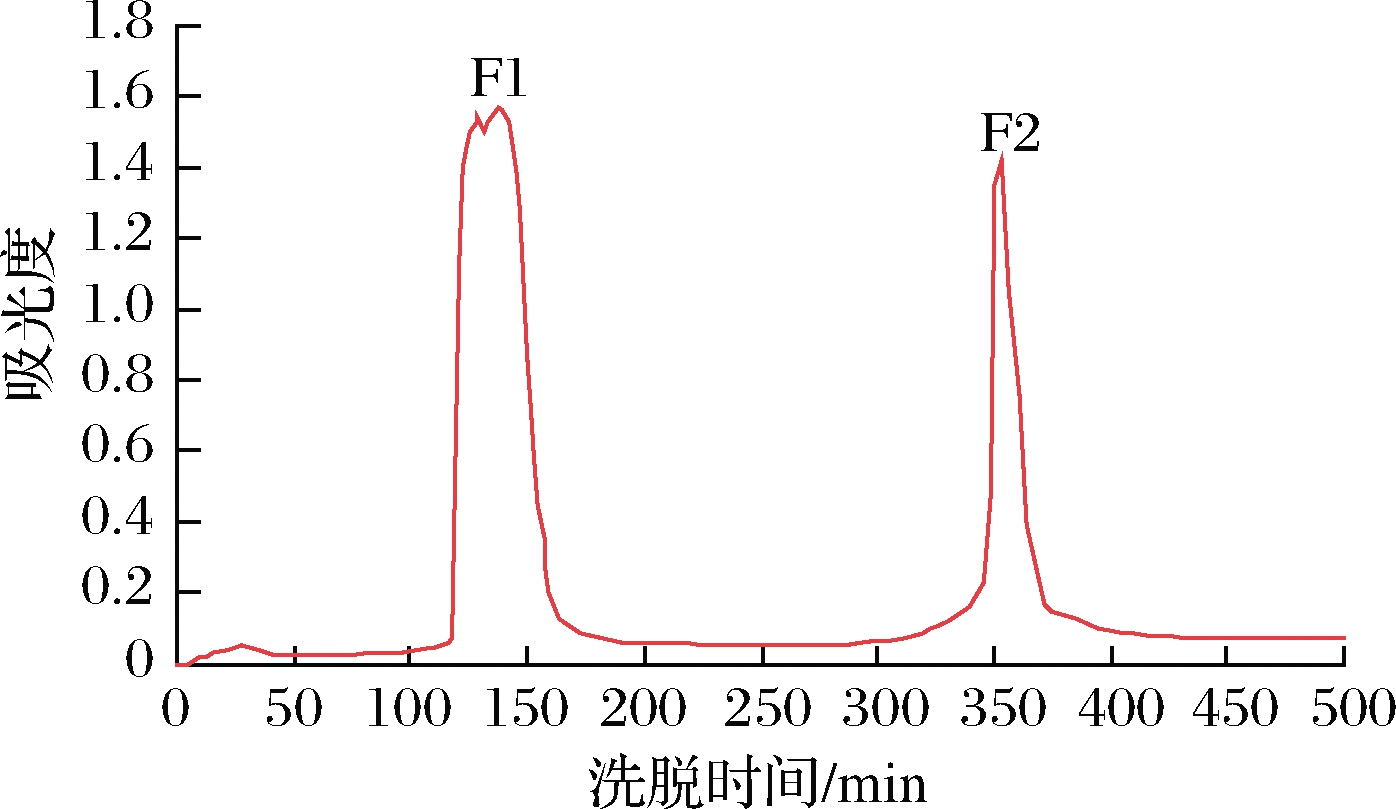
图3 固定金属亲和层析分离铁螯合肽的分离图谱
Fig.3 Separation of iron chelating peptides by IMAC-Fe2+
2.4 铁螯合肽的分子质量分布和氨基酸组成
阿胶铁螯合肽的分子质量分布如表2所示,分子质量5 000~180 Da的多肽质量分数为89.21%,其中180~2 000 Da 和180~1 000 Da的多肽分别占70.51%和50.56%,说明分离得到的铁螯合肽主要是< 5 000 Da的肽段,且集中分布在180~2 000 Da。分子质量大小在肽的螯合能力中起关键作用,而且研究表明小肽更容易被人体吸收,具有多种生物活性,低分子质量肽的金属元素螯合能力更强[23],这也提示分离获得的阿胶肽是具备较高铁螯合能力的铁螯合肽。
表2 铁螯合肽的分子质量分布
Table 2 Molecular weight distribution of iron chelating peptides

编号分子质量/Da相对含量/%1>5 0002.9923 000~5 0008.2932 000~3 00010.4141 000~2 00019.955 180~1 00050.566<1807.80
肽对金属离子的螯合能力不仅与肽的分子质量有关,还与肽的氨基酸组成有关。如表3所示,对铁螯合肽的氨基酸组成进行分析,其中含量最高是甘氨酸(Gly),质量分数为(25.14±0.19)%,其次是谷氨酸(Glu),质量分数为(13.25±0.13)%。此外,脯氨酸(Pro)、丙氨酸(Ala)、精氨酸(Arg)和天冬氨酸(Asp)的含量也较高。研究表明,酸性氨基酸、碱性氨基酸和一些特殊氨基酸对金属离子有很强的螯合能力[24]。铁螯合肽中酸性氨基酸和碱性氨基酸的质量分数分别为(20.08±0.18)%和(14.51±0.09)%。谷氨酸作为一种二羧酸,能够提供更多的铁结合位点,这决定了它具有较强的铁螯合能力。作为一种碱性氨基酸,精氨酸侧链上的氨基和亚胺也可以与亚铁离子结合。WU等[17]利用酶水解太平洋鳕鱼皮分离纯化了3种亚铁螯合肽,并证实赖氨酸(Lys)、组氨酸(His)、Asp和Arg是具有亚铁螯合位点的氨基酸。SUN等[23]发现亲水性氨基酸Asp、Arg含量与铁螯合活性呈正相关。因此,铁螯合肽中亚铁的螯合活性可归因于羧基和氨基的增加。
表3 铁螯合肽的氨基酸组成
Table 3 Amino acid compositions of iron chelating peptides
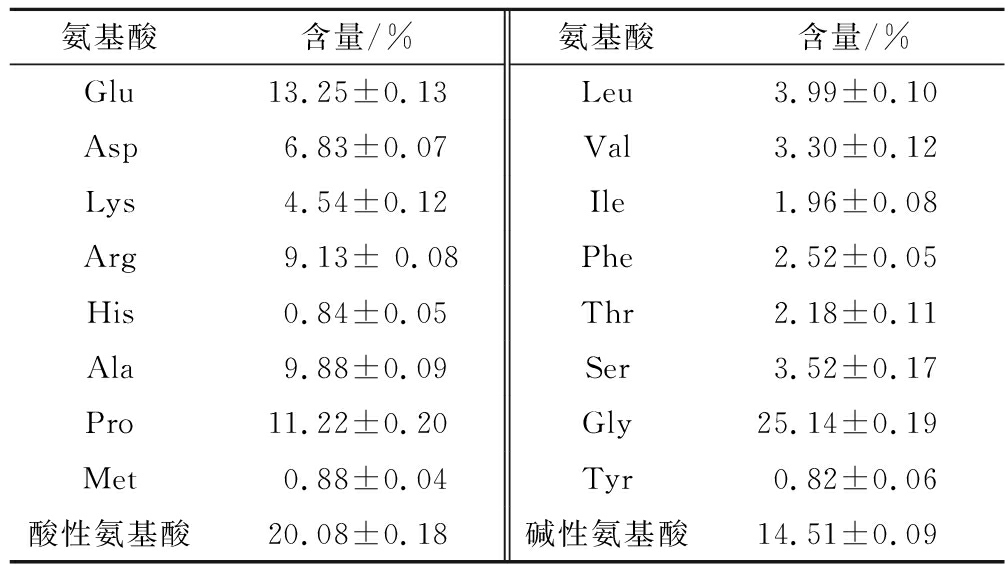
氨基酸含量/%氨基酸含量/%Glu13.25±0.13Leu3.99±0.10Asp6.83±0.07Val3.30±0.12Lys4.54±0.12Ile1.96±0.08Arg9.13± 0.08Phe2.52±0.05His0.84±0.05Thr2.18±0.11Ala9.88±0.09Ser3.52±0.17Pro11.22±0.20Gly25.14±0.19Met0.88±0.04Tyr0.82±0.06酸性氨基酸20.08±0.18碱性氨基酸14.51±0.09
注:酸性氨基酸为Glu和Asp;碱性氨基酸为Lys、Arg和His
2.5 氨基酸序列鉴定
对质谱鉴定结果采用De novo 氨基酸序列分析法进行分析并筛选出相对强度较高的4条肽的氨基酸序列,如表4所示。通过与Uniprot数据库中的驴源蛋白序列进行匹配,确定肽段分别来源于胶原蛋白α-1(I)链和胶原蛋白α-2(I)链。鉴定出的肽序列中富含Gly、Pro、Ala、Glu和Asp,且4条肽的分子质量均小于2 000 Da,这与铁螯合肽的分子质量分布和氨基酸组成结果相符,可以解释肽的高铁螯合能力。此外,LEE等[25]的研究证明从猪血中纯化的铁螯合肽的Glu、Asp和Lys残基与铁的螯合活性密切相关,与本研究结果一致。本研究分离得到的铁螯合肽为多种肽段的混合物,后期可对获得的肽段进行化学合成,分别验证其铁螯合能力和促铁吸收能力。
表4 铁螯合肽的氨基酸序列鉴定
Table 4 Amino acid sequences of peptides with high intensity from iron chelating peptides

编号质荷比分子质量/Da氨基酸序列蛋白来源1764.39763.42Gly -Pro-Ala-Gly-Pro-Ile-Gly-Pro-Val(GPAGPIGPV)胶原蛋白α-1(I)链2480.59943.45Leu-Gln-Gly-Met-Pro-Gly-Glu-Arg-Gly(LQGMPGERG)胶原蛋白α-1(I)链3562.031 121.55Ala-Gly-Pro-Pro-Gly-Ala-Asp-Gly-Gln-Pro-Gly-Ala-Lys (AGPPGADGQPGAK)胶原蛋白α-1(I)链4478.741 434.78Leu-Arg-Gly-Pro-Arg-Gly-Asp-Gln-Gly-Pro-Val-Gly-Arg-Ala (LRGPRGDQG-PVGRA)胶原蛋白α-2(I)链
2.6 肽铁螯合物的结构表征
2.6.1 荧光光谱分析
荧光光谱的激发和发射波长与分子结构和分子轨道能量有关,有机配体和金属离子之间的相互作用可以通过荧光光谱中波长和荧光强度的变化来反映[26]。在335 nm激发波长下记录了含有不同浓度Fe2+的铁螯合肽在365~500 nm的荧光光谱(图4)。铁离子的含量会影响内源荧光的强度和发射波长,随着Fe2+浓度的增加,肽在380和410 nm处的荧光强度逐渐下降,吸收峰也从384 nm、411 nm移动到380 nm、416 nm。在相关β-乳球蛋白水解物-铁复合物的研究中也出现了类似现象[27]。随着混合物中Fe2+的增加,荧光强度显著降低,发射光谱红移,肽与Fe2+发生螯合导致肽的内在荧光猝灭,BEYER等[28]的研究也证明,添加金属离子会使肽的结构发生折叠,改变肽的分子结构,导致荧光残基较少暴露于溶剂中,荧光强度减弱。这说明,肽与Fe2+确实发生了相互作用。
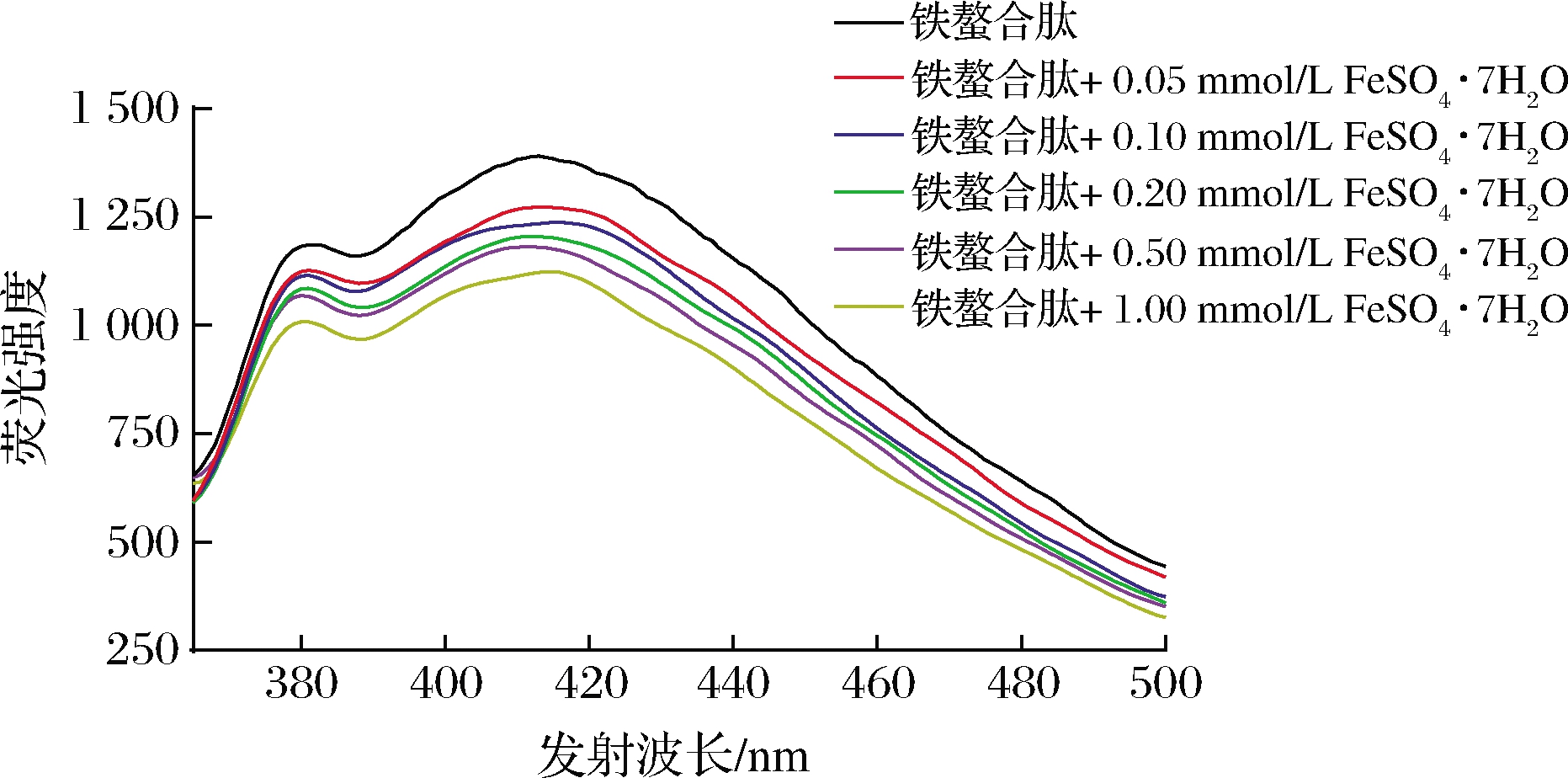
图4 不同Fe2+浓度下铁螯合肽的荧光光谱
Fig.4 Fluorescence spectra of iron chelating peptides with different concentrations of Fe2+
2.6.2 红外光谱分析
阿胶铁螯合肽和阿胶肽铁螯合物的红外光谱如图5所示。阿胶铁螯合肽在3 428.81 cm-1处的高频吸收为酰胺基N—H的伸缩振动峰;1 654.62 cm-1处为C![]() O的伸缩振动峰;1 390.42 cm-1处为羧基的伸缩振动峰,1 249.64 cm-1和1 085.72 cm-1处的弱吸收峰为C—N的伸缩振动和C—H键的弯曲振动。与铁螯合生成阿胶肽铁螯合物后,主要吸收峰发生了位移,相对强度也有所变化。高频吸收峰移动至3 409.52 cm-1,说明加铁后酰胺基参与了螯合,破坏了原有的共轭体系,吸收峰向短波长移动。C
O的伸缩振动峰;1 390.42 cm-1处为羧基的伸缩振动峰,1 249.64 cm-1和1 085.72 cm-1处的弱吸收峰为C—N的伸缩振动和C—H键的弯曲振动。与铁螯合生成阿胶肽铁螯合物后,主要吸收峰发生了位移,相对强度也有所变化。高频吸收峰移动至3 409.52 cm-1,说明加铁后酰胺基参与了螯合,破坏了原有的共轭体系,吸收峰向短波长移动。C![]() O伸缩振动峰移至1 639.19 cm-1表明羧基氧参与了螯合反应;1 124.29 cm-1处出现了新的较大吸收峰,说明阿胶肽与铁结合,使得C—N的伸缩振动和N-H的弯曲振动吸收发生了变化。红外光谱结果表明,铁离子主要与阿胶肽的羧基氧和氨基氮原子发生螯合反应。
O伸缩振动峰移至1 639.19 cm-1表明羧基氧参与了螯合反应;1 124.29 cm-1处出现了新的较大吸收峰,说明阿胶肽与铁结合,使得C—N的伸缩振动和N-H的弯曲振动吸收发生了变化。红外光谱结果表明,铁离子主要与阿胶肽的羧基氧和氨基氮原子发生螯合反应。

图5 铁螯合肽和肽铁螯合物的红外光谱
Fig.5 FT-IR of iron chelating peptides and peptide-iron chelates
2.6.3 SEM分析
用SEM观察肽和肽铁螯合物的微观结构,如图6所示。铁螯合肽呈现光滑均匀的平面,表面颗粒小且分散,存在一些裂纹,这是因为酶解后产生了结构均匀、分子质量较低的组分,裂纹应该是冷冻干燥后留下的。肽铁螯合物呈现折叠聚集的结构,表面粗糙并形成了一些不均匀的团状颗粒。铁螯合肽和肽铁螯合物微观结构的差异表明,肽与铁发生作用破坏了肽的原有结构,肽和铁离子之间的交联形成更大的颗粒,并发生聚集。

a-阿胶铁螯合肽;b-阿胶肽铁螯合物
图6 阿胶铁螯合肽和阿胶肽铁螯合物的SEM(×1 000)图
Fig.6 The SEM (×1 000) photograph of iron chelating peptides and peptide-iron chelates of Ejiao
3 结论
本文采用体外模拟消化和吸收模型,证实了阿胶经胃肠消化后其铁螯合能力增强,并可促进铁的吸收,通过IMAC分离得到阿胶铁螯合肽,对其物理性质及与铁螯合后的结构特征进行分析。结果表明,具有铁螯合能力的肽的分子质量主要集中分布在180~2 000 Da,且富含酸性和碱性氨基酸,羧基和氨基为主要螯合位点。初步证明了阿胶在消化过程中能与铁离子发生结合,形成的肽铁螯合物可有效促进铁的吸收,具备潜在的机体补血活性,这些发现为进一步探究阿胶的补血活性成分提供了新的思路。
[1] ABBASPOUR N, HURRELL R, KELISHADI R.Review on iron and its importance for human health[J].Journal of Research in Medical Sciences, 2014, 19(2):164-174.
[2] 管玲娟, 曹丛丛, 屠飘涵, 等.缺铁对肠道免疫功能的影响及新型补铁剂的研究进展[J].食品与发酵工业, 2020, 46(19):264-270.
GUAN L J, CAO C C, TU P H, et al.Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J].Food and Fermentation Industries, 2020, 46(19):264-270.
[3] WU W F, YANG Y Y, SUN N, et al.Food protein-derived iron-chelating peptides:The binding mode and promotive effects of iron bioavailability[J].Food Research International, 2020, 131:108976.
[4] LI Y F, ZHANG Z F, YANG L L, et al.Colla corii asini might upregulate ZNF471 and THOC5 by KRAB domain-containing zinc-finger protein pathway and THO complex subunit 5 pathway to improve anemia of pregnant women with β-thalassemia[J].Annals of hematology, 2019, 98(8):1 813-1 826.
[5] WU H Z, REN C Y, YANG F, et al.Extraction and identification of collagen-derived peptides with hematopoietic activity from Colla Corii Asini[J].Journal of Ethnopharmacology, 2016, 182:129-136.
[6] 吴宏忠. 阿胶补血作用的物质基础及分子机理研究[D].上海:华东理工大学, 2008.
WU H Z.Study on the material basis and molecular mechanism of donkey-hide gelatin′s effect on blood[D].Shanghai:East China University of Science and Technology, 2008.
[7] WU W M, HE L C, LIANG Y H, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284:80-89.
[8] HORIMOTO Y, TAN R, LIM L T.Enzymatic treatment of pork protein for the enhancement of iron bioavailability[J].International Journal of Food Sciences and Nutrition, 2019, 70(1):41-52.
[9] WALTERS M E, ESFANDI R, TSOPMO A.Potential of food hydrolyzed proteins and peptides to chelate iron or calcium and enhance their absorption[J].Foods, 2018, 7(10):172.
[10] CAETANO-SILVA M E, NETTO F M, BERTOLDO-PACHECO M T, et al.Peptide-metal complexes:Obtention and role in increasing bioavailability and decreasing the pro-oxidant effect of minerals[J].Critical Reviews in Food Science and Nutrition, 2021,61(9):1 470-1 489.
[11] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food — An international consensus[J].Food & Function, 2014, 5(6):1 113-1 124.
[12] MIYAKE M, KOGA T, KONDO S, et al.Prediction of drug intestinal absorption in human using the Ussing chamber system:A comparison of intestinal tissues from animals and humans[J].European Journal of Pharmaceutical Sciences, 2017, 96(1):373-380.
[13] SJÖGREN E, ERIKSSON J, VEDIN C, et al.Excised segments of rat small intestine in Ussing chamber studies:A comparison of native and stripped tissue viability and permeability to drugs[J].International Journal of Pharmaceutics, 2016, 505(1-2):361-368.
[14] GUO L D, HARNEDY P A, O KEEFFE M B, et al.Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J].Food Chemistry, 2015, 173:536-542.
[15] 唐顺博. 鱼鳞胶原肽亚铁螯合物的制备及性质研究[D].南昌:江西师范大学, 2020.
TANG S B.Preparation and properties of ferrous chelate of fish scale collagen peptide[D].Nanchang:Jiangxi Normal University, 2020.
[16] LYU Y, WEI K H, MENG X G, et al.Separation and identification of iron-chelating peptides from defatted walnut flake by nano LC-ESI-MS/MS and de novo sequencing[J].Process Biochemistry, 2017, 59:223-228.
[17] WU W F, LI B F, HOU H, et al.Identification of iron-chelating peptides from Pacific cod skin gelatin and the possible binding mode[J].Journal of Functional Foods, 2017, 35:418-427.
[18] CHEN M, JI H W, ZHANG Z W, et al.A novel calcium-chelating peptide purified from Auxis thazard protien hydrolysate and its binding properties with calcium[J].Journal of Functional Foods, 2019, 60:103447.
[19] SUN R N, LIU X F, YU Y, et al.Preparation process optimization, structural characterization and in vitro digestion stability analysis of Antarctic krill (Euphausia superba) peptides-zinc chelate[J].Food Chemistry, 2021, 340:128056.
[20] MIYAKE M, KONDO S, KOGA T, et al.Evaluation of intestinal metabolism and absorption using the Ussing chamber system equipped with intestinal tissue from rats and dogs[J].European Journal of Pharmaceutics and Biopharmaceutics, 2018, 122:49-53.
[21] LI Y N, JIANG H, HUANG G R.Protein hydrolysates as promoters of non-haem iron absorption[J].Nutrients, 2017, 9(6):609-627.
[22] LYU Y, LIU Q, BAO X L, et al.Identification and characteristics of iron-chelating peptides from soybean protein hydrolysates using IMAC-Fe3+[J].Journal of Agricultural and Food Chemistry, 2009, 57(11):4 593-4 597.
[23] SUN N, CUI P B, JIN Z Q, et al.Contributions of molecular size, charge distribution, and specific amino acids to the iron-binding capacity of sea cucumber (Stichopus japonicus) ovum hydrolysates[J].Food Chemistry, 2017, 230:627-636.
[24] SARABANDI K, JAFARI S M.Fractionation of flaxseed-Derived bioactive peptides and their influence on nanoliposomal carriers[J].Journal of Agricultural and Food Chemistry, 2020, 68(51):15 097-15 106.
[25] LEE S H, SONG K B.Purification of an iron-binding nona-peptide from hydrolysates of porcine blood plasma protein[J].Process biochemistry, 2009, 44(3):378-381.
[26] 王宁. 分子光谱和等温滴定量热法研究蛋白与小分子的相互作用[D].郑州:郑州大学, 2019.
WANG N.Study of Interaction between protein and small molecules by molecular spectroscopy and isothermal titration calorimetry[D].Zhengzhou:Zhengzhou University, 2019.
[27] ZHOU J, WANG X, AI T, et al.Preparation and characterization of β-lactoglobulin hydrolysate-iron complexes[J].Journal of Dairy Science, 2012, 95(8):4 230-4 236.
[28] BEYER R L, HOANG H N, APPLETON T G, et al.Metal clips induce folding of a short unstructured peptide into an α-helix via turn conformations in water.Kinetic versus thermodynamic products[J].Journal of the American Chemical Society, 2004, 126(46):15 096-15 105.