DFD(dark, firm, dry)牛肉,又被称为黑切牛肉,是一种异质肉,其颜色深黑、表面干燥,被消费者视作不新鲜和肉质差的肉品,主要由宰前应激消耗能量造成。目前,DFD牛肉是全球牛肉产业共同面临的难题之一,有研究表明,美国DFD牛肉的发生率为1.9%[1],巴西DFD牛肉发生率为4.53%[2],澳大利亚DFD牛肉发生率为10%[3],中国作为肉制品生产大国,DFD牛肉平均发生率高达10.07%,其中中原地区发生率最高,达到了23.61%[4],造成重大的经济损失。尽管不同国家对DFD牛肉的判定标准不一,相关统计的DFD牛肉发生率也有一定差异,但如今各国均没有措施有效控制DFD牛肉的发生。最近应用组学技术在肉质领域的研究得出的结果对理解肉类复杂的生物学机制以及与质量相关的生物标志物方面有很大帮助。众多学者利用基因组学和蛋白质组学探究DFD牛肉形成的内在机理,研究具体的鉴定方法和控制措施以期促进牛肉产业发展。因此,本文概述了DFD牛肉较正常牛肉的异常理化特征及其产生原因,结合组学技术深入探究DFD牛肉形成机理,并进一步总结了DFD牛肉的鉴定方法及宰后控制措施,以期为DFD牛肉控制研究和实践提供参考,从而为全面提升牛肉品质奠定基础。
1 DFD牛肉与正常牛肉的理化特征比较与产生原因分析
大量研究表明DFD牛肉较正常牛肉表现出了不同的理化特征,由于不同的研究中牛的品种、试验采用的肌肉部位、试验测定中所用仪器等的差别,不同研究中同一指标测量值存在差异,难以用统一数值范围概括,但总体而言,各指标值的高低具有规律性,具体见表1。
表1 DFD牛肉与正常牛肉理化特性比较
Table 1 Comparison of physicochemical properties between DFD beef and normal beef
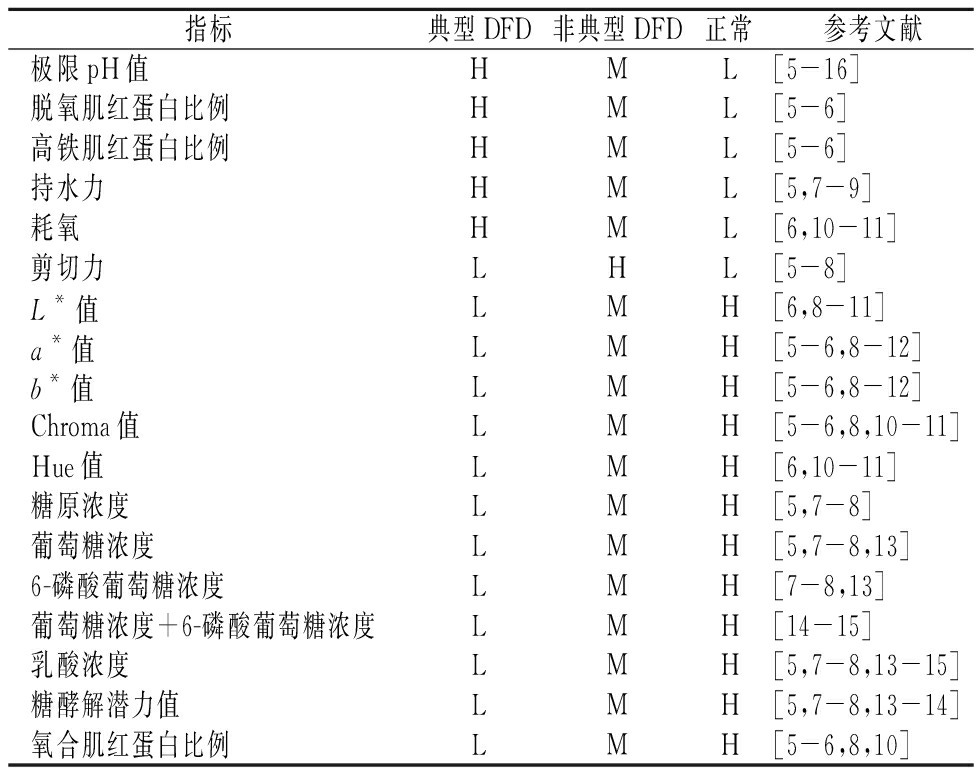
指标典型DFD非典型DFD正常参考文献极限pH值HML [5-16]脱氧肌红蛋白比例HML[5-6]高铁肌红蛋白比例HML[5-6]持水力HML[5,7-9]耗氧HML[6,10-11]剪切力LHL[5-8]L*值LMH[6,8-11]a*值LMH[5-6,8-12]b*值LMH[5-6,8-12]Chroma值LMH[5-6,8,10-11]Hue值LMH[6,10-11]糖原浓度LMH[5,7-8]葡萄糖浓度LMH[5,7-8,13]6-磷酸葡萄糖浓度LMH[7-8,13]葡萄糖浓度+6-磷酸葡萄糖浓度LMH[14-15]乳酸浓度LMH[5,7-8,13-15]糖酵解潜力值LMH[5,7-8,13-14]氧合肌红蛋白比例LMH[5-6,8,10]
注:根据pH值由大到小将牛肉分为典型DFD牛肉(>6.1),非典型DFD牛肉(5.8~6.1),正常牛肉(5.4~5.8);H表示指标值高、M表示指标值中、L表示指标值低
表1总结了DFD牛肉与正常牛肉的理化特征差异,这些差异来源于复杂的生化机理。牛体细胞在宰后脱离了原本的呼吸代谢环境,细胞代谢从原本的有氧呼吸转变为无氧呼吸,使得乳酸堆积和pH下降。在正常牛肉的糖酵解型肌肉中,糖酵解过程促进肌肉pH值从7.0左右降低到5.7~5.4。但在DFD牛肉中,由于宰前应激消耗了能量,DFD牛肉的糖原含量、葡萄糖含量和6-磷酸葡萄糖含量都较正常牛肉低,也表现为DFD牛肉的糖酵解潜力值较正常牛肉低。也由于能量储备较少,DFD牛肉无法在无氧呼吸过程中产生大量的乳酸,其pH的下降受到限制,最终产生极限pH值高的牛肉。
与正常牛肉相比,DFD牛肉的高极限pH值对牛肉的持水力、嫩度、颜色、以及耗氧有不同的影响。在高pH环境下,蛋白质变性程度小,具有更多的负电荷和更强的与水分子结合能力,且DFD牛肉肌节长度低于正常牛肉,缩小的肌节空间使游离水流动性下降,因此DFD牛肉持水力更佳[16];高pH牛肉具有较好的嫩度,而当pH降低到6.1~5.8时,蛋白水解活性降低,如钙蛋白酶和溶酶体酶系统不再处于最佳酸碱度范围[17],这可能导致牛肉韧性的增加,使非典型DFD牛肉具有质地坚硬的特征。DFD牛肉的颜色和耗氧联系紧密,在高pH的环境下,线粒体中酶的活性没有得到良好抑制,这直接导致了DFD牛肉高耗氧的特性,并对DFD牛肉的肉色产生深刻影响[11]。
肉色是生鲜牛肉最重要的品质特征,其决定性影响因素主要体现在两方面:肌红蛋白含量和组成、肌肉纤维结构和组成。一方面,生物体内的肌红蛋白以3种氧化还原形式存在:脱氧肌红蛋白(紫红色)、氧合肌红蛋白(鲜红色)和高铁肌红蛋白(褐红色),一般而言,氧合肌红蛋白含量最高[10]。在DFD牛肉中,高pH环境下线粒体活性较高,与肌红蛋白竞争氧气,使得氧合肌红蛋白合成受到抑制,且这种作用持续时间较长,TANG等[18]研究发现,在死后牛心肌中,即使在4 ℃下真空包装贮存60 d后,线粒体仍能消耗氧气。因此DFD牛肉中鲜红色的氧合肌红蛋白比例比正常牛肉中更低,脱氧肌红蛋白和高铁肌红蛋白含量比正常牛肉更高,从而解释DFD牛肉红度较低的现象[5]。另一方面,宰后肌肉纤维收缩与pH下降进程相关,HUGHES等[19]研究表明,较高的pH下牛肉缺乏肌肉纤维收缩,形成的肌纤维结构对光的散射程度较低,从而解释DFD牛肉亮度较低的现象。颜色稳定性也是牛肉重要品质特征之一。脱氧肌红蛋白在氧气存在的状态下可以发生氧化形成氧合肌红蛋白,氧合肌红蛋白可进一步形成高铁肌红蛋白,3种形式的肌红蛋白比例变化,肉色也会相应发生改变,从而解释宰后牛肉随着时间延长肉色稳定性发生变化的现象。值得一提的是,一些研究对DFD牛肉和正常牛肉的颜色稳定性研究结果并不一致,IJAZ等[8]研究发现DFD牛肉颜色稳定性较正常牛肉更低,WU等[10]研究结果与此相反。实际上,相较于正常牛肉,DFD牛肉并不总是表现出更好的颜色稳定性,这取决于肌肉纤维的组成;此外,高铁肌红蛋白还原酶活力和耗氧之间的平衡对于颜色稳定性十分重要[6]。
2 基于蛋白组学的DFD牛肉形成原因分析
大量研究学者基于蛋白组学技术针对DFD牛肉与正常牛肉的品质差异进行研究,确定其关键蛋白,从而探索DFD牛肉发生的内在机理。表2汇总了相关的关键蛋白标记物,依据功能分类主要涉及4个过程:细胞骨架与肌肉收缩、线粒体和代谢、糖酵解和糖异生、以及热休克蛋白与其他。总体上,由于DFD牛肉能量储存少,糖酵解和糖异生相关酶的含量变化降低了DFD牛肉糖酵解的能力,使得pH调控相关酶无法辅助pH快速下降,形成高pH牛肉;在高pH环境下,线粒体和代谢过程酶类的含量变化增强了线粒体呼吸作用的同时,增加了耗氧作用;细胞骨架与肌肉收缩过程和热休克蛋白相关酶的含量变化促进了DFD牛肉颜色和嫩度等特性的变化。值得注意的是,部分酶类如腺苷酸激酶同工酶1在牛宰前应激时即出现差异表达,部分酶类如肌酸激酶在宰后形成DFD牛肉时发生差异表达,前者多与pH下降过程相关,后者多与DFD牛肉品质特征相关。此外,同一过程的酶可能对多种品质特征具有影响,如线粒体和代谢相关酶不仅使耗氧作用增强,也与颜色和嫩度具有一定相关性。这些酶类的综合影响,使得DFD牛肉的理化特征与正常牛肉出现差异。
2.1 细胞骨架与肌肉收缩
细胞骨架与肌肉收缩相关酶主要与DFD牛肉的颜色和嫩度有关。DFD牛肉中基因ACTA1、ACTN2、ACTN4和MYOM3上调,MYOM1和MYOM2下调(表2)。肌动蛋白ACTA1在不同嫩度的肉中含量发生变化[21],其含量与肌肉的颜色品质呈负相关[22],主要存在于肌肉组织中,是细胞骨架和肌肉收缩结构的重要组成部分。肌动蛋白交联蛋白被认为是将肌动蛋白固定在多种细胞内结构上的蛋白质。MYOM1是肌原纤维M带的主要组成蛋白,与肌肉收缩相关,从肌肉细胞骨架中释放表明了细胞凋亡的进程。DFD牛肉较早的糖原降低可能是基因MYOM1与MYOM2在DFD牛肉中下调的原因,而后通过影响DFD牛肉肌肉纤维破碎程度以影响肉的嫩度[15]。
表2 基于组学的DFD牛肉和正常牛肉中蛋白/基因表达的相似标记物
Table 2 Similar biomarkers of protein/gene expression in DFD beef and normal beef based on omics

蛋白质名称蛋白英文名基因名称DFD牛肉中上/下调参考文献细胞骨架与肌肉收缩肌动蛋白,α-骨骼肌Actin, alpha skeletal muscleACTA1↑[15]α-肌动蛋白2Alpha-actin 2ACTN2↑[12]α-肌动蛋白4Alpha-actin -4ACTN4↑[12]肌间蛋白-1Myomesin-1MYOM1↓[15]肌间蛋白-2Myomesin (M-protein) 2MYOM2↓[10,20]肌间蛋白-3Myomesin-3MYOM3↑[12]线粒体和代谢ATP酶ATPase, Ca2+ transporting, cardiac muscle, fast twitch 1ATP2A1↓[14]ATP合酶亚基,线粒体ATP synthase subunit beta,mitochondrialATP5B↑[9]ATP合酶膜亚基eATP synthase membrane subunit eATP5ME↑[12]烯酰-CoA水合酶Enoyl-CoA hydrataseECHS1↑[10,12]苹果酸脱氢酶1Malate dehydrogenase 1MDH1↑[12]苹果酸脱氢酶2Malate dehydrogenase 2MDH2↑[10]丙酮酸脱氢酶激酶4Pyruvate dehydrogenase kinase 4PDK4↑[10,14]三磷酸腺苷依赖性-6-磷酸果糖激酶ATP-dependent-6-phosphofructokinasePFKM↑[10,20]乳酸脱氢酶DLactate dehydrogenase DLDHD↓[10]糖酵解和糖异生腺苷酸激酶同工酶1Adenylate kinase isoenzyme 1AK1↓[15,20]L-乳酸脱氢酶AL-lactate dehydrogenase ALDHA↓[15]糖原磷酸化酶Glycogen phosphorylase, musclePYGM↓[12,20]磷酸丙糖异构酶Triosephosphate isomeraseTPI↓[20]磷酸丙糖异构酶1Triosephosphate isomerase1 TPI1↑[9]30 kDa甘油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenaseGAPDH30↓[20]35 kDa甘油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenaseGAPDH35↓[20]甘油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenaseGAPDH↓[15]葡萄糖-6-磷酸异构酶Glucose-6-phosphate isomeraseGPI↓[12,20]热休克蛋白与其他IV型胶原蛋白α1多肽链Collagen alpha-1 (IV) chainCOL4A1↓[12]IV型胶原蛋白α2多肽链Collagen alpha-2 (IV) chainCOL4A2↓[12]VIII型胶原蛋白α1多肽链Collagen, type VIII, alpha 1COL8A1↑[14]70 kDa热休克蛋白70 kDa-Heat shock proteinHSP70↑[20]27 kDa热休克蛋白1Heat shock 27 kDa protein 1HSPB1↑[15]DnaJ同源亚家族C成员11DnaJ homolog subfamily C member 11DNAJC11↑[10]GrpE蛋白同源物GrpE protein homolog 1 GRPEL1↑[10]29 kDa肌酸激酶MCreatine kinase M-typeCKM29↑[20]40 kDa肌酸激酶MCreatine kinase M chainCKM40↓[20]肌酸激酶MCreatine kinaseCKM↓[15]
注:↑表示上调,↓表示下调
2.2 线粒体与代谢
线粒体与代谢相关酶主要与耗氧有关。在线粒体和代谢的过程中,基因LDHD和ATP2A1下调,其他8个上调(表2)。LDHD酶分布在线粒体,参与到乳酸分解中。ATP2A1定位于内质网膜和线粒体,参与到ATP水解和Ca2+再摄取到肌质网膜的过程,其基因的下调可能与ATP不足有关。参与Ca2+调节的蛋白质对肉质很重要,MICKELSON等[23]研究表明宰前应激使得猪的Ca2+释放速率约为正常猪的2倍,这表明基因ATP2A1在DFD肉中的下调和宰前应激有关,并通过影响Ca2+调节以影响肉的嫩度。ECHS1参与脂肪酸代谢,主要参与脂肪酸β氧化,YU等[24]研究发现以氧化型纤维为主的牛腰大肌中脂肪酸β氧化酶表达量比以糖酵解型纤维为主的背最长肌更高,说明基因ECHS1的上调使合成ATP时消耗更多氧气。苹果酸脱氢酶是三羟酸循环的关键酶,其中MDH1通常存在于细胞质,MDH2存在于线粒体,它们可以催化底物产生ATP和还原性辅酶Ⅰ。MOHAN等[25]报道了苹果酸脱氢酶的存在增加了牛肉还原性辅酶Ⅰ的形成,在DFD牛肉中丰度增加增强了细胞的耗氧,GAGAOUA等[22]则报道了还原性辅酶Ⅰ与高铁肌红蛋白还原酶活性呈负相关。这些耗氧作用的增强,使得线粒体与肌红蛋白竞争氧气的作用增强,间接导致了DFD牛肉颜色的变化。PDK4参与丙酮酸代谢,代谢产物乙酰辅酶A是三羟酸循环中必须的底物。JEREZ-TIMAURE等[14]认为PDK4是有助于解释DFD牛肉发生的关键因素之一,其研究表明该基因的表达和糖原浓度有很强的反比关系。此外,PDK4参与到脂肪酸代谢中,SIBUT等[26]报告了高脂鸡肉中基因PDK4的下调,这在JEREZ-TIMAURE等[14]的研究中得到了验证;PDK4还与细胞饥饿应答有关,因此动物宰前饥饿应激可能是DFD牛肉中基因PDK4上调的原因之一。综上,线粒体和代谢相关的酶的差异表达不仅会影响DFD牛肉的耗氧、还会影响肉的颜色的嫩度。
2.3 糖酵解与糖异生
糖酵解与糖异生相关酶主要与pH下降的进程有关。AK1催化ATP的末端磷酸基团转移到腺嘌呤核糖核苷酸以形成二磷酸腺苷,在能量稳态中起着重要作用。当AK1丰度增加时,二磷酸腺苷的增加可能会促进磷酸烯醇丙酮酸转化为丙酮酸,这是糖酵解循环的限速步骤。PFKM是糖酵解的限速酶,催化D-果糖-6-磷酸转化为果糖-1,6-二磷酸,这是糖酵解的第一步。PFKM与脱氧肌红蛋白呈正相关,与耗氧量呈负相关[10],在生化过程中依赖于ATP,在底物足量的前提下,PFKM上调会加速糖酵解的进程。然而,DFD组中该酶丰度增加,说明宰前应激消耗能量是基因PFKM上调的原因。LDHA参与由丙酮酸合成S-乳酸的子途径的第一步,在DFD牛肉中丰度下降会使乳酸的合成以及pH的下降速度减缓。此外,有研究表明基因LDHA的上调与牛背最长肌颜色稳定性的增加有关,且具有作为嫩度生物标志物的潜力[21]。PYGM参与到糖原分解为葡萄糖的过程,其丰度下降可能使得DFD牛肉糖原利用能力降低。TPI参与糖酵解途径中甘油磷酸合成D-甘油醛-3-磷酸的第一步,在DFD牛肉中表现为丰度增加或下降,与牛肉的a*值呈负相关[27],并与牛肉的嫩度有关[21],在FRANCO等[9]和D AZ等[20]研究中表达差异可能与样本的极限pH不同有关。GAPDH35和GAPDH30是GAPDH的35和30 kDa两个片段,参与到由D-甘油醛3-磷酸合成丙酮酸的子途径的第一步,与牛肉颜色稳定性和嫩度相关[21, 27]。GPI催化葡萄糖-6-磷酸转化为果糖-6-磷酸,这是糖酵解的第二步,也是糖异生过程中的反向反应。综上,这些糖酵解与糖异生有关的酶的活性变化使得DFD牛肉糖酵解的能力降低,从而影响DFD牛肉的pH降低进程。
AZ等[20]研究中表达差异可能与样本的极限pH不同有关。GAPDH35和GAPDH30是GAPDH的35和30 kDa两个片段,参与到由D-甘油醛3-磷酸合成丙酮酸的子途径的第一步,与牛肉颜色稳定性和嫩度相关[21, 27]。GPI催化葡萄糖-6-磷酸转化为果糖-6-磷酸,这是糖酵解的第二步,也是糖异生过程中的反向反应。综上,这些糖酵解与糖异生有关的酶的活性变化使得DFD牛肉糖酵解的能力降低,从而影响DFD牛肉的pH降低进程。
2.4 热休克蛋白与其他
热休克蛋白具有抗凋亡和保护细胞免受氧化应激的作用,它们的存在有助于蛋白质保持原有的构象和生物功能,在DFD牛肉表现出丰度增加,可能是因为宰前应激和宰后细胞环境变化。GRPEL1和DNAJC11是HSP70家族成员,可以辅助HSP70家族蛋白维持细胞完整性和修复变性蛋白[21]。DFD牛肉中基因GRPEL1和DNAJC11过表达,其伴侣功能可减轻应激对细胞的损伤。此外,GRPEL1与HSPE1相互作用强,HSPE1参与线粒体蛋白导入和大分子组装。因此,基因GRPEL1的上调可以保护肌红蛋白和线粒体免受氧化应激,使其颜色更稳定。OUALI等[28]第一次提出热休克蛋白由于其抗凋亡功能而在肉类嫩度中发挥作用;吴爽等[29]研究发现DFD牛肉肌浆蛋白中基因HSPB1上调;MAHMOOD等[15]研究发现基因HSPE1在非典型DFD牛肉中上调而不在典型DFD牛肉中上调;LOMIWES等[17]研究发现高剪切力牛肉中小热休克蛋白丰度增加,以上研究表明热休克蛋白的丰度增加可能是非典型DFD牛肉肉质坚硬的原因之一。CKM存在于具有周期性能量需求波动的组织中,比如骨骼肌,是细胞中一种能量转导的酶,它可逆地催化磷酸在ATP和各种磷化剂之间的转移,其丰度下降会使得牛肉ATP消耗速率降低,pH下降的速率也可能因此被延缓。D′ALESSANDRO等[27]发现宰后48 h pH值降低到5.61的韧性肉组中的CKM含量,相较于宰后48 h pH值降低到5.48的嫩肉组丰度降低,表明CKM可能与嫩度相关[21]。与胶原蛋白相关的COL4A1、COL4A2和COL8A1参与到细胞外基质结构组成中,其存在影响肉的嫩度,并且,胶原蛋白会发生交联,其交联程度可能进一步影响肉的嫩度变化[30]。
2.5 其他酶类
在表2列举的这些标记物之外,还有一些酶类在DFD牛肉的pH下降等过程中起重要作用。例如,糖原在糖原磷酸化酶(glycogenphosphorylase, GP)和糖原脱支酶(glycogen debranching enzyme, GDE)的催化下分解成为1-磷酸葡萄糖和葡萄糖。因为GDE的活性会受到畜体快速冷却的影响[27],所以糖酵解过程会受到宰后胴体温度变化的影响。当温度从39 ℃降至4 ℃时,GDE的活性从100%下降到10%,在APAOBLAZA等[13]研究中,这种酶在正常pH牛胴体和DFD牛胴体中没有显著性差别。GP和GDE具有协同作用,其中GP对于糖原分解贡献了40%~50%;APAOBLAZA等[13]发现高极限pH组的GP活性在宰后0 h与24 h对比下没有表现出显著性变化,低极限pH组的GP活性表现出显著的上升。这表明GP的活性在底物即糖原含量高时会丰度增加,这也可能是宰后初期,糖原含量高的胴体pH下降更快的原因之一。此外,研究中发现正常pH组的腺苷酸激酶活性是高极限pH组的4倍,腺苷酸激酶可以激活磷酸化酶激酶,进而激活GP,从而促进糖原分解,也可以通过磷酸化磷酸果糖激酶-2,从而促进糖酵解关键限速酶6-磷酸果糖激酶1的变构激活剂2-磷酸果糖的形成。
3 DFD牛肉的鉴定方法分析
相较于正常成熟的牛肉,DFD牛肉表面颜色呈现出深黑红色,肌肉表面干燥,触摸时硬度较大。因此,消费者购买鲜肉时通常通过对肉的颜色,表面干燥程度,触碰时候的硬度以及气味对肉的品质进行主观判定,然而这种方法主要取决于消费者购买经验,无法准确对DFD牛肉进行区分。现阶段,学者利用客观的鉴定方法获得了一些有效的结果,下文综述了根据肉色、极限pH、糖原含量或糖酵解潜力鉴定DFD牛肉的方法。
3.1 根据肉色鉴定DFD牛肉
目前根据肉色对DFD牛肉进行判定已经得到普及。加拿大牛肉评级署以背最长肌为评定部位,利用比色卡对牛肉颜色进行评级,当肉呈现暗红色或紫色时,被评为DFD[7]。同样,在澳大利亚,澳大利亚肉类标准体系也利用色卡进行牛肉分级,当色卡得分≥3时,牛肉被归类为DFD。以上2种判定方法都是主观的,此类分级标准都由培训过的专业人员完成。
色度计作为客观的颜色测量仪器被广泛应用于牛肉颜色的测量。SWATLAND[31]报道了色度计相较于主观评定的优势,对于pH≥6.0的肉样,光纤维探头评定的准确度达到了80%。还有研究发现消费者对色泽的偏好反映在色度计的测量值上,总体上L*值不低于34,a*值不低于9.5,最佳的b*值为19左右[32-33]。HOLMAN等[32]研究表明,30.5的Chroma值可作为DFD的有效阈值。实际上,不同地域人们对于肉的颜色喜好有所区别,最佳色度值也应该根据消费者有所调整。在ZHANG等[34]对亚洲4322名消费者的网络调查研究中,颜色的接受阈值为:L*值≥31.4,a*值≥16.4,b*值≥6.5,Chroma值≥17.4,hue值≥22.5。这项调查也发现相较于其他地域的消费者,亚洲消费者偏好肉色稍微偏深的牛肉。
3.2 根据极限pH鉴定DFD牛肉
根据极限pH判定DFD牛肉具有便捷和成本低的优点,传统上将DFD牛肉的极限pH划分在6.0以上[35],不过不同地域牛的品种和消费者对牛肉颜色喜好有所差异,因此,各国根据极限pH对DFD牛肉的判定标准也有所差别。在澳大利亚,当牛肉pH大于5.7时,会被判定为DFD牛肉;在加拿大,DFD牛肉pH阈值则是5.8,而典型DFD牛肉阈值则是6.0[7]。在中国,通常认为典型的DFD牛肉pH大于6.1[8, 10],而对于DFD阈值,WU等[10]认为是5.8,IJAZ等[8]则认为是5.7。也就是说,根据极限pH进行DFD牛肉划分时,通常会分成3个等级:典型DFD牛肉,非典型DFD牛肉,正常pH牛肉(以文献[10]中的划分为例,典型DFD牛肉的pH≥6.1,非典型DFD牛肉的pH范围为6.1~5.8,正常pH牛肉的pH范围为5.8~5.4)。非典型DFD的牛肉颜色介于典型DFD牛肉和正常pH牛肉之间,有明显差异的是,非典型DFD牛肉的韧性大嫩度小,而典型DFD牛肉以及正常pH牛肉的嫩度更好。相较于根据极限pH进行判定的方法,非典型DFD牛肉和典型DFD牛肉在韧性上的这种差别难以通过视觉进行区分。
肉色和pH有一定的生化联系,但并不紧密。MURRAY等[36]在阉牛和母牛胴体进行的调查中,发生DFD的牛肉在pH小于5.6、5.6~5.8、5.8~6.0和大于6.0的区间中发生率分别为6.4%、43.6%、36.8%和13.2%。HUGHES等[37]根据澳大利亚肉类色卡对牛肉进行分类,发现pH为5.4、5.6、5.8、6.0和6.2的肉色评分值大于3的比例分别为1%、5%、28%、74%和96%。PONNAMPALAM等[38]以极限pH阈值为5.7、5.8和6.0为基础,将一种杂交羔羊胴体划分为DFD,DFD比率分别是25%、12%和4%。这说明按照颜色进行分类和按照pH进行分类的结果并不总是一致,按照pH分级为正常的牛肉也可能拥有较差的颜色特征。
3.3 根据糖原或糖酵解潜力鉴定DFD牛肉
DFD牛肉的成因主要是动物宰前能量消耗过多,因此可用宰后糖原含量或糖酵解潜力作为判定DFD牛肉的依据。糖原的消耗贯穿在宰前和宰后,HENCKEL等[39]测定了猪背最长肌糖原的含量,发现宰后肌糖原含量在0~53 μmol/g的时候,糖原浓度和极限pH的大小成负相关关系。WARRISS[40]研究表明糖原浓度降到45 μmol/g以下时候,宰后肌肉pH的下降是有限的。在APAOBLAZA等[13]对牛背最长肌的研究中,屠宰后30 min的糖原含量在正常pH胴体中为(65.5±5.61) μmol/g,在高pH胴体中为(29.5±7.22) μmol/g,分别导致宰后24 h的pH为5.71±0.01和6.34±0.05。实际上,由于肌肉纤维的组成差异,动物胴体不同部位对糖原的利用能力是不同的,而且肌肉中可以用的能量形式不仅有糖原,还有葡萄糖、6-磷酸葡萄糖等。
因此,MONIN等[41]提出了一个公式评估宰后胴体的糖酵解潜力:[糖酵解潜力]=[乳酸浓度]+2([糖原浓度]+[6-磷酸葡萄糖浓度]+[葡萄糖浓度])。糖酵解潜力和极限pH高度相关[8, 41],ZEROUALA等[42]研究发现,100 μmol/g左右的糖酵解潜力是一个阈值,当糖酵解潜力高于这一数值时,极限pH会降到5.5及以下。WULF等[43]研究则表明在背最长肌中,糖酵解潜能值大于50 μmol/g时,极限pH能够降低到5.8以下,但HOLDSTOCK等[7]研究发现,极限pH>5.80的肌肉中糖酵解潜力可能大于50 μmol/g。相较于根据颜色或极限pH进行鉴定的方法,根据糖原或糖酵解潜力鉴定DFD牛肉的方法过程较为繁琐,但此方法具有可以在宰后立即进行鉴定的优点。因此,对于进一步采取DFD牛肉宰后控制而言,根据糖原或糖酵解潜力鉴定DFD牛肉是极有意义的。
4 DFD牛肉的宰后控制措施
动物宰前应激是DFD发生的重要原因,宰前影响因素包括动物品种、激素的应用、性别、屠宰年龄、气候条件和季节变化、宰前禁食、售卖市场和宰前运输等[4],针对这些因素,许多宰前管理措施,例如减小运输条件的影响、避免混群、宰前控制饮食、动物福利等均有实施,但DFD发生率并未明显降低。因此,下文综述了有机酸、气调包装等DFD牛肉的宰后控制措施。
4.1 有机酸控制DFD牛肉
较高的pH引发了DFD牛肉的一系列肉质问题,而适量添加有机酸能够降低pH值。SAWYER等[44]研究表明,在宰后72 h向牛外脊肉注射0.25%乳酸,真空包装2 ℃贮藏48 h后能使极限pH值有效降低,并能消除掉DFD牛肉煮后的红粉色,且在从真空包装取出后前4天保持较稳定、接近正常牛肉煮熟后的肉色。APPLE等[45]研究结果与此一致,发现加入0.50%的乳酸可以有效降低pH、改善生牛肉和熟牛肉的颜色以及降低熟的DFD牛肉特有的风味。此外,柠檬酸也有改善DFD牛肉品质的潜力,STACKHOUSE等[46]研究表明,用pH为2.5的柠檬酸溶液可以有效降低DFD牛肉pH和改善熟牛肉的颜色,但对鲜牛肉的肉色改善较小。
4.2 气调包装控制DFD牛肉
高氧气调包装和CO气调包装对DFD牛肉能起到一定的控制效果,但由于CO的毒性,CO气调包装的可用性具有争议。DFD牛肉的颜色较深的重要原因在于线粒体与肌红蛋白竞争氧气,通过高氧包装提供足量的氧气,可以弱化线粒体耗氧带来的不利影响。LU等[47]研究了不同浓度氧气对DFD牛肉的改善效果,发现60%和80%氧气浓度的包装能够将DFD牛肉的颜色改善到正常牛肉水平,且具有较低的高铁肌红蛋白还原活性。由于高氧环境,牛肉的脂肪氧化程度加深,可考虑在采取高氧包装的同时中向肉中加入抗氧化剂如迷迭香以达到抗氧化的作用。CO由于和肌肉中血红素结合后呈现比氧合肌红蛋白更稳定的樱桃红,也具有改善DFD牛肉颜色的潜力。ZHANG等[48]的研究中发现0.4%的CO气调包装具有和80%氧气浓度包装相近的肉色改善效果,并且脂质氧化水平得到了控制。
4.3 控制DFD牛肉的其他措施
RAMANATHAN等[49]研究表明,亚硝酸盐嵌入式包装也具有提高DFD牛肉红度的潜力,并且同时使用0.2%迷迭香会使得表面颜色更好。MOISEEV等[50]研究发现不仅乳酸的添加具有效果,添加0.3%过氧化钙也可以一定程度上促进DFD牛肉熟肉的褐变,但此剂量会引起过度氧化使得肉饼有轻微的绿色。其他的方式,如加入多聚磷酸盐,也可以达到降低DFD牛肉pH、改善DFD牛肉异质特征的目的[51]。
5 结语
DFD牛肉的异质现象主要由宰前应激消耗能量造成,结合组学技术可以更加深入地了解其发生机理。随着我国肉类工业发展,基于DFD牛肉形成原因进行DFD牛肉鉴定和宰后控制是极有必要的,这可以一定程度地提升人们的生活品质和减小肉类工业的经济损失。目前,针对DFD牛肉宰后控制的方法较少且存在一定的缺陷,在今后的研究中将已有的宰后控制方法如高氧包装与组学技术结合,进一步探索DFD牛肉形成机理,完善和开发宰后控制措施,将是改善DFD牛肉品质的方向之一。
[1] BOYKIN C A, EASTWOOD L C, HARRIS M K, et al.National Beef Quality Audit—2016:In-plant survey of carcass characteristics related to quality, quantity, and value of fed steers and heifers[J].Journal of Animal Science, 2017, 95(7):2 993-3 002.
[2] ROSA A, FONSECA R, BALIEIRO J C, et al.Incidence of DFD meat on Brazilian beef cuts[J].Meat Science, 2016, 112:132-133.
[3] PONNAMPALAM E N, HOPKINS D L, BRUCE H, et al.Causes and contributing factors to “dark cutting” meat:Current trends and future directions:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(3):400-430.
[4] 赵群. 中国DFD牛肉发生率调研及肉牛宰前管理规范[D]. 泰安:山东农业大学, 2013.
ZHAO Q. Survey on DFD beef incidences in China and specification in pre-slaughter management of cattle[D]. Tai′an:Shandong Agricultural University, 2013.
[5] MAHMOOD S, ROY B C, LARSEN I L, et al.Understanding the quality of typical and atypical dark cutting beef from heifers and steers[J].Meat Science, 2017, 133:75-85.
[6] WU S, HAN J N, LIANG R R, et al.Investigation of muscle-specific beef color stability at different ultimate pHs[J].Asian-Australasian Journal of Animal Sciences, 2020, 33(12):1 999-2 007.
[7] HOLDSTOCK J, AALHUS J L, UTTARO B A, et al.The impact of ultimate pH on muscle characteristics and sensory attributes of the longissimus thoracis within the dark cutting (Canada B4) beef carcass grade[J].Meat Science, 2014, 98(4):842-849.
[8] IJAZ M, LI X, ZHANG D Q, et al.Association between meat color of DFD beef and other quality attributes[J].Meat Science, 2020, 161:107954.
[9] FRANCO D, MATO A, SALGADO F J, et al.Tackling proteome changes in the longissimus thoracis bovine muscle in response to pre-slaughter stress[J].Journal of Proteomics, 2015, 122:73-85.
[10] WU S, LUO X, YANG X Y, et al.Understanding the development of color and color stability of dark cutting beef based on mitochondrial proteomics[J].Meat Science, 2020, 163:108046.
[11] RAMANATHAN R, KIYIMBA F, GONZALEZ J, et al.Impact of up-and downregulation of metabolites and mitochondrial content on pH and color of the longissimus muscle from normal-pH and dark-cutting beef[J].Journal of Agricultural and Food Chemistry, 2020, 68(27):7 194-7 203.
[12] KIYIMBA F, HARTSON S D, ROGERS J, et al.Changes in glycolytic and mitochondrial protein profiles regulates postmortem muscle acidification and oxygen consumption in dark-cutting beef[J].Journal of Proteomics, 2021, 232:104016.
[13] APAOBLAZA A, GALAZ A, STROBEL P, et al.Glycolytic potential and activity of adenosine monophosphate kinase (AMPK), glycogen phosphorylase (GP) and glycogen debranching enzyme (GDE) in steer carcasses with normal (< 5.8) or high (>5.9) 24 h pH determined in M.longissimus dorsi[J].Meat Science, 2015, 101:83-89.
[14] JEREZ-TIMAURE N, GALLO C, RAMíREZ-REVECO A, et al.Early differential gene expression in beef Longissimus thoracis muscles from carcasses with normal (< 5.8) and high (> 5.9) ultimate pH[J].Meat Science, 2019, 153:117-125.
[15] MAHMOOD S, TURCHINSKY N, PARADIS F, et al.Proteomics of dark cutting Longissimus thoracis muscle from heifer and steer carcasses[J].Meat Science, 2018, 137:47-57.
[16] 孙文彬,罗欣,毛衍伟,等. 正常牛肉与DFD牛肉成熟过程中保水性和水分状态变化[J]. 食品科学, 2020, 41(13): 14-21.
MAO W B, LUO X, MAO Y W, et al. Changes in water retention and moisture state of normal and dark, firm and dry beef during postmortem aging[J]. Food Science, 2020, 41(13): 14-21.
[17] LOMIWES D, FAROUK M M, FROST D A, et al.Small heat shock proteins and toughness in intermediate pHu beef[J].Meat Science, 2013, 95(3):472-479.
[18] TANG J, FAUSTMAN C, HOAGLAND T A, et al.Postmortem oxygen consumption by mitochondria and its effects on myoglobin form and stability[J].Journal of Agricultural and Food Chemistry, 2005, 53(4):1 223-1 230.
[19] HUGHES J, CLARKE F, PURSLOW P, et al.High pH in beef longissimus thoracis reduces muscle fibre transverse shrinkage and light scattering which contributes to the dark colour[J].Food Research International, 2017, 101:228-238.
[20] DíAZ F, DíAZ-LUIS A, SIERRA V, et al.What functional proteomic and biochemical analysis tell us about animal stress in beef?[J].Journal of Proteomics, 2020, 218:103722.
[21] PICARD B, GAGAOUA M.Proteomic investigations of beef tenderness[J].Proteomics in Food Science, 2017:177-197.
[22] GAGAOUA M, HUGHES J, TERLOUW E M C, et al.Proteomic biomarkers of beef colour[J].Trends in Food Science & Technology, 2020, 101:234-252.
[23] MICKELSON J R, LOUIS C F.Malignant hyperthermia:Excitation-contraction coupling, Ca2+ release channel, and cell Ca2+ regulation defects[J].Physiological Reviews, 1996, 76(2):537-592.
[24] YU Q, TIAN X, SHAO L, et al.Label-free proteomic strategy to compare the proteome differences between longissimus lumborum and psoas major muscles during early postmortem periods[J].Food Chemistry, 2018, 269:427-435.
[25] MOHAN A, HUNT M C, MUTHUKRISHNAN S, et al.Myoglobin redox form stabilization by compartmentalized lactate and malate dehydrogenases[J].Journal of Agricultural and Food Chemistry, 2010, 58(11):7 021-7 029.
[26] SIBUT V, HENNEQUET-ANTIER C, LE BIHAN-DUVAL E, et al.Identification of differentially expressed genes in chickens differing in muscle glycogen content and meat quality[J].Bmc Genomics, 2011, 12(1):1-13.
[27] D′ALESSANDRO A, MARROCCO C, RINALDUCCI S, et al.Chianina beef tenderness investigated through integrated Omics[J].Journal of Proteomics, 2012, 75(14):4 381-4 398.
[28] OUALI A, HERRERA-MENDEZ C H, COULIS G, et al.Revisiting the conversion of muscle into meat and the underlying mechanisms[J].Meat Science, 2006, 74(1):44-58.
[29] 吴爽,王磊,杨啸吟,等. 基于肌浆蛋白质组研究黑切牛肉的形成机制[J]. 食品科学, 2020, 41(5): 1-7.
WU S, WANG L, YANG X Y, et al. Understanding the formation mechanism of dark cutting beef based on sarcoplasmic proteomics[J]. Food Science, 2020, 41(5): 1-7.
[30] 曹银娟,韩玲,余群力,等. 冻融对牛瘤胃平滑肌胶原蛋白降解、交联及品质的影响[J/OL]. 食品科学,2021.http://kns.cnki.net/kcms/detail/11.2206.ts.20210303.1730.006.html.
CAO Y J, HAN L, YU X L, et al. The effect of freeze-thaw cycles on the degradation, cross-linking and quality of bovine rumen smooth muscle collagen[J/OL]. Food Science,2021.http://kns.cnki.net/kcms/detail/11.2206.ts.20210303.1730.006.html.
[31] SWATLAND H J.Effect of acidity on the optical transmittance of bovine myofibrillar proteins:How meat traps light at low wavelengths[J].Journal of Animal Science, 1990, 68(5):1 284-1 290.
[32] HOLMAN B W B, KERR M J, MORRIS S, et al.The identification of dark cutting beef carcasses in Australia, using Nix Pro Color Sensor? colour measures, and their relationship to bolar blade, striploin and topside quality traits[J].Meat Science, 2019, 148:50-54.
[33] KHLIJI S, VAN DE VEN R, LAMB T A, et al.Relationship between consumer ranking of lamb colour and objective measures of colour[J].Meat Science, 2010, 85(2):224-229.
[34] ZHANG Y N, HOLMAN B W B, MAO Y W, et al.Determination of a pH threshold for dark cutting beef based on visual evaluation by Asian consumers[J].Meat Science, 2021, 172:108347.
[35] BRISKEY E J.Etiological status and associated studies of pale, soft, exudative porcine musculature[J].Advances in Food Research, 1964, 13:89-178.
[36] MURRAY A C.Factors affecting beef color at time of grading[J].Canadian Journal of Animal Science, 1989, 69(2):347-355.
[37] HUGHES J M, KEARNEY G, WARNER R D.Improving beef meat colour scores at carcass grading[J].Animal Production Science, 2014, 54(4):422-429.
[38] PONNAMPALAM E N, JACOBS J L, KNIGHT M I, et al.Understanding the action of muscle iron concentration on dark cutting:An important aspect affecting consumer confidence of purchasing meat[J].Meat Science, 2020, 167:108156.
[39] HENCKEL P, KARLSSON A, JENSEN M T, et al.Metabolic conditions in porcine longissimus muscle immediately pre-slaughter and its influence on peri-and post mortem energy metabolism[J].Meat Science, 2002, 62(2):145-155.
[40] WARRISS P D.The handling of cattle pre-slaughter and its effects on carcass and meat quality[J].Applied Animal Behaviour Science, 1990, 28(1-2):171-186.
[41] MONIN G, SELLIER P.Pork of low technological quality with a normal rate of muscle pH fall in the immediate post-mortem period:The case of the Hampshire breed[J].Meat Science, 1985, 13(1):49-63.
[42] ZEROUALA A C, STICKLAND N C.Cattle at risk for dark-cutting beef have a higher proportion of oxidative muscle fibres[J].Meat Science, 1991, 29(3):263-270.
[43] WULF D M, EMNETT R S, LEHESKA J M, et al.Relationships among glycolytic potential, dark cutting (dark, firm, and dry) beef, and cooked beef palatability[J].Journal of Animal Science, 2002, 80(7):1 895-1 903.
[44] SAWYER J T, APPLE J K, JOHNSON Z B, et al.Fresh and cooked color of dark-cutting beef can be altered by post-rigor enhancement with lactic acid[J].Meat Science, 2009, 83(2):263-270.
[45] APPLE J K, SAWYER J T, MEULLENET J F, et al.Lactic acid enhancement can improve the fresh and cooked color of dark-cutting beef[J].Journal of Animal Science, 2011, 89(12):4 207-4 220.
[46] STACKHOUSE R J, APPLE J K, YANCEY J W S, et al.Postrigor citric acid enhancement can alter cooked color but not fresh color of dark-cutting beef[J].Journal of Animal Science, 2016, 94(4):1 738-1 754.
[47] LU X, CORNFORTH D P, CARPENTER C E, et al.Effect of oxygen concentration in modified atmosphere packaging on color changes of the M.longissimus thoraces et lumborum from dark cutting beef carcasses[J].Meat Science, 2020, 161:107999.
[48] ZHANG Y, QIN L, MAO Y, et al.Carbon monoxide packaging shows the same color improvement for dark cutting beef as high oxygen packaging[J].Meat Science, 2018, 137:153-159.
[49] RAMANATHAN R, MITACEK R M, BILLUPS S D, et al.Novel nitrite-embedded packaging improves surface redness of dark-cutting longissimus steaks[J].Translational Animal Science, 2018, 2(2):135-143.
[50] MOISEEV I V, CORNFORTH D P.Treatments for prevention of persistent pinking in dark-cutting beef patties[J].Journal of Food Science, 1999, 64(4):738-743.
[51] YOUNG O A, ZHANG S X, FAROUK M M, et al.Effects of pH adjustment with phosphates on attributes and functionalities of normal and high pH beef[J].Meat Science, 2005, 70(1):133-139.