乳液为一相(分散相)以液滴的形式分散于另一相(连续相)中所形成的分散体系,基于分散相和连续相分类方式,食品中有2种常规乳液,分别是油包水(W/O)和水包油(O/W)乳液。除常规乳液外,还有多种复杂结构的乳液(图1),如Pickering乳液、多层乳液、多重乳液、乳液凝胶、纳米乳液等。纳米乳液是乳液液滴平均粒径在20~100 nm,纳米乳液的平均粒径有时与微乳液相同,但纳米乳液在热力学上不稳定,而微乳液在热力学上是稳定的。Pickering乳液是通过固体颗粒物理稳定界面的一种乳液。油-水界面处堆积的颗粒形成的致密堆积层形成Pickering乳液,固体颗粒层基于空间稳定机制保护液滴免于絮凝和聚结。多层乳液通常通过逐层静电吸附制备。水包油包水(W/O/W)和油包水包油(O/W/O)乳液是称为“乳液中乳液”的复杂液体分散系统,其中一种分散液体的液滴进一步分散在另一种液体中[1]。天然高分子主要包含蛋白和多糖两大类,由于其具有良好的乳化特性,因此能够用于构建并稳定乳液结构。
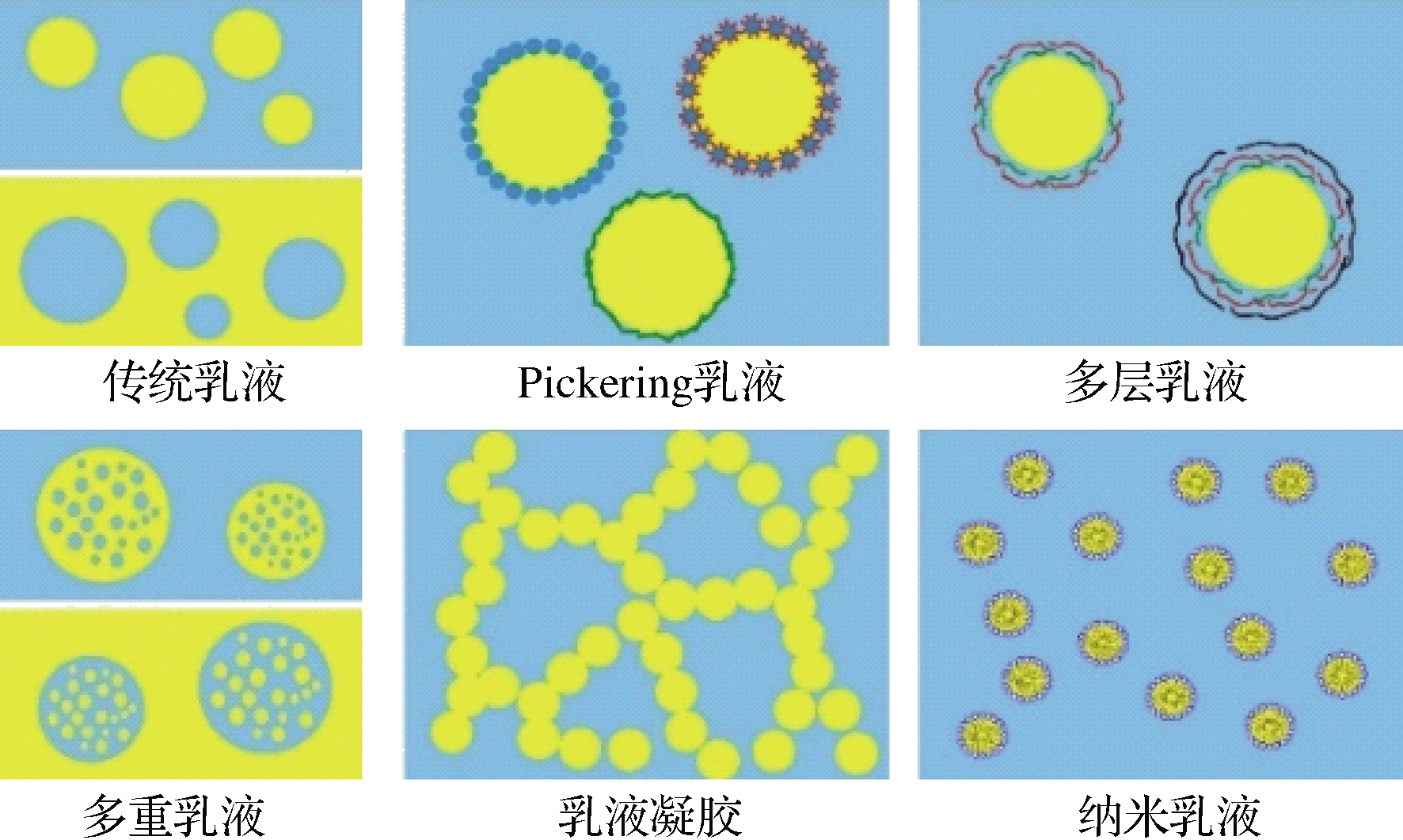
图1 复杂结构乳液
Fig.1 Complex emulsion tupes
1 蛋白类天然高分子
1.1 明胶
明胶是源自动物胶原蛋白加工的蛋白质,具有两亲性,但是其乳化性相对较弱。明胶单独作为乳化剂时,得到的乳液液滴尺寸通常较大,因此明胶可通过疏水基团接枝改性或与其他乳化剂结合使用以提高其作为复合乳化剂的有效性。SURH等[2] 研究了不同分子质量的鱼明胶的乳化特性,以及pH,盐和热处理对明胶稳定的乳液稳定性的影响,发现高分子质量的鱼明胶更有利于乳液稳定。通过静电相互作用制备得到十二烷基磺酸钠-鱼明胶多重乳液在不同温度下均表现出较好的稳定性[3]。与蛋白单组分制备的乳液相比,通过层层吸附得到的乳清蛋白-鱼明胶交联产物制备得到的乳液表现出优异的理化稳定性[4]。ZEEB等[5]研究了酶促交联对甜菜果胶-鱼明胶双层乳液的稳定作用,发现漆酶处理的双层乳液的冻融稳定性和上浮现象得到了显著改善。鱼明胶-阿拉伯胶复合物用于制备凝胶乳液,在较低pH值下观察到相邻油滴吸附层之间的较大分子间存在连接性,可实现凝胶网络扩展[6]。
1.2 玉米醇溶蛋白
玉米醇溶蛋白是玉米淀粉工业中湿法加工的副产物—玉米黄粉中的重要蛋白质,因其富含疏水性氨基酸(亮氨酸,脯氨酸和丙氨酸)不溶于水。DE等[7] 使用未改性的玉米醇溶蛋白胶体颗粒来稳定Pickering乳液,发现其稳定性差、易于上浮。玉米醇溶蛋白可通过与其他天然高分子混合改善其润湿性,从而实现更高的乳化性和乳化稳定性。ZOU等[8]制备了基于氢键稳定的玉米醇溶蛋白/鞣酸复合物胶体颗粒稳定的Pickering乳液,并且在油滴和蛋白质颗粒之间及其周围形成连续网络,从而形成稳定的Pickering乳液凝胶。ZHU等[9]制备了玉米醇溶蛋白/玉米纤维胶复合物胶体颗粒稳定的Pickering乳液,也观察到类似凝胶网络。ZOU等[10]以玉米醇溶蛋白/鞣酸复合物(颗粒浓度为0.7%~1.4%)稳定的高内相乳液凝胶,其油含量在72%~87%(质量分数)。玉米醇溶蛋白-丙二醇藻酸酯-鼠李糖脂复合物颗粒稳定油相比为75%的水包油Pickering高内相乳液[11]。LI等[12] 制备了玉米醇溶蛋白/阿拉伯胶纳米颗粒稳定的高油体积比(60%)的Pickering乳液。SUN等[13]制备了玉米醇溶蛋白/酪蛋白酸钠/海藻酸丙二醇酯复合物稳定的油相比达到80%的高内相Pickering乳液。
1.3 乳清分离蛋白
乳清蛋白在食品工业中广泛用作乳化剂,其等电点pH接近5,尤其更适用于酸性条件下的乳化体系,由于其独特的热诱导胶凝特性,广泛用于制备乳液凝胶。EUSTON等[14] 研究发现热变性过程中蛋白聚集的机制涉及连续相中乳剂液滴表面吸附的蛋白质与非吸附热变性蛋白质的相互作用。未被界面吸附的的蛋白质起“胶水”的作用,将乳液液滴聚集到在一起。这种复杂的胶体体系可以以乳液和凝胶的形式共同存在,通常称为“乳液凝胶”。乳液凝胶可以分为以下两类(图2):乳液填充凝胶和蛋白稳定乳液凝胶。乳液填充的蛋白质凝胶是一种蛋白质凝胶基质,其中嵌入了乳滴。它是一种充满颗粒的固体,其类固体流变特性主要由空间连续基体的网络特性决定。蛋白质稳定的乳液凝胶是一种颗粒状凝胶,其流变性主要取决于聚集的乳剂液滴网络的性质。
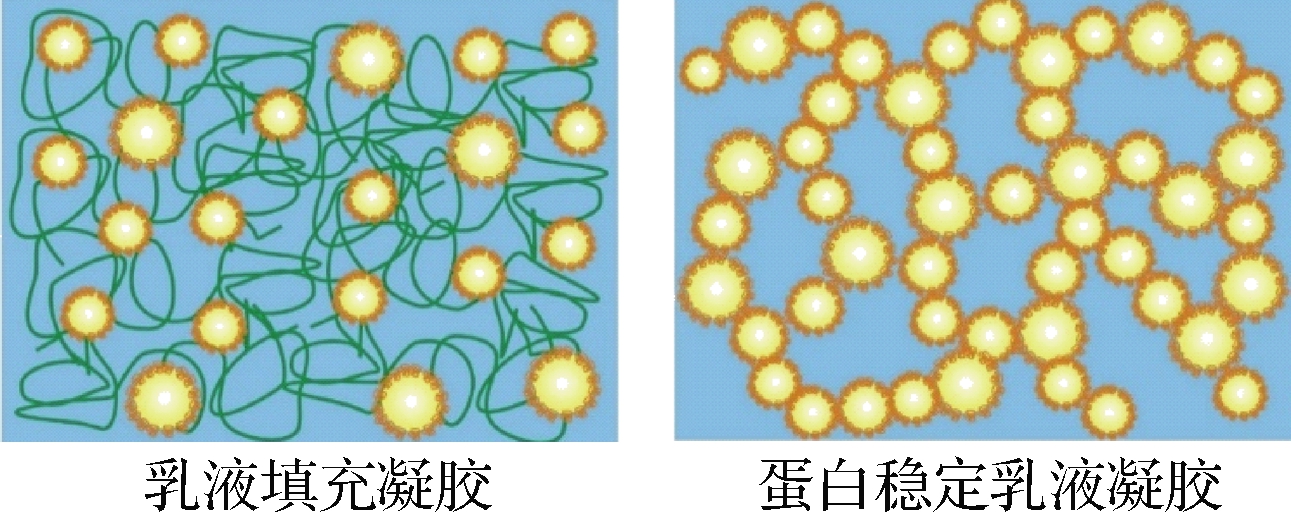
图2 乳液填充凝胶和蛋白稳定乳液凝胶示意图
Fig.2 Schematic presentation of emulsion filled protein gel and protein-stabilized emulsion gel
乳清蛋白可以通过加热,酸化或酶促作用等处理交联形成3D乳液凝胶网络结构,其结构可以通过改变pH值,液滴大小,离子强度和温度来改变。MANTOVANI等[15]研究了pH对蛋白稳定乳液凝胶(30%油和5%非加热乳清分离蛋白)和乳胶填充凝胶(乳化分散在热处理乳清中)的影响,发现由于较低的酸化速率和静电排斥力可促进更强烈的蛋白质聚集,因此在接近乳清蛋白等电点的pH值处可获得更强的凝胶强度。
1.4 酪蛋白
酪蛋白是哺乳动物乳中的主要蛋白质成分,其单体是复杂的两亲共聚物,具有很强的自组装性和吸附疏水性表面的趋势。乳化过程中,酪蛋白在油水界面处迅速吸附,通过静电和空间稳定机制稳定乳液。TAN等[16]发现酪蛋白浓度较低时,桥连絮凝现象明显,乳液不稳定;随着酪蛋白浓度增加,乳液稳定性逐渐增加,当酪蛋白浓度足够高时,乳液形成了连续的三维网状结构,乳液稳定性进一步增强。RADFORD等[17] 研究了乙醇和钙离子对酪蛋白酸钠乳液的影响,发现添加钙离子或乙醇会导致乳液黏度显著降低。BALAKRISHNAN等[18]通过在不同pH值(5.8、6.0和6.3)和油相质量分数(5%、10%和15%)条件下加热酪蛋白胶束稳定的葵花籽油乳液制备得到乳液凝胶。凝胶强度随pH值的降低和油质量比例的增加而增加。在pH 5.8或6.0下用乳清蛋白替代多达40%的酪蛋白后,凝胶强度没有明显变化,但在pH 6.3条件下却明显下降。然而,在乳清蛋白微凝胶稳定的Pickering乳液中添加少量酪蛋白可通过在界面处的竞争性吸附有效提高乳液的热稳定性[19]。MCINTYRE等[20]发现高钙离子浓度的酪蛋白乳液凝胶比低钙离子水平的凝胶强度显著低,并且在模拟胃消化过程中显示出最高的崩解速率。
2 多糖类天然高分子
2.1 阿拉伯胶
阿拉伯胶是食品工业中用途最广泛,使用量较大的一种天然高分子,它有助于稳定软饮料或浓缩果汁中的风味物质和精油。与蛋白类乳化剂不同,阿拉伯胶对pH值或者温度不敏感,这是由于在乳液液滴周围形成了厚的空间稳定层。阿拉伯胶中分离出3个不同的组分,即阿拉伯半乳聚糖(约占总质量的90%),阿拉伯半乳糖蛋白(约占总质量的10%)和糖蛋白(约占总质量的1%)。阿拉伯胶糖蛋白复合物是一种高分子质量糖蛋白。阿拉伯胶的功能特性主要归因于高分子质量蛋白质-多糖复合物在油-水界面处的吸附。蛋白质-多糖复合物的结构可以由“藤枝编花模型”模型(图3)解释,多糖呈球形,并与连续蛋白质连接。疏水性蛋白质将这种“天然”复合物牢固地锚定在油水界面上,并且共价连接的亲水性碳水化合物嵌段为液滴的絮凝和聚结提供了强大的空间屏障[21]。尽管如此,阿拉伯胶对油水界面的亲和力较低,这意味着必须以相对较高的浓度使用才能形成稳定的乳液。
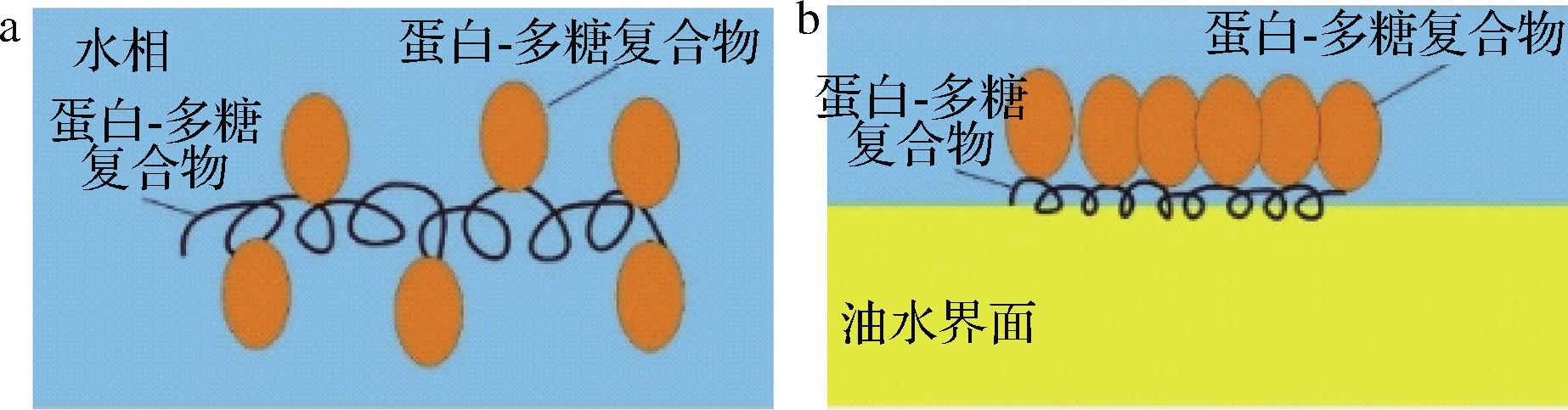
a-水相;b-油-水界面
图3 阿拉伯胶结构和界面吸附结构示意图
Fig.3 Schematic representation of the wattle blossom model of gum Arabic in solution and at the oil-water interface
2.2 果胶
柑橘和苹果果胶通常用作低pH值胶凝剂或增稠剂,但不能用作乳化剂,甜菜果胶通过吸附在油滴表面上,形成厚的水合层,通过静电和空间排斥力防止液滴絮凝和聚结,有效地稳定了乳液。甜菜果胶良好的乳化性能可归因于许多方面(蛋白质部分,乙酰基和高度分支的多糖结构),其中蛋白质起主要作用。WILLIAMS等[22] 发现甜菜果胶的乳化性受到蛋白质和阿魏酸基团到油滴表面的可及性,酯基团的比例以及馏分的分子质量分布的影响。但是,蛋白质或阿魏酸含量与乳化能力之间并不是简单的线型关系。FUNAMI等[23]发现脱蛋白的甜菜果胶(蛋白质含量为5%到0.5%)显示出比未处理的果胶更差的乳化性能。SIEW等[24]发现蛋白质含量较高(比平均值高12%)的甜菜果胶更易于吸附在油滴上。
2.3 半乳甘露聚糖
半乳甘露聚糖是豆科植物中常见的储备多糖,由于其碳链结构上没有疏水性基团,因此通常认为这种类型的天然高分子通过改变分散的颗粒或液滴之间的水相的流变性而稳定乳液的。目前,针对瓜尔豆胶和刺槐豆胶的界面性质的研究相对较多[25]。研究表明粗提瓜尔胶、纯化瓜尔胶和双纯化瓜尔胶所制备得到的乳液液滴尺寸和抗聚结和絮凝的能力没有显著差异[26],说明蛋白含量对瓜尔胶的乳化性没有影响。GARTI等[27]将瓜尔胶中的蛋白纯化低至0.8%,发现其乳化性与纯化前没有明显差异,说明瓜尔胶的乳化能力来源于其碳链结构上的疏水部分。DE等[28]将瓜尔胶用于制备W/O/W双重乳液,以改善花青素在酸性条件的热稳定性。RATHER等[29]添加不同含量的瓜尔豆胶(0.5%、1.0%和1.5%)到低脂肉类乳液作为脂肪替代品,加入瓜尔胶会导致更高的乳化稳定性和烹饪产量。
2.4 微晶纤维素
微晶纤维素(microcrystalline cellulose,MCC)是食品工业中最常用的纤维素衍生物之一。微晶纤维素是一种典型的水不溶性天然高分子,但是其能够在油水界面进行吸附。颗粒分布尺寸小于0.2 μm,对油和水都有很强的亲和力,可形成网络结构,游离的MCC的胶体结构会使乳液液滴之间的水相黏度增加,进而抑制乳液的聚结和絮凝[30]。分散在水中的MCC胶体体系已被用于模拟各种食品应用中的含脂肪体系的流变学,包括烘焙产品,冷冻甜品,蛋黄酱,肉汁和酱汁。例如与60%豆油的乳液相比,含20%豆油和1%~1.5%胶体MCC的乳液具有相似的稳定性和流变性能[31]。用MCC代替脂肪可以使低脂酱料具有丰富的奶油质地。MCC可以单独使用或与冰淇淋中的其他多糖结合使用以实现特定功能,如更好的稳定性和流变性[32]。在冰淇淋中加入MCC还可以增加产品的固体含量,并为消费者提供膳食纤维。
微米/纳米尺度范围内的纤维素晶体通常用于制备Pickering乳液。KALASHNIKOVA等[33]研究表明如果颗粒适当分散,则细菌纤维素纳米晶体可以有效地稳定Pickering O/W乳液长达几个月。胶体MCC(11%MCC与1%羧甲基纤维素钠混合)还用于通过在乳液周围形成网络来稳定O/W乳液和W/O/W多重乳液[34]。在这样的乳液体系中,MCC的功能是定位在油水界面,从而为油滴的聚结提供物理屏障[35],而体系中的其他材料则主要充当MCC的分散和保护性胶体。胶体MCC不仅可以使液滴之间的连续相变稠,而且可以有效地稳定乳液。MCC的添加改变了姜黄素乳液的微流变特性和冻融稳定性,这归因于姜黄素乳液液滴之间的排斥空间力增强。此外,该课题组还制备了硬脂酰化微晶纤维素稳定的具有89%的最高内相比的高内相Pickering乳液[36]。
2.5 淀粉
淀粉(包括改性淀粉)是一种常见的食品原料,在众多植物来源中,淀粉颗粒的大小、形状和组成存在很大的差异。通常天然淀粉的结构不适合吸附在油-水界面,因此一定程度的改性更适合于稳定乳液。通常可以进行物理改性,包括研磨,非溶剂沉淀,超声处理,高压处理,以减小淀粉的尺寸。降低淀粉的粒径通常与提高其Pickering乳液的贮存稳定性有关。辛烯基琥珀酸酐改性是最常用的化学改性方法,可提高淀粉的疏水性,是一种常用的作为乳化剂的食品原料。取代度为0.028 6的辛烯基琥珀酸酐藜麦淀粉颗粒可稳定油相为50%至70%的Pickering乳液[37]。LIU等[38]比较了不同槟榔芋淀粉(天然淀粉,辛烯基琥珀酸酐酯化淀粉,球磨淀粉和球磨合辛烯基琥珀酸酐复合改性淀粉)稳定的大豆水包油Pickering乳液的稳定性,发现复合改性淀粉具有最强的表面活性和乳液黏度,因此具有最佳的乳化能力和稳定性。LU等[39]研究表明高直链玉米淀粉颗粒比普通玉米淀粉颗粒乳液具有更高的乳化稳定性。KASPRZAK等[40]筛选了一系列市售食品淀粉,并发现非糯米淀粉,糯米淀粉和糯玉米淀粉PRIMA600凝胶化后显示出良好的乳化效果。
3 蛋白-多糖美拉德反应复合物
近年有许多针对蛋白-多糖复合物乳化特性的研究。蛋白-多糖复合物可通过蛋白质和多糖的共价连接制备得到,其中一种共价连接方式是通过控制温度、湿度、原料浓度进行美拉德反应进行的。通过美拉德反应产生的蛋白质-多糖复合物首次报道于1912年,美拉德反应是一系列非酶褐变反应,其发生在糖的还原端和自由氨基之间。蛋白质和多糖的功能特性可以通过美拉德反应结合起来,蛋白质和多糖之间的共价键会引起作为乳化剂和稳定剂的蛋白质功能增强。
诱导蛋白和多糖之间美拉德反应的方式包括干法、湿法美拉德反应。干法美拉德反应将目标蛋白和多糖分散在溶剂中混合均匀后冷冻干燥以保证充分接触,然后将其在控温控湿的条件下反应一定时间。湿法美拉德反应是将蛋白-多糖溶解于溶剂中后用特定的温度加热一定时间。与干法美拉德反应相比,湿法美拉德反应时间更短,但是由于蛋白质在高温条件下易聚集,因此接枝度可能较低。近年的研究表明超声辅助美拉德反应得到的蛋白-多糖复合物具有更好的乳化性能[41-43]。STANIC-VUCINIC等[44]研究发现,高强度超声有效地促进了β-乳球蛋白美拉德反应过程中的糖基化反应,生成的复合物具有更好抗氧化能力。如图4所示,蛋白-多糖复合物能够形成更厚的乳液液滴界面层,为乳液液滴提供更好的空间稳定性,通过美拉德反应将蛋白质连接到多糖上的主要优点是,在低pH和高离子强度等各种环境条件下,蛋白质的溶解度和功能特性得到了增强。近年还有研究集中在天然提取的蛋白-多糖进行原位美拉德反应后用于乳化体系。CIRRE等[45]对玉米纤维胶进行了干法美拉德反应,这导致了蛋白质组分聚集的溶解度和香气降低。与未反应的相比,美拉德反应后的乳化性能和稳定性大大提高。秋葵胶体黏液既含有蛋白也含有多糖,在100 ℃加热6 h产生的复合物比秋葵多糖和牛血清白蛋白形成的复合物表现出更好的乳化性能[46]。秋葵生胶体黏液在pH 7.0时未显示出显著的乳液稳定性能,但热处理后产生的复合物在相同pH下乳化性能显著提高。对提取于布瑞亚树渗出液的布雷亚胶,纯化后在110 ℃下进行24、48、72和96 h的热处理,经过热处理的布雷亚胶的蛋白质组分的分子质量和颜色发生了变化,美拉德反应增加了其表面活性并改善了其乳化和稳定能力,从而使玉米油乳液稳定了数月[47]。
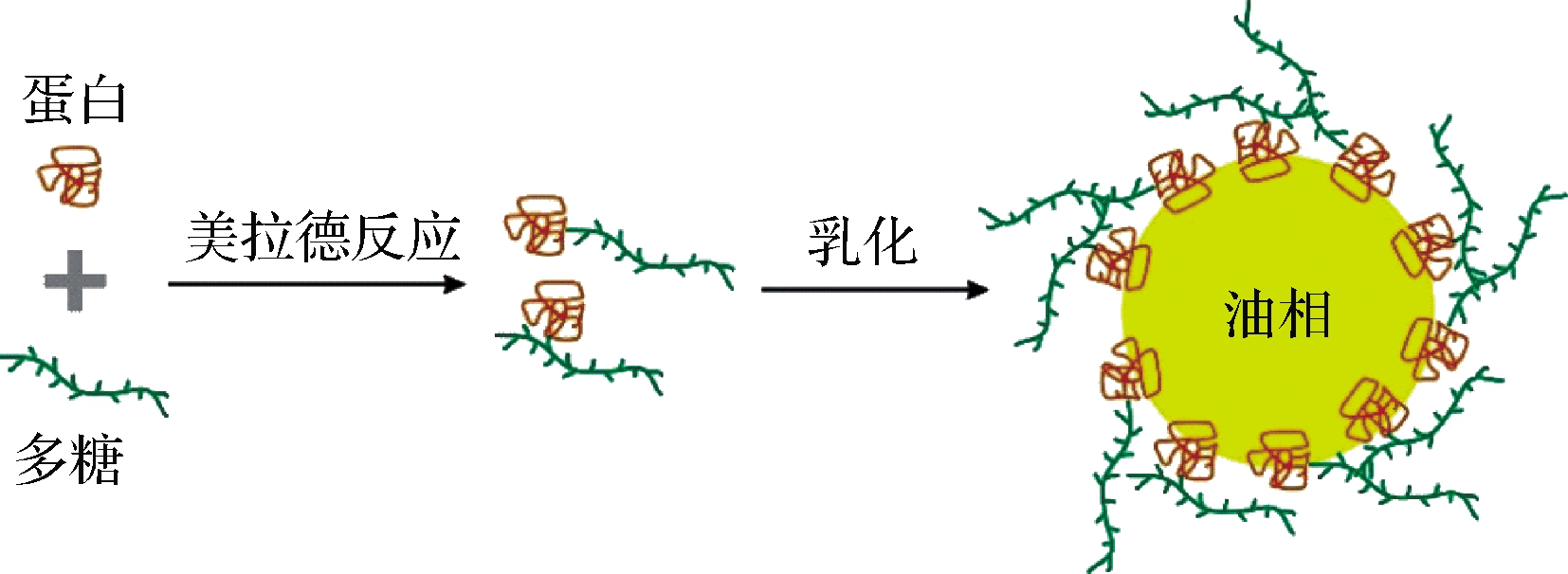
图4 蛋白-多糖复合物稳定乳液示意图
Fig.4 Schematic representation of Maillard reaction between protein and polysaccharide
4 应用展望
天然高分子稳定的乳液在食品工业中有许多应用,包括乳制品,肉制品,饮料等。饮料中的乳液是以高度稀释的形式存在。阿拉伯胶是应用最为广泛的乳化剂,也是饮料乳液中的稳定剂。饮料乳液中阿拉伯胶的常用替代品是改性淀粉,其亲疏水性可以通过改性来平衡[48]。还有其他具有良好乳化性能的天然高分子可用于饮料乳液,例如刺槐豆胶。在冰淇淋中,天然高分子已被用于多种功能,尤其是作为稳定剂,脂肪替代品和防冻剂[49]。明胶仅在冰淇淋行业中用作稳定剂,已逐渐被植物来源的多糖替代,包含刺槐豆胶,瓜尔胶和角叉菜胶的混合物。酪蛋白酸钠,大豆分离蛋白,瓜尔豆胶,黄原胶,结冷胶通常在肉制品中用作乳化剂。随着消费者越来越意识到高脂饮食的有害影响,脂肪替代体系的设计能够同时降低热值以及避免与脂肪相关的健康问题。通过多重乳液、Pickering乳液和乳液凝胶等新型乳液的制备模拟脂肪的质地和口感。已有研究在各种食品中使用不同的天然高分子进行了脂肪替代的应用,例如冰淇淋,蛋黄酱,香肠。

图5 天然高分子乳化体系在食品领域应用展望
Fig.5 Major application field for biopolymer emulsifiers in food industry
越来越多的研究针对天然高分子的乳化特性进行了深入的研究,从而对天然高分子的界面性质有了更深入的了解。随着消费趋势的改变,天然高分子由于具安全性、可降解性等优点而作为乳化剂广泛应用于各类食品的新产品开发过程。许多研究表明,与单组分相比,由美拉德反应诱导的蛋白质-多糖复合物具有良好的乳化性能,在饮料和乳制品中具有应用的潜力。但是由于不同类型食品的环境因素(温度、pH、离子强度等)差异较大,寻找针对特定体系的良好的新型乳化剂是未来的发展方向之一。针对天然高分子及其复合物结构和乳化功能特性之间的联系,未来还需要更深入的解析。
[1] BENICHOU A, ASERIN A, GARTI N.W/O/W double emulsions stabilized with WPI-polysaccharide complexes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 294(1-3):20-32.
[2] SURH J, DECKER E A, MCCLEMENTS D J.Properties and stability of oil-in-water emulsions stabilized by fish gelatin [J].Food Hydrocolloids, 2006, 20(5):596-606.
[3] SURH J, GU Y S, DECKER E A, et al.Influence of environmental stresses on stability of O/W emulsions containing cationic droplets stabilized by SDS-F fish gelatin membranes [J].Journal of Agricultural and Food Chemistry, 2005, 53(10):4 236-4 244.
[4] TAHERIAN A R, BRITTEN M, SABIK H, et al.Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion [J].Food Hydrocolloids, 2011, 25(5):868-878.
[5] ZEEB B, FISCHER L, WEISS J.Cross-linking of interfacial layers affects the salt and temperature stability of multilayered emulsions consisting of fish gelatin and sugar beet pectin [J].Journal of Agricultural and Food Chemistry, 2011, 59(19):10 546-10 555.
[6] ANVARI M, JOYNER H S.Effect of fish gelatin-gum Arabic interactions on structural and functional properties of concentrated emulsions [J].Food Research International, 2017, 102:1-7.
[7] DE FOLTER J W J, VAN RUIJVEN M W M, VELIKOV K P.Oil-in-water Pickering emulsions stabilized by colloidal particles from the water-insoluble protein zein [J].Soft Matter, 2012, 8(25):6 807-6 815.
[8] ZOU Y, GUO J, YIN S W, et al.Pickering emulsion gels prepared by hydrogen-bonded zein/tannic acid complex colloidal particles [J].Journal of Agricultural and Food Chemistry, 2015, 63(33):7 405-7 414.
[9] ZHU Q M, LU H Q, ZHU J Y, et al.Development and characterization of Pickering emulsion stabilized by zein/corn fiber gum (CFG) complex colloidal particles [J].Food Hydrocolloids, 2019, 91:204-213.
[10] ZOU Y, YANG X Q, SCHOLTEN E.Tuning particle properties to control rheological behavior of high internal phase emulsion gels stabilized by zein/tannic acid complex particles [J].Food Hydrocolloids, 2019, 89:163-170.
[11] DAI L, YANG S F, WEI Y, et al.Development of stable high internal phase emulsions by Pickering stabilization:Utilization of zein-propylene glycol alginate-rhamnolipid complex particles as colloidal emulsifiers [J].Food Chemistry, 2019, 275:246-254.
[12] LI J, XU X E, CHEN Z X, et al.Zein/gum Arabic nanoparticle-stabilized Pickering emulsion with thymol as an antibacterial delivery system [J].Carbohydrate Polymers, 2018, 200:416-426.
[13] SUN C X, GAO Y X, ZHONG Q X.Properties of ternary biopolymer nanocomplexes of zein, sodium caseinate, and propylene glycol alginate and their functions of stabilizing high internal phase pickering emulsions[J].Langmuir, 2018, 34(31):9 215-9 227.
[14] EUSTON S R, FINNIGAN S R, HIRST R L.Aggregation kinetics of heated whey protein-stabilized emulsions [J].Food Hydrocolloids, 2000, 14(2):155-161.
[15] MANTOVANI R A, CAVALLIERI  L F, CUNHA R L.Gelation of oil-in-water emulsions stabilized by whey protein [J].Journal of Food Engineering, 2016, 175:108-116.
L F, CUNHA R L.Gelation of oil-in-water emulsions stabilized by whey protein [J].Journal of Food Engineering, 2016, 175:108-116.
[16] TAN H L, MCGRATH K M.Na-caseinate/oil/water systems:Emulsion morphology diagrams [J].Journal of Colloid and Interface Science, 2012, 381(1):48-58.
[17] RADFORD S J, DICKINSON E, GOLDING M.Stability and rheology of emulsions containing sodium caseinate:combined effects of ionic calcium and alcohol [J].Journal of Colloid and Interface Science, 2004, 274(2):673-686.
[18] BALAKRISHNAN G, NGUYEN B T, SCHMITT C, et al.Heat-set emulsion gels of casein micelles in mixtures with whey protein isolate [J].Food Hydrocolloids, 2017, 73:213-221.
[19] CHEVALLIER M, RIAUBLANC A, CAUTY C, et al.The repartition of whey protein microgels and caseins between fat droplet surface and the continuous phase governs the heat stability of emulsions [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2019, 563:217-225.
[20] MCINTYRE I, O SULLIVAN M, O RIORDAN D.Altering the level of calcium changes the physical properties and digestibility of casein-based emulsion gels [J].Food and Function, 2017, 8(4):1 641-1 651.
[21] DICKINSON E.Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions [J].Soft Matter, 2008, 4(5):932-942.
[22] WILLIAMS P A, SAYERS C, VIEBKE C, et al.Elucidation of the emulsification properties of sugar beet pectin [J].Journal of Agricultural and Food Chemistry, 2005, 53(9):3 592-3 597.
[23] FUNAMI T, NAKAUMA M, ISHIHARA S, et al.Structural modifications of sugar beet pectin and the relationship of structure to functionality [J].Food Hydrocolloids, 2011, 25(2):221-229.
[24] SIEW C K, WILLIAMS P A, CUI S W, et al.Characterization of the surface-active components of sugar beet pectin and the hydrodynamic thickness of the adsorbed pectin layer [J].Journal of Agricultural and Food Chemistry, 2008, 56(17):8 111-8 120.
[25] REICHMAN D, GARTI N.Galactomannans as Emulsifiers[M].Cambridge:Elsevier,1991.
[26] GARTI N, REICHMAN D.Hydrocolloids as food emulsifiers and stabilizers [J].Food Structure, 1993, 12(4):3.
[27] GARTI N, REICHMAN D.Surface properties and emulsification activity of galactomannans [J].Food Hydrocolloids, 1994, 8(2):155-173.
[28] DE ALMEIDA PAULA D, MOTA RAMOS A, BAS LIO DE OLIVEIRA E, et al.Increased thermal stability of anthocyanins at pH4.0 by guar gum in aqueous dispersions and in double emulsions W/O/W [J].International Journal of Biological Macromolecules, 2018, 117:665-672.
LIO DE OLIVEIRA E, et al.Increased thermal stability of anthocyanins at pH4.0 by guar gum in aqueous dispersions and in double emulsions W/O/W [J].International Journal of Biological Macromolecules, 2018, 117:665-672.
[29] RATHER S A, MASOODI F A, AKHTER R, et al.Effects of guar gum as a fat substitute in low fat meat emulsions [J].Journal of Food Processing and Preservation, 2017, 41(6):e13249.
[30] MILANI J, MALEKI G.Hydrocolloids in Food Industry[M].London:IntechOpen,2012.
[31] TUASON D C, KRAWCZYK G R, BULIGA G.Microcrystalline Cellulose [M].New York:John Wiley & Sons,2011:223.
[32] NSOR-ATINDANA J, CHEN M S, GOFF H D, et al.Functionality and nutritional aspects of microcrystalline cellulose in food [J].Carbohydrate Polymers, 2017, 172:159-174.
[33] KALASHNIKOVA I, BIZOT H, CATHALA B, et al.New Pickering emulsions stabilized by bacterial cellulose nanocrystals [J].Langmuir, 2011, 27(12):7 471-7 479.
[34] JIA X J, CHEN Y W, SHI C, et al.Rheological properties of an amorphous cellulose suspension [J].Food Hydrocolloids, 2014, 39:27-33
[35] DICKINSON E.Stabilising emulsion-based colloidal structures with mixed food ingredients [J].Journal of the Science of Food and Agriculture, 2013, 93(4):710-721.
[36] PANG B, LIU H, LIU P W, et al.Water-in-oil Pickering emulsions stabilized by stearoylated microcrystalline cellulose [J].Journal of Colloid and Interface Science, 2018, 513:629-637.
[37] LI S N, ZHANG B, TAN C P, et al.Octenylsuccinate quinoa starch granule-stabilized Pickering emulsion gels:Preparation, microstructure and gelling mechanism [J].Food Hydrocolloids, 2019, 91:40-47.
[38] LIU C C, AN F P, HE H, et al.Pickering emulsions stabilized by compound modified Areca taro (Colocasia esculenta (L.) Schott) starch with ball-milling and OSA [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 556:185-194.
[39] LU X X, WANG Y, LI Y Q, et al.Assembly of Pickering emulsions using milled starch particles with different amylose/amylopectin ratios [J].Food Hydrocolloids, 2018, 84:47-57.
[40] KASPRZAK M M, MACNAUGHTAN W, HARDING S, et al.Stabilisation of oil-in-water emulsions with non-chemical modified gelatinised starch [J].Food Hydrocolloids, 2018, 81:409-418.
[41] XUE F, WU Z S, TONG J R, et al.Effect of combination of high-intensity ultrasound treatment and dextran glycosylation on structural and interfacial properties of buckwheat protein isolates [J].Bioscience, Biotechnology, and Biochemistry, 2017, 81(10):1 891-1 898.
[42] CHEN L, CHEN J S, WU K G, et al.Improved low pH emulsification properties of glycated peanut protein isolate by ultrasound Maillard reaction [J].Journal of Agricultural and Food Chemistry, 2016, 64(27):5 531-5 538.
[43] LIU F G, MA C C, MCCLEMENTS D J, et al.Development of polyphenol-protein-polysaccharide ternary complexes as emulsifiers for nutraceutical emulsions:Impact on formation, stability, and bioaccessibility of β-carotene emulsions [J].Food Hydrocolloids, 2016, 61:578-588.
[44] STANIC-VUCINIC D, PRODIC I, APOSTOLOVIC D, et al.Structure and antioxidant activity of β-lactoglobulin-glycoconjugates obtained by high-intensity-ultrasound-induced Maillard reaction in aqueous model systems under neutral conditions [J].Food Chemistry, 2013, 138(1):590-599.
[45] CIRRE J, AL-ASSAF S, PHILLIPS G O, et al.Improved emulsification performance of corn fibre gum following maturation treatment [J].Food Hydrocolloids, 2014, 35:122-128.
[46] TEMENOUGA V, CHARITIDIS T, AVGIDOU M, et al.Novel emulsifiers as products from internal Maillard reactions in okra hydrocolloid mucilage [J].Food Hydrocolloids, 2016, 52:972-981.
[47] CASTEL V, RUBIOLO A C, CARRARA C R.Improvement of emulsifying properties of Brea gum by controlled thermal treatment [J].Food Hydrocolloids, 2018, 85:93-101.
[48] TAN C-T.Beverage Emulsions[M].Boca Raton:CRC Press,2004:485-524.
[49] JAVIDI F, RAZAVI S M A.New Hydrocolloids in Ice Cream[M].Chinchester:Hohn Wiley & Sons Ltd,2019.