酪乳(buttermilk,BM)是黄油生产加工中奶油经过搅打后释放出的水相成分,其蛋白、灰分、乳糖的含量与脱脂乳(skim milk,SM)相似[1],但酪乳中含有大量乳脂肪球膜(milk fat globule membrane,MFGM),其极性脂质(polar lipid,PL)含量约为脱脂乳的6倍[2-3]。由于被搅打奶油的品种不同,酪乳有很多种类,不同国家和地区对酪乳的定义不同[4],但对酪乳最基本的定义是“搅打甜奶油得到的水相”。酪乳每年的产量很高,资源丰富,据统计2012年加拿大生产了约1.172×107 L的酪乳,2015年欧盟的酪乳产量达200万t[4],2019年中国黄油产量达9.7万t,而酪乳在搅打过程中的产率能达35%左右,可见在中国酪乳的产量也能达到较高水平。工业生产中,富含 MFGM 组分的酪乳未得到有效利用,常作为废料丢弃或用于动物饲料加工[5]。随着对MFGM 的结构、营养和功能特性的深入了解,研究者和乳制品公司探索了MFGM 的提取方法,并开发富含 MFGM 的乳制品[6]。奶油洗涤是常用的MFGM分离方法之一,但该法成本较高,利用乳脂加工副产物作为MFGM的分离原料能大大降低成本[7],所以从酪乳中分离MFGM的研究具有重要意义。此外关于酪乳成分的研究也在不断深入,酪乳也可作为一种配料用于乳制品加工和研发中[4]。
MFGM是指包裹于牛乳中脂肪球表面的3层膜结构,MFGM有助于牛乳形成稳定的水包油乳状液。MFGM中富含极性脂质,如鞘磷脂(sphingomyelin,SM)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰丝氨酸(phosphatidylserine,PS)和磷脂酰肌醇(phosphatidylinositol,PI)等[8]。研究表明这些极性脂质具有生物活性,包括调控胆固醇代谢、抗炎和抗神经退化,以及增强记忆力等[2]。而在MFGM的3层膜表面或其他部位镶嵌各种蛋白质,如嗜乳脂蛋白(butyrophilin,BTN)、黄嘌呤氧化还原酶(xanthine oxidoreductase,XO/XDH)、黏液素1(mucin 1,MUC1)、乳凝集素(lactadherin,MFG-E8或PAS6/7)、脂肪分化相关蛋白(adipophilin,ADPH)、分化簇36(cluster of differentiation 36,CD36)、脂肪酸结合蛋白(fatty acid binding protein,FABP)等,研究表明这些成分可以防止细胞衰亡、提高机体免疫力[9]。在食品加工中,MFGM作为配料加入婴幼儿配方奶粉(infant formula,IF)中,可以提高产品的营养价值,未来可开发成为功能性乳品的优质原料[10]。
酪乳的成分中除了MFGM片段之外,还存在不完整的乳脂肪球(milk fat globule,MFG)、酪蛋白、乳清蛋白、矿物质和乳糖等成分,其中乳蛋白会增加MFGM的分离纯化难度。在酪乳加工和MFGM分离的过程中,工艺条件会影响分离效果,乳清蛋白在加热条件下以巯基-二硫键形式结合到MFGM蛋白上,酪蛋白也会在一定条件下与膜上的蛋白发生交联反应[11],并且MFGM易受热处理、过滤和均质等工艺影响,这些工艺会影响MFGM中脂质、蛋白含量和功能,从而影响其生物活性和功效[12]。所以从酪乳中分离MFGM不仅要关注乳蛋白等非膜成分去除率也要关注MFGM成分损失率。HOLZMÜLLER等[13-14]关于MFGM方面做了很多研究,其以酪乳为原料分离MFGM,去除其中乳蛋白以提高MFGM成分纯度,关注了乳蛋白去除率和膜蛋白的损失率。
本文综述了近年来国内外关于酪乳成分组成、酪乳应用进展和从酪乳中分离MFGM的分离技术等内容,总结了目前酪乳成分分析和酪乳来源的MFGM分离过程存在的问题,展望未来酪乳的应用前景。
1 酪乳的成分分析
在搅打稀奶油过程中,奶油体系中MFG受剪切力作用发生破裂,表面部分MFGM发生脱落,MFG表面疏水性增强,彼此之间发生碰撞并聚集,当MFG聚集成奶油粒,奶油中的水相被全部排除,酪乳和奶油粒得到分离,图1是工业生产黄油工艺中酪乳的制备过程[15]。搅打后奶油中酪蛋白、乳清蛋白、部分脂肪小球、MFGM片段等进入酪乳中。MFGM片段具有3层膜结构,由单层内膜和双层外膜组成,膜主要由磷脂等极性脂质构成,在膜上及膜表面镶嵌结合着多种膜蛋白,图2是MFGM具体结构[5,16]。由此可见酪乳成分复杂,想要充分利用酪乳资源并发挥其应用价值,对酪乳进行成分分析必不可少。
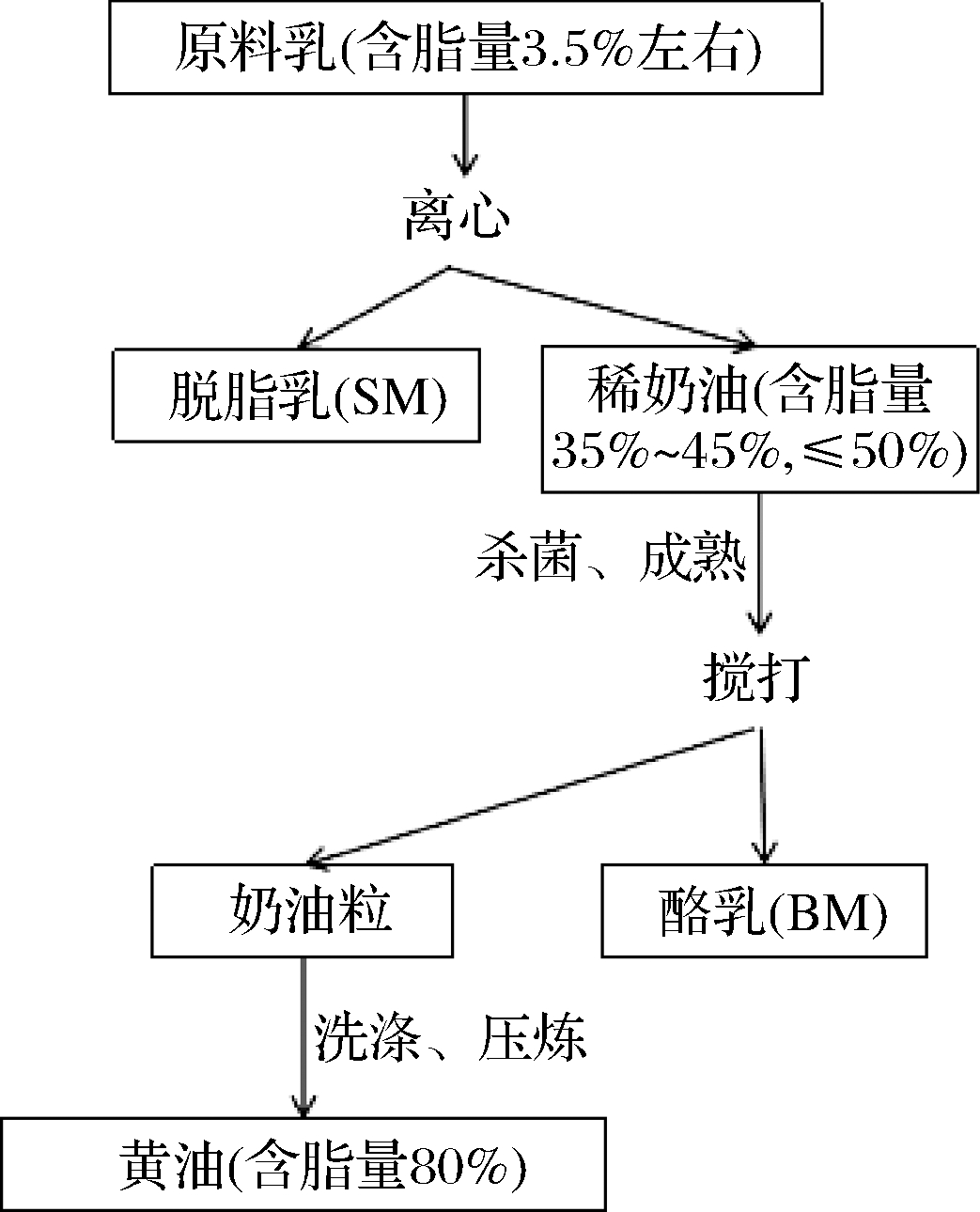
图1 酪乳的制备
Fig.1 Production of buttermilk

图2 MFGM的组成和结构
Fig.2 Composition and structure of MFGM
1.1 脂质成分分析
酪乳中脂质含量占酪乳干重的5%~13%,脂质主要是甘油三酯和极性脂质。甘油三酯包含饱和三酰甘油酯和单不饱和三酰甘油酯,极性脂质主要是磷脂类,包括PC、PE、PI、PS等甘油磷脂以及鞘酯类如鞘磷脂,它们主要存在于MFGM上。对酪乳中脂质的脂肪酸进行分析发现,酪乳中含量最丰富的是饱和脂肪酸,占总脂肪酸一半以上,其次是单不饱和脂肪酸和多不饱和脂肪酸,占脂肪酸40%左右,不饱和脂肪酸中富含亚油酸、α-亚麻酸和二十二碳六烯酸,不饱和脂肪酸的含量受奶牛的饲料、营养和环境影响[17]。酪乳中富含的磷脂类成分具有多种生物活性功能,能有效减少心血管疾病,抗炎症和胃肠道感染,抗癌症,促进胆固醇吸收、神经系统髓鞘形成和神经发育[18]。分析酪乳脂质成分,能为评价酪乳应用价值提供理论和数据支撑。
酪乳中脂质成分检测常用的仪器如高效液相色谱结合蒸发光散射检测器(HPLC-evaporative light scattering detector,HPLC-ELSD)或HPLC-MS,用于极性脂质的定性、定量分析;气相色谱-氢火焰离子化检测器(gas chromatography-flame ionization detector,GC-FID)或GC-MS,用于甘油三酯和胆固醇类定性定量分析。对脂质甲酯化后采用GC-FID可检测酪乳中脂肪酸的含量。脂质分析前使用有机溶剂萃取法提取脂质。目前,脂质提取主要关注提取效率和溶剂的低毒环保性[19]。在液相、气相色谱的检测中,通常使用脂质标准品作为参照进行绝对定量,标准品的价格昂贵且种类较多,多来自进口厂家,实验实施成本较高。开发简单且低成本的脂质检测方法能为相关研究提供便利。
由于不同实验选择的酪乳乳源、酪乳加工工艺、脂质检测方法存在差异,导致在酪乳脂质成分的定量结果有所区别,表1列出了来自不同实验的酪乳脂质和脂肪酸含量数据,可以更全面认识酪乳的脂质成分。
表1 酪乳中各类脂质含量
Table 1 Contents of various lipids in buttermilk
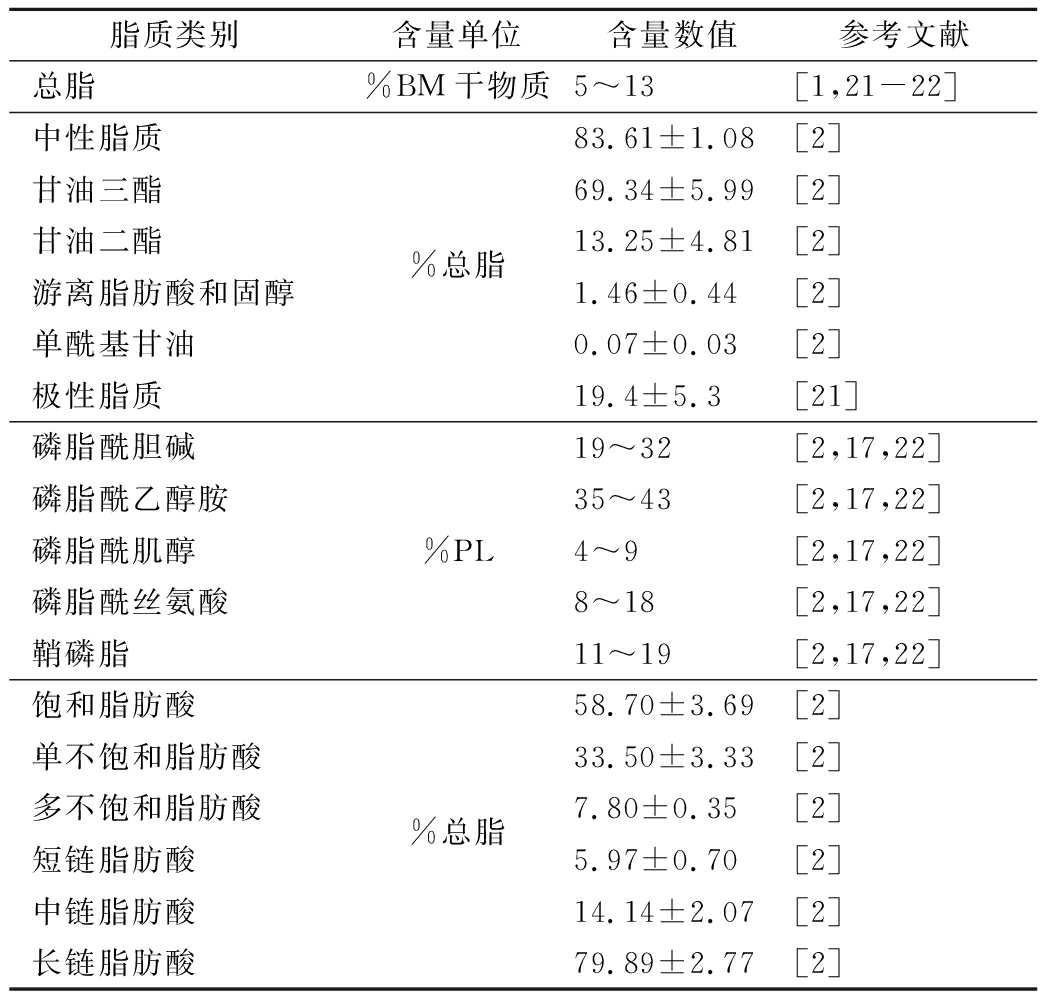
脂质类别含量单位含量数值参考文献总脂%BM干物质5~13[1,21-22]中性脂质83.61±1.08[2]甘油三酯69.34±5.99[2]甘油二酯%总脂13.25±4.81[2]游离脂肪酸和固醇1.46±0.44[2]单酰基甘油0.07±0.03[2]极性脂质19.4±5.3[21]磷脂酰胆碱19~32[2,17,22]磷脂酰乙醇胺35~43[2,17,22]磷脂酰肌醇%PL4~9[2,17,22]磷脂酰丝氨酸8~18[2,17,22]鞘磷脂11~19[2,17,22]饱和脂肪酸58.70±3.69[2]单不饱和脂肪酸 33.50±3.33[2]多不饱和脂肪酸 %总脂7.80±0.35[2]短链脂肪酸5.97±0.70[2]中链脂肪酸14.14±2.07[2]长链脂肪酸79.89±2.77[2]
基于对酪乳脂质组成和含量的初步认识,许多研究深入探究工艺条件对酪乳脂质含量影响,并对比酪乳和其他乳制品副产物的脂质差别。酪乳中脂质成分随黄油加工工艺条件变化而变化,如黄油搅打工艺中,低温和低pH可提高酪乳中极性脂质含量。实验对比了酪乳和以酪乳为原料制备的MFGM富集物的脂质成分。结果表明,酪乳和MFGM富集物中都存在一定数量的极性脂质和胆固醇等脂类,但含量不同,其中极性脂质在酪乳和MFGM富集物中占比分别为12%~16%和40%。MFGM富集物中甘油三酯、饱和脂肪酸和胆固醇的含量低于酪乳,MFGM富集物中脂质含量是酪乳的2倍,极性脂质含量是酪乳的4倍[2],这说明可通过从酪乳中分离富集MFGM,提高极性脂质的占比。HADDADIAN等[20]对比分析了实验室制成酪乳、市售的酪乳粉(buttermilk powder,BMP)、α-serum、β-serum等脂质成分(各类副产物生产途径见图3),发现极性脂质在β-serum含量最高, BMP中含量最少,BMP、α-serum、β-serum中极性脂质PE(31%~36%)、PC(31%~39%)、鞘磷脂(13%~24%)为主要成分,PI(2%~4%)和PS(2%~7%)为次要成分。这说明不同副产物脂质含量存在差距,未来对每种副产物进行精确脂质分析,可做到精准利用,来实现资源最大化利用。目前,有大量研究对比分析酪乳与黄油乳清(butterserum,BS)(生产途径见图3)的脂质成分差异。结果发现,BS和酪乳中脂质含量和种类存在较大差异,其中BS中极性脂质和胆固醇含量高于酪乳,酪乳和BS中都含有较丰富的鞘酯类和饱和脂肪酸,可作为食品加工中磷脂的优质来源,甚至可替代人乳中鞘磷脂和神经酰胺[21]。若对酪乳和BS简单分离纯化后,极性脂质占比会有明显上升[18]。

图3 乳制品副产物生产流程图[22]
Fig.3 Production process chart of dairy by-products
酪乳中的脂质含量会随加工工艺、检测方法不同而变化,脂肪酸组成易受乳源、饲料等多种因素影响,未来深入探究影响酪乳脂质的因素,并将其可控化,对开发利用酪乳等副产物具有重要意义。
1.2 蛋白成分分析
酪乳中的蛋白含量占酪乳干重90%左右,主要类别有酪蛋白、乳清蛋白及MFGM上镶嵌的膜蛋白。MFGM上包含100余种蛋白质,最主要的8种蛋白质为MUC1、XO/XDH、黏液素15(mucin 15,MUC15/PASⅢ)、CD36、BTN、PAS6/7、ADPH和FABP[9]。酪乳主要蛋白含量见表2,酪蛋白含量最高,占总蛋白的67%左右。目前由于缺乏膜蛋白标准品,对酪乳中膜蛋白做绝对定量比较困难,相对定量结果受计算模型影响,普遍数据显示BTN、PAS6/7、XO/XDH是含量较多的3种膜蛋白,特别是BTN和PAS6/7是膜外层蛋白,在奶油搅打中容易脱落,酪乳中富集较多。酪乳中膜蛋白具有生物功能特性,已经证实,XO/XDH在乳腺的发育、肠道抗炎症和组织损伤中具有一定作用[23];BTN在促进先天免疫中发挥重要作用[24];PAS6/7有助于抗炎、抗凋亡和促进肠黏膜修复[25];黏液素在肠道的黏膜物理防御和上皮细胞抗感染中起着重要作用[26]。对酪乳中的MFGM蛋白进行深入研究,可为其在营养品和免疫制剂中应用提供技术指导[16]。
表2 酪乳中主要蛋白含量
Table 2 Contents of main protein in buttermilk
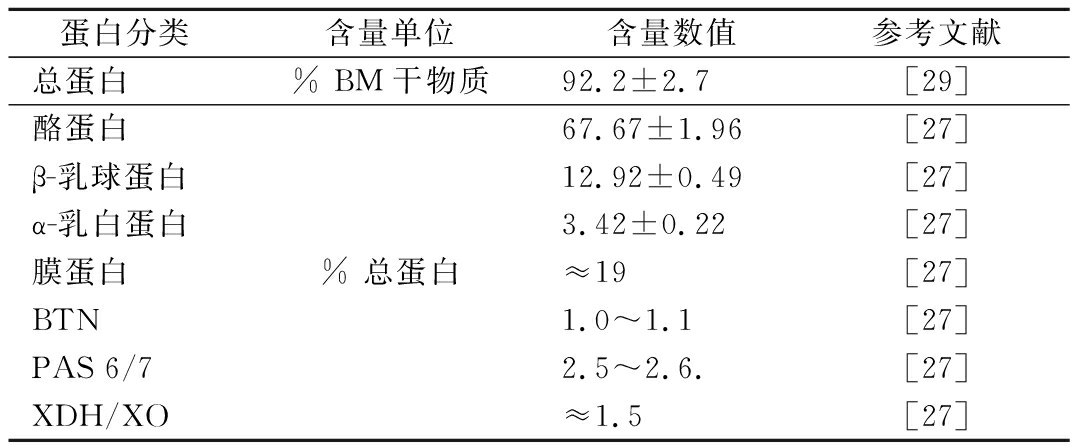
蛋白分类含量单位含量数值参考文献总蛋白% BM干物质92.2±2.7[29]酪蛋白67.67±1.96[27]β-乳球蛋白12.92±0.49[27] α-乳白蛋白3.42±0.22[27] 膜蛋白% 总蛋白≈19[27] BTN1.0~1.1[27] PAS 6/72.5~2.6.[27] XDH/XO≈1.5[27]
酪蛋白和乳清蛋白检测可采用HPLC定性定量,需以标准品作为参照,才能得到绝对定量数值。膜蛋白的定性、定量方法主要采用SDS-PAGE,此方法一般采用考马斯亮蓝染液进行染色,根据分离条带的分子量定性膜蛋白,通过ImageLab软件灰度分析对各类膜蛋白进行相对定量。由于不同结构的MFGM蛋白对染料吸附力不同,会对结果造成偏差。采用新型的免染色SDS-PAGE法,不需要染色标记,通过紫外照射检测蛋白中色氨酸残基来反映蛋白含量。HOLZMÜLLER等[27]根据免染色SDS-PAGE法得到的图像,建立了蛋白浓度计算模型,根据所要定量蛋白的分子质量、色氨酸残基数、色氨酸分子质量以及ImageLab分析得到的标准曲线斜率和面积积分定量结果代入模型公式得到绝对定量结果,如公式(1)所示。未来在膜蛋白定量检测中需在精确度和便利性上不断探索与跟进。
Cprotein ={[(mTrp/band)/(Trp/protein[%])]×100}÷
(DF×Vprotein)
(1)
式中:DF为蛋白溶液稀释倍数;mTrp/band由软件分析后给出的公式计算所得;Trp/protein[%]=NTrp/protein×(MwTrp残基/Mwprotein)×100%,MwTrp残基=186.21 g/mol,其余蛋白的分子质量分数可查资料得[27]。
基于对酪乳中蛋白种类和含量的认识,许多学者开始研究加工工艺条件对于酪乳中膜蛋白的影响,如热处理、搅拌、离心等。有研究对比分析了酪乳和BS的蛋白组分,发现BS中PAS6/7、XO、BTN这3种蛋白含量高于酪乳,尤其是PAS6/7的含量,BS比酪乳多经历了加热和离心的加工处理,造成膜蛋白脱落,因此膜蛋白在BS中的含量更高[27]。QU等[7]对比了脱脂乳、酪乳和BS中蛋白组分差异,实验发现,随加工过程进行,工艺下游得到的副产物中蛋白含量不断增加。这是因为经过离心、搅拌操作后MFGM上的蛋白会不断脱落得到富集。通过不同工艺阶段副产物中MFGM蛋白的含量来判断膜蛋白与膜结合程度。奶油加工过程中的搅打温度和pH会影响酪乳膜蛋白组成、XO活性及氧化还原电位(Eh)。在低温和低pH条件下搅打,可增加酪乳膜蛋白含量,提高膜蛋白活性和改变Eh值[28-29]。生产中,可通过调节控制加工条件来得到膜蛋白含量高和特定Eh值的副产物。HADDADIAN等[29]对比了BMP、酪乳和α-serum、β-serum的蛋白成分,发现BMP和酪乳中酪蛋白占比较高,而α-serum和β-serum中膜蛋白占比高,BMP由于经过喷雾干燥、高温脱水处理,其总蛋白和膜蛋白含量最低,同时一些膜蛋白的活性也受到影响。实验发现[28-29],在配制的乳液中添加分离自酪乳的MFGM蛋白成分能降低Eh值,达-320~-580 mV,添加来自α-serum和β-serum的MFGM蛋白会增加Eh值,达130~250 mV,虽然添加来自酪乳的MFGM蛋白乳液XO活性低于α-serum和β-serum,但Eh值降低有利于酪乳在奶酪中应用,因为低Eh值有利于微生物生长及风味物质形成,且能缓解脂肪氧化。
酪乳中蛋白定量检测需要不断提高精确度,开发新方法。不断深入探索酪乳加工条件对酪乳蛋白组成和含量的影响,追求不影响黄油质量前提下,膜蛋白含量高的优质酪乳。
1.3 酪乳中其他成分
在酪乳中除含有乳蛋白和MFGM成分外,还有乳糖、无机盐、矿物质等成分,其中包括许多游离/结合多糖和一些糖蛋白,如免疫球蛋白、乳铁蛋白、黏蛋白、乳凝集素和乳角蛋白,这些糖蛋白被证明具有一定程度的抗轮状病毒活性[30]。同时酪乳中天然存在不同蛋白水解物,它们具有一定抗氧化活性,可用于生产天然抗氧化剂[31]。抗病毒、抗氧化等活性受加工环境影响显著,特别是热处理,会导致发挥这一活性作用的蛋白发生变性或聚集,在低温长时间巴氏杀菌处理下,其活性丧失严重,所以研究非热杀菌如高压杀菌来减轻这一活性损失具有重大意义[30]。研究并控制加工过程条件能为利用酪乳各成分功能特性提供保障。
2 酪乳中MFGM分离技术研究
酪乳中分离纯化MFGM的目的是富集MFGM中极性脂类和功能性膜蛋白,尽可能去除非膜蛋白和其他杂质成分,包括酪蛋白和乳清蛋白,还有一些乳糖、矿物质等。酪蛋白形成的酪蛋白胶束与磷脂大小接近,且与MFGM片段大小有重叠部分,MFGM与酪蛋白胶束间还存在相互作用发生结合,这些因素增加了MFGM分离纯化难度[32]。超速离心和膜分离技术是现阶段从酪乳中分离MFGM的常用手段。
对酪乳进行超速离心可以得到酪蛋白去除率较高的MFGM富集物[33],对奶油搅打后收集的酪乳先进行预处理,添加酪乳体积2%的柠檬酸钠来解离酪乳中的酪蛋白胶束,之后在离心力100 000×g下离心50 min,能有效去除酪乳中酪蛋白[33]。但MFGM富集物中乳清蛋白保留率高,因为在奶油和酪乳加工过程存在热处理,部分β-乳球蛋白与MFGM蛋白通过二硫键发生结合[34]。MFGM表层的蛋白会在离心结束后存在于上层中,造成约20%MFGM蛋白损失[33]。超速离心酪乳的分离方式存在耗时耗能问题,不适合工业化生产,现阶段对于这种分离技术的研究有限。
近年来研究人员发现了膜分离技术去除酪蛋白胶束和乳清蛋白的潜力,将其应用于酪乳中分离MFGM[35-37]。酪乳中各成分大小及分子质量见表3,这是膜分离MFGM时选择膜包孔径的依据。膜分离技术制备MFGM关键点就在于选择合适的膜孔径,以最大限度的保留有效成分。针对膜包孔径的大小可分为2种膜过滤方式:微滤(0.1~1 μm)和超滤(0.001~0.1 μm,1~300 kDa)。酪乳中酪蛋白胶束、磷脂和MFGM片段大小相似的,直接膜分离难以分开,在分离前可采用了柠檬酸钠解离法和凝乳酶沉淀法处理,以改变酪蛋白大小,从而有效分离酪蛋白。经过凝乳酶沉淀处理后,可超滤去除其他小分子杂质,柠檬酸钠解离后则采用微滤去除粒径减小后的酪蛋白和其他小分子杂质。有研究表明,在 pH 6.8 和 45 ℃下加入0.03 %凝乳酶,先沉淀酪蛋白,再将上清液用80 nm的陶瓷膜进行6步洗滤得到MFGM富集物,其中各种膜蛋白保留率分别为70% (PAS6/7),35% (XO/XDH) 和20% (BTN),其中洗涤2次后,酪蛋白和乳清蛋白的去除率几乎接近100%[13]。存在的不足是:在凝乳和洗滤过程膜蛋白的损失率较高。可通过进一步优化凝乳条件和膜过滤条件(温度、pH等)来降低损失。许多研究中先添加柠檬酸钠解离酪蛋白胶束,再结合微滤分离酪乳中MFGM,有研究添加了酪乳20 mg/mL的柠檬酸钠,再用0.1 μm 微滤膜处理,结果发现,未添加柠檬酸钠的样品渗透液中几乎不存在酪蛋白,而添加柠檬酸钠后,可显著提高酪蛋白的透过率[38]。如使用微滤工艺处理未经过处理的酪蛋白胶束,酪蛋白会在截留液中大量残留。除了添加凝乳酶和螯合盐进行膜分离前预处理以提高 MFGM分离效果外,还可以选用其余原料制备MFGM,如酪乳奶酪乳清(酪乳制备奶酪过程中排出的乳清)以及乳清酪乳(乳清奶油搅打出来的酪乳),这些原料中不含或含有极少量酪蛋白胶束,可作为富集磷脂的优质原料[35,39]。BARRY等[32]在酪乳中添加蛋白水解酶,将其中的乳蛋白降解成小分子肽段,再采用50 kDa超滤膜去除肽段和乳清蛋白达到磷脂富集效果,磷脂含量分离浓缩后提高了7.8倍。
表3 酪乳中成分的分子质量和大小
Table 3 Molecular weights and sizes of ingredients in buttermilk
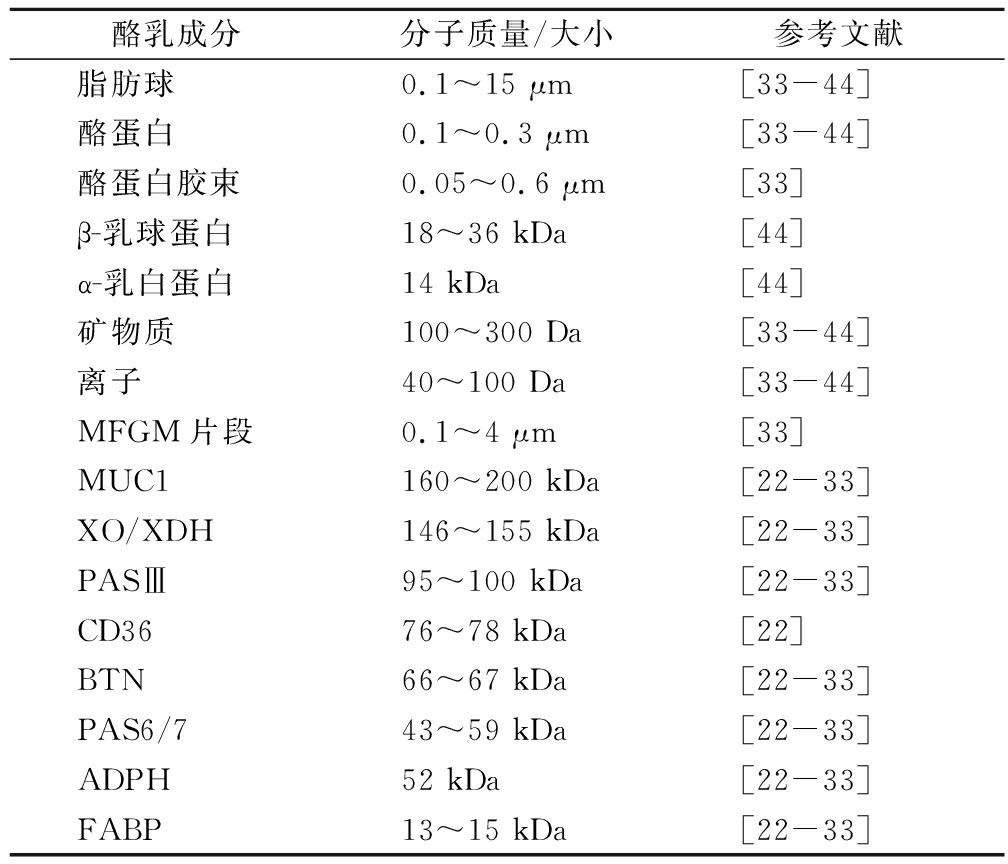
酪乳成分分子质量/大小参考文献脂肪球0.1~15 μm[33-44]酪蛋白0.1~0.3 μm[33-44]酪蛋白胶束0.05~0.6 μm[33]β-乳球蛋白18~36 kDa[44]α-乳白蛋白14 kDa[44]矿物质100~300 Da[33-44]离子40~100 Da[33-44]MFGM片段0.1~4 μm[33]MUC1160~200 kDa[22-33]XO/XDH146~155 kDa[22-33]PASⅢ95~100 kDa[22-33]CD3676~78 kDa[22]BTN66~67 kDa[22-33]PAS6/743~59 kDa[22-33]ADPH52 kDa[22-33]FABP13~15 kDa[22-33]
除选择合适的分离膜材料、膜孔径和分离前预处理方法,膜分离条件对分离效果也产生很大影响,包括分离温度和压力等。分离过程中温度的变化会影响分离效果,较高的温度会导致蛋白尤其是乳清蛋白与膜蛋白结合甚至变性,65 ℃条件下酪乳中磷脂通过MFGM片段与乳清蛋白发生聚集,继续升温至80 ℃,磷脂可直接与乳清蛋白发生聚集[40]。加热使乳清蛋白吸附到MFG表面,与MFGM片段部分结合,被结合的乳清蛋白会随着MFGM或MFG进入截留液中,降低乳清蛋白去除率[41]。酪乳原料分离前进行巴氏杀菌处理,会导致MFGM富集物中β-乳球蛋白上升,同时PAS6/7下降,而在分离后对截留液进行巴氏杀菌处理不会影响MFGM富集物中蛋白组分[42]。膜分离温度也不能过低,低温下液体黏度大,流动性差,会减少膜通量,从而降低分离效果[41]。除了温度影响外,pH和分离压力等会对分离效果产生影响,酪乳分离时,提高pH能减少MFG聚集,适当提高过膜压力能提高膜通透性,这都有助于分离制备MFGM。
从酪乳中分离MFGM,近年来出现了一些新颖的想法。以稀奶油为原料制备黄油时,在稀奶油搅打之前,可先用分离技术处理稀奶油,以降低搅打后酪乳中的乳蛋白含量,提高了酪乳中MFGM纯度。这是因为乳蛋白会与MFG竞争吸附到水-空气界面,预先去除乳蛋白,有利于搅打过程中MFG和MFGM的释放[41]。除了降低酪乳中的非膜蛋白外,还可对脂质进行预处理,如脱脂处理,将酪乳中粒径大于1 μm的脂质颗粒脱除,提高极性脂质在脂质中的占比,减小后续加工中脂质的变化[1]。最新研究将酶解、超滤技术以及超临界萃取组合,与只使用超滤工艺比较,使用组合技术50 kDa膜处理的截留物中磷脂的含量提高了约8倍,总脂含量提高了7~8倍[43]。
膜分离工艺中,酪乳预处理应尽可能减少营养成分的损失,为第2阶段膜分离提供优质原料;不同孔径下膜分离的条件有待优化来精确控制,提高分离效果。将新型的技术与膜分离结合,并不断完善分离效果的评价体系,是未来从酪乳中分离MFGM的研究方向。
3 酪乳的应用研究
酪乳中营养成分丰富,功能繁多,是乳制品研究的热点话题,酪乳中富含的MFGM具有独特加工特性和生物活性功能。为更好开发利用酪乳原料,挖掘其潜在价值,近年来关于酪乳的应用研究不断深入。
研究人员不断深入探索酪乳中极性脂质和膜蛋白的功能特性,有研究分离酪乳中脂肪组分来评价其潜在抗增殖作用,采用了食品级和非食品级溶剂进行选择性萃取,发现中性组分和极性组分对9种人癌细胞株均有一定的抗增殖活性,并且使用食品级乙醇获得的馏分比使用非食品级溶剂获得的产率更高,富含磷脂和鞘脂的组分对人卵巢和结肠癌细胞有很强的抗增殖作用,深入挖掘酪乳中脂类物质的功能特性为酪乳作为功能性食品添加剂奠定基础[45]。乳凝集素是MFGM一种外周糖蛋白,具有多种生物学活性,如抗病毒、抗凝血和抗炎症,实验采用酶联免疫吸附试验对多种乳副产品中乳凝集素进行定量,发现酪乳的乳凝集素含量最高,热处理和水解都能使乳凝集素浓度下降,且水解影响更显著[46]。
MFGM富含磷脂,是婴幼儿大脑发育重要物质,能应用于IF改良[8]。国外在IF中添加MFGM的研究较多,研究发现MFGM成分可调节婴幼儿代谢和肠道微生物,对肠道的发育成熟起着重要作用[47]。鞘磷脂是母乳中最重要的鞘脂,乳汁中的鞘磷脂对哺乳期新生儿肠道成熟起着关键性作用,以植物油和大豆卵磷脂混合为基础的婴儿配方奶粉中的鞘磷脂含量显著低于人乳,而人乳中的磷脂种类与酪乳中的磷脂谱高度相似,可成为IF中磷脂的优质原料[17]。有IF的制造商已经将富含MFGM成分的物质添加到IF中以改善婴儿的生长和发育,添加MFGM的IF已经在瑞典、西班牙等国家上市[48],评价添加MFGM的IF与不同泌乳期的母乳在脂质组成和含量的差异具有重要意义。在仿人乳新型IF产品中,关于构造的MFG表面成分的精确组成和其在人体中消化特性及代谢有待进一步的研究[6]。
由于酪乳中富含蛋白和磷脂,实验开始研究将其应用于奶酪、低脂酸奶等产品中,提高营养价值同时观察对产品品质的影响。将酪乳喷雾干燥成BMP加入奶酪中,能够改善奶酪质地风味、提高营养价值,但也存在增加奶酪水分含量和延长凝乳时间等负面影响。这是因为磷脂和变性乳清蛋白的存在,前者的极性基团结合较多水分,削弱脱水效果;后者可以与酪蛋白胶束和κ-酪蛋白相互作用,形成酪蛋白-乳清复合物,影响凝固剂对κ-酪蛋白的相互作用,从而增加凝乳酶凝固时间[49]。研究对添加了BMP的奶酪感官特性、功能性、成分组成和微结构进行研究,发现添加10%BMP可提高奶酪的磷脂含量、水分、pH和盐分,降低奶酪的总脂肪和非发酵菌含量,显著增加来自蛋白分解途径挥发性化合物的产生,添加BMP后会形成多孔的奶酪微结构,奶酪质地更柔软,流动性显著降低[49-50]。在奶酪中添加BMP能提高营养价值,更符合消费者健康需求,但要控制好添加量以避免造成不良风味和质地。近年来,由于人们对健康低脂饮食的追求,对低脂酸奶的需求量不断增加,但脂肪含量降低会导致酸奶质构特性不佳,风味释放不平衡,酸味尖锐,缺乏乳香,产生令人不快的味道,这大大降低了低脂酸奶的可接受度。有研究对全脂酸奶、无添加的低脂酸奶和添加不同质量分数BMP的低脂酸奶的感官特性和挥发性成分进行比较,发现BMP的添加改善了低脂酸奶的风味和质地,但添加过多(>4%)会降低其风味的可接受性。感官和电子鼻分析表明,添加1%BMP的低脂酸奶具有与全脂酸奶相似的风味[48],这为解决低脂酸奶质构风味问题提供参考。
一些乳制品经常出现脂肪上浮现象,这是由于MFG之间发生了聚集导致相转化,而MFGM富含极性脂质和特异性膜蛋白,使其具有乳化性质。MFGM上磷脂的氧化还原电位与MFG相近,而MFGM蛋白又能提供空间电阻,两者能作为表面活性剂来竞争脂肪滴界面,起到了乳化稳定的作用[36]。这能有效防止MFG之间的絮凝和聚集,为酪乳解决脂肪上浮提供了思路[51]。
目前关于酪乳功能特性和应用研究已经有了很多成果,阐明功能特性的机理并将成果转化为实际应用是接下来重点攻克的难题,基于现有研究对酪乳成分、特性和应用的不断深入,加工利用乳品加工副产物具有良好的发展前景。
4 总结与展望
在酪乳成分分析方面,由于MFGM成分含量和功能特性受酪乳加工条件、检测方法的影响,不同研究定量数据存在较大差异。在未来研究中重点关注加工条件对成分造成的损失,并开发精确环保的检测方法,为研究提供便利。
分离提取MFGM时,以提高非膜成分去除率,提高膜成分保留率为目标,在未来研究中对酪乳预处理条件、分离条件不断优化,减少极性脂质和膜蛋白的损失。寻求新型技术应用于MFGM的分离,以减少加工时间和能耗,不断提高分离效果并降低成本。
在酪乳应用方面,将正处于实验初级阶段的成果不断深入探索和转化,为开发膳食补充剂、营养强化剂和免疫增强剂等方面提供指导。在各类产品应用中,研究添加后对产品品质影响,丰富评价指标,为酪乳和MFGM作为乳品配料奠定基础。
目前市售的酪乳粉和MFGM富集物还存在一些问题需要改进,比如MFGM富集物纯度不高,溶解性差,酪乳粉生物活性成分损失严重。不断优化加工条件和寻求新型技术,让成品的营养和可利用度最大化。
[1] LAMBERT S, LECONTE N, BLOT M, et al.The lipid content and microstructure of industrial whole buttermilk and butter serum affect the efficiency of skimming[J].Food Research International, 2016, 83:121-130.
[2] CALVO M V, MART N-HERN
N-HERN NDEZ M C, GARC
NDEZ M C, GARC A-SERRANO A, et al.Comprehensive characterization of neutral and polar lipids of buttermilk from different sources and its milk fat globule membrane isolates[J].Journal of Food Composition and Analysis, 2020, 86:103386.
A-SERRANO A, et al.Comprehensive characterization of neutral and polar lipids of buttermilk from different sources and its milk fat globule membrane isolates[J].Journal of Food Composition and Analysis, 2020, 86:103386.
[3] VANDERGHEM C, BODSON P, DANTHINE S, et al.Milk fat globule membrane and buttermilks:From composition to valorization[J].Biotechnologie Agronomie Societe Et Environnement, 2010, 14(3):485-500.
[4] ALI A H.Current knowledge of buttermilk:Composition, applications in the food industry, nutritional and beneficial health characteristics[J].International Journal of Dairy Technology, 2019, 72(2):169-182.
[5] DEWETTINCK K, ROMBAUT R, THIENPONT N, et al.Nutritional and technological aspects of milk fat globule membrane material[J].International Dairy Journal, 2008, 18(5):436-457.
[6] 梁丽. 乳脂肪球的体外消化特性及其影响因素研究[D].无锡:江南大学, 2019.
LIANG L.Study on milk fat globules digestion characteristics in vitro and its influence factors [D].Wuxi:Jiangnan University, 2019.
[7] QU X N, HU H Y, WANG Y, et al.Proteomics analysis of milk fat globule membrane enriched materials derived from by-products during different stages of milk-fat processing[J].LWT, 2019, 116:108531.
[8] 李晓东, 潘悦, 刘璐, 等 乳脂肪球膜的特性、开发及在模拟母乳脂肪球结构中的应用[J/OL].食品科学,2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20201207.1645.106.html.
LI X D, PAN Y, LIU L,et al.Characterization, development and application of milk fat globules membrane to simulate the structure of breast milk fat globules [J/OL].Food Science,2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20201207.1645.106.html.
[9] 姚磊. 乳脂肪球膜蛋白的研究与应用进展[J].中国食品添加剂, 2020, 31(12):117-121.
YAO L.The research of milk fat globule membrane protein and its development[J].China Food Additives, 2020, 31(12):117-121.
[10] 郑姗, 于景华, 刘晓辉,等.乳脂肪球膜中的脂类及其在婴儿配方乳粉中的应用[J].乳业科学与技术, 2019, 42(3):34-38;8.
ZHENG S, YU J H, LIU X H, et al.A reviews of lipids in milk fat globule membrane and their application in infant formula[J].Journal of Dairy Science and Technology, 2019, 42(3):34-38;8.
[11] YE A Q, CUI J, DALGLEISH D, et al.Effect of homogenization and heat treatment on the behavior of protein and fat globules during gastric digestion of milk[J].Journal of Dairy Science, 2017, 100(1):36-47.
[12] JUKKOLA A, HOKKANEN S, K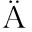 M
M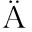 R
R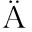 INEN T, et al.Changes in milk fat globules and membrane lipids under the shear fields of microfiltration and centrifugation[J].Journal of Membrane Science, 2019, 573:218-225.
INEN T, et al.Changes in milk fat globules and membrane lipids under the shear fields of microfiltration and centrifugation[J].Journal of Membrane Science, 2019, 573:218-225.
[13] HOLZMÜLLER W, KULOZIK U.Isolation of milk fat globule membrane (MFGM) material by coagulation and diafiltration of buttermilk[J].International Dairy Journal, 2016, 63:88-91.
[14] HOLZMÜLLER W, MÜLLER M, HIMBERT D, et al.Impact of cream washing on fat globules and milk fat globule membrane proteins[J].International Dairy Journal, 2016, 59:52-61.
[15] 李殿宝. 黄油的生产及品质营养评价[J].中国油脂, 2005, 30(3):30-31.
LI D B.Production and evaluation of quality and nutrition value of butter[J].China Oils and Fats, 2005, 30(3):30-31.
[16] 高三思,沈泰钰,于洪江,等.乳脂球膜蛋白的研究进展[J].中国畜牧兽医,2016,43(7):1 805-1 811.
GAO S S, SHEN T Y, YU H J, et al.Research progress on milk fat globule membrane proteins[J].China Animal Husbandry & Veterinary Medicine, 2016, 43(7):1 805-1 811.
[17] LOPEZ C, BLOT M, BRIARD-BION V, et al.Butter serums and buttermilks as sources of bioactive lipids from the milk fat globule membrane:Differences in their lipid composition and potentialities of cow diet to increase n-3 PUFA[J].Food Research International, 2017, 100:864-872.
[18] GASSI J Y, BLOT M, BEAUCHER E, et al.Preparation and characterisation of a milk polar lipids enriched ingredient from fresh industrial liquid butter serum:Combination of physico-chemical modifications and technological treatments[J].International Dairy Journal, 2016, 52:26-34.
[19] LÖFGREN L, STÅHLMAN M, FORSBERG G B, et al.The BUME method:A novel automated chloroform-free 96-well total lipid extraction method for blood plasma[J].Journal of Lipid Research, 2012, 53(8):1 690-1 700.
[20] HADDADIAN Z, EYRES G T, BREMER P, et al.Polar lipid composition of the milk fat globule membrane in buttermilk made using various cream churning conditions or isolated from commercial samples[J].International Dairy Journal, 2018, 81:138-142.
[21] BOURLIEU C, CHEILLAN D, BLOT M, et al.Polar lipid composition of bioactive dairy co-products buttermilk and butterserum:Emphasis on sphingolipid and ceramide isoforms[J].Food Chemistry, 2018, 240:67-74.
[22] FONTECHA J, BRINK L, WU S, et al.Sources, production, and clinical treatments of milk fat globule membrane for infant nutrition and well-being[J].Nutrients, 2020, 12(6):1 607.
[23] 韩立强, 杨国宇, 王月影, 等.乳中黄嘌呤氧化还原酶的研究进展[J].乳业科学与技术, 2006,29(5):212-214.
HAN L Q, YANG G Y, WANG Y Y, et al.Research advance of xanthine oxidoreductase in milk[J].Journal of Dairy Science and Technology, 2006, 29 (5):212-214.
[24] ARNETT H A, VINEY J L.Immune modulation by butyrophilins[J].Nature Reviews Immunology, 2014, 14(8):559-569.
[25] 陈丽, 向军英.MFG-E8对肠黏膜保护作用的研究进展[J].胃肠病学和肝病学杂志, 2015, 24(5):609-611.
CHEN L, XIANG J Y.Progress of MFG-E8 for intestinal mucosa protection[J].Chinese Journal of Gastroenterology & Hepatology, 2015, 24(5):609-611.
[26] MCAULEY J L, LINDEN S K, PNG C W, et al.MUC1 cell surface mucin is a critical element of the mucosal barrier to infection[J].The Journal of Clinical Investigation, 2007, 117(8):2 313-2 324.
[27] HOLZMÜLLER W, KULOZIK U.Quantification of MFGM proteins in buttermilk and butter serum by means of a stain free SDS-PAGE method[J].Journal of Food Composition and Analysis, 2016, 49:102-109.
[28] HADDADIAN Z, BREMER P, EYRES G T, et al.The impact of cream churning conditions on xanthine oxidase activity and oxidation-reduction potential in model emulsion systems[J].International Dairy Journal, 2016, 60:55-61.
[29] HADDADIAN Z, EYRES G T, CARNE A, et al.Impact of different milk fat globule membrane preparations on protein composition, xanthine oxidase activity, and redox potential[J].International Dairy Journal, 2017, 64:14-21.
[30] PARR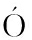 N J A, RIPOLLÉS D, NAVARRO F, et al.Effect of high pressure treatment on the antirotaviral activity of bovine and ovine dairy by-products and bioactive milk proteins[J].Innovative Food Science & Emerging Technologies, 2018, 48:265-273.
N J A, RIPOLLÉS D, NAVARRO F, et al.Effect of high pressure treatment on the antirotaviral activity of bovine and ovine dairy by-products and bioactive milk proteins[J].Innovative Food Science & Emerging Technologies, 2018, 48:265-273.
[31] RIPOLLÉS D, PARR N J A, CALVO M, et al.Antioxidant activity of co-products from milk fat processing and their enzymatic hydrolysates obtained with different proteolytic preparations[J].International Dairy Journal, 2016, 60:70-77.
N J A, CALVO M, et al.Antioxidant activity of co-products from milk fat processing and their enzymatic hydrolysates obtained with different proteolytic preparations[J].International Dairy Journal, 2016, 60:70-77.
[32] BARRY K M, DINAN T G, KELLY P M.Selective enrichment of dairy phospholipids in a buttermilk substrate through investigation of enzymatic hydrolysis of milk proteins in conjunction with ultrafiltration[J].International Dairy Journal, 2017, 68:80-87.
[33] HOLZMÜLLER W, KULOZIK U.Technical difficulties and future challenges in isolating membrane material from milk fat globules in industrial, settings-a critical review[J].International Dairy Journal, 2016, 61:51-66.
[34] MORIN P, JIMÉNEZ -FLORES R, POULIOT Y.Effect of processing on the composition and microstructure of buttermilk and its milk fat globule membranes[J].International Dairy Journal, 2007, 17(10):1 179-1 187.
[35] ROMBAUT R, DEJONCKHEERE V, DEWETTINCK K.Filtration of milk fat globule membrane fragments from acid buttermilk cheese whey[J].Journal of Dairy Science, 2007, 90(4):1 662-1 673.
[36] PHAN T T Q, LE T T, VAN DE WALLE D, et al.Combined effects of milk fat globule membrane polar lipids and protein concentrate on the stability of oil-in-water emulsions[J].International Dairy Journal, 2016, 52:42-49.
[37] MORIN P, BRITTEN M, JIMÉNEZ -FLORES R, et al.Microfiltration of buttermilk and washed cream buttermilk for concentration of milk fat globule membrane components[J].Journal of Dairy Science, 2007, 90(5):2 132-2 140.
[38] CORREDIG M, ROESCH R R, DALGLEISH D G.Production of a novel ingredient from buttermilk[J].Journal of Dairy Science, 2003, 86(9):2 744-2 750.
[39] KONRAD G, KLEINSCHMIDT T, LORENZ C.Ultrafiltration of whey buttermilk to obtain a phospholipid concentrate[J].International Dairy Journal, 2013, 30(1):39-44.
[40] SAFFON M, JIMÉNEZ -FLORES R, BRITTEN M, et al.Effect of heating whey proteins in the presence of milk fat globule membrane extract or phospholipids from buttermilk[J].International Dairy Journal, 2015, 48:60-65.
[41] JUKKOLA A, PARTANEN R, ROJAS O J, et al.Effect of heat treatment and pH on the efficiency of micro-diafiltration for the separation of native fat globules from cream in butter production[J].Journal of Membrane Science, 2018, 548:99-107.
[42] HANSEN S F, PETRAT-MELIN B, RASMUSSEN J T, et al.Placing pasteurisation before or after microfiltration impacts the protein composition of milk fat globule membrane material[J].International Dairy Journal, 2018, 81:35-41.
[43] BARRY K M, DINAN T G, KELLY P M.Pilot scale production of a phospholipid-enriched dairy ingredient by means of an optimised integrated process employing enzymatic hydrolysis, ultrafiltration and super-critical fluid extraction[J].Innovative Food Science & Emerging Technologies, 2017, 41:301-306.
[44] BRANS G, ![]() C G P H, VAN DER SMAN R G M, et al.Membrane fractionation of milk:State of the art and challenges[J].Journal of Membrane Science, 2004, 243(1-2):263-272.
C G P H, VAN DER SMAN R G M, et al.Membrane fractionation of milk:State of the art and challenges[J].Journal of Membrane Science, 2004, 243(1-2):263-272.
[45] CASTRO-G MEZ P, RODR
MEZ P, RODR GUEZ-ALCAL
GUEZ-ALCAL L M, MONTEIRO K M, et al.Antiproliferative activity of buttermilk lipid fractions isolated using food grade and non-food grade solvents on human cancer cell lines[J].Food Chemistry, 2016, 212:695-702.
L M, MONTEIRO K M, et al.Antiproliferative activity of buttermilk lipid fractions isolated using food grade and non-food grade solvents on human cancer cell lines[J].Food Chemistry, 2016, 212:695-702.
[46] RIPOLLÉS D, PARR N J A, FRAGUAS J, et al.Determination of lactadherin concentration in dairy by-products by ELISA:Effect of heat treatment and hydrolysis[J].Journal of Dairy Science, 2018, 101(2):912-923.
N J A, FRAGUAS J, et al.Determination of lactadherin concentration in dairy by-products by ELISA:Effect of heat treatment and hydrolysis[J].Journal of Dairy Science, 2018, 101(2):912-923.
[47] LEE H, SLUPSKY C M, HECKMANN A B, et al.Milk fat globule membrane as a modulator of infant metabolism and gut microbiota:A formula supplement narrowing the metabolic differences between breastfed and formula-fed infants [J].Molecular Nutrition & Food Research, 2021, 65(3):2000603.
[48] ZHAO L L, FENG R, REN F Z, et al.Addition of buttermilk improves the flavor and volatile compound profiles of low-fat yogurt[J].LWT, 2018, 98:9-17.
[49] HICKEY C D, O′SULLIVAN M G, DAVIS J, et al.The effect of buttermilk or buttermilk powder addition on functionality, textural, sensory and volatile characteristics of Cheddar-style cheese[J].Food Research International, 2018, 103:468-477.
[50] HICKEY C D, DIEHL B W K, NUZZO M, et al.Influence of buttermilk powder or buttermilk addition on phospholipid content, chemical and bio-chemical composition and bacterial viability in Cheddar style-cheese[J].Food Research International, 2017, 102:748-758.
[51] 李静. 加热对乳脂肪球膜的结构和成分影响[D].天津:天津科技大学, 2018.
LI J.Effect of heating on the structure and composition of milk fat globule membrane [D].Tianjin:Tianjin University of Science and Technology, 2018.