黄酒是中国传统的发酵酒(酒精体积分数8%~15%),在中国已有5 000多年的历史,其风味独特且营养丰富[1]。我国黄酒产地多,分布广,品类繁多,目前黄酒生产主要采用传统工艺(人工处理)和机械工艺(使用设备)2种工艺,通常发酵25~40 d,贮存6~12个月[2]。中国黄酒讲究“以麦制曲,用曲酿酒”[3],麦曲是传统黄酒酿造的重要原料之一,被誉为黄酒之“骨”。麦曲含有非常丰富的酶系,微生物是麦曲的重要组成部分,对黄酒的品质和风味起到了非常重要的作用,主要包含各类丝状真菌、细菌和酵母菌[4]。想要不断提高麦曲的品质,则需进一步研究其中的微生物,许多科研单位和黄酒酿造从业者也对其进行了大量的研究。崔梦君等[5]运用PCR-DGGE与MiSeq高通量测序技术相结合的方法分析了黄酒熟麦曲细菌多样性,结果显示芽孢杆菌属(Bacillus)与魏斯氏属(Weissella)是优势细菌属;JI等[6]利用高通量测序技术对麦曲中的丝状真菌进行了研究,发现丝状真菌在不同的麦曲和不同的发酵阶段存在差异,且在各发酵阶段中,曲霉属(Aspergillus)一直为优势丝状真菌属。目前,关于黄酒麦曲的微生物群落结构国内已有部分相关研究报道[5-8],但总体而言还比较浅显片面,而且揭示麦曲发酵过程微生物群落演替规律的研究还鲜有报道。本研究以四川黄酒麦曲发酵过程曲为研究对象,采用Illumina MiSeq PE300平台对细菌16S rDNA V3~V4区和真菌ITS区序列进行分析,旨在较为全面地解析四川黄酒麦曲发酵过程中微生物种群结构的动态变化规律,探索其与理化性质之间的相关性,为后续筛选功能微生物,优化黄酒麦曲生产工艺并提高麦曲品质提供理论支持。
1 材料与方法
1.1 材料与试剂
黄酒麦曲,四川省某黄酒厂制曲车间;氢氧化钠、无水乙酸钠、冰乙酸、碘化钾、可溶性淀粉、硫酸铜、酒石酸钾钠、葡萄糖、甲醛溶液(37%~40%)(均为分析纯),成都科龙化工试剂厂;E.Z.N.A.Soil DNA Kit,美国Omega公司;引物,上海美吉生物医药科技有限公司。
1.2 仪器与设备
PHS-3C酸度计,上海仪电科学仪器股份有限公司;DYY-5琼脂糖凝胶电泳仪,北京六一仪器厂;Legend Micro 17R高速冷冻离心机,美国赛默飞公司;GeneAmp® 9700型PCR仪,美国ABI公司;Illumina MiSeq PE300高通量测序平台,美国Illumina公司。
1.3 试验方法
1.3.1 黄酒麦曲制备工艺与样品采集
制曲工艺:以小麦为原料采用固态发酵的方式,在适宜的气温和水分条件下,小麦经过筛选、轧碎、拌水、踩曲、压制成型后,堆积于曲房内保温培养并进行自然接种,期间翻曲1~2次,经7 d左右的固态发酵而成。
样品采集:从发酵过程初始起每天取样1次,共计8 d、8次(依次标记为FH1~FH8),贮藏期取样1次(第12天,标记为FHC),共计9个样品。
1.3.2 理化指标分析检测
参照QB/T 4257—2011《酿酒大曲通用分析方法》[9]测定样品中水分、糖化力、液化力和酸度。采用酒母醪中标准葡萄糖液反滴定的还原糖测定法[10]。
1.3.3 DNA提取及测序
采用试剂盒提取麦曲微生物宏基因组DNA,用1%琼脂糖凝胶电泳检测提取结果,用NanoDrop2000检测浓度和纯度;使用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rDNA基因V3~V4区域扩增,20 μL PCR体系包括:4 μL 5×FastPfu缓冲液,2 μL 三磷酸脱氧核糖核苷酸(2.5 mmol/L),0.8 μL正反向引物(5 μmol/L),0.4 μL FastPfu聚合酶(5 μmol/L),0.2 μL BSA,10 ng DNA模板,补ddH2O至20 μL;使用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGA TGC-3′)对真菌ITS区域扩增,20 μL PCR体系包括:2 μL 10×缓冲液,2 μL三磷酸脱氧核糖核苷酸(2.5 mmol/L),0.8 μL正反向引物(5 μmol/L),0.2 μL rTaq聚合酶,0.2 μL 牛血清白蛋白(bovine albumin,BAS),10 ng DNA模板,补ddH2O至20 μL;扩增参数:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环30次;72 ℃延伸10 min;使用2%琼脂糖凝胶电泳检测PCR扩增产物,并纯化回收。送至上海美吉生物医药科技有限公司,用Illumina MiSeq PE300平台测序。
1.3.4 测序数据分析
对原始数据进行质量控制与预处理,得到有效序列[11],用于后续分析。使用UPARSE[12]软件将相似性>97%的序列进行操作分类单元(operational taxonomic unit,OTU)聚类。用QIIME[13]计算Alpha多样性,根据Ace、Chao1和Shannon指数对麦曲曲样中的微生物丰富度和多样性进行分析。通过BLAST比对,获得细菌和真菌分别在门和属水平下的分类情况[14]。用R语言的Vegan软件包进行典型对应分析(canonical correspondence analysis,CCA)并绘图。使用Origin 2018软件对麦曲样品的理化性质变化和其中优势微生物进行柱状图的绘制。
2 结果与分析
2.1 麦曲发酵过程的理化生化指标变化
麦曲发酵过程中温度的变化情况见图1-a。成型麦曲在曲房堆积时,铺上稻草以及及时的关门封窗措施会起到一定的保温作用,随着麦曲中微生物的生理代谢活动开始频繁,麦曲品温迅速增加,在麦曲入房堆积的第5天,达到了最高品温(55 ℃)。在整个发酵过程中, 麦曲品温始终高于36 ℃。图1-b是水分、糖化力、液化力、还原糖和酸度的变化情况。麦曲水分随发酵进行而逐渐降低,跟大曲发酵[15]相似,随着自然发酵温度的增加,水分不断汽化而减少,但成熟期麦曲的水分略有上升,这可能是由贮存环境的排湿处理和密闭性较差所导致的。麦曲的品温和水分为其发酵过程中微生物的生长繁殖与生理代谢提供了条件。在发酵第2天左右,糖化力达到887 U左右,随后下降,可能是因为该阶段曲霉属等多种利于产酶的丝状真菌生长代谢缓慢,糖化酶产量减少;在发酵第4天后,糖化力又大幅上升,最后趋于稳定在992 U左右。液化力在发酵第4~7天有一定波动,推测与微生物的菌群演替、生长繁殖有关,但整体呈上升趋势,最终稳定在0.38 U左右。还原糖含量随着糖化酶活力变化而变化,可能是因为麦曲中大量淀粉经α-淀粉酶及糖化酶分解转化为葡萄糖等,所以还原糖含量与糖化力有较大关联。麦曲的酸度主要来自微生物的有机酸代谢以及对淀粉、蛋白质等的降解[16]。发酵第3天时酸度达到峰值,这可能是由于此时微生物正在大量繁殖并产生了大量酸类代谢物。发酵第3天后,酸度又下降到0.55 mmol/10g左右,最后稳定在0.57 mmol/10g左右。
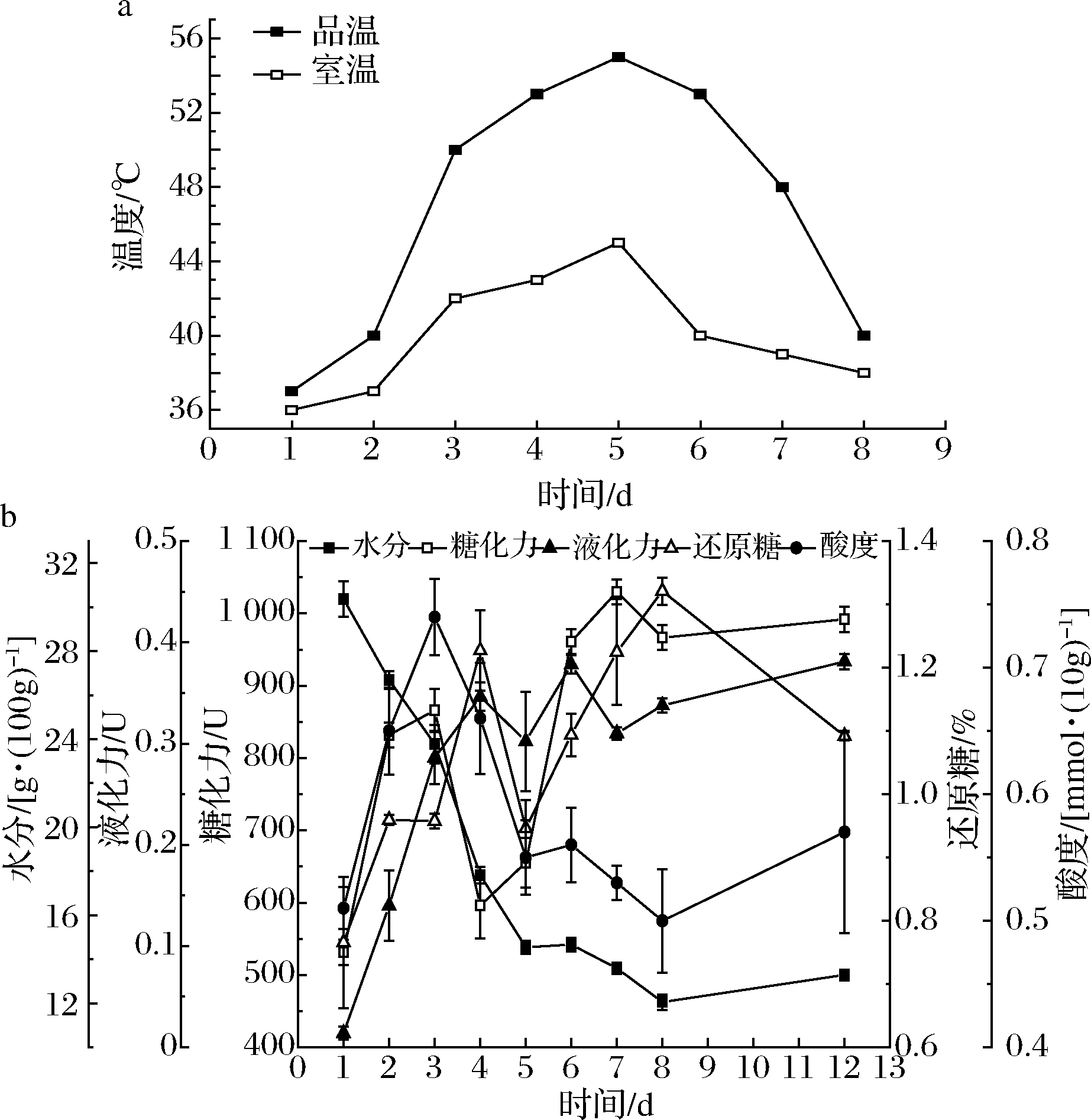
a-温度;b-水分、液化力、糖化力、还原糖含量、酸度
图1 黄酒麦曲发酵过程中理化指标的变化情况
Fig.1 Changes of physicochemical indexes during the fermentation of Huangjiu wheat Qu
2.2 麦曲微生物的Alpha多样性分析
由表1可知,发酵过程中麦曲的细菌OTU数逐渐上升;真菌OTU数呈先降后增再降的趋势,最终整体增加。所有样本的Coverage指数均大于0.999,说明样本文库中序列的覆盖率高。Ace指数和Chao1指数评估物种丰富度,Shannon指数评估物种均匀度和多样性。麦曲发酵前2 d的细菌Ace指数和Chao1指数较小,随后大幅上升,这表明麦曲在发酵初期细菌群落丰富度最低,经过一段时间的发酵作用后菌群丰富度上升。麦曲的细菌Shannon指数先升后降再上升,最终总体上升,这表明麦曲随着发酵的结束,其细菌群落多样性最终上升。同理可知,麦曲在发酵前期真菌群落丰富度较低,经过一段时间的发酵作用后菌群丰富度总体上升,且麦曲随着发酵的结束,其真菌群落多样性最终上升。
表1 黄酒麦曲发酵过程样品的细菌和真菌Alpha多样性指数
Table 1 Analysis of bacterial and fungal Alpha diversity ndexes of fermentation process samples of Huangjiu wheat Qu
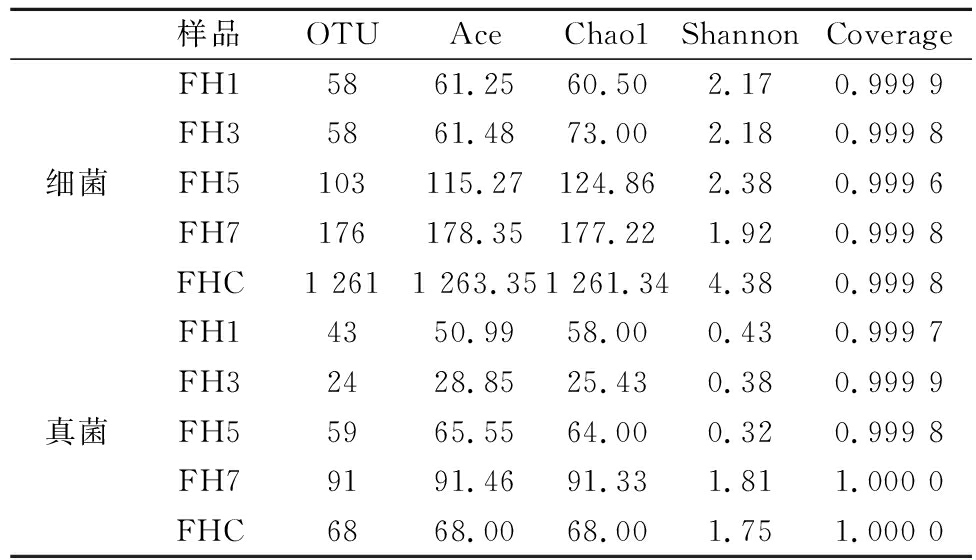
样品OTUAceChao1ShannonCoverageFH15861.2560.502.170.999 9FH35861.4873.002.180.999 8细菌FH5103115.27124.862.380.999 6FH7176178.35177.221.920.999 8FHC1 2611 263.351 261.344.380.999 8FH14350.9958.000.430.999 7FH32428.8525.430.380.999 9真菌FH55965.5564.000.320.999 8FH79191.4691.331.811.000 0FHC6868.0068.001.751.000 0
2.3 麦曲微生物群落结构分析
麦曲发酵过程中的细菌群落结构见图2。由图2-a可知,在门水平上,黄酒麦曲在整个发酵过程中,变形菌门(Proteobacteria)(21.69%~70.65%)和厚壁菌门(Firmicutes)(28.94%~58.69%)一直为优势菌门。在发酵后期,变形菌门相对丰度比例相对下降,厚壁菌门相对丰度比例相对上升,且蓝藻细菌(Cyanobacteria)和放线菌门(Actinobacteria)逐渐增多,但最终的成品曲(FHC)中厚壁菌门(44.10%)和变形菌门(21.05%)仍为相对优势菌,这与崔梦君等[5]的报道一致。原因可能是变形菌门中的部分好氧菌可能在低氧、高温的环境中难以生存,而厚壁菌门中的芽孢杆菌则可以适应这种恶劣的环境[17]。
由图2-b可知,在属水平上,黄酒麦曲发酵过程样品的细菌群落多样性波动上升,其变化情况与上述多样性指数一致。在发酵前期,葡萄球菌属(Staphylococcus)、肠杆菌属(Enterobacter)、Kosakonia、乳球菌属(Lactococcus)和魏斯氏菌属为相对优势菌,尤其在发酵第5天(顶温)时,群落物种最为丰富。在发酵后期,发酵温度逐渐下降,细菌群落组成发生显著改变,芽孢杆菌属和罗尔斯通氏菌属(Ralstonia)占相对优势,最终形成以芽孢杆菌属(38.38%)、不动杆菌属(Acinetobacter,2.01%)、代尔夫特菌(Delftia,1.80%)、棒状杆菌属(Corynebacterium,1.73%)、葡萄球菌属(1.67%)、气单胞菌属(Aeromonas,1.45%)、Sulfuricurvum(1.45%)、Cyanobium_PCC-6307(1.41%)和黄杆菌属(Flavobacterium,1.18%)为主的细菌群落。刘芸雅等[18]利用Illumina Miseq测序平台对绍兴黄酒麦曲的细菌群落结构进行分析,结果发现麦曲中优势菌属为芽孢杆菌属(58.65%),与本研究结论一致。芽孢杆菌属的高丰度的形成可能是由于其具有一定的耐高温、耐酸、耐碱性和复杂酶系的协同作用,在麦曲堆放过程中高达55 ℃的环境下,大部分微生物的生长繁殖受抑制,但芽孢杆菌属仍能以芽孢的方式生存[19],且在较高温度下生长的菌株一般具有较高的孢子耐热性[20]。
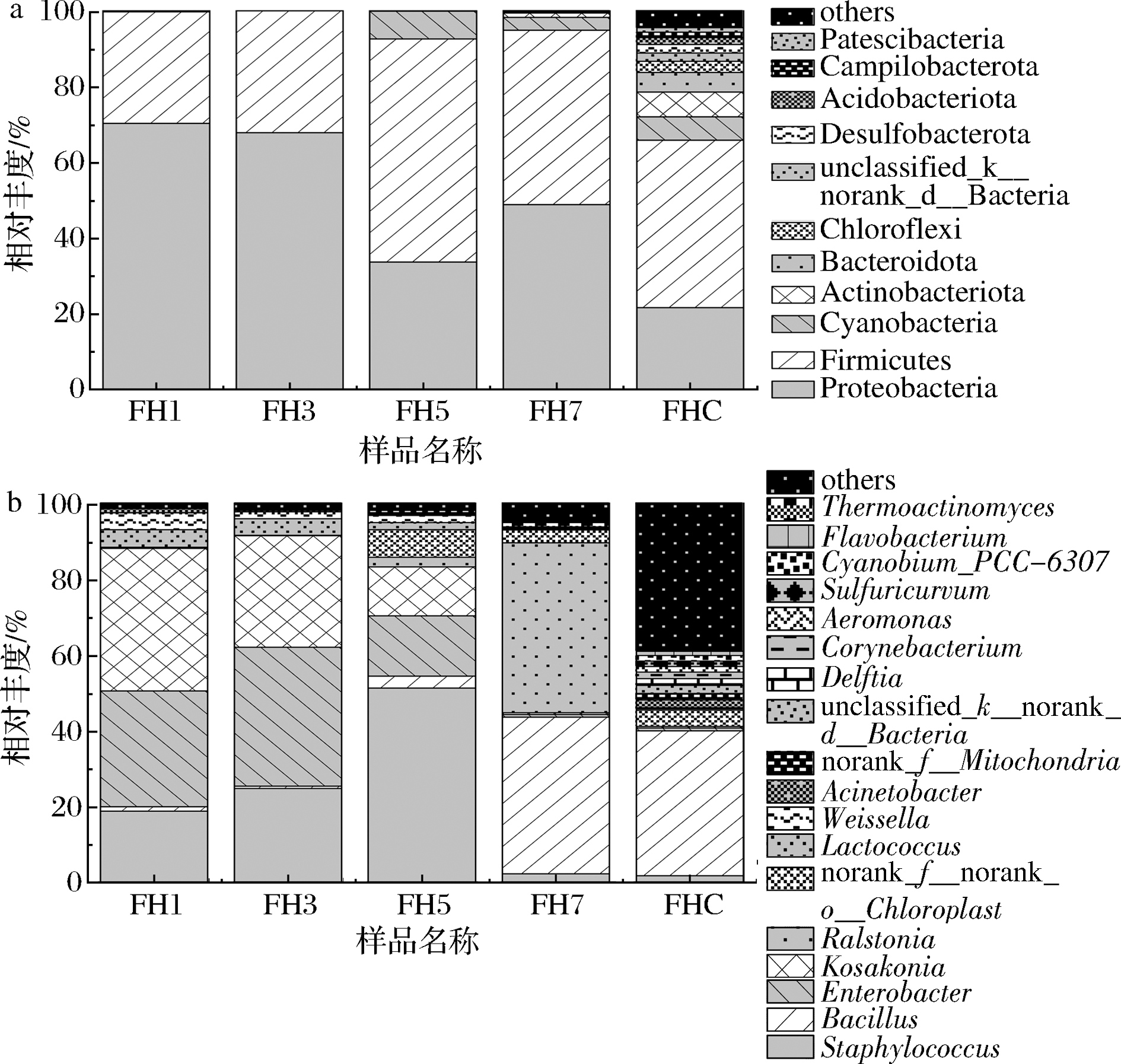
a-门水平;b-属水平
图2 门水平及属水平上黄酒麦曲发酵过程中细菌群落结构
Fig.2 Bacterial community structure during the fermentation of Huangjiu wheat Qu based on phylum and genus level
麦曲发酵过程中的真菌群落结构见图3。由图3-a可知,在门水平上,黄酒麦曲在整个发酵过程中,子囊菌门(Ascomycota,59.23%~99.99%)一直为绝对优势菌门;在发酵后期,担子菌门(Basidiomycota)和毛霉亚门(Mucoromycota)逐渐增多,仅次于子囊菌门共同成为绝对优势菌,这与凌梦萤[21]的研究结果一致。在属水平上(图3-b),在整个发酵过程中,曲霉属(42.72%~99.70%)一直都是绝对优势菌属。在发酵起始阶段,有足够的氧气和营养物质供给,因此形成一个相对复杂的真菌群落结构;自发酵开始,真菌微生物数量逐渐减少,这可能是由于细菌在繁殖过程中释放出一些可能会抑制真菌生长的物质(例如乙酸、乳酸等);随着进一步发酵,一些真菌在适应环境后,可利用残留的营养物质或其他微生物的代谢产物生长,因此真菌微生物数量又逐渐增多;在发酵后期,真菌群落组成发生显著改变,多样性较丰富,与上述多样性指数一致,最终形成以曲霉属(42.73%)、Apiotrichum(28.12%)、Cutaneotrichosporon(10.52%)、酿酒酵母(Saccharomyces,6.37%)、棒束孢属(Isaria,6.10%)、奥默柯达菌属(Kodamaea,1.39%)为主的真菌群落。曲霉属等多种丝状真菌在黄酒发酵过程中可分泌多种有利于淀粉糖化以及蛋白质分解的酶类,如α-淀粉酶、β-淀粉酶、糖化酶和蛋白酶等[22]。其中,糖化酶活力在第7天时最高, 达到了1 030 U(图1-b)。
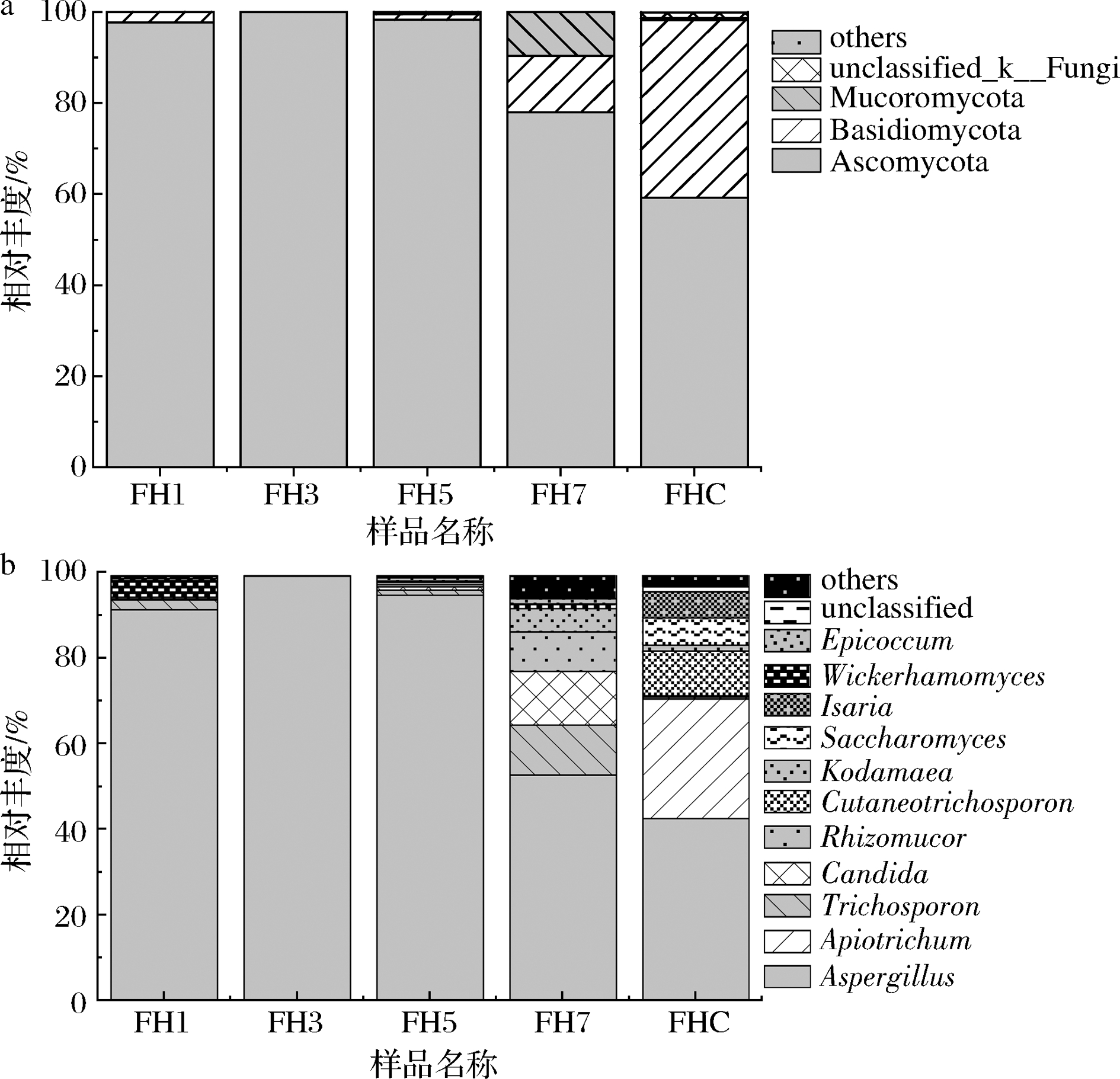
a-门水平;b-属水平
图3 门水平及属水平上黄酒麦曲发酵过程中真菌群落结构
Fig.3 Fungal community structure during the fermentation of Huangjiu wheat Qu based on phylum and genus level
2.4 细菌群落与理化因子的关联性分析
CCA方法[23]是生物多样性多元统计的常用方法之一。选择黄酒麦曲样品中相对丰度在前10位的细菌群落与糖化力、液化力、还原糖含量和酸度等理化因子进行CCA。如图4所示,酸度与液化力之间夹角为钝角,说明2个指标之间呈负相关;糖化力与液化力之间夹角为锐角,说明2个指标之间呈正相关,具有协同效应;同理可知,还原糖与糖化力、液化力均呈正相关,与酸度呈负相关。不同样品间的关系主要有:FH1、FH3和FH5之间相关性较大,与FH7和FHC均差异较大;FH7与FHC之间差异较大。不同物种间的关系主要有:葡萄球菌属、乳球菌属、魏斯氏菌属、Kosakonia和肠杆菌属等微生物呈正相关,与芽孢杆菌属等微生物呈负相关。物种和理化因子间的主要关系有:葡萄球菌属、乳球菌属、魏斯氏菌属、Kosakonia和肠杆菌属与酸度呈正相关,与糖化力、液化力和还原糖含量呈负相关;芽孢杆菌属与糖化力、液化力和还原糖含量呈正相关,与酸度呈负相关。由此说明,麦曲中微生物的种群结构对麦曲理化指标具有显著影响。

图4 黄酒麦曲发酵过程中细菌群落与理化因子的CCA
Fig.4 The CCA between bacterial community and physicochemical factors during the fermentation of Huangjiu wheat Qu
3 结论
本研究以四川黄酒麦曲发酵过程酒曲为研究对象,通过高通量测序技术探究了四川黄酒麦曲发酵过程中的细菌多样性和真菌多样性,对细菌群落而言,葡萄球菌属、肠杆菌属、Kosakonia为发酵前期的主要菌属,在发酵第5天(顶温)时,群落物种最为丰富,随着发酵继续进行,在发酵后期的发酵温度逐渐下降,细菌群落组成发生显著改变,最终芽孢杆菌属成为相对优势菌属;对真菌群落而言,在整个发酵过程中,曲霉属一直都是绝对优势菌属,随着发酵的进行,曲霉属的丰度略有下降,最终形成以曲霉属、Apiotrichum、Cutaneotrichosporon、酿酒酵母、棒束孢属和奥默柯达菌属为主的真菌群落。此外,对黄酒麦曲发酵过程中的理化特性变化情况进行了分析,总体而言,随着黄酒麦曲发酵结束,其水分含量下降,而糖化力、液化力、还原糖含量和酸度均上升。由CCA可知麦曲中微生物的种群结构与麦曲理化指标存在明显关联,且还原糖含量与微生物物种分布相关程度最大,芽孢杆菌属对麦曲理化指标的影响较大。本研究探究了黄酒麦曲在不同发酵阶段中细菌和真菌群落及理化特性的变化规律及相互关系,有助于构建关于黄酒麦曲微生物多样性的系统认识体系,后续可通过分析发酵过程中微生物具体代谢途径和机理来探究其对黄酒麦曲及黄酒的风味和品质的作用,以期为黄酒工业化发展提供理论基础。
[1] LIU R, FU Z K, ZHANG F J, et al.Effect of yellow rice wine on anti-aging ability in aged mice induced by d-galactose[J].Food Science and Human Wellness, 2020, 9(2):184-191.
[2] WU P G,CAI C G,SHEN X H, et al.Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine[J].Food Chemistry,2014,152:108-112.
[3] 胡武瑶,杨昳津,窦慧,等.不同麦曲酿造黄酒中挥发性风味物质的代谢差异[J].食品与发酵工业,2020,46(8):226-233.
HU W Y, YANG Y J, DOU H, et al.Metabolic differences of volatile flavor compounds in Huangjiu fermented with different wheat Qu[J].Food and Fermentation Industries, 2020, 46(8):226-233.
[4] ZHANG K Z, LI Q, WU W C, et al.Wheat Qu and its production technology, microbiota, flavor, and metabolites[J].Journal of Food Science,2019,84(10):2 373-2 386.
[5] 崔梦君,折米娜,张振东,等.黄酒熟麦曲中细菌多样性的评价[J].食品研究与开发,2019,40(11):194-199.
CUI M J, SHE M N, ZHANG Z D, et al.Evaluation of the bacterial diversity in Chinese rice wine cooked wheat Qu[J].Food Research and Development, 2019, 40(11):194-199.
[6] JI Z W, JIN J S, YU G S, et al.Characteristic of filamentous fungal diversity and dynamics associated with wheat Qu and the traditional fermentation of Chinese rice wine[J].International Journal of Food Science & Technology,2018,53(7):1 611-1 621.
[7] 胡翠翠. 黄酒曲中微生物菌群结构分析及生物胺产生菌的分离鉴定[D].天津:天津科技大学,2017.
HU C C.Analysis of microbial flora structure, isolation and identification biogenic amines produceing bacteria of rice wine Qu[D].Tianjin:Tianjin University of Science and Technology, 2017
[8] 杜丹,解修超,李新生,等.黄酒酒曲微生物及其代谢产物的研究进展[J].生物资源,2019,41(2):104-111.
DU D, XIE X C, LI X S, et al.Research progress on microorganisms and their metabolites of Huangjiu Qu[J].Biotic Resources, 2019, 41(2):104-111.
[9] 中华人民共和国工业和信息化部. QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社, 2011.
Ministry of Industry and Information Technology of the People′s Republic of China.QB/T 4257—2011 General methods of analysis for Daqu[S].Beijing:China Light Industry Press, 2011.
[10] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社, 1998.
SHEN Y F.Encyclopedia of Liquor Production Technology[M].Beijing: China Light Industry Pres, 1998.
[11] 董蕴,许小玲,代凯文,等.基于Miseq高通量测序技术对细菌型豆豉细菌类群的评价[J].食品工业科技, 2018, 39(13):150-154;247.
DONG Y, XU X L, DAI K W, et al.Characterization of bacterial microflora of bacteria-fermented Douchi by Miseq high-throughput sequencing[J].Science and Technology of Food Industry, 2018, 39(13):150-154;247.
[12] EDGAR R C.Uparse:Highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10).DOI:10.1038/nmeth.2604.
[13] CAPORASO J G,KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[14] 夏玙,罗惠波,周平,等.不同处理方式的大曲真菌群落差异分析[J].食品科学,2018,39(22):166-172.
XIA Y, LUO H B, ZHOU P, et al.Comparison of fungal communities in Daqu with different treatments[J].Food Science, 2018, 39(22):166-172.
[15] 尉嘉眙,常强,蒋超,等.大曲理化性质与白酒产品风味的相关性分析[J].食品工业科技,2020,41(18):244-251.
YU J Y, CHANG Q, JIANG C, et al.Correlation analysis between physicochemical properties of Daqu and flavor of liquor products[J].Science and Technology of Food Industry, 2020,41(18):244-251.
[16] 吴宗文,孙军勇,吴殿辉,等.绍兴黄酒发酵过程中有机酸及产酸细菌的初步研究[J].食品与发酵工业,2016,42(5):12-18.
WU Z W, SUN J Y, WU D H, et al.Preliminary study on organic acid and acid-producing bacterial during Chinese rice wine fermentation[J].Food and Fermentation Industries, 2016,42(5):12-18.
[17] SAKANDAR H A, HUSSAIN R, FARID KHAN Q, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu(starters):A review[J].Food Research International,2020,138:109830.
[18] 刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
LIU Y Y, MAO J, MENG X Y, et al.Exploring bacterial community in wheat Qu and their changes during Shaoxing rice wine fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2017,17(1):201-208.
[19] YANG G,YANG D Q,WANG X D, et al.A novel thermostable cellulase-producing Bacillus licheniformis A5 acts synergistically with Bacillus subtilis B2 to improve degradation of Chinese distillers′ grains[J].Bioresource Technology,2021,325(9-10):124729.
[20] KIM T D, BEGYN K, KHANAL S, et al.Bacillus weihenstephanensis can readily evolve for increased endospore heat resistance without compromising its thermotype[J].International Journal of Food Microbiology,2021,341(6):109072.
[21] 凌梦荧.绍兴黄酒麦曲的关键指标筛选及品质评价方法研究[D].无锡:江南大学,2019.
LING M Y.Study on the key indicators screening and quality evaluation method of Shaoxing Huangjiu wheat Qu[D].Wuxi:Jiangnan University, 2019.
[22] ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu—a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2011, 117(1):82-90.
[23] 于南京,俞存根,徐永久,等.舟山群岛外海域虾类群落结构及其与环境因子的关系[J].中国水产科学,2021,28(3):288-298.
YU N J, YU C G, XU Y J, et al.Shrimp community structure and its relationship with environmental factors in the offshore waters of Zhoushan Islands[J].Journal of Fishery Sciences of China,2021,28(3):288-298.