巴斯德毕赤酵母(Komagataella phaffii)是一种甲醇营养型酵母,其特有的醇氧化酶1(alcohol oxidase 1,Aox1)可以代谢甲醇,使其能在甲醇为唯一碳源的培养基中生长[1]。毕赤酵母具有可严紧调控,可高密度发酵,可翻译后修饰等诸多优点,因而被开发为现在应用最为广泛的重组蛋白表达系统之一。至今已有抗菌肽[2],病毒样颗粒[3],牛胃溶菌酶[4],普鲁兰酶[5]等多种外源蛋白成功在毕赤酵母中表达。但毕赤酵母对渗透压胁迫的抵抗力较弱,一定程度上影响了其在工业上的应用。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是真核细胞中高度保守的响应外界环境刺激的信号传导途径。酿酒酵母中含有5种MAPK信号通路[6],其中高渗甘油信号通路(high osmolarity glycerol pathway, HOG pathway)可以响应多种刺激[7],如高渗透压休克、亚砷酸盐、醋酸、冷休克和热休克等,是酵母响应外界渗透压变化的重要信号传导途径。HOG信号通路在响应高渗透压休克时,会通过SLN1和SHO1 2个上游信号分支激活MAPKK Pbs2[8],Pbs2再进一步激活Hog1[9],最终引发一系列下游基因的表达变化,达到在高渗条件下存活的结果。已有分析表明,约88%的Hog1依赖性基因的表达需要下游的Hot1、Msn2/4和Sko1 3个转录因子及其组合[10]。在这一过程中,Hog1作为唯一的MAPK发挥着最关键的作用,从接收信号到作为激酶向下游传导信号[11]及作为转录因子直接或间接地调控下游基因表达[10]都不可或缺。
然而,前期研究发现,毕赤酵母虽然也有同源的HOG信号通路,但与酿酒酵母有不少区别,例如GT1(glycerol transporter 1)[12]的高渗诱导程度远低于酿酒酵母中的同源基因STL1(sugar transporter-like protein 1)[13]的诱导程度,重要的甘油合成基因GPD1[14-15]表达反而受阻遏等[16]。上述区别使得毕赤酵母的高渗抗性弱于酿酒酵母。基于此,我们进行了相关的转录组分析(未发表结果),发现在高渗条件下,毕赤酵母中的甘油通道蛋白基因FPS1,甘油代谢第一步的甘油激酶基因GUT1等的表达显著上调,与酿酒酵母中的情况相反。这些结果以及胞内甘油含量的测定[16]让我们确信,毕赤酵母无法依靠积累胞内甘油来抵抗高渗环境。
本研究中总结归纳了前期实验的结论,利用2种策略来增强毕赤酵母的高渗抗性——开源和节流。一方面,通过尝试引入酿酒酵母的甘油合成基因ScGPD1、ScGPP2来增强毕赤酵母合成胞内甘油的能力,此为开源策略。另一方面,将不利于胞内甘油积累的FPS1、GUT1进行敲除来减少胞内甘油的外排和代谢,此为节流策略。进而综合2种改造策略,来共同提升毕赤酵母的高渗抗性。通过对比3种类型的构建菌株,我们发现了毕赤酵母无法通过积累胞内甘油来抵抗高渗的主要原因。鉴于Hog1是导致上述基因(除GPD1外)表达异于酿酒酵母的源头,对HOG1进行敲除后,发现了Hog1所具有的2种不同的作用。
1 材料与方法
1.1 菌株和质粒
本研究所用菌株见表1。
表1 本研究所用菌株
Table 1 Strains used in this study

菌株来源E.coli DH5α实验室保藏K.phaffii GS115购自InvitrogenK.phaffii PHSP12-ScGPD1实验室保藏K.phaffii PHSP12-ScGPP2实验室保藏K.phaffii PHSP12-ScGPD1/ScGPP2实验室保藏K.phaffii fps1Δ本研究构建K.phaffii gut1Δ本研究构建K.phaffii fps1Δ gut1Δ本研究构建K.phaffii fps1Δ PHSP12-ScGPD1本研究构建K.phaffii fps1Δ PHSP12-ScGPP2本研究构建K.phaffii fps1Δ PHSP12-ScGPD1/ScGPP2本研究构建K.phaffii gut1Δ PHSP12-ScGPD1本研究构建K.phaffii gut1Δ PHSP12-ScGPP2本研究构建K.phaffii gut1Δ PHSP12-ScGPD1/ScGPP2本研究构建K.phaffii fps1Δ gut1Δ PHSP12-ScGPD1本研究构建K.phaffii fps1Δ gut1Δ PHSP12-ScGPP2本研究构建K.phaffii fps1Δ gut1Δ PHSP12-ScGPD1/ScGPP2本研究构建hog1Δ A本研究构建hog1Δ B本研究构建hog1olΔ本研究构建
本研究所用质粒见表2。
表2 本研究所用质粒
Table 2 Plasmids used in this study

质粒来源pGAPZB购自InvitrogenpGAPKB实验室保藏pGPHD实验室保藏pGPHP实验室保藏pFPS1sg本研究构建pGUT1sg本研究构建pHOG1sg本研究构建
1.2 引物
本研究所用引物见表3。
表3 本研究所用引物
Table 3 Primers used in this study

引物名称引物序列(5'→3')FPS1sg-FCAAATGGATTCTGATGAGTCCGTGAG-GACGAAACGAGTAAGCTCGTCTCAGATA-ATCCAAGAGACTGAAGACTFPS1sg-RAAACAGTCTTCAGTCTCTTGGATTATCT-GAGACGAGCTTACTCGTTTCGTCCTCACG-GACTCATCAGAATCCAGUT1sg-FCAAATTTGACCTGATGAGTCCGTGAG-GACGAAACGAGTAAGCTCGTCTCAGATGT-CAAAAAGAATAGCTCTGGGUT1sg-RAAACCCAGAGCTATTCTTTTTGACATCT-GAGACGAGCTTACTCGTTTCGTCCTCACG-GACTCATCAGGTCAAALin-FTCCTGATCAGCCTATCTCGCLin-RGCAAGCTCGTACGAGAAGAAACHOG1sgA-FCAAAAGATCGCTGATGAGTCCGTGAG-GACGAAACGAGTAAGCTCGTCT-CAGATCGATCTTTGAGACCACCGCTHOG1sgA-RAAACAGCGGTGGTCTCAAAGATCGATCT-GAGACGAGCTTACTCGTTTCGTCCTCACG-GACTCATCAGCGATCTHOG1sgB-FCAAAGAGTTGCTGATGAGTCCGTGAG-GACGAAACGAGTAAGCTCGTCTCAGAT-CAACTCATCGTACCTAGCGGHOG1sgB-RAAACCCGCTAGGTACGATGAGTTGATCT-GAGACGAGCTTACTCGTTTCGTCCTCACG-GACTCATCAGCAACTCseqsg-FAGTATAGCGACCAGCATTHOG1upol-FAACTTCTATCATATTGATTTCTAACCTAT-ACGGGTTTAATGCHOG1upol-RTTTTTATGAAAGTTTGAAGATTT-GAAGACTGCCGGTTTATCCTCHOG1downol-FTCTTCAAACTTTCATAAAAAGTA-ATACTCTCGTTTAATAAAGCCHOG1downol-RCACTAAGGATGCGAAACTTGATGAAACCseqFPS1-FTTTCCGTGTTTGATTCCGTCCATGseqFPS1-RACCAGCGCACACAACCseqGUT1-FGCTGTTAGCTCACGCACTCseqGUT1-RCCCTCTGTCAATAGTGATGGAGTCseqHOG1-FTGATAGCAGTTATGAGCGCTGACseqHOG1-RTCTGGGGCACGGTAATATCTTGseqhog1olΔ-FCCCAATGAATTCATCATATTTCTTGAAGCATGCseqhog1olΔ-RGAGAATGTGCAGAGAGTTTTAGTGATCAATAGGHOG1OE-FGCTTCGAAATGTCCCAAGAGAAGTTCACAAGGHAHOG1OE-RCGGGGTACCTCAAGCGTAGTCTG-GAACGTCGTATGGGTATTGATCCTCAACT-TGATGGAAGTCTAAAATCTC
1.3 培养基
LB培养基(g/L):蛋白胨10,酵母提取物5,NaCl 5。LLB培养基(g/L)(适用于添加博来霉素):蛋白胨10,酵母提取物5,NaCl 2.5。YPD培养基(g/L):蛋白胨20, 酵母提取物10,葡萄糖20。固体培养基在相应液体培养基中加入质量分数为2%的琼脂粉。
1.4 菌株的构建
fps1Δ菌株的构建:通过本实验室改良的CRISPER/Cas9基因编辑系统(未发表研究)进行各基因的无痕敲除。gut1Δ菌株和hog1Δ A、hog1Δ B菌株的构建:参考fps1Δ菌株的构建。fps1Δ gut1Δ菌株的构建:在fps1Δ菌株的基础上进行GUT1的敲除。hog1olΔ菌株的构建:电转HOG1敲除用的sg质粒的同时电转有且仅有基因组上HOG1编码区上下游1 000 bp同源臂(overlap)的片段,实现整段编码序列的敲除。
fps1Δ PHSP12-ScGPD1菌株的构建:将前期研究构建并保藏的pGPHD(pGAPZB-PHSP12-ScGPD1)质粒用Lin-F和Lin-R引物通过环形PCR的方式线性化,电转至fps1Δ菌株中。fps1Δ PHSP12-ScGPP2菌株的构建:将前期研究构建并保藏的pGPHP(pGAPKB-PHSP12-ScGPP2)质粒用Lin-F和Lin-R引物通过环形PCR的方式线性化,电转至fps1Δ菌株中。fps1Δ PHSP12-ScGPD1/ScGPP2菌株的构建:线性化的pGPHD和pGPHP质粒同时电转至fps1Δ菌株中。其余双策略菌株的构建方法参考上述方法,均为在相应缺陷型宿主中电转对应的质粒。
1.5 培养方法
大肠杆菌的培养方法:液体培养条件37 ℃,220 r/min;平板培养条件37 ℃静置。毕赤酵母的培养方法:液体培养条件30 ℃,220 r/min;平板培养条件30 ℃静置。含pGPHD的菌株,采用博来霉素进行筛选,质量浓度为大肠杆菌25 μg/mL,毕赤酵母100 μg/mL。含pGPHP的菌株,大肠杆菌采用卡那霉素进行筛选,质量浓度为25 μg/mL,毕赤酵母采用G418进行筛选,质量浓度为200 μg/mL。同时含有pGPHD和pGPHP的毕赤酵母菌株,采用博来霉素和G418双抗生素筛选,浓度同上。
1.6 平板生长检测
将酵母细胞接种至YPD液体培养基中,过夜活化。然后以初始OD600=0.2接种到YPD液体培养基中,并在细胞生长至OD600=1.0左右时收集2 mL细胞悬液,离心弃上清液后,将细胞用PBS洗涤2次,并将细胞密度精确地校准在OD600=1.0。然后将2 μL的按10倍梯度稀释的细胞悬液接种到不同盐浓度的YPD平板上。培养2~3 d后,观察生长情况。
1.7 生长曲线的测定
将酵母细胞接种至YPD液体培养基中,过夜活化。然后以初始OD600=0.1接种到含0.5 mol/L NaCl的YPD培养基中。分别在3、6、9、12、24、36、48、60 h测定OD600。
2 结果与分析
2.1 菌株的构建
fps1Δ,gut1Δ和fps1Δ gut1Δ菌株使用本实验室改良的CRISPER/Cas9基因编辑系统实现。构建结果采用PCR扩增基因组上相对应的序列,送至苏州金唯智有限公司进行测序来验证,测序结果如图1所示。fps1Δ,gut1Δ和fps1Δ gut1Δ菌株分别发生了移码突变。
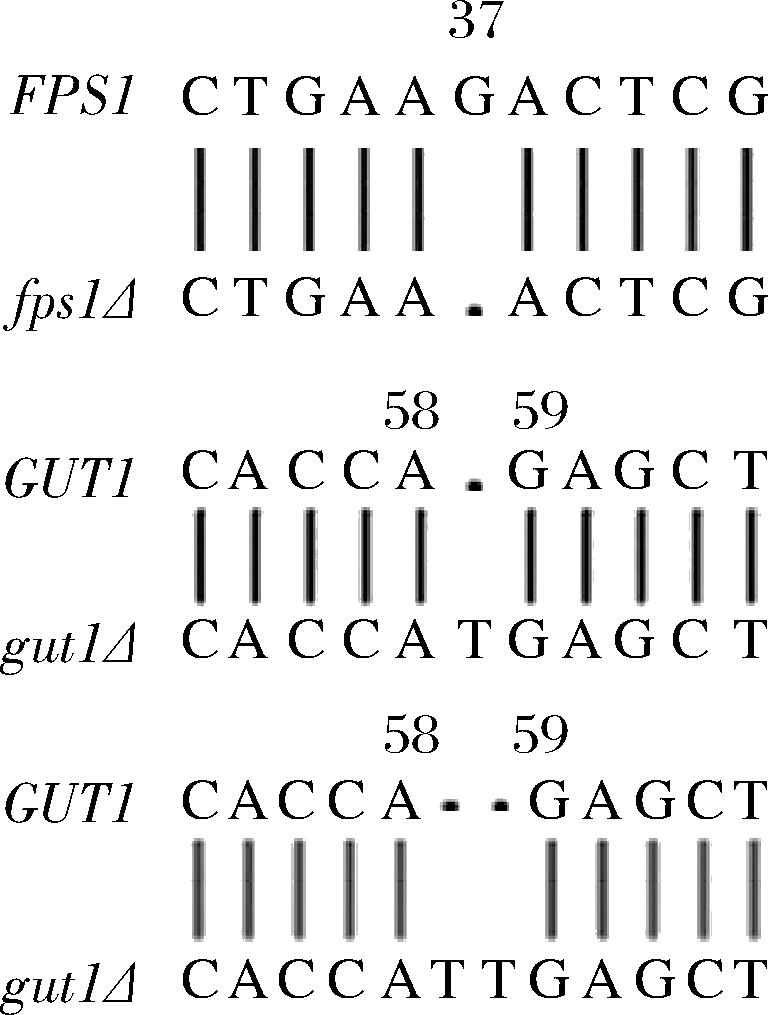
图1 fps1Δ,gut1Δ和fps1Δ gut1Δ菌株的测序结果
Fig.1 The sequencing results of fps1Δ,gut1Δ and fps1Δ gut1Δ strains
注:序号代表碱基所在基因上的位置(下同)
前期研究中,我们发现HSP12在高渗条件下诱导表达程度非常高,因此采用其启动子PHSP12来启动表达ScGPD1和ScGPP2。双策略菌株为在上述各敲除菌株的基础上进行外源蛋白表达,采用WB验证,结果如图2所示。根据前期实验及已发表报道[17],我们推测上述基因的RNA表达水平在10~45 min达到峰值,蛋白表达水平在60~90 min达到峰值,因此我们分别检测了60、90 min时的蛋白表达。

图2 双策略菌株的WB结果
Fig.2 The WB results of dual-strategy strains
注:序号下划线菌株将用于后续实验(下同)
hog1Δ A和hog1Δ B菌株的构建采用PCR扩增基因组上相对应的序列,送至苏州金唯智有限公司进行测序来验证,测序结果如图3-a所示。hog1olΔ菌株的构建采用PCR扩增基因组上相对应的位置,根据条带大小来验证,结果如图3-b所示。
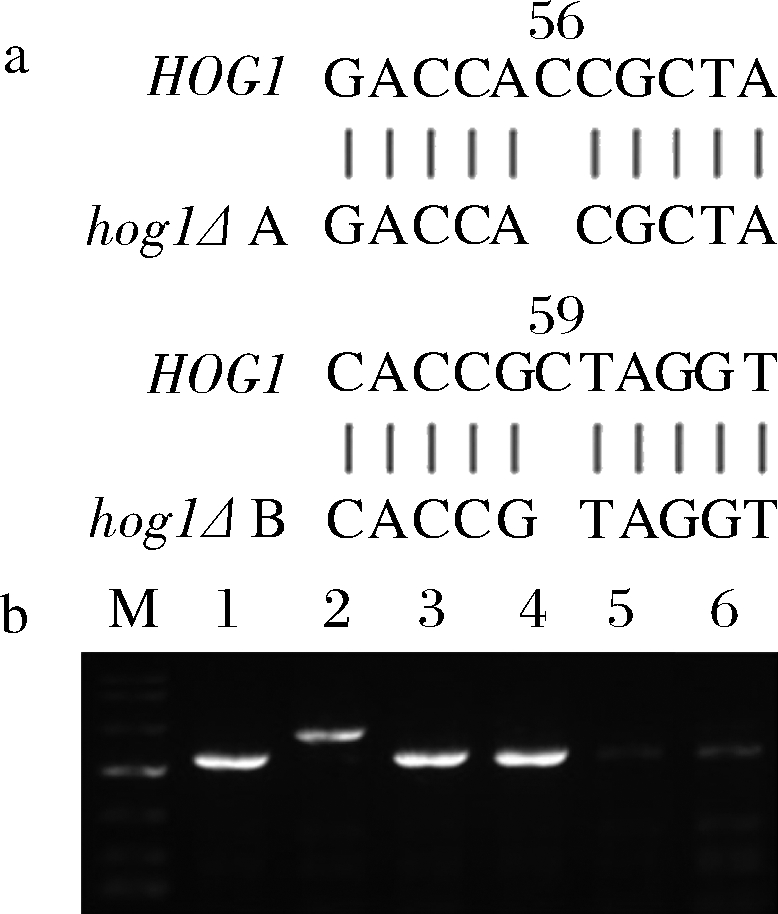
a-hog1Δ A,hog1Δ B菌株的测序结果;b-hog1olΔ菌株的基因组PCR结果
图3 hog1Δ A,hog1Δ B和hog1olΔ菌株的构建结果
Fig.3 The construction result of hog1Δ A,hog1Δ B and hog1olΔ strains
2.2 PHSP12-ScGPD1, PHSP12-ScGPP2和PHSP12-ScGPD1/ScGPP2菌株的生长表型检测
酿酒酵母在高渗环境中存活所依赖的重要方式之一为积累胞内甘油,此过程中起关键作用的基因为ScGPD1和ScGPP2[17]。为了通过增强毕赤酵母的甘油合成能力,来积累胞内甘油,进而平衡外界高渗环境,我们将酿酒酵母中甘油合成途径的关键酶ScGPD1,ScGPP2引入毕赤酵母。为了验证引入酿酒酵母的甘油合成途径是否提高了毕赤酵母的高渗抗性,将PHSP12-ScGPD1, PHSP12-ScGPP2和PHSP12-ScGPD1/ScGPP2菌株以及毕赤酵母GS115(WT)进行平板生长表型的检测。通过比较不同菌株在不同NaCl浓度的平板上的生长状态来鉴定外源表达的蛋白是否提高了毕赤酵母的高渗抗性。如图4所示,在NaCl浓度为0.4 mol/L时,3株构建菌株都表现出了比GS115更强的高渗抗性。而且,起主要作用的基因似乎是ScGPD1。

图4 PHSP12-ScGPD1, PHSP12-ScGPP2和PHSP12-ScGPD1/ScGPP2菌株的平板生长状况(3 d)
Fig.4 Growth status of PHSP12-ScGPD1, PHSP12-ScGPP2 and PHSP12-ScGPD1/ScGPP2 strains on plate (3 d)
鉴于PHSP12-ScGPD1, PHSP12-ScGPP2和PHSP12-ScGPD1/ScGPP2菌株和GS115菌株在中等NaCl浓度下体现出了较大的差别,我们测定了它们在0.5 mol/L NaCl浓度下的生长曲线,以进一步验证构建菌株的高渗抗性。如图5所示,在高渗条件下,PHSP12-ScGPD1/ScGPP2菌株在12~24 h体现出了最快的生长速率,然而在正常渗透压下,其生长却是最慢的。作为对比,GS115则在2种渗透压情况下分别表现出了相反的表型。在后期PHSP12-ScGPD1/ScGPP2菌株的生长优势变得不明显,可能是因为高渗环境由于菌体缓慢的渗透压平衡机制、吸收利用等因素而不再对菌株的生长造成不良影响。上述结果表明引入的ScGPD1/ScGPP2基因确实起到了增强宿主菌株高渗抗性的作用。
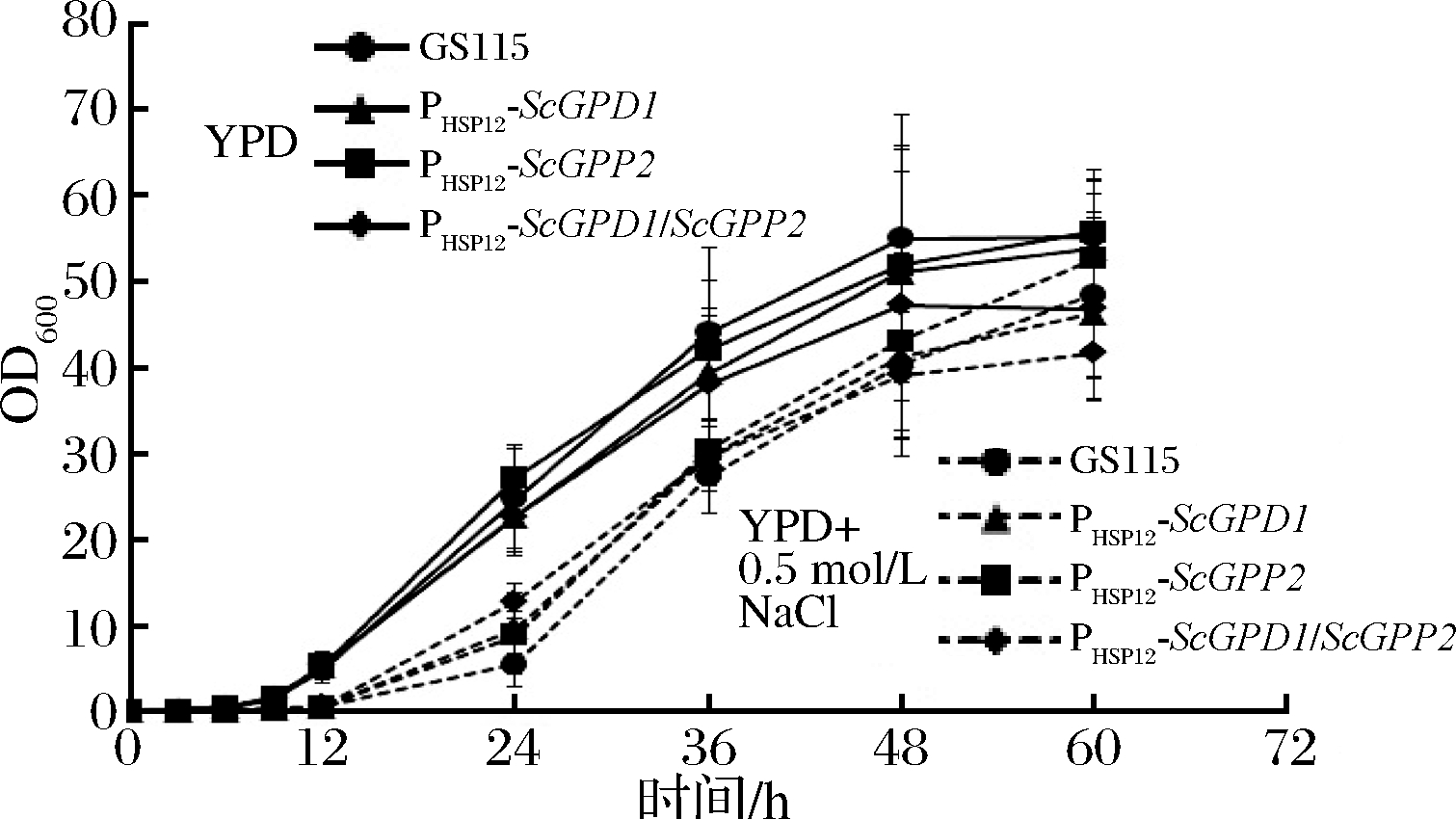
图5 PHSP12-ScGPD1, PHSP12-ScGPP2和PHSP12-ScGPD1/ScGPP2菌株的液体培养基生长状况
Fig.5 Growth status of PHSP12-ScGPD1, PHSP12-ScGPP2 and PHSP12-ScGPD1/ScGPP2 strains in liquid medium
2.3 fps1Δ,gut1Δ和fps1Δ gut1Δ菌株的生长表型检测
酿酒酵母在高渗环境中同时会抑制FPS1和GUT1来降低甘油外排[18]和代谢[17]。为了通过降低毕赤酵母的甘油外排和代谢,来积累胞内甘油,进而平衡外界高渗环境,我们敲除了毕赤酵母的FPS1,GUT1。为了验证敲除上述基因是否提高了毕赤酵母的高渗抗性,将构建成功的fps1Δ,gut1Δ和fps1Δ gut1Δ菌株以及毕赤酵母GS115(WT)进行平板生长表型的检测。通过比较不同菌株在不同NaCl浓度的平板上的生长状态来鉴定敲除相应基因是否提高了毕赤酵母的高渗抗性。如图6所示,3株敲除菌株的高渗抗性均较大幅度地增强,足以耐受0.8 mol/L NaCl的高渗环境。fps1Δ菌株与gut1Δ菌株之间无明显差异,且2个基因同时敲除无叠加效果。

图6 fps1Δ,gut1Δ和fps1Δ gut1Δ菌株的平板生长状况(2 d)
Fig.6 Growth status of fps1Δ,gut1Δ and fps1Δ gut1Δ strains on plate (2 d)
2.4 双策略菌株的生长表型检测
为了通过综合上述2种策略,来积累胞内甘油,进而平衡外界高渗环境,我们构建了双策略菌株。为了验证双策略菌株的高渗抗性,将构建成功的fps1Δ PHSP12-ScGPD1,fps1Δ PHSP12-ScGPP2,fps1Δ PHSP12-ScG-PD1/ScGPP2,gut1Δ PHSP12-ScGPD1,gut1Δ PHSP12-ScGPP2,gut1Δ PHSP12-ScGPD1/ScGPP2和fps1Δ gut1Δ PHSP12-ScGPD1,fps1Δ gut1Δ PHSP12-ScGPP2,fps1Δ gut1Δ PHSP12-ScGPD1/ScGPP2菌株以及毕赤酵母GS115(WT)进行平板生长表型的检测。通过比较不同菌株在不同NaCl浓度的平板上的生长状态来鉴定是否提高了毕赤酵母的高渗抗性。如图7所示,所有双策略菌株的高渗抗性相较于GS115均显著增强,但双策略菌株之间的差异并不明显。同时双策略菌株足以耐受0.8 mol/L NaCl的高渗。比较在0.8 mol/L的NaCl浓度下开源策略和节流策略带来的高渗抗性提升程度,可以发现节流策略效果明显,而将双策略菌株加入比较,可以发现增强的高渗抗性主要起因为节流策略,而开源策略在此基础上仅使得高渗抗性略有提高(0.8 mol/L NaCl第4列)。因此可以推断,毕赤酵母无法通过积累胞内甘油来抵抗高渗,主要是因为甘油的外排和代谢导致甘油难以积累,而不是合成能力不足。

图7 双策略菌株的平板生长状况(2 d)
Fig.7 Growth status of dual-strategy strains on plate (2 d)
2.5 hog1Δ菌株的生长表型检测
我们的前期研究表明,毕赤酵母Hog1仍然参与渗透压调控,只是调控机制不同[19]。鉴于上述与酿酒酵母相反的基因表达(除GPD1外)都是由Hog1引起的,我们尝试敲除了HOG1。为了验证敲除HOG1对毕赤酵母高渗抗性的影响,将构建成功的hog1Δ A菌株以及毕赤酵母GS115(WT)进行平板生长表型的检测。如图8所示,hog1Δ A菌株的高渗抗性在0.4、0.8 mol/L的NaCl浓度下强于GS115。这一现象与酿酒酵母截然相反,在酿酒酵母中,Schog1Δ菌株对高渗的耐受能力大幅降低,生长状况不如野生型。为了进一步验证该现象,我们构建了在不同位置移码突变的hog1Δ B菌株,和整段编码序列敲除的hog1olΔ菌株。将构建成功的上述菌株以及毕赤酵母GS115(WT)进行平板生长表型的检测。

图8 hog1Δ A,hog1Δ B,hog1olΔ和HOG1OE菌株的平板生长状况(3 d)
Fig.8 Growth status of hog1Δ A,hog1Δ B,hog1olΔ and HOG1OE strains on plate (3 d)
如图8所示,hog1Δ B菌株以及hog1olΔ菌株都表现出了强于GS115的高渗抗性,证明该现象是可重复的。上述结果间接证实了Hog1确实是导致上述基因异常表达的起因,进一步说明Hog1的存在对毕赤酵母的高渗抗性起到了负面作用。另外,3种hog1缺陷型菌株的高渗抗性并没有比双策略菌株更高,甚至稍弱于双策略菌株(0.8 mol/L NaCl),进一步证明了我们前期研究的结论,即Hog1还存在着某些对高渗抗性起正面作用的调控机制,例如损伤修复[16]等。但总体而言,毕赤酵母Hog1的存在不利于毕赤酵母高渗抗性。我们进一步构建了HOG1过表达(over experessed,OE)菌株,来检查过表达HOG1是否能降低毕赤酵母的高渗抗性。结果表明,HOG1OE菌株与GS115的高渗抗性无显著区别。其原因可能为Hog1发挥功能取决于磷酸化的状态[20],而不是蛋白质的数量。
3 结论与讨论
HOG信号通路对于酿酒酵母在高渗环境中的存活至关重要。然而在毕赤酵母中,Hog1阻遏甘油合成基因GPD1的表达,诱导甘油外排通道蛋白基因FPS1、甘油代谢基因GUT1的表达,反而不利于胞内甘油的积累,进而不利于毕赤酵母在高渗环境中的存活。
本研究通过引入外源甘油合成基因ScGPD1,ScGPP2,敲除不利于甘油积累的基因FPS1,GUT1的策略,将Hog1引起的各基因的表达变化加以逆转,来促进毕赤酵母胞内甘油的积累,最终提高了毕赤酵母的高渗抗性。对HOG1的敲除表明,Hog1虽然对高渗抗性同时有着负面和正面2种作用,但总体而言不利于毕赤酵母的高渗抗性。hog1Δ菌株反而具有更强的高渗抗性这一现象,揭示了毕赤酵母与酿酒酵母截然不同的HOG信号通路调控机制。具体通过何种机制来调控下游基因的表达,本研究尚未深入探讨,需要在未来进行更细致的研究。
本研究构建的耐高渗毕赤酵母菌株可应用于特定产物的发酵工业生产。在甘油培养阶段可以加入较高浓度的甘油,简化了操作流程。
[1] AHMAD M, HIRZ M, PICHLER H, et al.Protein expression in Pichia pastoris:Recent achievements and perspectives for heterologous protein production[J].Applied Microbiology and Biotechnology, 2014, 98(12):5 301-5 317.
[2] 王莲哲, 刘士俊, 刘佳乐, 等.树蛙抗菌肽Cathelicidin在毕赤酵母中的表达及抑菌活性分析[J].农业生物技术学报, 2021, 29(1):67-72.
WANG L Z, LIU S J, LIU J L, et al.Expression of tree frog (Rhacophorus) cathelicidin peptide in Pichia pastoris and its antibacterial activity analysis[J].Journal of Agricultural Biotechnology, 2021, 29(1):67-72.
[3] 杜加亮, 古琼, 刘悦越, 等.诺如病毒VP1蛋白病毒样颗粒在毕赤酵母中的分泌表达[J].中国生物制品学杂志, 2020, 33(10):1 097-1 103.
DU J L, GU Q, LIU Y Y, et al.Secretory expression of virus-like particles of Norovirus VP1 in Pichia pastoris[J].Chinese Journal of Biologicals, 2020, 33(10):1 097-1 103.
[4] 刘毓均, 卢春, 袁萍, 等.牛胃溶菌酶基因在毕赤酵母中的表达、发酵参数优化及抑菌活性研究[J].黑龙江畜牧兽医, 2020, 589(1):125-130;162.
LIU Y J, LU C, YUAN P, et al.Study on expression of Bovine stomach Lysozyme gene in Pichia Pastoris, optimization of fermentation parameters and antibacterial activity[J].Heilongjiang Animal Science and Veterinary Medicine, 2020, 589(1):125-130;162.
[5] 王颢霖. 普鲁兰酶基因在毕赤酵母中的表达研究[J].河南农业, 2020(21):52-54.
WANG H L.Study on the expression of Pullulanase gene in Pichia pastoris[J].Henan Agriculture, 2020(21):52-54.
[6] DUNAYEVICH P, BALTAN S R, CLEMENTE J A, et al.Heat-stress triggers MAPK crosstalk to turn on the hyperosmotic response pathway[J].Scientific Reports, 2018,8:15 168.
S R, CLEMENTE J A, et al.Heat-stress triggers MAPK crosstalk to turn on the hyperosmotic response pathway[J].Scientific Reports, 2018,8:15 168.
[7] SAITO H, TATEBAYASHI K.Regulation of the osmoregulatory HOG MAPK cascade in yeast[J].Journal of Biochemistry, 2004,136(3):267-272.
[8] TATEBAYASHI K, YAMAMOTO K, NAGOYA M, et al.Osmosensing and scaffolding functions of the oligomeric four-transmembrane domain osmosensor Sho1[J].Nature Communications, 2015, 6:6 975.
[9] TATEBAYASHI K, YAMAMOTO K, TOMIDA T, et al.Osmostress enhances activating phosphorylation of Hog1 MAP kinase by mono-Phosphorylated Pbs2 MAP2K[J].The EMBO Journal, 2020, 39(5):e103444.
[10] CAPALDI A P, KAPLAN T, LIU Y, et al.Structure and function of a transcriptional network activated by the MAPK Hog1[J].Nature Genetics, 2008, 40(11):1 300-1 306.
[11] HOHMANN S, KRANTZ M, NORDLANDER B.Yeast Osmoregulation, Osmosensing and Osmosignaling[M].Manhattan:Academic Press,2007:29-45.
[12] XIANG L, YANKUN Y, CHUNJUN Z, et al.Transcriptional analysis of impacts of glycerol transporter 1 on methanol and glycerol metabolism in Pichia pastoris[J].FEMS Yeast Research, 2017.DOI:10.1093/femsyr/fox081.
[13] BAI C, TESKER M, ENGELBERG D.The yeast Hot1 transcription factor is critical for activating a single target gene, STL1[J].Molecular Biology of the Cell, 2015, 26(12):2 357-2 374.
[14] ANSELL R, GRANATH K, HOHMANN S, et al.The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded by GPD1 and GPD2 have distinct roles in osmoadaptation and redox regulation[J].The EMBO Journal, 1997, 16(9):2 179-2 187.
[15] REP M, ALBERTYN J, THEVELEIN J M, et al.Different signalling pathways contribute to the control of GPD1 gene expression by osmotic stress in Saccharomyces cerevisiae[J].Microbiology, 1999, 145(Pt3):715-727.
[16] WANG R B, ZHAO T Y, ZHUO J L, et al.MAPK/HOG signaling pathway induced stress-responsive damage repair is a mechanism for Pichia pastoris to survive from hyperosmotic stress[J].Journal of Chemical Technology & Biotechnology, 2021, 96(2):412-422.
[17] TAM S M J,HOHMANN S.The Osmotic Stress Response of Saccharomyces cerevisiae[M].Berlin:Springer Berlin Heidelberg, 2003:121-200.
S M J,HOHMANN S.The Osmotic Stress Response of Saccharomyces cerevisiae[M].Berlin:Springer Berlin Heidelberg, 2003:121-200.
[18] LEE J, REITER W, DOHNAL I, et al.MAPK Hog1 closes the S.cerevisiae glycerol channel Fps1 by phosphorylating and displacing its positive regulators[J].Genes & Development, 2013, 27(23):2 590-2 601.
[19] 王荣斌, 赵天宇, 卓俊林, 等.巴斯德毕赤酵母MAPK/HOG信号通路的分子互作研究[J].生物学杂志, 2020, 37(3):7-11.
WANG R B, ZHAO T Y, ZHUO J L, et al.The interactions of MAPK/HOG signal pathway factors in Pichia pastoris[J].Journal of Biology, 2020, 37(3):7-11.
[20] TANAKA K, TATEBAYASHI K, NISHIMURA A, et al.Yeast osmosensors Hkr1 and Msb2 activate the Hog1 MAPK cascade by different mechanisms[J].Science Signaling, 2014, 7(314):21.