蓝果忍冬(Lonicera caerulea L.)又名蓝靛果,是国际上新兴的“第三代果树”中十分重要的树种,具有很高的营养价值[1]。在我国主要分布于东北、西北和华北地区,野生蓝果忍冬种质资源在大兴安岭漠河地区十分丰富,目前已经得到一定程度的开发利用,具备较好的开发前景。
多酚广泛存在于自然植物界,如蔬菜、水果、种子中,天然多酚常以与一个或多个与羟基相关的糖残基的共轭形式存在,可分为黄酮类化合物、酚酸类化合物、对苯二酚、木质素等。其中黄酮类化合物分布最广,而花色苷是黄酮类化合物中最普遍的一种。蓝果忍冬内富含多酚类物质,花色苷是其重要组成部分。据报道,富含花色苷的野生蓝莓及蓝莓均能有效清除自由基,具有较强的抗氧化能力[2],而且蓝果忍冬的多酚含量与抗氧化能力呈正相关关系[3]。蓝果忍冬因富含多酚类物质,可以很好地抑制α-淀粉酶、α-葡萄糖苷酶,对于Ⅱ型糖尿病有明显的抑制作用,因此是天然降血糖药的主要来源[4]。蓝果忍冬含量最高的花色苷——矢车菊-3-葡萄糖苷(cyanidin-3-O-glucoside,C3G)在抗乳腺癌、抗肝癌、抗肺癌等抗癌方面[5-6],抗肺炎、抗肝炎、抗肠胃炎、抗牙龈炎、抗眼部炎症等[7-8]抗炎方面都有显著的生理功效。
目前,常用检测植物多酚的方法主要有HPLC、GC-MS、分光光度法、电喷雾萃取电离以及核磁共振技术等。其中HPLC法在果蔬多酚分离和鉴定中首选且应用广泛,液相-质谱联用/质谱是测定不同多酚含量的最佳方法以及分析其结构的最有效方法[9]。本研究通过固相萃取技术(solid phase extraction,SPE)分离纯化多酚组分,利用高效液相色谱-电喷雾质谱法研究漠河蓝果忍冬花色苷以及非花色苷多酚的种类、分子结构和相对含量,同时分析了抗氧化活性、抗淀粉酶活性、抗脂肪酶活性,对漠河蓝果忍冬资源深入开发提供理论支撑。
1 材料与方法
1.1 材料与试剂
蓝果忍冬果实采集自漠河市。采集的材料冻干后研磨成粉末,过80目筛放于-20 ℃冰箱内保存后,用作后续分析。
玉米淀粉、福林酚试剂、没食子酸标品(gallic acid,GA,纯度≥98%),上海源叶生物科技有限公司;α-淀粉酶、α-葡萄糖苷酶、阿卡波糖、色谱级乙腈、甲酸、醋酸铵,美国Sigma公司;6-羟基-2,5,7,8-四甲基氯代甲烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、荧光素钠、2,2′-偶氮二(2-甲基丙脒) 二盐酸盐、2,4,6-三三嗪基-S-三嗪、FeCl3·6H2O、FeSO4·7H2O,北京博奥拓达科技有限公司;对硝基苯基磷酸酯(p-nitrophenyl phosphate,pNPP),美国Sigma公司。
1.2 仪器与设备
LL3000冻干机,美国赛默飞世尔公司;Epoch 2酶标仪,美国BioTek公司;SPE固相萃取仪,上海安普公司;HPLC-20 AD高效液相色谱仪,日本岛津公司;液相色谱质谱联用仪(HPLC-TOF/MS2),美国AB SCIEX公司;Luna C18分析色谱柱(150 mm×46 mm×5 μm),美国Phenomenex公司;Sep-Pak C18固相萃取柱,爱尔兰Waters公司。
1.3 试验方法
1.3.1 蓝果忍冬果实多酚提取及含量测定
称取10 g冻干果粉,加入一定浓度的甲醇进行提取,超声提取后放入冷冻离心机(8 000 r/min,4 ℃,10 min)中离心得上清液。上述条件再次萃取,合并2次上清液旋蒸(40 ℃)浓缩,得到多酚粗提液。参考Folin-Ciocalteu法[10]稍作修改,测定样品765 nm吸光值,用0~100 μg/mL的没食子酸(gallic acid,GAE)溶液绘制标准曲线,标准曲线为y=5.381 5x+0.000 3(R2=0.999 1)。蓝果忍冬的总酚含量表示为mg GAE/100g DW。
1.3.2 总花青素测定
参考pH示差法[11]并稍作修改,2种缓冲液(氯化钾和乙酸钠缓冲液)与花青素浓缩液混合于96孔板,在520和700 nm处分别读取吸光度,总花青素通过公式(1)、公式(2)进行计算,蓝果忍冬的总花青素表示为mg C3G/g DW。
A=(A510 nm-A700 nm) pH1.0-(A510 nm-A700 nm) pH4.5
(1)
(2)
式中,A,吸光度;MW,C3G的分子质量(449.2);DF,稀释倍数;ε,摩尔吸光系数(26 900)。
1.3.3 多酚的提取、纯化
通过固相萃取将多酚粗提液分离、浓缩,参考KIM等[12]的方法,将3个组分的洗脱液于35 ℃下旋蒸浓缩,过0.22 μm的有机滤膜后保存于-20 ℃冰箱中,用于后续的鉴定于分析,同时测定浓度。
1.3.4 多酚的HPLC-PDA和HPLC-TOF/MS2鉴定
花色苷的鉴定(二元流动相):A相(酸水:5%乙腈,1%甲酸,体积分数),B相(乙腈)。洗脱程序如表1所示,流速0.6 mL/min,柱温25 ℃,花色苷检测波长为520 nm。
表1 花色苷鉴定的洗脱程序
Table 1 Elution procedure for identification of anthocyanins
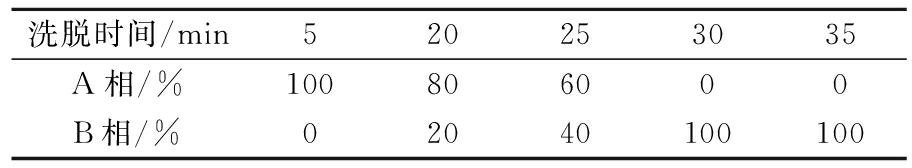
洗脱时间/min520253035A相/%100806000B相/%02040100100
非花色苷多酚的鉴定(三元流动相):A相(5 mmol/L醋酸铵);B相(20% A相溶于乙腈);C相(60 mmol/L甲酸)。洗脱程序如表2,流速为0.6 mL/min,柱温25 ℃,非花色苷多酚检测波长为280 nm。
表2 非花色苷多酚鉴定的洗脱程序
Table 2 Elution procedure for identification of non-anthocyanin polyphenols
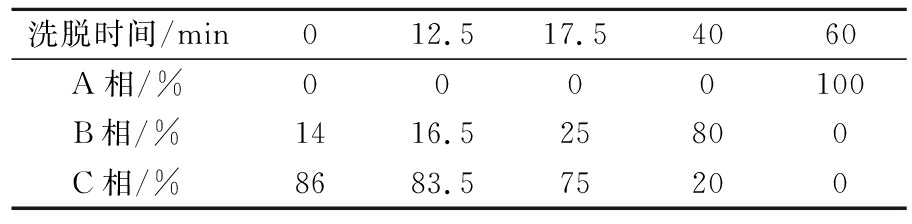
洗脱时间/min012.517.54060A相/%0000100B相/%1416.525800C相/%8683.575200
TOF质谱仪通过ESI进行分析,并通过Analyst® TF 1.7.1 Software进行控制,流动相与上述一致。
1.3.5 多酚提取液的抗氧化能力测定
(1)DPPH法测定
参考BRANDWILLIAMS等[13]的方法测定。以0.1~0.8 mmol/L的Trolox建立标准曲线:y=0.160 8x-10.928(R2=0.996 9),并将y值代入到标准曲线中进行计算,并与质量浓度(mg/mL)进行换算,结果表示为1 g(DW)样品中的μmol Trolox当量(TEAC),单位为μmol TE/g DW。
(2)抗氧化能力(oxygen radical absorbance capacity,ORAC)测定
参考HUANG等[14]的方法并稍加修改,适量稀释的样品与荧光素溶液混合,再加入偶氮二异丁脒盐酸盐溶液,37 ℃的条件下测定2 h内的荧光值。以0.01~0.2 mmol/L的Trolox建立标准曲线:y=0.024 9x-24.717(R2=0.994 6),并将y值代入到标准曲线中进行计算,并与质量浓度(mg/mL)进行换算,结果表示为1 g(DW)样品中的μmol Trolox当量(TEAC),单位为μmol TE/g DW。
(3)铁离子还原能力(ferric ion reducing antioxidant power,FRAP)测定
参考NAYAK等[15]的方法并稍做修改,在593 nm下测量空白读数后再与样品和去离子水混合,在37 ℃,593 nm处记录第30 min的读数,作为检测的吸光度。以0.1~1.0 mmol/L的FeSO4·7H2O建立标准曲线:y=0.003 x+0.018 6(R2=0.992 2),并将质量y值代入到标准曲线中进行计算,并与质量浓度(mg/mL)进行换算,结果表示为1 g(DW)样品中的μmol FeSO4当量(TEAC),单位为μmol TE/g DW。
(4)ABTS法
ABTS的测定参考RE等[16]的方法。以0.05~0.5 mmol/L的Trolox建立标准曲线:y=0.718x+0.667 6(R2=0.999 4),并将y值代入到标准曲线中进行计算,并与质量浓度(mg/mL)进行换算,结果表示为1 g(DW)样品中的μmol Trolox当量(TEAC),单位为μmol TE/g DW。
1.3.6 多酚提取液对脂肪酶的抑制活性
取冻干粉与二氯甲烷(dichloromethane,DCM)进行混合与离心,得到DCM提取液。96孔板内加入样品、脂肪酶和pNPP溶液在410 nm下读取1 h内混合物的吸光度,得到不同样品对脂肪酶抑制的动力学曲线。对猪胰脂肪酶活性的抑制率计算入公式(3)所示:
脂肪酶抑制率![]()
(3)
式中:AUC1,样品对脂肪酶抑制曲线下面积;AUCCK,对照对脂肪酶抑制曲线下面积。
1.3.7 多酚提取液对淀粉酶的抑制活性
参考LIU等[17]的方法测定抗α-淀粉酶和α-葡萄糖苷酶活性。玉米淀粉和磷酸缓冲液混合,在磁力搅拌机中加热搅拌直至半透明状态。然后将样品或磷酸缓冲液(作为对照)、α-淀粉酶(α-葡萄糖苷酶)和糊化的玉米淀粉混合于660 nm处读取2 h内混合物的吸光度,得到漠河蓝果忍冬多酚粗提液对淀粉酶活性的抑制动力学曲线,对淀粉酶抑制率计算如公式(4)所示:
淀粉酶抑制率![]()
(4)
式中:AUC1,样品对淀粉酶抑制曲线下的面积;AUCCK,对照对淀粉酶抑制曲线下的面积。
1.4 数据处理
所有实验平行测定3次,数据表示为平均值±标准偏差,采用SPSS 20.0软件ANOVA分析对数据进行方差分析,Microsoft Excel进行数据整理及计算,Peak View 2.0软件对HPLC-TOF/MS2的数据进行鉴定分析,使用ChemDraw 16.0绘制结构图。
2 结果与分析
2.1 漠河蓝果忍冬的总酚、总花青素含量及比较分析
蓝果忍冬果实中的多酚含量丰富,漠河市蓝果忍冬果实中的总酚含量为(108.52±6.80) mg GAE/100g DW。WANG等[18]的研究发现野生蓝果忍冬提取物的总酚含量是栽培品种总酚含量的1.7倍,YU等[19]也发现蓝果忍冬的总酚含量11.8 mg/mL显著高于红穗醋栗10.33 mg/mL等其他浆果。漠河市蓝果忍冬果实中的总花青素含量为(23.36±0.54)mg C3G/100g DW,分别约为白穗醋栗(0.15 mg C3G/100g DW)和蔓越莓(6.6 mg C3G/100g DW)的155.7和3.5倍[20],这表明漠河蓝果忍冬果实具有较高的利用价值,可作为获取花青素的来源。
2.2 漠河蓝果忍冬抗氧化活性的比较分析
漠河蓝果忍冬果实清除DPPH自由基的能力为(201.19±9.97) μmol TE/g DW。瑞士栽培的7个蓝果忍冬品种对DPPH自由基清除能力在60~228 μmol TE/g DW[21],与本研究结果相近。漠河蓝果忍冬果实的铁离子还原力为(5.16±0.16) μmol TE/g DW。RUPASINGHE等[22]发现一些蓝果忍冬品种对铁还原能力明显强于蓝莓(16.24 μmol TE/g)、草莓(8.0 μmol TE/g)、黑莓(15.03 μmol TE/g)和覆盆子(7.57 μmol TE/g)。漠河蓝果忍冬清除ABTS阳离子自由基自由基的能力为(658.18±9.73) μmol TE/g DW, 瑞士栽培的7个蓝果忍冬品种对ABTS阳离子自由基自由基清除能力在125~485 μmol TE/g DW,其抗氧化能力显著低于漠河蓝果忍冬对ABTS阳离子自由基自由基清除的能力[21]。漠河蓝果忍冬氧化自由基吸收能力法测得的抗氧化能力为(414.79±2.08) μmol TE/g DW,显著高于一般浆果果实,如软枣猕猴桃(28.37 μmol TE/g DW)、蔓越莓(13.50 μmol TE/g DW)等 [20](图1)。综上所述,从漠河市蓝果忍冬中提取的花色苷可有效清除DPPH自由基、ABTS阳离子自由基,对氧自由基表现出很好的吸收能力,并且对铁离子还原能力较强,抗氧化能力强于大多数浆果,是抗氧化剂的较优来源。
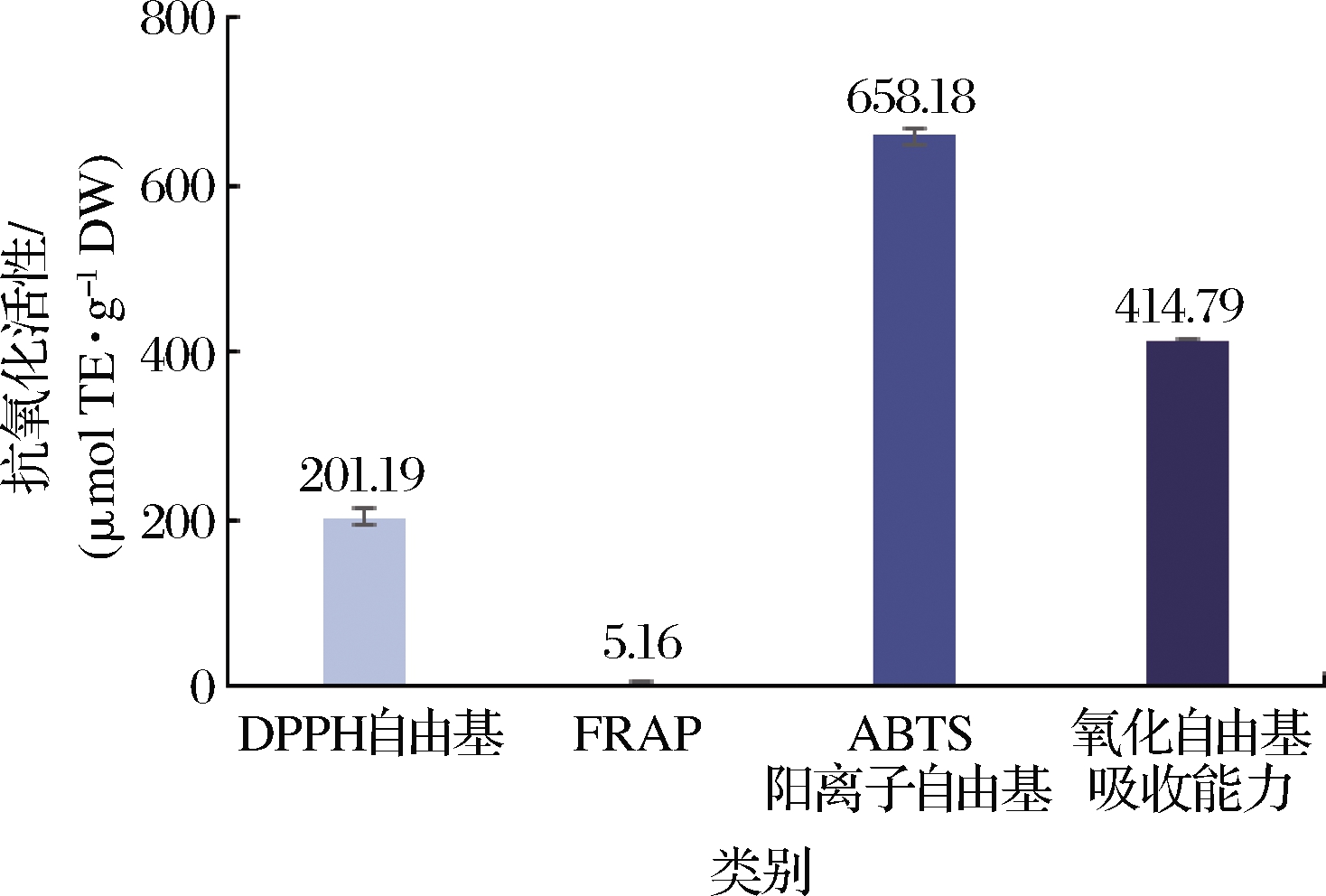
图1 漠河市蓝果忍冬的抗氧化活性
Fig.1 Antioxidant activity of blue honeysuckle fruits in Mohe city
2.3 漠河蓝果忍冬抗脂肪酶活性的比较分析
人们摄取的膳食脂肪主要为甘油三酯,脂肪酶可水解甘油三酯随后被人体吸收,对人类的肥胖症,例如糖尿病等呈现明显的相关性。而通过抑制脂肪酶,可降低人体吸收脂类物质的比例,达到治疗人类肥胖症的目的。漠河蓝果忍冬果实的多酚提取液与脂肪酶聚合从而抑制脂肪酶的活性,抑制率高达53.2%,半抑制浓度(IC50)为1.912 mg/mL,这表明其对脂肪酶具有较强的抑制作用,高于覆盆子等果实提取物的抑制胃肠道脂肪酶活性的潜力[23],通过减少脂肪消化来控制肥胖症的有效治疗靶点。因此它可以作为减肥类保健产品的天然来源,减少化学合成类减肥产品对人体带来的不良副作用和耐药反应,这也为研发安全性相对较高的减肥类产品带来新的出路。
2.4 漠河蓝果忍冬抗淀粉酶活性的比较分析
花色苷主要通过抑制碳水化合物水解酶(α-淀粉酶和α-葡萄糖苷酶)降低糖尿病发生的概率。在本研究中,阿卡波糖作为阳性对照,对α-淀粉酶的IC50为140.2 μg/mL,漠河蓝果忍冬果实对α-淀粉酶的抑制性如图2所示,蓝果忍冬果实对α-淀粉酶表现出抑制活性(IC50为6.399 mg/mL)。KITHMA等[24]测得在不同成熟阶段下,4个品种的蓝果忍冬果实提取物的抑制α-淀粉酶活性(IC50为2.38~5.08 mg/mL),与本研究结果相近。MCDOUGALL等[23]发现多酚和花色苷是抑制α-淀粉酶活性的主要活性物质,这证实了蓝果忍冬内因富含多酚而具有较强的抗α-淀粉酶活性,有效地抑制糖类降解酶的活性,表现出抗糖尿病的特性。
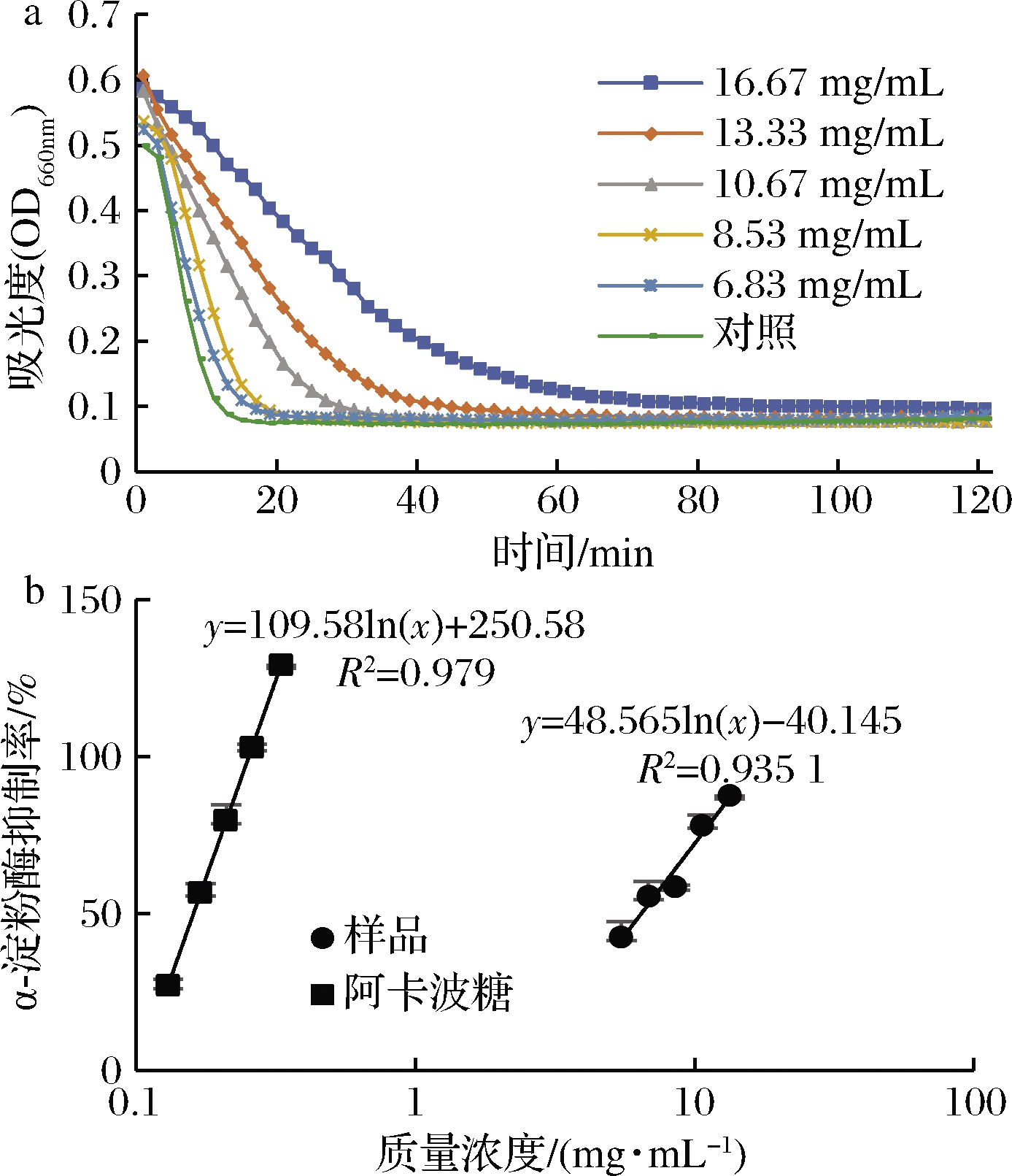
a-吸光度;b-α-淀粉酶的抑制率
图2 漠河市蓝果忍冬对α-淀粉酶的抑制性
Fig.2 Alpha-amylase inhibition activity of blue honeysuckle fruits in Mohe city
α-葡萄糖苷酶作为糖类水解过程中的关键酶,可以通过抑制α-葡萄糖苷酶的活性从而降低血糖,可作为Ⅱ型糖尿病的降糖药[24]。本研究中将阿卡波糖作为阳性对照,对α-葡萄糖苷酶抑制活性的IC50为11.41 μg/mL。漠河蓝果忍冬果实对α-葡萄糖苷酶的半抑制浓度为11.73 mg/mL,见图3,与罗汉果皂甙粗提物对α-葡萄糖苷酶表现出的抑制活性(IC50为9.125 mg/mL)较接近[11]。研究表明蓝果忍冬内含有的原花青素、咖啡酰奎宁酸等多酚类物质可能是抑制α-葡萄糖苷酶活性的重要原因[24]。

a-吸光度;b-α-葡萄糖苷酶抑制率
图3 漠河市蓝果忍冬对α-葡萄糖苷酶的抑制性
Fig.3 Alpha-glucosidase inhibition activity of blue honeysuckle fruits in Mohe city
2.5 漠河蓝果忍冬果实多酚的鉴定
2.5.1 漠河蓝果忍冬果实中花色苷的鉴定
花色苷单糖的糖苷在正离子模式下以阳离子形式存在,主离子峰为[M]+。花色苷二级质谱裂解方式为糖苷键断裂或双糖与糖苷苷源之间的糖苷键的断裂,丢失单(双)糖基团后产生对应的苷元碎片离子。根据表3的MS数据和保留时间,图4的花色苷质谱图以及文献中的出峰时间和顺序进行综合分析[25-27],可得出这些化合物:A1、A2、A3号峰均具有矢车菊素花色苷的离子为287 m/z,其中A2号峰丢失1个葡萄糖基162 m/z,推测为矢车菊素-3-葡萄糖苷;而A1号峰丢失3-位的1个葡萄糖基产生了离子碎片449 m/z,接下来5-位的糖苷键断裂丢失另外1个葡萄糖基,产生离子碎片287 m/z,推测此为矢车菊素-3,5-二葡萄糖苷;A3号主离子峰为595 m/z,3-位失去了1个芸香苷双糖糖基(308 m/z),产生碎片离子287 m/z,所以推测为矢车菊素-3-芸香糖苷;A4号分子离子峰为433 m/z,3-为糖苷键断裂产生天竺葵素离子碎片271 m/z,因此推测A4号峰为天竺葵素-3-葡萄糖苷。
表3 漠河市蓝果忍冬果实中花色苷鉴定结果
Table 3 Identification of anthocyanins from blue honeysuckle fruits in Mohe city
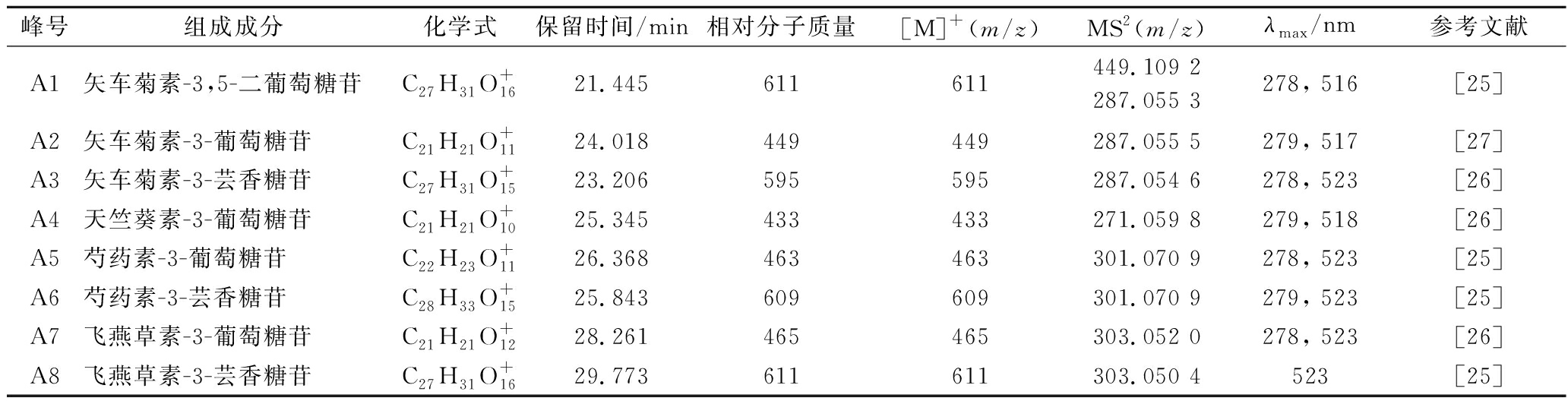
峰号组成成分化学式保留时间/min相对分子质量[M]+ (m/z)MS2(m/z)λmax/nm参考文献A1矢车菊素-3,5-二葡萄糖苷C27H31O+1621.445611611449.109 2287.055 3278, 516[25]A2矢车菊素-3-葡萄糖苷C21H21O+1124.018449449287.055 5279, 517[27]A3矢车菊素-3-芸香糖苷C27H31O+1523.206595595287.054 6278, 523[26]A4天竺葵素-3-葡萄糖苷C21H21O+1025.345433433271.059 8279, 518[26]A5芍药素-3-葡萄糖苷C22H23O+1126.368463463301.070 9278, 523[25]A6芍药素-3-芸香糖苷C28H33O+1525.843609609301.070 9279, 523[25]A7飞燕草素-3-葡萄糖苷C21H21O+1228.261465465303.052 0278, 523[26]A8飞燕草素-3-芸香糖苷C27H31O+1629.773611611303.050 4523[25]
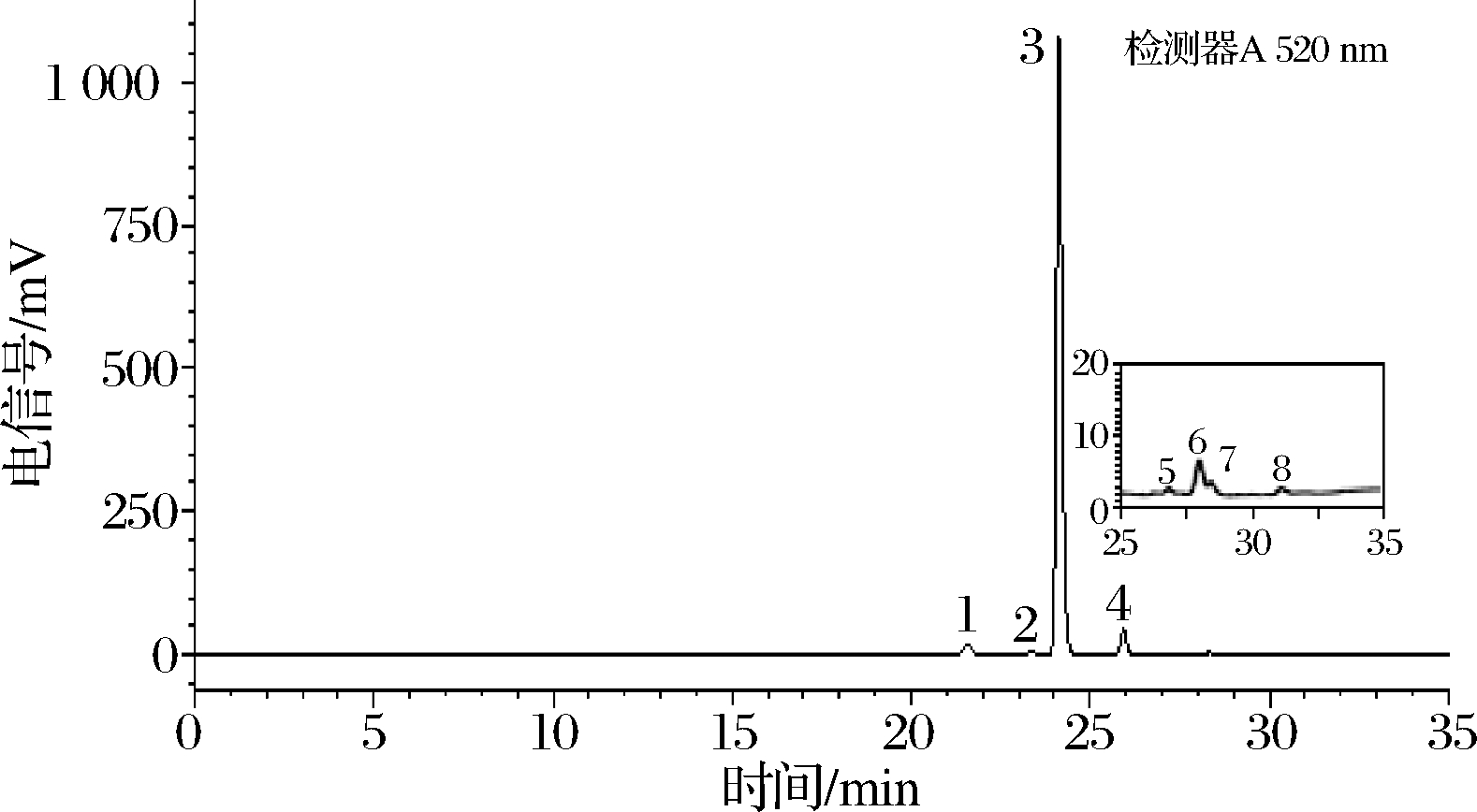
图4 漠河市蓝果忍冬果实中花色苷质谱图
Fig.4 Mass spectrum of anthocyanins from blue honeysuckle fruits in Mohe city
根据上文花色苷单糖和双糖糖苷的二级质谱断裂特点,在A5和A6号峰中均具有芍药素花色苷的离子为301 m/z,因此可推测A5号峰为芍药素-3-葡萄糖苷、A6号峰为芍药素-3-芸香糖苷;A7和A8号峰均具有矢车菊素花色苷的离子为611 m/z,推测A7号峰为飞燕草素-3-葡萄糖苷、A8号峰为飞燕草素-3-芸香糖苷。漠河市蓝果忍冬果实中含4种类型的花色苷苷源:矢车菊素、芍药素、飞燕草素和天竺葵素。其中矢车菊-3-葡萄糖苷为漠河蓝果忍冬中相对最高的花色苷化合物,占总含量的92%。芍药素-3-芸香糖苷占总和的5%,而其他花色苷含量的总和仅占总花色苷含量的3%。漠河蓝果忍冬果实中花色苷种类丰富,共检测到8种花色苷,主要花色苷的结构式见图5。
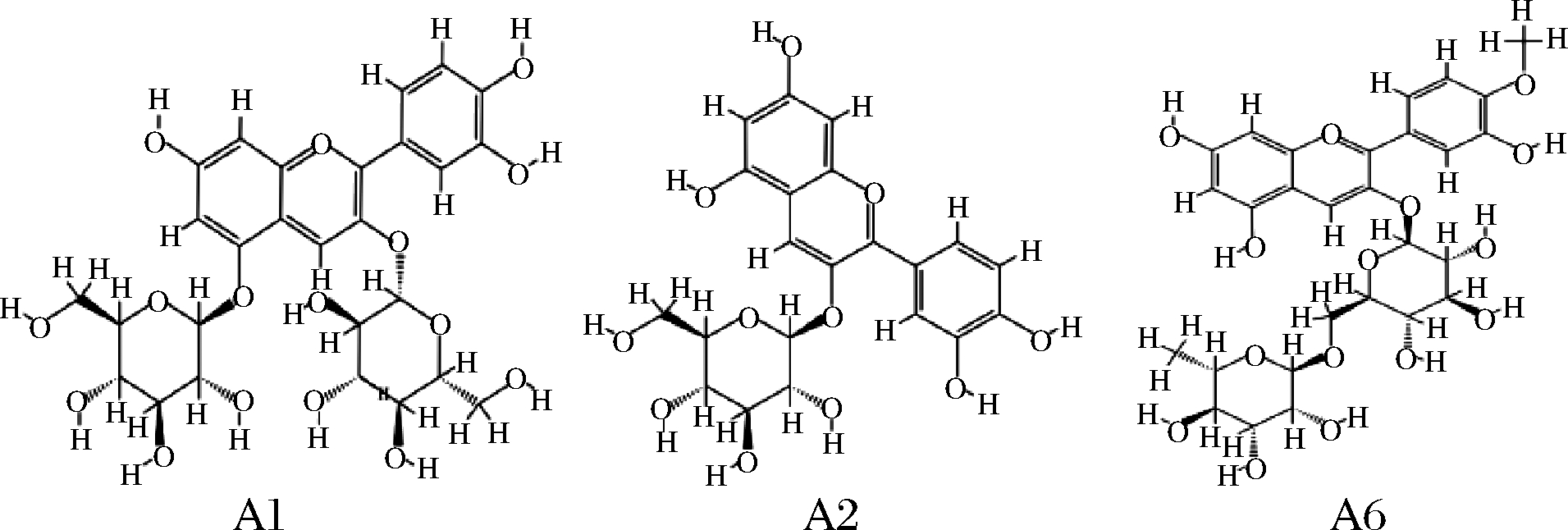
图5 漠河市蓝果忍冬果实中主要花色苷的结构式
Fig.5 Structure of major anthocyanins from blue honeysuckle fruits in Mohe city
2.5.2 漠河蓝果忍冬果实中非花色苷多酚的鉴定
漠河蓝果忍冬中的非花色苷成分种类众多,共24种,如图6所示,主要非花色苷多酚的结构式见图7。根据表4的MS数据和保留时间进行综合分析,P1、P8和P19均具有奎宁酸的特征离子(m/z 191),因此被认定为奎宁酸及其衍生物。其中P8和P19在m/z 353处显示碎片离子,表示消除了咖啡酸部分。P19还存在二级质谱,根据文献可判断为二咖啡酰奎宁酸(裂解途径见图8-a),是一类由奎宁酸与数目不等的咖啡酸通过酯化反应缩合而来。
表4 漠河市蓝果忍冬果实中非花色苷多酚鉴定结果
Table 4 Identification of non-anthocyanin polyphenols from blue honeysuckle fruits in Mohe city

峰号组成成分化学式保留时间/min相对分子质量[M-H]-(m/z)MS2(m/z)λmax/nm参考文献P1奎宁酸C7H12O611.73192191-279[28]P2未知C16H22O1212.86406405191.950 9324P3柠檬酸C6H8O715.11192191-278[28]P4马钱苷酸bC16H24O1016.23376375213.078 2324[28]P52-甲基柠檬酸bC7H10O717.55206205-279[28]P6原金丝桃素bC30H18O818.79506505345.049 8317[28]P7龙胆酸C7H6O419.68154153-274[28]P85-咖啡酰奎宁酸C16H18O920.79354353191.055 9277, 524[25]P9断氧化马钱子苷C17H24O1123.02404403125.024 7324[28]P10原花青素二聚体C30H26O1228.34578577289.070 5273[28]P11槲皮素-3-芸香糖苷C27H30O1629.88610609301.031 6320[16]P12山奈酚-3-芸香糖苷C27H30O1530.66594593285.039 2282, 353[30]P13槲皮素-3-葡萄糖-7-鼠李糖苷C27H30O1631.19611609301.031 6320[16]P14原花青素A2bC30H24O1231.68576575289.069 8273[29]P15山奈酚-3-半乳糖苷C21H20O1132.01448447285.036326[28]P16槲皮素-3-阿拉伯糖bC20H18O1132.18434433271.022 9274[16]P17二氢槲皮素bC15H12O732.66304303-278[28]P18槲皮素-3-葡萄糖苷C21H20O1232.98464463301.032 8320[28]P19二咖啡酰奎宁酸C25H24O1233.67516515353.087 5276[28]P20山奈酚-3-乙酰基葡萄糖苷C23H22O1234.45490489285.041 1325[28] P21槲皮素-3-乙酰基葡萄糖苷bC23H22O1335.38506505301.035 7278[16]P22三水槲皮素bC21H26O1536.89518517271.026 2324[16]P23柚皮素bC15H12O537.79272271-273[28]P24山奈酚bC15H10O638.00286285-278[28]
注:b表示该化合物在蓝果忍冬中首次被发现,-表示未检出
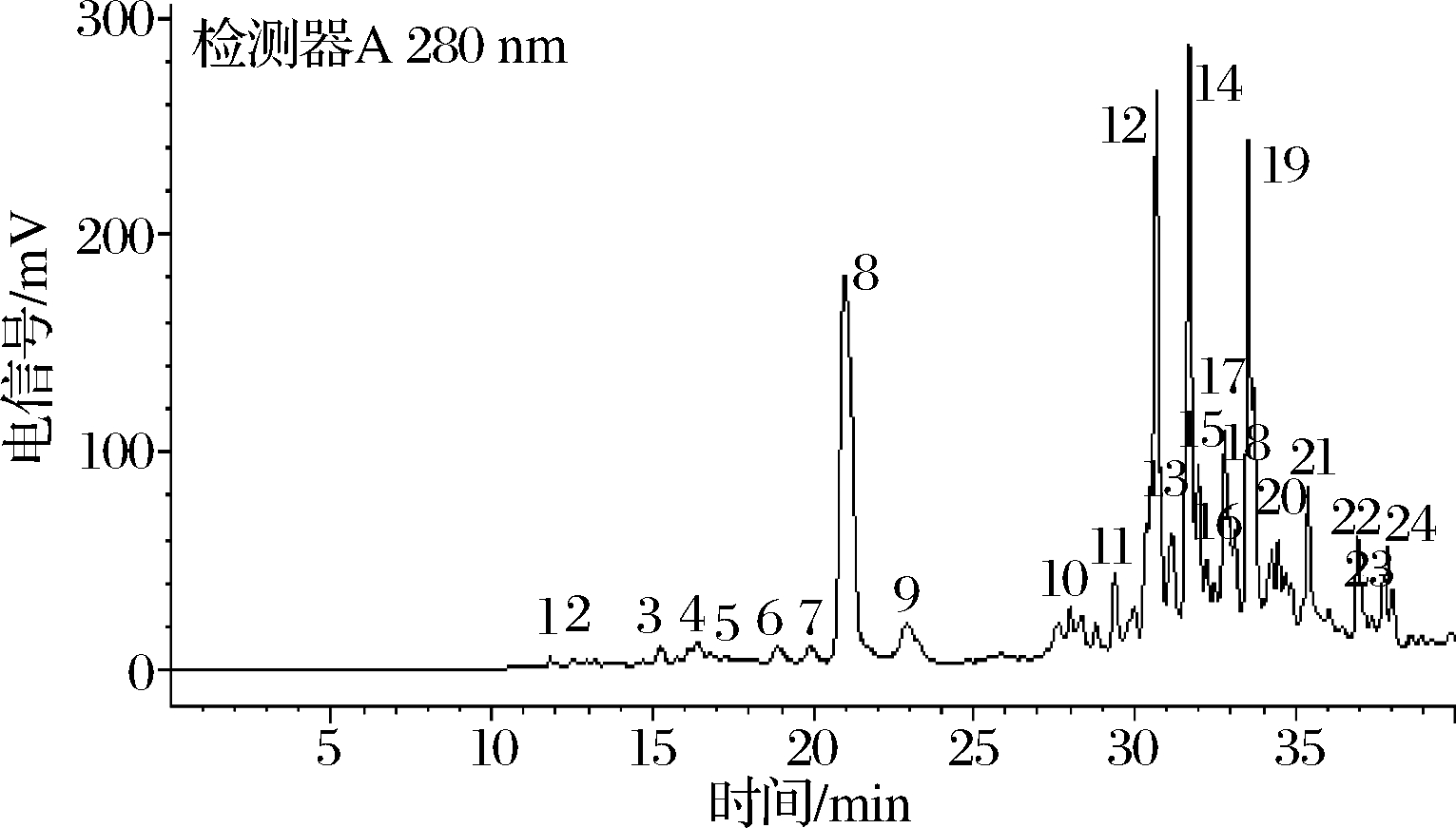
图6 漠河市蓝果忍冬果实中非花色苷多酚质谱图
Fig.6 Mass spectrum of non-anthocyanin polyphenols from blue honeysuckle fruits in Mohe city

图7 漠河市蓝果忍冬果实中主要非花色苷多酚的结构式
Fig.7 Structure of major non-anthocyanin polyphenols from blue honeysuckle fruits in Mohe city
P3和P5均具有柠檬酸的特征离子(m/z 191),P4和P9均具有马钱苷酸的特征离子(m/z 375)。P2和P20号峰物质未知,根据文献推测P2为奎宁酸类,P20为山奈酚类,MS数据的缺失可能是由于杂质的干扰引起的。P10和P14的碎片离子中均含有m/z289,根据CHEN等[28]的研究,在负离子模式下产生m/z 289的碎片离子的化合物为上端为A-型结构的原花青素,因此P10为A型原花青素二聚体(裂解途径见图8-b);P14与文献报道[29]的谱图一致,被确定为原花青素A2。P11、P13、P16、P18、P21、P22由二级质谱图, 可知其分子离子峰m/z 301,均具有槲皮素的特征离子。P12、P15、P24在二级质谱扫描显示均有一个m/z 285的碎片离子(山奈酚),其中P12在碰撞中母离子失去了m/z 308的芸香糖苷(裂解途径见图8-c),P15失去了m/z 162的半乳糖苷。根据文献[28]分析得出:P6、P7、P23为原金丝桃酸(m/z 506)、龙胆酸(m/z 153)和柚皮素(m/z 272)。经鉴定得出:漠河蓝果忍冬果实的非花色苷多酚中原花青素、山奈酚-3-芸香糖苷和二咖啡酰奎宁酸的含量较高,即槲皮素、山奈酚等物质所占比重大。

a-二咖啡酰奎宁酸;b-原花青素二聚体;c-山奈酚-3-O-芸香糖苷
图8 二咖啡酰奎宁酸、原花青素二聚体、山奈酚-3-O-芸香糖苷的裂解途径
Fig.8 Fragmentation pathway of dicaffeoyl-quinic acid, procyanidin dimer and kaempferol-3-O-rutinoside
3 结论
本研究结果显示,漠河蓝果忍冬果实中共检测到8种花色苷,24种非花色苷多酚,其中富含矢车菊素-3-葡萄糖苷、原花青素、山奈酚-3-芸香糖苷和二咖啡酰奎宁酸。蓝果忍冬果实具有较高的总酚及总花青素含量,4种抗氧化分析方法结果表明,蓝果忍冬均具有较强的抗氧化活性。抗酶分析结果表明,漠河蓝果忍冬果实对α-淀粉酶和α-葡萄糖苷酶活性具有较强的抑制作用,且可有效抑制脂肪酶。这可能与漠河蓝果忍冬内含有高含量的多酚类物质有关,具有降低血糖的功效。该研究可为蓝果忍冬产品的开发提供理论依据,对助推蓝果忍冬功能性保健品、食品和药品的研发具有重要意义。
[1] 王苒, 杜鹏飞, 李明文.蓝靛果忍冬新品种比较试验研究[J].安徽农学通报, 2019, 25(13):32-35.
WANG R, DU P F, LI M W.Breeding research of the fine variety of Lonicera caerulea[J].Anhui Agricultural Science Bulletin, 2019, 25(13):32-35.
[2] 张星, 毕金峰, 陈芹芹, 等.4种浆果成分分析及抗氧化活性研究[J].食品科技, 2020, 45(6):52-58.
ZHANG X, BI J F, CHEN Q Q, et al.Components analysis and antioxidant activities of four varieties of berries[J].Food Science and Technology, 2020, 45(6):52-58.
[3] 朱力国, 郭阳, 唐思媛, 等.不同品种蓝靛果化学成分及抗氧化活性比较[J].中国酿造, 2018, 37(10):153-157.
ZHU L G, GUO Y, TANG S Y, et al.Comparison of chemical constituents and antioxidant activities of different Lonicera caerulea varieties[J].China Brewing, 2018, 37(10):153-157.
[4] KIM J W, LEE Y S, SEOL D J, et al.Anti-obesity and fatty liver-preventing activities of Lonicera caerulea in high-fat diet-fed mice[J].International Journal of Molecular Medicine, 2018, 42(6):3 047-3 064.
[5] ZHOU L P, WANG H, YI J J, et al.Anti-tumor properties of anthocyanins from Lonicera caerulea ‘Beilei’ fruit on human hepatocellular carcinoma:In vitro and in vivo study[J].Biomedicine & Pharmacotherapy, 2018, 104(5):520-529.
[6] PACE E, JIANG Y Y, CLEMENS A, et al.Impact of thermal degradation of cyanidin-3-O-glucoside of haskap berry on cytotoxicity of hepatocellular carcinoma HepG2 and breast cancer MDA-MB-231 cells[J].Antioxidants, 2018, 7(2):24.
[7] ZHAO J, LIN Y, ZHAO Y B, et al.Polyphenol-rich blue honeysuckle extract alleviates silica particle-induced inflammatory responses and macrophage apoptosis via NRF2/HO-1 and MAPK signaling[J].Journal of Functional Foods, 2018, 46(6):463-474.
[8] 杨文康, 李超, 喻柯柯, 等.罗汉果皂甙粗提物的α-葡萄糖苷酶体外抑制活性研究[J].食品工业科技, 2016, 37(24):111-115.
YANG W K, LI C, YU K K, et al.Inhibitory effect of mogrosides crude extract on α-glucosidase in vitro[J].Science and Technology of Food Industry, 2016, 37(24):111-115.
[9] 高媛. 岩高兰多酚的提取纯化、成分鉴定及其生物活性研究[D].哈尔滨:东北林业大学, 2020.
GAO Y.Study on extraction, purification, identification and bioactivities of polyphenols from Empetrum nigrum aerial parts[D].Harbin:Northeast Forestry University, 2020.
[10] SONG H H, BI J F, CHEN Q Q, et al.Structural and health functionality of dried goji berries as affected by coupled dewaxing pre-treatment and hybrid drying methods[J].International Journal of Food Properties, 2018, 21(1):2 527-2 538.
[11] PETROVA K, IVANOVA P, MIHALEV K, et al., Antioxidant capacity, polyphenol and anthocyanin content in blackberries[J].Journal of Mountain Agriculture on the Balkans, 2016,19(2):221-232.
[12] KIM D, LEE C Y.Extraction and isolation of polyphenolics[J].Current Protocols in Food Analytical Chemistry, 2002, 6(1):1 210-1 212.
[13] BRANDWILLIAMS W, CUVELIER M, BERSET C, et al.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology, 1995, 28(1):25-30.
[14] HUANG D J, OU B X, HAMPSCH-WOODILL M, et al.High-throughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J].Journal of Agricultural and Food Chemistry, 2002, 50(16):4 437-4 444.
[15] NAYAK B, BERRIOS J D J, POWERS J R, et al.Thermal degradation of anthocyanins from purple potato (Cv.Purple Majesty) and impact on antioxidant capacity[J].Journal of Agricultural and Food Chemistry, 2011, 59(20):11 040-11 049.
[16] RE R, PELLEGRINI N, PROTEGGENTE A, et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine, 1999, 26(9-10):1 231-1 237.
[17] LIU T T, SONG L X, WANG H Y, et al.A high-throughput assay for quantification of starch hydrolase inhibition based on turbidity measurement[J].Journal of Agricultural & Food Chemistry, 2011, 59(18):9 756-9 762.
[18] WANG Y H,ZHU J Y,MENG X J,et al.Comparison of polyphenol, anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts[J].Food Chemistry, 2016, 197:522-529.
[19] YU R,CHEN L,XIN X L.Comparative assessment of chemical compositions,antioxidant and antimicrobial activity in ten berries grown in China[J].Flavour & Fragrance Journal, 2020, 35(2):197-208.
[20] 刘佩, 张妍, 霍俊伟, 等.五种寒地果树果实的多酚含量、抗氧化活性及抗α-淀粉酶活性分析[J].食品工业科技, 2020, 41(4):282-288.
LIU P,ZHANG Y,HUO J W, et al.Analysis of polyphenolic content, antioxidant capacity and α-amylase inhibitory activity of five fruits[J].Science and Technology of Food Industry, 2020, 41(4):282-288.
[21] AUZANNEAU N, WEBER P, KOSINSKA A, et al.Bioactive compounds and antioxidant capacity of Lonicera caerulea,berries:Comparison of seven cultivars over three harvesting years[J].Journal of Food Composition & Analysis, 2017, 66(12):81-89.
[22] RUPASINGHE H P V, ARUMUGGAM N, AMARARATHNA M, et al.The potential health benefits of haskap (Lonicera caerulea L.):Role of cyanidin-3-O-glucoside[J].Journal of Functional Foods, 2018, 44(5):24-39.
[23] MCDOUGALL G J, KULKARNI N N, STEWART D.Berry polyphenols inhibit pancreatic lipase activity in vitro[J].Food Chemistry, 2009, 115(1):193-199.
[24] KITHMA A B, SILVA H D, RUPASINGHE H P V.Polyphenols composition and anti-diabetic properties in vitro of haskap (Lonicera caerulea L.) berries in relation to cultivar and harvesting date[J].Journal of Food Composition and Analysis, 2020, 88(12):10 340.
[25] CAPRIOLI G, IANNARELLI R, INNOCENTI M, et al.Blue honeysuckle fruit (Lonicera caerulea L.) from eastern Russia:Phenolic composition, nutritional value and biological activities of its polar extracts [J].Food & Function, 2016, 7(4):1 892-1 903.
[26] SENICA M, BAVEC M, STAMPAR F, et al.Blue honeysuckle (Lonicera caerulea subsp.edulis (Turcz.Ex Herder) Hultén.) berries and changes in their ingredients across different locations[J].Journal of the Science of Food & Agriculture, 2018, 98(9):3 333-3 342.
[27] DEL BO′ C, MARTINI D, PORRINI M, et al.Berries and oxidative stress markers:An overview of human intervention studies[J].Food & Function, 2015, 6(9):2 890-2 917.
[28] CHEN H J, CHEN B H, INBARAJ B S.Determination of phenolic acids and flavonoids in Taraxacum formosanum Kitam by liquid chromatography-tandem mass spectrometry coupled with a post-column derivatization technique[J].International Journal of Molecular Sciences, 2012, 13(12):260-285.
[29] LOU H X, YAMAZAK Y, SASAKI Y.A-type proanthocyanidins from peanut skins[J].Phytochemistry, 1999, 51(2):297-308.
[30] DUAN L, GUO L, LIU L L, et al.An UHPLC-MS/MS method for simultaneous determination of quercetin 3-O-rutinoside, kaempferol 3-O-rutinoside, isorhamnetin 3-O-rutinoside, bilobalide and ligustrazine in rat plasma, and its application to pharmacokinetic study of Xingxiong injection[J].Chinese Journal of Natural Medicines, 2017, 15(9):710-720.