枸杞由于其药食同源的特性被广泛应用于保健食品加工,其富含的甜菜碱,枸杞色素及枸杞多糖具有重要的生物学功能[1],如抑制癌细胞的增殖[2]、提高人体的免疫力、减少肝脏损伤[3]等。中国是枸杞的主要生产国和消费国,宁夏、内蒙古西部、新疆、青海为枸杞主要产区。2009—2018年,枸杞的年产量从128 200 t增加到451 000 t。由于不同产区之间土壤特性、气候条件和耕作方法不同,果实质量、重量、糖含量和活性物质存在差异,从而导致产地之间的风味差异[4]。虽然大面积的种植区提高了枸杞产量,但也造成市面上枸杞质量不一,鱼龙混杂的现状。由于粮食市场的全球化,人们对农产品的溯源越来越关注[5],部分国家制定了确保产品地理标志质量的政策。自2006年以来,中国已实施了有关农产品原产地的管理法,以改善原产地条件并确保原产地的质量安全。因此,开发一种快速鉴别产地的方法检测枸杞的地理来源,对于规范市场和控制质量均具有重要意义。色谱-离子迁移谱法(headspace-gas chromatography-ion mobility spectroscopy,HS-GC-IMS)是一种快速分离和鉴定风味化合物的新方法,无需预处理即可以较低的检测限进行快速分析,在食品质量鉴别,溯源及风味分析中起着重要的作用[6-7],如区分松茸不同部位的风味差异,椰子油等级及鉴定伊比利亚火腿真伪等[8-10]。
如今消费者对产地溯源愈加重视,因此本研究通过对不同产区枸杞化学成分的测定,结合气相离子色谱及偏最小二乘法判别(partial least squares discrimination analysis,PLS-DA)对4个主要产区枸杞进行区分,旨在分析地理环境对枸杞品质的影响,确定不同产区枸杞中含量差异较大的挥发性风味化合物,为枸杞产品的产地鉴定提供指导。
1 材料与方法
1.1 材料及试剂
5%苯酚溶液、硫酸、无水乙醇、柠檬酸、氢氧化钠、硝酸铝、亚硝酸钠等,国药试剂。
2020年7月,从宁夏回族自治区中卫县区域(n=7)、新疆维吾尔自治区精河县区域(n=5)、青海省柴达木盆地区域(n=7)和内蒙古西部乌拉特前旗区域(n=5)的4个主要产区范围内收集枸杞样品,有关收集地区的地理位置相关信息汇总至表1。
表1 中国枸杞产区地理位置
Table 1 Location information of wolfberry region in China
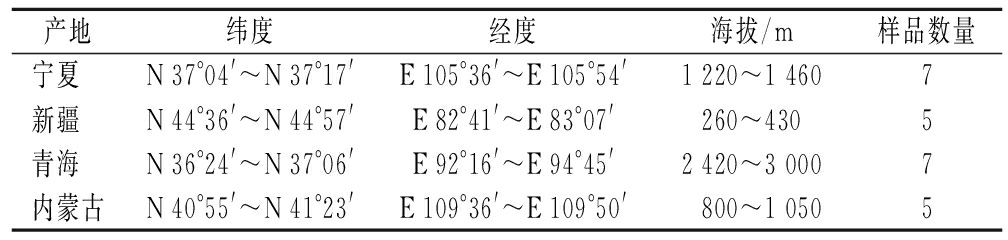
产地纬度经度海拔/m样品数量宁夏 N 37°04'~N 37°17'E 105°36'~E 105°54'1 220~1 4607新疆 N 44°36'~N 44°57'E 82°41'~E 83°07'260~4305青海 N 36°24'~N 37°06'E 92°16'~E 94°45'2 420~3 0007内蒙古N 40°55'~ N 41°23'E 109°36'~E 109°50'800~1 0505
1.2 仪器与设备
PL2002电子天平、AL204分析天平、FE20精密数显pH计,梅特勒托利多仪器有限公司;UV2300紫外-可见光分光光度计,上海天美公司;Kjeltec8400全自动凯式定氮仪,美国FOSS公司;FlavourSpec 1H1-00053型顶空气相-离子迁移谱仪,德国G.A.S.公司。
1.3 试验方法
1.3.1 不同产地枸杞化学成分测定
水分含量参照GB 5009.3—2016《食品安全国家标准 食品水分的测定》采用直接干燥法进行测定;蛋白质含量参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》采用凯式定氮法进行测定;总糖含量参照GB/T 0782—2006《食品安全国家标准 食品中总糖的测定》采用滴定法进行测定;枸杞多糖、黄酮、类胡萝卜素含量均参照吴有锋等[11]经超声提取后采用分光光度法进行测定。
1.3.2 GC-IMS测定条件
根据FANG等[12]的方法稍作修改。样品预处理:所有样品(水分含量相似)用超纯水洗涤3次后以料水笔1∶3(g∶mL)浸泡2 h,匀浆,取2 mL枸杞汁放入20 mL顶空瓶中待测。GC条件:柱温起始温度50 ℃,保持2 min,以3 ℃/min加热至125 ℃,保持2 min后以15 ℃/min加热至160 ℃;载气为纯度≥99.999%氮气。自动顶空进样器的条件:温育温度80 ℃,温育时间15 min。在不分流进样模式下于85 ℃注入1 000 μL等分试样;喷雾方式∶顶空喷雾;加热方式∶摇动加热;摇动速度∶600 r/min;IMS的检测条件:漂移管的长度98 mm,温度为45 ℃;漂移气体为高纯N2,纯度≥99.999%。流速:150 mL/min,线性电压管:500 V/cm;辐射源:β射线(tri,3H);电离模式:正离子。
1.3.3 数据分析
使用LAV及 Reporter、Gallery Plot插件进行样品分析,通过GC×IMS内置NIST数据库和IMS数据库对枸杞样品中挥发性化合物进行定性。采用PLS-DA(Simca-p软件)对风味数据进行建模,以确定不同区域中的特定标记。采用SPSS 22.0软件进行方差分析,P<0.05表示物质浓度存在显著差异。
2 结果与分析
2.1 不同产地枸杞化学成分分析
各产地随机挑选5份枸杞样品进行化学成分的测定,各样品具体理化指标及活性物质含量见表2,为便于比较不同产区间的成分差异,对各产区样品进行显著性差异分析,结果汇总于表3。由表3可知,不同地区样品中水分、枸杞多糖、黄酮、总糖、蛋白质、类胡萝卜素含量水平均在产区之间表现出一定差异(P<0.05)。就水分而言,宁夏及内蒙古枸杞较为干燥,水分含量在10%~12%,两产区之间无显著差异。新疆枸杞由于颗粒较大导致晒制结束后残留水分较多,水分含量达到(14.83±0.97)%。四产地枸杞样品的蛋白质含量均处于较高水平,在10%~15%波动,与之前研究报道的结果相似,也侧面说明枸杞是一种高蛋白质的药食两用资源。糖是枸杞风味重要的组成成分,糖分的积累受不同生态因子及蔗糖代谢相关酶的影响[13],同时糖分也调控其生长成熟中众多物质的代谢,大部分果实中挥发性香气物质是果实碳水化合物次生代谢的重要产物[14],各产区总糖含量由高至低为:青海>新疆>宁夏>内蒙古。有研究表明苹果果实从幼果期开始适度干旱胁迫可以提高果实蔗糖及果糖含量[15],柴达木盆地年均降水量为20~80 mm,约为内蒙古西部的20%~50%,青海产区与内蒙古产区相比,海拔较高,昼夜温差增大,中度干旱的环境促进了该产区枸杞糖分的积累。但过高的含糖量会影响枸杞晾晒制干过程,使枸杞变得潮湿黏软,不易贮藏[16]。经上述理化指标综合比较,内蒙与宁夏的枸杞更易贮藏及运输。
表2 中国不同产地枸杞化学成分分析(n=3,mean±SD)
Table 2 Chemical constituents of wolfberry from different region of China(n=3,mean±SD)
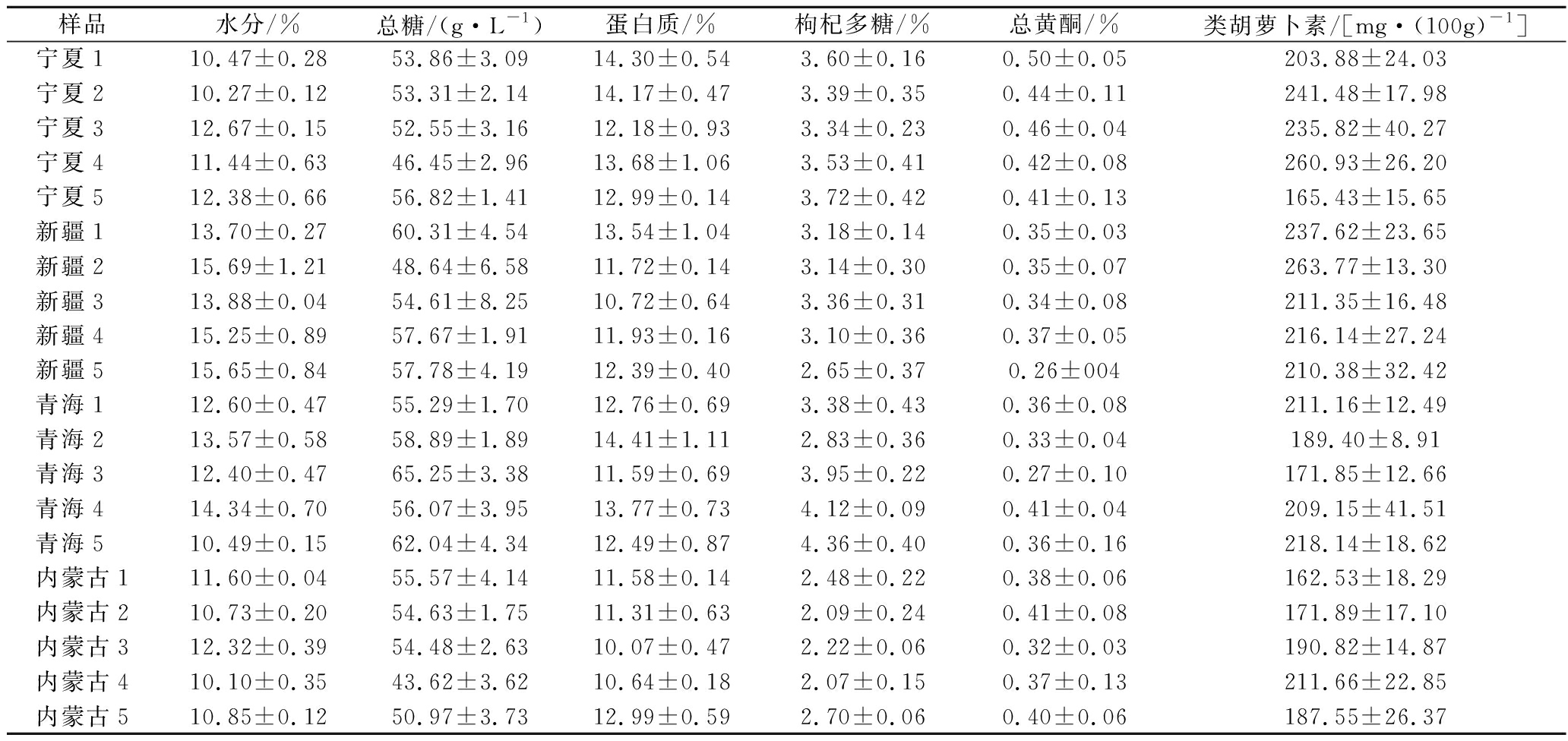
样品水分/%总糖/(g·L-1) 蛋白质/%枸杞多糖/%总黄酮/%类胡萝卜素/[mg·(100g)-1] 宁夏1 10.47±0.2853.86±3.0914.30±0.543.60±0.160.50±0.05203.88±24.03宁夏2 10.27±0.1253.31±2.1414.17±0.473.39±0.350.44±0.11241.48±17.98宁夏3 12.67±0.1552.55±3.1612.18±0.933.34±0.230.46±0.04235.82±40.27宁夏4 11.44±0.6346.45±2.9613.68±1.063.53±0.410.42±0.08260.93±26.20宁夏5 12.38±0.6656.82±1.4112.99±0.143.72±0.420.41±0.13165.43±15.65新疆1 13.70±0.2760.31±4.5413.54±1.043.18±0.140.35±0.03237.62±23.65新疆2 15.69±1.2148.64±6.5811.72±0.143.14±0.300.35±0.07263.77±13.30新疆3 13.88±0.0454.61±8.2510.72±0.643.36±0.310.34±0.08211.35±16.48新疆4 15.25±0.8957.67±1.9111.93±0.163.10±0.360.37±0.05216.14±27.24新疆5 15.65±0.8457.78±4.1912.39±0.402.65±0.370.26±004210.38±32.42青海1 12.60±0.4755.29±1.7012.76±0.693.38±0.430.36±0.08211.16±12.49青海2 13.57±0.5858.89±1.8914.41±1.112.83±0.360.33±0.04189.40±8.91青海3 12.40±0.4765.25±3.3811.59±0.693.95±0.220.27±0.10171.85±12.66青海4 14.34±0.7056.07±3.9513.77±0.734.12±0.090.41±0.04209.15±41.51青海5 10.49±0.1562.04±4.3412.49±0.874.36±0.400.36±0.16218.14±18.62内蒙古111.60±0.0455.57±4.1411.58±0.142.48±0.220.38±0.06162.53±18.29内蒙古210.73±0.2054.63±1.7511.31±0.632.09±0.240.41±0.08171.89±17.10内蒙古312.32±0.3954.48±2.6310.07±0.472.22±0.060.32±0.03190.82±14.87内蒙古410.10±0.3543.62±3.6210.64±0.182.07±0.150.37±0.13211.66±22.85内蒙古510.85±0.1250.97±3.7312.99±0.592.70±0.060.40±0.06187.55±26.37
表3 中国不同产地枸杞化学成分统计分析
Table 3 Analysis of chemical constituents of wolfberry from different region of China
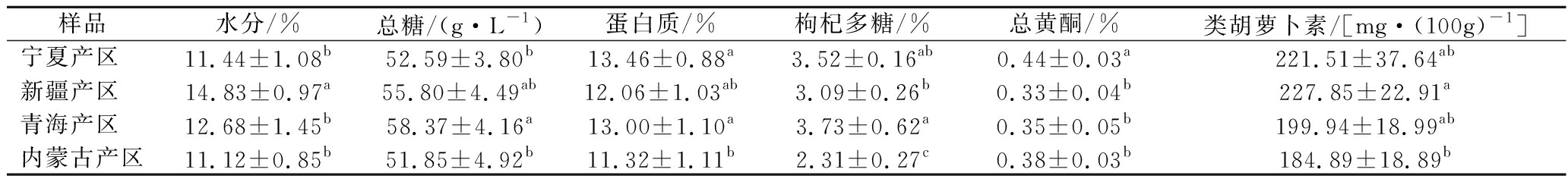
样品水分/%总糖/(g·L-1)蛋白质/%枸杞多糖/%总黄酮/%类胡萝卜素/[mg·(100g)-1]宁夏产区 11.44±1.08b52.59±3.80b13.46±0.88a3.52±0.16ab0.44±0.03a221.51±37.64ab新疆产区 14.83±0.97a55.80±4.49ab12.06±1.03ab3.09±0.26b0.33±0.04b227.85±22.91a青海产区 12.68±1.45b58.37±4.16a13.00±1.10a3.73±0.62a0.35±0.05b199.94±18.99ab内蒙古产区11.12±0.85b51.85±4.92b11.32±1.11b2.31±0.27c0.38±0.03b184.89±18.89b
注:同一列不同字母表示差异显著(P<0.05)
黄酮广泛存在于自然界植物及浆果中,其作为枸杞的次生代谢物在保健功效中具有重要作用,可抗肿瘤、抗氧化、降低血脂等[17],除枸杞外银杏叶片、大豆、葡萄及菊科植物中均含有大量黄酮类化合物。宁夏产区枸杞黄酮含量最高,达到(0.44±0.03)%,同一产区间并无显著差异。有研究表明土壤中氮及磷元素的缺乏会增强MYBb、bHLH转录因子表达,提高CHS、CHI 基因表达量进而促进作物体内黄酮合成[18-19],宁夏土质中氮、磷及有机质含量较低,相比较其他产区其土壤条件更利于枸杞中黄酮的积累。枸杞多糖是枸杞中主要的功能性物质,可以减轻高脂带来的内脏损伤。研究结果表明,不同产区间枸杞多糖含量差异较大,青海产区枸杞的多糖含量最高,其次为宁夏产区,两产区纬度相近但海拔差距明显,海拔升高则温度降低,光照强度及时间增加,昼夜温差增大,利于枸杞中多糖的富集,与崔治家等[20]研究结果相符。而内蒙古相比宁夏产区,海拔相似但纬度差异较大,宁夏产区年均温度更高,利于多糖的积累。由此可以看出枸杞多糖含量与地理位置及气候环境密切相关,日照时间的增加及气温的升高均有利于枸杞品质的提升。类胡萝卜素为存在光合植物中的天然色素,具有保护眼部、预防心脑血管疾病等重要保健功能,辣椒、柑橘及桃果实均含有大量类胡萝卜素。同一产区内类胡萝卜素含量波动较大,新疆产区的类胡萝卜素含量最高,为(227.85±22.91) g/L,内蒙古产区样品最低,为(187.55±26.37)g/L。综上可以看出中国主要产区的枸杞品质存在一定差异,宁夏及青海产区地理环境对黄酮及多糖的积累有一定优势,产区的生态条件包括温度、光照、降水对道地性药材枸杞的功能性物质成分及总糖含量影响较大,选取枸杞栽培区时应综合考虑各环境因子对枸杞品质的影响。
2.2 不同产地枸杞挥发性物质的差异
果实风味极大程度上受到产区环境影响,不同纬度地区植物的化学成分不同[21],在光照时间、昼夜温差、降水量以及气温的综合作用下形成产区间的风味差异。利用HS-GC-IMS鉴定不同产区中枸杞的挥发性物质,图1(以内蒙古枸杞样品为例)中光谱代表枸杞样品的总挥发性化合物,可以看出大多数信号峰值位于1.0~1.5 s的漂移时间和400~1 400 s的保留时间内。IMS检测依赖于由β电离产生的空气簇离子与分析物之间的快速离子反应。因此,HS-GC-IMS分析对痕量物质的检测更加敏感,除可以准确鉴定挥发性化合物外还可以建立样品完整的指纹图谱[22]。如图1所示,纵坐标代表气相色谱的保留时间,横坐标代表离子迁移时间。RIP峰(反应离子峰,横坐标1.0处红色竖线)两侧的每个点代表一种挥发性有机化合物。点的颜色深浅与该种化合物浓度有关,颜色越深则浓度越高。在4个产地枸杞样品中共检测到72个峰,通过IMS数据库鉴定出36种挥发性化合物。由于浓度不同,一些挥发性化合物会在迁移过程中产生不同的产物离子,即同一种化合物的单体和二聚体[10]。不同产物离子的保留时间相同,但漂移时间不同,例如图1中由黄色方框标出的己醛(a、a′)、(E)-2-己烯醛(b、b′)、1-戊醇(c、c′)、1-己醇(d、d′)、糠醛(e、e′)均可观察到2个信号峰。
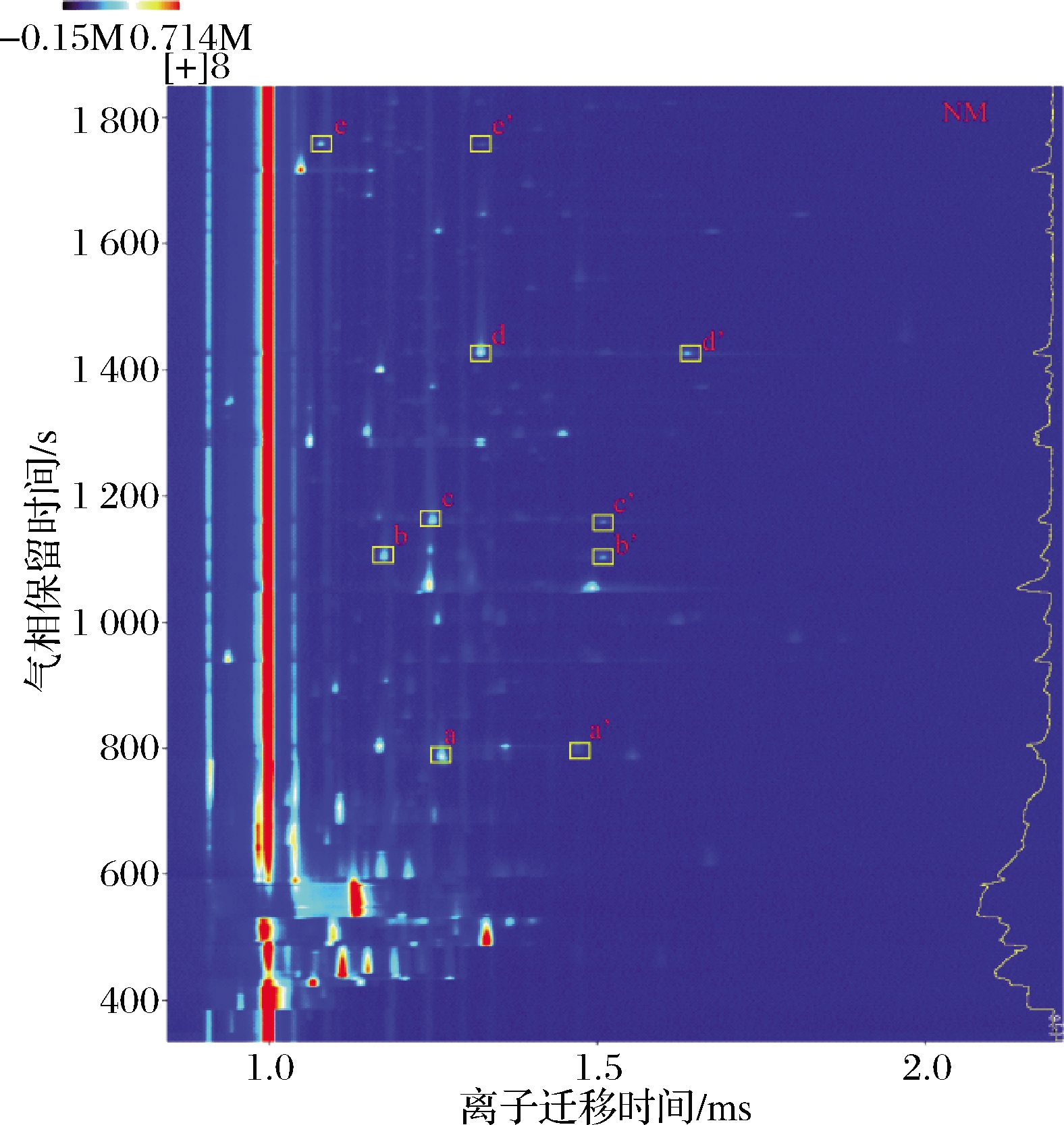
图1 枸杞气相离子迁移谱
Fig.1 GC-IMS topographic plots of wolfberry
为更直观地比较不同产地枸杞风味成分之间的差异,选择内蒙古枸杞风味指纹图谱作为参比,并以差异比较模式从其他样品的光谱中扣除该参比。如果挥发性化合物浓度一致,则扣除后的背景为白色,红色表示物质的浓度高于参比值,蓝色表示物质的浓度低于参比值。如图2所示,不同产地枸杞的挥发性化合物种类相似,但含量略有不同。大多数化合物的差异信号集中在400~500 s和1 000~1 200 s的保留时间内(由红色方框圈出)。与参比相比较,其他三产区样品的大部分信号在扣除后均为蓝色,这表明内蒙古独特的地理环境对某些化合物的积累起了正向作用,这些物质可能成为产地鉴定的关键物质。
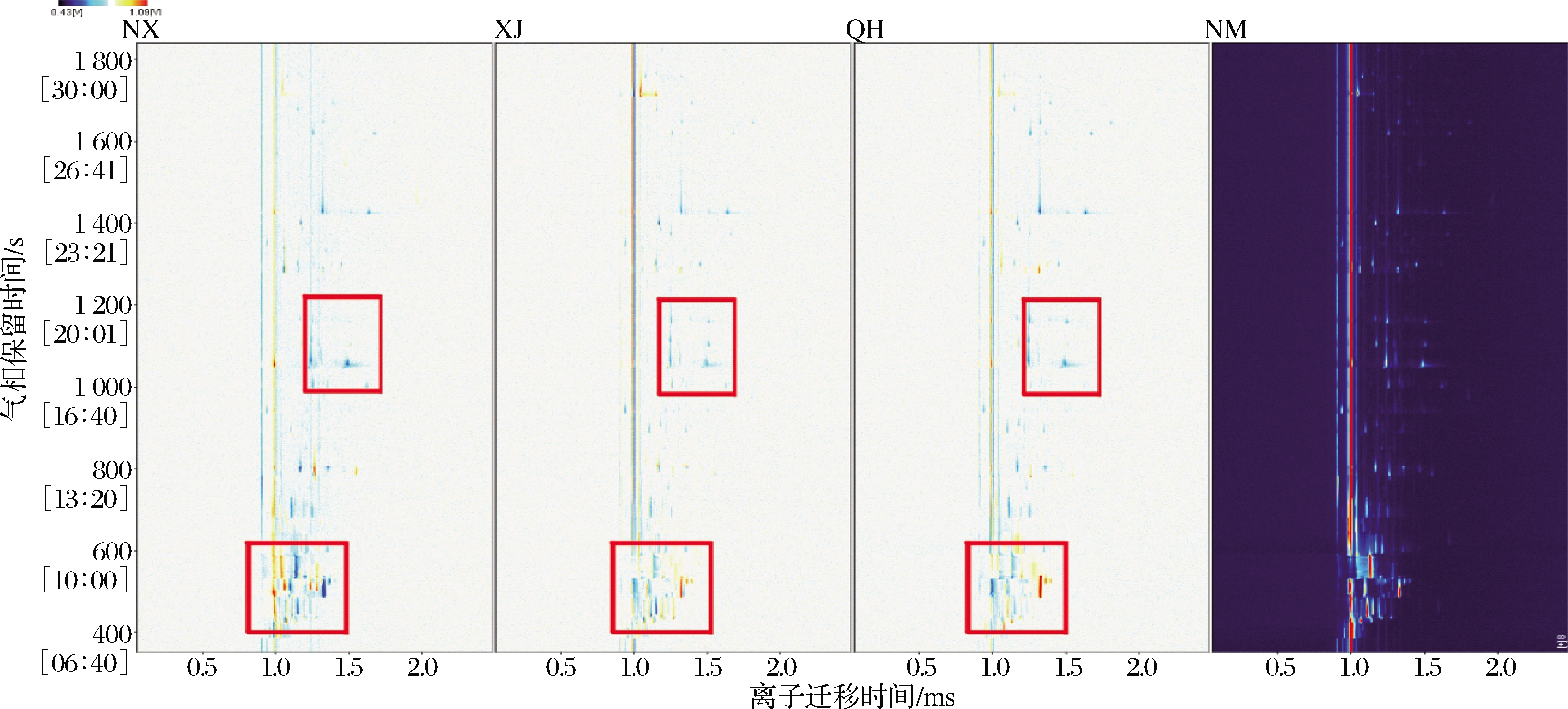
图2 枸杞样品的GC-IMS差异图谱
Fig.2 The differences fingerprint of volatile compounds in wolfberry
2.3 不同地区枸杞挥发性物质的指纹图谱
前期利用GC-IMS分析共鉴定出36种挥发性化合物,具体信息见表4,包括化合物名称、CAS号、分子式、分子质量、漂移时间、保留指数和保留时间。图3 为使用内置Gallery Plot插件生成不同产地枸杞的挥发性有机物(volatile organic compounds,VOCs)指纹图谱,横坐标为每种挥发性化合物的名称,用以表征每个枸杞来源的完整VOCs信息,其中每行代表1个样品采集的差异物质信号峰,每列代表不同枸杞样品中相同VOCs的信号峰。其中右侧化合物为产生地域性差异较大的16种化合物(紫色框内),由图3可以直观观察到来自不同地区的枸杞样品中挥发性化合物的差异,并建立与每个产区相对应的特征指纹图谱。

图3 枸杞样品挥发性香气化合物指纹图谱
Fig.3 The fingerprint of volatile compounds of wolfberry
表4 特征峰对应化合物
Table 4 Volatile compounds of wolfberry identified by GC-IMS
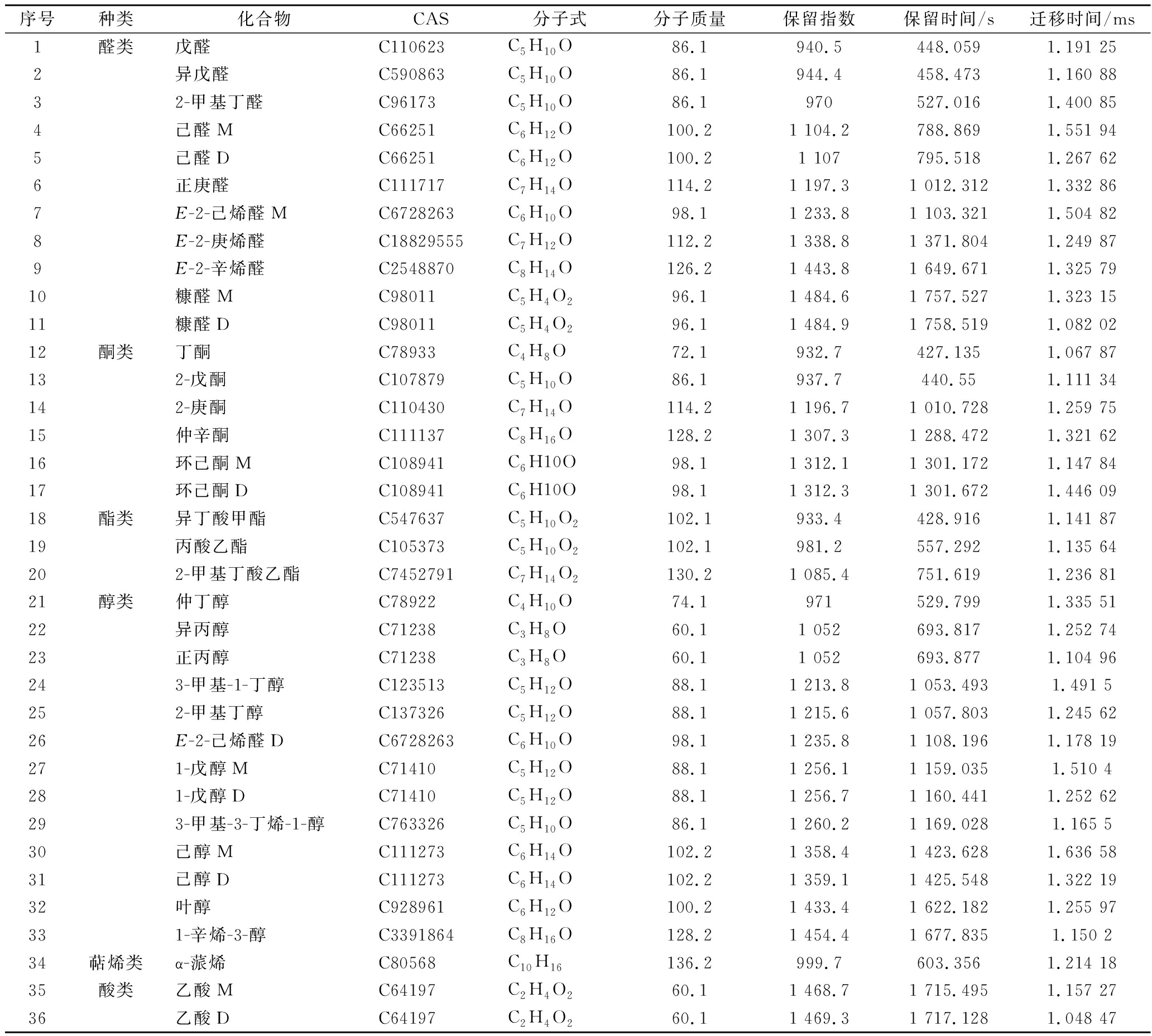
序号种类化合物CAS分子式分子质量保留指数保留时间/s迁移时间/ms1醛类戊醛C110623C5H10O86.1940.5448.0591.191 252异戊醛C590863C5H10O86.1944.4458.4731.160 8832-甲基丁醛C96173C5H10O86.1970527.0161.400 854己醛MC66251C6H12O100.21 104.2788.8691.551 945己醛DC66251C6H12O100.21 107795.5181.267 626正庚醛C111717C7H14O114.21 197.31 012.3121.332 867E-2-己烯醛MC6728263C6H10O98.11 233.81 103.3211.504 828E-2-庚烯醛C18829555C7H12O112.21 338.81 371.8041.249 879E-2-辛烯醛C2548870C8H14O126.21 443.81 649.6711.325 7910糠醛MC98011C5H4O296.11 484.61 757.5271.323 1511糠醛DC98011C5H4O296.11 484.91 758.5191.082 0212酮类丁酮C78933C4H8O72.1932.7427.1351.067 87132-戊酮C107879C5H10O86.1937.7440.551.111 34142-庚酮C110430C7H14O114.21 196.71 010.7281.259 7515仲辛酮C111137C8H16O128.21 307.31 288.4721.321 6216环己酮MC108941C6H10O98.11 312.11 301.1721.147 8417环己酮DC108941C6H10O98.11 312.31 301.6721.446 0918酯类异丁酸甲酯C547637C5H10O2102.1933.4428.9161.141 8719丙酸乙酯C105373C5H10O2102.1981.2557.2921.135 64202-甲基丁酸乙酯C7452791C7H14O2130.21 085.4751.6191.236 8121醇类仲丁醇C78922C4H10O74.1971529.7991.335 5122异丙醇C71238C3H8O60.11 052693.8171.252 7423正丙醇 C71238C3H8O60.11 052693.8771.104 96243-甲基-1-丁醇C123513C5H12O88.11 213.81 053.4931.491 5252-甲基丁醇C137326C5H12O88.11 215.61 057.8031.245 6226E-2-己烯醛D C6728263C6H10O98.11 235.81 108.1961.178 19271-戊醇M C71410C5H12O88.11 256.11 159.0351.510 4281-戊醇D C71410C5H12O88.11 256.71 160.4411.252 62293-甲基-3-丁烯-1-醇C763326C5H10O86.11 260.21 169.0281.165 530己醇MC111273C6H14O102.21 358.41 423.6281.636 5831己醇DC111273C6H14O102.21 359.11 425.5481.322 1932叶醇C928961C6H12O100.21 433.41 622.1821.255 97331-辛烯-3-醇C3391864C8H16O128.21 454.41 677.8351.150 234萜烯类α-蒎烯C80568C10H16136.2999.7603.3561.214 1835酸类乙酸MC64197C2H4O260.11 468.71 715.4951.157 2736乙酸DC64197C2H4O260.11 469.31 717.1281.048 47
注:M表示单体;D表示多聚体(下同)
鉴定出的风味化合物可大致分为酮类、醛类、酯类、醇类、酸类及萜烯类。由于HS-GC-IMS对醛酮类物质检测更加敏感,相比GC-MS方法能够检测到更多的醛酮类物质[23]。大部分醛酮类物质被描述为具有青草及木质香气,有研究表明高海拔低气温更利于果实中醛酮类的积累[24],青海在四产区中海拔最高,平均海拔为2 800 m,2-甲基丁醛、糠醛、己醛在该产区中浓度明显增加,而在海拔较低的新疆和内蒙古产区枸杞中则表现出明显的降低或缺失(红色及黄色方框内)。目前枸杞中醛类风味物质合成机理尚未明确,但与枸杞同属茄科的番茄果实中2-甲基丁醛合成积累与支链氨基酸合成途径密切相关[25],青海柴达木枸杞17种氨基酸含量均处于较高水平[26],相比其他产区,前体物质异亮氨酸及亮氨酸含量的增加促进了该产区枸杞2-甲基丁醛的合成。青海产区醛类物质含量的增加使该产区枸杞可可、咖啡及青草气味更明显。酯类是成熟果实中重要的风味化合物,包含直链酯类及支链酯类2种,主要来源于脂肪酸和氨基酸途径,其含量受果实成熟程度及采摘后贮藏温度影响较大。在四产区的枸杞样品中共检测到3种酯类,分别为异丁酸甲酯、丙酸乙酯、2-甲基丁酸乙酯,表现为菠萝香味及果香。其中丙酸乙酯含量在产区间有较大差别,丙酸乙酯为果香型化合物,在成熟草莓及杏果实中均可被检测到。鉴定出的12种醇类物质中有8种在产区间差别较大,大部分醇类物质表现为青草香及甜香,但由于其气味阈值较高,对果实整体风味贡献相比醛类较低[27],黄瓜及甜瓜中醇类化合物种类及含量较多。由图4可知,内蒙古产区枸杞中1-戊醇、3-甲基-1-丁醇、己醇(绿色方框内)的含量显著增加,C5醇类的形成可能与有脂氧合酶(lipoxygenase,LOX)参加的氧化反应有关[28],LOX广泛存在于谷物及蔬菜水果中,如水稻、黄瓜、桃果实等,其在己醛类及醇类风味化合物的合成代谢中具有重要作用。番茄果实中C5风味化合物的形成也被认为与LOX有关。内蒙古地处内陆的地理环境及土壤气候更利于醇类的形成与积累,其中正丙醇为内蒙古产区枸杞的特有挥发性化合物可用于该产区枸杞的鉴定。萜烯类物质虽然含量低,但由于其阈值较低,也是水果中重要的助香化合物[29]。不同产地同一品种果实的萜烯类组成含量相似,本次研究中α-蒎烯的含量在四产地枸杞中也并无显著区别,α-蒎烯作为代表性的单萜类化合物作为植物精油的主要成分,是枸杞果实香气的重要来源。
2.4 不同地区枸杞PLS-DA模型分析
通过PLS-DA将风味数据进行降维处理,相比于PCA,PLS-DA在高维数据的可视化、判别分析与代谢变化有关的潜在代谢物方面更具优势[30]。其中R2和Q2分别代表该模型的解释性和预测性,R2和Q2值越接近于1则拟合越好。由图4-a可知,枸杞样品被大致分为四类,主成分1和主成分2的贡献率分别为71.4%和8.45%,累积贡献率达到79.85%,能够反应不同产地枸杞差异性挥发性物质的总体状态。模型拟合度较好,其中R2Y=0.847 4,Q2=0.715 1。此外,该模型经过交叉验证的200次置换测试,并未出现过拟合现象。使用变量投影重要性(variable importance in projection,VIP)分析来进一步确定可以有效区分产地的标记物质,其中VIP值是选择潜在分类标记物的主要参数,代表特定标记与不同产地枸杞样品的相关性。通常认为潜在标记的VIP得分应>1,>1.5则更佳[30]。图4-b列出了16种化合物的VIP值,其中有5种物质VIP值>1且在不同产地中表现出显著的浓度差异,分别为糠醛D(>1.5),1-辛烯-3-醇,叶醇,2-甲基丁醛及异戊醛,可以认为是区分不同产地的关键性风味物质。
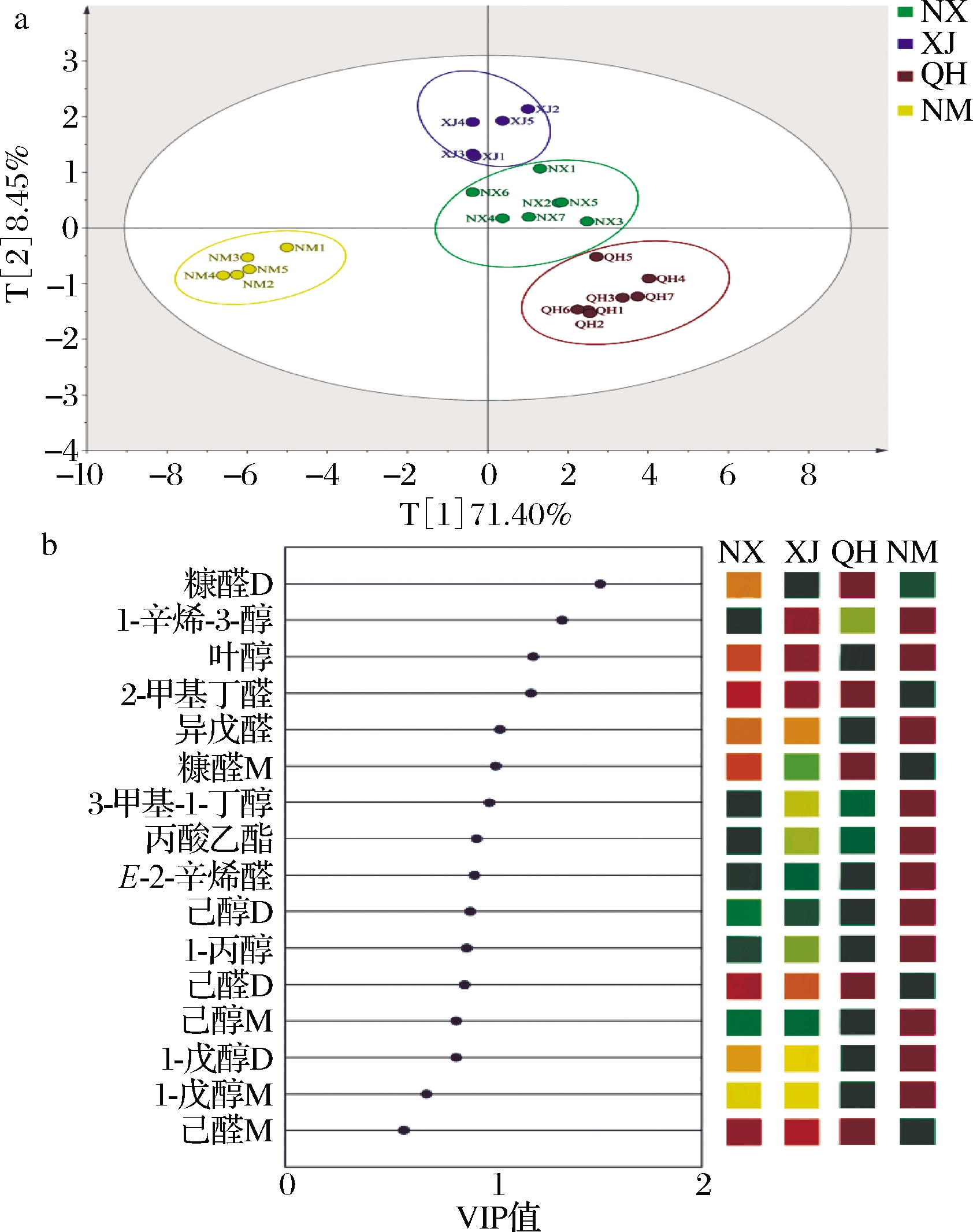
a-主成分分析;b-VIP值
图4 四个产地枸杞差异挥发性物质PLS-DA分析
Fig.4 PLS-DA analysis of different volatile substances in wolfberry from four producing areas
3 结论
枸杞是中国最具地域性的浆果之一,本研究通过HS-GC-IMS分析了来自4个产地的枸杞中风味物质的差异,发现地理环境对其中的风味化合物的形成具有重要影响。不同产区枸杞中共鉴定出36种风味化合物,醛类及醇类化合物占比较大,16种物质浓度表现出显著差异。且正丙醇为内蒙古地区枸杞中的特有物质,可作为地域性标记。通过VIP分析筛选出5种标记物质可用于区别枸杞产地,分别为糠醛(>1.5)、1-辛烯-3-醇、叶醇、2-甲基丁醛及异戊醛,通过标记性物质的含量差异分析,可以为鉴定其产品产地提供参考。但由于本次试验样本量有限,若进一步扩充样本量则可以建立更优的模型用于枸杞的产地分类,且IMS数据库还不够完善,仍有部分物质无法鉴别,需通过其他技术进一步进行定性分析。
[1] POTTERAT O.Goji (Lycium barbarum L.Chinese):phytochemistry, pharmacology and safety in the perspective of traditional uses and recent popularity[J].Planta Medica, 2010, 76(1):7-19.
[2] CHEN S Y, LIANG L N, WANG Y, et al.Synergistic immunotherapeutic effects of Lycium barbarum polysaccharide and interferon-α2b on the murine Renca renal cell carcinoma cell line in vitro and in vivo[J].Molecular Medicine Reports, 2015, 12 (5):6 727-6 737.
[3] AHN M, PARK J S, CHAE S, et al.Hepatoprotective effects of Lycium Chinese Miller fruit and its constituent betaine in CCl4-induced hepatic damage in rats[J].Acta histochemica, 2014, 116(6):1 104-1 112.
[4] GAMBOA G, VSQUEZ V, QUIROZ C, et al.Carignan phenolic composition in wines from ten sites of the Maule Valley (Chile):Location and rootstock implications[J].Scientia Horticulturae, 2018, 234:63-73.
[5] ZHANG S S, WEI Y M, WEI S, et al.Authentication of Zhongning wolfberry with geographical indication by mineral profile[J].International Journal of Food Science & Technology, 2017, 52(2):457-463.
[6] GALLEGOS J, ARCE C, JORDANO R, et al.Target identification of volatile metabolites to allow the differentiation of lactic acid bacteria by gas chromatography ion mobility spectrometry[J].Food Chemistry, 2017, 220:362-370.
[7] PUTON J, NAMIESNIK J.Ion mobility spectrometry:Current status and application for chemical warfare agents detection[J].Trac Trends in Analytical Chemistry, 2016, 85(Part B):10-20.
[8] LI M Q, YANG R W, ZHANG H, et al.Development of a flavor fingerprint by HS-GC-IMS with PCA for volatile compounds of Tricholoma matsutake Singer[J].Food Chemistry, 2019, 290:32-39.
[9] ARROYO M N, MARTIN G A, JURADO C N, et al.Target vs spectral fingerprint data analysis of Iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J].Food Chemistry, 2018, 246:65-73.
[10] CHANG M, ZHAO P Z, ZHANG T, et al.Characteristic volatiles fingerprints and profiles determination in different grades of coconut oil by HS-GC-IMS and HS-SPME-GC-MS[J].International Journal of Food Science and Technology, 2020, 55(12):3 670-3 679.
[11] 吴有锋, 马世震, 谭亮, 等.柴达木枸杞化学成分的测定[J].中成药, 2017, 39(5):984-989.
WU Y F, MA S Z, TAN L, et al.Determination of chemical consituents in Lycii Fructus from Qaidam Basin[J].Chinese Traditional Patent Medicine, 2017, 39(5):984-989.
[12] FANG Y, LIU Y, WANG B, et al.Screening of the volatile compounds in fresh and thermally treated watermelon juice via headspace-gas chromatographyion mobility spectrometry and comprehensive two-dimensional gas chromatography-olfactory-mass spectrometry analysis[J].LWT, 2021, 137:110478.
[13] 孙达, 张红艳, 程运江, 等.11个产地纽荷尔脐橙果实风味物质含量差异[J].植物科学学报, 2015, 33(4):513-520.
SUN D, ZHANG HY, CHENG Y J, et al.Contents of flavor components in Newhall Navel Oranges (Citrus sinensis) harvested from eleven production areas of China [J].Plant Science Journal, 2015, 33(4):513-520.
[14] 伊兴凯. 果实香气物质代谢谱及单糖转运体功能的研究[D].合肥:安徽农业大学, 2015.
YI X K.Aromatic metabolite profiling and functional analysis for monosaccharide transporters in fruit[D].Hefei:Anhui Agricultural University, 2015.
[15] 王元基. 干旱对苹果品质的影响及其与糖代谢的关系[D].杨凌:西北农林科技大学, 2017.
WANG Y J.Effects of drought on apple quality and its relationship with sugar metabolism[D].Yangling:Northwest A&F University, 2015.
[16] 吴中华, 李文丽, 赵丽娟, 等.枸杞分段式变温热风干燥特性及干燥品质[J].农业工程学报, 2015, 31 (11):287-293.
WU Z H, LI W L, ZHAO L J, et al.Drying characteristics and product quality of Lycium barbarum under stages-varying temperatures drying process[J].Transactions of the Chinese Society of Agricultural English, 2015, 31 (11):287-293.
[17] ZHANG Q Y, CHEN W W, ZHAO J H, et al.Functional constituents and antioxidant activities of eight Chinese native goji genotypes[J].Food Chemistry, 2016, 200:230-236.
[18] LEA U S, SLIMESTAD R, SMEDVIG P, et al.Nitrogen deficiency enhances expression of specific MYB and bHLH transcription factors and accumulation of end products in the flavonoid pathway[J].Planta, 2007, 225(5):1 245-1 253.
[19] JIA H, WANG J A, YANG Y, et al.Changes in flavonoid content and transcript levels of genes in the flavonoid pathway in tobacco under phosphorus deficiency[J].Plant Growth Regulation, 2014, 76(2):225- 231.
[20] 崔治家, 刘峰林, 张启立, 等.不同产地枸杞子中枸杞多糖含量的比较分析[J].华西药学杂志, 2020, 35(1):59-61.
CUI Z J, LIU L F, ZHANG Q L, et al.Comparative analysis of the content of Lycium barbarum polysaccharide in Lycii Fructus from different places[J].West China Journal of Pharmaceutical Science, 2020, 35(1):59-61.
[21] 段毅, 吴保祥, 徐丽, 等.不同纬度地区植物中正构烷烃及其同位素组成[J].地质学报, 2011, 85(2):262-271.
DUAN Y, WU B X, XU L, et al.Compositions of n-alkanes and their isotopes in plants from the different latitude regions in China[J].Acta Geologica Sinica, 2011, 85(2):262-271.
[22] GARRIDO D R, DOBAO P M, ARCE L, et al.Determination of volatile compounds by GC-IMS to assign the quality of virgin olive oil[J].Food Chemistry, 2016, 187:572-579.
[23] JIN J Y, ZHAO M Y, ZHANG N, et al.Stable isotope signatures versus gas chromatographyion mobility spectrometry to determine the geographical origin of Fujian Oolong tea (Camellia sinensis) sample[J].European Food Research and Technology, 2020, 246(5):955-964.
[24] JI T, DAMI I E.Characterization of free flavor compounds in traminette grape and their relationship to vineyard training system and location[J].Journal of Food Science, 2008, 73(4):262-267.
[25] RAMBLA J L, TIKUNOV Y M, MONFORTE A J, et al.The expanded tomato fruit volatile landscape[J].Journal of Experimental Botany, 2014, 65 (16):4 613-4 623.
[26] 吴有锋, 谭亮, 沈建伟, 等.柴达木枸杞中17种氨基酸的测定与分析[J].食品工业科技, 2017, 38(1):281-286.
WU Y F, TAN L, SHEN J W, et al.Determination and analysis of 17 amino acids in Qaidam Chinese wolfberry[J].Science and Technology of Food Industry, 2017, 38(1):281-286.
[27] EL HADI M A M, ZHANG F J, WU F F, et al.Advances in fruit aroma volatile research[J].Molecules, 2013, 18(7):8 200-8 229.
[28] 申济源. 基于 LOX 途径的果实香气物质形成与调控解析[D].杭州:浙江大学, 2013.
SHEN J Y.Biosynthesis and regulation of fruit aroma-related volatiles derived from the LOX pathway[D].Hangzhou:Zhejiang university, 2013.
[29] 张明霞, 吴玉文, 段长青.葡萄与葡萄酒香气物质研究进展[J].中国农业科学, 2008, 41(7):2 098-2 104.
ZHANG M X, WU Y W, DUAN C Q.Progress in study of aromatic compounds in grape and wine[J].Scientia Agricultura Sinica, 2008, 41(7):2 098-2 104.
[30] WANG X R, ROGERS K M, LI Y, et al.Untargeted and targeted discrimination of honey collected by Apis cerana and Apis mellifera based on volatiles using HS-GC-IMS and HS-SPME-GC-MS[J].Journal of Agricultural and Food Chemistry, 2019, 67(43):12 144-12 152.