副溶血弧菌(Vibrio parahaemolyticus)是一种嗜盐性病原菌,广泛分布于河口和海洋环境中,在鱼、贝、虾、蟹等海产品及腌渍食品中常可发现,能引起急性肠胃炎、败血症、伤口感染甚至死亡[1]。生物被膜是指细菌聚集黏附于生物或非生物表面后,通过生长繁殖及分泌胞外聚合物(DNA、蛋白质和胞外多糖等),将自身包裹在其中形成的具有复杂空间结构的成膜状聚合体[2]。副溶血弧菌能以生物被膜形式存在,为菌体生长提供天然保护屏障,增强膜内细菌抵抗外界不利环境、产生耐药性并导致持续性污染和感染[3]。经统计发现,副溶血弧菌是西班牙、美国、日本及世界多地导致海鲜相关肠胃炎的主要病因[4];而在国内,中国东海岸近些年共爆发与食源性致病菌相关的802病例中,约40.1%是由副溶血弧菌引起[5]。副溶血弧菌已成为威胁人类健康的主要食源性致病菌之一。
群体感应(quorum sensing,QS)是细菌之间借助信号分子进行通讯,使大量的细菌随着种群密度和物种组成变化同步调控自身特定基因的表达,从而实现改变生物学行为的一种现象[6]。研究表明,副溶血弧菌形成生物被膜及表达毒力因子等生理过程受到QS系统的调控。蒋富凤等[7]发现,受LuxM和LuxS基因调控的OpaR和AphA基因是副溶血弧菌QS系统级联信号传导机制中的2个核心调控子,与其运动性、生物被膜形成和毒力有关。李灿[8]和GUO等[9]均发现,在敲除调控副溶血弧菌合成QS信号分子的LuxM和LuxS基因后,其生长、溶血活性、tdh毒力基因表达以及生物被膜形成均受到不同程度影响。
QS抑制剂(QS inhibitors,QSIs)是具有QS淬灭作用的一类物质,不同的QSIs通过不同的方式来干扰细菌QS过程,如抑制QS信号分子的生物合成,降解信号分子,与信号分子竞争结合受体位点,以及结合以清除信号分子等[10]。乳酸菌分布广,种类多,属于公认安全性(generally recognized as safe,GRAS)菌,目前已被广泛应用于食品、医学、农业等领域中[11]。从乳酸菌中挖掘QSIs更不失为一种安全、高效的方式,目前乳酸菌源QSIs正引起学者们的关注,研究取得了一定的进展,如海洋源戊糖片球菌zy-B-1乙酸乙酯提取物能抑制单增李斯特的AI-2活性和生物被膜形成,具有良好的QSIs活性[12]。林洋等[13]从传统发酵蔬菜中得到1株植物乳杆菌SCT-2,能通过QS抑制嗜水气单胞菌生物被膜的形成,并降低其蛋白酶和嗜铁素的分泌量。本研究以副溶血弧菌QS系统为靶标,筛选出对其QS信号分子AI-2活性具有较强淬灭作用的鼠李糖乳杆菌MS1菌株,评价该菌株控制副溶血弧菌QS和生物被膜形成的效果,为开发一种绿色、安全、高效的乳酸菌源QSIs提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
16株乳酸菌(包括菌株DF1、DF2、DF4、DF5、DF6、DF9、DF12、DF14、DF15、DF16、L14、L15、L17、GK3、CG2和MS1)均为本实验室从发酵奶豆腐和发酵果汁中分离;哈维氏弧菌BB170和副溶血弧菌ATCC 17802,广东省微生物菌种保藏中心。
1.1.2 主要培养基和试剂
TSB培养基(g/L):胰蛋白胨15,大豆蛋白胨5,NaCl 30,pH 7.2。121 ℃灭菌15 min。
MRS培养基(g/L):胰蛋白胨10,牛肉膏5,酵母粉4,葡萄糖20,磷酸氢二钾1.52,乙酸钠3.53,柠檬酸三铵2,硫酸镁0.2,硫酸锰0.038, 吐温-80 1.0 mL,pH 6.0。121 ℃灭菌15 min。
AB培养基(g/L):硫酸镁12.3,NaCl 17.5,酸水解酪蛋白(不含维生素)2,用氢氧化钾溶液调节pH 7.5。121 ℃灭菌15 min后添加无菌的10 mL 1 mol/L磷酸氢二钾溶液(pH 7.5)及10 mL 0.1 mol/L L-精氨酸(pH 7.5),20 mL 50%甘油。以上所用试剂均为市售的分析纯或化学纯试剂。
结晶紫,天津福晨公司;乙酸乙酯,天津富宇公司;PI染料、PBS缓冲液,上海生工公司;FITC-ConA染料,Sigma公司。
1.1.3 仪器与设备
PL602-S电子分析天平,瑞士梅特勒-托利多公司;YXQ-LS-50A全自动高压灭菌锅,上海博讯公司;150A生化培养箱,江苏荣华公司;TS-200B恒温摇床,上海天呈公司;5417R超高速冷冻离心机,德国Eppendorf公司;1285生物安全柜,美国Thermo公司;SpectraMax i3x多功能酶标仪,美国Molecular Devices公司;梯度PCR仪,日本Takara公司;R1001-VN旋转蒸发仪、循环水式多用真空泵,郑州长城科工贸公司;光学显微镜,麦克Motic公司;EVO MA 15场发射扫描电镜,美国FEI公司;LSM 7810 DUO and LSM 7 Live激光共聚焦显微镜,德国Zeiss公司。
1.2 实验方法
1.2.1 菌株活化
乳酸菌接种于MRS培养基中,37 ℃静置培养12 h;副溶血弧菌接种于TSB培养基中,37 ℃、150 r/min培养12 h;哈维氏弧菌BB170接种于AB培养基中,30 ℃、90 r/min培养12 h。所有菌株均活化2代用于实验。
1.2.2 乳酸菌乙酸乙酯提取物的制备
将活化的乳酸菌接于MRS培养基,37 ℃培养24 h后,4 ℃、8 000 r/min离心10 min,用0.45 μm微孔滤膜过滤获得乳酸菌发酵上清液。将上清液与乙酸乙酯等比例加入分液漏斗,振荡萃取,静置过夜。待分层后,收集乳化层,于37 ℃、120 r/min进行真空旋转蒸发以除去乙酸乙酯。收集浓缩液,真空冷冻干燥成粉末(干燥器中保存)。实验前将提取物溶于TSB或AB培养基,过滤除菌,配制成质量浓度为50 mg/mL工作液,备用。
1.2.3 副溶血弧菌QSIs的筛选
采用哈维氏弧菌BB170生物发光法[14]测定经过不同的乳酸菌源QSIs处理的副溶血弧菌的AI-2活性,以筛选乳酸菌源QSIs。将活化的副溶血弧菌接种于含2 mg/mL 乳酸菌源QSIs的TSB培养基中,37 ℃、150 r/min 培养12 h。4 ℃、8 000 r/min离心10 min,收集、过滤获得无菌上清液,备用。活化后的哈维氏弧菌BB170接种于AB培养基,30 ℃、90 r/min培养12 h,调节菌液OD595nm为0.8左右,再用无菌新鲜AB培养基按1∶5 000稀释该菌液,混匀备用。按1∶50体积比将上述收集的上清液与哈维氏弧菌BB170稀释菌悬液混合。30 ℃、100 r/min摇瓶培养3 h,避光条件下吸取200 μL于黑色不透明酶标板中,以多功能酶标仪检测哈维氏弧菌BB170发光情况,以MS1-QSI未处理的副溶血弧菌为对照组。计算乳酸菌QSIs对副溶血弧菌AI-2活性的抑制率如公式(1)所示:
抑制率![]()
(1)
1.2.4 MS1-QSI对副溶血弧菌和哈维氏弧菌生长曲线的影响
采用全自动生长曲线仪进行测定。在100微型孔板孔内分别加入200 μL含MS1-QSI质量浓度为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL 的TSB或AB培养基,以未含MS1-QSI的TSB或AB培养基为对照组。将活化的副溶血弧菌或哈维氏弧菌接种于孔内。37 ℃或30 ℃培养24 h,每隔2 h测定OD600nm值。
1.2.5 MS1-QSI对副溶血弧菌群集和泳动的抑制
按照SANTHAKUMARI等[15]的方法进行并稍作修改。取2 μL上述1.2.5中培养前的含不同质量浓度MS1-QSI的副溶血弧菌菌悬液接于群集平板(1%蛋白胨、3% NaCl、0.5%琼脂和0.5%葡萄糖,pH 7.2)和泳动平板(1%胰蛋白胨、3% NaCl和0.3%琼脂,pH 7.2)中央,以未加MS1-QSI作为空白对照组。37 ℃正置培养24 h,观察2种培养基上副溶血弧菌迁移直径的变化,计算如公式(2)所示:
抑制率![]()
(2)
式中:dControl为空白对照组副溶血弧菌群集或泳动的迁移直径,mm;dQSIs为MS1-QSI处理组副溶血弧菌群集或泳动的迁移直径,mm。
1.2.6 MS1-QSI对副溶血弧菌AI-2信号分子活性影响
副溶血弧菌菌悬液加入含MS1-QSI质量浓度为0、0.2、0.4、0.8 mg/mL的TSB培养基(菌的终浓度为107 CFU/mL),混匀,于37 ℃、150 r/min培养12 h后,离心、过滤收集上清液。按照1.2.3方法测定AI-2活性。
1.2.7 MS1-QSI对胞外多糖(extracellular polysaccharides,EPS)生成的影响
按照NITHYA等[16]的方法进行。在48孔板孔内加入1 mL含MS1-QSI质量浓度为0、0.2、0.4、0.8 mg/mL的TSB培养基,副溶血弧菌菌悬液接种于孔内(菌的终浓度为107 CFU/mL),每孔放入无菌盖玻片,37 ℃温育24 h。将培养后的盖玻片放入含0.5 mL生理盐水试管中,充分振荡洗脱30 s后,加入0.5 mL 5%(体积分数)苯酚,立即振匀并加入2.5 mL浓H2SO4,振荡后测定OD490nm。抑制率计算如公式(3)所示:
抑制率![]()
(3)
式中:ODControl指空白对照组测得的EPS的OD490nm值;ODQSIs指MS1-QSI处理后测得的EPS的OD490nm值。
1.2.8 MS1-QSI对生物被膜生物量的影响
采用结晶紫染色法测定生物被膜的生物量。在96板孔内加入200 μL含MS1-QSI质量浓度为0、0.2、0.4、0.8 mg/mL的TSB培养基,副溶血弧菌菌悬液接种于孔内(菌的终浓度为107 CFU/mL),37 ℃培养24 h;移除孔内浮游菌,用PBS缓冲液轻缓清洗2~3次,60 ℃干燥固定30 min;加入0.1%结晶紫染色5 min,用PBS缓冲液轻缓清洗3次,干燥;加入33%冰乙酸脱色10 min,测定OD595nm值。
1.2.9 光学显微镜观察
在24孔板中分别加入1.5 mL含MS1-QSI质量浓度为0.8 mg/mL的TSB培养基,副溶血弧菌菌悬液接种于培养基中(菌的终浓度为107 CFU/mL),每孔中放置无菌盖玻片,37 ℃培养24 h。以未加入MS1-QSI处理的作为空白对照组;用超纯水轻缓润洗玻片,去除浮游状态菌;以结晶紫染色5 min,弃染色液,用PBS缓冲液缓慢清洗玻片,室温下晾干;用光学显微镜的油镜观察。
1.2.10 场发射扫描电镜(field emission scanning electron microscope,FESEM)观察
将1.2.8获得的生物被膜标本片,用PBS缓冲液轻缓润洗3次,加入2.5%戊二醛溶液,4 ℃固定24 h;用PBS缓冲液轻缓清洗3次,加入1%锇酸固定0.5 h;用PBS缓冲液轻缓清洗3次,用体积分数为30%、50%、70%、80%、90%乙醇各脱水10 min,最后用100%乙醇脱水2次,每次10 min;盖玻片真空干燥后喷金,扫描电镜下观察生物被膜。
1.2.11 激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察
将1.2.8获得的生物被膜标本片,用PBS缓冲液轻缓洗去玻片上的浮游菌,加入5 μL FITC Con-A染色液,4 ℃低温染色30 min;加入5 μL PI染料,低温染色15 min。上述染色和制片操作均在避光条件下进行。使用CLSM观察,激发波长为488 nm,发射波长为510 nm。
1.2.12 数据处理
实验平行进行3次,取其平均值,结果采用Graphpad prism 7.0作图,采用SPSS 25.0软件进行统计学分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 乳酸菌源QSIs的筛选
图1显示,16株乳酸菌乙酸乙酯提取物对副溶血弧菌AI-2信号分子存在不同程度的抑制作用,抑制率为7.74%~69.54%;菌株DF1、DF4、DF5、L14、GK3、CG2、MS1对副溶血弧菌AI-2活性抑制率超过50%,可作为潜在的副溶血弧菌QSIs,其中鼠李糖乳杆菌MS1乙酸乙酯提取物抑制率达69.54%,将该提取物命名为MS1-QSI,进一步研究其对副溶血弧菌的抑制效果。
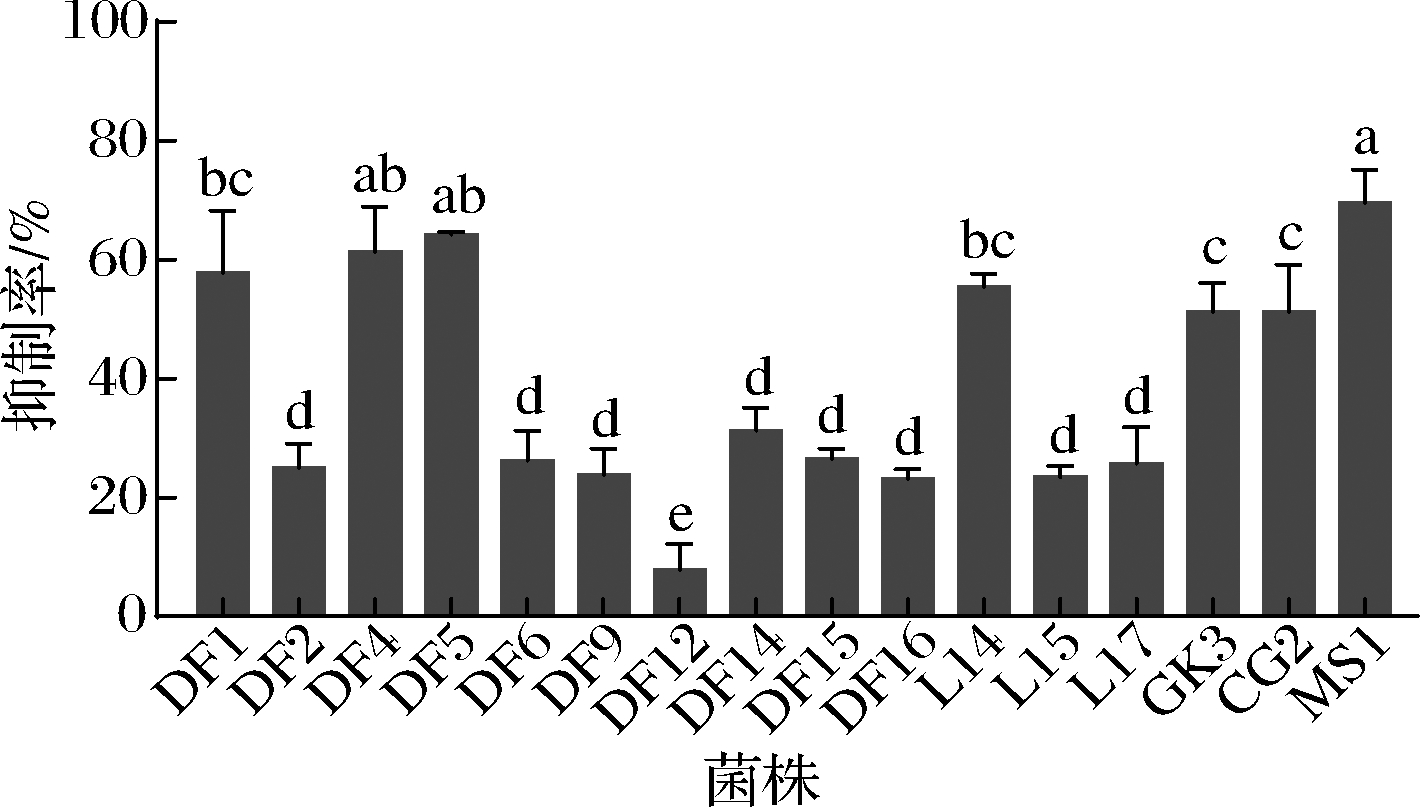
图1 乳酸菌菌株的乙酸乙酯提取物对副溶血弧菌AI-2活性的影响
Fig.1 Effects of the ethyl acetate extracts of different strains of lactic acid bacteria on AI-2 activity of V.parahaemolyticus
注:不同字母表示差异显著(P<0.05)(下同)
2.2 MS1-QSI对副溶血弧菌和哈维氏弧菌生长的影响
图2-A表明,随着MS1-QSI浓度的增加,对副溶血弧菌生长的抑制作用逐渐增强,呈现剂量依赖性;图2-B表明,MS1-QSI在添加质量浓度范围内,对哈维氏弧菌的生长基本不产生影响。为证明菌株MS1是通过抑制副溶血弧菌QS而非抑菌发挥作用,后续实验选择0.8 mg/mL及以下质量浓度的MS1-QSI进行。
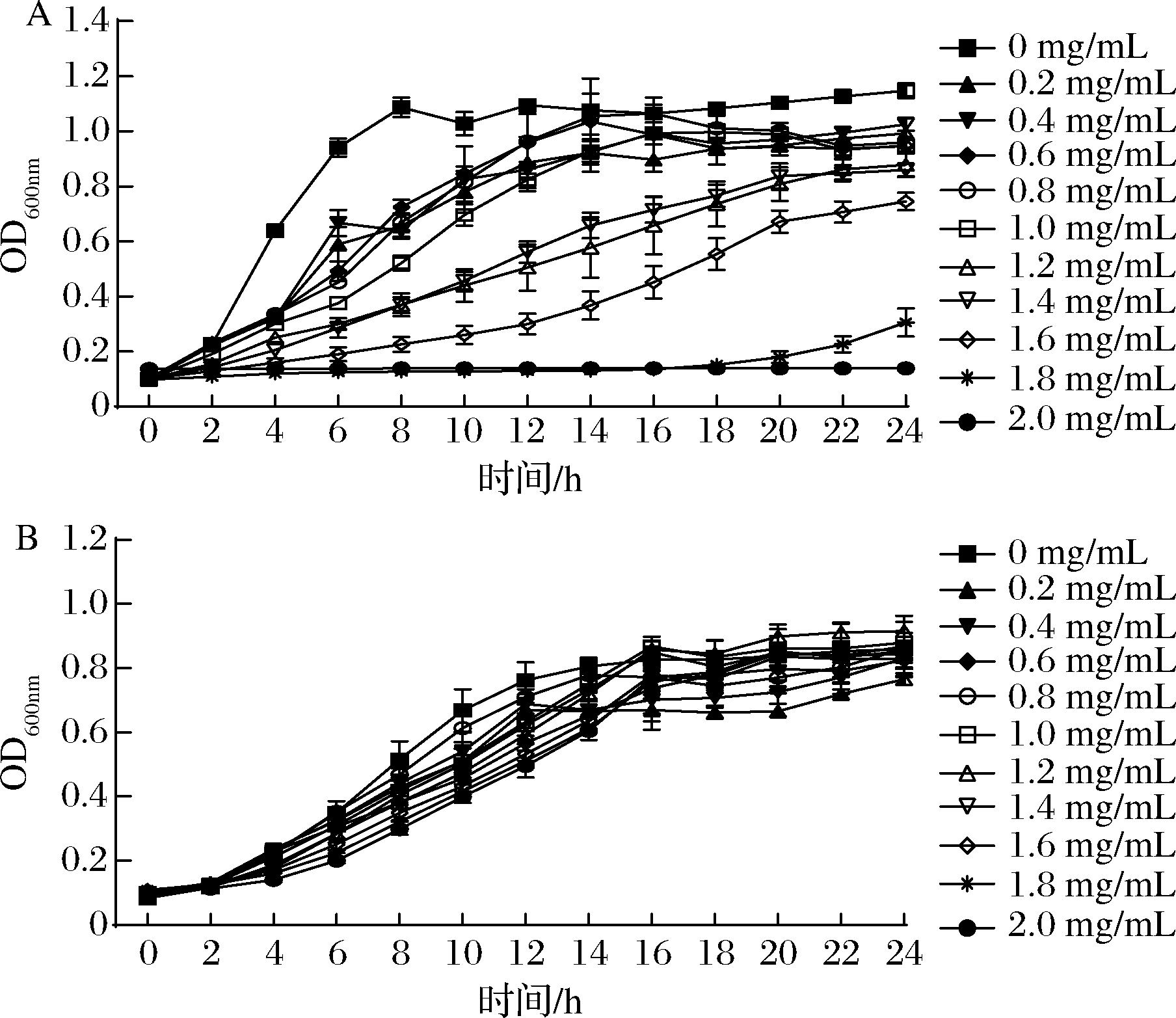
A-副溶血弧菌;B-哈维氏弧菌
图2 MS1-QSI对副溶血弧菌和哈维氏弧菌生长的影响
Fig.2 Effect of MS1-QSI on the growths of V.parahaemolyticus and V.harveyi
2.3 MS1-QSI对副溶血弧菌群集和泳动能力的影响
群集和泳动是副溶血弧菌的主要运动方式,副溶血弧菌依赖鞭毛运动有利于增强生物被膜的形成,增加对海鲜食品的污染能力及对宿主的致病性[17]。由图3可知,添加MS1-QSI后的致病菌运动范围明显缩小,且呈现浓度依赖性的抑制作用。在群集平板中,对照组的群集直径为(14.11±1.75) mm,添加0.8 mg/mL的MS1-QSI使细菌群集范围缩小至(6.68±0.34) mm,抑制率达52.67%;在泳动平板中,对照组的迁移范围靠近皿底边缘,迁移直径达(89.59±0.15) mm,表明副溶血弧菌的泳动能力强;添加0.8 mg/mL的MS1-QSI可使迁移直径降低至(43.49±1.13) mm,抑制率达51.45%。

1~4-MS1-QSI添加质量浓度分别为0、0.2、0.4、0.8 mg/mLA-副溶血弧菌群集;B-副溶血弧菌泳动
图3 MS1-QSI对副溶血弧菌群集和泳动的抑制作用
Fig.3 Inhibitory activities of MS1-QSI on swarming and swimming of V.parahaemolyticu
2.4 MS1-QSI对副溶血弧菌群体感应AI-2活性、EPS合成和生物被膜形成的影响
AI-2型QS系统能调控副溶血弧菌生物被膜的形成。EPS是维持生物被膜复杂空间结构的主要基质成分,能抵抗外界环境抗菌物质的扩散,诱导并促进细菌耐药性。图4显示,MS1-QSI对副溶血弧菌AI-2活性、EPS合成和生物被膜形成的抑制作用随质量浓度的增大而显著增加(P<0.05)。当质量浓度为0.8 mg/mL 时,MS1-QSI对AI-2活性、EPS合成和生物被膜形成的抑制率分别达65.27%、65.54%、86.91%。结果表明,MS1-QSI可有效抑制副溶血弧菌的AI-2活性及EPS合成,从而抑制生物被膜形成。
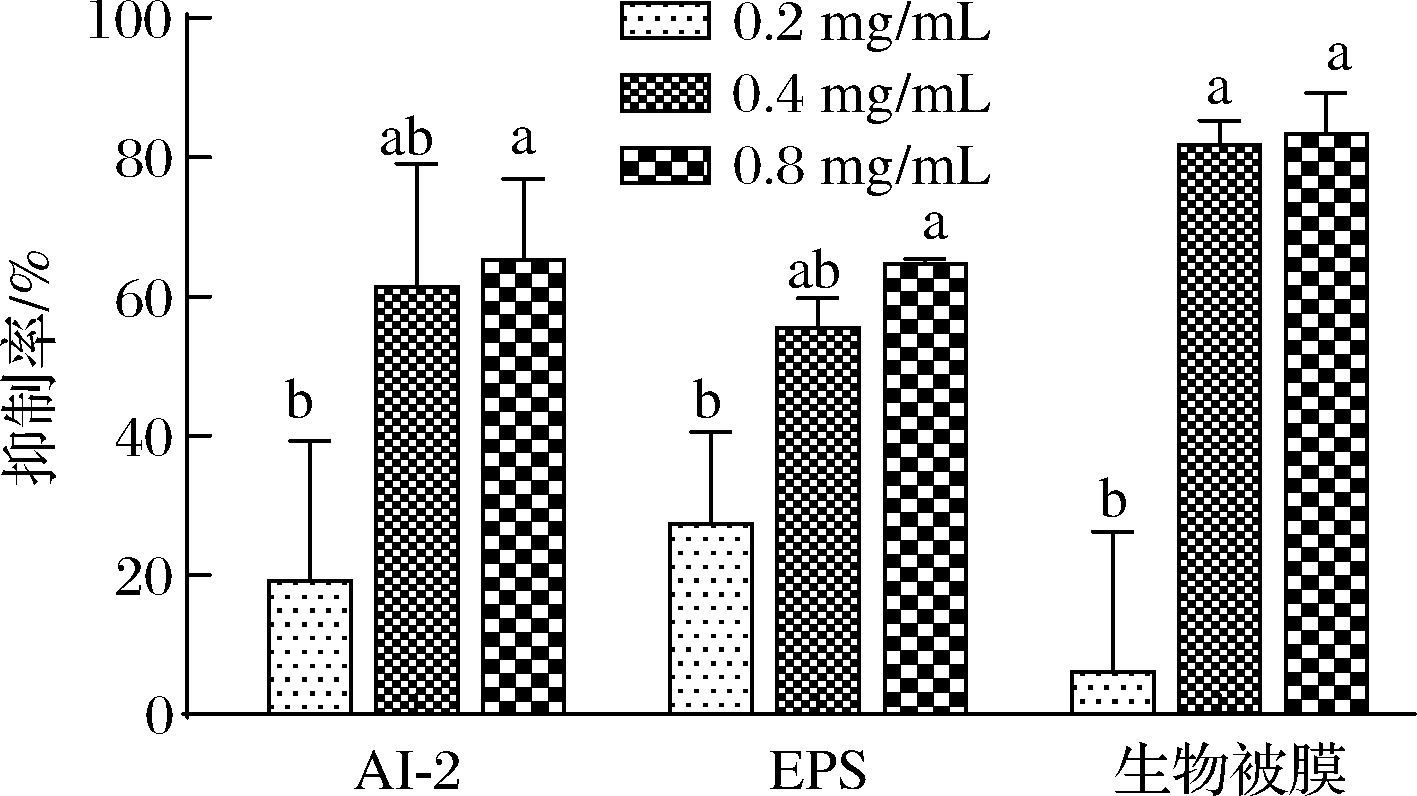
图4 MS1-QSI对副溶血弧菌AI-2活性、EPS合成和生物被膜形成的影响
Fig.4 Effect of MS1-QSI on AI-2 activity, EPS synthesis and biofilm formation of V.parahaemolyticuss
2.5 光学显微镜和FESEM观察生物被膜的变化
图5为光学显微镜和FESEM观察MS1-QSI对副溶血弧菌生物被膜的影响。在光学显微镜下,对照组中的副溶血弧菌菌落出现聚集,菌体间紧密联结,处理组的细菌分布明显稀疏。FESEM观察发现对照组的副溶血弧菌聚集成团状,形成具有明显空间特征的生物被膜,而处理后的细菌则散落分布在视野中。结果表明MS1-QSI能有效阻止副溶血弧菌的相互聚集,抑制细菌聚集体的形成从而抑制生物被膜形成。
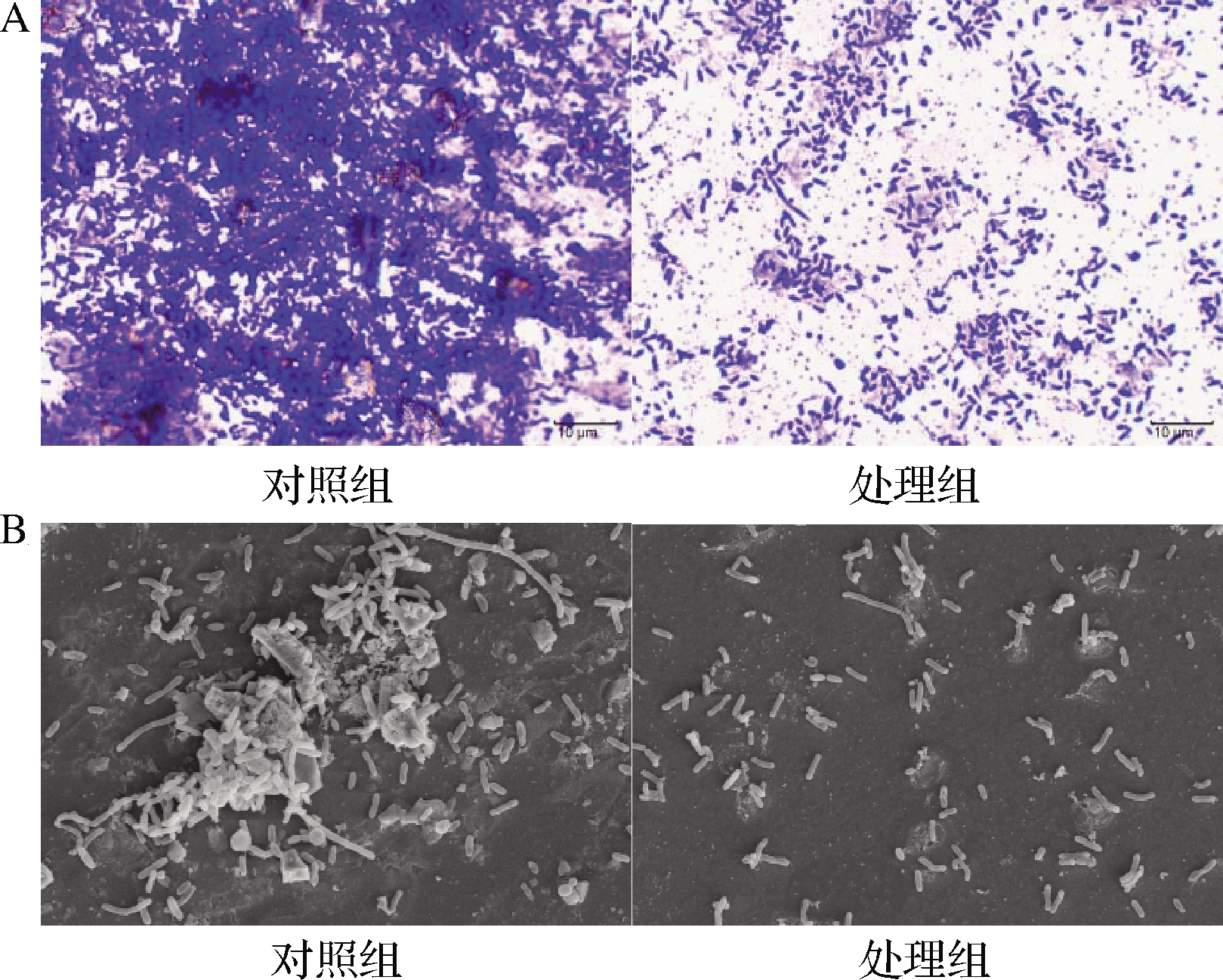
A-光学显微镜(1 000×);B-FESEM(3 500×)
图5 光学显微镜和FESEM观察MS1-QSI对副溶血弧菌生物被膜的影响
Fig.5 Observation of the biofilm of V.parahaemolyticus treated by MS1-QSI under light microscope and FESEM
2.6 CLSM观察生物被膜的变化
荧光染料结合CLSM显像技术可观察生物被膜结构和厚度情况[18]。如图6所示,对照组中的副溶血弧菌菌体连接致密,分泌大量EPS将自身包裹其中,生物被膜结构完整,具有一定厚度;处理组中的细菌疏散,生物被膜的荧光强度明显减弱,表明细菌分泌的EPS显著减少,生物被膜较对照组稀薄。
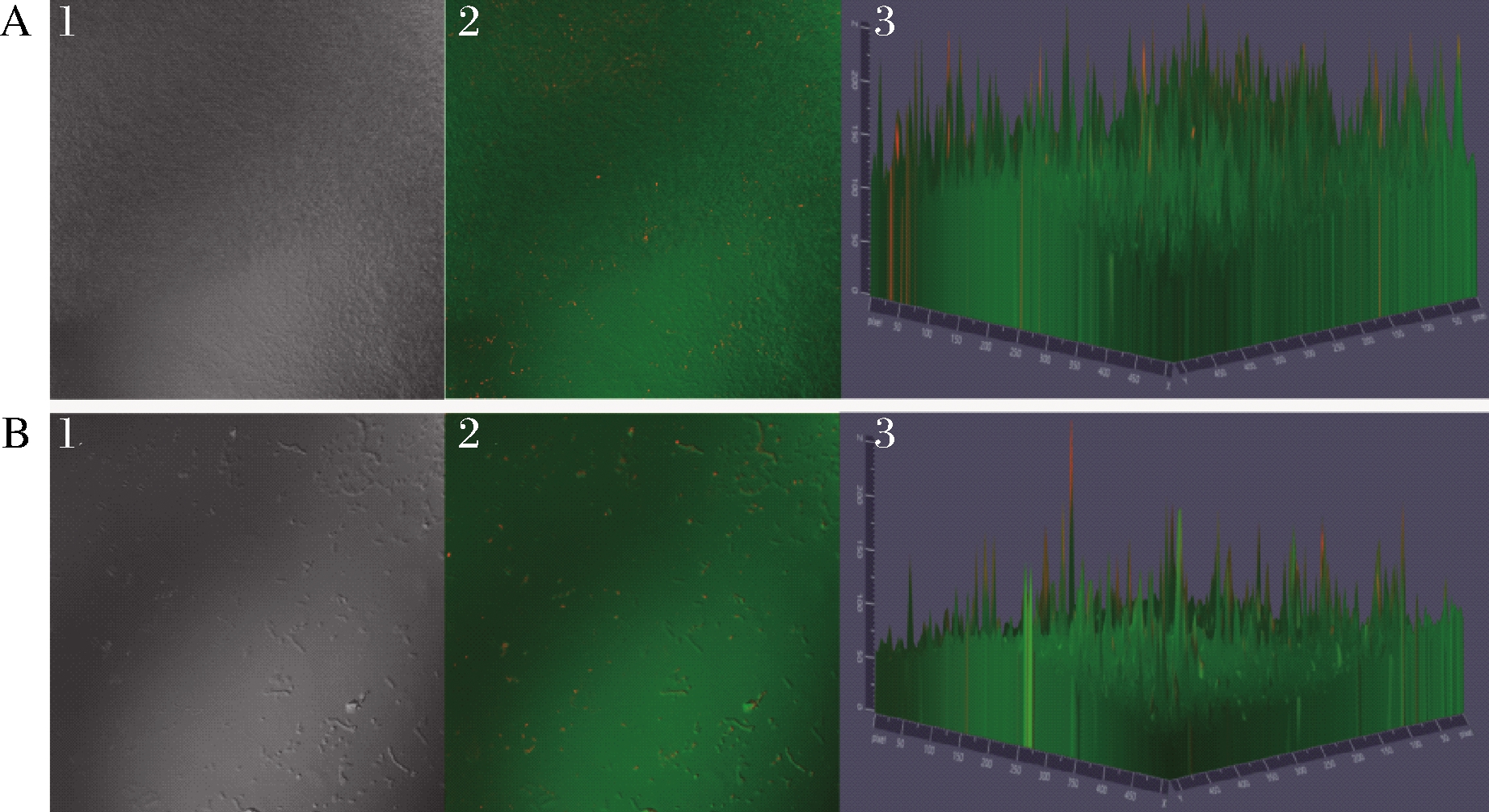
1~3-CLSM观察下生物被膜的明场、平面及其荧光强度图
A-对照组;B-处理组
图6 CLSM观察MS1-QSI对副溶血弧菌生物被膜的影响
Fig.6 Effect of MS1-QSI on the biofilm of V.parahaemolyticus
3 讨论
AI-2型QS系统参与微生物的多种重要生化过程,是近年来研究的热点,例如LuxS/ AI-2系统不仅介导铜绿假单胞菌的生长发育、生物被膜形成和致病性[19],也可通过调节外排泵SatAB基因参与猪链球菌对氟喹诺酮类抗生素的敏感性[20],还能调控肺炎球菌生物被膜与毒力等相关基因的表达[21]。以QS为靶标干扰细菌不引起细菌的耐药性,对控制食品腐败变质和食物中毒,保障食品安全具有重要意义。目前,基于QS淬灭机制的微生物源QSIs研究取得了一定进展,但目标菌多集中于铜绿假单胞菌等致病菌,对副溶血弧菌的相关研究相对匮乏,本研究以副溶血弧菌QS系统为靶标,研究对其淬灭作用较强的乳酸菌,对控制副溶血弧菌的危害,以及拓宽乳酸菌的研究和应用领域,寻找新的食品防腐保鲜措施具有积极的意义。
本研究采用哈维氏弧菌BB170生物发光法筛选得到对副溶血弧菌群体感应AI-2活性抑制作用强的乳酸菌,并从细菌生长、运动、EPS产生以及生物被膜形成4个方面探究其对副溶血弧菌QS的淬灭作用。鞭毛运动不仅介导细菌在物体表面上的初始黏附,参与、维持生物被膜空间立体结构,也有利于细菌从成熟生物被膜中脱离并发生再黏附过程[2]。鞭毛突变体的单增李斯特菌显著降低了在玻璃表面的黏附能力,形成有缺陷的生物被膜[22];ENOS-BERLAG等[23]把副溶血弧菌鞭毛基因flgE和flgD敲除后,细菌的生物被膜形成能力减弱,不产生成熟生物被膜,说明鞭毛是生物被膜形成过程中的重要决定因子。MS1-QSI在不影响副溶血弧菌正常生长前提下,能有效阻止由副溶血弧菌鞭毛主导的群集和泳动现象,这与其他乳酸菌源QSIs能通过QS系统抑制嗜水气单胞菌[24]、单增李斯特菌[12]的鞭毛运动结果相类似。EPS具有黏液性,能使细胞聚集并相互连接,从而在物体表面形成三维生物被膜结构[25]。GUVENER等[26]研究发现多糖合成基因(cpsA)受到群体感应调节因子OpaR的调控。本文研究表明MS1-QSI能显著降低副溶血弧菌AI-2活性、干扰副溶血弧菌QS系统, 影响其鞭毛运动、EPS合成和生物被膜形成能力。鼠李糖乳杆菌MS1具有良好的QS淬灭活性,有望成为控制副溶血弧菌感染和致病性的新型生物制剂,其调控副溶血弧菌QS、生物被膜形成的分子机制还有待于进一步研究。
[1] LETCHUMANAN V, CHAN K G, LEE L H.Vibrio parahaemolyticus:A review on the pathogenesis, prevalence, and advance molecular identification techniques[J].Frontiers in Microbiology, 2014, 5:705.
[2] DONLAN R M.Biofilms:Microbial life on surfaces[J].Emerging Infectious Diseases, 2002, 8(9):881-890.
[3] WHITEHEAD K A, VERRAN J.Formation, architecture and functionality of microbial biofilms in the food industry[J].Current Opinion in Food Science, 2015, 2:84-91.
[4] GHENEM L, ELHADI N, ALZAHRANI F, et al.Vibrio parahaemolyticus:A review on distribution, pathogenesis, virulence determinants and epidemiology[J].Saudi Journal of Medicine & Medical Sciences, 2017, 5(2):93-103.
[5] 魏大伟. 中国沿海地区副溶血弧菌流行病学调查及遗传多样性分析[D].杨凌:西北农林科技大学, 2018.
WEI D W.Epidemiological investigation and genetic diversity of Vibrio parahaemolyticus isolated from coastal areas of China[D].Yangling:Northwest A&F University, 2018.
[6] BORGES A, SIM ES M.Quorum sensing inhibition by marine bacteria[J].Marine Drugs, 2019, 17(7):427.
ES M.Quorum sensing inhibition by marine bacteria[J].Marine Drugs, 2019, 17(7):427.
[7] 蒋富凤, 雷涛, 吴清平, 等.副溶血性弧菌生物被膜形成及其调控机制研究进展[J].微生物学报, 2020, 60(11):2 381-2 390.
JIANG F F, LEI T, WU Q P, et al.Biofilm formation and regulation mechanism of Vibrio parahaemolyticus:Progress and trends[J].Acta Microbiologica Sinica, 2020, 60(11):2 381-2 390.
[8] 李灿. 基于群体感应分析腐败希瓦氏菌对副溶血弧菌毒力因子的影响机制[D].湛江:广东海洋大学, 2016.
LI C.The mechanism analysis of Shewanella putrefaciens to Vibrio parahaemolyticus virulence factors based on quorum sensing[D].Zhanjiang:Guangdong Ocean University, 2016.
[9] GUO M H, FANG Z J, SUN L J, et al.Regulation of thermostable direct hemolysin and biofilm formation of Vibrio parahaemolyticus by quorum-sensing genes LuxM and LuxS[J].Current Microbiology, 2018, 75(9):1 190-1 197.
[10] KALIA V C, PATEL S K S, KANG Y C, et al.Quorum sensing inhibitors as antipathogens:Biotechnological applications[J].Biotechnology Advances, 2019, 37(1):68-90.
[11] 杨晓萍, 陈梓琦, 钟先锋.乳酸菌的分离鉴定方法及益生功能应用研究[J].农产品加工, 2020(13):50-54.
YANG X P, CHEN Z Q, ZHONG X F.Advances in the isolation and identification of lactic acid bacteria and the application of probiotics[J].Farm Products Processing, 2020(13):50-54.
[12] 黄湘湄, 吴雅茜, 刘颖, 等.海洋源乳酸菌AI-2类群体感应抑制剂对单增李斯特菌抑制效果研究[J].生物技术通报, 2019, 35(4):36-42.
HUANG X M, WU Y Q, LIU Y, et al.Inhibitory effects of AI-2 quorum sensing inhibitors from marine lactic acid bacteria on Listeria monocytogenes[J].Biotechnology Bulletin, 2019, 35(4):36-42.
[13] 林洋, 孙梦桐, 吕欣然, 等.滤纸片法筛选抑制嗜水气单胞菌群体感应的乳酸菌及抑制作用分析[J].食品科学, 2018, 39(14):125-131.
LIN Y, SUN M T, LYU X R, et al.Screening of lactic acid bacteria with inhibitory activity against quorum sensing of Aeromonas hydrophila using filter paper method and their inhibitory effects[J].Food Science, 2018, 39(14):125-131.
[14] BASSLER B L, GREENBERG E P, STEVENS A M.Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi[J].Journal of Bacteriology, 1997, 179(12):4 043-4 045.
[15] SANTHAKUMARI S, KANNAPPAN A, PANDIAN S K, et al.Inhibitory effect of marine cyanobacterial extract on biofilm formation and virulence factor production of bacterial pathogens causing vibriosis in aquaculture[J].Journal of Applied Phycology.2016, 28(1):313-324.
[16] NITHYA C, DEVI M G, KARUTHA PANDIAN S.A novel compound from the marine bacterium Bacillus pumilus S6-15 inhibits biofilm formation in Gram-positive and Gram-negative species[J].Biofouling, 2011, 27(5):519-528
[17] 华姿. 柠檬醛对副溶血性弧菌致病性的抑制作用及机理的研究[D].杨凌:西北农林科技大学, 2017.
HUA Z.Inhibition of citral on virulence of Vibrio parahaemolyticus virus and the possible mode of action[D].Yangling:Northwest A&F University, 2017.
[18] 游雪娇, 李良秋, 马连营, 等.激光共聚焦扫描显微镜在抗菌机理研究中的应用[J].微生物学通报, 2015, 42(6):1 108-1 121.
YOU X J, LI L Q, MA L Y, et al.Applications of confocal laser scanning microscope in the research of antimicrobial mechanism[J].Microbiology, 2015, 42(6):1 108-1 121.
[19] CUI T Q, BAI F L, SUN M T, et al.Lactobacillus crustorum ZHG 2-1 as novel quorum-quenching bacteria reducing virulence factors and biofilms formation of Pseudomonas aeruginosa[J].LWT-Food Science and Technology, 2020, 117:108696.
[20] WANG Y, LIU B B, LI J P, et al.LuxS/AI-2 system is involved in fluoroquinolones susceptibility in Streptococcus suis through overexpression of efflux pump SatAB[J].Veterinary Microbiology, 2019, 233:154-158.
[21] YADAV M K, VIDAL J E, GO Y Y, et al.The LuxS/AI-2 quorum-sensing system of Streptococcus pneumoniae is required to cause disease, and to regulate virulence- and metabolism-related genes in a rat model of middle ear infection[J].Frontiers in Cellular and Infection Microbiology, 2018, 8:138.
[22] LEMON K P, HIGGINS D E, KOLTER R.Flagellar motility is critical for Listeria monocytogenes biofilm formation[J].Journal of Bacteriology, 2007, 189(12):4 418-4 424.
[23] ENOS-BERLAG E J L, GUVENER Z T, KEENAN C E, et al.Genetic determinants of biofilm development of opaque and translucent Vibrio parahaemolyticus[J].Molecular Microbiology, 2005, 55(4):1 160-1 182.
[24] 孙梦桐, 吕欣然, 林洋, 等.传统腌渍蔬菜中抑制嗜水气单胞菌群体感应及生物膜形成乳酸菌的筛选[J].中国食品学报, 2020, 20(7):172-180.
SUN M T, LYU X R, LIN Y, et al.Screening of lactic acid bacteria inhibiting quorum sensing and biofilm of Aeromonas hydrophila in Chinese traditional pickled vegetables[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):172-180.
[25] 张义全.AphA和OpaR对副溶血弧菌密度感应系统相关基因的转录调控机制研究[D].北京:中国人民解放军军事医学科学院, 2014.
ZHANG Y Q.Transcriptional regulation of the genes associated with quorum sensing system by AphA and OpaR in Vibrio parahaemolyticus[D].Beijing:Academy of Military Medical Sciences, 2014.
[26] GUVENER Z T, MCCARTER L L.Multiple regulators control capsular polysaccharide production in Vibrio parahaemolyticus[J].Journal of Bacteriology, 2003, 185(18):5 431-5 441.