噬菌体(phage)是感染细菌的病毒,能特异性的感染和杀死宿主菌[1-2]。近年来噬菌体作为抗生素的代替剂得到了广泛关注。与抗生素相比,噬菌体具有很多优势。抗生素可以持续存在于土壤和其他环境中,从而增加细菌耐药性进一步发生的风险[3]。噬菌体在没有宿主菌的情况下不会在环境中持续很长时间,不会对环境造成严重污染[4]。而且噬菌体专门针对某一类细菌,具有特异性。
有研究表明少数噬菌体含有致病菌的毒力因子基因,并能随噬菌体传播[5]。另外,一些溶原性噬菌体编码的毒力因子能将原本无害的细菌转化为致病菌[1]。例如,与霍乱毒素相关的CTX噬菌体[6]。此外,溶原性噬菌体通过把DNA插入到宿主菌来传播自身的DNA,也能从宿主菌中获得并传播基因片段,包括耐药性基因[5]。噬菌体携带耐药性基因在细菌之间的传播,被认为是耐药基因传播、扩散或细菌获得耐药性基因的主要途径之一[7-8]。内溶酶和穿孔素作为噬菌体裂解系统中的功能蛋白,能很好的解决噬菌体制剂存在的这些不足和缺陷。
噬菌体内溶酶(endolysin)是一种可以生物降解的蛋白质[9],具有裂解细菌的能力,能从宿主细胞内部降解细菌细胞壁。内溶酶的肽聚糖靶标十分保守,是裂解细菌细胞壁肽聚糖层的主键。与抗生素相比,细菌很难对内溶酶产生抗性[10]。此外,内溶酶还具有稳定性好、作用速度快、细胞毒性低甚至没有,以及能与现有抗生素协同等优点,使其成为有潜力的新型抗菌物质[11-12]。穿孔素(holin)能调控由内溶酶介导的宿主细胞裂解[13]。穿孔素的2个基本作用是在细胞膜上制造小孔以释放内溶酶和决定感染周期的结束时间。穿孔素在宿主的细胞质中积累,累积到特定的浓度后在细胞膜上形成小孔,使内溶酶能够通过细胞膜并降解肽聚糖[14-15]。与内溶酶不同,它对革兰氏阳性菌和革兰氏阴性菌均具有广谱的非特异性抗菌活性[16]。与单纯的内溶酶制剂相比,联合使用穿孔素和内溶酶制剂是一种有效控制革兰氏阳性菌的方法[17]。内溶酶和穿孔素可以直接作用于细胞壁或细胞膜,不需要经过噬菌体与细菌吸附、核酸注入和复制等过程,因此具有更高的效率[18-19]。并且这2种蛋白在保留噬菌体宿主特异性的前提下,具有比噬菌体更宽的宿主谱[20]。此外,内溶酶和穿孔素作为蛋白质,比噬菌体更容易被大众接受。
在前期的工作中,本实验室分离得到1株大肠杆菌(Escherichia coli)O157∶H7噬菌体EC-p9和沙门氏菌(Salmonella)噬菌体SM-p2,表达纯化了EC-p9和SM-p2的内溶酶和穿孔素(Lys 9、Hol 9和Lys 2、Hol 2)。本研究通过平板菌落计数法研究了这4种蛋白的裂解活性,评估这4种蛋白对温度和pH的稳定性,以及细菌是否会对这4种重组蛋白产生抗性。由此来对噬菌体内溶酶和穿孔素的功能进行评价。为更好地利用内溶酶和穿孔素提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和噬菌体
大肠杆菌O157∶H7(NCTC 12900)和沙门氏菌(CGMCC 1.0090)分别购于英国菌种保藏中心和中国科学院微生物学研究所(北京)。单增李斯特菌(ATCC 19115)贮存在实验室超低温冰箱。噬菌体为本实验室分离保存的烈性大肠杆菌 O157∶H7噬菌体EC-p9和烈性沙门氏菌噬菌体SM-p2。内溶酶和穿孔素为本实验室表达纯化的噬菌体EC-p9和SM-p2的内溶酶和穿孔素Lys 9、Hol 9和Lys 2、Hol 2。
1.1.2 试剂与培养基
LB肉汤、胰酪胨大豆肉汤培养基(trypticase soy broth,TSB)、胰酪胨大豆琼脂培养基(tryptose soya agar,TSA)、BHI肉汤和PALCAM琼脂,青岛高科园海博生物技术有限公司;醋酸钠、甘氨酸、磷酸、氯化锌、碳酸钠、邻硝基苯-β-D-吡喃半乳糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG)、NaH2PO4、盐酸、氯化钠、氯化钙、氢氧化钠,成都市科龙化工试剂厂;琼脂粉,Gentihold;Tris、结晶紫,索莱宝生物技术有限公司。所有试剂均为分析纯,所有水均为二次蒸馏水。
1.1.3 仪器与设备
YX280A型高压灭菌锅,上海三申医疗器械有限公司;SQP型电子天平、PB-10型pH仪,Sartorius;SW-CJ-FD型超净工作台,苏州安泰空气技术有限公司;Mill-Q型纯水系统,Merck Millipore;U410型超低温冰箱,NEW BRUNSWICK Premium;BCD-649 W型普通冰箱,青岛海尔股份有限公司;UV-1600型紫外可见分光光度仪,北京普析通用仪器有限责任公司;THZ-D型恒温摇床,江苏太仓市实验设备厂;5810R型冷冻高速离心机,Eppendorf;MX-F型微型涡旋混合仪、DK-98-II型万用电炉、DHP-9272型恒温培养箱,上海泸西分析仪器有限公司。
1.2 实验方法
1.2.1 细菌的培养
从-80 ℃超低温冰箱取出大肠杆菌O157∶H7或沙门氏菌分别平板划线于TSA板,然后37 ℃过夜培养。取单菌落接种于20 mL的LB肉汤或BHI肉汤中,37 ℃,120 r/min培养16 h。
1.2.2 内溶酶和穿孔素的杀菌活性测定
1.2.2.1 杀菌活性
将过夜培养的大肠杆菌O157∶H7或沙门氏菌在8 000×g离心5 min,去除上清液。用Tris-NaCl缓冲液洗涤细菌沉淀2次,然后重悬于Tris-NaCl缓冲液,用Tris-NaCl缓冲液调整重悬液使OD600为1.0。将100 μL细菌悬浮液放入96孔板中。实验组加入100 μL 已知浓度的亲和纯化的重组蛋白,其中Lys 9和Hol 9用于处理大肠杆菌O157∶H7;Lys 2和Hol 2用于处理沙门氏菌。对照组加入不含重组蛋白的缓冲液。将96孔板放置于37 ℃,每隔10 min测定细菌的菌落数,共60 min。酶的裂解活性计算入公式(1)所示:
酶的裂解活性![]()
(1)
1.2.2.2 重组蛋白的最小抑菌浓度
将过夜培养的大肠杆菌O157∶H7、沙门氏菌和单增李斯特菌用培养基稀释到106 CFU/mL。然后用培养基对Lys 9、Lys 2、Hol 9和Hol 2进行2倍比稀释。取0.5 mL不同浓度的重组蛋白溶液分别与4.5 mL稀释后菌液混合,加入试管。置于37 ℃培养箱中过夜培养。以没有肉眼可见的细菌生长的最低浓度为重组蛋白的最小抑菌浓度(minimal inhibitory concentration, MIC)。用不含重组蛋白的试管作为阳性对照,菌液出现明显浑浊则表明实验有意义。
1.2.3 重组蛋白的稳定性
将过夜培养的大肠杆菌O157∶H7和沙门氏菌在8 000×g离心5 min,用Tris-NaCl缓冲液洗涤2次并重悬于Tris-NaCl缓冲液,使OD600值为1.0,测定细菌数量为初始细菌数。Lys 9和Hol 9的稳定性用其对大肠杆菌O157∶H7的裂解活性进行评估;Lys 2和Hol 2则用其对沙门氏菌的裂解活性进行评估。
为了评价不同温度对内溶酶和穿孔素酶活性的影响,将蛋白分别在4、25、37、50、60、70、80、90 ℃下处理15 min,在96孔板中加入150 μL的细胞重悬液和不同温度下处理的50 μL终浓度为MIC的重组蛋白,将96孔板放置在37 ℃处理30 min,测定菌落数并计算酶的裂解活性。
为了评价不同pH对内溶酶和穿孔素酶活性的影响,pH 4.2和pH 5.2的20 mmol/L醋酸钠、pH 6.2的10 mmol/L磷酸、pH 7.2的10 mmol/L PBS、pH 8.2的20 mmol/L Tris-HCl和pH 9.2的20 mmol/L甘氨酸-NaOH代替Tris-NaCl缓冲液重悬细菌细胞。在96孔板中加入150 μL的细胞重悬液和50 μL终浓度为MIC的重组蛋白,对照组用Tris-NaCl缓冲液重悬细胞。将96孔板放置在37 ℃处理30 min,测定菌落数并计算酶的裂解活性。
1.2.4 细菌对内溶酶和穿孔素抗性产生的分析
将大肠杆菌O157∶H7和沙门氏菌分别涂布在2个不同的TSA平板上。将10 μL Lys 9和Hol 9(浓度为MIC)滴加在含有大肠杆菌O157∶H7的TSA平板上。将10 μL Lys 2或Hol 2(浓度为MIC)滴加在含有沙门氏菌的TSA平板上。将平板在37 ℃倒置培养8 h,在不清晰抑菌圈的边缘挑取菌落加入LB肉汤或BHI肉汤中在37 ℃、120 r/min培养8 h后,涂布在TSA平板。重复以上操作,共循环7代。并在第7代的基础上挑取单菌落到LB或BHI培养基中连续培养5代(不与重组蛋白作用),分别检测内溶酶对每一代酶的裂解活性。
1.2.5 穿孔素对细菌细胞膜通透性的检测
ONPG作为β-半乳糖苷酶的底物,可以用来检测细菌悬液中β-半乳糖苷酶的活性,间接探究细菌细胞膜的通透性。将大肠杆菌O157∶H7和沙门氏菌在37 ℃培养至OD600值为0.6,5 000×g离心10 min,弃上清液,用0.05 mol/L NaH2PO4缓冲液洗涤3次后重悬,使其OD600值约为0.2。用终浓度为2 MIC的重组蛋白进行处理后,取5 mL菌液12 000×g离心15 min。然后将1 mL上清液与4 mL 0.05 mol/L ONPG溶液混匀,在37 ℃水浴反应30 min。随后加入5 mL 0.5 mol/L Na2CO3溶液终止反应,并测量OD420值。酶活力计算如公式(2)所示:
β-半乳糖苷酶活力/(U·mL-1)=(OD420×V)/(t×Vs×0.004 5)
(2)
式中:V,反应混合液体积,5 mL;t,反应时间,30 min;Vs,样品体积,5 mL;0.004 5,消光系数,mL/nmoL。换算后如公式(3)所示:
β-半乳糖苷酶活力/(U·mL-1)=OD420×7.407 4
(3)
1.2.6 内溶酶和穿孔素的联合抑菌作用
选择大肠杆菌O157∶H7为底物,对重组内溶酶Lys 9、穿孔素Hol 9及其组合物的杀菌能力进行检测分析。将过夜培养的大肠杆菌O157∶H7菌液用Tris-NaCl缓冲液洗涤重悬,并调节OD600值至0.8~1.0;取450 μL菌液分别加入50 μL终浓度为2 MIC 的Lys 9或Hol 9;取450 μL菌液加入50 μL Lys 9和Hol 9的组合物,Lys 9和Hol 9的终质量浓度分别为2.5、1.4 mg/mL,在37 ℃培养1 h后测定菌落数。
选择沙门氏菌为底物,对重组内溶酶Lys 2、穿孔素Hol 2及其组合物的杀菌能力进行检测分析。方法如上所述,内溶酶Lys 2和穿孔素Hol 2组合物加入菌液后,Lys 2和Hol 2的终浓度分别为1.2 mol/mL和1.0 mg/mL。
1.2.7 统计分析
本研究所有实验均重复3次。本研究中所得数据在Excel 2016中统计,所有细菌菌落数(CFU/mL)和噬菌体滴度(PFU/mL)转化为以10为底对数,单位分别为lgCFU/mL和lgPFU/mL。使用GraphPad Prism 8.0绘制图表,运用ANOVA进行单因素方差分析。所有数据均采用SPSS 22.0(Duncan)进行显著性分析。P<0.05表示差异显著。
2 结果与分析
2.1 重组蛋白的杀菌活性测定
利用纯化后的Lys 9、Hol 9、Lys 2、Hol 2验证其在体外的裂解能力。结果如图1所示,Lys 9、Hol 9、Lys 2和Hol 2的裂解活性分别在30、20、40、30 min后逐渐保持稳定,最高的裂解活性分别为61.348%、81.120%、74.251%和83.356%。
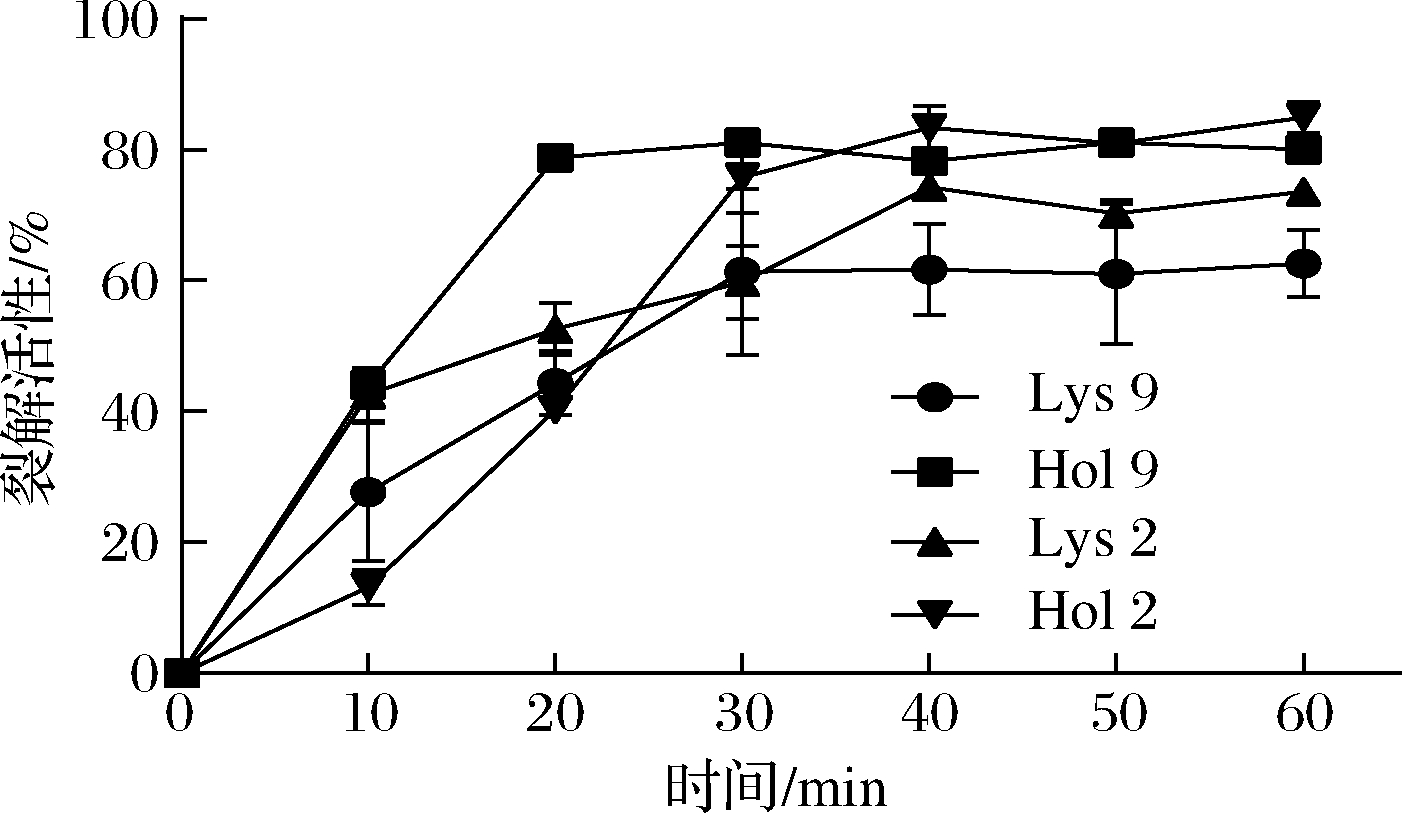
图1 重组蛋白的裂解活性
Fig.1 Lytic activity of recombinant protein
2.2 重组蛋白的MIC
重组蛋白对大肠杆菌O157∶H7,沙门氏菌和单增李斯特菌的MIC如表1所示。4种重组蛋白MIC不同,其中Lys 9对大肠杆菌O157∶H7和沙门氏菌的MIC≥0.25 mol/mL,对单增李斯特≥0.125 mol/mL;Hol 9对大肠杆菌O157∶H7和沙门氏菌的MIC≥0.14 mol/mL,对单增李斯特≥0.28 mol/mL;Lys 2对大肠杆菌O157∶H7和沙门氏菌的MIC≥0.12 mol/mL,对单增李斯特≥0.06 mol/mL;Hol 2对大肠杆菌O157∶H7和沙门氏菌的MIC≥0.10 mol/mL,对单增李斯特≥0.20 mol/mL。Lys 9和Lys 2对单增李斯特菌的MIC小于其他2种菌,这是因为单增李斯特菌属于革兰氏阳性菌。与革兰氏阴性菌相比,革兰氏阳性菌没有细胞壁外膜的阻隔,内溶酶更容易与细菌细胞壁的肽聚糖接触并导致细菌死亡[21-22]。
表1 重组蛋白的MIC 单位:mol/mL
Table 1 The MIC of recombinant protein
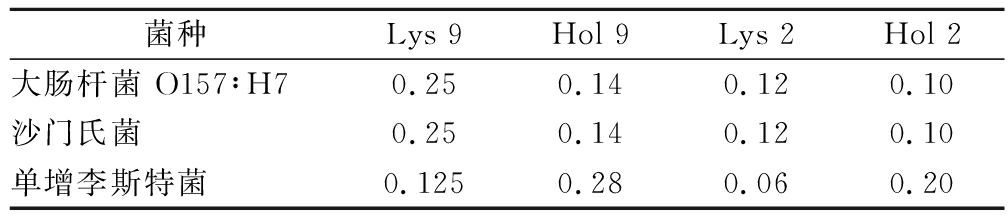
菌种Lys 9 Hol 9 Lys 2 Hol 2 大肠杆菌 O157∶H7 0.25 0.14 0.12 0.10 沙门氏菌 0.25 0.14 0.12 0.10 单增李斯特菌 0.125 0.28 0.06 0.20
2.3 温度对重组蛋白稳定的影响
重组蛋白用不同的温度处理后,对细菌的裂解活性如图2所示。4种重组蛋白在70、80、90 ℃处理15 min后完全丧失裂解活性。4、25、37 ℃处理15 min后,Lys 9 和Hol 9的裂解活性没有显著性差异(P>0.05);随着处理温度升高到50、60 ℃,Lys 9的裂解活性与4 ℃相比显著降低了17.00%和33.67%(P<0.05);在50 ℃处理15 min后,Hol 9的裂解活性为44.15%,与4 ℃相比降低了34.68%;在60 ℃处理15 min后,Hol 9完全丧失裂解活性。4、25 ℃处理Lys 9 和Hol 9,其裂解活性没有显著性差异(P>0.05),但随着温度从25 ℃上升至60 ℃,Lys 9的裂解活性从70.34%降低到42.65%;Hol 2的裂解活性从80.94%降低到13.23%。上述结果表明,在4、25、37 ℃时,这4种蛋白的裂解活性稳定;在50 ℃时,这4种蛋白未完全失活,仍然具有裂解细菌的能力。
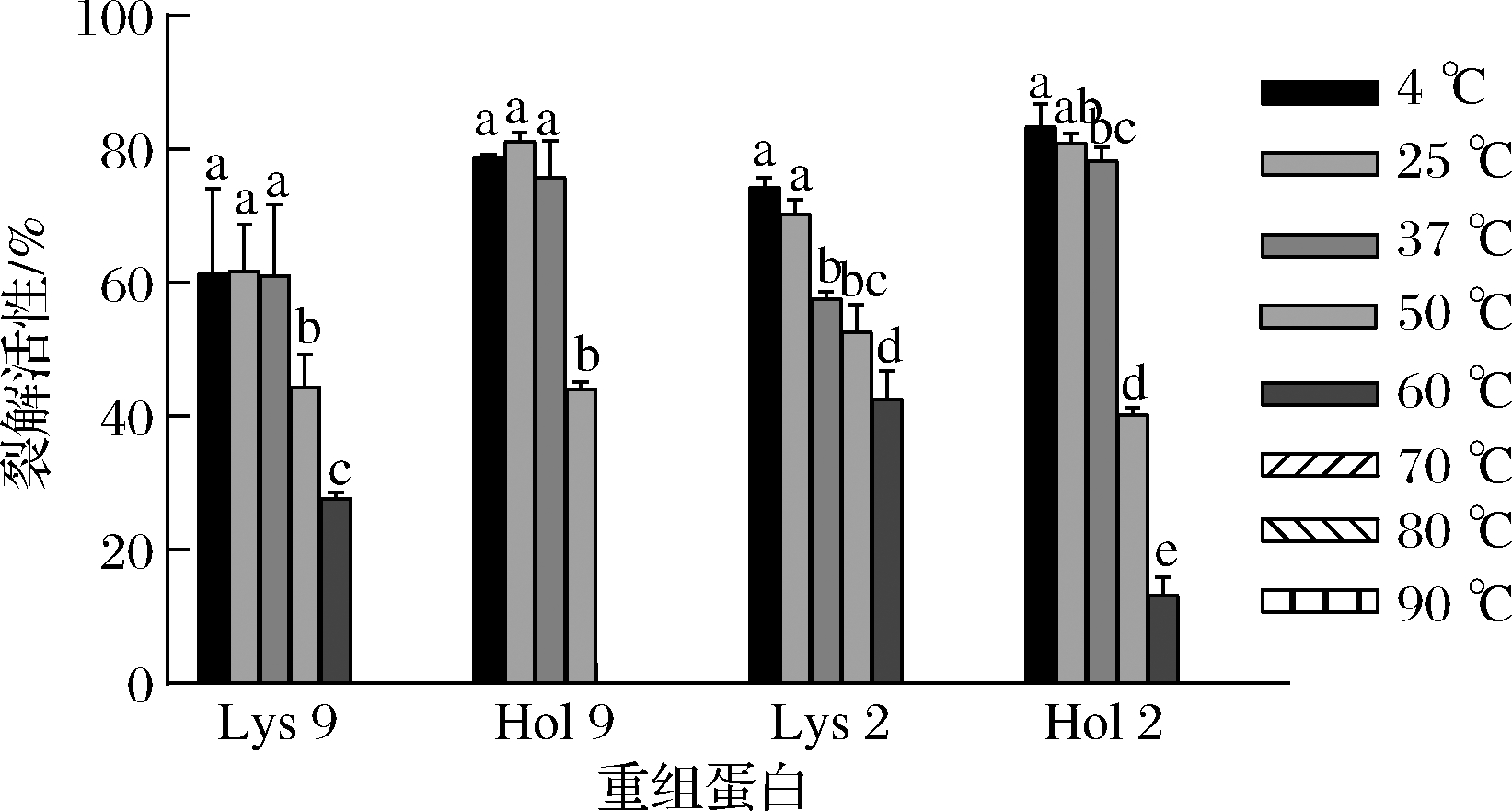
图2 温度对重组蛋白稳定性的影响
Fig.2 Effect of temperature on the stability of recombinant protein
注:不同小写字母表示差异显著(P<0.05)(下同)
2.4 pH对重组蛋白稳定性的影响
重组蛋白在不同pH环境中的裂解活性如图3所示。Lys 9、Hol 9和Lys 2在pH为8时,裂解活性最强,分别为62.62%、81.12%和80.00%,Hol 2在pH为7的环境下裂解活性最强为83.36%,且这4种重组蛋白的裂解活性在pH为7和8时,没有显著性差异(P>0.05)。Lys 9和Lys 2在pH为4~10时较为稳定,且在pH为3时,Lys 9和lys 2依然保持裂解活性,分别为22.61%和4.47%;Hol 9和Hol 2在pH为3时完全丧失列裂解活性,且在pH为4时,裂解活性仅为1.35%和9.01%;pH ≥11时,Hol 9和 lys 2 丧失裂解活性;总的来说,这4个重组蛋白对pH有较高的稳定性且在中性和弱碱性条件下表现出最高的裂解活性。
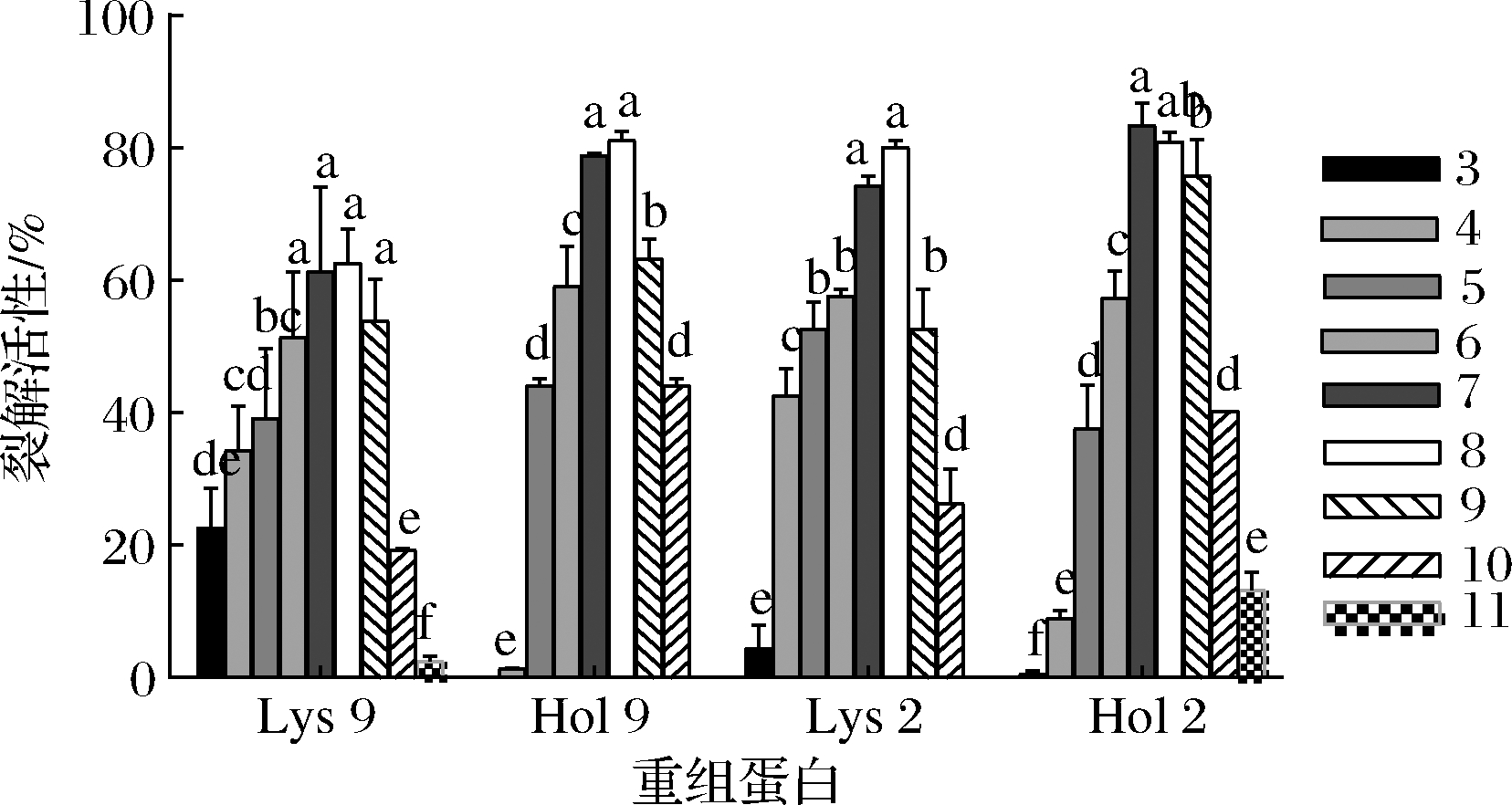
图3 pH对重组蛋白稳定性的影响
Fig.3 Effect of pH on the stability of recombinant protein
2.5 细菌对重组蛋白产生抗性的情况
重组蛋白具有很宽的裂解谱和很强的杀菌能力,预示着其应用前景十分广泛。但宿主菌在进化的过程中是否会对4种重组蛋白产生抗性,还需要进一步验证。如图4所示,在连续传代12代后,每一代的细菌对4种重组蛋白的敏感性都没有显著降低(P>0.05),表明在12代内细菌不会对Lys 9、Lys 2、Hol 9和Hol 2产生抗性。

图4 细菌对重组蛋白的抗性
Fig.4 The bacteria resistance to recombinant proteins
2.6 穿孔素对细菌细胞膜通透性检测
穿孔素是在宿主的细胞质膜中形成非特异性的孔或损伤,当细胞膜受到破坏损伤时,一部分细胞内合成β-半乳糖苷酶会泄漏到细胞外。该酶能分解ONPG,生成黄色的邻硝基酚,然后通过溶液颜色变化检测β-半乳糖苷酶活性。因此,细胞外β-半乳糖苷酶的酶活性可以作为一个参数用来间接评价细胞膜通透性是否发生变化。结果如图5所示,经Hol 9和Hol 2处理的大肠杆菌和沙门氏菌悬液中的OD600值显著高于未处理组(P<0.05)。这表明,这两种穿孔素处理的菌悬液中的β-半乳糖苷酶的酶活力明显高于未处理组,β-半乳糖苷酶从胞内流出。因此可以推断,Hol 9和Hol 2影响了细菌细胞膜的通透性。
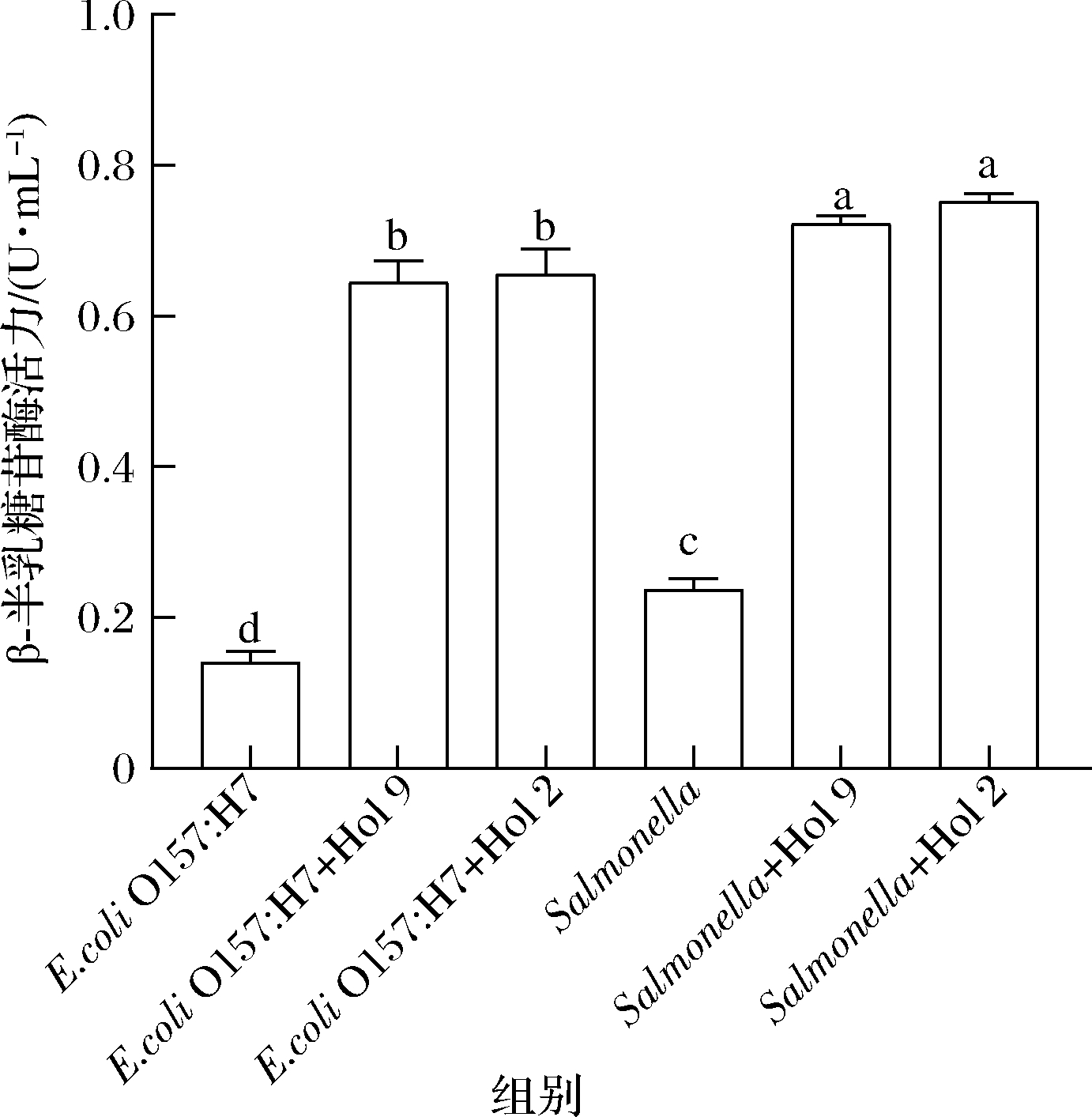
图5 穿孔素对细菌细胞膜通透性的影响
Fig.5 Effect of holin on membrane permeability
2.7 内溶酶和穿孔素的联合抑菌作用
本研究中4种重组蛋白都具有抑菌能力,见图6。本实验通过平板菌落计数实验测定Lys 9和Hol 9联合应用对大肠杆菌的抑制作用和Lys 2和Hol 2联合应用对沙门氏菌的抑制作用。图6显示,Lys 9和Hol 9联合应用1 h 后,大肠杆菌的数量下降了约3 lgCFU/mL,显著高于单独使用Lys 9或Hol 9(P<0.05);Lys 2和Hol 2联合应用1 h 后,沙门氏菌的数量下降了约4 lgCFU/mL,显著高于单独使用Lys 2或Hol 2(P<0.05)。这表明穿孔素和内溶酶在抑制病原菌上表现出协同作用。
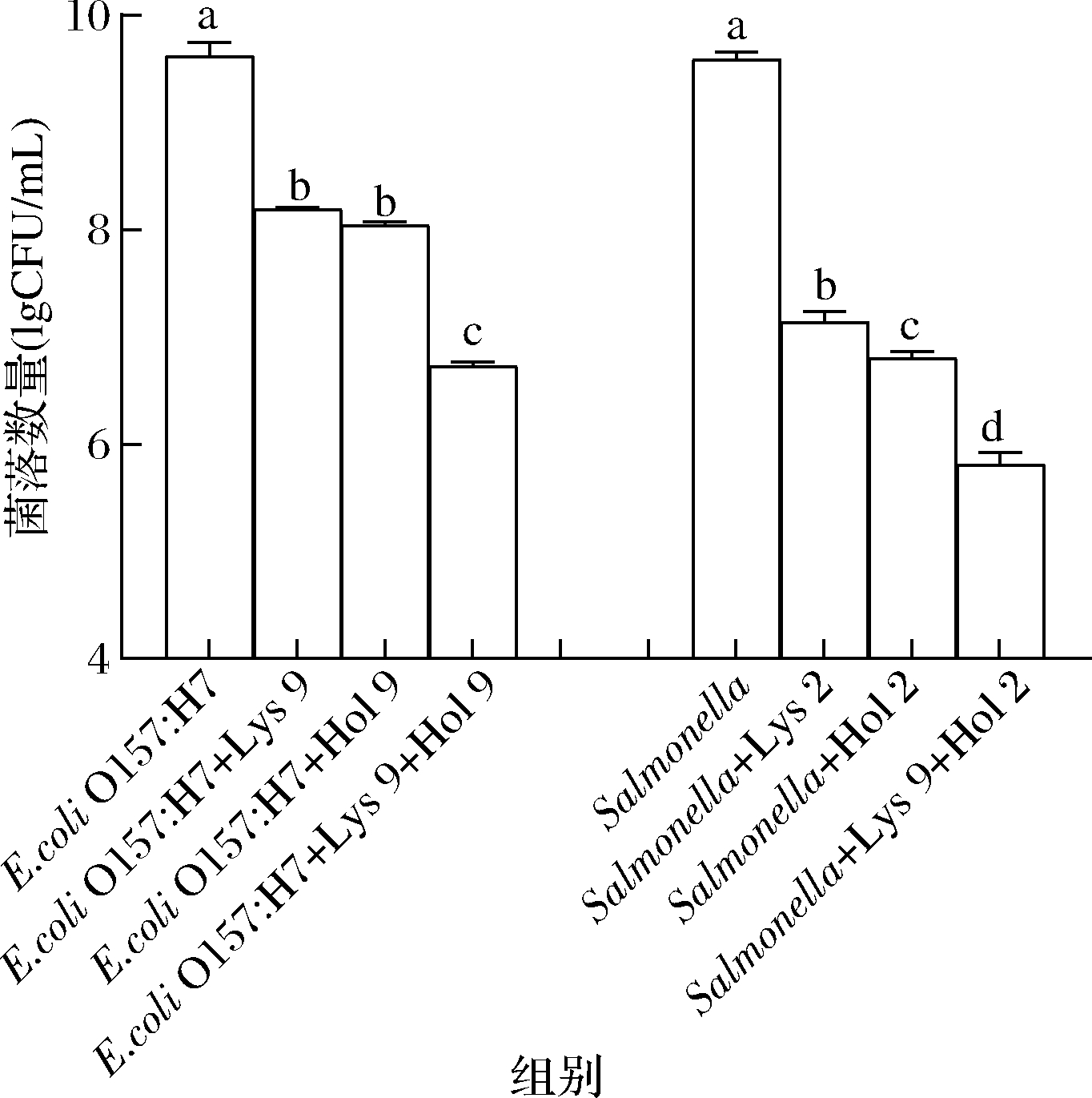
图6 内溶酶和穿孔素的联合抑菌作用
Fig.6 Bacteriostatic effect of endolysin and holing
3 结论
生化特征表明Lys 9和Lys 2具有中性或者弱碱性,因为在中性或弱碱性条件下,这2种蛋白活性相对较高。Lys 9、Hol 9、Lys 2和Hol 2在4 ℃时表现出较高的活性,然而,在60 ℃时还具有活性,表明这4种蛋白具有热稳定性,其在预防和治疗病原细菌方面的实际应用,具有明显的优势。内溶酶已经应用于控制家禽的体外或体内革兰氏阳性致病菌的感染;能有效去除顽固的生物被膜[23];能控制牛奶和水果中的致病菌[24]。这4种蛋白具有广谱的杀菌活性和很强的杀菌能力,使其可以作用于多种病原菌,能够来预防食源性致病菌引起的疾病。穿孔素和内溶酶还展现出协同抑菌作用。细菌很难对噬菌体内溶酶和穿孔素产生抗性,这主要是由于内溶酶和穿孔素作用的细菌细胞壁和细胞膜的结构相对保守不容易产生变异。这些数据表明内溶酶和穿孔素作为一种新型的抑菌物质具有很大的潜力和巨大发展空间。
[1] O′SULLIVAN L, BOLTON D, MCAULIFFE O, et al..Bacteriophages in food applications:From foe to friend[J].Annual Review of Food Science and Technology, 2019, 10:151-172.
[2] 胡颖,李洪军,贺稚非.噬菌体防控食源性致病菌的研究进展[J].食品与发酵工业, 2019, 45(1):246-251.
HU Y, LI H J, HE Z F.Research progress on bacteriophages for preventing and controlling foodborne pathogens[J].Food and Fermentation Industries, 2019, 45(1):246-251.
[3] TADEO J L.Analysis of Pesticides in Food and Environmental Samples[M].Boca Raton:CRC Press, 2019.
[4] ACKERMANN H W.Classification of Bacteriophages[M].Oxford University Press, 2006.
[5] 闫广谋.大肠杆菌噬菌体裂解酶突变体与融合蛋白Colicin-Lysep3的构建及其菌外裂解活性的研究[D].长春:吉林大学, 2019.
YAN G M.Study on construction and exogenous lytic mechanism of bacteriophage lysin mutants of E.coli and Colicin-Lysep3 fusion protein[D].Changchun:Jilin University, 2019.
[6] BOYD E F, MOYER K E, SHI L, et al.Infectious CTXØ and the Vibrio pathogenicity island prophage in Vibrio mimicus:Evidence for recent horizontal transfer between V.mimicus and V.cholerae[J].Infection and Immunity, 2000, 68(3):1 507-1 513.
[7] KUTTER E, DE VOS D, GVASALIA G, et al.Phage therapy in clinical practice:Treatment of human infections[J].Current Pharmaceutical Biotechnology, 2010, 11(1):69-86.
[8] BROWN-JAQUE M, CALERO-C CERES W, MUNIESA M.Transfer of antibiotic-resistance genes via phage-related mobile elements[J].Plasmid, 2015, 79:1-7.
CERES W, MUNIESA M.Transfer of antibiotic-resistance genes via phage-related mobile elements[J].Plasmid, 2015, 79:1-7.
[9] NELSON D C, SCHMELCHER M, RODRIGUEZ-RUBIO L, et al.Endolysins as antimicrobials[J].Advances in Virus Research, 2012, 83:299-365.
[10] FISCHETTI V A.Bacteriophage lytic enzymes:Novel anti-infectives[J].Trends in Microbiology, 2005, 13(10):491-496.
[11] FISCHETTI V A.Development of phage lysins as novel therapeutics:A historical perspective[J].Viruses, 2018, 10(6):E310.
[12] ABDELKADER K, GERSTMANS H, SAAFAN A, et al.The preclinical and clinical progress of bacteriophages and their lytic enzymes:The parts are easier than the whole[J].Viruses, 2019, 11(2):96.
[13] GONDIL V S, HARJAI K, CHHIBBER S.Endolysins as emerging alternative therapeutic agents to counter drug resistant infections[J].International Journal of Antimicrobial Agents, 2020, 55(2):105844.
[14] YOUNG R.Bacteriophage lysis:Mechanism and regulation[J].Microbiological Reviews, 1992, 56(3):430-481.
[15] WANG I N, SMITH D L, YOUNG R.Holins:The protein clocks of bacteriophage infections[J].Annual Review of Microbiology, 2000, 54(1):799-825.
[16] SONG J, XIA F F, JIANG H Y, et al.Identification and characterization of HolGH15:The holin of Staphylococcus aureus bacteriophage GH15[J].The Journal of General Virology, 2016, 97(5):1 272-1 281.
[17] SHI Y B, LI N, YAN Y X, et al.Combined antibacterial activity of phage lytic proteins holin and lysin from Streptococcus suis bacteriophage SMP [J].Current Microbiology, 2012, 65(1):28-34.
[18] FISCHETTI V A.Lysin therapy for Staphylococcus aureus and other bacterial pathogens [J].Current Topics in Microbiology and Immunology, 2017, 409:529-540.
[19] HESELPOTH R D.Engineering enhanced structural stability to the Streptococcal bacteriophage endolysin PlyC[D].College Park:University of Maryland, 2014.
[20] DEFRAINE V, SCHEURMANS J, GRYMONPREZ B, et al.Efficacy of artilysin Art-175 against resistant and persistent Acinetobacter baumannii[J].Antimicrobial Agents and Chemotherapy, 2016, 60(6):3 480-3 488.
[21] OLIVEIRA H, VILAS BOAS D, MESNAGE S, et al.Structural and enzymatic characterization of ABgp46, a novel phage endolysin with broad anti-gram-negative bacterial activity[J].Frontiers in Microbiology, 2016, 7:208.
[22] SANTOS S B, COSTA A R, CARVALHO C, et al.Exploiting bacteriophage proteomes:The hidden biotechnological potential[J].Trends in Biotechnology, 2018, 36(9):966-984.
[23] GUTIÉRREZ D, RUAS-MADIEDO P, MART NEZ B, et al.Effective removal of Staphylococcal biofilms by the endolysin LysH5[J].PLoS One, 2014, 9(9).e107307.
NEZ B, et al.Effective removal of Staphylococcal biofilms by the endolysin LysH5[J].PLoS One, 2014, 9(9).e107307.
[24] CHANG Y, KIM M, RYU S.Characterization of a novel endolysin LysSA11 and its utility as a potent biocontrol agent against Staphylococcus aureus on food and utensils[J].Food Microbiology, 2017, 68:112-120.