分支环糊精是在酶的作用下,通过α-1,6糖苷键将单糖或二糖结合到环糊精C-6位的羟基上形成的环糊精衍生物。麦芽糖基-β-环糊精(maltosyl-β-cyclodextrin,M-β-CD)的制备是以麦芽糖和β-环糊精(β-cyclodextrin,β-CD)作为底物,在高底物浓度下通过普鲁兰酶逆向合成[1],或以麦芽糖基氟化物和环糊精作为底物,在解支酶糖基转移作用下制备的一类分支环糊精[2]。与β-CD相比,M-β-CD具有更低的溶血活性[3]、更高的水溶性和更优的包埋性能以及靶向作用[4]等优点,在食品、医药、精细化工等领域应用日益广泛。经过前人研究,M-β-CD在底物应用、生产工艺、菌种选择等方面不断优化,合成体系中产物转化率已提高至50%以上[5],但是仍然不能规模化生产,其原因是分离成本过高。为保证反应逆向进行,底物的浓度高达83.3%,其中麦芽糖含量约为74.9%,M-β-CD含量仅占10.5%,高浓度的麦芽糖导致反应体系呈高黏稠状态,大大增加了分离成本与难度,并且由实验室前期实验可知,高浓度麦芽糖的存在也会影响M-β-CD的分离,分离成为M-β-CD工业化的瓶颈。
为了高效地从合成体系中分离目标产物,研究者尝试了各种分离方法,如膜过滤、凝胶层析、色谱法等。其中,色谱法因精度高、分辨率好、获得产物纯度高,被认为是最适用于M-β-CD分离的技术。如IWAHORI等[6]采用反相高效液相色谱法分离了M-β-CD,但上样量不足1 mg;JINGRICH等[7]用纸层析和高效液相色谱分离麦芽糖基-α-环糊精酶制液中的产物;WATANABE等[8]利用色谱柱分离了单半乳糖基-α-环糊精和二半乳糖基-α-环糊精。上述的分离方法分离分支环糊精,需要用到大量有机溶剂作为洗脱剂,这不仅造成工艺复杂,而且大大增加生产成本,无法规模化生产。因此亟需对M-β-CD分离方法进行改进。
高速逆流色谱(high-speed counter-current chromatography,HSCCC)是一种连续高效的液-液分配色谱分离技术,结合了液液萃取和分配色谱的特点,无需任何固态载体或支撑,流动相和固定相选择更加多样,组合更加灵活,同时具有单次进样量大,样品不需精制的优势。HSCCC在实验室级别高纯度天然产物制备方面得到了很多应用[9-11],但目前尚未有HSCCC分离M-β-CD的报道,因此有必要对此做研究。目前HSCCC对天然产物研究集中在中性化合物研究上,而对于糖类这类高极性物质分离研究较少。糖类由于高度亲水,难以找到合适的溶剂体系应用于糖类的分离,因此起步较晚。有关HSCCC分离糖类的溶剂体系,目前存在:(1)传统有机试剂两相体系:溶剂体系极性不高,分离效率不大,且大量使用有机试剂[12-13];(2)双水相体系:极性很强,绿色环保,但是容易受温度影响,体系不稳定,且在色谱中固定相保留率低[14];(3)醇盐溶剂体系:极性强,利于糖类分配,所使用溶剂可回收再利用。SHINOMIYA等[15]初次使用乙醇-硫酸铵(2 mol/L)(体积比3∶5)两相系统改进了CCC中糖的早期分离,WARD等[16]在此基础上加入二甲亚砜作为糖类分离改性剂,用乙醇-二甲基亚砜-硫酸铵(300 g/L)(体积比0.8∶0.1∶1.8)两相体系成功分离得到纯度大于90%的鼠李糖、阿拉伯糖,半乳糖和半乳糖醛酸。因此,研究合适的HSCCC溶剂体系,可让HSCCC成为经济高效分离纯化M-β-CD的方法。
实验室前期已采用膜分离对M-β-CD进行了初步分离,但由于酶合成体系中麦芽糖含量过高,仅通过膜分离技术难以分离纯化。本研究利用HSCCC技术进一步对膜分离后的M-β-CD进行分离纯化。通过筛选和优化HSCCC溶剂体系组成,建立了一套M-β-CD的HSCCC分离纯化方法。该方法操作简单,耗时短,提高了M-β-CD分离效率与纯度。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
乙醇、二甲基亚砜、丙酮、四氢呋喃、石油醚、异丙醇、氨水、硫酸铵、磷酸氢二钾、β-环糊精均为分析纯,国药集团化学试剂有限公司;普鲁兰酶、麦芽糖(纯度>95%),上海源叶生物有限公司;乙腈(色谱级),上海阿拉丁有限公司。
1.1.2 主要仪器与设备
TBE-30A高速逆流色谱仪,上海同田生物技术有限公司;高速离心机,赛默飞世尔科技(中国)有限公司;LC-20T高效液相色谱,日本岛津公司;色谱柱(4.6 mm×250 mm,5 μm),美国Waters公司;电子天平(分度值=0.000 1 g),奥豪斯科技有限公司;移液器(1 000 μL),德国Eppendorf公司。
1.2 实验方法
1.2.1 M-β-CD膜分离样品的制备
称取200 g麦芽糖和40 g β-CD到97 mL pH 5.0 的醋酸缓冲液中,加入普鲁兰酶(300 U/g β-CD),60 ℃ 下恒温下于振荡水浴锅内反应60 h后高温灭酶,然后稀释4倍,抽滤去除固体颗粒和沉淀的酶,接下来通过截留值为5 kDa的卷式膜进行超滤去除残留的酶蛋白,最后使用截留值为1 kDa卷式膜通过间歇渗滤实现麦芽糖的去除。设置渗滤条件为0.4 MPa、40 ℃,物料质量浓度为100 g/L,间歇循环4次后得到的浓缩液,经喷雾干燥后待用。
1.2.2 高速逆流色谱溶剂体系相图制作
相图的绘制采用浊点滴定法[17]。用乙醇缓慢滴定已知浓度的无机盐溶液,并在混合器上混合,观察溶液澄清程度,直到溶液开始出现浑浊为止(双相区)。然后逐滴加入去离子水,直到出现澄清的单相溶液,再继续滴加乙醇。如此反复,记录好每次滴加的乙醇体积以及水的体积,计算每次达到浑浊时乙醇及无机盐在系统总量中的百分含量。
1.2.3 高速逆流色谱溶剂体系的筛选
本实验借鉴常见的低聚糖的HSCCC分离体系,结合M-β-CD的极性,选取乙醇-盐-水体系,为了防止添加有机相后发生盐沉淀,因此在将有机溶剂添加到体系之前,先根据所选溶剂系统中的比例将无机盐溶液与水充分混合,随后测定不同溶剂体系下的分配系数。测定方法如下:分别称取10 mg的麦芽糖、β-CD、M-β-CD,置于10 mL试管中,加入平衡后的上、下相各2 mL,振荡使其完全溶解,静置分层,分别取上、下相进行HPLC分析,上相和下相峰面积比值即是分配系数[18],分配系数之间的比值即是分离因子α。所有实验重复3次。
1.2.4 M-β-CD的高速逆流色谱分离纯化
将固定相(上相)以20 mL/min的流速泵入高速逆流色谱仪的聚四氟乙烯螺旋管中,待固定相(上相)充满螺旋管后,开启高速逆流色谱仪,调整转速为950 r/min,同时流动相(下相)以1.5 mL/min的流速泵入充满固定相后的螺旋管中,待末端有流动相流出时,即螺旋管中上下相已达到动态平衡。将1.2.1中制备的样品溶液从进样阀中注入高速逆流色谱仪,每隔5 min收集馏分。HPLC检测分析各馏分并采用面积归一化法计算纯度。
1.2.5 HPLC分析条件
色谱条件:X Amide色谱柱(2.1 mm×75 mm,2.5 μm);流动相:65%(体积分数)乙腈-1%(体积分数)氨水;检测器:RID-10A;柱温:室温;流速:1 ml/min;进样量:20 μL。
2 结果与分析
2.1 不同盐离子的双水相图绘制
HSCCC中用于分离高极性化合物最常用的溶剂体系是正丁醇-水,加入少量甲醇或乙酸作为改性剂[19]。但是由于正丁醇具有高黏度特性,因此这种溶剂体系固定相保留率低,导致分离效果差。而根据盐析萃取理论,添加无机盐可显着降低高亲水性化合物在水溶液中的溶解度,有利于极性化合物在有机相中的分配[20],因此,醇盐体系或可优化高极性糖类化合物在HSCCC的分离纯化。在此选择磷酸氢二钾、硫酸铵、磷酸二氢钠与乙醇组成两相体系,探究其与乙醇成相能力,并选择实验中合适的盐浓度。
由图1可知,磷酸氢二钾与乙醇成相能力最好,即在低浓度乙醇下也可成相。在双水相形成过程中,盐和水分子的相互作用起着非常重要的作用。离子所带的电荷越多、离子半径越小,则越容易形成双水相,例如,阳离子盐析效应为Al3+>Fe3+>Mg2+>Ca2+>Li+>Na+>NH4+>K+。而在实验过程中又发现,乙醇浓度越高,上下相体积比越小,体积比过小将不利于目标物分配且会造成浪费,因此为合理分配上下相体积,同时在两相形成体积范围内,选取硫酸铵质量浓度为250、300、350 g/L,磷酸二氢钠与磷酸氢二钾均为300、400、500 g/L。
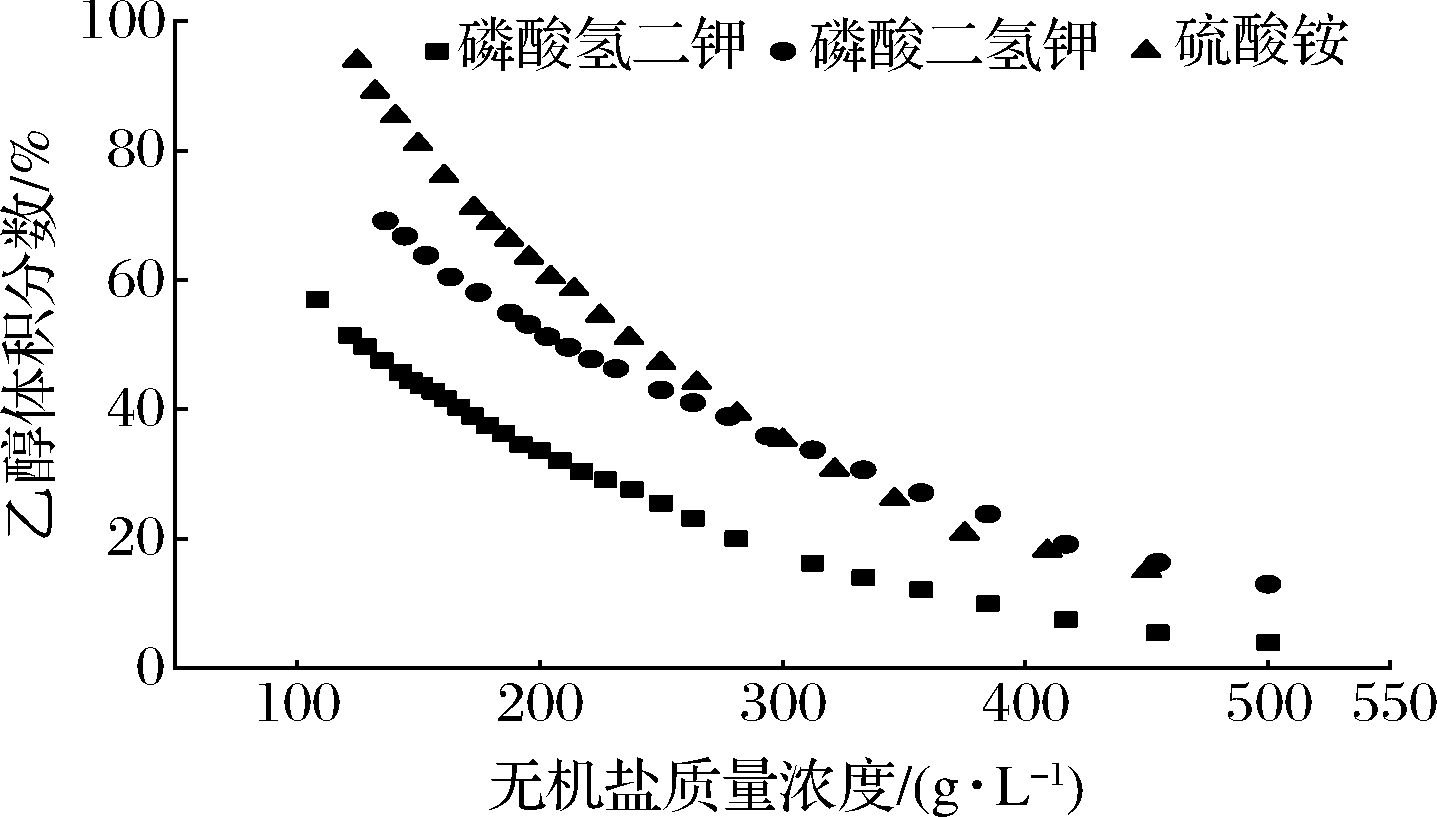
图1 不同盐离子与乙醇的双曲线相图
Fig.1 Binodal curves for the different salt with ethanol ATPS
2.2 盐离子及其浓度筛选
盐的种类和浓度对分配系数的影响主要反映在对相间电位和疏水性的影响。依据2.1中筛选的盐离子浓度范围,考察其成相时间及测定所形成的不同溶剂体系对麦芽糖、β-CD、M-β-CD分配系数的影响,结果如表1所示。
表1 不同类型及不同浓度盐离子对环糊精及麦芽糖分配系数的影响
Table 1 Effects of different types and different concentrations of salt ions on the partition coefficient of cyclodextrin and maltose
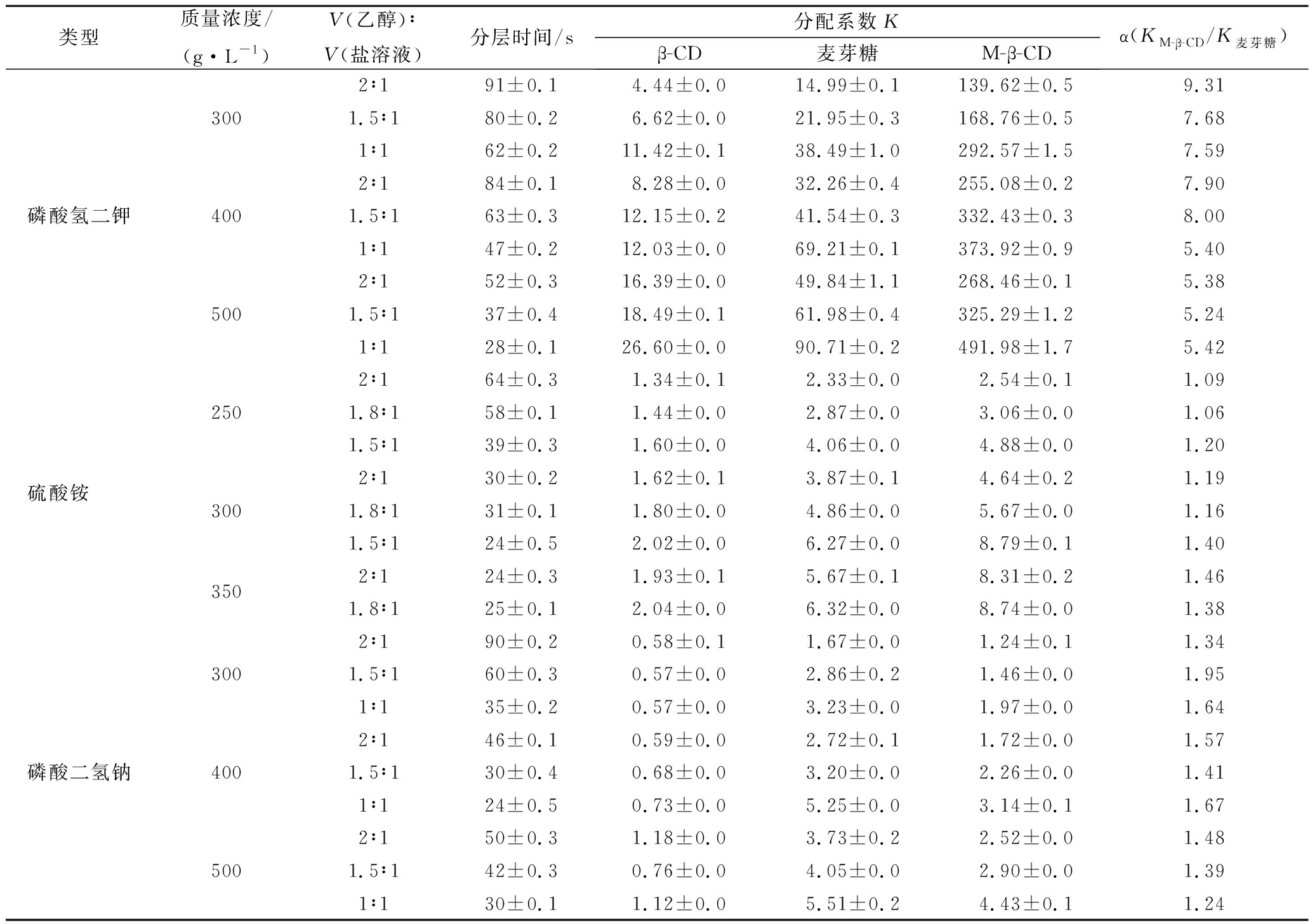
类型质量浓度/(g·L-1)V(乙醇)∶V(盐溶液)分层时间/s分配系数Kβ-CD麦芽糖M-β-CDα(KM-β-CD/K麦芽糖)2∶191±0.14.44±0.014.99±0.1139.62±0.59.313001.5∶180±0.26.62±0.021.95±0.3168.76±0.57.681∶162±0.211.42±0.138.49±1.0292.57±1.57.592∶184±0.18.28±0.032.26±0.4255.08±0.27.90磷酸氢二钾4001.5∶163±0.312.15±0.241.54±0.3332.43±0.38.001∶147±0.212.03±0.069.21±0.1373.92±0.95.402∶152±0.316.39±0.049.84±1.1268.46±0.15.385001.5∶137±0.418.49±0.161.98±0.4325.29±1.25.241∶128±0.126.60±0.090.71±0.2491.98±1.75.422∶164±0.31.34±0.12.33±0.02.54±0.11.092501.8∶158±0.11.44±0.02.87±0.03.06±0.01.061.5∶139±0.31.60±0.04.06±0.04.88±0.01.20硫酸铵 2∶130±0.21.62±0.13.87±0.14.64±0.21.193001.8∶131±0.11.80±0.04.86±0.05.67±0.01.161.5∶124±0.52.02±0.06.27±0.08.79±0.11.403502∶124±0.31.93±0.15.67±0.18.31±0.21.461.8∶125±0.12.04±0.06.32±0.08.74±0.01.382∶190±0.20.58±0.11.67±0.01.24±0.11.343001.5∶160±0.30.57±0.02.86±0.21.46±0.01.951∶135±0.20.57±0.03.23±0.01.97±0.01.642∶146±0.10.59±0.02.72±0.11.72±0.01.57磷酸二氢钠4001.5∶130±0.40.68±0.03.20±0.02.26±0.01.411∶124±0.50.73±0.05.25±0.03.14±0.11.672∶150±0.31.18±0.03.73±0.22.52±0.01.485001.5∶142±0.30.76±0.04.05±0.02.90±0.01.391∶130±0.11.12±0.05.51±0.24.43±0.11.24
由表1可知,在3种盐与乙醇形成的两相体系中,3种糖的分配系数各不相同,但都遵循着相同的规律:盐的质量浓度越高,分配系数越大,盐所占体积比例越大,分配系数越大。这可能是随着下相中盐的质量浓度增加,盐析能力增强[21],竞争水分子能力增强,吸引上相中的水分子逐渐转移至下层盐相,而有机溶剂逐渐从盐相转移至有机相,因此分配系数逐渐增大[22]。其中磷酸氢二钾中分配系数最大,远远超过逆流色谱合适分配系数范围(K=0.5~2)[18],不适合用于分支环糊精的HSCCC分离。低浓度的硫酸铵分配系数尚在合理范围内,但均大于磷酸二氢钠中的分配系数。这可能是由于硫酸铵的酸性小于磷酸二氢钠,而环糊精易溶于碱性溶液,因此吸引更多环糊精溶于下相,使得分配系数变大。另外由于β-CD亲水性弱,在水中的溶解度远远不及麦芽糖和M-β-CD,因此分配系数始终最小。而M-β-CD接枝一个麦芽糖单位,既又有环糊精内亲水外疏水性质,又具有麦芽糖的亲水性,因此在磷酸二氢钠溶液中,分配系数小于麦芽糖。
在硫酸铵盐体系中,M-β-CD与麦芽糖分离系数相差不大,α<1.5,这会使得这2种物质分离不完全,影响分离纯度,因此也不适合环糊精体系的分离。而磷酸二氢钠体系的分层时间较长,会造成出峰时间慢、峰图变宽、固定相保留率低等问题,将影响逆流色谱最终分离效果,因此接下来需要进一步改性磷酸二氢钠体系以缩短分层时间。
2.3 改性剂选择及其比例
选择极性稍小的有机试剂加入两相体系中,扩大上下相极性的差异,可缩短分层时间。考虑到环糊精溶解度以及溶液自身极性等因素,选择乙腈、丙酮、异丙醇、四氢呋喃、石油醚等5种有机试剂作为改性剂添加在两相体系中,测定麦芽糖、β-CD、M-β-CD在新两相体系中的分配行为(表2)。
表2 不同改性剂对分层时间及分层体积比的影响
Table 2 The influence of different modifiers on settling time and volume ratio

改性剂分层时间/s分层体积比乙腈 34±0.10.43丙酮 29±0.30.4异丙醇 32±0.20.46四氢呋喃31±0.40.38石油醚 //
注:/代表无数据
由表2可以看出,在加入改性剂后,上下相极性差距变大,两相体系分层时间明显缩短,皆在30 s附近,符合逆流色谱对分层时间的要求,但石油醚加入后两相体系分成三相,不适合此体系。
如表3所示,加入改性剂后,对上相有机相极性有所改变,因此3种糖的分配系数也随之变化,均随着上相极性的减小而增大,但变化幅度不同。四氢呋喃体系中未在上相中检测出3种糖,因此不适合用作改性剂,而乙腈与异丙醇的加入使得麦芽糖与M-β-CD分配系数增大至3以上,且两者之间分离因子差距变小,因此也不适合用作改性剂。丙酮在缩短分层时间的同时保持3种糖的分配系数依然在合适范围内,并未有较大影响,作为改性剂较为合适。
表3 不同改性剂对麦芽糖、β-环糊精、麦芽糖基β-环糊精分配系数的影响
Table 3 Effect of modifiers on the partition coefficient of maltose, β-CD and M-β-CD

改性剂分配系数K麦芽糖β-CDM-β-CD乙腈 3.18±0.11.40±0.03.19±0.0丙酮 2.25±0.00.66±0.01.55±0.0异丙醇 3.41±0.11.41±0.24.12±0.2四氢呋喃NDNDND
注:ND代表未检测出
进一步探究丙酮作为改性剂的浓度对分配系数的影响,由于麦芽糖与M-β-CD分配系数较为相近,因此只需考虑麦芽糖与M-β-CD分配系数即可,寻找合适的体积比使两者差异更大。根据表1磷酸二氢钠的分层时间以及分配系数的结果,选择300 g/L以及350 g/L 2种盐浓度,醇盐体积比2∶3为基础进行研究。表4结果表明,当磷酸二氢钠质量浓度为300 g/L,磷酸二氢钠-乙醇-丙酮体积比为6∶2∶1.5时,麦芽糖分配系数为1.78, M-β-CD为1.04,两者α达到最大值1.72,通常情况下,α>1.5代表两者物质可在高速逆流色谱仪器分开[23]。因此选择此体系当做逆流色谱两相溶剂体系。
表4 丙酮浓度对麦芽糖和麦芽糖基β-环糊精分配系数的影响
Table 4 Effect of acetone concentration on the partition coefficient of maltose and M-β-CD
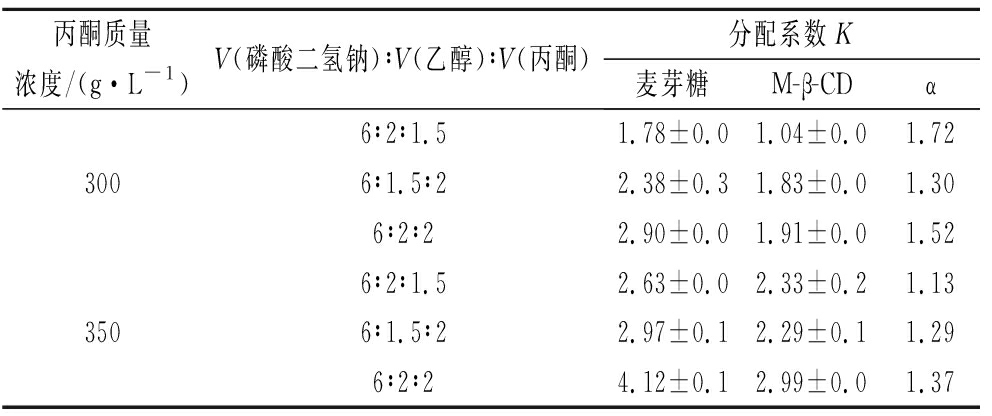
丙酮质量浓度/(g·L-1)V(磷酸二氢钠)∶V(乙醇)∶V(丙酮)分配系数K麦芽糖M-β-CDα6∶2∶1.51.78±0.01.04±0.01.723006∶1.5∶22.38±0.31.83±0.01.306∶2∶22.90±0.01.91±0.01.526∶2∶1.52.63±0.02.33±0.21.133506∶1.5∶22.97±0.12.29±0.11.296∶2∶24.12±0.12.99±0.01.37
2.4 分离效果
将膜分离后的样品溶解于优化后的溶剂体系中,进行高速逆流色谱分离。
经过高速逆流色谱分离后,在30~35 min收集到目标馏分,目标馏分HPLC色谱图及组分含量如图2、表5所示,在该时间段馏分中,几乎没有麦芽糖,M-β-CD纯度由膜分离后的32.3%提高至93.2%,此时固定相保留率为60%,由此可证明HSCCC与膜分离技术联用,是可行有效的分离纯化M-β-CD的方法。
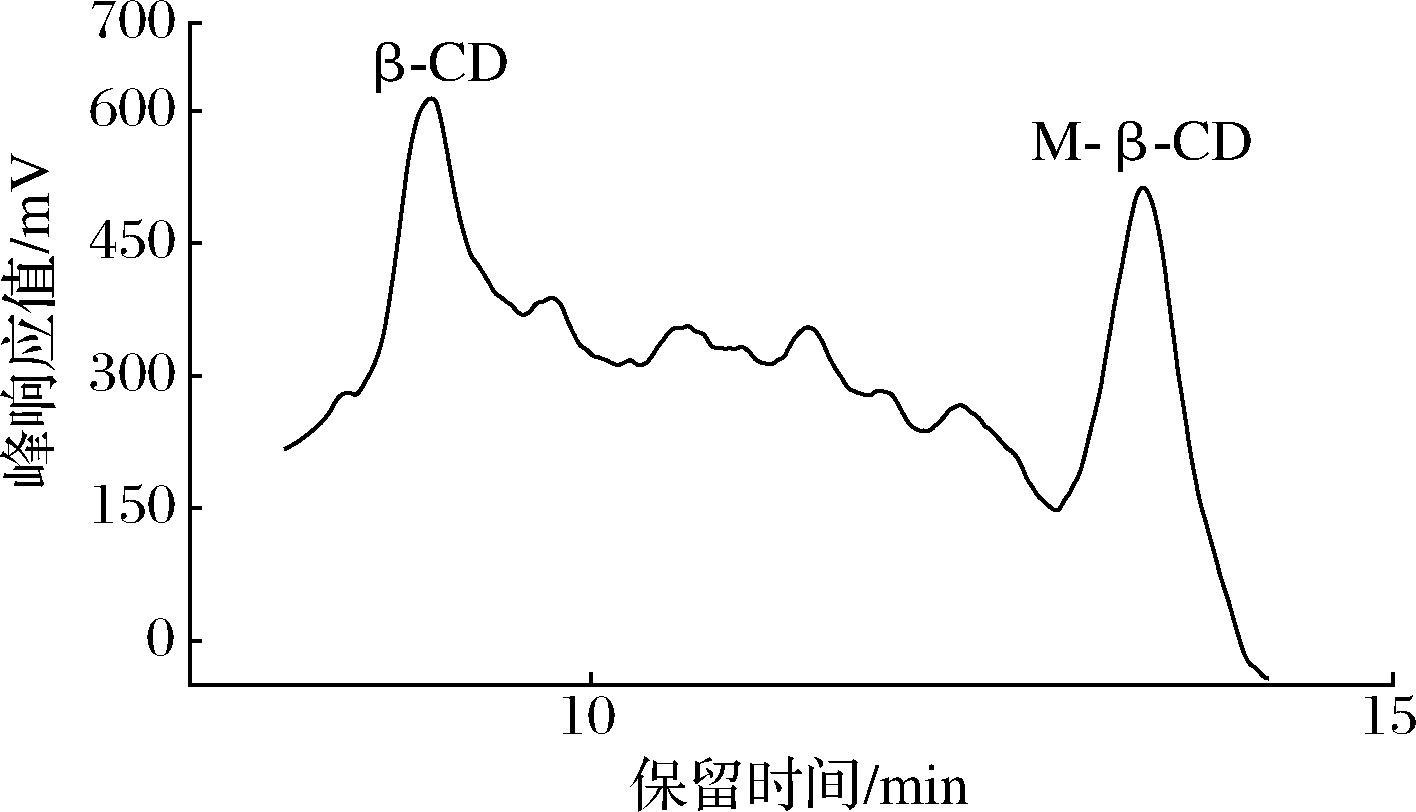
图2 HSCCC目标馏分HPLC色谱图
Fig.2 HPLC chromatogram of HSCCC target fraction
表5 目标馏分物质含量
Table 5 Target fraction substance content

组分峰响应值/mV质量浓度/(mg·mL-1)纯度β-CD8 5700.156.8%M-β-CD27 9382.0593.2%
3 结论
利用HSCCC结合膜分离技术,通过探索膜分离条件及HSCCC溶剂体系,成功分离纯化出麦芽糖基β-环糊精,纯度为93.2%。该方法相较于曾报道的反相高效液相色谱法,具有处理量大,耗时短,操作简便等优势。本文探讨了HSCCC新型溶剂体系中的一种,另外还存在离子液体、深共溶溶剂等新型极性溶剂体系,后续也可研究用于糖类分离中。
[1] SHIRAISHI T, KUSANO S, TSUMURAYA Y, et al.Synthesis of maltosyl(α1→6) cyclodextrins through the reverse reaction of thermostable Bacillus acidopullulyticus pullulanase[J].Agricultural and Biological Chemistry, 1989, 53(8):2 181-2 188.
[2] YOSHIMURA Y, KITAHATA S, OKADA S.Formation of 6-O-α-maltosylcyclomalto-oligosaccharides by transfer action of three debranching enzymes[J].Carbohydrate Research, 1987, 168(2):285-294.
[3] SHINODA T, MAEDA A, KAGATANI S, et al.Specific interaction between galactose branched-cyclodextrins and hepatocytes in vitro[J].International Journal of Pharmaceutics, 1998, 167(1-2):147-154.
[4] AJISAKA N, HARA K, MIKUNI K, et al.Effects of branched cyclodextrins on the solubility and stability of terpenes[J].Bioscience, Biotechnology, and Biochemistry, 2000, 64(4):731-734.
[5] 王少杰. 麦芽糖基β-环糊精的制备、分离及应用[D].无锡:江南大学, 2005.
WANG S J.Preparation, isolation and application of maltosyl (α1→6) β-cyclodextrins[D].Wuxi:Jiangnan University, 2005.
[6] IWAHORI A, HIROTA Y, SAMPE R.NII-electronic library service[J].Chemical Pharmaceutical Bulletin, 1970,43:2 091.
[7] JINDRICH J, PITHA J, LINDBERG B.Separation of cyclodextrins and their derivatives by thin-layer and preparative column chromatography[J].Carbohydrate Research, 1995, 275(1):1-7.
[8] WATANABE N, YAMAMOTO K, TSUZUKI W, et al.A novel method to produce branched α-cyclodextrins:Pullulanase- glucoamylase-mixed method[J].Journal of Fermentation and Bioengineering, 1997, 83(1):43-47.
[9] MA Y M, YANG X, CHEN J L, et al.Separation of five flavonoids with similar polarity from Caragana korshinskii Kom.by preparative high speed counter-current chromatography with recycling and heart cut mode[J].Journal of Separation Science, 2020, 43(19):3 748-3 755.
[10] YU P, MA J B, DU Y R, et al.An efficient strategy based on liquid-liquid extraction and pH-zone-refining counter-current chromatography for selective enrichment, separation, and purification of alkaloids and organic acids from natural products[J].Journal of Separation Science, 2020, 43(18):3 607-3 614.
[11] JIANG Z G, WANG Y H.Stepwise elution by high-speed counter-current chromatography combined with a modified macroporous resin to isolate and purify antioxidant phenolics from discarded jackfruit (Artocarpusheterophyllus Lam.) peels[J].Analytical Methods, 2020, 12(38):4 674-4 681.
[12] ZHANG H, BRACE E C, ENGELBERTH A S.Selection of a nonaqueous two-phase solvent system for fractionation of xylo-oligosaccharide prebiotics using a conductor-like screening model for real solvents [J].Journal of Liquid Chromatography & Related Technologies, 2016, 39(14):666-673.
[13] YIN J Y, JIANG Z H, YU H, et al.A new application of an aqueous diphase solvent system in one-step preparation of polysaccharide from the crude water extract of Radix Astragali by high-speed counter-current chromatography[J].Journal of Chromatography A, 2012, 1 262:92-97.
[14] 宋广磊. 黑木耳多糖的分离制备及生物活性研究[D].杭州:浙江工商大学, 2011.
SONG G L.Preparation isolation of polysaccharides from Auricularia polytricha and their bioacitiveties [D].Hangzhou:Zhengjiang Gongshang University, 2011.
[15] SHINOMIYA K, KABASAWA Y, ITO Y.Countercurrent chromatographic separation of sugars and their p- NITROPHENYL derivatives by cross-axis coil planet centrifuge[J].Journal of Liquid Chromatography and Related Technologies, 1999, 22(4):579-592.
[16] WARD D P, C RDENAS-FERN
RDENAS-FERN NDEZ M, HEWITSON P, et al.Centrifugal partition chromatography in a biorefinery context:Separation of monosaccharides from hydrolysed sugar beet pulp[J].Journal of Chromatography A, 2015, 1 411:84-91.
NDEZ M, HEWITSON P, et al.Centrifugal partition chromatography in a biorefinery context:Separation of monosaccharides from hydrolysed sugar beet pulp[J].Journal of Chromatography A, 2015, 1 411:84-91.
[17] EBRAHIMI N, SADEGHI R.Propanol-sugar aqueous biphasic systems as a suitable platform for biomolecules extraction[J].Journal of Chromatography A, 2018, 1 581-1 582:156-167.
[18] OKA H, IKAI Y, KAWAMURA N, et al.Optimization of a high speed countercurrent chromatograph for analytical separations[J].Journal of High Resolution Chromatography, 1991, 14(5):306-311.
[19] BALDERMANN S, MULYADI A N, YANG Z Y, et al.Application of centrifugal precipitation chromatography and high-speed counter-current chromatography equipped with a spiral tubing support rotor for the isolation and partial characterization of carotenoid cleavage-like enzymes in Enteromorpha compressa (L.) Nees [J].Journal of Separation Science, 2011, 34(19):2 759-2 764.
[20] SPóRNA-KUCAB A, MILO A, KUMORKIEWICZ A, et al.Studies on polar high-speed counter-current chromatographic systems in separation of amaranthine-type betacyanins from Celosia species[J].Journal of Chromatography B, 2018, 1 073:96-103.
[21] LIU X L, MU T H, SUN H N, et al.Optimisation of aqueous two-phase extraction of anthocyanins from purple sweet potatoes by response surface methodology[J].Food Chemistry, 2013, 141(3):3 034-3 041.
[22] MA T, DONG H J, XU L H, et al.Effects of inorganic salts on the partition of iridoid glycosides in high-polarity solvent systems and their preparative separation from Lonicerae japonicae Flos by high-speed counter-current chromatography[J].Journal of Liquid Chromatography & Related Technologies, 2019, 42(19-20):654-661.
[23] BOJCZUK M, ![]() D, HODUREK P.Centrifugal partition chromatography-A review of recent applications and some classic references[J].Journal of Separation Science, 2017, 40(7):1 597-1 609.
D, HODUREK P.Centrifugal partition chromatography-A review of recent applications and some classic references[J].Journal of Separation Science, 2017, 40(7):1 597-1 609.